Method Article
Biópsia Transperineal da Próstata Guiada por Micro-Ultrassonografia: Um Procedimento Clínico
Neste Artigo
Resumo
Este manuscrito descreve as etapas para a realização de uma biópsia transperineal da próstata guiada por microssom sob anestesia local.
Resumo
O câncer de próstata é a malignidade sólida mais comum em homens e requer uma biópsia para diagnóstico. Este manuscrito descreve uma técnica transperineal guiada por microssom à mão livre realizada sob anestesia local, que mantém a precisão, mantém os pacientes confortáveis, tem baixos eventos adversos e minimiza a necessidade de descartáveis. As técnicas transperineais guiadas por microssom anteriores exigiam anestesia geral ou raquidiana. As principais etapas descritas no protocolo incluem (1) a colocação da anestesia local, (2) imagens de micro-ultrassom, (3) e a visualização da agulha anestésica / biópsia enquanto desacoplada do plano de insonação. Uma revisão retrospectiva de 100 pacientes submetidos a essa técnica demonstrou uma taxa de detecção de câncer clinicamente significativa de 68%. Os escores de dor foram coletados prospectivamente em um subconjunto de pacientes (N = 20) e mostraram um escore médio de dor no procedimento de 2 em 10. A taxa de eventos adversos de Grau III em 30 dias foi de 3%; Um desses eventos provavelmente estava relacionado à biópsia da próstata. No geral, apresentamos uma técnica simples, precisa e segura para realizar uma biópsia transperineal da próstata guiada por microssom.
Introdução
O câncer de próstata é a malignidade sólida mais comum entre os homens americanos, com 268.000 diagnósticos projetados em 20221. O diagnóstico de câncer de próstata requer uma biópsia de próstata, que tradicionalmente é realizada passando uma agulha de biópsia através da mucosa retal (transretal) para a próstata. A orientação da agulha segue um modelo sistemático "cego", pois o ultrassom convencional não consegue diferenciar o câncer do tecido benigno2. Nos Estados Unidos, mais de 1 milhão dessas biópsias são realizadas anualmente 3,4.
Na última década, dois avanços significativos em imagens e técnicas melhoraram a segurança e a precisão. Primeiro, o aumento do uso de biópsias transperineais para evitar a mucosa retal diminuiu o risco de sepse sem a necessidade de antibióticos 5,6. Em segundo lugar, o uso de ressonância magnética e microssom (Micro-US) melhorou as taxas de detecção de câncer em comparação com a biópsia com orientação de ultrassom convencional (5 MHz) 5,7,8,9.
O Micro-US utiliza ondas acústicas de 29 MHz, densidade de cristal piezoelétrico aprimorada e novo processamento de ondas para atingir uma resolução espacial de 70 μm em comparação com cerca de 200 μm para um ultrassom convencional8. Um sistema de classificação usando uma escala Likert de 5 pontos (Prostate Risk Identification Using Micro-Ultrasound, PRI-MUS) é usado para quantificar o risco de câncer de próstata em lesões de micro-ultrassom10. Os locais do núcleo da biópsia e da lesão PRI-MUS são rastreados em relação à linha média usando um acelerômetro localizado na alça da sonda Micro-US (ExactImaging, Markham, ON). A capacidade de rastrear biópsias permite a reconstrução 3D de locais de câncer de próstata. Tratamentos de câncer de precisão, como terapia focal e reforço de radiação, são ativados por meio das informações espaciais obtidas por núcleos rastreados.
Até o momento, nenhuma técnica publicada que permita a biópsia transperineal da próstata guiada por microssom sob anestesia local também pode manter a orientação espacial dos núcleos e lesões. Este manuscrito tem como objetivo delinear tal técnica.
Protocolo
Os métodos descritos são baseados na experiência da Universidade da Flórida (UF). O protocolo e a aquisição dos dados foram aprovados pelo Comitê de Ética em Pesquisa da Universidade (IRB). As indicações para biópsia da próstata incluíram um exame de toque retal (DRE) suspeito, elevação do antígeno prostático específico (PSA) ou outra anormalidade do biomarcador (ou seja, 4K, ExoDx). O protocolo é descrito para um cirurgião destro.
1. Preparação da sonda de micro-ultrassom
- Desinfete a sonda de acordo com o "Manual de Operação e Segurança do Sistema" de microssom11.
- Coloque cerca de 20 mL de gel acústico na extremidade da tampa da sonda e remova as bolhas. Coloque uma guia de agulha na sonda e coloque a tampa da sonda sobre a sonda (Figura 1A).
NOTA: As bolhas são removidas girando a tampa da sonda com lubrificante como em um brinquedo rabo de raposa. A força centrífuga desloca a lubrificação distalmente enquanto move as bolhas proximalmente. - Coloque um elástico ao redor do pescoço da sonda abaixo dos cristais piezoelétricos para evitar vazamento de gel.
- Configure o equipamento de biópsia de acordo com a preferência do cirurgião.
NOTA: A configuração usada neste estudo é demonstrada na Figura 1B.
2. Posicionamento e anestesia do paciente
- Posicione o paciente na posição de litotomia com o ânus na borda da cama. Forneça apoio para a cabeça e uma cortina genital para melhorar o conforto e a privacidade (Figura 1C).
NOTA: Na UF, os estribos para posicionamento de litotomia são preferidos. - Colocar 10 mL de gel de lidocaína viscosa a 2% no reto, conforme descrito anteriormente12.
- Garanta o conforto do paciente e a preparação dos materiais necessários durante esse período.
- Ajuste a altura da cama para que o ânus fique no nível do cotovelo do cirurgião.
- Instrua o paciente a elevar o escroto e expor o períneo (Figura 1C).
- Usando gel acústico, realize um exame de toque retal. Observe anormalidades palpáveis para estadiamento e direcionamento de biópsia.
- Troque as luvas e esterilize a pele perineal com betadina ou clorexidina da base do escroto até abaixo do ânus.
- Anestesiar os tecidos moles perineais nas posições de 10 e 2 horas, começando a cerca de 10-15 mm do ânus (Figura 1D).
NOTA: Comece com uma agulha de 2 polegadas e 25 G contendo lidocaína a 1% com epinefrina 1:100.000 e solução de bicarbonato de sódio a 8,4% misturada na proporção de 1:10 (1 mL de NaHCO3: 10 mL de lidocaína). Isso é, doravante, referido como "lidocaína". - Insira a agulha paralelamente ao reto e injete lidocaína à medida que a agulha avança. Coloque cerca de 3 mL de lidocaína no tecido mole entre a pele e a fáscia de Colles e 2 mL entre a fáscia de Colles (Figura 2A).
NOTA: Para maior eficiência, a etapa acima é executada de forma cega; No entanto, no início da experiência, considere a utilização de orientação por ultrassom, pois a anatomia do paciente difere de acordo com a forma pélvica, a musculatura glútea e a obesidade.
3. Diagnóstico por micro-ultrassom
- Lubrifique a sonda, insira-a suavemente no reto e avance até que o meio da próstata esteja centralizado no monitor de visualização.
NOTA: Siga o contorno do sigmóide direcionando a ponta da sonda para baixo (em direção ao sacro) uma vez além do esfíncter anal. Usando esta técnica, a base da bexiga pode ser visualizada com o mínimo de desconforto. Deixar de direcionar a sonda para baixo causará dor. - Otimize as configurações de imagem de microssom.
- Segure a sonda de imagem com a mão esquerda (não dominante) na parte mais grossa da sonda. Incline e levante a sonda para cima para que a base da próstata receba a maior pressão dos cristais piezoelétricos. O movimento de arremesso e elevação comprimirá o reto e otimizará a visualização (Figura 1C).
- Ajuste os controles deslizantes de ganho compensado pelo tempo (TCG) em uma forma suave de "C" ou "J" reverso até que haja uma escala de cinza uniforme na imagem.
- Ajuste o botão de ganho principal para que as bordas laterais da próstata sejam bem visualizadas, mas o centro da próstata não seja muito brilhante.
NOTA: A próstata lateral é acusticamente mais escura do que a glândula média, pois menos ondas de ultrassom refletidas retornam em ângulo. - Certifique-se de que nenhuma bolha ou muco retal esteja causando sombra.
NOTA: Na UF, as configurações padrão são utilizadas para faixa dinâmica, profundidade e foco; no entanto, eles podem ser ajustados de acordo com a preferência do cirurgião. - Selecione uma predefinição de imagem (Pequena, Média, Grande e Extragrande) que permita a visualização da próstata com o mínimo de gordura prostática anterior.
NOTA: Os detalhes da otimização da imagem e da operação do Micro-US estão disponíveis no "Manual de Operação e Segurança do Sistema" do Micro-US11.
- Realize um cálculo do volume da próstata pressionando o botão Duplo/Transversal , realizando uma varredura da próstata e, em seguida, medindo o comprimento sagital e a altura e largura axiais reconstruídas.
- Gire a sonda até que a uretra seja visualizada. A visualização da uretra é melhor na bexiga, pescoço e ápice da próstata. Coloque a sonda paralela à linha média de modo que o colo da bexiga e a uretra fiquem visíveis no mesmo plano (guinada neutra).
- Pressione o botão Angle Reset na tela sensível ao toque Micro-US para zerar o acelerômetro da sonda.
- Coloque a mão direita na parte proximal da sonda onde a sonda encontra o cabo elétrico. A mão esquerda desliza sob o pescoço da sonda, apoiando a posição de inclinação para cima (Figura 1C).
- Diga ao paciente para ficar parado; Em um movimento, varra da borda lateral direita da próstata (sentido horário) através da próstata até a borda esquerda, levando ~ 25 s. Pressione o botão Cine Loop para gravar a varredura.
NOTA: Varreduras separadas do ápice e da base são frequentemente necessárias para próstatas maiores que 50 mL. É uma prática recomendada gravar uma varredura que visualize a zona de transição e uma varredura na configuração Pequena para visualizar a zona periférica.
4. Avaliação diagnóstica
- Avalie a zona de transição para lesões PRI-MUS.
- Depois que a zona de transição for avaliada, mude para a configuração de imagem pequena e avalie a zona periférica para lesões PRI-MUS.
NOTA: Considere praticar o uso da biblioteca de diagnóstico gratuita Micro-US para ganhar experiência na identificação e classificação de lesões PRI-MUS11. - Observe a localização das regiões de interesse (ROI) encontradas registrando o ângulo central e os ângulos nos quais a ROI é visível pela primeira e pela última vez.
NOTA: Na UF, esses ângulos são chamados pelo cirurgião e registrados nas notas operatórias pela equipe da sala de biópsia. - Se estiver utilizando um software de fusão, carregue uma ressonância magnética anotada pré-biópsia e pressione o botão Linha média enquanto visualiza a uretra (Figura 2B).
5. Anestesia da próstata
- Usando uma agulha de 6 polegadas e 20 G, perfure a pele no trato de biópsia previamente anestesiado e avance a agulha para o elevador do ânus sob visualização de Micro-US (Figura 2A).
- Coloque 3 mL do anestésico local no complexo muscular elevador do ânus (Figura 2A).
- Avance a agulha 20 G para o triângulo periapical (delimitado pela uretra medialmente, o elevador do ânus lateralmente e a fáscia de Denonvilliers posteriormente). Injete 5-7 mL de lidocaína no triângulo periapical (Figura 2A).
NOTA: O aspecto lateral do complexo venoso dorsal (DVC) drapeja no triângulo periapical; Assim, aspire antes da injeção de lidocaína. A anestesia apropriada irá hidrodissecar entre a cápsula da próstata e a fáscia de Denonvilliers.
6. Biópsia de próstata
- Insira um angiocateter 14 G ou uma agulha coaxial metálica 15 G (agulha de acesso) através do trato previamente anestesiado até 5-10 mm do ápice da próstata. Passe a agulha de acesso acima do esfíncter anal e através ou medial ao elevador do ânus. Personalize a distância entre a agulha de acesso e o reto de acordo com a localização do ROI.
- Colete amostras de toda a próstata usando uma localização de agulha 5 mm acima do reto e 15 ° -20 ° do plano médio da próstata onde a uretra é visível (Figura 1D, posições de 10 horas e 2 horas).
- Gire a sonda para que o plano de insonação visualize a agulha de acesso e avance a pistola de biópsia até que a ponta da agulha de biópsia fique visível na extremidade da agulha de acesso.
- Gire a sonda para visualizar o alvo da biópsia (ROI ou núcleo sistemático) e, em seguida, gire de volta para visualizar a ponta da agulha da biópsia. Ajuste a trajetória da agulha em direção ao alvo ajustando a pistola de biópsia externa ao paciente.
- Avance a agulha sob visão e complete pequenos rolos de sonda de 3 ° a 10 ° (micro rolos) para guiar a ponta da agulha para o alvo pretendido. Avance a agulha de biópsia apenas enquanto visualiza a ponta para evitar ultrapassar o alvo pretendido.
NOTA: É necessário retirar a agulha de biópsia se estiver fazendo movimentos maiores em direção a um alvo. Nesta técnica, a sonda é mantida paralela à uretra e não paralela à agulha ("guinada"). Preservar o ângulo da biópsia em relação à uretra permite uma reconstrução precisa da localização do câncer e maximiza o conforto do paciente. A parte mais desafiadora dessa técnica é visualizar a agulha quando desacoplada do plano de insonação. Em nossa experiência instruindo residentes, bolsistas e outros médicos, a memória muscular necessária para implementar a técnica requer cerca de 3 h de prática. Considere praticar em um simulador de próstataou simulador 13 para construir a memória muscular necessária antes de uma biópsia. Realizar essa técnica inicialmente em um paciente anestesiado facilitará a transição para uma prática clínica. - Antes de obter uma amostra de biópsia, role-a até a uretra e certifique-se de que o ângulo esteja dentro de 1°-2° da posição de 0°. Registre a posição do ângulo para cada lance de biópsia capturando um quadro ou loop de cinema.
NOTA: Por convenção, a rotação do lado direito (sentido anti-horário) é indicada por um ângulo positivo, enquanto a rotação do lado esquerdo (sentido horário) é caracterizada por um ângulo negativo. - Comece obtendo três núcleos de biópsia distribuídos através da ROI (Figura 2C).
- Considere realizar uma biópsia sistemática transperineal (Figura 3). Para eficiência, inicie biópsias sistemáticas ipsilaterais ao ROI. Se a ROI for anterior, abaixe a agulha coaxial para melhorar a amostragem sistemática da biópsia da zona periférica.
NOTA: Este estudo realizou uma biópsia sistemática de 14 núcleos (Figura 3). Uma biópsia sistemática provavelmente pode ser ignorada nestes casos: 1) núcleos sistemáticos sobrepostos a uma ROI previamente amostrada e 2) próstatas pequenas onde um único lance coleta amostras do ápice e da base. Utilizando este modelo, as biópsias apicais são obtidas iniciando o lançamento na cápsula apical da próstata. As biópsias de base são obtidas iniciando o arremesso na glândula média.
7. Fim do procedimento
- Depois de adquirir todas as biópsias, remova a agulha coaxial e a sonda de ultrassom.
- Mantenha a pressão no períneo com uma toalha por 1-5 min até que a hemostasia no local da punção seja alcançada.
- Ajude os pacientes a sentar-se e, após 1 min, a ficar em pé.
- Aconselhe os pacientes a esperar hematúria e hematospermia transitórias.
- Prescreva pacientes com alfabloqueadores do fluxo urinário restrito basal para serem preenchidos conforme necessário.
Resultados
Uma análise retrospectiva de nosso banco de dados mantido prospectivamente de setembro de 2021 a junho de 2022 (IRB202200022) é descrita. O câncer de próstata clinicamente significativo (csPCa) foi considerado câncer de próstata ≥Grupo de Grau 2 (Gleason 3 + 4 = 7). A taxa de detecção de câncer (CDR) foi calculada como ≥GG2/total de pacientes. Os escores de dor foram avaliados em uma escala Likert de 1 a 10 pontos no início do estudo, na colocação da anestesia local, na inserção da sonda retal e durante a biópsia. Os eventos adversos foram discutidos com os pacientes 2 semanas após o procedimento, e os eventos capturados pela revisão de prontuários foram documentados dentro de 30 dias após a biópsia. Os eventos adversos foram classificados usando a nota CTEP (Programa de Avaliação da Terapia do Câncer) e o guia de atribuição.
Identificamos 100 pacientes submetidos a biópsia transperineal clínica guiada por Micro-US sob anestesia local. Neste estudo, a RCD por paciente foi de 68%. O CDR variou de acordo com os escores PI-RADS (Prostate Image Reporting and Data System) e PRI-MUS de cada lesão (Tabela 1).
Os escores de dor estavam disponíveis entre um subconjunto posterior de pacientes (N = 20). Os escores médios de dor (IQR) foram 0 (0, 1) no início do estudo, 2 (1, 4) durante a administração de anestesia local, 2 (1, 5) durante a colocação da sonda transretal e 2 (0, 5) durante a biópsia da próstata.
Os eventos adversos foram relativamente raros, com incidência de 3% de eventos adversos de Grau III (Tabela 2). Não houve eventos de Grau IV ou Grau V. Os eventos de Grau II envolveram principalmente a nova prescrição de alfabloqueadores para aliviar a desaceleração do fluxo urinário. Como mencionado acima, os pacientes foram rastreados quanto aos sintomas antes da biópsia. Os eventos de grau III envolveram a hospitalização de três pacientes. De acordo com o guia de atribuição do CTEP, uma hospitalização por hipotensão sintomática provavelmente estava relacionada à biópsia de próstata secundária à absorção de lidocaína. O paciente apresentou uma resolução espontânea dos sintomas dentro de 12 h após o monitoramento. Dois pacientes adicionais foram hospitalizados (queda mecânica e estado mental alterado) dentro de 30 dias após a biópsia. Incidentalmente, verificou-se que eles tinham ITUs não sépticas e não sintomáticas, possivelmente relacionadas à biópsia. Além desses pacientes específicos mencionados, não houve sepse, prostatite, cistite ou outros casos de infecção.
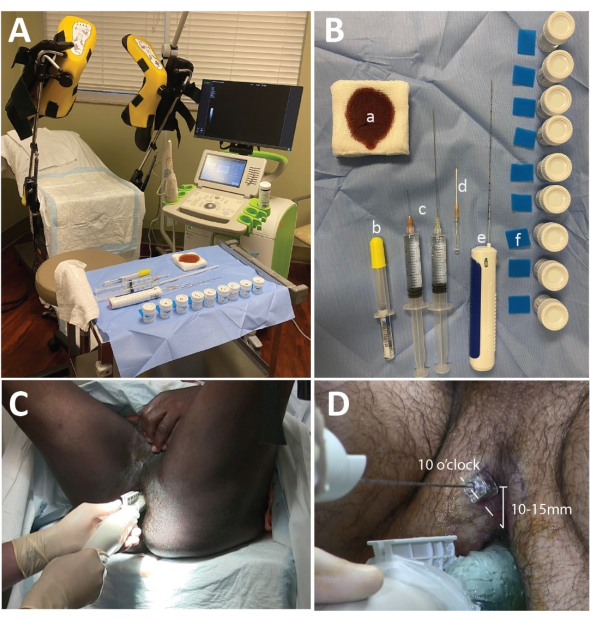
Figura 1: Configuração de microssom, bandeja de biópsia e colocação da agulha. (A) A configuração da sala de procedimentos com a máquina ExactVu colocada à direita do cirurgião. (B) Mesa de biópsia incluindo (a) compressas de gaze de 4 cm x 4 cm embebidas em betadina, (b) 10 mL de gel de lidocaína a 2%, (c) lidocaína a 1% com epinefrina 1:100.000 distribuída com 2 mL de solução de bicarbonato de sódio a 8,4% (1 mL de NaHCO3: 10 mL de lidocaína) em 2 seringas de 2 mL de 20 mL com agulha de 2 polegadas 25 G e agulha de 6 polegadas 20 G, (d) um angiocath 14 G ou agulha de metal coaxial, (e) uma pistola de biópsia, (f) almofadas de biópsia de espuma e recipientes de formalina. (C) A posição da mão para realizar a varredura diagnóstica. Observe que a mão esquerda suporta a pressão ascendente na próstata, enquanto a mão direita gira a sonda. (D) A posição da agulha coaxial ou angiocateter: 10 horas para a próstata do lado direito e 2 horas para a próstata do lado esquerdo (não mostrado). Clique aqui para ver uma versão maior desta figura.
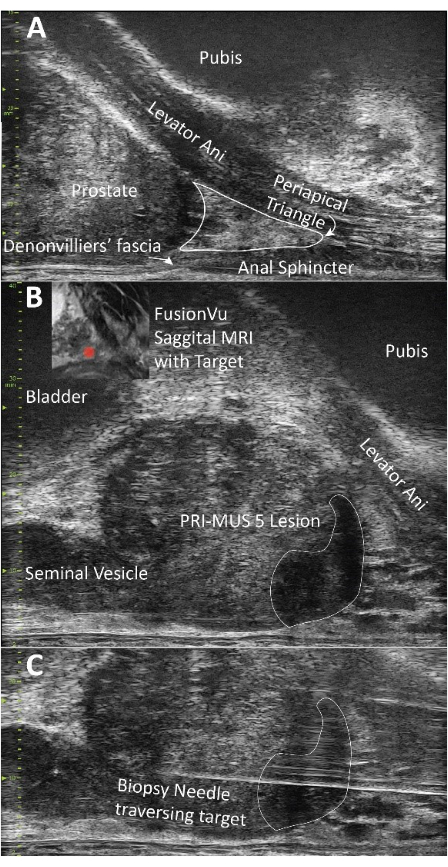
Figura 2: Demonstração da anatomia da próstata e biópsia. (A) Visualização do elevador do ânus e triângulo periapical; ambas são estruturas importantes a serem anestesiadas para a implementação bem-sucedida desta técnica. (B) Demonstração de uma lesão PRI-MUS 5, anatomicamente concordante com a ressonância magnética pré-biópsia. (C) Confirmação visual da agulha de biópsia atravessando o alvo. Clique aqui para ver uma versão maior desta figura.

Figura 3: Modelo de biópsia sistemática para a técnica proposta. Este modelo é baseado no modelo disponível no Michigan Urologic Surgery Improvement Collaborative (MUSIC)14. No entanto, este modelo é uma melhoria em três aspectos. (i) Aumento da amostragem da zona anterior (4 núcleos versus 2 núcleos), (ii) Exibição visual muito melhorada da localização do núcleo usando um modelo 3D e (iii) nomenclatura modificada do núcleo para melhorar a usabilidade. Neste protocolo, biópsias sistemáticas são feitas após a biópsia ROI dentro de tecido de imagem negativo (PRI-MUS ≤ 2). Clique aqui para ver uma versão maior desta figura.
| PI-RADS 5 | PI-RADS 4 | PI-RADS 3 | |
| PRI-MUS 5 | 95% (n = 20) | 80% (n = 15) | 100% (n = 1) |
| PRI-MUS 4 | 100% (n = 1) | 69% (n = 13) | 75% (n = 4) |
| PRI-MUS 3 | 0% (n = 0) | 33% (n = 3) | NA |
Tabela 1: Detecção de câncer de próstata clinicamente significativo estratificado pelos escores PI-RAD e PRI-MUS. Taxa de detecção de câncer de próstata (CDR) clinicamente significativa entre pacientes com ressonância magnética e micro-ultrassom disponíveis no momento da biópsia. O CDR é estratificado pelos escores PI-RADS (coluna) e PRI-MUS (linha). O número de pacientes que atendem a esses critérios é registrado entre parênteses.
| CLAVIEN DINDO GRAU | INCIDÊNCIA |
| GRAU I | 4% (n = 4) |
| GRAU II | 5% (n = 5) |
| GRAU III | 3% (n = 3) |
| GRAU IV | 0% (n = 0) |
| GRAU V | 0% (n = 0) |
Tabela 2: Porcentagem de pacientes com eventos adversos por grau. Porcentagem de pacientes com evento adverso dentro de 30 dias após a biópsia da próstata. Observe que os eventos adversos de grau III foram hospitalizações por eventos não sépticos, um dos quais provavelmente estava relacionado à biópsia e dois dos quais possivelmente estavam associados à biópsia.
Discussão
Este manuscrito detalha o procedimento e os resultados da biópsia de próstata transperineal guiada por Micro-US, à mão livre, sob anestesia local. Esta é a primeira descrição de uma técnica que preserva a localização do núcleo da biópsia e o conforto do paciente. Em nossa experiência, o procedimento é preciso, bem tolerado e tem eventos adversos mínimos.
Notavelmente, não houve casos relatados de sepse ou prostatite, apesar da falta de antibióticos profiláticos. Os resultados da amostra aqui utilizada corroboram os achados e a taxa de complicações do estudo NORAPP, que não encontrou benefício dos antibióticos profiláticos na biópsia transperineal6.
As etapas críticas do procedimento são as seguintes. A desinfecção e a anestesia observadas na etapa 2.6 e na seção 5 são os principais componentes para reduzir as taxas de infecção, atravessando o períneo em vez da parede retal, mantendo o conforto do paciente. A Seção 4 delineia as ROIs para alvos de biópsia, permitindo que menos núcleos sejam coletados enquanto amostram efetivamente as áreas problemáticas da próstata.
A biópsia transperineal ganhou popularidade em comparação com os métodos alternativos, dadas as taxas zero de sepse15,16, a precisão da amostragem de tumores anteriores, a administração de antibióticos e as recomendações das diretrizes 17,18. Simultaneamente, o Micro-US está sendo reconhecido como uma modalidade de imagem de câncer precisa, plataforma de fusão simples e biomarcador de imagem independente 9,19. Técnicas transperineais guiadas por Micro-US anteriores relataram um excelente CDR de 42%; no entanto, essa técnica utilizou um guia de agulha para alinhar a agulha e o plano de insonação. Embora o uso de um guia melhore a curva de aprendizado, ele provavelmente limita a biópsia à sala de cirurgia para permitir o uso de anestesia geral, pois cada punção de biópsia entra por um novo local20. Relatamos um CDR de 68%, demonstrando que essa técnica à mão livre tem precisão comparável ao uso de um guia de agulha.
A precisão, tolerabilidade e eventos adversos mínimos de nossa técnica devem ser interpretados dentro de certas limitações. Aproximadamente 3 h de prática prática em um simulador ou simulador são necessários para localizar e direcionar a agulha de biópsia. Pode ser necessário tempo adicional para aprender a interpretação da imagem Micro-US. A realização de biópsias direcionadas e sistemáticas pode resultar em 17 ou mais núcleos de biópsia e exigir até 30 minutos de tempo de procedimento. Embora relatemos excelentes taxas de detecção de câncer, o sucesso dessa técnica está parcialmente relacionado à nossa prática de omitir a biópsia da próstata em pacientes com risco calculado de <15% de csPCa21. Finalmente, o modelo de biópsia sistemática usado neste estudo mostra as áreas de maior risco da próstata, mas nunca foi comparado a outros modelos de biópsia transperineal. Apesar dessas limitações, essa técnica tem várias vantagens, principalmente a capacidade de realizar o procedimento em um ambiente clínico. Além disso, o rastreamento de posição da sonda micro-US permite a reconstrução 3D dos locais do câncer para uso ao realizar extirpação cirúrgica, aumento de radiação ou terapia focal.
Em conclusão, o Micro-US representa uma melhora recente na biópsia da próstata. Demonstramos uma abordagem transperineal que pode ser implementada na clínica sob anestesia local. Embora sejam necessárias avaliações adicionais e melhorias na capacidade diagnóstica do Micro-US, os cirurgiões que adotam essa técnica acharão simples de implementar, precisa e segura.
Divulgações
Nenhum.
Agradecimentos
Nenhum.
Materiais
| Name | Company | Catalog Number | Comments |
| 14 ga Angiocatheter | BD Angiocath | BD382269 | |
| Aquasonic | Parker Labs | Aquasonic 100 | |
| Biopsy Needle | Bard | MaxCore | |
| Biopsy Sponge 2 mm x 25.4 mm x 30.2 mm | McKesson | 1019107 | |
| ExactVu Micro-Ultrasound Machine | ExactImaging | ||
| ExactVu Micro-Ultrasound Probe (EV29L) | ExactImaging | ||
| Guaze Sponge McKesson Cotton 12-Ply 4'' x 4'' | McKesson | 762703 | |
| Hypodermic Needle 25 G 1.5 inch | McKesson | 42142523 | |
| Lidocaine 1% with Epinephrine 1:100,000 | NA | ||
| Lidocaine 2% Gel, 20 mL | URO-Jet | 76329301505 | |
| Probe Cover | ExactImaging | ||
| Skin Prep Solution betadine (10%) | McKesson | 1073829 | |
| Spinal Needle 20 G, 6 inch | McKesson | 992546 | |
| TruGuide | Bard | C1616A |
Referências
- Siegel, R. L., Miller, K. D., Fuchs, H. E., Jemal, A. Cancer statistics, 2022. CA: A Cancer Journal for Clinicians. 72 (1), 7-33 (2022).
- Onur, R., Littrup, P. J., Pontes, J. E., Bianco, F. J. Contemporary impact of transrectal ultrasound lesions for prostate cancer detection. The Journal of Urology. 172 (2), 512-514 (2004).
- Loeb, S., Carter, H. B., Berndt, S. I., Ricker, W., Schaeffer, E. M. Complications after prostate biopsy: Data from SEER-Medicare. The Journal of Urology. 186 (5), 1830-1834 (2011).
- Borghesi, M., et al. Complications after systematic, random, and image-guided prostate biopsy. European Urology. 71 (3), 353-365 (2017).
- Pradere, B., et al. Nonantibiotic strategies for the prevention of infectious complications following prostate biopsy: A systematic review and meta-analysis. The Journal of Urology. 205 (3), 653-663 (2021).
- Jacewicz, M., et al. Antibiotic prophylaxis versus no antibiotic prophylaxis in transperineal prostate biopsies (NORAPP): A randomised, open-label, non-inferiority trial. The Lancet. Infectious Diseases. 22 (10), 1465-1471 (2022).
- Ahmed, H. U., et al. Diagnostic accuracy of multi-parametric MRI and TRUS biopsy in prostate cancer (PROMIS): A paired validating confirmatory study. The Lancet. 389 (10071), 815-822 (2017).
- Kasivisvanathan, V., et al. MRI-targeted or standard biopsy for prostate-cancer diagnosis. The New England Journal of Medicine. 378 (19), 1767 (2018).
- Sountoulides, P., et al. Micro-ultrasound-guided vs multiparametric magnetic resonance imaging-targeted biopsy in the detection of prostate cancer: A systematic review and meta-analysis. The Journal of Urology. 205 (5), 1254-1262 (2021).
- Ghai, S., et al. Assessing cancer risk on novel 29 MHz micro-ultrasound images of the prostate: Creation of the micro-ultrasound protocol for prostate risk identification. The Journal of Urology. 196 (2), 562-569 (2016).
- Exact Imaging E-learning. Exact Imaging Available from: https://elearn.exactimaging.com/learn (2022)
- Siddiqui, E. J., Ali, S., Koneru, S. The rectal administration of lignocaine gel and periprostatic lignocaine infiltration during transrectal ultrasound-guided prostate biopsy provides effective analgesia. Annals of the Royal College of Surgeons of England. 88 (2), 218-221 (2006).
- Zhang, Z., et al. Attitude is everything: Keep probe pitch neutral during side-fire prostate biopsy. A simulator study. BJU International. 128 (5), 615-624 (2021).
- Prostate Biopsy. Michigan Urological Surgery Improvement Collaborative (MUSIC) Available from: https://musicurology.com/programs/prostate/transperinealbiopsy/ (2022)
- Sigle, A., et al. Safety and side effects of transperineal prostate biopsy without antibiotic prophylaxis. Urologic Oncology: Seminars and Original Investigations. 39 (11), (2021).
- Grummet, J. P., et al. Sepsis and "superbugs": Should we favour the transperineal over the transrectal approach for prostate biopsy. BJU International. 114 (3), 384-388 (2014).
- Pilatz, A., et al. European association of urology position paper on the prevention of infectious complications following prostate biopsy. European Urology. 79 (1), 11-15 (2021).
- Meyer, A. R., et al. Transperineal prostate biopsy improves the detection of clinically significant prostate cancer among men on active surveillance. The Journal of Urology. 205 (4), 1069-1074 (2021).
- Avolio, P. P., et al. The use of 29 MHz transrectal micro-ultrasound to stratify the prostate cancer risk in patients with PI-RADS III lesions at multiparametric MRI: A single institutional analysis. Urologic Oncology: Seminars and Original Investigations. 39 (12), 1-7 (2021).
- Rodríguez Socarrás, M. E., et al. Prostate mapping for cancer diagnosis: The Madrid protocol. Transperineal prostate biopsies using multiparametric magnetic resonance imaging fusion and micro-ultrasound guided biopsies. The Journal of Urology. 204 (4), 726-733 (2020).
- Kinnaird, A., et al. A prostate cancer risk calculator: Use of clinical and magnetic resonance imaging data to predict biopsy outcome in North American men. Canadian Urological Association Journal. 16 (3), 161-166 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados