Method Article
Biopsie transpérinéale de la prostate guidée par micro-échographie : une procédure clinique
Dans cet article
Résumé
Ce manuscrit décrit les étapes de la réalisation d’une biopsie transpérinéale de la prostate guidée par micro-échographie sous anesthésie locale.
Résumé
Le cancer de la prostate est la tumeur maligne solide la plus fréquente chez les hommes et nécessite une biopsie pour le diagnostic. Ce manuscrit décrit une technique transpérinéale guidée par micro-échographie à main levée réalisée sous anesthésie locale, qui maintient la précision, maintient le confort des patients, a peu d’effets indésirables et minimise le besoin de produits jetables. Les techniques transpérinéales antérieures guidées par micro-échographie nécessitaient une anesthésie générale ou rachidienne. Les étapes clés décrites dans le protocole comprennent (1) la mise en place de l’anesthésie locale, (2) l’imagerie par micro-échographie, (3) et la visualisation de l’aiguille d’anesthésie/biopsie lorsqu’elle est découplée du plan d’insonation. Une revue rétrospective de 100 patients subissant cette technique a démontré un taux de détection du cancer cliniquement significatif de 68 %. Les scores de douleur ont été collectés de manière prospective chez un sous-ensemble de patients (N = 20) et ont montré un score médian de douleur procédurale de 2 sur 10. Le taux d’événements indésirables de grade III à 30 jours était de 3 % ; L’un de ces événements était probablement lié à la biopsie de la prostate. Dans l’ensemble, nous présentons une technique simple, précise et sûre pour effectuer une biopsie transpérinéale de la prostate guidée par micro-échographie.
Introduction
Le cancer de la prostate est la tumeur maligne solide la plus fréquente chez les hommes américains, avec 268 000 diagnostics prévus en 20221. Le diagnostic du cancer de la prostate nécessite une biopsie de la prostate, qui est traditionnellement réalisée en passant une aiguille de biopsie à travers la muqueuse rectale (transrectale) dans la prostate. Le guidage de l’aiguille suit un modèle systématique « à l’aveugle », car l’échographie conventionnelle ne peut pas différencier le cancer du tissu bénin2. Aux États-Unis, plus d’un million de biopsies de ce type sont effectuées chaque année 3,4.
Au cours de la dernière décennie, deux progrès significatifs en matière d’imagerie et de techniques ont amélioré la sécurité et la précision. Tout d’abord, l’augmentation de l’utilisation des biopsies transpérinéales pour éviter la muqueuse rectale a diminué le risque de septicémie sans avoir besoin d’antibiotiques 5,6. Deuxièmement, l’utilisation de l’IRM et de la micro-échographie (Micro-US) a amélioré les taux de détection du cancer par rapport à la biopsie avec un guidage échographique conventionnel (5 MHz) 5,7,8,9.
Micro-US utilise des ondes acoustiques de 29 MHz, une densité de cristaux piézoélectriques améliorée et un traitement d’ondes innovant pour atteindre une résolution spatiale de 70 μm contre environ 200 μm pour un ultrason conventionnel8. Un système de classification à l’aide d’une échelle de Likert à 5 points (Prostate Risk Identification Using Micro-Ultrasound, PRI-MUS), est utilisé pour quantifier le risque de cancer de la prostate dans les lésions par micro-échographie10. L’emplacement des carottes de biopsie et des lésions PRI-MUS est suivi par rapport à la ligne médiane à l’aide d’un accéléromètre situé dans la poignée de la sonde Micro-US (ExactImaging, Markham, ON). La possibilité de suivre les biopsies permet la reconstruction 3D des emplacements du cancer de la prostate. Les traitements de précision contre le cancer, tels que la thérapie focale et l’amplification des radiations, sont rendus possibles grâce aux informations spatiales obtenues par les carottes suivies.
À ce jour, aucune technique publiée permettant une biopsie transpérinéale de la prostate guidée par micro-échographie sous anesthésie locale ne permet également de conserver l’orientation spatiale des noyaux et des lésions. Ce manuscrit vise à décrire une telle technique.
Protocole
Les méthodes décrites sont basées sur l’expérience de l’Université de Floride (UF). Le protocole et l’acquisition des données ont été approuvés par le Conseil d’examen institutionnel de l’Université (IRB). Les indications de la biopsie de la prostate comprenaient un toucher rectal (TR) suspect, une élévation de l’antigène prostatique spécifique (PSA) ou une autre anomalie du biomarqueur (c’est-à-dire 4K, ExoDx). Le protocole est décrit pour un chirurgien droitier.
1. Préparation de la sonde micro-ultrasonore
- Désinfectez la sonde conformément au manuel d’utilisation et de sécurité du système de micro-échographie11.
- Placez environ 20 ml de gel acoustique à l’extrémité du couvercle de la sonde et éliminez les bulles. Placez un guide d’aiguille sur la sonde et placez le couvercle de la sonde sur la sonde (Figure 1A).
REMARQUE : Les bulles sont éliminées en tournant le couvercle de la sonde avec du lubrifiant comme avec un jouet à queue de renard. La force centrifuge déplace la lubrification vers l’horizontale tout en déplaçant les bulles vers l’extérieur. - Placez un élastique autour du col de la sonde sous les cristaux piézoélectriques pour éviter les fuites de gel.
- Installez l’équipement de biopsie selon la préférence du chirurgien.
REMARQUE : La configuration utilisée dans cette étude est illustrée à la figure 1B.
2. Positionnement du patient et anesthésie
- Positionnez le patient en position de lithotomie avec l’anus au bord du lit. Fournir un appui-tête et un drap génital pour améliorer le confort et l’intimité (figure 1C).
REMARQUE : À l’UF, les étriers pour le positionnement de la lithotomie sont préférés. - Placez 10 ml de gel de lidocaïne visqueuse à 2 % dans le rectum comme décrit précédemment12.
- Assurer le confort du patient et la préparation du matériel nécessaire pendant cette période.
- Ajustez la hauteur du lit de manière à ce que l’anus soit au niveau du coude du chirurgien.
- Demandez au patient d’élever son scrotum et d’exposer le périnée (Figure 1C).
- À l’aide de gel acoustique, effectuez un toucher rectal. Notez les anomalies palpables pour la stadification et le ciblage de la biopsie.
- Changez de gants et stérilisez la peau périnéale avec de la bétadine ou de la chlorhexidine de la base du scrotum jusqu’en dessous de l’anus.
- Anesthésier les tissus mous périnéaux aux positions 10 heures et 2 heures, en commençant à environ 10-15 mm de l’anus (Figure 1D).
REMARQUE : Commencer avec une aiguille de 2 pouces 25 g contenant 1 % de lidocaïne avec une solution d’épinéphrine 1:100 000 et de bicarbonate de sodium à 8,4 % mélangée dans un rapport de 1:10 (1 mL de NaHCO3 : 10 mL de lidocaïne). C’est, ci-après, appelé « lidocaïne ». - Insérez l’aiguille parallèlement au rectum et injectez de la lidocaïne au fur et à mesure que l’aiguille avance. Placez environ 3 ml de lidocaïne dans les tissus mous entre la peau et le fascia de Colles et 2 ml entre le fascia de Colles (figure 2A).
REMARQUE : Pour plus d’efficacité, l’étape ci-dessus est effectuée à l’aveugle ; Cependant, au début de votre expérience, envisagez d’utiliser le guidage par échographie, car l’anatomie du patient diffère avec la forme pelvienne, la musculature fessière et l’obésité.
3. Diagnostic par micro-échographie
- Lubrifiez la sonde, insérez-la doucement dans le rectum et avancez jusqu’à ce que le milieu de la prostate soit centré sur le moniteur de visualisation.
REMARQUE : Suivez le contour du sigmoïde en dirigeant la pointe de la sonde vers le bas (vers le sacrum) une fois au-delà du sphincter anal. En utilisant cette technique, la base de la vessie peut être visualisée avec un minimum d’inconfort. Ne pas diriger la sonde vers le bas causera de la douleur. - Optimisez les paramètres de l’image micro-échographie.
- Saisissez la sonde d’imagerie dans la main gauche (non dominante) au niveau de la partie la plus épaisse de la sonde. Inclinez et soulevez la sonde vers le haut de manière à ce que la base de la prostate reçoive la plus grande pression des cristaux piézoélectriques. Le mouvement de tangage et de levage comprimera le rectum et optimisera la visualisation (Figure 1C).
- Ajustez les curseurs de gain compensé dans le temps (TCG) en une forme « C » ou « J » inversée douce jusqu’à ce qu’il y ait une échelle de gris uniforme sur l’image.
- Ajustez le cadran de gain principal de sorte que les bords latéraux de la prostate soient bien visualisés mais que le centre de la prostate ne soit pas trop lumineux.
REMARQUE : La prostate latérale est acoustiquement plus foncée que la glande moyenne, car moins d’ondes ultrasonores réfléchies reviennent à un angle. - Assurez-vous qu’aucune bulle ou mucus rectal ne provoque d’ombre.
REMARQUE : À UF, les paramètres par défaut sont utilisés pour la plage dynamique, la profondeur et la mise au point ; Cependant, ceux-ci peuvent être ajustés selon les préférences du chirurgien. - Sélectionnez un préréglage d’image (Petit, Moyen, Grand et Très grand) qui permet de visualiser la prostate avec un minimum de graisse prostatique antérieure.
REMARQUE : Les détails de l’optimisation de l’image et du fonctionnement Micro-US sont disponibles dans le « Manuel d’utilisation et de sécurité du système »11.
- Effectuez un calcul du volume de la prostate en appuyant sur le bouton Dual/Transverse , en effectuant un balayage de la prostate, puis en mesurant la longueur sagittale et la hauteur et la largeur axiales reconstruites.
- Tournez la sonde jusqu’à ce que l’urètre soit visualisé. La visualisation de l’urètre est meilleure au niveau de la vessie, du cou et de l’apex de la prostate. Placez la sonde parallèlement à la ligne médiane de sorte que le col de la vessie et l’urètre soient visibles dans le même plan (lacet neutre).
- Appuyez sur la réinitialisation de l’angle sur l’écran tactile Micro-US pour mettre à zéro l’accéléromètre de la sonde.
- Placez la main droite sur la partie proximale de la sonde où la sonde rencontre le cordon électrique. La main gauche se glisse sous le col de la sonde, soutenant la position d’inclinaison vers le haut (Figure 1C).
- Dites au patient de rester immobile ; En un seul mouvement, balayez du bord latéral droit de la prostate (dans le sens des aiguilles d’une montre) à travers la prostate jusqu’au bord gauche, en prenant ~25 s. Appuyez sur le bouton Cine Loop pour enregistrer le balayage.
REMARQUE : Des balayages séparés de l’apex et de la base sont souvent nécessaires pour les prostates de plus de 50 ml. Il est recommandé d’enregistrer un balayage qui visualise la zone de transition et un balayage sur le paramètre Petit pour visualiser la zone périphérique.
4. Évaluation diagnostique
- Évaluer la zone de transition pour les lésions PRI-MUS.
- Une fois la zone de transition évaluée, passez au réglage Petite image et évaluez la zone périphérique pour les lésions PRI-MUS.
REMARQUE : Envisagez de vous entraîner à utiliser la bibliothèque de diagnostic gratuite Micro-US pour acquérir de l’expérience dans l’identification et la classification des lésions PRI-MUS11. - Notez l’emplacement des régions d’intérêt (ROI) rencontrées en enregistrant l’angle central et les angles auxquels le ROI est le premier et le dernier visible.
REMARQUE : À l’UF, ces angles sont indiqués par le chirurgien et consignés dans les notes opératoires par le personnel de la salle de biopsie. - Si vous utilisez un logiciel de fusion, chargez une IRM annotée avant la biopsie et appuyez sur le bouton de la ligne médiane tout en visualisant l’urètre (Figure 2B).
5. Anesthésie de la prostate
- À l’aide d’une aiguille de 6 pouces et 20 G, percez la peau au niveau du tractus de biopsie précédemment anesthésié et avancez l’aiguille jusqu’au releveur de l’anus sous visualisation Micro-US (Figure 2A).
- Placez 3 ml de l’anesthésique local dans le complexe musculaire releveur de l’anus (Figure 2A).
- Avancez l’aiguille 20 G dans le triangle péri-apical (délimité par l’urètre médialement, le releveur anal latéralement et le fascia de Denonvilliers postérieurement). Injecter 5 à 7 ml de lidocaïne dans le triangle péri-apical (figure 2A).
REMARQUE : La face latérale du complexe veineux dorsal (CVD) se drape dans le triangle périapical ; Ainsi, aspirez avant l’injection de lidocaïne. Une anesthésie appropriée s’hydrodissectionra entre la capsule prostatique et le fascia de Denonvilliers.
6. Biopsie de la prostate
- Insérez un angiocathéter de 14 G ou une aiguille coaxiale métallique de 15 G (aiguille d’accès) à travers le tractus précédemment anesthésié jusqu’à 5-10 mm de l’apex de la prostate. Passez l’aiguille d’accès au-dessus du sphincter anal et à travers ou médialement jusqu’au releveur de l’anus. Personnalisez la distance entre l’aiguille d’accès et le rectum en fonction de l’emplacement du retour sur investissement.
- Prélever l’ensemble de la prostate à l’aide d’une aiguille située à 5 mm au-dessus du rectum et à 15°-20° du plan médian de la prostate où l’urètre est visible (figure 1D, positions 10 heures et 2 heures).
- Faites pivoter la sonde de manière à ce que le plan d’insonation visualise l’aiguille d’accès, et avancez le pistolet de biopsie jusqu’à ce que la pointe de l’aiguille de biopsie devienne visible à l’extrémité de l’aiguille d’accès.
- Tournez la sonde pour visualiser la cible de la biopsie (soit le retour d’investissement, soit le forage systématique), puis tournez-la vers l’arrière pour visualiser la pointe de l’aiguille de biopsie. Ajustez la trajectoire de l’aiguille vers la cible en ajustant le pistolet de biopsie à l’extérieur du patient.
- Avancez l’aiguille sous la vision et complétez de petits rouleaux de sonde de 3° à 10° (micro-rouleaux) pour guider la pointe de l’aiguille dans la cible prévue. N’avancez l’aiguille de biopsie que tout en visualisant la pointe pour éviter de dépasser la cible prévue.
REMARQUE : Il est nécessaire de retirer l’aiguille de biopsie si vous faites des mouvements plus importants vers une cible. Dans cette technique, la sonde est maintenue parallèle à l’urètre plutôt que parallèle à l’aiguille (« lacet »). La préservation de l’angle de biopsie par rapport à l’urètre permet une reconstruction précise de l’emplacement du cancer et maximise le confort du patient. La partie la plus difficile de cette technique est de visualiser l’aiguille lorsqu’elle est découplée du plan d’insonation. D’après notre expérience de formation de résidents, de moniteurs et d’autres médecins, la mémoire musculaire nécessaire à la mise en œuvre de la technique nécessite environ 3 heures de pratique. Envisagez de vous entraîner sur un fantôme de prostate ou un simulateur13 pour développer la mémoire musculaire requise avant une biopsie. L’exécution initiale de cette technique sur un patient anesthésié facilitera la transition vers une pratique en clinique. - Avant d’obtenir un échantillon de biopsie, roulez-le dans l’urètre et assurez-vous que l’angle est compris entre 1° et 2° de la position 0°. Enregistrez la position de l’angle pour chaque lancer de biopsie en capturant une image ou une boucle cinéma.
REMARQUE : Par convention, la rotation du côté droit (dans le sens inverse des aiguilles d’une montre) est indiquée par un angle positif, tandis que la rotation du côté gauche (dans le sens des aiguilles d’une montre) est caractérisée par un angle négatif. - Commencez par obtenir trois carottes de biopsie distribuées via le retour d’investissement (Figure 2C).
- Envisagez d’effectuer une biopsie systématique transpérinéale (Figure 3). Pour plus d’efficacité, commencer des biopsies systématiques ipsilatérales au ROI. Si le ROI est antérieur, abaissez l’aiguille coaxiale pour améliorer le prélèvement systématique de la zone périphérique par biopsie.
REMARQUE : Cette étude a effectué une biopsie systématique à 14 carottes (Figure 3). Une biopsie systématique peut probablement être sautée dans les cas suivants : 1) des carottes systématiques chevauchant un retour d’intérêt précédemment échantillonné, et 2) de petites prostates où un seul jet échantillonne l’apex et la base. À l’aide de ce modèle, les biopsies apicales sont obtenues en commençant le lancer au niveau de la capsule apicale de la prostate. Les biopsies de base sont obtenues en commençant le lancer dans la glande médiane.
7. Fin de la procédure
- Après avoir acquis toutes les biopsies, retirez l’aiguille coaxiale et la sonde à ultrasons.
- Maintenez la pression sur le périnée avec une serviette pendant 1 à 5 minutes jusqu’à ce que l’hémostase du site de ponction soit atteinte.
- Aidez les patients à se mettre en position assise et, après 1 min, en position debout.
- Conseillez aux patients de s’attendre à une hématurie transitoire et à une hématospermie.
- Prescrire aux patients des alpha-bloquants du flux urinaire restreints de base à remplir au besoin.
Résultats
Une analyse rétrospective de notre base de données gérée prospectivement de septembre 2021 à juin 2022 (IRB202200022) est décrite. Le cancer de la prostate cliniquement significatif (csPCa) a été considéré comme un cancer de la prostate du groupe ≥grade 2 (Gleason 3 + 4 = 7). Le taux de détection du cancer (CDR) a été calculé à ≥GG2/total de patients. Les scores de douleur ont été évalués sur une échelle de Likert de 1 à 10 points au départ, lors de la mise en place de l’anesthésie locale, lors de l’insertion de la sonde rectale et pendant la biopsie. Les événements indésirables ont été discutés avec les patients 2 semaines après l’intervention, et les événements saisis par l’examen des dossiers ont été documentés dans les 30 jours suivant la biopsie. Les événements indésirables ont été notés à l’aide de la note et du guide d’attribution du CTEP (Cancer Therapy Evaluation Program).
Nous avons identifié 100 patients qui ont subi une biopsie transpérinéale clinique guidée par Micro-US sous anesthésie locale. Dans cette étude, le TCD par patient était de 68 %. Le CDR variait en fonction des scores PI-RADS (Prostate Image Reporting and Data System) et PRI-MUS de chaque lésion (tableau 1).
Les scores de douleur étaient disponibles chez un sous-ensemble ultérieur de patients (N = 20). Les scores médians de douleur (IQR) étaient de 0 (0, 1) au départ, de 2 (1, 4) lors de l’administration d’une anesthésie locale, de 2 (1, 5) lors de la mise en place de la sonde transrectale et de 2 (0, 5) lors de la biopsie de la prostate.
Les effets secondaires étaient relativement rares, avec une incidence de 3 % d’effets indésirables de grade III (tableau 2). Il n’y a pas eu d’événements de grade IV ou de grade V. Les événements de grade II impliquaient principalement la nouvelle prescription d’alpha-bloquants pour soulager un ralentissement du jet urinaire. Comme mentionné ci-dessus, les patients ont été dépistés pour les symptômes avant la biopsie. Les événements de grade III ont entraîné l’hospitalisation de trois patients. Selon le guide d’attribution du CTEP, une hospitalisation due à une hypotension symptomatique était probablement liée à la biopsie de la prostate secondaire à l’absorption de la lidocaïne. Les symptômes de la patiente ont disparaître spontanément dans les 12 heures suivant la surveillance. Deux autres patients ont été hospitalisés (chute mécanique et altération de l’état mental) dans les 30 jours suivant la biopsie. On a découvert qu’ils avaient des infections urinaires non septiques et asymptomatiques, peut-être liées à la biopsie. En dehors de ces patients spécifiques mentionnés, il n’y avait pas de septicémie, de prostatite, de cystite ou d’autres cas d’infection.
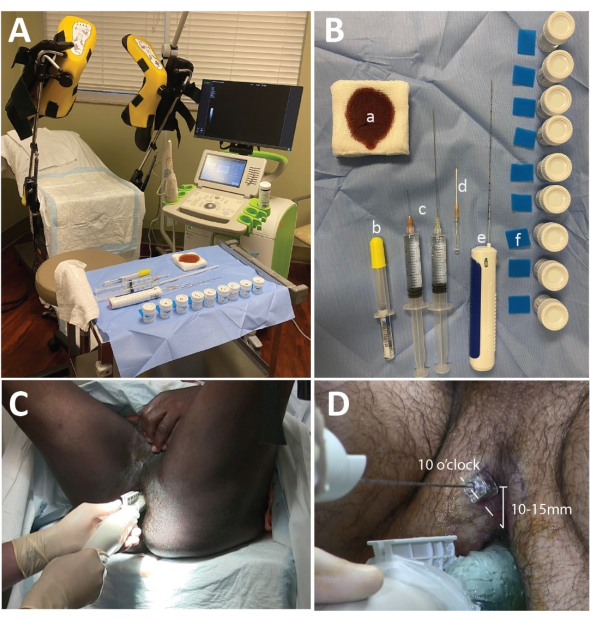
Figure 1 : Configuration de la micro-échographie, plateau de biopsie et placement de l’aiguille. (A) La configuration de la salle d’intervention avec l’appareil ExactVu placé à la droite du chirurgien. (B) table de biopsie comprenant (a) des compresses de gaze de 4 cm x 4 cm imbibées de bétadine, (b) 10 mL de gel de lidocaïne à 2 %, (c) de la lidocaïne à 1 % avec 1:100 000 d’épinéphrine distribuée avec 2 mL de solution de bicarbonate de sodium à 8,4 % (1 mL de NaHCO3:10 mL de lidocaïne) dans 2 seringues de 20 mL avec une aiguille de 2 pouces 25 g et une aiguille de 6 pouces 20 g, (d) un angiocath 14 G ou une aiguille métallique coaxiale, (e) un pistolet à biopsie, (f) des tampons de biopsie en mousse et des récipients de formol. (C) La position de la main pour effectuer le balayage de diagnostic. Notez que la main gauche supporte la pression ascendante sur la prostate, tandis que la main droite fait pivoter la sonde. (D) La position de l’aiguille coaxiale ou de l’angiocathéter : 10 heures pour la prostate du côté droit et 2 heures pour la prostate du côté gauche (non illustré). Veuillez cliquer ici pour voir une version agrandie de cette figure.
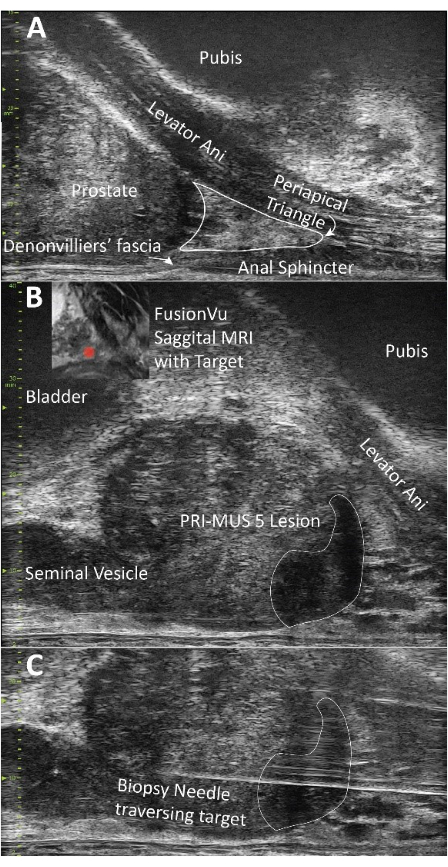
Figure 2 : Démonstration de l’anatomie de la prostate et biopsie. (A) Visualisation du releveur de l’anus et du triangle périapical ; Les deux sont des structures importantes à anesthésier pour la mise en œuvre réussie de cette technique. (B) Mise en évidence d’une lésion PRI-MUS 5, anatomiquement concordante avec l’IRM pré-biopsie. (C) Confirmation visuelle de l’aiguille de biopsie traversant la cible. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Modèle de biopsie systématique de la technique proposée. Ce modèle est basé sur le modèle disponible dans le Michigan Urologic Surgery Improvement Collaborative (MUSIC)14. Cependant, ce modèle est une amélioration à trois égards. (i) Augmentation de l’échantillonnage de la zone antérieure (4 carottes contre 2 carottes), (ii) Amélioration considérable de l’affichage visuel de l’emplacement de la carotte à l’aide d’un modèle 3D, et (iii) Modification de la nomenclature des carottes pour améliorer la convivialité. Dans ce protocole, des biopsies systématiques sont prélevées après la biopsie ROI dans un tissu d’imagerie négative (PRI-MUS ≤ 2). Veuillez cliquer ici pour voir une version agrandie de cette figure.
| PI-RADS 5 | PI-RADS 4 | PI-RADS 3 | |
| PRI-MUS 5 | 95 % (n = 20) | 80 % (n = 15) | 100 % (n = 1) |
| PRI-MUS 4 | 100 % (n = 1) | 69 % (n = 13) | 75 % (n = 4) |
| PRI-MUS 3 | 0 % (n = 0) | 33 % (n = 3) | NA |
Tableau 1 : Détection du cancer de la prostate cliniquement significatif stratifié par les scores PI-RAD et PRI-MUS. Taux de détection du cancer de la prostate (CDR) cliniquement significatif chez les patients avec IRM et micro-échographie disponibles au moment de la biopsie. Le CDR est stratifié par les scores PI-RADS (colonne) et PRI-MUS (rangée). Le nombre de patients répondant à ces critères est indiqué entre parenthèses.
| CLAVIEN DINDO GRADE | INCIDENCE |
| GRADE I | 4 % (n = 4) |
| GRADE II | 5 % (n = 5) |
| GRADE III | 3 % (n = 3) |
| GRADE IV | 0 % (n = 0) |
| GRADE V | 0 % (n = 0) |
Tableau 2 : Pourcentage de patients présentant des effets indésirables par grade. Pourcentage de patients présentant un événement indésirable dans les 30 jours suivant la biopsie de la prostate. Il convient de noter que les événements indésirables de grade III étaient des hospitalisations pour des événements non septiques, dont l’un était probablement lié à la biopsie et deux étaient peut-être associés à la biopsie.
Discussion
Ce manuscrit détaille la procédure et les résultats de la biopsie de la prostate transpérinéale guidée par Micro-US sous anesthésie locale. Il s’agit de la première description d’une technique qui préserve l’emplacement du noyau de biopsie et le confort du patient. D’après notre expérience, la procédure est précise, bien tolérée et comporte un minimum d’événements indésirables.
Notamment, aucun cas de septicémie ou de prostatite n’a été signalé malgré l’absence d’antibiotiques prophylactiques. Les résultats de l’échantillon utilisé ici corroborent les résultats et le taux de complications de l’essai NORAPP, qui n’a pas trouvé d’avantage des antibiotiques prophylactiques dans la biopsie transpérinéale6.
Les étapes critiques de la procédure sont les suivantes. La désinfection et l’anesthésie notées à l’étape 2.6 et à la section 5 sont les éléments clés pour réduire les taux d’infection en traversant le périnée plutôt que la paroi rectale tout en maintenant le confort du patient. La section 4 délimite les zones d’intérêt pour les cibles de biopsie, ce qui permet de prélever moins de carottes tout en échantillonnant efficacement les zones problématiques de la prostate.
La biopsie transpérinéale a gagné en popularité par rapport aux méthodes alternatives compte tenu des taux zéro de septicémie15,16, de la précision de l’échantillonnage des tumeurs antérieures, de la gestion des antibiotiques et des recommandations des lignes directrices17,18. Simultanément, Micro-US est reconnu comme une modalité d’imagerie du cancer précise, une plate-forme de fusion simple et un biomarqueur d’imagerie indépendant 9,19. Les techniques transpérinéales guidées antérieures par Micro-US ont rapporté un excellent CDR de 42 % ; Cependant, cette technique utilisait un guide d’aiguille pour aligner l’aiguille et le plan d’insonation. Bien que l’utilisation d’un guide améliore la courbe d’apprentissage, il est probable qu’il confine la biopsie à la salle d’opération pour permettre l’utilisation d’une anesthésie générale, car chaque ponction de biopsie pénètre par un nouveau site20. Nous rapportons un CDR de 68 %, démontrant que cette technique à main levée a une précision comparable à l’utilisation d’un guide d’aiguille.
La précision, la tolérabilité et le nombre minimal d’effets indésirables de notre technique doivent être interprétés dans certaines limites. Environ 3 h de pratique sur un simulateur ou un fantôme sont nécessaires pour localiser et diriger l’aiguille de biopsie. Du temps supplémentaire peut être nécessaire pour apprendre l’interprétation des images Micro-US. La réalisation de biopsies ciblées et systématiques peut entraîner 17 carottes de biopsie ou plus et nécessiter jusqu’à 30 minutes de procédure. Bien que nous rapportions d’excellents taux de détection du cancer, le succès de cette technique est en partie lié à notre pratique d’omission de la biopsie de la prostate chez les patients présentant un risque calculé de <15 % de csPCa21. Enfin, le modèle de biopsie systématique utilisé dans cette étude échantillonne les zones les plus à risque de la prostate, mais n’a jamais été comparé à d’autres modèles de biopsie transpérinéale. Malgré ces limites, cette technique présente plusieurs avantages, notamment la possibilité d’effectuer la procédure dans un environnement clinique. De plus, le suivi de position de la sonde micro-US permet la reconstruction 3D des emplacements du cancer pour une utilisation lors de l’extirpation chirurgicale, de l’amplification des radiations ou de la thérapie focale.
En conclusion, Micro-US représente une amélioration récente de la biopsie de la prostate. Nous démontrons une approche transpérinéale qui peut être mise en œuvre en clinique sous anesthésie locale. Bien qu’une évaluation plus poussée et des améliorations de la capacité diagnostique de Micro-US soient justifiées, les chirurgiens qui adoptent cette technique la trouveront simple à mettre en œuvre, précise et sûre.
Déclarations de divulgation
Aucun.
Remerciements
Aucun.
matériels
| Name | Company | Catalog Number | Comments |
| 14 ga Angiocatheter | BD Angiocath | BD382269 | |
| Aquasonic | Parker Labs | Aquasonic 100 | |
| Biopsy Needle | Bard | MaxCore | |
| Biopsy Sponge 2 mm x 25.4 mm x 30.2 mm | McKesson | 1019107 | |
| ExactVu Micro-Ultrasound Machine | ExactImaging | ||
| ExactVu Micro-Ultrasound Probe (EV29L) | ExactImaging | ||
| Guaze Sponge McKesson Cotton 12-Ply 4'' x 4'' | McKesson | 762703 | |
| Hypodermic Needle 25 G 1.5 inch | McKesson | 42142523 | |
| Lidocaine 1% with Epinephrine 1:100,000 | NA | ||
| Lidocaine 2% Gel, 20 mL | URO-Jet | 76329301505 | |
| Probe Cover | ExactImaging | ||
| Skin Prep Solution betadine (10%) | McKesson | 1073829 | |
| Spinal Needle 20 G, 6 inch | McKesson | 992546 | |
| TruGuide | Bard | C1616A |
Références
- Siegel, R. L., Miller, K. D., Fuchs, H. E., Jemal, A. Cancer statistics, 2022. CA: A Cancer Journal for Clinicians. 72 (1), 7-33 (2022).
- Onur, R., Littrup, P. J., Pontes, J. E., Bianco, F. J. Contemporary impact of transrectal ultrasound lesions for prostate cancer detection. The Journal of Urology. 172 (2), 512-514 (2004).
- Loeb, S., Carter, H. B., Berndt, S. I., Ricker, W., Schaeffer, E. M. Complications after prostate biopsy: Data from SEER-Medicare. The Journal of Urology. 186 (5), 1830-1834 (2011).
- Borghesi, M., et al. Complications after systematic, random, and image-guided prostate biopsy. European Urology. 71 (3), 353-365 (2017).
- Pradere, B., et al. Nonantibiotic strategies for the prevention of infectious complications following prostate biopsy: A systematic review and meta-analysis. The Journal of Urology. 205 (3), 653-663 (2021).
- Jacewicz, M., et al. Antibiotic prophylaxis versus no antibiotic prophylaxis in transperineal prostate biopsies (NORAPP): A randomised, open-label, non-inferiority trial. The Lancet. Infectious Diseases. 22 (10), 1465-1471 (2022).
- Ahmed, H. U., et al. Diagnostic accuracy of multi-parametric MRI and TRUS biopsy in prostate cancer (PROMIS): A paired validating confirmatory study. The Lancet. 389 (10071), 815-822 (2017).
- Kasivisvanathan, V., et al. MRI-targeted or standard biopsy for prostate-cancer diagnosis. The New England Journal of Medicine. 378 (19), 1767 (2018).
- Sountoulides, P., et al. Micro-ultrasound-guided vs multiparametric magnetic resonance imaging-targeted biopsy in the detection of prostate cancer: A systematic review and meta-analysis. The Journal of Urology. 205 (5), 1254-1262 (2021).
- Ghai, S., et al. Assessing cancer risk on novel 29 MHz micro-ultrasound images of the prostate: Creation of the micro-ultrasound protocol for prostate risk identification. The Journal of Urology. 196 (2), 562-569 (2016).
- Exact Imaging E-learning. Exact Imaging Available from: https://elearn.exactimaging.com/learn (2022)
- Siddiqui, E. J., Ali, S., Koneru, S. The rectal administration of lignocaine gel and periprostatic lignocaine infiltration during transrectal ultrasound-guided prostate biopsy provides effective analgesia. Annals of the Royal College of Surgeons of England. 88 (2), 218-221 (2006).
- Zhang, Z., et al. Attitude is everything: Keep probe pitch neutral during side-fire prostate biopsy. A simulator study. BJU International. 128 (5), 615-624 (2021).
- Prostate Biopsy. Michigan Urological Surgery Improvement Collaborative (MUSIC) Available from: https://musicurology.com/programs/prostate/transperinealbiopsy/ (2022)
- Sigle, A., et al. Safety and side effects of transperineal prostate biopsy without antibiotic prophylaxis. Urologic Oncology: Seminars and Original Investigations. 39 (11), (2021).
- Grummet, J. P., et al. Sepsis and "superbugs": Should we favour the transperineal over the transrectal approach for prostate biopsy. BJU International. 114 (3), 384-388 (2014).
- Pilatz, A., et al. European association of urology position paper on the prevention of infectious complications following prostate biopsy. European Urology. 79 (1), 11-15 (2021).
- Meyer, A. R., et al. Transperineal prostate biopsy improves the detection of clinically significant prostate cancer among men on active surveillance. The Journal of Urology. 205 (4), 1069-1074 (2021).
- Avolio, P. P., et al. The use of 29 MHz transrectal micro-ultrasound to stratify the prostate cancer risk in patients with PI-RADS III lesions at multiparametric MRI: A single institutional analysis. Urologic Oncology: Seminars and Original Investigations. 39 (12), 1-7 (2021).
- Rodríguez Socarrás, M. E., et al. Prostate mapping for cancer diagnosis: The Madrid protocol. Transperineal prostate biopsies using multiparametric magnetic resonance imaging fusion and micro-ultrasound guided biopsies. The Journal of Urology. 204 (4), 726-733 (2020).
- Kinnaird, A., et al. A prostate cancer risk calculator: Use of clinical and magnetic resonance imaging data to predict biopsy outcome in North American men. Canadian Urological Association Journal. 16 (3), 161-166 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon