Method Article
3차원 난포 배양을 위한 새로운 히알루로난 하이드로겔의 응용 및 마우스 난포 동결 보존을 위한 방법론
요약
이 프로토콜은 티라민 결합 히알루로난 하이드로겔을 사용하여 마우스 난소에서 전방의 여포를 캡슐화하고 배양하는 새로운 3차원(3-D) 배양 모델을 설명합니다. 또한 유리화(vitrification)에 의한 난소 여포 동결 보존에 대한 두 가지 접근 방식에 대해서도 자세히 설명합니다.
초록
세포질 및 핵 성숙에 필요한 난포 여포의 3D 구조와 체세포 구성 요소와 난모세포 간의 복잡한 상호 작용은 기존의 2차원(2D) 배양 시스템에서 유지하기 어렵습니다. 우리는 마우스 난포의 캡슐화 및 배양을 위해 티라민 결합 히알루로난 하이드로겔을 사용하는 새로운 3D 배양 모델을 설명합니다. 히알루로난 캡슐화 기법은 여포의 3차원 성장과 발달 중인 여포에 근접한 영양 인자의 유지를 가능하게 합니다. 이 하이드로겔은 용도가 매우 다양하며 분리된 난포와 난소 조직 조각에 적용할 수 있습니다. HA 겔의 점탄성 특성은 겔 농도에 따라 강성과 성형성을 조정할 수 있습니다. 이 배양 모델에서 발달하는 전방의 여포는 배양 후 10-12일 이내에 감수분열 성숙을 완료할 수 있으며 hCG로 유발될 때 중기 II 난모세포를 배란시킬 수 있습니다. 이 논문은 또한 유리화(vitrification)에 의한 난소 여포 동결 보존에 대한 두 가지 접근 방식에 대해 설명합니다.
서문
인간의 체외 모낭형성은 체외 수정으로 첫 출산을 한 지 40년이 지난 지금까지도 여전히 과제로 남아 있습니다. 현재까지 건강한 아기를 낳을 수 있는 생존 가능한 배아의 생산을 지원하는 인간 난포 배양 방법론은 여전히 부족하다1. 인간의 체외 여포 성장에 필요한 최적의 물리적 특성은 아직 결정되지 않았습니다. 온전한 난소에는 다양한 발달 단계에 있는 수천 개의 난포가 채워져 있으며, 이의 성장을 조절하는 것은 복잡한 과정입니다(그림 1)2. 인간 전방여포의 생식 소포 단계(GV) 난모세포는 배양에서 30일 정도 걸리면 감수분열적으로 성숙하고 중기 II 단계3에 도달합니다. 간극연접(gap junction)을 통한 난모세포(난모세포)와 주변 과립층 세포 사이의 양방향 통신은 세포질과 핵 성숙에 매우 중요합니다 4,5,6.
기존의 2-D 배양 시스템은 특히 배양에 오랜 시간이 필요한 대형 포유류 모델에서 난포 배양에 적합하지 않습니다. 난포가 접시에 붙고, 과립층 세포가 멀어짐에 따라 과립층 세포와 난모세포 사이의 연결은 더욱 약해집니다. 따라서 난포에 대한 3차원(3-D) 배양 시스템은 생체 내 생리학을 보다 밀접하게 모방하는 수단으로 부상했습니다 7,8.
3차원 성장을 촉진하기 위해 매트릭스 내에 난포를 캡슐화하는 것은 체외 배양(IVC) 동안 여포 구조를 보존하기 위한 한 가지 접근 방식이었습니다. 천연 고분자(예: 콜라겐, 아가로스, 피브린, 알긴산, 히알루론산)와 합성 고분자(예: 폴리에틸렌 글리콜, 폴리비닐 알코올 및 폴리글리콜산)의 바이오 매트릭스가 테스트되었습니다 7,9,10,11,12,13. 바이오매트릭스의 기계적 특성은 영양소 확산, 척골 세포 분화, 전미 형성 및 호르몬 분비에 영향을 미치는 것으로 나타났습니다14. 세포의 자연적인 세포외 기질(ECM)의 일부인 콜라겐은 테스트된 최초의 매트릭스 중 하나이며 처음에는 15,16,17로 유망했습니다. 그러나 콜라겐 제제를 표준화하는 물류, 열악한 기계적 특성 및 안정성으로 인해 사용이 제한되었습니다18. 아가로스는 원시 여포뿐만 아니라 전방 여포에서 방출되는 적운-난모 복합체(COC)에 대해 테스트되었습니다19,20. 보다 최근에는 프린팅된 3D 아가로스 주형이 골격이 없는 여포 배양에 대한 가능성을 보여주었습니다21. 2003년에 처음 보고된 칼슘 알긴산 캡슐화는 현재까지 IVC22에 대해 가장 널리 연구된 시스템입니다. 그것은 쥐, 둔감한, 원숭이 뿐 아니라 인간적인 여포 23,24,25,26,27에 시험되었다. 칼슘 알긴산염을 사용하면 여포가 폴리머의 마이크로 방울에 단독으로 로드되고 염화칼슘에 노출되어 겔 비드를 생성합니다. 비드에서 난포를 추출하려면 킬레이트제로 처리해야 합니다. 그러나 이 매트릭스에는 몇 가지 단점이 있습니다. 알긴산은 조류에서 분리된 다당류이며, 지지력을 제공하기는 하지만 난포의 자연적인 세포외 기질의 일부는 아닙니다. 데이터는 알긴산염28에서 IVC 후 방추체 결함의 발생률이 더 높다는 것을 시사합니다. 나중에 알긴산과 피브린 또는 기타 세포외 기질 성분(ECM)을 결합하여 시스템을 수정하면 칼슘 알긴산 시스템을 보다 효과적으로 만드는 데 도움이 되었습니다29,30.
점점 더 많은 증거가 세포 외 기질이 세포 성장의 핵심 조절인자로 지적되고 있습니다 10,31,32 . 세포는 세포를 지원할 뿐만 아니라 세포 부착, 기능, 성장 및 의사 소통에 중요한 역할을 합니다. ECM의 주요 구성 요소 중 하나는 자연적으로 발생하는 글리코사미노글리칸인 히알루로난입니다. 난포에서 히알루론은 과립층 세포에 의해 생성되며 발달 중인 난포의 구조적 무결성과 기능에 기여합니다33,34. 따라서 히알루로난을 여포 배양 모델에 통합하면 보다 생리학적 환경을 조성하고 기능적으로 유능한 난모세포의 생산을 향상시키는 데 도움이 될 수 있습니다.
이 연구는 티라민 결합 히알루로난을 신선 및 냉동 난포 배양 및 난모세포(IVM)의 체외 성숙을 위한 바이오매트릭스로 새롭게 응용하는 것을 설명합니다. 또한 두 가지 유형의 장치에서 유리화(vitrification)에 의한 난포 동결 보존(follicle cryopreservation) 기술에 대해서도 자세히 설명합니다. 첫 번째 방법은 액체 질소에 직접 담그는 것이고 두 번째 방법은 담그기 전에 모낭을 빨대에 넣는 것입니다. 주요 목표는 차이점에도 불구하고 방법론과 장치 모두 여포 동결 보존에 안정적으로 사용될 수 있음을 보여주는 것입니다.
프로토콜
모든 동물 실험은 클리블랜드 클리닉의 기관 동물 사용 및 관리 프로토콜에 따라 수행되었으며 실험실 동물의 관리 및 사용에 대한 미국 국립보건원(National Institutes of Health)의 지침 및 규정에 따라 수행되었습니다.
1. 배지 준비
참고: 아래에 설명된 배지는 이 절차의 여러 단계, 즉 난소 조직(OT) 처리, OT 콜라겐분해효소 분해, 난포 배양(FCM) 및 유리화에 사용됩니다. 멸균 기술을 사용하여 조직 배양 후드에 모든 배지를 준비합니다.
- 난소 조직 취급 매체
- 50mL 조직 배양 플라스크(T-50)에 20mL의 Leibovitz's medium(L-15)에 0.1% 소 태아 혈청(FBS)을 추가합니다.
- 뚜껑을 단단히 닫고 플라스크를 인큐베이터에 밤새 넣어 사용하기 전에 37°C로 데웁니다. 이 배지는 인큐베이터 외부의 난소 조직 및 여포를 처리하는 데 사용되며 7.2에서 7.4의 pH를 유지하기 위해 CO2 가 필요하지 않습니다.
주의 : 접시를 CO2 가스에 노출시키지 마십시오. 그렇지 않으면 매체가 산성화됩니다.
- 콜라겐분해효소 소화액
- 난포 수확 아침에 1mg의 Type I 콜라겐 분해 효소 (295 U/mg)를 2.2 mL의 예열 OT 취급 배지와 함께 시험관에 첨가합니다. 원하는 콜라겐 분해 효소 농도는 134 U/mL이며 필터는 0.22 μm 주사기 필터를 사용하여 살균합니다. 뚜껑을 단단히 닫고 보온 블록에 넣으십시오.
- 난포 배양 배지 및 오일
- T-50 플라스크에 5% 소 태아 혈청이 보충된 최소 에센셜 미디엄 알파 30mL를 준비합니다. 100 mIU/mL FSH, 10 mIU/mL LH, 10 μg/mL 인슐린, 5 μg/mL 트랜스페린 및 5 ng/m 셀레늄을 보충하십시오.
- 37°C에서 6% CO2 로 FCM을 사전 평형화하고 사용하기 전에 인큐베이터에서 밤새 공기시킵니다.
- 플라스크에 미네랄 오일 50mL를 넣고 뚜껑을 느슨하게 닫고 인큐베이터에서 밤새 평형을 이룹니다.
- FL 및 FL-Cluster를 위한 유리화(Vitrification) 배지
- 모든 용액의 기초 배지는 20% 합성 단백질 대체물이 보충된 Global-Hepes입니다. 기초 배지에서 7.5% 에틸렌 글리콜(EG) 및 7.5% 디메틸 설폭사이드(DMSO)가 포함된 VS1 용액 20mL를 준비합니다.
- 기초 배지에서 15% EG, 15% DMSO 및 0.5M 자당이 포함된 20mL의 VS2를 준비합니다. 0.22μm 주사기 필터로 모든 용액을 멸균하고 사용할 때까지 4°C에서 보관하십시오. 솔루션은 최대 4주 동안 사용할 수 있습니다.
- 유리화된 여포와 FL-Cluster를 위한 보온 배지
- 모든 용액의 기초 배지는 20% 합성 단백질 대체물이 보충된 Global-Hepes입니다. 0.25M 자당이 함유된 20mL의 기초 배지를 준비합니다. 레이블을 WS1로 지정합니다.
- 0.125M 자당이 함유된 기저 배지 20mL를 준비하고 WS2로 표시합니다. 필터는 0.22μm 주사기 필터로 멸균합니다. 용액을 4°C에서 최대 4주 동안 보관하십시오.
2. 난소 수확
- 10-14일 된 B6D2F1 새끼를 경추 탈구(마취 없음)로 안락사시킵니다. 실험을 위해 3-4 마리의 새끼를 사용하여 250-300 개의 손상되지 않은 전엽 여포를 얻습니다.
- 동물을 등에 눕히고 70% 이소프로필 알코올로 배를 면봉으로 닦습니다. 깨끗한 가위를 사용하여 정중선을 작게 수평으로 자릅니다. 가느다란 집게로 절인 부위의 위아래 피부를 잡고 양방향(머리와 발 방향)으로 당겨 복부를 드러냅니다.
- 두 번째 깨끗한 가위와 가는 집게를 사용하여 복벽을 자릅니다. 장 코일을 들어 올립니다. 자궁 뿔, 난관 및 난소를 찾습니다. 난소를 절제하고 37°C로 예열된 1mL의 OT 취급 매체가 들어 있는 중앙 웰 접시에 넣습니다.
- 해부 현미경을 사용하여 지방과 산란 조직을 잘라냅니다. 난소를 이등분합니다.
3. 여포 및 FL-클러스터(FL-C) 분리
- 여포 분리 및 취급을 위해 37°C로 가열된 표면의 층류 후드를 사용하십시오. 후드에서 무균 상태로 작업하십시오. FCM 접시에 주의하십시오. 층류 후드에서 작업할 때 버블러를 사용하여 접시에 5% CO2 로 가스를 공급합니다.
알림: 모든 용액은 37°C로 예열해야 합니다. FCM 매체와 미네랄 오일은 사용하기 전에 37°C의 인큐베이터에서 6% CO2 로 밤새 사전 평형화해야 합니다. 중간 pH는 인큐베이터 밖에서 10분 이상 있을 때 변합니다. - 사전 평형화된 FCM을 6mL 파이펫으로 60mm 접시 2개에 넣고 미네랄 오일로 오버레이합니다. 인큐베이터에 다시 넣습니다.
- 중앙 웰 접시에 콜라겐분해효소 1mL를 피펫하고 외벽에 OT 배지 3mL를 피펫합니다. 유리 마이크로피펫(1000μm)을 사용하여 난소를 콜라겐분해효소 용액으로 이동합니다. 층류 후드의 가열된 표면에서 접시를 30-40분 동안 배양합니다.
- 콜라겐분해효소 배양이 끝나면 OT 배지 6mL를 1 및 2로 표시된 60mm 조직 배양 접시 2개에 피펫으로 주입합니다. 후드의 따뜻한 표면에 놓습니다.
- 마이크로피펫을 사용하여 콜라겐분해효소 처리된 난소를 바깥쪽으로 잘 옮겨 콜라겐분해효소를 제거하도록 헹굽니다. 마이크로피펫을 교체한 다음 난소를 OT 접시 1로 이동합니다.
- P200 피펫터를 사용하여 각 난소에서 난포를 채취합니다. 효소 처리된 난소를 다양한 크기로 절단된 피펫 팁을 통해 반복적으로 흡인하고 배출하여 난포를 방출합니다. 피펫팅 전에 2개의 27G 바늘로 조직을 조각으로 기계적으로 분리하는 것도 개별 난포를 방출하는 데 도움이 됩니다. 각 새끼 쥐는 원하는 크기의 60-75개의 온전한 여포를 생성해야 합니다.
- 필요한 경우, 해리되지 않은 난소 조각을 다시 콜라겐 분해 효소로 5-10분 더 넣고 헹구고 피펫팅을 반복하여 더 많은 난포를 방출합니다.
참고: 콜라겐분해효소에 과도하게 노출되면 난모세포를 둘러싼 과립층 세포층이 파괴됩니다. 난소 전체를 파괴하려고 하지 마십시오. 250-300개의 난포가 채취되면 중단합니다. - 박리 현미경을 사용하여 40x 배율로 방출된 난포를 검사합니다. 온전한 기저막(기저판) 내에 둘러싸인 중앙에 위치한 난모세포가 있는 2차 전전방 여포(~120 -140 μm 직경)를 확인합니다. 이 크기의 난포는 일반적으로 난자를 둘러싸고 있는 2-4개의 과립층 세포를 가지고 있습니다( 그림 1 참조).
참고: 175μm 마이크로피펫 팁의 개구부와 여포를 비교하여 대략적인 여포 크기를 측정합니다. 여포는 피펫 직경의 약 3/4 크기여야 합니다. 이것은 원하는 크기의 모낭을 선택하는 가장 빠른 방법입니다. - 175μm 마이크로피펫을 사용하여 선택한 난포를 OT2 접시로 이동합니다. 수집이 완료되면 FCM1 접시의 모든 난포를 헹구어 OT 배지의 흔적을 제거합니다. 그런 다음 FCM2 접시로 옮깁니다.
- 임베딩 프로세스를 시작하기 전에 접시를 인큐베이터에 60분 동안 놓습니다.
- 여포 클러스터 격리의 경우 3.1-3.5단계를 수행합니다. 투베르큘린 주사기 2개(27G)를 사용하여 난소를 조각으로 분리한 다음 6-10개의 난포로 구성된 작은 클러스터로 만듭니다.
참고: 여포 클러스터 배양(FL-C)은 개별 여포 배양의 대안입니다. 이 방법은 기질 구성 요소와 함께 고유한 여포 구조를 유지합니다. FL-C의 난포 크기는 균일하지 않습니다. 여포는 원시, 1차 및 2차 여포가 존재하는 생체 내 구성을 유지합니다. - 200μm 마이크로피펫을 사용하여 이러한 난포 클러스터(FL-C)를 OT2 접시에 수집합니다. 수집이 완료되면 모든 FL-C를 헹구고 FCM2로 옮겨 삽입을 기다립니다.
4. 여포 및 여포 클러스터 포함
- 활성 티라민 결합 히알루로난 하이드로겔(HA)의 10mg/mL 원액을 준비합니다. 티라민 치환 히알루론산 나트륨 분말 250mg을 양고추냉이 과산화효소(HRP; 10 IU/mL) 25mL를 인산염 완충 식염수에 재수화합니다. 용해가 완료되면 향후 실험을 위해 이 활성 HA 스톡의 500μL 분취액을 -4°C에서 보관합니다.
- 여포 실험의 경우, HA 원액을 해동하고 37°C로 가열된 전체 배지에서 3mg/mL의 농도로 희석합니다. 벤치 표면이 37°C로 가열된 층류 후드에서 모든 임베딩 단계를 수행합니다. 포매 및 후속 여포 배양을 위해 8개의 100μL 웰이 있는 60mm 접시를 사용합니다.
- FCM 접시에서 내장될 여포 또는 FL 클러스터를 HA 젤 한 방울로 이동하여 배양 배지를 무료로 헹굽니다. 추적 매체는 겔 형성을 방해합니다. FCM 접시를 버블러 아래에 다시 놓고 가스를 공급합니다.
참고: 고립된 여포는 실험에 따라 단독으로 또는 그룹으로 삽입될 수 있습니다. 우리는 일반적으로 구슬 당 2-4 개의 여포를 파종하는 것을 선호합니다. - 페트리 접시에 0.03% 과산화수소(H2O2) 1μL를 놓습니다. 25μL의 3mg/mL HA 겔을 과산화수소 방울에 추가하고 피펫팅으로 혼합하여 교차결합을 시작합니다( 그림 2 참조).
- P20 피펫터를 사용하여 HA-H2O2 혼합물을 추출하고 8웰 배양 접시의 두 개의 별도 웰에 한 방울(~8-10 μL)을 피펫으로 넣습니다. 거품을 만들지 마십시오.
- 200μm 마이크로피펫을 사용하여 난포 또는 FL-C를 각 방울의 중앙으로 빠르게 옮깁니다(그림 3). HA가 촉매(과산화물)에 노출되면 1-2분 이내에 겔화되기 시작하므로 속도가 중요합니다. 파종 중 거품이 생기지 않도록 주의하세요.
참고: 개별 난포 성장을 추적하려면 모낭을 서로 멀리 떨어진 곳에 배치하십시오. 난포를 젤 바닥에 너무 가깝게 두지 마십시오. 그렇지 않으면 IVC 중에 난포가 부착될 만큼 충분히 내려갈 수 있습니다. - 겔화 과정을 완료하기 위해 ~ 3 분을 기다린 다음 각 웰에 100 μL의 사전 평형 FCM을 첨가합니다. 이 과정을 반복하고 8개의 웰 모두에 모낭을 로드합니다. 따뜻한 사전 평형 미네랄 오일을 바르고 접시를 인큐베이터에 넣습니다.
5. 여포와 FL 송이의 유리화(Vitrification)
참고: 유리화는 개방형 캐리어(Cryoloop; CL), 액체 질소와 직접 접촉을 허용하거나 밀폐 캐리어(Rapid I; RI)에서 시료가 외부 빨대 내에 밀봉되어 있으므로 액체 질소와 접촉하지 않습니다. 그림 4 는 두 가지 유리화 시스템의 장치와 대조를 보여줍니다. 두 장치 모두에서 유리화(Vitrification)는 배아 동결 보존에 효과적인 것으로 나타났습니다35.
- 폐쇄형 캐리어 RI 유리화(vitrification)
- 가열된 블록에서 VS 용액의 2mL 부분 표본을 37°C로 예열합니다. 박리 현미경을 사용하여 층류 후드의 가열된 표면에서 모든 유리화 단계를 수행하여 여포와 담체를 시각화합니다.
- 절연 극저온 상자를 액체 질소(LN2)로 채웁니다. 장치의 외부 빨대를 상자 안의 고정 슬롯에 넣어 액체 질소에 부분적으로 담그도록 합니다. 적재 준비를 위해 페트리 접시 뚜껑을 가로질러 작은 구멍이 있는 내부 플라스틱 스틱을 놓습니다.
- VS1 두 방울을 상단 근처의 페트리 접시에 나란히 놓습니다. 200μm 마이크로피펫을 사용하여 첫 번째 방울에 두 개의 난포를 놓습니다. 헹구고 VS1의 두 번째 방울로 빠르게 이동합니다. 5분 동안 배양합니다. FL 클러스터를 유리화하는 경우 한 번에 하나의 클러스터를 처리합니다.
- 첫 번째 배양이 거의 완료되면 같은 접시에 VS2 3방울을 나란히 놓습니다. 그런 다음 60초 이내에 3개의 VS2 드롭을 통해 난포를 순차적으로 빠르게 이동하고 캐리어에 로드합니다. 한 방울에서 다른 방울로 배지를 추적하는 것을 피하기 위해 모낭으로 최소한의 액체를 끌어오도록 주의하십시오.
- 캐리어에 적재하려면 두 개의 난포를 집어 들고 플라스틱 스틱의 작은 구멍에 최소한의 액체로 넣으십시오. 구멍의 최종 유체 부피는 0.5μL< 미미합니다. 유체가 구멍에서 플라스틱 스틱으로 흘러내리는 과충진을 피하십시오.
- 미리 식힌 외부 빨대에 스틱을 떨어뜨립니다. 초음파 실러를 사용하여 빨대를 닫고 밀봉하십시오. 극저온에 부착된 잔에 빨대를 놓습니다. 같은 잔에 빨대를 최대 4개까지 넣을 수 있습니다.
- 지팡이를 플라스틱 보호 슬리브로 덮으십시오. 지팡이를 액체 질소 저장(LN2) 탱크에 넣습니다.
- 개방형 캐리어 CL 유리화
- VS 솔루션을 37°C로 예열합니다. 층류 후드의 가열된 표면에서 모든 유리화 단계를 수행합니다. 필요한 CL 오픈 캐리어의 수를 미리 준비합니다. 금속 CL 줄기를 자화 바이알 캡에 삽입하고 단단히 고정되고 있는지 확인합니다(필요한 경우 약간의 접착제 사용).
- 단열 크라이오박스에 액체 질소(LN2)를 채웁니다. LN2가 바이알 상단 아래에 오도록 극저온 용기를 고정하기 위해 극저온 상자에 랙을 놓습니다.
- 특수 자화 및 배출 바이알에 LN2를 채웁니다. 랙에 놓습니다. 6.1.3 - 6.1.5 단계에 설명된 대로 유리화 단계를 수행합니다. 유일한 차이점은 일반적으로 한 번에 5개의 난포를 처리한다는 것입니다. 다시 한 번, 떨어뜨릴 때마다 추적 유체를 최소화하도록 주의하십시오.
- 모낭을 로드하려면 금속 막대를 사용하여 부착된 마그네틱 캡으로 CL 오픈 캐리어를 잡습니다. CL 오픈 캐리어를 VS2 한 방울에 별도로 떨어뜨려 동결 보호제 필름을 만듭니다.
- 마이크로피펫을 사용하여 모든 난포 또는 FL-Cluster를 집어 최소한의 액체로 필름에 놓습니다. 필름이 마르기 시작하기 전에 난포를 로드해야 하므로 빠르게 작업하십시오.
- 즉시 CL을 LN2로 채워진 cryovial에 담그어 샘플을 유리화합니다. 뚜껑을 닫고 유리병을 cryocane에 놓습니다. 플라스틱 슬리브로 덮으십시오. 지팡이를 액체 질소 저장 탱크에 넣으십시오.
6. 유리화 여포와 FL 클러스터의 온난화
- RI 폐쇄형 캐리어 워밍업
- 외부 웰에 3mL의 사전 평형 FCM과 중앙 웰에 1mL가 있는 중앙 웰 디쉬를 준비합니다. 오일을 바르고 인큐베이터에 넣습니다.
- 예열된 WS1 및 WS2 0.5mL를 레이블이 지정된 두 개의 중앙 웰 접시에 넣습니다. 저장 탱크의 샘플이 담긴 지팡이를 LN2로 채워진 냉동 상자로 옮깁니다.
- 플라스틱 지팡이 덮개를 제거하십시오. 잔에서 빨대를 제거하고 담근 상태로 유지하고 냉동 상자의 고정 슬롯에 밀어 넣습니다.
- 가는 가위를 사용하여 난포가 있는 내부 RI 캐리어의 상단을 나타내는 검은색 점 바로 위에 있는 외부 빨대를 자릅니다.
- 가는 집게를 사용하여 내부 플라스틱 스틱을 외부 빨대에서 약간 들어 올립니다. 장치를 잡고 스틱을 WS1에 빠르게 담그고 부드럽게 소용돌이치면서 모낭을 방출합니다. 속도가 매우 중요합니다. 난포는 10초 이내에 WS1로 언로드되어야 합니다.
- 해부 현미경을 사용하여 난포를 시각화하고 모든 모낭이 캐리어에서 내려졌는지 확인합니다. WS1에서 2분 후 마이크로피펫을 사용하여 배지를 추적하지 않도록 주의하면서 모든 여포(또는 FL-Cluster)를 WS2로 이동합니다.
- 3분 후 FCM 접시의 바깥쪽 웰에서 난포를 헹구고 중앙 웰로 이동합니다. 삽입하기 전에 1-2시간 동안 인큐베이터에 다시 넣습니다.
- CL 오픈 캐리어 워밍
- 위에서 설명한 대로 FCM 및 WS 요리를 준비합니다. 저장 탱크에서 난포가 있는 지팡이를 LN2로 채워진 극저온 상자로 옮깁니다. 플라스틱 지팡이 덮개를 벗깁니다.
- 자기 봉을 사용하여 CL의 금속 줄기가 보일 때까지 극저온 캡을 들어 올립니다.
- 집게를 사용하여 금속 줄기를 잡습니다. 바이알에서 CL을 제거하고 WS 1에 매우 빠르게 담그고 부드럽게 소용돌이치면서 여포를 방출합니다. 10초 이내에 WS1로 언로드합니다. 해부 내시경을 사용하여 모든 여포가 언로드되었는지 확인합니다.
- 워밍을 위한 나머지 모든 단계는 7.1.6단계부터 시작하는 RI 폐쇄 캐리어 단계와 동일합니다.
7. 여포 및 FL 클러스터 이미징 및 미디어 변화
- 10-12일 배양 기간 동안 Hoffman contrast modulation optics가 장착된 도립 광 현미경을 사용하고 고화질 카메라를 장착하여 well의 여포 및 FL 클러스터를 모니터링합니다. 이미징 소프트웨어를 사용하여 크기에 따라 40배 및 총 배율 100배 또는 200배로 이미지를 캡처할 수 있습니다.
- 여포의 이미징 및 평가
- 배양 1일차에 임베딩 후 도립 현미경을 사용하여 40배 및 200배 배율로 모든 배양 웰을 이미지화하여 기준선 형태와 크기를 설정합니다. 접시를 인큐베이터에 다시 넣으십시오.
- 이미지를 보고 각 겔 비드에 완전히 삽입된 난포의 수를 기록합니다. FL-C의 경우 배양 시작 시 여포 수를 추정합니다.
- 이미징 소프트웨어를 사용하여 기저막의 가장자리에서 수직 및 수평 평면을 따라 여포 직경을 측정합니다. zona의 바깥쪽 가장자리에서 유사하게 난모세포 크기를 측정합니다. 평균값을 기록합니다. 클러스터 직경의 수직 및 수평 측정을 수행합니다.
- 2-3일마다 배양을 계속 이미지화합니다. 서로 접촉하지 않는 여포의 직경을 측정합니다. FL-C를 사용하면 IVC 중에 클러스터가 볼링되므로 전체 클러스터를 수직 및 수평 평면에서 측정할 수 있습니다.
참고: 서로 밀접하게 그룹화된 난포의 경우 배양 4일차 이후에는 개별 난포 경계를 식별하지 못할 수 있으므로 측정하지 않습니다. - 어둡거나 자가사멸하는 난포와 난모세포가 더 이상 과립층 세포로 둘러싸여 있지 않거나 돌출된 난포를 생존 불가능한 것으로 분류합니다. 접시 표면에 부착된 난포 또는 FL-C를 추적합니다( 그림 5 참조).
- 8일차부터 난포가 형성되는지 주의 깊게 관찰합니다. antrums가 있는 여포는 그 안에 빈 공간이나 더 밝은 공간이 있는 것처럼 보일 것입니다(그림 6).
- 2일마다 배양 배지를 절반 변경합니다. 50 μL로 설정된 P200 피펫터를 사용합니다. 팁을 오일 오버레이 아래 웰에 삽입하고 겔 비드에서 멀리 떨어뜨립니다. 배양 배지 50μL를 천천히 꺼냅니다. 오일 오버레이 아래에 50μL의 새 FCM을 천천히 피펫팅하여 배지를 교체합니다. 거품을 만들지 마십시오.
8. 캡슐화된 여포에서 난모세포의 성숙
참고: 최종 성숙 단계는 일반적으로 총 파종된(및 생존 가능한) 여포 중 개미 형성이 40% 이상에 도달할 때 시작됩니다. 그러나 antrum 형성이 낮거나 보이지 않는 경우 배양 12일차까지 트리거링하는 것이 좋습니다. 우리는 더 이상 기다리는 것이 유익하지 않다는 것을 관찰했습니다. FL-C 배양의 경우, 일반적으로 웰의 40%에서 또는 늦어도 12일째까지 앤트럼이 관찰될 때 성숙이 시작됩니다.
- FCM에 1.5IU/mL의 인간 융모성 성선 자극 호르몬(hCG)과 5ng/mL의 표피 성장 인자(EGF)를 보충하여 체외 성숙 배지(IVM)를 준비합니다.
- 오후 5시경에 각 웰의 FCM을 100μL의 IVM 배지로 교체하여 성숙을 트리거합니다. 하룻밤 숙성 후(방아쇠 후 16-18시간), 40배 배율에서 해부 현미경을 사용하여 HA 겔 비드에서 배란된 적운-난모세포 복합체(COC)에 대해 각 배양 웰을 검사합니다. COC는 일반적으로 겔 비드 바로 위에 있거나 그렇지 않으면 매우 가까운 곳에 있습니다.
- 배란된 COC를 오일로 오버레이한 1mL의 사전 평형 FCM이 있는 중앙 웰 접시에 모으고 접시를 다시 인큐베이터에 넣습니다.
- P200 피펫터를 사용하여 HA-bead를 부드럽게 피펫팅하여 비배란 COC를 방출하여 아직 박혀 있는 난포에서 난모세포를 수집합니다. FCM과 함께 별도의 접시에 모으십시오.
- 외벽에 히알루로니다아제 1mL(10IU/mL)와 FCM 배지 3mL가 있는 센터 웰 디쉬를 준비합니다.
- 배란된 COC를 히알루로니다아제 용액으로 옮기고 효소에 잠시 노출시켜(30-45초) 과립층 세포의 난모세포를 탈락시켜 난모세포 핵 상태를 시각화합니다. 자세한 평가를 위해 오일 아래에 5μL의 신선한 배지 방울을 넣기 전에 난모세포를 헹구어 효소를 제거합니다. 접시를 인큐베이터에 넣으십시오. 배란되지 않은 COC에 대해 이 과정을 반복합니다.
- 회수된 배란 난자와 배란되지 않은 난자의 총 수를 기록합니다. 회수된 각 난모세포의 핵 상태(GV, metaphase I 또는 metaphase II)를 촬영하고 평가합니다. 직경을 측정하고 기록합니다.
- 총 생존 가능한 난포(hCG가 유발된 날까지 생성된 난자)와 회수된 총 난자를 기반으로 IVC 생존율을 계산합니다. 배란된 COC에서 metaphase II 난모세포의 비율을 계산합니다. 배란되지 않은 COC에서 회수된 모든 난모세포에 대해 이 작업을 반복합니다.
- FL-C와 동일한 방식으로 II중기로의 성숙 속도를 측정합니다.
결과
이 논문은 마우스 전전 여포의 체외 배양을 위해 새로운 티라민 결합 히알루로난 젤을 사용하는 방법론을 자세히 설명합니다36,37. 그림 6은 기존 2-D 배양 시스템에 배치했을 때와 3-D 배양을 위해 HA 겔로 캡슐화된 단일 여포의 차이를 보여줍니다. 토착 여포 건축은 12일의 문화 기간 동안 유지되며, 성장의 마지막 날에 분명히 볼 수 있는 전개막이 있습니다.
HA 젤은 아주 다재다능하, 고립된 여포의 성장을 단독으로 또는 그룹으로 허용하고 또한 난소 조직은 기계적으로 여포의 작은 송이로 끊어집니다. 젤은 투명하여 깊이가 다르더라도 난포를 시각화할 수 있습니다. 캡슐화된 여포와 FL-C는 지속적인 과립층 세포 증식으로 인해 방사상 확장을 나타냅니다(그림 7). 초기 난포 직경은 평균 139.8 ± 28 μm이며 GV 난모 세포 직경은 63.5 ± 4.6 μm입니다. 단독으로 배양된 여포에서 최종 직경은 약 385.6 ± 36.7 μm로 측정되며, 이는 크기가 약 3배 증가합니다. 배란 중기 II 난모세포는 약 84.8 ± 3.8 μm를 측정합니다. 배양된 FL 클러스터 내에서 여포 크기는 상당히 다양합니다(그림 5, 그림 7). hCG 유발 후 배란된 난모세포는 여포 근처에서 발견됩니다(그림 8). 중기 II기 난모세포의 대부분은 배란된 COC에서 회수됩니다. 방아쇠 후에도 여전히 박혀 있는 난포는 일반적으로 GV와 중기 I 난모세포를 포함합니다.
표 1 은 신선 난소 또는 냉동 난소에서 분리된 난포와 FL 클러스터 간의 성숙 속도를 대조합니다. 동결 보존된 난소의 FL-C는 성숙 속도가 현저히 낮았습니다. 현미경 관찰에 따르면 그들은 자주 기저판이 부러져 조기 난모세포 압출에 매우 취약한 것으로 나타났습니다. 난포 군집의 연약한 특성은 캡슐화에 의해 다소 상쇄되었습니다. 동결 보존된 난소에 대한 콜라겐분해효소 처리는 생존율이 낮고 온전한 난포의 수율이 낮아 특히 손상되기 때문에 피했습니다.
분리된 난포의 동결 보존은 전체 난소 보존보다 훨씬 더 효과적입니다. 조사된 두 가지 유리화 방법을 모두 사용하여 높은 성숙 속도를 달성할 수 있습니다(표 2). 냉각 속도의 큰 차이에도 불구하고 IVC 후 난모세포 성숙은 차이가 없었습니다. CL 오픈 캐리어는 단일 CL 오픈 캐리어에 최대 10개의 난포를 적재할 수 있으므로 더 많은 효율성을 허용합니다. 이는 또한 여러 동결 보존된 여포를 복구하는 데 걸리는 전체 시간을 단축합니다. 그러나, 인간 여포에 대한 유리화의 궁극적인 임상적 적용의 경우, 폐쇄형 밀봉 시스템이 선호될 수 있습니다.
GV 난모세포의 핵소체(nucleolus) 주위의 염색질 배열은 배란 후 수정되어 배반포로 발달할 가능성이 가장 높은 난모세포를 식별하는 데 사용할 수 있습니다38. 그림 9 는 염색질 분포 패턴을 시각화하기 위해 난모세포의 살아있는 염색을 보여줍니다.
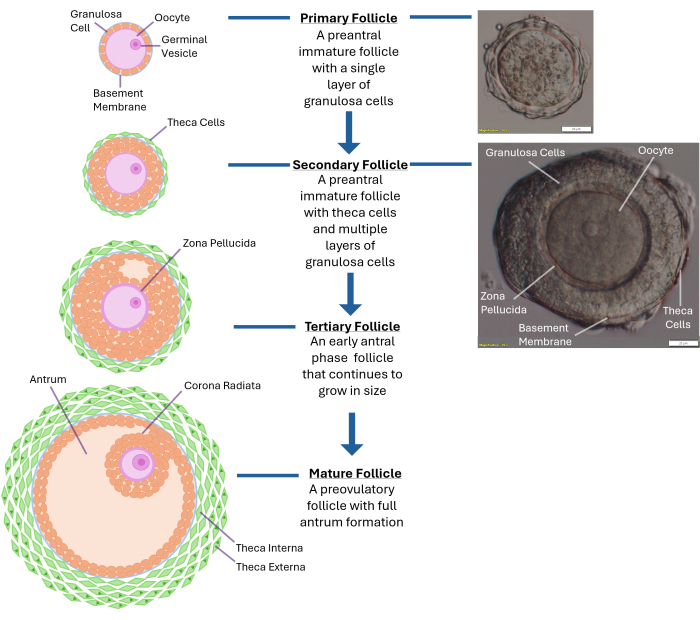
그림 1: 난포 성장의 개략도. 이 다이어그램은 1차 여포에서 2차 전방기, 그리고 마지막으로 배란이 준비된 완전히 성숙한 3차 난포에 이르기까지 여포 발달의 여러 단계를 보여줍니다. 전형적인 전방(preantral follicle)의 현미경 이미지도 다양한 형태학적 특징과 함께 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
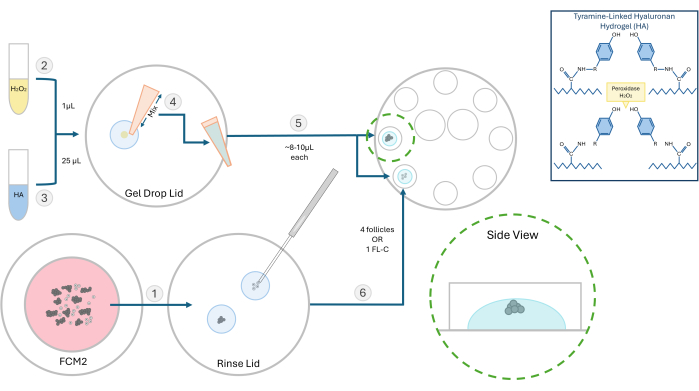
그림 2: HA 캡슐화 방법의 개략도. 히알루로난 겔의 구조와 난포 포매를 위한 다양한 단계가 이 다이어그램에 설명되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
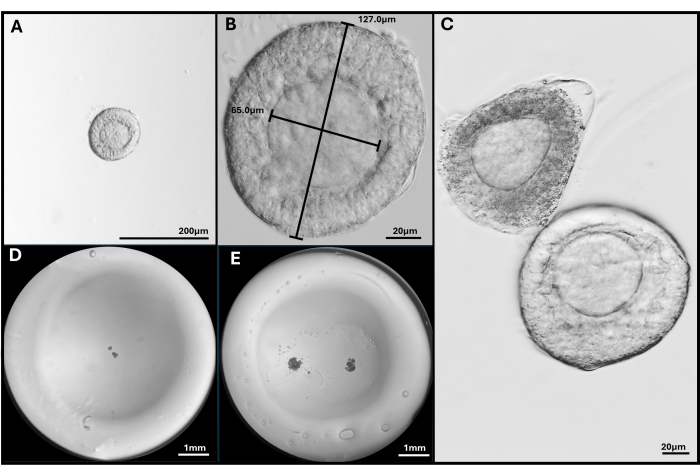
그림 3: 난포 분리 및 캡슐화. (A, B) 40배 및 200배 확대에서 포매를 위해 선택된 전전여포. (C) 자가사멸 여포는 난모세포가 중심이 아닌 건강한 전전여포로 표시됩니다. (D) 여포와 (E) 2개의 FL-C가 파종된 HA 겔 비드의 이미지. 전체 젤 비드를 보여주기 위해 실체 현미경으로 촬영한 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 분리된 여포의 동결 보존을 위한 유리화(Vitrification) 장치. CL 개방형 캐리어 장치를 사용하면 유리화(vitrification) 단계가 난포를 액체 질소에 직접 담그는 방식으로 수행됩니다. 따라서 냉각 속도는 -20,000°C/min 이상으로 매우 높습니다. 대조적으로, RI 폐쇄형 캐리어를 사용하면 내부 플라스틱 스틱에 난포가 적재되어 액체 질소에 잠긴 외부 빨대에 떨어집니다. 이 폐쇄형 유리화(vitrification) 방법은 액체 질소와의 직접적인 접촉을 방지합니다. 그러나 냉각 속도는 -1220°C/min에서 현저히 낮습니다. 두 보인자 중 하나에서 난포를 적재하고 회복하는 것은 쉽습니다. CL 개방형 캐리어는 장치당 최대 10개의 난포를 적재할 수 있는 반면, RI 폐쇄형 캐리어는 2개에 불과했습니다. 이 수치는35에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
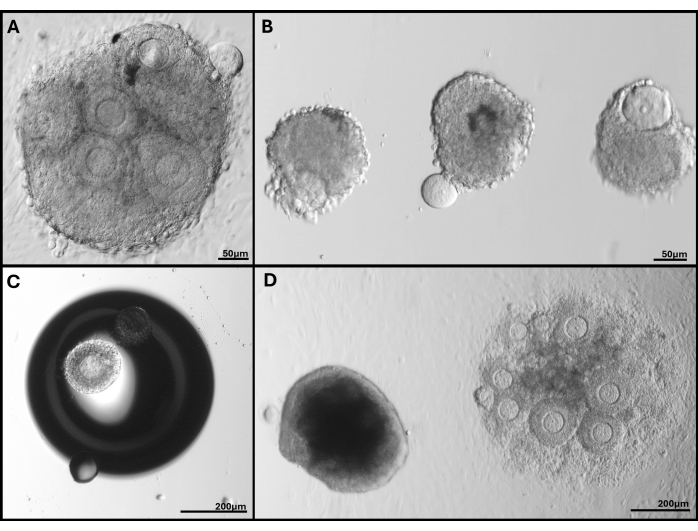
그림 5: 발생한 문제의 대표 이미지. (A) 난모세포가 압출되는 난포 클러스터. (B) 부러진 기저 층막이 있는 고립된 여포와 돌출된 난모세포가 있는 여포. (C) 젤의 거품 아래에 끼워진 여포. (D) 젤에 남아 있는 난포 클러스터(왼쪽)와 너무 깊게 박혀 결국 접시에 부착된 클러스터와 비교. FL-C의 다양한 난포 크기가 명확하게 보입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
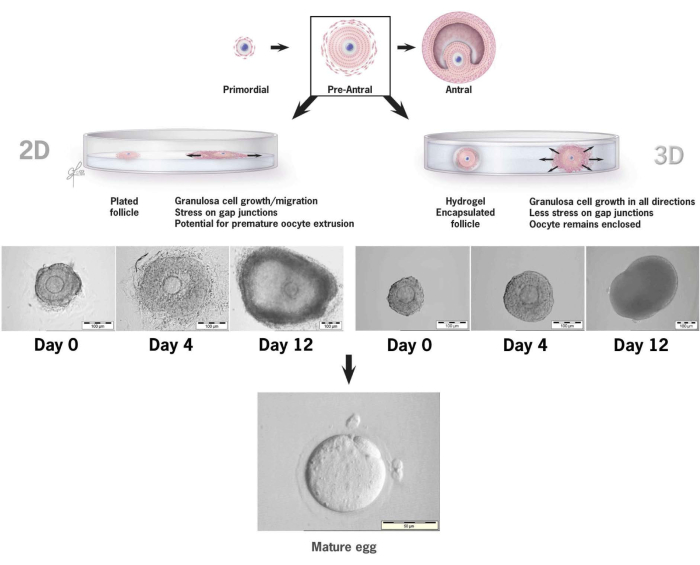
그림 6: HA에서 2-D 대 3-D 배양 컨벤션의 난포 성장 비교. 2-D 성장의 경우, 4일차까지 난포가 편평해지고 조직 배양 접시에 과립층 세포가 부착되는 것이 관찰되었으며, 이로 인해 난모세포는 과립층 세포 이동, 간극 연접 파괴 및 조기 난모세포 압출에 취약해졌습니다. HA-캡슐화된 여포는 배양 간격 동안 부착되지 않은 상태로 유지되었습니다. 과립층 세포 확장은 모든 방향에서 발생하여 난모세포를 감싸고 3D 구조를 유지했습니다. 이 수치는36에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 티라민 결합 히알루로난 겔에 캡슐화된 난포의 대표 이미지. (A) 1일차에 신선한 난소의 콜라겐분해효소 분해 후 수집된 전방난포. (B) 배양 1일차 및 (C) 4일차에 이미지화된 4개의 전방(preantral follicle)이 파종된 젤 드롭, (D) 2일차에 신선한 난소에서 추출한 난포 클러스터, (E) 6일차, (F) 배양 9일차에 이미지화. (G) 유리화된 전체 난소에서 기계적으로 절개된 난포 클러스터, 배양 2일차 및 (H) 배양 6일차에 나타남. (I) antrum 형성이 있는 난포는 배양 9일차에 명확하게 볼 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
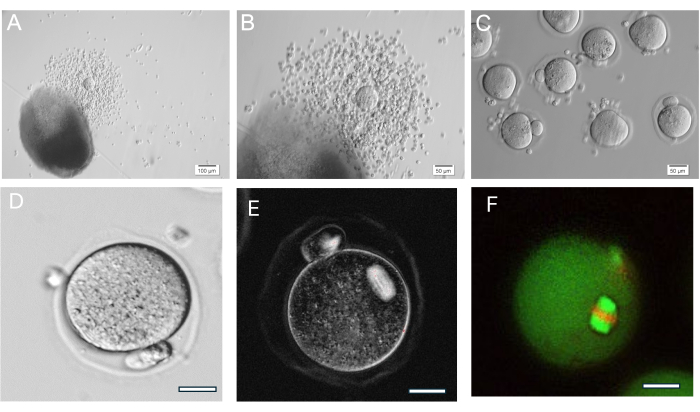
그림 8: 난모세포 배란. (A, B) 배란된 적운-난모세포 복합체(COC)가 다음에 나타난 HA-gel bead. (C) 주변 적운 세포를 제거하기 위해 히알루로니다아제(hyaluronidase)로 COC를 효소 처리한 후 난모세포를 이미지화했습니다. 수많은 중기 II 난모세포. (D) 두드러진 극체를 가진 중기 II 난모세포. 배율 400x. (E)37에 설명된 대로 감수분열 방추체를 시각화하고 조직을 평가하기 위해 편광과 이미징 시스템을 사용한 중기 II 난모세포의 라이브 이미징. 배율 400x. 수직 복굴절 스핀들이 보입니다. (F) 감수분열 방추체 조직을 시각화하기 위해 anti-alpha/beta-tubulin 및 propidium iodide로 고정 및 염색된 중기 II 난모세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
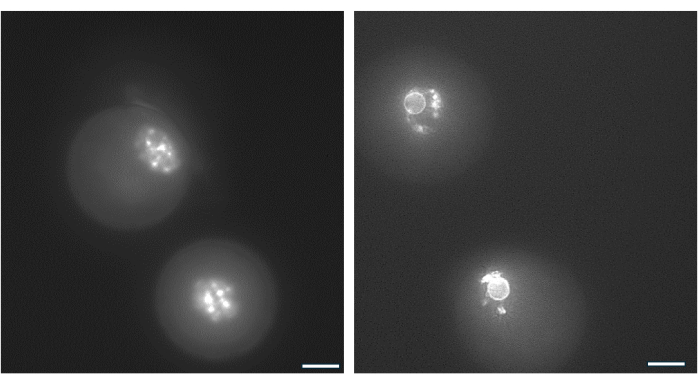
그림 9: GV 난모세포의 염색질 재조직. antrum 형성 후 GV 난모세포의 염색질 배열을 Hoechst 33342(50ng/mL)로 DNA를 염색하여 검사했습니다. 대표적인 난포는 부드러운 피펫팅을 통해 HA beads에서 채취했습니다. 과립층 세포는 히알루로니다아제를 사용하여 제거하였다. 그런 다음 GV 난모세포를 15분 동안 염색했습니다(Monti et al.38의 프로토콜 참조). 이미지는 40배 확대하여 촬영되었습니다. (A) 배양 시작 시 1일차에 나타난 GV 난모세포는 비주위 염색질(NSN) 염색 패턴을 나타냅니다. (B) hCG 유발 당일에 나타난 antrum과 함께 성장하는 여포에서 나온 GV 난모세포. 염색질은 응축되어 핵소체 주위에 핵주위 고리를 형성했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 매개 변수 | 신선한 난소 | 얼어붙은 난소 | |
| FL 절연 | FL 클러스터 | FL 클러스터 | |
| IVC 중 관찰된 난포 | 130 | 154 | 69 |
| HCG (%) 후에 배란 | 71% | 66% | 93% |
| (92/130) | (101/154) | (64/69) | |
| GVBD (%) | 30% | 28% | 52% |
| (28/92) | (28/101) | (33/64) | |
| MII 난모세포 형성(%) | 59% | 55% | *34% |
| (54//92) | (56/101) | (22/64) | |
표 1: 신선 난소와 유리화된 난소에서 HA가 포매된 난포의 결과. 신선한 난소의 난포 및 FL-C는 HA 겔에 캡슐화된 후 시험관 에서 숙성되었습니다. HA 겔은 또한 EG/DMSO 프로토콜39를 사용하여 유리화한 난소의 난포에 대해 테스트되었습니다. 신선한 난소의 경우, 콜라겐분해효소 소화 후 개별 난포(FL)와 여포 클러스터(FL-C)를 모두 수집했습니다. 유리화된 난소의 경우, 콜라겐분해효소에 노출되면 실제로 난포가 손상되었습니다. 동결 보존된 난소를 사용하는 가장 좋은 방법은 개별 난포가 아닌 FL 클러스터를 분리하고 바늘을 사용한 기계적 절제만 사용하는 것이었습니다. 이 표는 4-6개의 그룹으로 난포가 파종된 HA 비드와 6-10개의 여포를 포함하는 단일 FL-C가 있는 비드 간의 결과를 대조합니다. *동결보존된 난소에서 FL-C의 성숙률은 유의하게 낮았다(p=0.008; 유의성을 검정하기 위한 카이제곱 분석).
| 항공모함 | RI | 씨엘 |
| (종료) | (오픈) | |
| 생존율 (%) | 100% (24/24) | 100% (41/41) |
| 앤트럼 형성* (%) | 25.0% (6/24) | 75.6% (31/41)* |
| 배란률(%) | 66.7% (16/24) | 87.8% (36/41) |
| 성숙률(% MII) | 81.3% (13/16) | 69.4% (25/36) |
표 2: 두 개의 서로 다른 유리화 장치에서 분리된 난포를 동결 보존한 후의 결과. 높은 성숙률은 개방형 CL 장치와 폐쇄형 RI 캐리어 모두에서 달성되었으며 냉각 속도가 더 낮았습니다. 앤트럼 형성은 유의미한 것으로 관찰된 유일한 결과 측정이었지만 전체 성숙률에는 영향을 미치지 않았다(p < 0.05; 유의성을 검정하기 위한 카이제곱 분석).
토론
티라민 결합 HA 하이드로겔의 기계적 특성과 생분해성을 제어하는 능력은 조직 공학 응용 분야에 많은 이점을 제공합니다. 우리 실험실은 난포 성장을 위해 이 특정 HA 젤을 적용하는 최초입니다. 이 특허받은 티라민 치환 히알루론산 나트륨 겔(TS-NAHY)은 클리블랜드 클리닉에서 개발한 새로운 히알루로난 기반 하이드로겔 시스템입니다. 겔의 가교는 활성화된 겔 혼합물 내의 과산화효소(peroxidase)가 산화제에 노출됨으로써 구동됩니다. 이것은 시험관 내 또는 생체 내에서 모두 수행 할 수 있습니다. 형성된 TS-NAHY 하이드로겔은 겔40의 농도에 따라 약한 겔, 페이스트에서 깨지기 쉬운 고체에 이르기까지 광범위한 특성을 나타냅니다.
난포 배양에 대한 실망스러운 진전은 새로운 배양 모델을 설계해야 할 필요성을 강조합니다. 전적으로 천연 세포외 기질 성분만을 기반으로 하는 배양 시스템을 만드는 것이 더 유리한 접근 방식일 수 있습니다. 설명된 HA 배양 모델은 추가 ECM 구성 요소가 필요하지 않은 생리학적 방식으로 쉽게 사용할 수 있습니다. 젤은 투명하여 모낭을 자세히 시각화할 수 있습니다. HA 겔의 점탄성 특성은 강성과 성형성의 조정을 용이하게 합니다. 이 기능은 이 바이오매트릭스의 다양성을 증가시킵니다. 바이오매트릭스의 강성은 과립층 세포 증식 및 전복 형성에 영향을 미칠 수 있습니다 30,41,42. antrum 형성에 허용되는 배양 환경에서 유래한 여포는 비지지적 배양 시스템(non-supportive culture system)의 여포와 다른 유전자 발현 프로파일을 갖는 것으로 보고되었습니다43. 영장류 여포는 더 단단한 기질44를 필요로 하는 것으로 보인다. 인간을 포함한 다양한 동물 종의 요구 사항을 충족하도록 바이오매트릭스를 조정하는 것은 성공적인 체외 성숙을 위해 중요할 것입니다.
생쥐 전방(preantral follicle) 성장의 경우, 2-5 mg/mL36 범위의 겔 농도를 테스트했습니다. 난모세포 성숙률은 44%에서 58% 사이였습니다. HA 겔의 농도가 높을수록 3D 구조의 성형성과 유지율이 높아졌지만 여포 확장이 영향을 받았습니다. HA 농도가 낮을수록 여포의 방사상 확장이 더 많아졌지만, IVC가 끝나기 전에 난포가 자발적으로 돌출될 위험이 높아졌습니다. 3-3.5 mg/mL 농도의 HA는 쥐 전방여포에 가장 효과적이었습니다. IVC 전반에 걸쳐 여포를 3D 구성으로 유지하기에 충분한 깊이를 가진 HA 겔 비드를 형성하는 데 겔 방울을 작게 유지하는 것이 필수적이었습니다. 더 큰 방울은 평평해져서 겔을 통해 난포가 하강하고 플레이트 표면에 부착됩니다. 포매를 위한 이 생체 재료 사용의 한 가지 한계는 겔화 시간이 매우 빠르다는 것입니다. 한 번에 두 개 이상의 HA 겔 비드를 파종하는 것이 어렵습니다. HA 겔에 난포 파종의 효율성을 높이는 것은 우리가 개선하려고 하는 영역 중 하나입니다.
HA를 사용한 3차원 환경에서 여포 군집의 배양은 큰 잠재력을 가지고 있습니다. 정상적인 난소 구조는 유지되며 다양한 크기의 난포가 서로 접촉하고 지지하는 기질이 있습니다. LH는 조기 분화 대포세포의 변화를 유도하여 FL-C에서 더 작은 전방여포의 성장을 도울 수 있으므로 FCM 배지45에 포함되었습니다. hCG 유발 요인 이후에도 여전히 박혀 있는 작은 여포에서 새로운 성장의 물결이 시작될 수 있는지 확인하기 위해 12일 이상 FL-C 배양을 계속하는 것은 추가 연구가 필요합니다. 배양 환경의 추가적인 최적화는 조직 단편에서 서로 다른 크기 범위의 난포를 배양하기 위한 전제 조건이 될 수 있습니다. FL-C를 사용한 이 3-D HA 배양 모델의 장점은 생체 내 여포 배열 및 상호 작용을 밀접하게 모방할 수 있다는 것입니다. 또 다른 중요한 특성은 칼슘 알긴산염 및 기타 고분자 시스템과 달리 조직이나 겔 매트릭스에서 여포를 물리적으로 제거하지 않고도 배란과 성숙을 유도할 수 있다는 것입니다.
체외 난포 배양과 동결을 위한 성숙한 난모세포를 얻는 데 필요한 시간은 특히 대형 포유류에서 길다. 수확된 여포 또는 여포 클러스터를 동결 보존할 수 있는 능력은 나중에, 그리고 아마도 더 유리한 시간까지 이 단계를 지연시킬 수 있는 방법을 제시합니다. 이러한 기술이 언젠가 난소 적출 시 인간의 난포에 적용될 수 있다면 유익할 수 있습니다. 가임력 보존을 위한 전체 난소 동결 보존은 현재 환자를 위한 유일한 옵션입니다. 그러나 그것이 실제로 최선의 방법인지는 아직 결정되지 않았습니다. 본 논문에서는 3D 배양 후 온난화 후 생존율과 성숙률이 우수한 전방여포 동결보존을 위한 유리화(vitrification) 방법론을 제시합니다.
결론적으로, 우리는 네이티브 ECM의 구성 요소인 히알루로난을 사용하여 새로운 3D 배양 모델을 설명했습니다. HA 캡슐화 기법은 발달 중인 여포에 근접한 영양 인자의 보유를 가능하게 합니다. 바이오매트릭스에서 캡슐화하는 방법론은 간단하며 분리된 여포와 여포 클러스터를 수용할 수 있습니다. 후자는 연구의 새로운 길을 열고 모낭형성의 기본 생물학과 그 조절에 대한 통찰력을 제공할 수 있습니다. HA로 캡슐화된 난포에서 추출한 난모세포는 기능적으로 유능한 것으로 나타났습니다37. 이러한 난모세포는 수정될 수 있고, 체외에서 배반포를 형성할 수 있으며, 유사 임신 마우스로 이식될 수 있습니다. 이러한 데이터는 티라민 결합 히알루론을 3D 난포 배양 및 체외 난모세포 성숙을 위한 바이오매트릭스로 사용하는 것을 검증합니다. 이 프로토콜은 인간을 포함한 다른 동물 모델의 난포 배양에 잠재적으로 적용될 수 있습니다. 이 3-D HA 겔 시스템의 다른 가능한 응용 분야는 배아체 및 오가노이드 배양일 수 있습니다.
공개
이해 상충 또는 공개가 없습니다.
감사의 말
도움을 주신 Cleveland Clinic의 배아학 팀 전체와 REI 부서, 특히 Falcone 박사님께 감사드립니다. 이 프로젝트는 클리블랜드 클리닉(Cleveland Clinic)의 연구 기금을 통해 자금을 지원받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Anti-alpha tubulin-FITC labelled | Sigma-Aldrich | F2168 | |
| Anti-beta tubulin-FITC labelled | Sigma-Aldrich | F2043 | |
| BZ-X700 | Keyence | ||
| Center well dish | Fisher Scientific | 08-772-12 | |
| Collagenase Type I | Worthington Biochemical Corporation | LS004196 | |
| Crycap vial-vented | Hampton Research | HR4-904 | |
| Cryoloop | Hampton Research | HR4-974 | |
| Crystal cap | Hampton Research | HR4-733 | |
| Culture dish 60mm | Fisher Scientific | 08-772B | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Epidermal growth factor (EGF) | R &D Systems | 236-EG | |
| Ethylene Glycol (EG) | Sigma-Aldrich | 293237 | |
| Fetal Bovine Serum-Heat Inactivated | ThermoFisher Scientific | 10082-147 | |
| Follicle Stimulating Hormone (FSH) | Sigma-Aldrich | F4021 | |
| Global-Hepes medium | CooperSurgical | LGGH-100 | |
| Hoechst 33342 | Sigma-Aldrich | B2261 | |
| Human chorionic gonadotrophin (hCG) | Sigma-Aldrich | CG10 | |
| Human serum albumin | CooperSurgical | GHSA-125 | |
| Hyaluronidase | CooperSurgical | ART-4007-A | |
| Hydrogen Peroxide | CVS Pharmacy Inc. | 372441 | |
| Insulin-transferrin-selenium (ITS) | ThermoFisher Scientific | 41400-045 | |
| Leibovitz medium (L-15) | ThermoFisher Scientific | 11415-064 | |
| Luteinizing hormone | Sigma-Aldrich | L9773 | |
| Magnetic wand | Hampton Research | HR4-729 | |
| Micropipettes (1000 µm) | Minitube | 19025/0050 | |
| Micropipettes (175 , 200, and 275µm) | CooperSurgical | MXL3-175, MXL3-200, MXL3-275 | |
| Millex GV filter 0.22 µm | Millipore | SLGU033RS | |
| Mineral oil | CooperSurgical | LGOL-500 | |
| Minimum Essential Medium alpha (MEM) | ThermoFisher Scientific | 32561-037 | |
| Oocyte Imaging System-Spindleview | Hamilton Thorne | ||
| Phosphate buffered saline (PBS) | ThermoFisher Scientific | 10010-023 | |
| Propidium iodide | Sigma-Aldrich | P4170 | |
| Rapid i | VitroLife | 14406 | |
| SmartBox | VitroLife | 14423 | |
| Synthetic Protein Substitute (SPS) | CooperSurgical | ART-3011 | |
| Tyramine -linked Hyaluronan Biohydrogel Kit | LifeCore | ENG-00151 | |
| Ultrasonic sealer | VitroLife | 14415 | |
| Universal GPS Culture dish 8x 100 µl wells | CooperSurgical | UGPS-010 |
참고문헌
- Telfer, E. E., Andersen, C. Y. In vitro growth and maturation of primordial follicles and immature oocytes. Fertil Steril. 115 (5), 1116-1125 (2021).
- Telfer, E. E., McLaughlin, M. Natural history of the mammalian oocyte. Reprod Biomed Online. 15 (3), 288-295 (2007).
- Xiao, S., et al. In vitro follicle growth supports human oocyte meiotic maturation. Sci Rep. 5, 17323 (2015).
- Carabatsos, M. J., Sellitto, C., Goodenough, D. A., Albertini, D. F. Oocyte-granulosa cell heterologous gap junctions are required for the coordination of nuclear and cytoplasmic meiotic competence. Dev Biol. 226 (2), 167-179 (2000).
- Diaz, F. J., Wigglesworth, K., Eppig, J. J. Oocytes are required for the preantral granulosa cell to cumulus cell transition in mice. Dev Biol. 305 (1), 300-311 (2007).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biol Reprod. 73 (2), 351-357 (2005).
- Dadashzadeh, A., Moghassemi, S., Shavandi, A., Amorim, C. A. A review on biomaterials for ovarian tissue engineering. Acta Biomater. 135, 48-63 (2021).
- Simon, L. E., Kumar, T. R., Duncan, F. E. In vitro ovarian follicle growth: a comprehensive analysis of key protocol variablesdagger. Biol Reprod. 103 (3), 455-470 (2020).
- Belli, M., et al. Towards a 3D culture of mouse ovarian follicles. Int J Dev Biol. 56 (10-12), 931-937 (2012).
- Berkholtz, C. B., Shea, L. D., Woodruff, T. K. Extracellular matrix functions in follicle maturation. Semin Reprod Med. 24 (4), 262-269 (2006).
- Desai, N., et al. Three-dimensional in vitro follicle growth: overview of culture models, biomaterials, design parameters and future directions. Reprod Biol Endocrinol. 8, 119 (2010).
- Shea, L. D., Woodruff, T. K., Shikanov, A. Bioengineering the ovarian follicle microenvironment. Annu Rev Biomed Eng. 16, 29-52 (2014).
- Paulini, F., et al. Survival and growth of human preantral follicles after cryopreservation of ovarian tissue, follicle isolation and short-term xenografting. Reprod Biomed Online. 33 (3), 425-432 (2016).
- West, E. R., Xu, M., Woodruff, T. K., Shea, L. D. Physical properties of alginate hydrogels and their effects on in vitro follicle development. Biomaterials. 28 (30), 4439-4448 (2007).
- Joo, S., et al. The effect of collagen hydrogel on 3D culture of ovarian follicles. Biomed Mater. 11 (6), 065009 (2016).
- Telfer, E., Torrance, C., Gosden, R. G. Morphological study of cultured preantral ovarian follicles of mice after transplantation under the kidney capsule. J Reprod Fertil. 89 (2), 565-571 (1990).
- Torrance, C., Telfer, E., Gosden, R. G. Quantitative study of the development of isolated mouse pre-antral follicles in collagen gel culture. J Reprod Fertil. 87 (1), 367-374 (1989).
- Dong, C., Yonggang, L. V. Application of collagen scaffold in tissue engineering: recent advances and new perspectives. Polymers. 8 (2), 42 (2016).
- Le, B. A. M., et al. Agarose-based 3D culture improved the developmental competence of oocyte-granulosa complex isolated from porcine preantral follicle. Theriogenology. 223, 11-21 (2024).
- Park, J. E., et al. In vitro maturation on an agarose matrix improves the developmental competence of porcine oocytes. Theriogenology. 157, 7-17 (2020).
- Zaniker, E. J., et al. Three-dimensionally printed agarose Micromold supports scaffold-free mouse ex vivo follicle growth, ovulation, and luteinization. Bioengineering. 11 (7), 719 (2024).
- Pangas, S. A., Saudye, H., Shea, L. D., Woodruff, T. K. Novel approach for the three-dimensional culture of granulosa cell-oocyte complexes. Tissue Eng. 9 (5), 1013-1021 (2003).
- West, E. R., Shea, L. D., Woodruff, T. K. Engineering the follicle microenvironment. Semin Reprod Med. 25 (4), 287-299 (2007).
- Xu, J., et al. Survival, growth, and maturation of secondary follicles from prepubertal, young, and older adult rhesus monkeys during encapsulated three-dimensional culture: effects of gonadotropins and insulin. Reproduction. 140 (5), 685-697 (2010).
- Xu, M., Kreeger, P. K., Shea, L. D., Woodruff, T. K. Tissue-engineered follicles produce live, fertile offspring. Tissue Eng. 12 (10), 2739-2746 (2006).
- Amorim, C. A., Van Langendonckt, A., David, A., Dolmans, M. M., Donnez, J. Survival of human pre-antral follicles after cryopreservation of ovarian tissue, follicular isolation and in vitro culture in a calcium alginate matrix. Hum Reprod. 24 (1), 92-99 (2009).
- Converse, A., Zaniker, E. J., Amargant, F., Duncan, F. E. Recapitulating folliculogenesis and oogenesis outside the body: encapsulated in vitro follicle growth dagger. Biol Reprod. 108 (1), 5-22 (2023).
- Mainigi, M. A., Ord, T., Schultz, R. M. Meiotic and developmental competence in mice are compromised following follicle development in vitro using an alginate-based culture system. Biol Reprod. 85 (2), 269-276 (2011).
- Kreeger, P. K., Deck, J. W., Woodruff, T. K., Shea, L. D. The in vitro regulation of ovarian follicle development using alginate-extracellular matrix gels. Biomaterials. 27 (5), 714-723 (2006).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. Interpenetrating fibrin-alginate matrices for in vitro ovarian follicle development. Biomaterials. 30 (29), 5476-5485 (2009).
- Griffith, L. G., Swartz, M. A. Capturing complex 3D tissue physiology in vitro. Nat Rev Mol Cell Biol. 7 (3), 211-224 (2006).
- Irving-Rodgers, H. F., Rodgers, R. J. Extracellular matrix of the developing ovarian follicle. Semin Reprod Med. 24 (4), 195-203 (2006).
- Salustri, A., Camaioni, A., Di Giacomo, M., Fulop, C., Hascall, V. Hyaluronan and proteoglycans in ovarian follicles. Hum Reprod Update. 5, 293 (1999).
- Rashki Ghaleno, L., Cristian, P. P., Shahverdi, A., Dardmeh, F., Alipour, H., Valojerd, M. R. Exploring the role of hyaluronic acid in reproductive biology and beyond: Applications in assisted reproduction and tissue engineering. Adv. Biology. 8 (6), e202300621 (2024).
- Desai, N. N., Goldberg, J. M., Austin, C., Falcone, T. The new Rapid-i carrier is an effective system for human embryo vitrification at both the blastocyst and cleavage stage. Reprod Biol Endocrinol. 11, 41 (2013).
- Desai, N., Abdelhafez, F., Calabro, A., Falcone, T. Three dimensional culture of fresh and vitrified mouse pre-antral follicles in a hyaluronan-based hydrogel: a preliminary investigation of a novel biomaterial for in vitro follicle maturation. Reprod Biol Endocrinol. 10 (1), 29 (2012).
- Desai, N., Spangler, M., Nanavaty, V., Gishto, A., Brown, A. New hyaluronan-based biomatrix for 3-D follicle culture yields functionally competent oocytes. Reprod Biol Endocrinol. 20 (1), 148 (2022).
- Monti, M., Redi, C. A. Isolation and characterization of mouse antral oocytes based on nucleolar chromatin organization. J Vis Exp. (107), e53616 (2016).
- Huang, L., et al. Cryopreservation of human ovarian tissue by solid-surface vitrification. Eur J Obstet Gynecol Reprod Biol. 139 (2), 193-198 (2008).
- Chan, J., Darr, A., Alam, D., Calabro, A. Investigation of a novel cross-linked hyaluronan hydrogel for use as a soft-tissue filler. Am J Cosmetic Sur. 22, 105-108 (2005).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. A method for ovarian follicle encapsulation and culture in a proteolytically degradable 3-dimensional system. J Vis Exp. (49), e2695 (2011).
- Xu, M., West, E., Shea, L. D., Woodruff, T. K. Identification of a stage-specific permissive in vitro culture environment for follicle growth and oocyte development. Biol Reprod. 75 (6), 916-923 (2006).
- West-Farrell, E. R., et al. The mouse follicle microenvironment regulates antrum formation and steroid production: alterations in gene expression profiles. Biol Reprod. 80 (3), 432-439 (2009).
- Xu, M., et al. Encapsulated three-dimensional culture supports development of nonhuman primate secondary follicles. Biol Reprod. 81 (3), 587-594 (2009).
- Wu, J., Nayudu, P. L., Kiesel, P. S., Michelmann, H. W. Luteinizing hormone has a stage-limited effect on preantral follicle development in vitro. Biol Reprod. 63 (1), 320-327 (2000).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유