Method Article
Anwendung eines neuartigen Hyaluron-Hydrogels für die dreidimensionale Follikelkultur und Methodik für die Kryokonservierung von Ovarialfollikeln in der Maus
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt ein neuartiges dreidimensionales (3-D) Kulturmodell, bei dem ein Tyramin-gebundenes Hyaluronan-Hydrogel verwendet wird, um präantrale Follikel aus dem Eierstock der Maus zu verkapseln und zu kultivieren. Wir beschreiben auch zwei Ansätze zur Kryokonservierung von Eierstockfollikeln durch Vitrifikation.
Zusammenfassung
Die 3-D-Architektur des Ovarialfollikels und die komplexen Wechselwirkungen zwischen somatischen Zellbestandteilen und der Eizelle, die für die zytoplasmatische und nukleare Reifung notwendig sind, sind in herkömmlichen zweidimensionalen (2-D) Kultursystemen nur schwer aufrechtzuerhalten. Wir beschreiben ein neuartiges 3-D-Kulturmodell unter Verwendung eines Tyramin-gebundenen Hyaluronan-Hydrogels zur Verkapselung und Kultivierung von Ovarialfollikeln der Maus. Die Hyaluronsäure-Verkapselungstechnik ermöglicht das 3-D-Wachstum von Follikeln und die Beibehaltung trophischer Faktoren in unmittelbarer Nähe der sich entwickelnden Follikel. Dieses Hydrogel ist sehr vielseitig und kann sowohl auf isolierte Follikel als auch auf Eierstockgewebefragmente aufgetragen werden. Die viskoelastischen Eigenschaften des HA-Gels ermöglichen die Einstellung der Steifigkeit sowie der Formbarkeit basierend auf der Gelkonzentration. Präantrale Follikel, die sich in diesem Kulturmodell entwickeln, sind in der Lage, die meiotische Reifung innerhalb von 10-12 Tagen nach der Kultur abzuschließen und eine Metaphase-II-Eizelle nach Auslösung mit hCG zu ovulieren. In diesem Artikel werden auch zwei Ansätze zur Kryokonservierung von Eierstockfollikeln durch Vitrifikation beschrieben.
Einleitung
Die In-vitro-Follikulogenese des Menschen bleibt auch vier Jahrzehnte nach der ersten Geburt aus der In-vitro-Fertilisation eine Herausforderung. Bisher fehlt es noch an einer Methodik für die Follikelkultur der menschlichen Eierstöcke, die die Produktion eines lebensfähigen Embryos unterstützt, der zu einem gesunden Baby führt1. Die optimalen physikalischen Eigenschaften, die für das Wachstum von menschlichen In-vitro-Follikeln erforderlich sind, müssen noch bestimmt werden. Der intakte Eierstock ist mit Tausenden von Follikeln in verschiedenen Entwicklungsstadien besiedelt, und die Regulation ihres Wachstums ist ein komplexer Prozess (Abbildung 1)2. Eizellen im Keimbläschenstadium (GV) aus menschlichen präantralen Follikeln benötigen in Kultur bis zu 30 Tage, um meiotisch reif zu werden und das Metaphase-II-Stadium3 zu erreichen. Die bidirektionale Kommunikation zwischen der Eizelle und den umgebenden Granulosazellen durch Gap Junctions ist entscheidend für die zytoplasmatische und nukleare Reifung 4,5,6.
Herkömmliche 2-D-Kultursysteme sind nicht ideal für die Follikelkultur, insbesondere bei größeren Säugetiermodellen, die eine längere Zeit in der Kultur erfordern. Follikel heften sich an die Schale, und die Verbindung zwischen Granulosazellen und der Eizelle wird schwächer, wenn die Granulosazellen wegwandern. Dreidimensionale (3-D) Kultursysteme für Follikel haben sich daher als Mittel herausgestellt, um die In-vivo-Physiologie genauer nachzuahmen 7,8.
Die Verkapselung von Follikeln in einer Matrix zur Förderung des 3D-Wachstums war ein Ansatz zur Erhaltung der Follikelarchitektur während der In-vitro-Kultur (IVC). Biomatrizen aus natürlichen Polymeren (wie Kollagen, Agarose, Fibrin, Alginat und Hyaluronsäure) sowie synthetischen Polymeren (wie Polyethylenglykol, Polyvinylalkohol und Polyglykolsäure) wurden getestet 7,9,10,11,12,13. Es wurde gezeigt, dass die mechanischen Eigenschaften einer Biomatrix die Nährstoffdiffusion, die Differenzierung der thekalen Zelle, die Antrumbildung sowie die Hormonsekretion beeinflussen14. Kollagen als Teil der natürlichen extrazellulären Matrix (EZM) der Zelle ist eine der frühesten getesteten Matrices und war zunächst vielversprechend 15,16,17. Die Logistik der Standardisierung von Kollagenpräparaten, die schlechten mechanischen Eigenschaften und die Stabilität haben jedoch die Verwendung eingeschränkt18. Agarose wurde an Kumulus-Oozyten-Komplexen (KOK) getestet, die sowohl aus Antralfollikeln als auch aus Primordialfollikeln freigesetzt wurden19,20. In jüngerer Zeit hat sich eine gedruckte 3D-Agarose-Form als vielversprechend für die gerüstfreie Follikelkultur erwiesen21. Die Calciumalginat-Verkapselung, über die erstmals 2003 berichtet wurde, war bisher das am besten untersuchte System für IVC22. Es wurde an Mäusen, Rindern, Affen sowie menschlichen Follikelngetestet 23,24,25,26,27. Bei Calciumalginat werden Follikel einzeln in Mikrotropfen des Polymers geladen und mit Calciumchlorid belichtet, um eine Gelkügelchen zu erzeugen. Die Extraktion von Follikeln aus der Perle erfordert eine Behandlung mit einem Chelatbildner. Diese Matrix hat jedoch einige Nachteile. Alginat ist ein Polysaccharid, das aus Algen isoliert wird, und obwohl es Unterstützung bietet, ist es nicht Teil der natürlichen extrazellulären Matrix des Follikels. Die Daten deuten auf eine höhere Inzidenz von Spindeldefekten nach IVC bei Alginathin 28. Spätere Modifikationen des Systems durch die Kombination von Alginat mit Fibrin oder anderen extrazellulären Matrixkomponenten (ECM) haben dazu beigetragen, das Calciumalginatsystem effektiver zu machen29,30.
Immer mehr Hinweise deuten darauf hin, dass die extrazelluläre Matrix ein wichtiger Modulator für das Zellwachstum ist 10,31,32 . Es bietet nicht nur Unterstützung, sondern spielt auch eine entscheidende Rolle bei der Zellanhaftung, -funktion, -wachstum und -kommunikation. Einer der Hauptbestandteile der EZM ist Hyaluronan, ein natürlich vorkommendes Glykosaminoglykan. Im Eierstockfollikel wird Hyaluronan von Granulosazellen produziert und trägt zur strukturellen Integrität und Funktion des sich entwickelnden Follikels bei33,34. Die Integration von Hyaluronan in ein Follikelkulturmodell kann daher dazu beitragen, ein physiologischeres Umfeld zu schaffen und die Produktion funktionell kompetenter Eizellen zu verbessern.
Diese Arbeit beschreibt die neuartige Anwendung eines Tyramin-gebundenen Hyaluronans als Biomatrix für die Kultivierung frischer und gefrorener Ovarialfollikel und die in vitro Reifung von Eizellen (IVM). Wir beschreiben auch Techniken für die Kryokonservierung von Follikeln durch Vitrifikation an zwei Arten von Geräten. Bei einer Methode werden die Follikel direkt in flüssigen Stickstoff getaucht, während bei der zweiten Methode die Follikel vor dem Eintauchen in einen Strohhalm eingeschlossen werden. Primäres Ziel ist es, zu zeigen, dass trotz aller Unterschiede sowohl Methoden als auch Geräte zuverlässig für die Kryokonservierung von Follikeln eingesetzt werden können.
Protokoll
Alle Tierversuche wurden im Rahmen der institutionellen Tierverwendungs- und Pflegeprotokolle der Cleveland Clinic und gemäß den Richtlinien und Vorschriften der National Institutes of Health für die Pflege und Verwendung von Labortieren durchgeführt.
1. Mittlere Vorbereitung
HINWEIS: Die unten beschriebenen Medien werden für die verschiedenen Schritte dieses Verfahrens verwendet: Handhabung des Eierstockgewebes (OT), OT-Kollagenase-Verdau, Follikelkultur (FCM) und Vitrifizierung. Bereiten Sie das gesamte Medium in einer Gewebekulturhaube mit steriler Technik vor.
- Medium zur Handhabung von Eierstockgewebe
- 20 ml Leibovitz-Medium (L-15) mit 0,1 % fötalem Rinderserum (FBS) in einem 50-ml-Gewebekulturkolben (T-50) ergänzen.
- Den Kolben fest verschließen und über Nacht in den Inkubator stellen, um ihn vor Gebrauch auf 37 °C zu erwärmen. Dieses Medium wird für den Umgang mit Eierstockgewebe und Follikeln außerhalb des Inkubators verwendet und benötigt kein CO2 , um einen pH-Wert von 7,2 bis 7,4 aufrechtzuerhalten
ACHTUNG: Geschirr nicht CO2 -Gas aussetzen, da das Medium sonst sauer wird.
- Kollagenase-Verdauungsmedium
- Am Morgen der Follikelentnahme 1 mg Kollagenase Typ I (295 U/mg) in das Reagenzglas mit 2,2 ml vorgewärmtem OT-Handhabungsmedium geben. Die gewünschte Endkonzentration der Kollagenase beträgt 134 U/ml. Filter, sterilisieren Sie mit einem 0,22-μm-Spritzenfilter. Den Deckel fest verschließen und in den Warmhalteblock legen.
- Follikelkulturmedium und Öl
- Bereiten Sie 30 ml Minimum Essential Medium Alpha zu, ergänzt mit 5 % fötalem Rinderserum, in einem T-50-Kolben vor. Ergänzen Sie mit 100 mIU/mL FSH, 10 mIU/mL LH, 10 μg/mL Insulin, 5 μg/mL Transferrin und 5 ng/m Selen.
- FCM bei 37 °C mit 6 % CO2 voräquilibrieren und vor der Verwendung über Nacht im Inkubator an der Luft auffrischen.
- 50 ml Mineralöl in einen Kolben geben, den Deckel locker aufsetzen und über Nacht im Inkubator äquilibrieren.
- Vitrifikationsmedien für FL und FL-Cluster
- Das Basalmedium für alle Lösungen ist Global-Hepes, ergänzt mit 20% synthetischem Proteinersatz. Bereiten Sie 20 ml VS1-Lösung mit 7,5 % Ethylenglykol (EG) und 7,5 % Dimethylsulfoxid (DMSO) in Basalmedium vor.
- Bereiten Sie 20 ml VS2 mit 15 % EG, 15 % DMSO und 0,5 M Saccharose in Basalmedium vor. Alle Lösungen mit einem 0,22 μm Spritzenvorsatzfilter sterilisieren und bis zur Verwendung bei 4 °C lagern. Die Lösungen können bis zu 4 Wochen lang verwendet werden.
- Wärmemedien für vitrifizierte Follikel und FL-Cluster
- Das Basalmedium für alle Lösungen ist Global-Hepes, ergänzt mit 20% synthetischem Proteinersatz. Bereiten Sie 20 ml Basalmedium mit 0,25 M Saccharose vor. Bezeichnen Sie als WS1.
- 20 ml Basalmedium mit 0,125 M Saccharose vorbereiten und als WS2 beschriften. Filter mit 0,22 μm Spritzenvorsatzfilter sterilisieren. Lagern Sie Lösungen bis zu 4 Wochen bei 4 °C.
2. Ernte der Eierstöcke
- 10-14 Tage alte B6D2F1-Welpen durch Gebärmutterhalsluxation einschläfern (keine Anästhesie). Verwenden Sie 3-4 Welpen, um 250-300 intakte präantrale Follikel für Experimente zu erhalten.
- Legen Sie das Tier auf den Rücken und tupfen Sie den Bauch mit 70%igem Isopropylalkohol ab. Machen Sie mit einer sauberen Schere einen kleinen horizontalen Schnitt in der Mitte. Fassen Sie die Haut oben und unten mit einer feinen Pinzette und ziehen Sie in beide Richtungen (in Richtung Kopf und Füße), um den Bauch freizulegen.
- Schneide mit einer zweiten sauberen Schere und einer feinen Pinzette die Bauchdecke auf. Hebe die Darmspiralen weg. Lokalisieren Sie die Gebärmutterhörner, Eileiter und Eierstöcke. Die Eierstöcke exzitieren und in eine Schale in der Mitte geben, die 1 ml OT-Handhabungsmedium enthält, das auf 37 °C erwärmt ist.
- Schneiden Sie mit einem Präpariermikroskop jegliches Fett und Eileitergewebe ab. Die Eierstöcke halbieren.
3. Follikel- und FL-Cluster-Isolierung (FL-C)
- Verwenden Sie eine Laminar-Flow-Haube mit einer 37 °C beheizten Oberfläche für die Follikelisolierung und -handhabung. Arbeiten Sie aseptisch in der Haube. Seien Sie vorsichtig mit der FCM-Schale. Verwenden Sie den Bubbler, um das Gericht mit 5 % CO2 zu begasen, wenn Sie in der Laminar-Flow-Haube arbeiten.
HINWEIS: Alle Lösungen müssen auf 37 °C vorgewärmt werden. FCM-Medium sowie Mineralöl müssen vor der Verwendung über Nacht in einem Inkubator bei 37 °C mit 6 % CO2 voräquilibriert werden. Der mittlere pH-Wert verschiebt sich, wenn er sich länger als 10 Minuten außerhalb des Inkubators befindet. - 6 mL des voräquilibrierten FCM in zwei 60-mm-Schalen pipettieren und mit Mineralöl überziehen. Legen Sie es wieder in den Inkubator.
- Pipettieren Sie 1 ml Kollagenase in eine Vertiefungsschale in der Mitte und 3 ml OT-Medium in die Außenwand. Bewegen Sie die Eierstöcke mit einer Mikropipette aus Glas (1000 μm) in Kollagenaselösung. Inkubieren Sie die Schale 30-40 Minuten lang auf der erhitzten Oberfläche der Laminar-Flow-Haube.
- Am Ende der Kollagenase-Inkubation pipettieren Sie 6 ml OT-Medium in zwei 60-mm-Gewebekulturschalen mit der Bezeichnung 1 und 2. Auf die warme Oberfläche der Haube legen.
- Bewegen Sie die mit Kollagenase behandelten Eierstöcke mit einer Mikropipette in die äußere Vertiefung, um sie von Kollagenase zu befreien. Wechseln Sie die Mikropipetten und verschieben Sie dann die Eierstöcke in die OP-Schale 1.
- Entnehmen Sie Follikel aus jedem Eierstock mit einer P200-Pipette. Befreien Sie Follikel durch wiederholtes Aspiration und Ausstoßen des enzymbehandelten Eierstocks durch die Pipettenspitze, die in verschiedenen Größen geschnitten ist. Auch das mechanische Auftrennen von Gewebe in Fragmente mit zwei 27G-Nadeln vor dem Pipettieren ist hilfreich, um einzelne Follikel freizusetzen. Jedes Mausbaby sollte 60-75 intakte Follikel der gewünschten Größe liefern.
- Falls erforderlich, geben Sie undissoziierte Eierstockstücke für weitere 5-10 Minuten in die Kollagenase zurück, spülen Sie sie aus und wiederholen Sie das Pipettieren, um weitere Follikel freizusetzen.
HINWEIS: Eine übermäßige Exposition gegenüber Kollagenase führt zu einer Störung der Granulosazellschichten, die die Eizelle umgeben. Versuchen Sie nicht, den gesamten Eierstock aufzubrechen. Hören Sie auf, sobald 250-300 Follikel entnommen wurden. - Untersuchen Sie freigesetzte Follikel mit einem Präpariermikroskop bei 40-facher Vergrößerung. Identifizieren Sie sekundäre präantrale Follikel (~120 -140 μm Durchmesser) mit einer zentral gelegenen Eizelle, die von einer intakten Basalmembran (Basallamina) eingeschlossen ist. Ein Follikel dieser Größe hat typischerweise 2-4 Schichten von Granulosazellen, die die Eizelle umgeben (siehe Abbildung 1).
HINWEIS: Vergleichen Sie die Follikel mit der Öffnung einer 175-μm-Mikropipettenspitze, um die ungefähre Follikelgröße zu ermitteln. Der Follikel sollte auf etwa 3/4 des Pipettendurchmessers zugeschnitten sein. Dies ist die schnellste Methode, um Follikel der gewünschten Größe auszuwählen. - Verschieben Sie ausgewählte Follikel mit einer 175-μm-Mikropipette in die OT2-Schale. Spülen Sie nach Abschluss der Entnahme alle Follikel in der FCM1-Schale, um alle Spuren des OT-Mediums zu entfernen. Dann in die FCM2-Schale geben.
- Stellen Sie die Schale für 60 Minuten in einen Inkubator, bevor Sie mit dem Einbetten beginnen.
- Führen Sie für die Isolierung von Follikelclustern die Schritte 3.1 bis 3.5 aus. Verwenden Sie zwei Tuberkulinspritzen (27 G), um den Eierstock in Fragmente und dann in kleine Cluster von 6-10 Follikeln zu zerkleinern.
HINWEIS: Die Kultur von Follikelclustern (FL-C) ist eine Alternative zur Kultivierung einzelner Follikel. Bei dieser Methode wird die native follikuläre Architektur zusammen mit den stromalen Komponenten beibehalten. Die Follikelgröße in FL-C ist nicht einheitlich. Die Follikel behalten ihre in vivo-Konfiguration bei, wobei primordiale, primäre und sekundäre Follikel vorhanden sind. - Sammeln Sie diese Follikelcluster (FL-C) mit einer 200 μm Mikropipette in der OT2-Schale. Spülen Sie nach Abschluss der Entnahme alle FL-C und übertragen Sie sie auf FCM2, um auf die Einbettung zu warten.
4. Einbettung von Follikeln und Follikelclustern
- Bereiten Sie eine 10 mg/ml-Stammlösung aus aktiviertem tyramingebundenem Hyaluronan-Hydrogel (HA) vor. Rehydrieren Sie 250 mg tyraminsubstituiertes Natriumhyaluronatpulver mit 25 ml Meerrettichperoxidase-Enzym (HRP; 10 IE/ml) in phosphatgepufferter Kochsalzlösung. Nach der Solubilisierung lagern Sie 500 μl Aliquots dieses aktivierten HA-Bestands bei -4 °C für zukünftige Experimente.
- Für Follikelexperimente wird die HA-Stammlösung aufgetaut und in einem auf 37 °C erwärmten globalen Medium auf eine Konzentration von 3 mg/ml verdünnt. Führen Sie alle Einbettungsschritte in einer Laminar-Flow-Haube mit einer auf 37 °C beheizten Tischoberfläche durch. Verwenden Sie eine 60-mm-Schale mit acht 100-μl-Wells für die Einbettung und anschließende Follikelkultur.
- Bewegen Sie Follikel oder FL-Cluster, die eingebettet werden sollen, aus der FCM-Schale in einen Tropfen HA-Gel, um sie frei von Kulturmedium zu spülen. Das Tracking-Medium stört die Gelbildung. Stellen Sie die FCM-Schale wieder unter den Bubbler, um sie zu begasen.
HINWEIS: Isolierte Follikel können je nach Experiment einzeln oder in Gruppen eingebettet werden. Wir bevorzugen es im Allgemeinen, 2-4 Follikel pro Perle zu säen. - 1 μl 0,03 % Wasserstoffperoxid (H2O2) auf eine Petrischale geben. Geben Sie 25 μl 3 mg/ml HA-Gel auf den Wasserstoffperoxid-Tropfen und mischen Sie es durch Pipettieren, um die Vernetzung einzuleiten (siehe Abbildung 2).
- Ziehen Sie mit einer P20-Pipettore die HA-H2O2-Mischung auf und pipettieren Sie einen Tropfen (~8-10 μl) in zwei separate Vertiefungen der 8-Well-Kulturschale. Vermeide es, Blasen zu bilden.
- Mit einer 200-μm-Mikropipette können Sie die Follikel oder ein FL-C schnell in die Mitte jedes Tropfens übertragen (Abbildung 3). Geschwindigkeit ist wichtig, da das HA, sobald es dem Katalysator (Peroxid) ausgesetzt ist, innerhalb von 1-2 Minuten zu gelieren beginnt. Achten Sie darauf, dass während der Aussaat keine Blasen entstehen.
HINWEIS: Um das Wachstum einzelner Follikel zu verfolgen, positionieren Sie die Follikel in einem gewissen Abstand voneinander. Platzieren Sie die Follikel nicht zu nahe am Gelboden, da sie sonst während der IVC weit genug absinken können, um sich zu befestigen. - Warten Sie ~ 3 Minuten, um den Geliervorgang abzuschließen, und fügen Sie dann 100 μl voräquilibriertes FCM in jede Vertiefung hinzu. Wiederholen Sie diesen Vorgang und laden Sie Follikel in alle acht Vertiefungen. Mit warmem, vorausgeglichenem Mineralöl überziehen und die Schale in einen Inkubator stellen.
5. Vitrifikation von Follikeln und FL-Clustern
HINWEIS: Die Vitrifizierung kann entweder mit einem offenen Träger (Cryoloop; CL), der den direkten Kontakt mit flüssigem Stickstoff ermöglicht, oder aber ein geschlossener Träger (Rapid I; RI), bei dem die Probe in einem äußeren Halm verschlossen ist und daher niemals mit flüssigem Stickstoff in Berührung kommt. Abbildung 4 zeigt die Geräte und Kontraste der beiden Vitrifikationssysteme. Die Vitrifikation auf beiden Geräten hat sich für die Kryokonservierung von Embryonen als wirksam erwiesen35.
- RI-Vitrifikation mit geschlossenem Träger
- 2 mL Aliquots von VS-Lösungen in einem erhitzten Block auf 37 °C vorwärmen. Führen Sie alle Vitrifikationsschritte auf der beheizten Oberfläche der Laminar-Flow-Haube mit einem Präpariermikroskop durch, um den Follikel und den Träger sichtbar zu machen.
- Füllen Sie die isolierte Kryobox mit flüssigem Stickstoff (LN2). Legen Sie den äußeren Strohhalm des Geräts in einen Halteschlitz in der Box, so dass er teilweise in flüssigen Stickstoff getaucht ist. Lege den inneren Plastikstab mit einem winzigen Loch quer über den Deckel einer Petrischale, um ihn für das Laden vorzubereiten.
- Geben Sie zwei Tropfen VS1 nebeneinander auf eine Petrischale in der Nähe der Oberseite. Verwenden Sie eine 200-μm-Mikropipette, um zwei Follikel in den ersten Tropfen zu platzieren. Spülen Sie es aus und gehen Sie schnell zum zweiten Tropfen VS1 über. 5 Min. inkubieren. Wenn Sie FL-Cluster vitrifizieren, verarbeiten Sie jeweils einen einzelnen Cluster.
- Geben Sie drei Tropfen VS2 nebeneinander auf dieselbe Schale, wenn die erste Inkubation fast abgeschlossen ist. Bewegen Sie dann die Follikel innerhalb von 60 s schnell nacheinander durch die drei VS2-Tropfen und laden Sie sie auf den Träger. Achten Sie darauf, eine minimale Menge Flüssigkeit mit den Follikeln zu ziehen, um zu vermeiden, dass das Medium von einem Tropfen zum anderen verfolgt wird.
- Um den Träger zu beladen, nehmen Sie zwei Follikel und geben Sie sie mit minimaler Flüssigkeit in das winzige Loch im Kunststoffstab. Das endgültige Flüssigkeitsvolumen im Loch beträgt winzige < 0,5 μl. Vermeiden Sie eine Überfüllung, die dazu führt, dass Flüssigkeit aus dem Loch auf den Kunststoffstab ausläuft.
- Lassen Sie das Stäbchen in den vorgekühlten äußeren Strohhalm fallen. Verwenden Sie das Ultraschallschweißgerät, um den Strohhalm zu verschließen und zu versiegeln. Lege den Strohhalm in einen Becher, der am Kryorohr befestigt ist. Bis zu 4 Strohhalme können in den gleichen Kelch gelegt werden.
- Decken Sie den Stock mit einer Schutzhülle aus Kunststoff ab. Tauchen Sie das Rohr in einen Flüssigstickstoff-Vorratstank (LN2).
- CL-Vitrifikation mit offenem Träger
- VS-Lösungen auf 37 °C vorwärmen. Führen Sie alle Verglasungsschritte auf der beheizten Oberfläche der Laminar-Flow-Haube durch. Bereiten Sie die Anzahl der benötigten offenen CL-Träger im Voraus vor. Setzen Sie den CL-Stiel aus Metall in die magnetisierte Fläschchenkappe ein und stellen Sie sicher, dass er fest hält (verwenden Sie bei Bedarf einen winzigen Tupfer Klebstoff).
- Füllen Sie die isolierte Kryobox mit flüssigem Stickstoff (LN2). Setzen Sie ein Gestell in die Kryobox ein, um die Kryofläschchen so zu halten, dass sich LN2 unter der Oberseite des Fläschchens befindet.
- Füllen Sie das spezielle magnetisierte und belüftete Fläschchen mit LN2. Stellen Sie es auf das Gitter. Führen Sie die Vitrifizierungsschritte wie in den Schritten 6.1.3 bis 6.1.5 beschrieben durch. Der einzige Unterschied besteht darin, dass wir in der Regel fünf Follikel gleichzeitig verarbeiten. Achten Sie auch hier darauf, die Nachführflüssigkeit von Tropfen zu Tropfen zu minimieren.
- Um Follikel zu laden, fassen Sie den offenen CL-Träger mit dem Metallstab an der angebrachten Magnetkappe. Tauchen Sie den offenen CL-Träger in einen separaten Tropfen VS2, um einen Film aus Kryoprotektivum zu erzeugen.
- Nehmen Sie mit einer Mikropipette alle Follikel oder den FL-Cluster auf und platzieren Sie sie mit minimaler Flüssigkeit auf der Folie. Arbeiten Sie schnell, da die Follikel geladen werden müssen, bevor die Folie zu trocknen beginnt.
- Tauchen Sie den CL sofort in das mit LN2 gefüllte Kryofläschchen, um die Probe zu vitrifizieren. Verschließen Sie das Fläschchen und setzen Sie es auf das Kryorohr. Mit einer Kunststoffhülle abdecken. Tauchen Sie das Rohr in einen Vorratstank für flüssigen Stickstoff.
6. Erwärmung von vitrifizierten Follikeln und FL-Clustern
- RI Erwärmung mit geschlossenem Träger
- Bereiten Sie ein Gericht in der Mitte der Vertiefung mit 3 ml voräquilibriertem FCM in der äußeren Vertiefung und 1 ml in der mittleren Vertiefung zu. Mit Öl überziehen und in den Inkubator legen.
- Geben Sie 0,5 ml vorgewärmtes WS1 und WS2 in zwei beschriftete Schalen in der Mitte. Bringen Sie die Stöcke mit Proben aus dem Lagertank in eine mit LN2 gefüllte Kryobox.
- Entfernen Sie die Abdeckung des Kunststoffstocks. Nehmen Sie den Strohhalm aus dem Kelch, halten Sie ihn eingetaucht und schieben Sie ihn in den Halteschlitz in der Kryobox.
- Schneiden Sie mit einer feinen Schere den äußeren Strohhalm knapp über dem schwarzen Punkt ab, der die Oberseite des inneren RI-Trägers mit Follikeln anzeigt.
- Heben Sie mit einer feinen Pinzette den inneren Kunststoffstab leicht aus dem äußeren Strohhalm heraus. Fassen Sie das Gerät und tauchen Sie den Stick schnell in WS1 ein, wobei Sie ihn vorsichtig schwenken, um die Follikel zu entladen. Geschwindigkeit ist entscheidend. Die Follikel müssen innerhalb von 10 s in WS1 entladen werden.
- Verwenden Sie ein Präpariermikroskop, um die Follikel sichtbar zu machen und sicherzustellen, dass alle vom Träger entladen wurden. Nach 2 Minuten in WS1 verschieben Sie mit einer Mikropipette alle Follikel (oder FL-Cluster) nach WS2 und achten Sie darauf, das Medium nicht zu verfolgen.
- Spülen Sie nach 3 Minuten die Follikel in der äußeren Vertiefung der FCM-Schale ab und bringen Sie sie dann in die mittlere Vertiefung. Vor dem Einbetten wieder für 1-2 Stunden in den Inkubator stellen.
- CL Offener Träger Erwärmung
- Bereiten Sie FCM- und WS-Gerichte wie oben beschrieben zu. Bewegen Sie das Rohr mit Follikeln aus einem Lagertank in eine mit LN2 gefüllte Kryobox. Nimm die Abdeckung des Plastikstocks ab.
- Heben Sie mit dem Magnetstab die Kryoröschchenkappe an, bis der Metallstiel des CL sichtbar ist.
- Fassen Sie mit einer Pinzette den Metallstiel an. Nehmen Sie das CL aus der Durchstechflasche und tauchen Sie es sehr schnell in WS 1 ein, wobei Sie es vorsichtig schwenken, um die Follikel zu entladen. Entladen in WS1 innerhalb von 10 s. Überprüfen Sie mit einem Präparierfernrohr, ob alle Follikel entladen wurden
- Alle verbleibenden Schritte für die Erwärmung sind die gleichen wie bei den Schritten mit geschlossenen RI-Trägern ab Schritt 7.1.6.
7. Follikel- und FL-Cluster-Bildgebung und Medienwandel
- Überwachen Sie Follikel und FL-Cluster in Vertiefungen während des 10- bis 12-tägigen Kulturintervalls mit einem inversen Lichtmikroskop mit Hoffman-Kontrastmodulationsoptik und einer hochauflösenden Kamera. Verwenden Sie eine Imaging-Software, um Bilder mit 40-facher und entweder 100- oder 200-facher Gesamtvergrößerung aufzunehmen, je nach Größe.
- Bildgebung und Beurteilung von Follikeln
- Am Kulturtag 1 nach dem Einbetten werden alle Kulturvertiefungen mit einem inversen Mikroskop bei 40- und 200-facher Vergrößerung abgebildet, um die Ausgangsmorphologie und -größe zu bestimmen. Lege die Schale wieder in den Inkubator.
- Betrachten Sie Bilder und notieren Sie die Anzahl der vollständig eingebetteten Follikel in jeder Gelperle. Für FL-C nehmen Sie zu Beginn der Kultur eine Schätzung der Follikelzahl vor.
- Messen Sie mit Hilfe einer Bildgebungssoftware den Follikeldurchmesser entlang vertikaler und horizontaler Ebenen vom Rand der Basalmembran aus. Messen Sie die Eizellgröße auf ähnliche Weise vom äußeren Rand der Zona aus. Erfassen Sie Durchschnittswerte. Nehmen Sie ein vertikales und ein horizontales Maß für den Cluster-Durchmesser vor.
- Fahren Sie fort, alle 2-3 Tage Kulturen abzubilden. Messen Sie die Durchmesser der Follikel, die nicht miteinander in Berührung kommen. Mit FL-C ballen sich die Cluster während der IVC zusammen, so dass der gesamte Cluster in der vertikalen und horizontalen Ebene gemessen werden kann.
HINWEIS: Bei Follikeln, die eng beieinander gruppiert sind, sind einzelne Follikelgrenzen nach Tag 4 der Kultur möglicherweise nicht mehr erkennbar, daher werden keine Messungen durchgeführt. - Follikel, die dunkel oder apoptotisch werden, sowie Follikel, bei denen die Eizelle nicht mehr von Granulosazellen umgeben ist oder extrudiert wurde, sind als nicht lebensfähig zu klassifizieren. Behalten Sie den Überblick über Follikel oder FL-C, die sich an der Oberfläche der Schale festgesetzt haben (siehe Abbildung 5).
- Beobachten Sie die Follikel ab dem 8. Tag sorgfältig auf die Antrumbildung. Follikel mit Antrum sehen aus, als hätten sie einen lichten oder helleren Raum in sich (Abbildung 6).
- Führen Sie alle 2 Tage einen halben Wechsel des Kulturmediums durch. Verwenden Sie eine P200-Pipette, die auf 50 μl eingestellt ist. Führen Sie die Spitze in die Vertiefung unter der Ölauflage und weg von der Gelperle ein. Ziehen Sie langsam 50 μl des Nährmediums heraus. Ersetzen Sie das Medium, indem Sie langsam 50 μl frisches FCM unter die Ölauflage pipettieren. Vermeide es, Blasen zu bilden.
8. Reifung von Eizellen in verkapselten Follikeln
HINWEIS: Der letzte Reifungsschritt wird in der Regel eingeleitet, wenn die Antrumbildung unter den insgesamt gesäten (und lebensfähigen) Follikeln über 40 % erreicht. Für den Fall, dass die Antrumbildung jedoch gering oder nicht sichtbar ist, empfehlen wir das Auslösen bis zum 12. Tag der Kultur. Wir haben keinen Nutzen darin festgestellt, noch länger zu warten. Bei FL-C-Kulturen wird die Reifung typischerweise ausgelöst, wenn in 40 % der Vertiefungen oder spätestens am 12. Tag Antrums beobachtet werden.
- Bereiten Sie In-vitro-Reifungsmedium (IVM) vor, indem Sie FCM mit 1,5 IE/ml humanem Choriongonadotropin (hCG) und 5 ng/ml epidermalem Wachstumsfaktor (EGF) ergänzen.
- Lösen Sie die Reifung aus, indem Sie FCM in jeder Vertiefung gegen 17 Uhr durch 100 μl IVM-Medium ersetzen. Nach der Reifung über Nacht (16-18 Stunden nach dem Trigger) verwenden Sie ein Präpariermikroskop mit 40-facher Vergrößerung, um jede Kultur gut auf Kumulus-Eizell-Komplexe (KOK) zu untersuchen, die aus der HA-Gelkügelchen ovuliert haben. Die KOKs befinden sich in der Regel direkt über der Gelperle oder in unmittelbarer Nähe.
- Sammeln Sie die ovulierten KOK in einer Schale in der Mitte mit 1 ml voräquilibriertem FCM, überlagert mit Öl, und stellen Sie die Schale wieder in den Inkubator.
- Sammeln Sie Eizellen aus Follikeln, die noch eingebettet sind, indem Sie die HA-Kügelchen vorsichtig mit einer P200-Pipettiermaschine pipettieren, um nicht ovulierte KOK freizusetzen. Sammeln Sie diese in einer separaten Schale mit FCM.
- Bereiten Sie ein Gericht in der Mitte mit 1 ml Hyaluronidase (10 IE/ml) und 3 mL FCM-Medium in der Außenwand zu.
- Ovulierte KOK in Hyaluronidase-Lösung übertragen und kurz dem Enzym aussetzen (30-45 s), um die Eizelle der Granulosazellen zu entblößen und den Kernstatus der Eizelle sichtbar zu machen. Spülen Sie die Eizellen aus, um das Enzym zu entfernen, bevor Sie 5 μl Tropfen frisches Medium zur detaillierten Beurteilung unter Öl geben. Stellen Sie die Schale in den Inkubator. Wiederholen Sie diesen Vorgang für die nicht ovulierten KOK.
- Notieren Sie die Gesamtzahl der ovulierten und nicht ovulierten Eizellen. Fotografieren und beurteilen Sie den nukleären Status (GV, Metaphase I oder Metaphase II) jeder gewonnenen Eizelle. Messen und aufzeichnen Sie den Durchmesser.
- Berechnen Sie die IVC-Überlebensrate basierend auf der Gesamtzahl der lebensfähigen Follikel (diejenigen, die es bis zum Tag des hCG-Auslösers schaffen) und der Gesamtzahl der gewonnenen Eizellen. Berechnen Sie den prozentualen Anteil der Metaphase-II-Eizellen aus den ovulierten KOK. Wiederholen Sie diesen Vorgang für alle Eizellen, die aus den nicht ovulierten KOK gewonnen wurden.
- Bestimmen Sie die Reifungsrate zur Metaphase II auf die gleiche Weise für FL-C.
Ergebnisse
In diesem Artikel wird die Methodik für die Verwendung eines neuartigen tyramingebundenen Hyaluronan-Gels für die In-vitro-Kultur von präantralen Mausfollikelnbeschrieben 36,37. Abbildung 6 veranschaulicht die Unterschiede zwischen dem Wachstum präantraler Follikel, wenn es in einem konventionellen 2-D-Kultursystem platziert wird, und einem einzelnen Follikel, der in HA-Gel für die 3-D-Kultur eingekapselt ist. Die native Follikelarchitektur wird während der 12 Tage der Kultur beibehalten, wobei am letzten Tag des Wachstums ein Antrum deutlich sichtbar ist.
Das HA-Gel ist sehr vielseitig und ermöglicht das Wachstum isolierter Follikel einzeln oder in Gruppen und auch das Eierstockgewebe wird mechanisch in kleine Follikelcluster aufgebrochen. Das Gel ist transparent, so dass Follikel auch in unterschiedlichen Tiefen sichtbar gemacht werden können. Verkapselte Follikel und FL-C zeigen eine radiale Expansion durch fortgesetzte Granulosazellproliferation (Abbildung 7). Die anfänglichen Follikeldurchmesser betragen durchschnittlich 139,8 ± 28 μm, wobei der GV-Eizellendurchmesser 63,5 ± 4,6 μm beträgt. Bei einfach kultivierten Follikeln beträgt der Enddurchmesser etwa 385,6 ± 36,7 μm, was einer etwa 3-fachen Vergrößerung entspricht. Ovulierte Metaphase-II-Eizellen messen etwa 84,8 ± 3,8 μm. Innerhalb kultivierter FL-Cluster ist die Follikelgröße ziemlich unterschiedlich (Abbildung 5, Abbildung 7). Ovulierte Eizellen nach hCG-Trigger befinden sich in der Nähe des Follikels (Abbildung 8). Der Großteil der Metaphase-II-Eizellen wird aus den ovulierten KOK entnommen. Follikel, die nach dem Trigger noch eingebettet sind, enthalten in der Regel GV- und Metaphase-I-Eizellen.
Tabelle 1 stellt die Reifungsraten zwischen isolierten Follikeln und FL-Clustern aus frischen oder gefrorenen Eierstöcken gegenüber. FL-C aus kryokonservierten Eierstöcken hatte signifikant niedrigere Reifungsraten. Mikroskopische Beobachtungen zeigten, dass sie häufig gebrochene Basallamina hatten, was sie sehr anfällig für eine vorzeitige Eizellextrusion machte. Der fragilen Natur von Follikelclustern wurde durch die Verkapselung etwas entgegengewirkt. Eine Kollagenase-Behandlung von kryokonservierten Eierstöcken wurde vermieden, da sie bei geringem Überleben und geringer Ausbeute an intakten Follikeln besonders schädlich war.
Die Kryokonservierung von isolierten Follikeln ist viel effektiver als die Konservierung ganzer Eierstöcke. Mit beiden untersuchten Vitrifikationsmethoden können hohe Reiferaten erzielt werden (Tabelle 2). Trotz großer Unterschiede in den Kühlraten unterschied sich die Eizellreifung nach IVC nicht. Der offene CL-Träger ermöglicht eine höhere Effizienz, da bis zu zehn Follikel auf einen einzigen offenen CL-Träger geladen werden können. Dies verkürzt auch die Gesamtzeit für die Rückgewinnung mehrerer kryokonservierter Follikel. Für eine eventuelle klinische Anwendung der Vitrifikation für menschliche Follikel kann jedoch das geschlossene, versiegelte System vorzuziehen sein.
Die Chromatinanordnung um den Nukleolus der GV-Eizelle kann verwendet werden, um Eizellen zu identifizieren, die am wahrscheinlichsten nach dem Eisprung befruchten und sich zu Blastozysten entwickeln38. Abbildung 9 zeigt die Lebendfärbung von Eizellen zur Visualisierung des Chromatinverteilungsmusters.
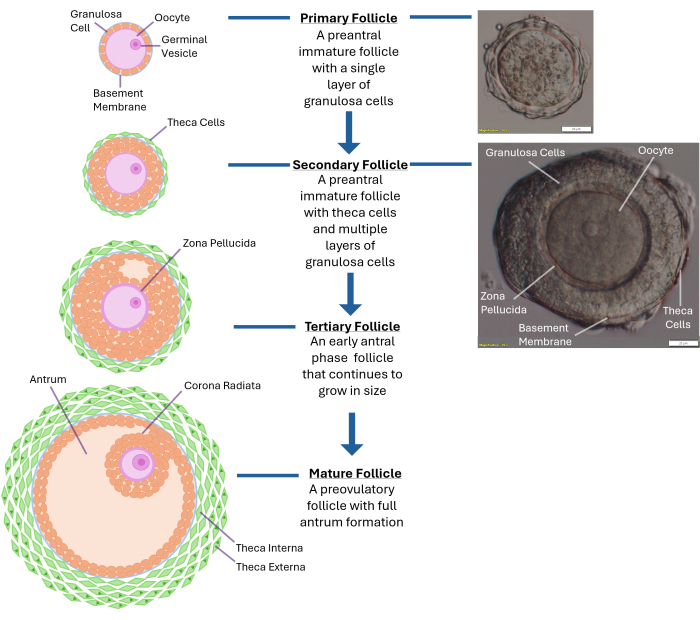
Abbildung 1: Schematische Darstellung des Follikelwachstums. Dieses Diagramm veranschaulicht die verschiedenen Stadien der Follikelentwicklung, von einem Primärfollikel über das sekundäre präantrale Stadium bis hin zu einem voll ausgereiften Tertiärfollikel, der bereit für den Eisprung ist. Gezeigt wird auch eine mikroskopische Aufnahme eines typischen präantralen Follikels mit seinen unterschiedlichen morphologischen Merkmalen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
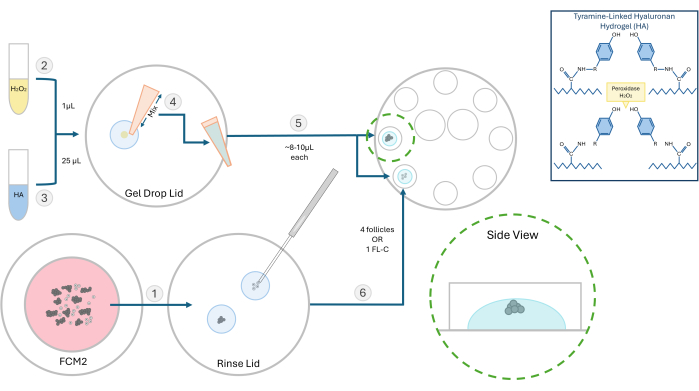
Abbildung 2: Schematische Darstellung der HA-Verkapselungsmethode. Die Struktur des Hyaluronsäure-Gels und die verschiedenen Schritte zur Follikeleinbettung sind in diesem Diagramm dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
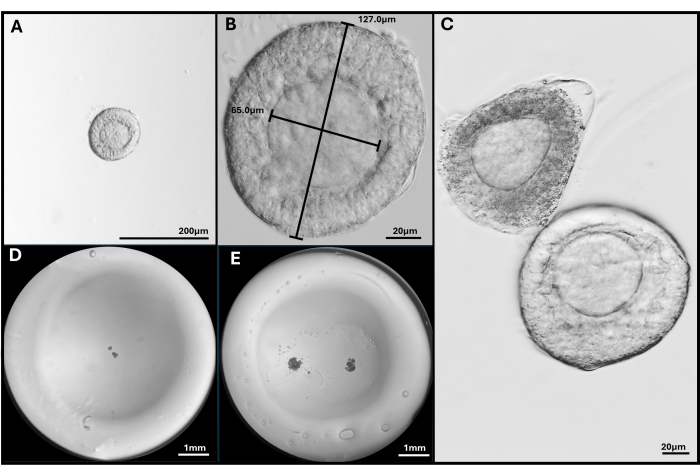
Abbildung 3: Follikelisolierung und -verkapselung. (A, B) Präantraler Follikel, der für die Einbettung bei 40- und 200-facher Vergrößerung ausgewählt wurde. (C) Apoptotischer Follikel ist mit gesundem präantralen Follikel mit nicht ganz zentraler Eizelle dargestellt. (D) Bild einer HA-Gelperle, die mit Follikeln besiedelt ist, und (E) mit zwei FL-C. Bilder, die mit einem Stereomikroskop aufgenommen wurden, um die gesamte Gelkügelchen zu zeigen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Vitrifikationsgeräte zur Kryokonservierung isolierter Follikel. Bei der offenen Trägervorrichtung CL wird der Vitrifikationsschritt durch direktes Eintauchen der Follikel in flüssigen Stickstoff durchgeführt. Die Abkühlgeschwindigkeit ist daher mit über -20.000 °C/min extrem hoch. Im Gegensatz dazu werden beim geschlossenen RI-Träger die Follikel auf den inneren Kunststoffstab geladen und in einen äußeren Strohhalm gelegt, der in flüssigen Stickstoff getaucht ist. Dieses geschlossene Vitrifikationsverfahren vermeidet den direkten Kontakt mit flüssigem Stickstoff. Allerdings ist die Abkühlrate mit -1220 °C/min deutlich geringer. Das Laden und die Rückgewinnung von Follikeln aus beiden Trägern ist einfach. Der offene CL-Träger konnte bis zu zehn Follikel pro Gerät laden, verglichen mit nur zwei beim geschlossenen RI-Träger. Diese Zahl wurde von35 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
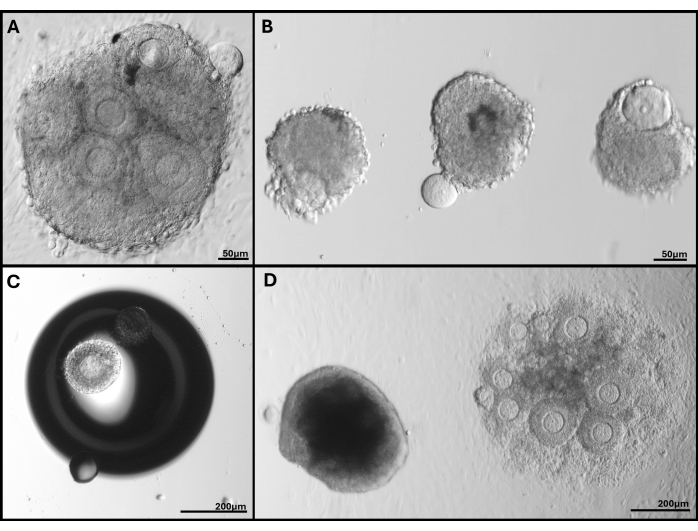
Abbildung 5: Repräsentative Bilder der aufgetretenen Probleme. (A) Follikelcluster mit Eizelle, die extrudiert wird. (B) Isolierte Follikel mit gebrochener Basallaminamembran und einer mit einer extrudierten Eizelle. (C) Eingebetteter Follikel unter einer Blase im Gel. (D) Follikelcluster, der im Gel verblieben ist (links), verglichen mit einem zu tief eingebetteten Cluster, der sich schließlich an die Schale anheftet. Die große Bandbreite an Follikelgrößen in FL-C ist deutlich sichtbar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
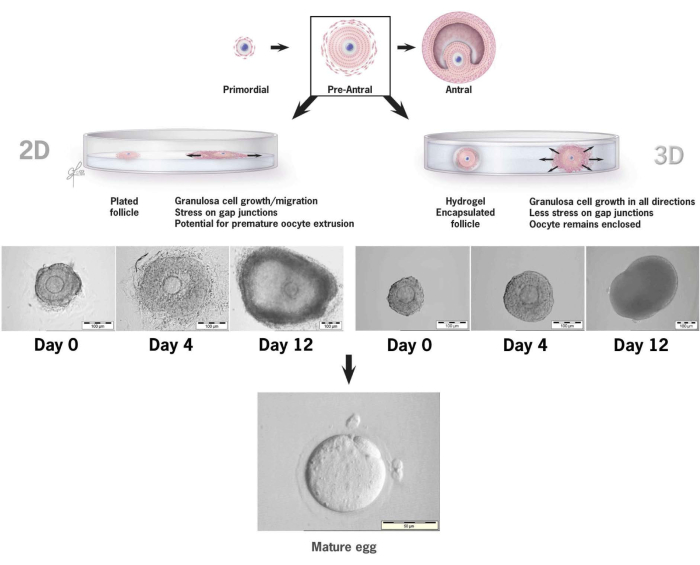
Abbildung 6: Vergleich des Follikelwachstums in der 2-D- und 3-D-Kultur bei HA. Mit dem 2-D-Wachstum wurde bis zum 4. Tag eine Abflachung des Follikels und eine Bindung der Granulosazellen an die Gewebekulturschale beobachtet, wodurch die Eizelle anfällig für die Migration von Granulosazellen, eine Störung der Gap Junctions und eine vorzeitige Eizellextrusion wurde. Der HA-verkapselte Follikel blieb während des gesamten Kulturintervalls ungebunden. Die Expansion der Granulosazellen erfolgte in alle Richtungen, wobei die Eizelle umhüllt und die 3D-Architektur beibehalten wird. Diese Zahl wurde von36 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Repräsentative Bilder von Follikeln, die in Tyramin-gebundenem Hyaluronsäuregel eingekapselt sind. (A) Präantralfollikel, der nach dem Kollagenaseverdau eines frischen Eierstocks an Tag 1 entnommen wurde. (B) Gel-Tropfen, besiedelt mit vier präantralen Follikeln, aufgenommen an Tag 1 und (C) Tag 4 der Kultur, (D) Follikelcluster aus frischem Eierstock an Tag 2, (E) an Tag 6 und (F) an Tag 9 der Kultur. (G) Follikelcluster, mechanisch präpariert aus vitrifiziertem ganzen Eierstock, gezeigt an Tag 2 und (H) an Tag 6 der Kultur. (I) Der Follikel mit Antrumbildung ist am 9. Tag der Kultur deutlich sichtbar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
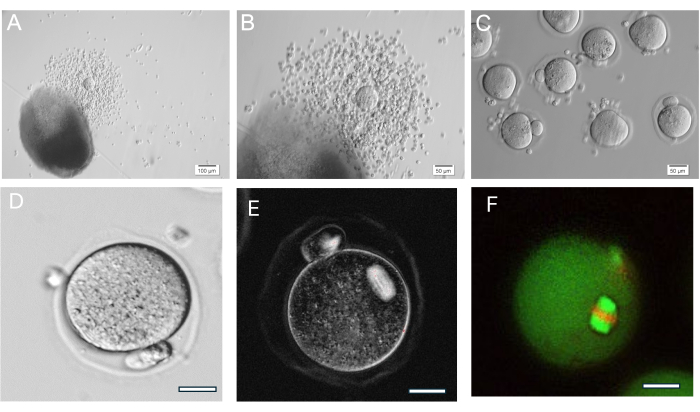
Abbildung 8: Eisprung der Eizelle. (A, B) Ovulierter Kumulus-Oozyten-Komplex (COC) neben der HA-Gel-Kugel. (C) Die Eizellen wurden nach enzymatischer Behandlung von KOK mit Hyaluronidase abgebildet, um die umgebenden Kumuluszellen zu entfernen. Zahlreiche Metaphase-II-Eizellen. (D) Metaphase-II-Eizelle mit markantem Polkörper. Vergrößerung 400x. (E) Live-Bildgebung der Metaphase-II-Eizelle unter Verwendung von polarisiertem Licht und einem Bildgebungssystem zur Visualisierung der meiotischen Spindel und zur Beurteilung der Organisation, durchgeführt wie in37 beschrieben. Vergrößerung 400x. Normale, doppelbrechende Spindel sichtbar. (F) Metaphase-II-Eizelle, fixiert und gefärbt mit Anti-alpha/beta-Tubulin und Propidiumiodid, um die Organisation der meiotischen Spindel sichtbar zu machen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
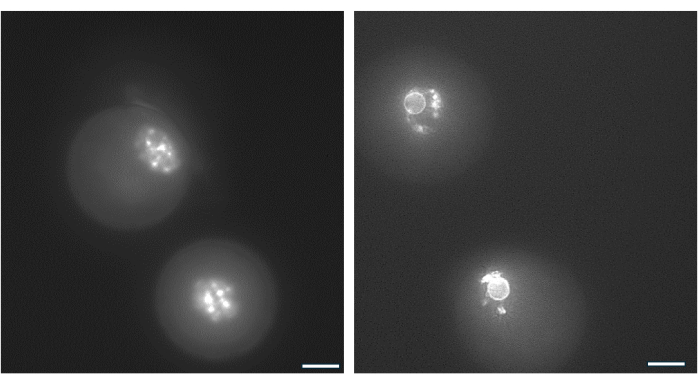
Abbildung 9: Chromatin-Reorganisation in GV-Oozyten. Die Chromatinanordnung in GV-Oozyten nach der Antrumbildung wurde durch Färbung der DNA mit Hoechst 33342 (50 ng/ml) untersucht. Repräsentative Follikel wurden durch schonendes Pipettieren aus HA-Kügelchen gewonnen. Granulosazellen wurden mittels Hyaluronidase entfernt. Die GV-Eizellen wurden dann 15 Minuten lang gefärbt (siehe Protokoll von Monti et al.38). Die Bilder wurden mit 40-facher Vergrößerung aufgenommen. (A) GV-Eizelle, die an Tag 1 bei Kulturbeginn gezeigt wurde und das Färbemuster für das nicht umgebende Chromatin (NSN) aufweist. (B) GV-Eizelle aus wachsendem Follikel mit Antrum, gezeigt am Tag des hCG-Triggers. Das Chromatin kondensierte und bildete einen perinukleären Ring um den Nukleolus. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Parameter | Frischer Eierstock | Gefrorener Eierstock | |
| FL-isoliert | FL-Cluster | FL-Cluster | |
| Follikel, die während der IVC beobachtet wurden | 130 | 154 | 69 |
| Eisprung nach HCG (%) | 71% | 66% | 93% |
| (92/130) | (101/154) | (64/69) | |
| Gesamtblutzucker (%) | 30% | 28% | 52% |
| (28/92) | (28/101) | (33/64) | |
| MII-Eizellbildung (%) | 59% | 55% | *34% |
| (54//92) | (56/101) | (22/64) | |
Tabelle 1: Ergebnisse mit HA-eingebetteten Follikeln aus frischen und vitrifizierten Eierstöcken. Follikel und FL-C aus frischen Eierstöcken wurden nach der Verkapselung in HA-Gel in vitro gereift. HA-Gel wurde auch an Follikeln aus Eierstöcken getestet, die mit einem EG/DMSO-Protokoll vitrifiziert wurden39. Bei frischen Eierstöcken wurden nach dem Kollagenaseverdau sowohl einzelne Follikel (FL) als auch Follikelcluster (FL-C) gesammelt. Bei vitrifizierten Eierstöcken war die Exposition gegenüber Kollagenase in der Tat schädlich für die Follikel. Der beste Ansatz bei kryokonservierten Eierstöcken bestand darin, FL-Cluster anstelle einzelner Follikel zu isolieren und nur eine mechanische Dissektion mit Nadeln zu verwenden. In der Tabelle werden die Ergebnisse zwischen HA-Kügelchen, die mit Follikeln besiedelt wurden, in Gruppen von 4-6 Follikeln und Kügelchen mit einem einzelnen FL-C mit 6-10 Follikeln verglichen. *Die Reifungsrate mit FL-C aus kryokonservierten Eierstöcken war signifikant niedriger (p = 0,008; Chi-Quadrat-Analyse zum Testen der Signifikanz).
| Träger | RI | CL |
| (Geschlossen) | (Geöffnet) | |
| Überleben (%) | 100% (24/24) | 100% (41/41) |
| Antrumbildung* (%) | 25.0% (6/24) | 75.6% (31/41)* |
| Ovulationsrate (%) | 66.7% (16/24) | 87.8% (36/41) |
| Reiferate (% MIIs) | 81.3% (13/16) | 69.4% (25/36) |
Tabelle 2: Ergebnisse nach Kryokonservierung von isolierten Follikeln auf zwei verschiedenen Vitrifikationsgeräten. Sowohl mit dem offenen CL-Baustein als auch mit dem geschlossenen RI-Träger mit seiner geringeren Kühlrate wurden hohe Reiferaten erreicht. Die Antrumbildung war das einzige Endpunktmaß, das sich als signifikant erwies, aber keinen Einfluss auf die Gesamtreifungsrate hatte (p < 0,05; Chi-Quadrat-Analyse zum Testen der Signifikanz).
Diskussion
Die Möglichkeit, die mechanischen Eigenschaften und die biologische Abbaubarkeit des tyramingebundenen HA-Hydrogels zu kontrollieren, bietet viele Vorteile für Tissue-Engineering-Anwendungen. Unser Labor ist das erste, das dieses spezielle HA-Gel für das Wachstum von Eierstockfollikeln anwendet. Dieses patentierte tyraminsubstituierte Natriumhyaluronat-Gel (TS-NAHY) ist ein neuartiges Hydrogel-System auf Hyaluronan-Basis, das an der Cleveland Clinic entwickelt wurde. Die Vernetzung des Gels wird durch die Exposition der Peroxidase in der aktivierten Gelmischung mit einem Oxidationsmittel angetrieben. Dies kann sowohl in vitro als auch in vivo erfolgen. Geformte TS-NAHY-Hydrogele weisen je nach Konzentration von Gel40 ein breites Spektrum an Eigenschaften auf, von schwachem Gel über eine Paste bis hin zu einem zerbrechlichen Feststoff.
Die enttäuschenden Fortschritte bei der Ovarialfollikelkultur unterstreichen die Notwendigkeit, neue Kulturmodelle zu entwickeln. Die Schaffung eines Kultursystems, das ausschließlich auf nativen extrazellulären Matrixkomponenten basiert, kann ein vorteilhafterer Ansatz sein. Das beschriebene HA-Kulturmodell ist auf physiologische Weise einfach zu verwenden, ohne dass zusätzliche ECM-Komponenten erforderlich sind. Das Gel ist transparent und ermöglicht eine detaillierte Visualisierung der Follikel. Die viskoelastischen Eigenschaften des HA-Gels erleichtern die Einstellung der Steifigkeit sowie der Formbarkeit. Diese Eigenschaft erhöht die Vielseitigkeit dieser Biomatrix. Die Steifigkeit einer Biomatrix kann sich auf die Proliferation von Granulosazellen und die Antrumbildung auswirken 30,41,42. Es wurde berichtet, dass Follikel, die aus Kulturumgebungen stammen, die für die Antrumbildung durchlässig sind, andere Genexpressionsprofile aufweisen als solche in einem nicht-unterstützenden Kultursystem43. Primatenfollikel scheinen eine starrere Matrix zu benötigen44. Die Anpassung der Biomatrix an die Bedürfnisse verschiedener Tierarten, einschließlich des Menschen, wird wahrscheinlich für eine erfolgreiche In-vitro-Reifung wichtig sein.
Für das Wachstum präantraler Follikel der Maus haben wir Gelkonzentrationen im Bereich von 2-5 mg/ml36 getestet. Die Reifungsraten der Eizellen lagen zwischen 44 % und 58 %. Höhere Konzentrationen des HA-Gels ermöglichten eine bessere Formbarkeit und Beibehaltung einer 3-D-Struktur, aber die Follikelexpansion wurde beeinträchtigt. Niedrigere HA-Konzentrationen ermöglichten eine radialere Ausdehnung des Follikels, erhöhten jedoch das Risiko, dass der Follikel vor dem Ende der IVC spontan extrudiert wurde. Die Konzentration von 3-3,5 mg/ml HA wirkte am besten bei präantralen Follikeln der Maus. Die Minimierung des Geltropfens war für die Bildung von HA-Gelkügelchen mit ausreichender Tiefe unerlässlich, um die Follikel während der gesamten IVC in einer 3-D-Konfiguration zu halten. Größere Tropfen flachten ab, was zum Abstieg der Follikel durch das Gel und zur Anhaftung an die Plattenoberfläche führte. Eine Einschränkung bei der Verwendung dieses Biomaterials zur Einbettung ist die extrem schnelle Gelierungszeit. Das macht es schwierig, mehr als zwei HA-Gelkügelchen auf einmal zu säen. Die Steigerung der Effizienz der Follikelaussaat in das HA-Gel ist ein Bereich, in dem wir versuchen, uns zu verbessern.
Die Kultivierung von Follikelclustern in einer 3D-Umgebung mit Hilfe von HA hat großes Potenzial. Die normale ovarielle Architektur bleibt erhalten, wobei unterschiedlich große Follikel miteinander und mit dem stützenden Stroma in Kontakt kommen. LH kann das Wachstum kleinerer präantraler Follikel im FL-C unterstützen, indem es Veränderungen in den früh differenzierenden thekalen Zellen induziert, daher wurde es in das FCM-Mediumaufgenommen 45. Die Fortsetzung der FL-C-Kultur über 12 Tage hinweg, um zu sehen, ob eine neue Wachstumswelle in einem der kleineren Follikel ausgelöst werden kann, die nach dem hCG-Auslöser noch eingebettet sind, muss weiter untersucht werden. Eine weitere Optimierung des Kulturmilieus kann eine Voraussetzung für die Kultivierung von Follikeln unterschiedlicher Größenbereiche in einem Gewebefragment sein. Ein Vorteil dieses 3-D-HA-Kulturmodells mit FL-C besteht darin, dass es eine genaue Nachahmung der in vivo Follikelanordnung und -interaktionen ermöglicht. Ein weiteres wichtiges Merkmal ist, dass im Gegensatz zu Calciumalginat und anderen Polymersystemen Eisprung und Reifung induziert werden können, ohne dass die Follikel physisch aus dem Gewebe oder der Gelmatrix entfernt werden müssen.
Die Zeit, die für die In-vitro-Follikelkultur und die Gewinnung reifer Eizellen zum Einfrieren benötigt wird, ist lang, insbesondere bei großen Säugetieren. Die Möglichkeit, geerntete Follikel oder Follikelcluster zu kryokonservieren, stellt eine Möglichkeit dar, diesen Schritt auf einen späteren und möglicherweise günstigeren Zeitpunkt zu verschieben. Wenn eine solche Technologie eines Tages während der Eierstockentnahme auf menschliche Follikel angewendet werden kann, könnte dies von Vorteil sein. Die Kryokonservierung des gesamten Eierstocks zur Erhaltung der Fruchtbarkeit ist derzeit die einzige Option für Patientinnen. Aber ob es tatsächlich die beste Methode ist, bleibt abzuwarten. In diesem Artikel stellen wir eine Vitrifikationsmethodik für die Kryokonservierung präantraler Follikel vor, die nach der 3-D-Kultur hervorragende Überlebens- und Reifungsraten nach der Erwärmung ermöglicht.
Abschließend haben wir ein neues 3-D-Kulturmodell unter Verwendung von Hyaluronan, einer Komponente der nativen ECM, beschrieben. Die HA-Verkapselungstechnik ermöglicht die Beibehaltung trophischer Faktoren in unmittelbarer Nähe der sich entwickelnden Follikel. Die Methodik für die Verkapselung in der Biomatrix ist einfach und kann sowohl isolierte Follikel als auch Follikelcluster aufnehmen. Letzteres kann neue Forschungswege eröffnen und Einblicke in die grundlegende Biologie der Follikulogenese und ihrer Regulation geben. Es wurde gezeigt, dass Eizellen aus HA-verkapselten Follikeln funktionell kompetent sind37. Diese Eizellen können befruchtet werden, in vitro Blastozysten bilden und sich beim Transfer auf pseudoschwangere Mäuse einnisten. Diese Daten bestätigen die Verwendung von Tyramin-gebundenem Hyaluronan als Biomatrix für die 3-D-Follikelkultur und die In-vitro-Eizellreifung. Dieses Protokoll könnte möglicherweise auf Eierstockfollikelkulturen in anderen Tiermodellen, einschließlich des Menschen, angewendet werden. Weitere mögliche Anwendungen für dieses 3-D-HA-Gelsystem könnten die Embryoidenkörper- und Organoidkultur sein.
Offenlegungen
Keine Interessenkonflikte oder Offenlegungen.
Danksagungen
Wir möchten dem gesamten Embryologie-Team der Cleveland Clinic für ihre Unterstützung sowie der REI-Abteilung und insbesondere Dr. Falcone für die Unterstützung danken. Dieses Projekt wurde durch einen Forschungsfonds an der Cleveland Clinic finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Anti-alpha tubulin-FITC labelled | Sigma-Aldrich | F2168 | |
| Anti-beta tubulin-FITC labelled | Sigma-Aldrich | F2043 | |
| BZ-X700 | Keyence | ||
| Center well dish | Fisher Scientific | 08-772-12 | |
| Collagenase Type I | Worthington Biochemical Corporation | LS004196 | |
| Crycap vial-vented | Hampton Research | HR4-904 | |
| Cryoloop | Hampton Research | HR4-974 | |
| Crystal cap | Hampton Research | HR4-733 | |
| Culture dish 60mm | Fisher Scientific | 08-772B | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Epidermal growth factor (EGF) | R &D Systems | 236-EG | |
| Ethylene Glycol (EG) | Sigma-Aldrich | 293237 | |
| Fetal Bovine Serum-Heat Inactivated | ThermoFisher Scientific | 10082-147 | |
| Follicle Stimulating Hormone (FSH) | Sigma-Aldrich | F4021 | |
| Global-Hepes medium | CooperSurgical | LGGH-100 | |
| Hoechst 33342 | Sigma-Aldrich | B2261 | |
| Human chorionic gonadotrophin (hCG) | Sigma-Aldrich | CG10 | |
| Human serum albumin | CooperSurgical | GHSA-125 | |
| Hyaluronidase | CooperSurgical | ART-4007-A | |
| Hydrogen Peroxide | CVS Pharmacy Inc. | 372441 | |
| Insulin-transferrin-selenium (ITS) | ThermoFisher Scientific | 41400-045 | |
| Leibovitz medium (L-15) | ThermoFisher Scientific | 11415-064 | |
| Luteinizing hormone | Sigma-Aldrich | L9773 | |
| Magnetic wand | Hampton Research | HR4-729 | |
| Micropipettes (1000 µm) | Minitube | 19025/0050 | |
| Micropipettes (175 , 200, and 275µm) | CooperSurgical | MXL3-175, MXL3-200, MXL3-275 | |
| Millex GV filter 0.22 µm | Millipore | SLGU033RS | |
| Mineral oil | CooperSurgical | LGOL-500 | |
| Minimum Essential Medium alpha (MEM) | ThermoFisher Scientific | 32561-037 | |
| Oocyte Imaging System-Spindleview | Hamilton Thorne | ||
| Phosphate buffered saline (PBS) | ThermoFisher Scientific | 10010-023 | |
| Propidium iodide | Sigma-Aldrich | P4170 | |
| Rapid i | VitroLife | 14406 | |
| SmartBox | VitroLife | 14423 | |
| Synthetic Protein Substitute (SPS) | CooperSurgical | ART-3011 | |
| Tyramine -linked Hyaluronan Biohydrogel Kit | LifeCore | ENG-00151 | |
| Ultrasonic sealer | VitroLife | 14415 | |
| Universal GPS Culture dish 8x 100 µl wells | CooperSurgical | UGPS-010 |
Referenzen
- Telfer, E. E., Andersen, C. Y. In vitro growth and maturation of primordial follicles and immature oocytes. Fertil Steril. 115 (5), 1116-1125 (2021).
- Telfer, E. E., McLaughlin, M. Natural history of the mammalian oocyte. Reprod Biomed Online. 15 (3), 288-295 (2007).
- Xiao, S., et al. In vitro follicle growth supports human oocyte meiotic maturation. Sci Rep. 5, 17323 (2015).
- Carabatsos, M. J., Sellitto, C., Goodenough, D. A., Albertini, D. F. Oocyte-granulosa cell heterologous gap junctions are required for the coordination of nuclear and cytoplasmic meiotic competence. Dev Biol. 226 (2), 167-179 (2000).
- Diaz, F. J., Wigglesworth, K., Eppig, J. J. Oocytes are required for the preantral granulosa cell to cumulus cell transition in mice. Dev Biol. 305 (1), 300-311 (2007).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biol Reprod. 73 (2), 351-357 (2005).
- Dadashzadeh, A., Moghassemi, S., Shavandi, A., Amorim, C. A. A review on biomaterials for ovarian tissue engineering. Acta Biomater. 135, 48-63 (2021).
- Simon, L. E., Kumar, T. R., Duncan, F. E. In vitro ovarian follicle growth: a comprehensive analysis of key protocol variablesdagger. Biol Reprod. 103 (3), 455-470 (2020).
- Belli, M., et al. Towards a 3D culture of mouse ovarian follicles. Int J Dev Biol. 56 (10-12), 931-937 (2012).
- Berkholtz, C. B., Shea, L. D., Woodruff, T. K. Extracellular matrix functions in follicle maturation. Semin Reprod Med. 24 (4), 262-269 (2006).
- Desai, N., et al. Three-dimensional in vitro follicle growth: overview of culture models, biomaterials, design parameters and future directions. Reprod Biol Endocrinol. 8, 119 (2010).
- Shea, L. D., Woodruff, T. K., Shikanov, A. Bioengineering the ovarian follicle microenvironment. Annu Rev Biomed Eng. 16, 29-52 (2014).
- Paulini, F., et al. Survival and growth of human preantral follicles after cryopreservation of ovarian tissue, follicle isolation and short-term xenografting. Reprod Biomed Online. 33 (3), 425-432 (2016).
- West, E. R., Xu, M., Woodruff, T. K., Shea, L. D. Physical properties of alginate hydrogels and their effects on in vitro follicle development. Biomaterials. 28 (30), 4439-4448 (2007).
- Joo, S., et al. The effect of collagen hydrogel on 3D culture of ovarian follicles. Biomed Mater. 11 (6), 065009 (2016).
- Telfer, E., Torrance, C., Gosden, R. G. Morphological study of cultured preantral ovarian follicles of mice after transplantation under the kidney capsule. J Reprod Fertil. 89 (2), 565-571 (1990).
- Torrance, C., Telfer, E., Gosden, R. G. Quantitative study of the development of isolated mouse pre-antral follicles in collagen gel culture. J Reprod Fertil. 87 (1), 367-374 (1989).
- Dong, C., Yonggang, L. V. Application of collagen scaffold in tissue engineering: recent advances and new perspectives. Polymers. 8 (2), 42 (2016).
- Le, B. A. M., et al. Agarose-based 3D culture improved the developmental competence of oocyte-granulosa complex isolated from porcine preantral follicle. Theriogenology. 223, 11-21 (2024).
- Park, J. E., et al. In vitro maturation on an agarose matrix improves the developmental competence of porcine oocytes. Theriogenology. 157, 7-17 (2020).
- Zaniker, E. J., et al. Three-dimensionally printed agarose Micromold supports scaffold-free mouse ex vivo follicle growth, ovulation, and luteinization. Bioengineering. 11 (7), 719 (2024).
- Pangas, S. A., Saudye, H., Shea, L. D., Woodruff, T. K. Novel approach for the three-dimensional culture of granulosa cell-oocyte complexes. Tissue Eng. 9 (5), 1013-1021 (2003).
- West, E. R., Shea, L. D., Woodruff, T. K. Engineering the follicle microenvironment. Semin Reprod Med. 25 (4), 287-299 (2007).
- Xu, J., et al. Survival, growth, and maturation of secondary follicles from prepubertal, young, and older adult rhesus monkeys during encapsulated three-dimensional culture: effects of gonadotropins and insulin. Reproduction. 140 (5), 685-697 (2010).
- Xu, M., Kreeger, P. K., Shea, L. D., Woodruff, T. K. Tissue-engineered follicles produce live, fertile offspring. Tissue Eng. 12 (10), 2739-2746 (2006).
- Amorim, C. A., Van Langendonckt, A., David, A., Dolmans, M. M., Donnez, J. Survival of human pre-antral follicles after cryopreservation of ovarian tissue, follicular isolation and in vitro culture in a calcium alginate matrix. Hum Reprod. 24 (1), 92-99 (2009).
- Converse, A., Zaniker, E. J., Amargant, F., Duncan, F. E. Recapitulating folliculogenesis and oogenesis outside the body: encapsulated in vitro follicle growth dagger. Biol Reprod. 108 (1), 5-22 (2023).
- Mainigi, M. A., Ord, T., Schultz, R. M. Meiotic and developmental competence in mice are compromised following follicle development in vitro using an alginate-based culture system. Biol Reprod. 85 (2), 269-276 (2011).
- Kreeger, P. K., Deck, J. W., Woodruff, T. K., Shea, L. D. The in vitro regulation of ovarian follicle development using alginate-extracellular matrix gels. Biomaterials. 27 (5), 714-723 (2006).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. Interpenetrating fibrin-alginate matrices for in vitro ovarian follicle development. Biomaterials. 30 (29), 5476-5485 (2009).
- Griffith, L. G., Swartz, M. A. Capturing complex 3D tissue physiology in vitro. Nat Rev Mol Cell Biol. 7 (3), 211-224 (2006).
- Irving-Rodgers, H. F., Rodgers, R. J. Extracellular matrix of the developing ovarian follicle. Semin Reprod Med. 24 (4), 195-203 (2006).
- Salustri, A., Camaioni, A., Di Giacomo, M., Fulop, C., Hascall, V. Hyaluronan and proteoglycans in ovarian follicles. Hum Reprod Update. 5, 293 (1999).
- Rashki Ghaleno, L., Cristian, P. P., Shahverdi, A., Dardmeh, F., Alipour, H., Valojerd, M. R. Exploring the role of hyaluronic acid in reproductive biology and beyond: Applications in assisted reproduction and tissue engineering. Adv. Biology. 8 (6), e202300621 (2024).
- Desai, N. N., Goldberg, J. M., Austin, C., Falcone, T. The new Rapid-i carrier is an effective system for human embryo vitrification at both the blastocyst and cleavage stage. Reprod Biol Endocrinol. 11, 41 (2013).
- Desai, N., Abdelhafez, F., Calabro, A., Falcone, T. Three dimensional culture of fresh and vitrified mouse pre-antral follicles in a hyaluronan-based hydrogel: a preliminary investigation of a novel biomaterial for in vitro follicle maturation. Reprod Biol Endocrinol. 10 (1), 29 (2012).
- Desai, N., Spangler, M., Nanavaty, V., Gishto, A., Brown, A. New hyaluronan-based biomatrix for 3-D follicle culture yields functionally competent oocytes. Reprod Biol Endocrinol. 20 (1), 148 (2022).
- Monti, M., Redi, C. A. Isolation and characterization of mouse antral oocytes based on nucleolar chromatin organization. J Vis Exp. (107), e53616 (2016).
- Huang, L., et al. Cryopreservation of human ovarian tissue by solid-surface vitrification. Eur J Obstet Gynecol Reprod Biol. 139 (2), 193-198 (2008).
- Chan, J., Darr, A., Alam, D., Calabro, A. Investigation of a novel cross-linked hyaluronan hydrogel for use as a soft-tissue filler. Am J Cosmetic Sur. 22, 105-108 (2005).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. A method for ovarian follicle encapsulation and culture in a proteolytically degradable 3-dimensional system. J Vis Exp. (49), e2695 (2011).
- Xu, M., West, E., Shea, L. D., Woodruff, T. K. Identification of a stage-specific permissive in vitro culture environment for follicle growth and oocyte development. Biol Reprod. 75 (6), 916-923 (2006).
- West-Farrell, E. R., et al. The mouse follicle microenvironment regulates antrum formation and steroid production: alterations in gene expression profiles. Biol Reprod. 80 (3), 432-439 (2009).
- Xu, M., et al. Encapsulated three-dimensional culture supports development of nonhuman primate secondary follicles. Biol Reprod. 81 (3), 587-594 (2009).
- Wu, J., Nayudu, P. L., Kiesel, P. S., Michelmann, H. W. Luteinizing hormone has a stage-limited effect on preantral follicle development in vitro. Biol Reprod. 63 (1), 320-327 (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten