Method Article
Aplicación de un nuevo hidrogel de hialuronano para el cultivo tridimensional de folículos y metodología para la criopreservación de folículos ováricos de ratón
En este artículo
Resumen
Este protocolo describe un nuevo modelo de cultivo tridimensional (3-D) que utiliza un hidrogel de hialuronano unido a tiramina para encapsular y cultivar folículos preantrales del ovario de ratón. También detallamos dos enfoques para la criopreservación de folículos ováricos por vitrificación.
Resumen
La arquitectura 3D del folículo ovárico y las complejas interacciones entre los componentes de la célula somática y el ovocito que son necesarias para la maduración citoplasmática y nuclear son difíciles de mantener en los sistemas de cultivo bidimensionales (2-D) convencionales. Describimos un nuevo modelo de cultivo en 3D que utiliza un hidrogel de hialuronano unido a tiramina para la encapsulación y el cultivo de folículos ováricos de ratón. La técnica de encapsulación de hialuronano permite el crecimiento 3D de los folículos y la retención de factores tróficos en las proximidades de los folículos en desarrollo. Este hidrogel es muy versátil y se puede aplicar tanto a folículos aislados como a fragmentos de tejido ovárico. Las propiedades viscoelásticas del gel de HA permiten ajustar la rigidez y la moldeabilidad en función de la concentración del gel. Los folículos preantrales que se desarrollan en este modelo de cultivo son capaces de completar la maduración meiótica dentro de los 10-12 días posteriores al cultivo y ovular un ovocito en metafase II al desencadenarse con hCG. Este artículo también detalla dos enfoques para la criopreservación de folículos ováricos mediante vitrificación.
Introducción
La foliculogénesis humana in vitro sigue siendo un desafío incluso cuatro décadas después del primer nacimiento de la fertilización in vitro. Hasta la fecha, aún no se cuenta con una metodología para el cultivo de folículos ováricos humanos que apoye la producción de un embrión viable que dé lugar a un bebé sano1. Las propiedades físicas óptimas necesarias para el crecimiento del folículo humano in vitro aún no se han determinado. El ovario intacto está poblado por miles de folículos en diversas etapas de desarrollo, y la regulación de su crecimiento es un proceso complejo (Figura 1)2. Los ovocitos en etapa de vesícula germinal (GV) de folículos preantrales humanos tardan hasta 30 días en cultivo para madurar meióticamente y alcanzar la etapa 3 de metafaseII. La comunicación bidireccional entre el ovocito y las células granulosas circundantes a través de uniones gap es crítica para la maduración citoplasmática y nuclear 4,5,6.
Los sistemas de cultivo 2D convencionales no son ideales para el cultivo de folículos, especialmente en modelos de mamíferos más grandes que requieren un tiempo prolongado en cultivo. Los folículos se adhieren a la placa y el enlace entre las células de la granulosa y el ovocito se vuelve más tenue a medida que las células de la granulosa migran. Por lo tanto, los sistemas de cultivo tridimensional (3-D) para folículos han surgido como un medio para imitar más de cerca la fisiología in vivo 7,8.
La encapsulación de folículos dentro de una matriz para promover el crecimiento en 3D ha sido un enfoque para preservar la arquitectura folicular durante el cultivo in vitro (IVC). Se han probado biomatrices de polímeros naturales (como colágeno, agarosa, fibrina, alginato y ácido hialurónico), así como polímeros sintéticos (como polietilenglicol, alcohol polivinílico y ácido poliglicólico) 7,9,10,11,12,13. Se ha demostrado que las propiedades mecánicas de una biomatriz influyen en la difusión de nutrientes, la diferenciación de las células tecales, la formación de antros y la secreción hormonal14. El colágeno, como parte de la matriz extracelular (MEC) natural de la célula, es una de las matrices más tempranas probadas e inicialmente prometía 15,16,17. Sin embargo, la logística de estandarización de las preparaciones de colágeno, las malas propiedades mecánicas y la estabilidad han limitado su uso18. La agarosa ha sido probada en complejos cúmulo-ovocito (COC) liberados por los folículos antrales, así como en folículos primordiales19,20. Más recientemente, un molde de agarosa impreso en 3D se ha mostrado prometedor para el cultivo de folículos sin andamio21. La encapsulación de alginato de calcio, reportada por primera vez en 2003, ha sido, hasta la fecha, el sistema más ampliamente estudiado para la VCI22. Se ha probado en ratones, bovinos, monos y folículos humanos 23,24,25,26,27. Con el alginato de calcio, los folículos se cargan individualmente en microgotas del polímero y se exponen al cloruro de calcio para generar una perla de gel. La extracción de los folículos de la perla requiere un tratamiento con un agente quelante. Sin embargo, esta matriz tiene algunos inconvenientes. El alginato es un polisacárido aislado de las algas y, aunque proporciona soporte, no forma parte de la matriz extracelular natural del folículo. Los datos sugieren una mayor incidencia de defectos del huso después de la VCI en el alginato28. Modificaciones posteriores del sistema mediante la combinación de alginato con fibrina u otros componentes de la matriz extracelular (MEC) han ayudado a que el sistema de alginato de calcio sea más efectivo29,30.
Cada vez hay más evidencias que apuntan a la matriz extracelular como un modulador clave en el crecimiento celular 10,31,32 . No solo proporciona apoyo, sino que desempeña un papel fundamental en la adhesión, la función, el crecimiento y la comunicación de las células. Uno de los principales componentes de la MEC es el hialuronano, un glicosaminoglicano natural. En el folículo ovárico, el hialuronano es producido por las células de la granulosa y contribuye a la integridad estructural y la función del folículo en desarrollo33,34. Por lo tanto, la integración del hialuronano en un modelo de cultivo de folículos puede ayudar a crear un entorno más fisiológico y mejorar la producción de ovocitos funcionalmente competentes.
Este trabajo describe la novedosa aplicación de un hialuronano ligado a la tiramina como biomatriz para el cultivo de folículos ováricos frescos y congelados y la maduración in vitro de ovocitos (IVM). También detallamos técnicas para la criopreservación de folículos por vitrificación en dos tipos de dispositivos. Un método implica la inmersión directa en nitrógeno líquido, mientras que en el segundo método, los folículos se encierran en una pajita antes de la inmersión. El objetivo principal es demostrar que, a pesar de las diferencias, tanto las metodologías como los dispositivos pueden utilizarse de forma fiable para la criopreservación de folículos.
Protocolo
Todos los experimentos con animales se llevaron a cabo bajo los protocolos institucionales de Uso y Cuidado de Animales de Cleveland Clinic y siguiendo las pautas y regulaciones de los Institutos Nacionales de Salud para el Cuidado y Uso de Animales de Laboratorio.
1. Preparación media
NOTA: Los medios que se describen a continuación se utilizarán para los diferentes pasos de este procedimiento: manipulación del tejido ovárico (OT), digestión de la colagenasa OT, cultivo de folículos (FCM) y vitrificación. Prepare todo el medio en una campana de cultivo de tejidos utilizando una técnica estéril.
- Medio de manipulación de tejido ovárico
- Complemente 20 mL del medio de Leibovitz (L-15) con un 0,1% de suero fetal bovino (FBS) en un matraz de cultivo de tejidos de 50 mL (T-50).
- Tape herméticamente y coloque el matraz en la incubadora durante la noche para que se caliente a 37 °C antes de usarlo. Este medio se utiliza para manipular tejido ovárico y folículos fuera de la incubadora y no requiereCO2 para mantener un pH de 7,2 a 7,4
PRECAUCIÓN: No exponga los platos al gas CO2 o el medio se volverá ácido.
- Medio de digestión de colagenasa
- En la mañana de la recolección del folículo, agregue 1 mg de colagenasa tipo I (295 U/mg) al tubo de ensayo con 2,2 mL de medio de manejo OT precalentado. La concentración final deseada de colagenasa es de 134 U/mL Filtrar esterilizar con un filtro de jeringa de 0,22 μm. Tape herméticamente y colóquelo en el bloque de calentamiento.
- Medio de cultivo de folículos y aceite
- Preparar 30 mL de Medio Esencial Mínimo alfa suplementado con un 5% de suero fetal bovino en un matraz T-50. Suplementar con 100 mUI/mL de FSH, 10 mUI/mL de LH, 10 μg/mL de insulina, 5 μg/mL de transferrina y 5 ng/m de selenio.
- Preequilibre el FCM a 37 °C con 6% de CO2 y aire durante la noche en la incubadora antes de su uso.
- Coloque 50 ml de aceite mineral en un matraz, tape sin apretar y equilibre durante la noche en la incubadora.
- Medios de vitrificación para FL y FL-Clusters
- El medio basal para todas las soluciones es Global-Hepes suplementado con un 20% de sustituto de proteínas sintéticas. Prepare 20 mL de solución VS1 con 7,5% de etilenglicol (EG) y 7,5% de dimetilsulfóxido (DMSO) en medio basal.
- Preparar 20 mL de VS2 con 15% de EG, 15% de DMSO y 0,5 M de sacarosa en medio basal. Esterilice todas las soluciones con un filtro de jeringa de 0,22 μm y almacene a 4 °C hasta su uso. Las soluciones se pueden utilizar hasta por 4 semanas.
- Medios de calentamiento para folículos vitrificados y FL-Clusters
- El medio basal para todas las soluciones es Global-Hepes suplementado con un 20% de sustituto de proteínas sintéticas. Preparar 20 mL de medio basal con 0,25 M de sacarosa. Etiqueta como WS1.
- Prepare 20 mL de medio basal con 0,125 M de sacarosa y etiquételo como WS2. Esterilizar con filtro de jeringa de 0,22 μm. Almacene las soluciones a 4 °C durante un máximo de 4 semanas.
2. Recolección de ovarios
- Eutanasia a cachorros B6D2F1 de 10 a 14 días de edad mediante dislocación cervical (sin anestesia). Use 3-4 crías para obtener 250-300 folículos preantrales intactos para la experimentación.
- Acueste al animal boca arriba y frote el vientre con alcohol isopropílico al 70%. Haz un pequeño corte horizontal en la línea media con unas tijeras limpias. Agarre la piel por encima y por abajo, corte con pinzas finas y tire en ambas direcciones (hacia la cabeza y los pies) para exponer el abdomen.
- Con un segundo juego de tijeras limpias y pinzas finas, corte la pared abdominal. Levanta las espirales intestinales. Localiza los cuernos uterinos, los oviductos y los ovarios. Extirpar los ovarios y colocar en un plato de pocillo central que contenga 1 mL de medio de manipulación OT calentado a 37 °C.
- Con un microscopio de disección, recorte la grasa y el tejido oviductal. Bisecta los ovarios.
3. Aislamiento de folículos y grupos FL-C (FL-C)
- Utilice una campana de flujo laminar con una superficie calentada a 37 °C para el aislamiento y la manipulación de los folículos. Trabaje asépticamente en el capó. Ten cuidado con el plato de FCM. Utilice el burbujeador para mantener el plato gaseado con un 5% de CO2 cuando trabaje en la campana de flujo laminar.
NOTA: Todas las soluciones deben precalentarse a 37 °C. El medio FCM, así como el aceite mineral, deben preequilibrarse durante la noche en una incubadora a 37 °C con 6% de CO2 antes de su uso. El pH medio cambiará cuando esté fuera de la incubadora durante más de 10 minutos. - Pipetear 6 mL de FCM preequilibrado en dos platos de 60 mm y recubrir con aceite mineral. Vuelva a colocarlo en la incubadora.
- Pipetear 1 mL de colagenasa en una placa de pocillo central y 3 mL de medio OT en la pared externa. Mover los ovarios a una solución de colagenasa con una micropipeta de vidrio (1000 μm). Incubar la placa durante 30-40 min en la superficie calentada de la campana de flujo laminar.
- Al final de la incubación de la colagenasa, pipetear 6 mL de medio OT en dos placas de cultivo de tejidos de 60 mm marcadas con las líneas 1 y 2. Coloque sobre la superficie cálida de la campana.
- Con una micropipeta, mueva los ovarios tratados con colagenasa al pocillo exterior para enjuagar y liberarlos de colagenasa. Cambie las micropipetas y luego mueva los ovarios a la placa OT 1.
- Extraiga folículos de cada ovario con una pipeta P200. Liberación de folículos por aspiración repetida y expulsión del ovario tratado con enzimas a través de la punta de la pipeta cortada a diferentes tamaños. La separación mecánica del tejido en fragmentos con dos agujas de 27G antes del pipeteo también es útil para liberar folículos individuales. Cada cría de ratón debe producir entre 60 y 75 folículos intactos del tamaño deseado.
- Si es necesario, devuelva los trozos de ovario no disociados a la colagenasa durante otros 5-10 minutos, enjuague y repita el pipeteo para liberar más folículos.
NOTA: La sobreexposición a la colagenasa provocará la alteración de las capas de células de la granulosa que rodean al ovocito. No intente romper todo el ovario. Detenerse una vez que se hayan recolectado 250-300 folículos. - Examine los folículos liberados con un microscopio de disección con un aumento de 40x. Identificar folículos preantrales secundarios (~120 -140 μm de diámetro) con un ovocito ubicado en el centro encerrado dentro de una membrana basal intacta (lámina basal). Este tamaño de folículo suele tener de 2 a 4 capas de células de la granulosa que rodean el óvulo (véase la figura 1).
NOTA: Compare los folículos con la abertura de una punta de micropipeta de 175 μm para aproximar el tamaño del folículo. El folículo debe tener un tamaño aproximado de 3/4 del diámetro de la pipeta. Este es el método más rápido para seleccionar folículos del tamaño deseado. - Con una micropipeta de 175 μm, mueva los folículos seleccionados a la placa OT2. Una vez finalizada la recolección, enjuague todos los folículos en el plato FCM1 para eliminar cualquier rastro del medio OT. Luego transfiera al plato FCM2.
- Coloque el plato en una incubadora durante 60 minutos antes de comenzar el proceso de incrustación.
- Para el aislamiento del grupo de folículos, realice los pasos 3.1 a 3.5. Utilice dos jeringas de tuberculina (27 G) para separar el ovario en fragmentos y luego en pequeños grupos de 6-10 folículos.
NOTA: El cultivo de grupos de folículos (FL-C) es una alternativa al cultivo de folículos individuales. Este método conserva la arquitectura folicular nativa junto con los componentes estromales. El tamaño del folículo en FL-C no es uniforme. Los folículos conservan su configuración in vivo con folículos primordiales, primarios y secundarios presentes. - Recoja estos grupos de folículos (FL-C) con una micropipeta de 200 μm en la placa OT2. Una vez finalizada la recolección, enjuague todo el FL-C y transfiéralo a FCM2 para esperar la incrustación.
4. Incrustación de folículos y grupos de folículos
- Prepare una solución madre de 10 mg/ml de hidrogel de hialuronano (HA) activado unido a la tiramina. Rehidrate 250 mg de polvo de hialuronato de sodio sustituido por tiramina con 25 mL de enzima peroxidasa de rábano picante (HRP; 10 UI/mL) en solución salina tamponada con fosfato. Una vez solubilizado, almacene 500 μL de alícuotas de este caldo de AH activado a -4 °C para futuros experimentos.
- Para experimentos con folículos, descongele la solución madre de AH y dilúyala hasta una concentración de 3 mg/mL en un medio global calentado a 37 °C. Realice todos los pasos de incrustación en una campana de flujo laminar con una superficie de banco calentada a 37 °C. Utilice una placa de 60 mm con ocho pocillos de 100 μL para la inclusión y posterior cultivo de folículos.
- Mueva los folículos o los grupos de FL que se incrustarán de la placa de FCM a una gota de gel de HA para enjuagar sin necesidad de medio de cultivo. El medio de seguimiento interferirá con la formación de gel. Vuelva a colocar el plato FCM debajo del burbujeador para gasear.
NOTA: Los folículos aislados se pueden incrustar, individualmente o en grupos, dependiendo del experimento. Por lo general, preferimos sembrar de 2 a 4 folículos por cuenta. - Coloque 1 μL de peróxido de hidrógeno al 0,03% (H2O2) en una placa de Petri. Agregue 25 μL de gel de HA de 3 mg/mL sobre la gota de peróxido de hidrógeno y mezcle mediante pipeteo para iniciar la reticulación (ver Figura 2).
- Con una pipeta P20, extraiga la mezcla HA-H2O2 y pipetee una gota (~8-10 μL) en dos pocillos separados de la placa de cultivo de 8 pocillos. Evita hacer burbujas.
- Con una micropipeta de 200 μm, transfiera rápidamente los folículos o un FL-C al centro de cada gota (Figura 3). La velocidad es importante, ya que una vez que el HA se expone al catalizador (peróxido), comenzará a gelificarse en 1-2 minutos. Tenga cuidado de no introducir burbujas durante la siembra.
NOTA: Para rastrear el crecimiento de los folículos individuales, coloque los folículos a una distancia entre sí. No coloque los folículos demasiado cerca de la parte inferior del gel o, de lo contrario, durante la VCI pueden descender lo suficiente como para adherirse. - Espere ~ 3 minutos para completar el proceso de gelificación y luego agregue 100 μL de FCM preequilibrado a cada pocillo. Repita este proceso y cargue los folículos en los ocho pocillos. Cubra con aceite mineral preequilibrado tibio y coloque el plato en una incubadora.
5. Vitrificación de folículos y grupos FL
NOTA: La vitrificación se puede realizar utilizando un portador abierto (Cryoloop; CL), que permite el contacto directo con nitrógeno líquido, o bien un portador cerrado (Rapid I; RI), donde la muestra está sellada dentro de una pajita exterior y, por lo tanto, nunca entra en contacto con nitrógeno líquido. En la figura 4 se muestran los dispositivos y contrastes de los dos sistemas de vitrificación. La vitrificación en ambos dispositivos ha demostrado ser eficaz para la criopreservación de embriones35.
- Vitrificación RI de portador cerrado
- Precalentar 2 mL de alícuotas de soluciones VS a 37 °C en un bloque calentado. Realice todos los pasos de vitrificación en la superficie calentada de la campana de flujo laminar utilizando un microscopio de disección para visualizar el folículo y el portador.
- Llene la caja criogénica aislada con nitrógeno líquido (LN2). Coloque la pajita exterior del dispositivo en una ranura de sujeción dentro de la caja para que quede parcialmente sumergida en nitrógeno líquido. Coloque el palo de plástico interior con un pequeño orificio a través de la tapa de una placa de Petri en preparación para la carga.
- Coloque dos gotas de VS1 una al lado de la otra en una placa de Petri cerca de la parte superior. Utilice una micropipeta de 200 μm para colocar dos folículos en la primera gota. Enjuague y pase rápidamente a la segunda gota de VS1. Incubar durante 5 min. Si vitrifica clústeres de FL, procese un solo clúster a la vez.
- Coloque tres gotas de VS2 una al lado de la otra en el mismo plato cuando la primera incubación esté casi completa. A continuación, mueva rápidamente los folículos secuencialmente a través de las tres gotas VS2 en un plazo de 60 s y cárguelos en el portador. Tenga cuidado de extraer una cantidad mínima de líquido con los folículos para evitar seguir el medio de una gota a otra.
- Para cargar el portador, recoja dos folículos y deposítelos con un mínimo de líquido en el pequeño orificio del palo de plástico. El volumen final de líquido en el orificio es minúsculo < 0,5 μL. Evite el llenado excesivo, lo que hace que el líquido se derrame fuera del orificio y caiga sobre el palo de plástico.
- Coloque el palo en la pajita exterior preenfriada. Utilice el sellador ultrasónico para cerrar y sellar la pajita. Coloque la pajita en una copa unida al criocano. Se pueden colocar hasta 4 pajitas en la misma copa.
- Cubra el bastón con una funda protectora de plástico. Sumerge la caña en un tanque de almacenamiento de nitrógeno líquido (LN2).
- Vitrificación de CL de portador abierto
- Precalentar soluciones VS a 37 °C. Realice todos los pasos de vitrificación en la superficie calentada de la campana de flujo laminar. Prepare con anticipación el número de portadores abiertos CL necesarios. Inserte el vástago metálico CL en la tapa del vial magnetizado, asegurándose de que se sujete firmemente (use una pequeña cantidad de adhesivo si es necesario).
- Llene la criocaja aislada con nitrógeno líquido (LN2). Coloque una rejilla en la caja criogénica para sostener los crioviales de manera que el LN2 quede por debajo de la parte superior del vial.
- Llene el vial especial magnetizado y ventilado con LN2. Colócalo en la rejilla. Realice los pasos de vitrificación como se describe en los pasos 6.1.3 a 6.1.5. La única diferencia es que normalmente procesamos cinco folículos a la vez. Una vez más, tenga cuidado de minimizar el rastro del líquido de gota a gota.
- Para cargar los folículos, sujete el soporte abierto CL por su tapa magnética adjunta con la varilla metálica. Sumerja el portador abierto CL en una gota separada de VS2 para crear una película de crioprotector.
- Con una micropipeta, recoja todos los folículos o el FL-Cluster y colóquelos en la película con un mínimo de líquido. Trabaje rápidamente, ya que los folículos deben cargarse antes de que la película comience a secarse.
- Sumerja inmediatamente el CL en el criovial lleno de LN2 para vitrificar la muestra. Tape y coloque el vial sobre el criocano. Cubra con una funda de plástico. Sumerge la caña en un tanque de almacenamiento de nitrógeno líquido.
6. Calentamiento de folículos vitrificados y grupos FL
- Calentamiento del portador cerrado RI
- Prepare un plato de pocillo central con 3 mL de FCM preequilibrado en el pocillo exterior y 1 mL en el pocillo central. Cubra con aceite y colóquelo en la incubadora.
- Coloque 0,5 mL de WS1 y WS2 precalentados en dos platos de pocillos centrales etiquetados. Mueva los bastones con muestras del tanque de almacenamiento a una caja criogénica llena de LN2.
- Retire la cubierta de plástico del bastón. Retire la pajita de la copa, manteniéndola sumergida, y deslícela en la ranura de sujeción de la caja criogénica.
- Con unas tijeras finas, corte la pajita exterior justo por encima del punto negro que indica la parte superior del portador IR interno con folículos.
- Con pinzas finas, levante el palo de plástico interior ligeramente fuera de la pajita exterior. Sujete el dispositivo y sumerja rápidamente la varilla en WS1, girándola suavemente para descargar los folículos. La velocidad es fundamental. Los folículos deben descargarse en WS1 en un plazo de 10 s.
- Use un microscopio de disección para visualizar los folículos y asegurarse de que todos se hayan descargado del portador. Después de 2 minutos en WS1, utilice una micropipeta para mover todos los folículos (o FL-Cluster) a WS2, teniendo cuidado de no seguir el medio.
- Después de 3 minutos, enjuague los folículos en el pocillo exterior del plato FCM y luego muévalos al pocillo central. Vuelva a colocar en la incubadora durante 1-2 h antes de incrustar.
- CL Calentamiento de portador abierto
- Prepare los platos FCM y WS como se describe anteriormente. Mueva la caña con folículos de un tanque de almacenamiento a una caja criogénica llena de LN2. Retire la cubierta de plástico del bastón.
- Utilice la varilla magnética para levantar la tapa criovial, hasta que el vástago metálico del CL sea visible.
- Con unas pinzas, agarre el vástago metálico. Retire el CL del vial y sumérjalo rápidamente en WS 1, girando suavemente para descargar los folículos. Descargue en WS1 en 10 s. Con un endoscopio de disección, verifique que se hayan descargado todos los folículos
- Todos los pasos restantes para el calentamiento son los mismos que con los pasos de portadora cerrada RI a partir del paso 7.1.6.
7. Imágenes de folículos y grupos FL y cambio de medios
- Monitoree los folículos y los grupos de FL en los pocillos durante el intervalo de cultivo de 10 a 12 días utilizando un microscopio de luz invertida con óptica de modulación de contraste Hoffman y equipado con una cámara de alta definición. Utilice el software de generación de imágenes para capturar imágenes con un aumento total de 40x y 100x o 200x, según el tamaño.
- Diagnóstico por imágenes y evaluación de folículos
- En el día 1 del cultivo, después de la incrustación, se tomaron imágenes de todos los pocillos de cultivo con un aumento de 40x y 200x utilizando un microscopio invertido para establecer la morfología y el tamaño de la línea de base. Regrese el plato a la incubadora.
- Vea imágenes y registre el número de folículos completamente incrustados en cada perla de gel. En el caso de la FL-C, haga una estimación del número de folículos al comienzo del cultivo.
- Con un software de diagnóstico por imágenes, mida el diámetro del folículo a lo largo de planos verticales y horizontales desde el borde de la membrana basal. Mida el tamaño de los ovocitos de manera similar desde el borde exterior de la zona. Registre los valores medios. Tome una medida vertical y horizontal del diámetro del racimo.
- Continúe tomando imágenes de cultivos cada 2-3 días. Mida los diámetros de los folículos que no están en contacto entre sí. Con FL-C, los grupos se agrupan durante la IVC, por lo que todo el grupo se puede medir en el plano vertical y horizontal.
NOTA: En el caso de los folículos agrupados muy juntos, es posible que los bordes individuales de los folículos no sean discernibles después del día 4 de cultivo, por lo que no se toman mediciones. - Clasificar los folículos que se vuelven oscuros o apoptóticos, así como aquellos en los que el ovocito ya no está rodeado de células de la granulosa o ha sido extruido como no viable. Lleve un registro de cualquier folículo o FL-C que se haya adherido a la superficie del plato (consulte la Figura 5).
- Observe cuidadosamente los folículos para la formación de antros a partir del día 8. Los folículos con antrums parecerán tener un claro o un espacio más claro dentro de ellos (Figura 6).
- Realizar medio cambio de medio de cultivo cada 2 días. Utilice una pipeta P200, configurada para 50 μL. Inserte la punta en el pozo debajo de la capa de aceite y lejos de la perla de gel. Extraiga lentamente 50 μL del medio de cultivo. Reemplace el medio pipeteando lentamente 50 μL de FCM fresco debajo de la capa de aceite. Evita hacer burbujas.
8. Maduración de ovocitos en folículos encapsulados
NOTA: El paso final de maduración generalmente se inicia cuando la formación de antro entre el total de folículos sembrados (y viables) alcanza más del 40%. Sin embargo, en el caso de que la formación de antro sea baja o no sea visible, recomendamos desencadenar el disparo a partir del día 12 de cultivo. No hemos observado ningún beneficio en esperar más. En el caso de los cultivos FL-C, la maduración suele desencadenarse cuando se observan antros en el 40% de los pocillos o, a más tardar, a los 12 días.
- Prepare el medio de maduración in vitro (IVM) suplementando FCM con 1,5 UI/mL de gonadotropina coriónica humana (hCG) y 5 ng/mL de factor de crecimiento epidérmico (EGF).
- Desencadene la maduración reemplazando FCM en cada pocillo con 100 μL de medio IVM alrededor de las 5 PM. Después de la maduración durante la noche (16-18 h después del desencadenante), utilice un microscopio de disección con un aumento de 40x para examinar cada pozo de cultivo en busca de complejos cúmulo-ovocito (COC) que hayan ovulado a partir de la perla de gel de AH. Los COC generalmente se encuentran descansando justo encima de la perla de gel o muy cerca.
- Recoja los AOC ovulados en un plato de pocillo central con 1 mL de FCM preequilibrado cubierto con aceite y vuelva a colocar el plato en la incubadora.
- Recoja ovocitos de los folículos que aún están incrustados pipeteando suavemente la perla de HA con una pipeta P200 para liberar los AOC no ovulados. Recójalos en un plato separado con FCM.
- Prepare un plato de pozo central con 1 mL de hialuronidasa (10 UI/mL) y 3 mL de medio FCM en la pared externa.
- Transfiera los AOC ovulados a una solución de hialuronidasa y exponga brevemente a la enzima (30-45 s) para desnudar el ovocito de las células de la granulosa con el fin de visualizar el estado nuclear del ovocito. Enjuague los ovocitos para eliminar la enzima antes de colocarlos en gotas de 5 μL de medio fresco debajo del aceite para una evaluación detallada. Coloque el plato en la incubadora. Repita este proceso para los AOC no ovulados.
- Registrar el número total de óvulos ovulados y no ovulados recuperados. Fotografiar y evaluar el estado nuclear (GV, metafase I o metafase II) de cada ovocito recuperado. Mida y registre el diámetro.
- Calcule la tasa de supervivencia de la VCI en función del total de folículos viables (los que llegan al día del desencadenamiento de la hCG) y el total de óvulos recuperados. Calcular el porcentaje de ovocitos en metafase II procedentes de los AOC ovulados. Repita esto para cualquier ovocito recuperado de los AOC no ovulados.
- Determine la tasa de maduración a la metafase II de la misma manera para FL-C.
Resultados
En este artículo se detalla la metodología para el uso de un nuevo gel de hialuronano ligado a la tiramina para el cultivo in vitro de folículos preantrales de ratón36,37. La Figura 6 ilustra las diferencias entre el crecimiento del folículo preantral cuando se coloca en un sistema de cultivo 2D convencional frente a un solo folículo encapsulado en gel de HA para cultivo 3D. La arquitectura de los folículos nativos se mantiene durante los 12 días de cultivo con un antro claramente visible en el último día de crecimiento.
El gel de AH es muy versátil, permitiendo el crecimiento de folículos aislados individualmente o en grupos y también el tejido ovárico se rompe mecánicamente en pequeños grupos de folículos. El gel es transparente, lo que permite visualizar los folículos incluso a diferentes profundidades. Los folículos encapsulados y FL-C exhiben expansión radial debido a la proliferación continua de células de la granulosa (Figura 7). Los diámetros iniciales de los folículos tienen un promedio de 139,8 ± 28 μm, con un diámetro de ovocitos GV de 63,5 ± 4,6 μm. En los folículos cultivados individualmente, los diámetros finales miden entre 385,6 ± 36,7 μm, un aumento de tamaño de aproximadamente 3 veces. Los ovocitos ovulados en metafase II miden alrededor de 84,8 ± 3,8 μm. Dentro de los grupos de FL cultivados, el tamaño del folículo es bastante diverso (Figura 5, Figura 7). Los ovocitos ovulados después del desencadenamiento de la hCG se encuentran cerca del folículo (Figura 8). La mayoría de los ovocitos de la metafase II se extraerán de los AOC ovulados. Los folículos que aún están incrustados después del desencadenamiento generalmente contienen ovocitos GV y metafase I.
En la Tabla 1 se contrastan las tasas de maduración entre folículos aislados y grupos FL de ovarios frescos o congelados. El FL-C de ovarios criopreservados tuvo tasas de maduración significativamente más bajas. Las observaciones microscópicas mostraron que con frecuencia se les rompía la lámina basal, lo que las hacía bastante susceptibles a la extrusión prematura de ovocitos. La fragilidad de los grupos de folículos se contrarrestó de alguna manera con la encapsulación. Se evitó el tratamiento con colagenasa de los ovarios criopreservados, ya que era especialmente perjudicial con baja supervivencia y bajo rendimiento de folículos intactos.
La criopreservación de folículos aislados es mucho más eficaz que la preservación de ovario completo. Se pueden lograr altas tasas de maduración con los dos métodos de vitrificación examinados (Tabla 2). A pesar de las grandes diferencias en las tasas de enfriamiento, la maduración de los ovocitos después de la VCI no difirió. El portador abierto CL permite una mayor eficiencia, ya que se pueden cargar hasta diez folículos en un solo portador abierto CL. Esto también acorta el tiempo total para recuperar múltiples folículos criopreservados. Sin embargo, para cualquier aplicación clínica eventual de la vitrificación de folículos humanos, puede ser preferible el sistema cerrado y sellado.
La disposición de la cromatina alrededor del nucléolo del ovocito GV se puede utilizar para identificar los ovocitos con mayor probabilidad de fertilizar después de la ovulación y desarrollarse a blastocistos38. La figura 9 ilustra la tinción en vivo de los ovocitos para visualizar el patrón de distribución de la cromatina.
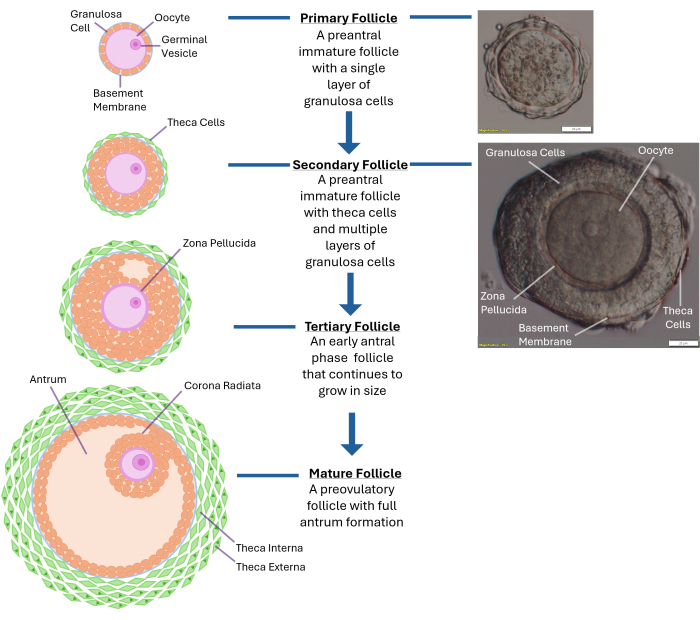
Figura 1: Esquema del crecimiento del folículo. Este diagrama ilustra las diferentes etapas del desarrollo del folículo, desde un folículo primario hasta la etapa preantral secundaria y, finalmente, hasta un folículo terciario completamente maduro listo para la ovulación. También se muestra una imagen microscópica de un folículo preantral típico con sus diferentes características morfológicas. Haga clic aquí para ver una versión más grande de esta figura.
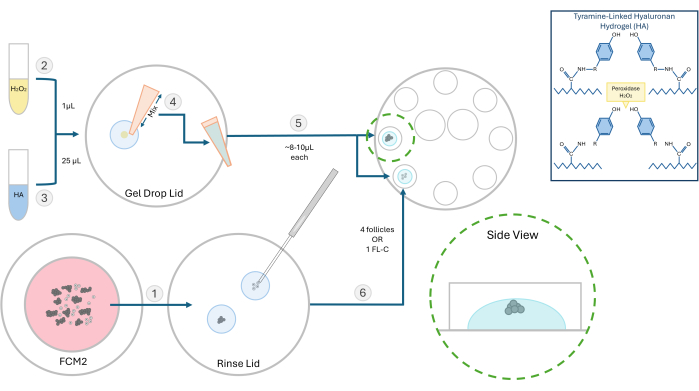
Figura 2: Esquema del método de encapsulación de alta disponibilidad. La estructura del gel de hialuronano y los diferentes pasos para la incrustación del folículo se ilustran en este diagrama. Haga clic aquí para ver una versión más grande de esta figura.
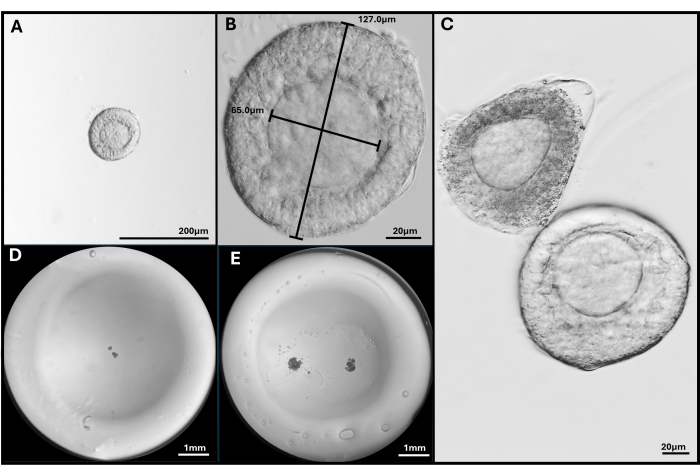
Figura 3: Aislamiento y encapsulación del folículo. (A, B) Folículo preantral seleccionado para su inclusión con aumentos de 40x y 200x. (C) El folículo apoptótico se muestra con un folículo preantral sano con el ovocito no del todo central. (D) Imagen de perla de gel de HA sembrada con folículos y (E) con dos FL-C. Imágenes tomadas con un microscopio estereoscópico para mostrar toda la perla de gel. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Dispositivos de vitrificación para la criopreservación de folículos aislados. Con el dispositivo portador abierto CL, la etapa de vitrificación se lleva a cabo mediante la inmersión directa de los folículos en nitrógeno líquido. Por lo tanto, la velocidad de enfriamiento es extremadamente alta, más de -20.000 °C/min. Por el contrario, con el portador cerrado RI, los folículos se cargan en el palo de plástico interior y se dejan caer en una pajita exterior sumergida en nitrógeno líquido. Este método de vitrificación cerrado evita el contacto directo con el nitrógeno líquido. Sin embargo, la velocidad de enfriamiento es significativamente menor a -1220 °C/min. La carga y recuperación de folículos de cualquiera de los portadores es fácil. El portador abierto CL admitió la carga de hasta diez folículos por dispositivo en comparación con solo dos con el portador cerrado RI. Esta cifra ha sido modificada de35. Haga clic aquí para ver una versión más grande de esta figura.
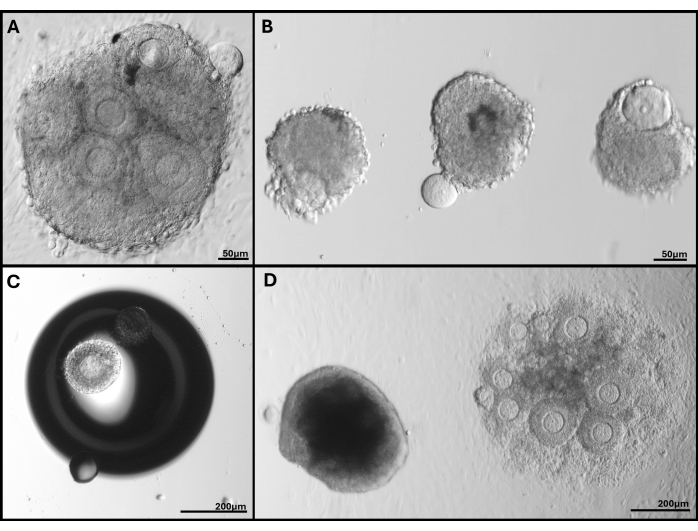
Figura 5: Imágenes representativas de los problemas encontrados. (A) Cúmulo de folículos con ovocitos en extrusión. (B) Folículos aislados con membrana de lámina basal rota y uno con un ovocito extruido. (C) Folículo incrustado debajo de una burbuja en el gel. (D) Racimo de folículos que permaneció en gel (izquierda) en comparación con el racimo incrustado demasiado profundo que finalmente se adhirió a la placa. La amplia gama de tamaños de folículos en FL-C es claramente visible. Haga clic aquí para ver una versión más grande de esta figura.
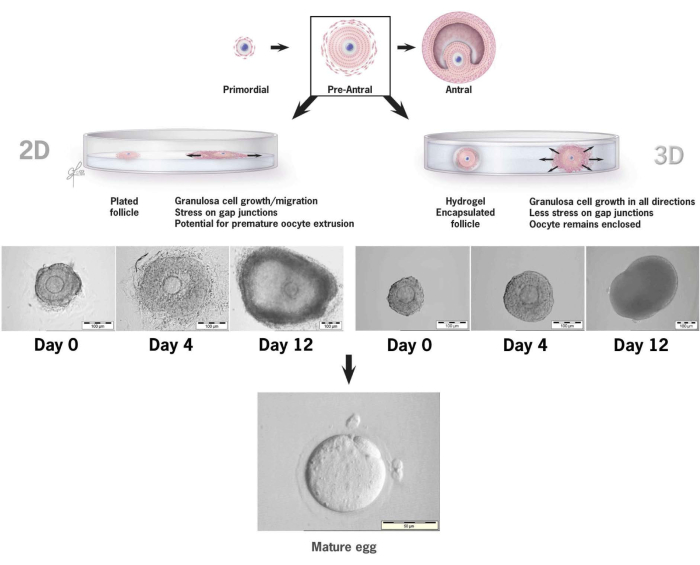
Figura 6: Comparación del crecimiento de folículos en el cultivo convencional 2-D versus 3-D en AH. Con el crecimiento en 2D, se observó el aplanamiento del folículo y la unión de las células de la granulosa a la placa de cultivo de tejidos en el día 4, lo que dejaba al ovocito vulnerable a la migración de las células de la granulosa, la interrupción de las uniones gap y la extrusión prematura de ovocitos. El folículo encapsulado en HA permaneció suelto durante todo el intervalo de cultivo. La expansión de las células de la granulosa se produjo en todas las direcciones, encerrando el ovocito y manteniendo la arquitectura 3D. Esta cifra ha sido modificada de36. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Imágenes representativas de folículos encapsulados en gel de hialuronano unido a tiramina. (A) Folículo preantral recolectado después de la digestión de colagenasa de ovario fresco en el día 1. (B) Gota de gel sembrada con cuatro folículos preantrales fotografiados en el día 1 y (C) Día 4 de cultivo (D) Racimo de folículos de ovario fresco en el día 2 (E) en el día 6 y (F) en el día 9 de cultivo. (G) Racimo de folículos disecado mecánicamente a partir de ovario entero vitrificado mostrado en el día 2 y (H) en el día 6 de cultivo. (I) La formación de folículos con antro es claramente visible en el día 9 de cultivo. Haga clic aquí para ver una versión más grande de esta figura.
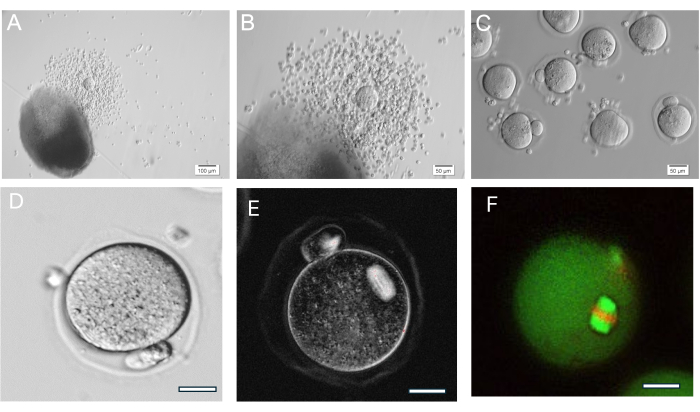
Figura 8: Ovulación de ovocitos. (A, B) Complejo cúmulo-ovocito ovulado (COC) que se muestra a continuación perla de gel de HA. (C) Se obtuvieron imágenes de los ovocitos después del tratamiento enzimático de los AOC con hialuronidasa para eliminar las células del cúmulo circundante. Numerosos ovocitos en metafase II. (D) Ovocito en metafase II con cuerpo polar prominente. Aumento 400x. (E) Imágenes en vivo de ovocitos en metafase II utilizando luz polarizada y un sistema de imágenes para visualizar el huso meiótico y evaluar la organización, realizadas como se describe en37. Aumento 400x. Huso birrefringente normal visible. (F) Ovocito en metafase II fijado y teñido con anti-alfa/beta-tubulina y yoduro de propidio para visualizar la organización meiótica del huso. Haga clic aquí para ver una versión más grande de esta figura.
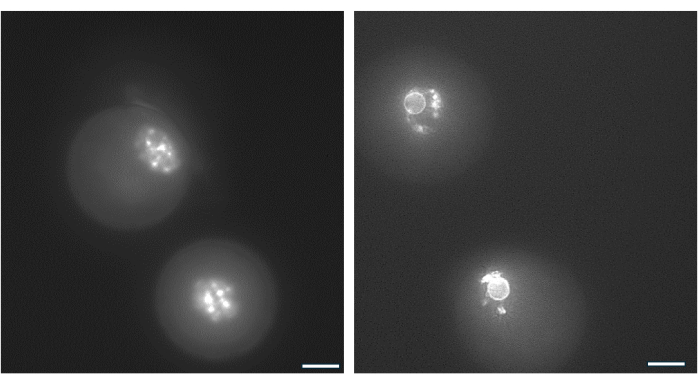
Figura 9: Reorganización de la cromatina en ovocitos GV. La disposición de la cromatina en los ovocitos GV después de la formación del antro se examinó mediante tinción de ADN con Hoechst 33342 (50 ng/mL). Los folículos representativos se cosecharon de las perlas de AH mediante un pipeteo suave. Las células de la granulosa se extrajeron con hialuronidasa. A continuación, los ovocitos GV se tiñeron durante 15 min. (Ver protocolo de Monti et al.38). Las imágenes se tomaron con un aumento de 40x. (A) Ovocito GV mostrado el día 1 al inicio del cultivo que exhibe el patrón de tinción de cromatina no rodeada (NSN). (B) Ovocito GV de folículo en crecimiento con antro mostrado el día del desencadenante de la hCG. La cromatina se condensó y formó un anillo perinuclear alrededor del nucléolo. Haga clic aquí para ver una versión más grande de esta figura.
| Parámetro | Ovario fresco | Ovario congelado | |
| FL-Aislado | FL-Cluster (Cúmulo de flores) | FL-Cluster (Cúmulo de flores) | |
| Folículos observados durante la VCI | 130 | 154 | 69 |
| Ovulación después de la HCG (%) | 71% | 66% | 93% |
| (92/130) | (101/154) | (64/69) | |
| GVBD (%) | 30% | 28% | 52% |
| (28/92) | (28/101) | (33/64) | |
| Formación de ovocitos MII (%) | 59% | 55% | *34% |
| (54//92) | (56/101) | (22/64) | |
Tabla 1: Resultados con folículos incrustados en HA de ovarios frescos y vitrificados. Los folículos y la FL-C de ovarios frescos se maduraron in vitro después de la encapsulación en gel de AH. El gel de AH también se probó en folículos de ovarios vitrificados utilizando un protocolo EG/DMSO39. Con los ovarios frescos, se recolectaron folículos individuales (FL) y grupos de folículos (FL-C) después de la digestión con colagenasa. En el caso de los ovarios vitrificados, la exposición a la colagenasa fue, de hecho, perjudicial para los folículos. El mejor enfoque con los ovarios criopreservados fue aislar los grupos de FL en lugar de los folículos individuales y utilizar únicamente la disección mecánica con agujas. La tabla contrasta los resultados entre las perlas de AH sembradas con folículos en grupos de 4 a 6 frente a las perlas con un solo FL-C que contiene de 6 a 10 folículos. *La tasa de maduración con FL-C de ovarios criopreservados fue significativamente menor (p = 0,008; Análisis de Chi-cuadrado para probar la significación).
| Portador | RI | CL |
| (Cerrado) | (Abierto) | |
| Supervivencia (%) | 100% (24/24) | 100% (41/41) |
| Formación de antros* (%) | 25.0% (6/24) | 75.6% (31/41)* |
| Tasa de ovulación (%) | 66.7% (16/24) | 87.8% (36/41) |
| Tasa de maduración (% MIIs) | 81.3% (13/16) | 69.4% (25/36) |
Tabla 2: Resultados después de la criopreservación de folículos aislados en dos dispositivos de vitrificación diferentes. Se lograron altas tasas de maduración tanto con el dispositivo CL abierto como con el portador RI cerrado, con su menor velocidad de enfriamiento. La formación de antro fue la única medida de resultado observada como significativa, pero no afectó la tasa de maduración general (p < 0,05; Análisis de Chi-cuadrado para probar la significación).
Discusión
La capacidad de controlar las propiedades mecánicas y la biodegradabilidad del hidrogel de AH ligado a la tiramina ofrece muchas ventajas para las aplicaciones de ingeniería de tejidos. Nuestro laboratorio es el primero en aplicar este gel de AH específico para el crecimiento de los folículos ováricos. Este gel patentado de hialuronato de sodio sustituido por tiramina (TS-NAHY) es un novedoso sistema de hidrogel a base de hialuronano desarrollado en la Clínica Cleveland. La reticulación del gel es impulsada por la exposición de la peroxidasa en la mezcla de gel activado a un agente oxidante. Esto se puede hacer tanto in vitro como in vivo. Los hidrogeles TS-NAHY formados muestran un amplio espectro de propiedades, desde un gel débil, una pasta hasta un sólido frágil, dependiendo de la concentración de gel40.
El decepcionante avance del cultivo de folículos ováricos pone de manifiesto la necesidad de diseñar nuevos modelos de cultivo. La creación de un sistema de cultivo basado exclusivamente en componentes de la matriz extracelular nativa puede ser un enfoque más ventajoso. El modelo de cultivo de AH descrito es fácil de usar de manera fisiológica sin necesidad de componentes adicionales de ECM. El gel es transparente, lo que permite una visualización detallada de los folículos. Las propiedades viscoelásticas del gel de AH facilitan el ajuste de la rigidez y la moldeabilidad. Esta característica aumenta la versatilidad de esta biomatriz. La rigidez de una biomatriz puede afectar la proliferación de células de la granulosa y la formación de antros 30,41,42. Se ha reportado que los folículos derivados de ambientes de cultivo permisivos para la formación de antros tienen perfiles de expresión génica diferentes a los de un sistema de cultivo no de apoyo43. Los folículos de los primates parecen requerir una matriz más rígida44. Es probable que la adaptación de la biomatriz para satisfacer los requisitos de las diferentes especies animales, incluidos los humanos, sea importante para el éxito de la maduración in vitro.
Para el crecimiento del folículo preantral de ratón, hemos probado concentraciones de gel que oscilan entre 2 y 5 mg/mL36. Las tasas de maduración de los ovocitos oscilaron entre el 44% y el 58%. Las concentraciones más altas del gel de AH permitieron una mayor moldeabilidad y retención de una estructura 3D, pero la expansión del folículo se vio afectada. Las concentraciones más bajas de HA permitieron una mayor expansión radial del folículo, pero aumentaron el riesgo de que el folículo se extruyera espontáneamente antes del final de la VCI. La concentración de 3-3,5 mg/mL de AH funcionó mejor para los folículos preantrales de ratón. Mantener la gota de gel pequeña fue esencial para formar perlas de gel de HA con suficiente profundidad para mantener los folículos en una configuración 3D durante toda la VCI. Las gotas más grandes se aplanaban, lo que provocaba el descenso de los folículos a través del gel y la adhesión a la superficie de la placa. Una limitación del uso de este biomaterial para la inclusión es el tiempo de gelificación extremadamente rápido. Esto dificulta la siembra de más de dos cuentas de gel de HA a la vez. Aumentar la eficiencia de la siembra de folículos en el gel de AH es un área en la que estamos tratando de mejorar.
El cultivo de grupos de folículos en un entorno 3D utilizando HA tiene un gran potencial. Se conserva la arquitectura ovárica normal, con folículos de diferentes tamaños en contacto entre sí y con el estroma de soporte. La LH puede ayudar al crecimiento de folículos preantrales más pequeños en el FL-C al inducir cambios en las células tecales diferenciadoras tempranas, por lo que se incluyó en el medio FCM45. Continuar el cultivo de FL-C durante los últimos 12 días para ver si se puede iniciar una nueva ola de crecimiento en alguno de los folículos más pequeños que aún están incrustados después del desencadenante de la hCG necesita más estudio. Una mayor optimización del medio de cultivo puede ser un requisito previo para el cultivo de folículos de diferentes rangos de tamaño en un fragmento de tejido. Una ventaja de este modelo de cultivo de HA en 3D con FL-C es que permite imitar de cerca la disposición folicular y las interacciones in vivo . Otro atributo importante es que, a diferencia del alginato de calcio y otros sistemas de polímeros, la ovulación y la maduración se pueden inducir sin eliminar físicamente los folículos del tejido o de la matriz de gel.
El tiempo necesario para el cultivo in vitro de folículos y la obtención de ovocitos maduros para la congelación es largo, especialmente en grandes mamíferos. La capacidad de criopreservar folículos recolectados o grupos de folículos presenta una forma de retrasar este paso hasta un momento posterior y posiblemente más favorable. Si esta tecnología se puede aplicar algún día a los folículos humanos durante la recolección de ovarios, podría ser beneficiosa. La criopreservación de ovario completo para la preservación de la fertilidad es, en la actualidad, la única opción para las pacientes. Pero aún está por determinar si es, de hecho, el mejor método. En este artículo, presentamos una metodología de vitrificación para la criopreservación de folículos preantrales que proporciona excelentes tasas de supervivencia y maduración después del calentamiento después del cultivo en 3D.
En conclusión, hemos descrito un nuevo modelo de cultivo en 3D utilizando hialuronano, un componente de la MEC nativa. La técnica de encapsulación de AH permite la retención de factores tróficos en estrecha proximidad a los folículos en desarrollo. La metodología para la encapsulación en la biomatriz es simple y puede acomodar folículos aislados, así como grupos de folículos. Este último puede abrir nuevas vías de investigación y proporcionar información sobre la biología fundamental de la foliculogénesis y su regulación. Se ha demostrado que los ovocitos de folículos encapsulados en HA son funcionalmente competentes37. Estos ovocitos pueden ser fertilizados, formar blastocistos in vitro e implantarse en el momento de la transferencia a ratones pseudo-embarazadas. Estos datos validan el uso del hialuronano ligado a la tiramina como biomatriz para el cultivo de folículos en 3D y la maduración in vitro de ovocitos. Este protocolo podría aplicarse potencialmente al cultivo de folículos ováricos en otros modelos animales, incluidos los humanos. Otras posibles aplicaciones para este sistema de gel de HA en 3D podrían ser el cultivo de cuerpos embrioides y organoides.
Divulgaciones
Sin conflictos de intereses ni divulgaciones.
Agradecimientos
Queremos agradecer a todo el equipo de embriología de Cleveland Clinic por su ayuda, así como al departamento de REI y especialmente al Dr. Falcone por su apoyo. Este proyecto fue financiado a través de un fondo de investigación de la Clínica Cleveland.
Materiales
| Name | Company | Catalog Number | Comments |
| Anti-alpha tubulin-FITC labelled | Sigma-Aldrich | F2168 | |
| Anti-beta tubulin-FITC labelled | Sigma-Aldrich | F2043 | |
| BZ-X700 | Keyence | ||
| Center well dish | Fisher Scientific | 08-772-12 | |
| Collagenase Type I | Worthington Biochemical Corporation | LS004196 | |
| Crycap vial-vented | Hampton Research | HR4-904 | |
| Cryoloop | Hampton Research | HR4-974 | |
| Crystal cap | Hampton Research | HR4-733 | |
| Culture dish 60mm | Fisher Scientific | 08-772B | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Epidermal growth factor (EGF) | R &D Systems | 236-EG | |
| Ethylene Glycol (EG) | Sigma-Aldrich | 293237 | |
| Fetal Bovine Serum-Heat Inactivated | ThermoFisher Scientific | 10082-147 | |
| Follicle Stimulating Hormone (FSH) | Sigma-Aldrich | F4021 | |
| Global-Hepes medium | CooperSurgical | LGGH-100 | |
| Hoechst 33342 | Sigma-Aldrich | B2261 | |
| Human chorionic gonadotrophin (hCG) | Sigma-Aldrich | CG10 | |
| Human serum albumin | CooperSurgical | GHSA-125 | |
| Hyaluronidase | CooperSurgical | ART-4007-A | |
| Hydrogen Peroxide | CVS Pharmacy Inc. | 372441 | |
| Insulin-transferrin-selenium (ITS) | ThermoFisher Scientific | 41400-045 | |
| Leibovitz medium (L-15) | ThermoFisher Scientific | 11415-064 | |
| Luteinizing hormone | Sigma-Aldrich | L9773 | |
| Magnetic wand | Hampton Research | HR4-729 | |
| Micropipettes (1000 µm) | Minitube | 19025/0050 | |
| Micropipettes (175 , 200, and 275µm) | CooperSurgical | MXL3-175, MXL3-200, MXL3-275 | |
| Millex GV filter 0.22 µm | Millipore | SLGU033RS | |
| Mineral oil | CooperSurgical | LGOL-500 | |
| Minimum Essential Medium alpha (MEM) | ThermoFisher Scientific | 32561-037 | |
| Oocyte Imaging System-Spindleview | Hamilton Thorne | ||
| Phosphate buffered saline (PBS) | ThermoFisher Scientific | 10010-023 | |
| Propidium iodide | Sigma-Aldrich | P4170 | |
| Rapid i | VitroLife | 14406 | |
| SmartBox | VitroLife | 14423 | |
| Synthetic Protein Substitute (SPS) | CooperSurgical | ART-3011 | |
| Tyramine -linked Hyaluronan Biohydrogel Kit | LifeCore | ENG-00151 | |
| Ultrasonic sealer | VitroLife | 14415 | |
| Universal GPS Culture dish 8x 100 µl wells | CooperSurgical | UGPS-010 |
Referencias
- Telfer, E. E., Andersen, C. Y. In vitro growth and maturation of primordial follicles and immature oocytes. Fertil Steril. 115 (5), 1116-1125 (2021).
- Telfer, E. E., McLaughlin, M. Natural history of the mammalian oocyte. Reprod Biomed Online. 15 (3), 288-295 (2007).
- Xiao, S., et al. In vitro follicle growth supports human oocyte meiotic maturation. Sci Rep. 5, 17323 (2015).
- Carabatsos, M. J., Sellitto, C., Goodenough, D. A., Albertini, D. F. Oocyte-granulosa cell heterologous gap junctions are required for the coordination of nuclear and cytoplasmic meiotic competence. Dev Biol. 226 (2), 167-179 (2000).
- Diaz, F. J., Wigglesworth, K., Eppig, J. J. Oocytes are required for the preantral granulosa cell to cumulus cell transition in mice. Dev Biol. 305 (1), 300-311 (2007).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biol Reprod. 73 (2), 351-357 (2005).
- Dadashzadeh, A., Moghassemi, S., Shavandi, A., Amorim, C. A. A review on biomaterials for ovarian tissue engineering. Acta Biomater. 135, 48-63 (2021).
- Simon, L. E., Kumar, T. R., Duncan, F. E. In vitro ovarian follicle growth: a comprehensive analysis of key protocol variablesdagger. Biol Reprod. 103 (3), 455-470 (2020).
- Belli, M., et al. Towards a 3D culture of mouse ovarian follicles. Int J Dev Biol. 56 (10-12), 931-937 (2012).
- Berkholtz, C. B., Shea, L. D., Woodruff, T. K. Extracellular matrix functions in follicle maturation. Semin Reprod Med. 24 (4), 262-269 (2006).
- Desai, N., et al. Three-dimensional in vitro follicle growth: overview of culture models, biomaterials, design parameters and future directions. Reprod Biol Endocrinol. 8, 119 (2010).
- Shea, L. D., Woodruff, T. K., Shikanov, A. Bioengineering the ovarian follicle microenvironment. Annu Rev Biomed Eng. 16, 29-52 (2014).
- Paulini, F., et al. Survival and growth of human preantral follicles after cryopreservation of ovarian tissue, follicle isolation and short-term xenografting. Reprod Biomed Online. 33 (3), 425-432 (2016).
- West, E. R., Xu, M., Woodruff, T. K., Shea, L. D. Physical properties of alginate hydrogels and their effects on in vitro follicle development. Biomaterials. 28 (30), 4439-4448 (2007).
- Joo, S., et al. The effect of collagen hydrogel on 3D culture of ovarian follicles. Biomed Mater. 11 (6), 065009 (2016).
- Telfer, E., Torrance, C., Gosden, R. G. Morphological study of cultured preantral ovarian follicles of mice after transplantation under the kidney capsule. J Reprod Fertil. 89 (2), 565-571 (1990).
- Torrance, C., Telfer, E., Gosden, R. G. Quantitative study of the development of isolated mouse pre-antral follicles in collagen gel culture. J Reprod Fertil. 87 (1), 367-374 (1989).
- Dong, C., Yonggang, L. V. Application of collagen scaffold in tissue engineering: recent advances and new perspectives. Polymers. 8 (2), 42 (2016).
- Le, B. A. M., et al. Agarose-based 3D culture improved the developmental competence of oocyte-granulosa complex isolated from porcine preantral follicle. Theriogenology. 223, 11-21 (2024).
- Park, J. E., et al. In vitro maturation on an agarose matrix improves the developmental competence of porcine oocytes. Theriogenology. 157, 7-17 (2020).
- Zaniker, E. J., et al. Three-dimensionally printed agarose Micromold supports scaffold-free mouse ex vivo follicle growth, ovulation, and luteinization. Bioengineering. 11 (7), 719 (2024).
- Pangas, S. A., Saudye, H., Shea, L. D., Woodruff, T. K. Novel approach for the three-dimensional culture of granulosa cell-oocyte complexes. Tissue Eng. 9 (5), 1013-1021 (2003).
- West, E. R., Shea, L. D., Woodruff, T. K. Engineering the follicle microenvironment. Semin Reprod Med. 25 (4), 287-299 (2007).
- Xu, J., et al. Survival, growth, and maturation of secondary follicles from prepubertal, young, and older adult rhesus monkeys during encapsulated three-dimensional culture: effects of gonadotropins and insulin. Reproduction. 140 (5), 685-697 (2010).
- Xu, M., Kreeger, P. K., Shea, L. D., Woodruff, T. K. Tissue-engineered follicles produce live, fertile offspring. Tissue Eng. 12 (10), 2739-2746 (2006).
- Amorim, C. A., Van Langendonckt, A., David, A., Dolmans, M. M., Donnez, J. Survival of human pre-antral follicles after cryopreservation of ovarian tissue, follicular isolation and in vitro culture in a calcium alginate matrix. Hum Reprod. 24 (1), 92-99 (2009).
- Converse, A., Zaniker, E. J., Amargant, F., Duncan, F. E. Recapitulating folliculogenesis and oogenesis outside the body: encapsulated in vitro follicle growth dagger. Biol Reprod. 108 (1), 5-22 (2023).
- Mainigi, M. A., Ord, T., Schultz, R. M. Meiotic and developmental competence in mice are compromised following follicle development in vitro using an alginate-based culture system. Biol Reprod. 85 (2), 269-276 (2011).
- Kreeger, P. K., Deck, J. W., Woodruff, T. K., Shea, L. D. The in vitro regulation of ovarian follicle development using alginate-extracellular matrix gels. Biomaterials. 27 (5), 714-723 (2006).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. Interpenetrating fibrin-alginate matrices for in vitro ovarian follicle development. Biomaterials. 30 (29), 5476-5485 (2009).
- Griffith, L. G., Swartz, M. A. Capturing complex 3D tissue physiology in vitro. Nat Rev Mol Cell Biol. 7 (3), 211-224 (2006).
- Irving-Rodgers, H. F., Rodgers, R. J. Extracellular matrix of the developing ovarian follicle. Semin Reprod Med. 24 (4), 195-203 (2006).
- Salustri, A., Camaioni, A., Di Giacomo, M., Fulop, C., Hascall, V. Hyaluronan and proteoglycans in ovarian follicles. Hum Reprod Update. 5, 293 (1999).
- Rashki Ghaleno, L., Cristian, P. P., Shahverdi, A., Dardmeh, F., Alipour, H., Valojerd, M. R. Exploring the role of hyaluronic acid in reproductive biology and beyond: Applications in assisted reproduction and tissue engineering. Adv. Biology. 8 (6), e202300621 (2024).
- Desai, N. N., Goldberg, J. M., Austin, C., Falcone, T. The new Rapid-i carrier is an effective system for human embryo vitrification at both the blastocyst and cleavage stage. Reprod Biol Endocrinol. 11, 41 (2013).
- Desai, N., Abdelhafez, F., Calabro, A., Falcone, T. Three dimensional culture of fresh and vitrified mouse pre-antral follicles in a hyaluronan-based hydrogel: a preliminary investigation of a novel biomaterial for in vitro follicle maturation. Reprod Biol Endocrinol. 10 (1), 29 (2012).
- Desai, N., Spangler, M., Nanavaty, V., Gishto, A., Brown, A. New hyaluronan-based biomatrix for 3-D follicle culture yields functionally competent oocytes. Reprod Biol Endocrinol. 20 (1), 148 (2022).
- Monti, M., Redi, C. A. Isolation and characterization of mouse antral oocytes based on nucleolar chromatin organization. J Vis Exp. (107), e53616 (2016).
- Huang, L., et al. Cryopreservation of human ovarian tissue by solid-surface vitrification. Eur J Obstet Gynecol Reprod Biol. 139 (2), 193-198 (2008).
- Chan, J., Darr, A., Alam, D., Calabro, A. Investigation of a novel cross-linked hyaluronan hydrogel for use as a soft-tissue filler. Am J Cosmetic Sur. 22, 105-108 (2005).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. A method for ovarian follicle encapsulation and culture in a proteolytically degradable 3-dimensional system. J Vis Exp. (49), e2695 (2011).
- Xu, M., West, E., Shea, L. D., Woodruff, T. K. Identification of a stage-specific permissive in vitro culture environment for follicle growth and oocyte development. Biol Reprod. 75 (6), 916-923 (2006).
- West-Farrell, E. R., et al. The mouse follicle microenvironment regulates antrum formation and steroid production: alterations in gene expression profiles. Biol Reprod. 80 (3), 432-439 (2009).
- Xu, M., et al. Encapsulated three-dimensional culture supports development of nonhuman primate secondary follicles. Biol Reprod. 81 (3), 587-594 (2009).
- Wu, J., Nayudu, P. L., Kiesel, P. S., Michelmann, H. W. Luteinizing hormone has a stage-limited effect on preantral follicle development in vitro. Biol Reprod. 63 (1), 320-327 (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados