Method Article
יישום של הידרוג'ל היאלורונן חדשני לתרבית זקיקים תלת מימדית ומתודולוגיה לשימור הקפאה של זקיקי שחלות עכבר
In This Article
Summary
פרוטוקול זה מתאר מודל תרבית תלת מימדי חדש (3-D) המשתמש בהידרוג'ל היאלורונן המקושר לטירמין כדי לעטוף ולתרבית זקיקים פרה-אנטרליים משחלת העכבר. אנו מפרטים גם שתי גישות לשימור הקפאה של זקיקי השחלות על ידי ויטריפיקציה.
Abstract
הארכיטקטורה התלת-ממדית של זקיק השחלה והאינטראקציות המורכבות בין רכיבי התא הסומטי לביצית הנחוצות להתבגרות ציטופלזמית וגרעינית קשות לשמירה במערכות תרבית דו-ממדיות קונבנציונליות (2-D). אנו מתארים מודל תרבית תלת-ממדי חדשני המשתמש בהידרוג'ל היאלורונן המקושר לטירמין לאנקפסולציה ותרבית של זקיקי שחלות עכבר. טכניקת האנקפסולציה ההיאלורונית מאפשרת צמיחה תלת מימדית של זקיקים ושמירה על גורמים טרופיים בסמיכות לזקיקים המתפתחים. הידרוג'ל זה הוא רב תכליתי וניתן למרוח אותו על זקיקים מבודדים כמו גם על שברי רקמת שחלות. התכונות הויסקו-אלסטיות של ג'ל ה-HA מאפשרות התאמה של קשיחות כמו גם יכולת עיצוב על בסיס ריכוז הג'ל. זקיקים פרה-אנטרליים המתפתחים במודל תרבית זה מסוגלים להשלים התבגרות מיוטית תוך 10-12 ימים מהתרבית ולבייץ ביצית מטפאזה II עם הפעלת hCG. מאמר זה מפרט גם שתי גישות לשימור הקפאה של זקיקי השחלות על ידי ויטריפיקציה.
Introduction
זקיקי מבחנה אנושיים נותרו אתגר גם ארבעה עשורים לאחר הלידה הראשונה מהפריה חוץ גופית. נכון להיום, המתודולוגיה לתרבית זקיקי שחלות אנושית התומכת בייצור עובר בר קיימא וכתוצאה מכך תינוק בריא עדיין חסרה1. התכונות הפיזיקליות האופטימליות הדרושות לצמיחת זקיקי מבחנה אנושית עדיין לא נקבעו. השחלה השלמה מאוכלסת באלפי זקיקים בשלבי התפתחות שונים, וויסות גדילתם הוא תהליך מורכב (איור 1)2. לביציות שלב שלפוחית הנבט (GV) מזקיקים פרה-אנטרליים אנושיים לוקח עד 30 יום בתרבית להתבגר מבחינה מיוטית ולהגיע לשלבהמטאפאזה II 3. תקשורת דו-כיוונית בין הביצית לתאי הגרנולוזה הסובבים אותה באמצעות צמתים מרווחים היא קריטית להתבגרות ציטופלזמית וגרעינית 4,5,6.
מערכות תרבית דו-ממדיות קונבנציונליות אינן אידיאליות לתרבית זקיקים, במיוחד במודלים של יונקים גדולים יותר הדורשים זמן ממושך בתרבית. זקיקים נצמדים לצלחת, והקשר בין תאי גרנולוזה לביצית הופך קלוש יותר ככל שתאי הגרנולוזה נודדים משם. מערכות תרבית תלת מימדיות (3-D) לזקיקים התגלו אפוא כאמצעי לחקות מקרוב יותר את הפיזיולוגיה in vivo 7,8.
אנקפסולציה של זקיקים בתוך מטריצה כדי לקדם צמיחה תלת מימדית הייתה גישה אחת לשימור ארכיטקטורת זקיקים במהלך תרבית חוץ גופית (IVC). ביומטריצות מפולימרים טבעיים (כגון קולגן, אגרוז, פיברין, אלגינט וחומצה היאלורונית), כמו גם פולימרים סינתטיים (כגון פוליאתילן גליקול, אלכוהול פוליוויניל וחומצה פוליגליקולית), נבדקו 7,9,10,11,12,13. הוכח כי התכונות המכניות של ביומטריצה משפיעות על דיפוזיה של חומרים מזינים, התמיינות תאים תקליים, היווצרות אנטרום וכן על הפרשה הורמונלית14. קולגן, כחלק מהמטריצה החוץ-תאית הטבעית של התא (ECM), הוא אחת המטריצות המוקדמות ביותר שנבדקו והבטיח בתחילה 15,16,17. עם זאת, הלוגיסטיקה של סטנדרטיזציה של תכשירים של קולגן, תכונות מכניות ירודות ויציבות הגבילו את השימוש בו18. אגרוז נבדק על קומפלקסים קומולוס-ביציות (COCs) המשתחררים מזקיקים אנטרליים כמו גם זקיקים קדמוניים19,20. לאחרונה, תבנית אגרוז תלת מימדית מודפסת הראתה הבטחה לתרבית זקיקים ללא פיגומים21. אנקפסולציה של סידן אלגינט, שדווחה לראשונה בשנת 2003, הייתה עד כה המערכת הנחקרת ביותר עבור IVC22. הוא נבדק על עכברים, בקר, קופים וכן זקיקים אנושיים 23,24,25,26,27. עם סידן אלגינט, זקיקים נטענים בנפרד לתוך טיפות מיקרו של הפולימר ונחשפים לסידן כלורי ליצירת חרוז ג'ל. מיצוי זקיקים מהחרוז דורש טיפול בחומר כלאט. עם זאת, למטריצה זו יש כמה חסרונות. אלגינט הוא רב-סוכר המבודד מאצות, ולמרות שהוא מספק תמיכה, הוא אינו חלק מהמטריצה החוץ-תאית הטבעית של הזקיק. הנתונים מצביעים על שכיחות גבוהה יותר של פגמים בציר לאחר IVC באלגינט28. שינויים מאוחרים יותר במערכת על ידי שילוב של אלגינט עם פיברין או רכיבי מטריצה חוץ-תאיים אחרים (ECM) עזרו להפוך את מערכת הסידן אלגינט ליעילה יותר29,30.
עדויות הולכות וגדלות מצביעות על המטריצה החוץ-תאית כמודולטור מרכזי בצמיחת תאים 10,31,32 . הוא לא רק מספק תמיכה אלא ממלא תפקיד קריטי בחיבור התאים, בתפקודם, בגדילה ובתקשורת. אחד המרכיבים העיקריים של ECM הוא היאלורונן, גליקוזאמינוגליקן טבעי. בזקיק השחלה, היאלורונן מיוצר על ידי תאי גרנולוזה ותורם לשלמות המבנית ולתפקוד של הזקיק המתפתח33,34. שילוב של היאלורונן במודל תרבית זקיקים עשוי אפוא לסייע ביצירת סביבה פיזיולוגית יותר ולשפר את הייצור של ביציות מוכשרות מבחינה תפקודית.
עבודה זו מתארת את היישום החדשני של היאלורונן המקושר לטירמין כביומטריצה לגידול זקיקי שחלות טריים וקפואים ולהבשלת ביציות במבחנה (IVM). אנו מפרטים גם טכניקות לשימור הקפאת זקיקים על ידי ויטריפיקציה בשני סוגים של מכשירים. שיטה אחת כוללת טבילה ישירה בחנקן נוזלי ואילו בשיטה השנייה זקיקים סגורים בקשית לפני הטבילה. המטרה העיקרית היא להראות שלמרות ההבדלים, ניתן להשתמש באופן אמין הן במתודולוגיות והן במכשירים לשימור הקפאה של זקיקים.
Protocol
כל הניסויים בבעלי חיים בוצעו על פי הפרוטוקולים המוסדיים לשימוש וטיפול בבעלי חיים של קליבלנד קליניק ובהתאם להנחיות ולתקנות של המכונים הלאומיים לבריאות לטיפול ושימוש בחיות מעבדה.
1. הכנה בינונית
הערה: המדיה המתוארת להלן תשמש לשלבים השונים בהליך זה: טיפול ברקמת שחלה (OT), עיכול קולגנאז OT, תרבית זקיקים (FCM) וזיגוג. הכן את כל המדיום במכסה המנוע של תרבית רקמות בטכניקה סטרילית.
- מדיום לטיפול ברקמות שחלות
- תוסף 20 מ"ל של מדיום לייבוביץ (L-15) עם 0.1% סרום בקר עוברי (FBS) בבקבוק תרבית רקמה של 50 מ"ל (T-50).
- יש לסגור היטב ולהניח את הבקבוק באינקובטור למשך הלילה כדי להתחמם ל-37 מעלות צלזיוס לפני השימוש. מדיום זה משמש לטיפול ברקמת שחלה וזקיקים מחוץ לחממה ואינו דורש CO2 כדי לשמור על pH של 7.2 עד 7.4
זהירות: אין לחשוף כלים לגזCO2 אחרת המדיום יהפוך לחומצי.
- מדיום עיכול קולגנאז
- בבוקר קציר הזקיקים, יש להוסיף 1 מ"ג של קולגנאז מסוג I (295 יח'/מ"ג) למבחנה עם 2.2 מ"ל של מדיום טיפול OT שחומם מראש. הריכוז הרצוי הסופי של קולגנאז הוא 134 U/mL מסנן סטריליזציה באמצעות מסנן מזרק 0.22 מיקרומטר. מכסה היטב ומניח בבלוק התחממות.
- מדיום תרבית זקיקים ושמן
- יש להכין 30 מ"ל של אלפא בינוני חיוני מינימלי בתוספת סרום בקר עוברי 5% בבקבוק T-50. תוסף עם 100 mIU/mL FSH, 10 mIU/mL LH, 10 מיקרוגרם/מ"ל אינסולין, 5 מיקרוגרם/מ"ל טרנספרין ו-5 ננוגרם/מ"ל סלניום.
- אזנו מראש את FCM ב-37 מעלות צלזיוס עם 6% CO2 ואוויר לילה בחממה לפני השימוש.
- מניחים 50 מ"ל שמן מינרלי בבקבוק, מכסים באופן רופף ומאזן למשך הלילה בחממה.
- מדיית ויטריפיקציה עבור אשכולות FL ו-FL
- המדיום הבסיסי לכל הפתרונות הוא Global-Hepes בתוספת תחליף חלבון סינתטי של 20%. הכן 20 מ"ל של תמיסת VS1 עם 7.5% אתילן גליקול (EG) ו-7.5% דימתיל סולפוקסיד (DMSO) במדיום בסיסי.
- הכן 20 מ"ל של VS2 עם 15% EG, 15% DMSO ו-0.5 M סוכרוז במדיום בסיסי. יש לעקר את כל התמיסות עם מסנן מזרק של 0.22 מיקרומטר ולאחסן בטמפרטורה של 4 מעלות צלזיוס עד לשימוש. ניתן להשתמש בתמיסות עד 4 שבועות.
- מדיה מחממת לזקיקים מזוגגים ואשכולות FL
- המדיום הבסיסי לכל הפתרונות הוא Global-Hepes בתוספת תחליף חלבון סינתטי של 20%. הכן 20 מ"ל של מדיום בסיסי עם סוכרוז 0.25 M. תווית כ-WS1.
- הכן 20 מ"ל של מדיום בסיסי עם סוכרוז 0.125 M ותווית כ-WS2. מסנן לעקר עם מסנן מזרק 0.22 מיקרומטר. יש לאחסן את התמיסות בטמפרטורה של 4 מעלות צלזיוס למשך עד 4 שבועות.
2. קציר השחלות
- המתת חסד של גורי B6D2F1 בני 10-14 יום על ידי פריקת צוואר הרחם (ללא הרדמה). השתמש ב-3-4 גורים כדי להשיג 250-300 זקיקים פרה-אנטרליים שלמים לניסויים.
- השכיבו את החיה על הגב וספגו את הבטן עם 70% אלכוהול איזופרופיל. בצע חתך אופקי קטן בקו האמצע בעזרת מספריים נקיים. אחוז בעור מעל ומתחת לחתך בעזרת מלקחיים עדינים ומשוך לשני הכיוונים (לכיוון הראש והרגליים) כדי לחשוף את הבטן.
- בעזרת סט שני של מספריים נקיים ומלקחיים עדינים, חותכים את דופן הבטן. הרם את סלילי המעי. אתר את קרני הרחם, הביציות והשחלות. בלו שחלות ומניחים בכלי באר מרכזי המכיל 1 מ"ל של מדיום טיפול OT שחומם ל-37 מעלות צלזיוס.
- בעזרת מיקרוסקופ מנתח, חתוך כל שומן ורקמת ביצית. חצו את השחלות.
3. בידוד זקיק ואשכול FL (FL-C).
- השתמש במכסה זרימה למינרי עם משטח מחומם של 37 מעלות צלזיוס לבידוד וטיפול בזקיקים. עבדו בצורה אספטית במכסה המנוע. היזהר עם צלחת ה-FCM. השתמש בבועה כדי לשמור על הכלי בגז עם 5% CO2 בעת עבודה בקולט האדים הלמינר.
הערה: יש לחמם מראש את כל התמיסות ל-37 מעלות צלזיוס. מדיום FCM, כמו גם שמן מינרלי, חייבים להיות מאוזנים מראש למשך הלילה בחממה ב-37 מעלות צלזיוס עם 6% CO2 לפני השימוש. pH בינוני ישתנה כאשר הוא מחוץ לחממה במשך יותר מ-10 דקות. - פיפט 6 מ"ל של FCM מאוזן מראש לשתי צלחות 60 מ"מ וכיסוי בשמן מינרלי. מניחים בחזרה בחממה.
- פיפט 1 מ"ל קולגנאז בצלחת באר מרכזית ו-3 מ"ל מדיום OT בדופן החיצונית. העבירו את השחלות לתמיסת קולגנאז באמצעות מיקרופיפטה מזכוכית (1000 מיקרומטר). דגרו את המנה למשך 30-40 דקות על המשטח המחומם של מכסה המנוע הלמינר.
- בתום הדגירה של הקולגנאז, פיפט 6 מ"ל של מדיום OT לשתי צלחות תרבית רקמה בגודל 60 מ"מ המסומנות 1 ו-2. הניחו על המשטח החם של מכסה המנוע.
- בעזרת מיקרופיפטה, העבירו את השחלות שטופלו בקולגנאז לבאר החיצונית כדי לשטוף ללא קולגנאז. החלף מיקרופיפטות ולאחר מכן העביר את השחלות לכלי OT 1.
- קצור זקיקים מכל שחלה באמצעות פיפטור P200. שחרר זקיקים על ידי שאיפה חוזרת וגירוש של השחלה שטופלה באנזים דרך קצה הפיפט שנחתך לגדלים שונים. התגרות מכנית של רקמה לשברים עם שתי מחטי 27G לפני הפיפטינג מועילה גם בשחרור זקיקים בודדים. כל גור עכבר צריך להניב 60-75 זקיקים שלמים בגודל הרצוי.
- במידת הצורך, החזירו חתיכות שחלה לא מנותקות בחזרה לקולגנאז למשך 5-10 דקות נוספות, שטפו וחזרו על הפיפטינג כדי לשחרר זקיקים נוספים.
הערה: חשיפת יתר לקולגנאז תגרום לשיבוש בשכבות תאי הגרנולוזה המקיפות את הביצית. אל תנסה לפרק את כל השחלה. עצור לאחר איסוף 250-300 זקיקים. - בדוק זקיקים משוחררים באמצעות מיקרוסקופ מנתח בהגדלה של פי 40. זהה זקיקים קדם-אנטרליים משניים (קוטר ~120 -140 מיקרומטר) עם ביצית הממוקמת במרכז הסגורה בתוך קרום בסיס שלם (למינה בסיסית). לזקיק בגודל זה יהיו בדרך כלל 2-4 שכבות של תאי גרנולוזה המקיפים את הביצית (ראה איור 1).
הערה: השווה זקיקים מול פתח של קצה מיקרופיפטה של 175 מיקרומטר לגודל הזקיק המשוער. גודל הזקיק צריך להיות בערך 3/4 מקוטר הפיפטה. זוהי השיטה המהירה ביותר לבחירת זקיקים בגודל הרצוי. - בעזרת מיקרופיפטה של 175 מיקרומטר, העבירו זקיקים נבחרים לצלחת OT2. עם השלמת האיסוף, שטפו את כל הזקיקים בצלחת FCM1 כדי להסיר עקבות של מדיום ה-OT. לאחר מכן מעבירים לצלחת FCM2.
- מניחים את המנה בחממה למשך 60 דקות לפני שמתחילים בתהליך ההטמעה.
- לבידוד אשכול זקיקים, בצע את שלבים 3.1 עד 3.5. השתמש בשני מזרקי טוברקולין (27 גרם) כדי להפריד את השחלה לשברים ולאחר מכן לאשכולות קטנים של 6-10 זקיקים.
הערה: תרבית אשכולות זקיקים (FL-C) היא חלופה לתרבית זקיקים בודדים. שיטה זו שומרת על ארכיטקטורה זקיקית מקורית יחד עם רכיבים סטרומליים. גודל הזקיק ב-FL-C אינו אחיד. זקיקים שומרים על תצורת ה-in vivo שלהם עם זקיקים ראשוניים, ראשוניים ומשניים נוכחים. - אסוף את אשכולות הזקיקים הללו (FL-C) עם מיקרופיפטה של 200 מיקרומטר לתוך צלחת OT2. עם השלמת האיסוף, שטפו את כל ה-FL-C והעבירו ל-FCM2 כדי להמתין להטמעה.
4. הטמעת זקיקים ואשכולות זקיקים
- הכן תמיסת מלאי של 10 מ"ג/מ"ל של הידרוג'ל היאלורונן (HA) המקושר לטירמין פעיל. יש להחזיר 250 מ"ג של אבקת נתרן היאלורונאט תחליף טירמין ב-25 מ"ל של אנזים חזרת פרוקסידאז (HRP; 10 יחב"ל/מ"ל) בתמיסת מלח עם פוספט. לאחר המסה, אחסן 500 מיקרוליטר של מלאי HA מופעל זה ב-4 מעלות צלזיוס לניסויים עתידיים.
- לניסויים בזקיקים, יש להפשיר את תמיסת ה-HA ולדלל אותה לריכוז של 3 מ"ג/מ"ל בתווך גלובלי שחומם ל-37 מעלות צלזיוס. בצע את כל שלבי ההטבעה בקולט אדים למינרי עם משטח ספסל המחומם ל-37 מעלות צלזיוס. השתמש בצלחת 60 מ"מ עם שמונה בארות של 100 מיקרוליטר להטמעה ותרבית זקיקים לאחר מכן.
- העבר זקיקים או אשכולות FL שיוטמעו מצלחת FCM לטיפה של ג'ל HA כדי לשטוף ללא מדיום תרבית. אמצעי המעקב יפריע להיווצרות הג'ל. הנח את צלחת ה-FCM בחזרה מתחת למבעבע לגז.
הערה: ניתן להטמיע זקיקים מבודדים, לבד או בקבוצות בהתאם לניסוי. בדרך כלל אנו מעדיפים לזרוע 2-4 זקיקים לכל חרוז. - מניחים 1 מיקרוליטר של 0.03% מי חמצן (H2O2) על צלחת פטרי. הוסף 25 מיקרוליטר של 3 מ"ג/מ"ל ג'ל HA על טיפת מי החמצן וערבב על ידי פיפטינג כדי ליזום קישור צולב (ראה איור 2).
- בעזרת פיפטור P20, משכו את תערובת HA-H2O2 וזרמו טיפה אחת (~8-10 מיקרוליטר) לשתי בארות נפרדות של צלחת התרבות בת 8 הבארות. הימנע מיצירת בועות.
- באמצעות מיקרו-פיפטה של 200 מיקרומטר, העבירו במהירות את הזקיקים או FL-C למרכז כל טיפה (איור 3). המהירות חשובה מכיוון שברגע שה-HA נחשף לזרז (מי חמצן) הוא יתחיל לג'ל תוך 1-2 דקות. היזהר לא להכניס בועות במהלך הזריעה.
הערה: כדי לעקוב אחר צמיחת זקיקים בודדים, מקם את הזקיקים במרחק זה מזה. אל תניח זקיקים קרוב מדי לתחתית הג'ל אחרת במהלך IVC הם עלולים לרדת מספיק כדי להיצמד. - אפשר ~ 3 דקות להשלמת תהליך הג'ל ולאחר מכן הוסף 100 מיקרוליטר של FCM מאוזן מראש לכל באר. חזור על תהליך זה והעמיס זקיקים לכל שמונה הבארות. מכסים בשמן מינרלי חם מאוזן מראש ומניחים את המנה בחממה.
5. ויטריפיקציה של זקיקים ואשכולות FL
הערה: ניתן לבצע ויטריפיקציה באמצעות מנשא פתוח (Cryoloop; CL), המאפשר מגע ישיר עם חנקן נוזלי, או מוביל סגור (Rapid I; RI), כאשר הדגימה אטומה בתוך קש חיצוני ולכן לעולם לא באה במגע עם חנקן נוזלי. איור 4 מציג את המכשירים והניגודים של שתי מערכות הזיגוג. ויטריפיקציה בשני המכשירים הוכחה כיעילה לשימור עובריםבהקפאה 35.
- ויטריפיקציה RI מוביל סגור
- יש לחמם מראש 2 מ"ל של תמיסות VS ל-37 מעלות צלזיוס בבלוק מחומם. בצע את כל שלבי הזיגוג על המשטח המחומם של מכסה המנוע הלמינרי באמצעות מיקרוסקופ מנתח כדי לדמיין את הזקיק והמנשא.
- מלאו את קופסת הקריו המבודדת בחנקן נוזלי (LN2). הנח את הקש החיצוני של המכשיר לתוך חריץ אחיזה בתוך הקופסה כך שהוא יהיה שקוע חלקית בחנקן נוזלי. הניחו את מקל הפלסטיק הפנימי עם חור זעיר על פני מכסה צלחת פטרי כהכנה להעמסה.
- מניחים שתי טיפות של VS1 זו לצד זו על צלחת פטרי ליד החלק העליון. השתמש במיקרופיפטה של 200 מיקרומטר כדי להניח שני זקיקים בטיפה הראשונה. יש לשטוף ולעבור במהירות לטיפה השנייה של VS1. דגירה למשך 5 דקות. אם אשכולות FL מזגגים, עבד אשכול בודד בכל פעם.
- מניחים שלוש טיפות של VS2 זו לצד זו על אותה צלחת כאשר הדגירה הראשונה כמעט הושלמה. לאחר מכן, העבירו במהירות זקיקים ברצף דרך שלוש טיפות ה-VS2 תוך 60 שניות והעמיסו על המנשא. הקפד לשאוב כמות מינימלית של נוזלים עם הזקיקים כדי להימנע ממעקב אחר המדיום מטיפה אחת לאחרת.
- כדי להעמיס את המנשא, הרם שני זקיקים והפקיד עם נוזל מינימלי לתוך החור הזעיר במקל הפלסטיק. נפח הנוזל הסופי בחור הוא זעיר < 0.5 מיקרוליטר. הימנע ממילוי יתר, הגורם לנוזל להישפך מהחור אל מקל הפלסטיק.
- זרוק את המקל לתוך הקש החיצוני שהתקרר מראש. השתמש בסילר האולטראסוני כדי לסגור ולאטום את הקש. מניחים את הקש בגביע המחובר לקריוקן. ניתן להניח עד 4 קשיות באותו גביע.
- מכסים את המקל בשרוול מגן מפלסטיק. צלול את המקל למיכל אחסון חנקן נוזלי (LN2).
- ויטריפיקציה פתוחה של מנשא CL
- יש לחמם מראש פתרונות VS ל-37 מעלות צלזיוס. בצע את כל שלבי הזיגוג על המשטח המחומם של מכסה המנוע הלמינר. הכן מראש את מספר המובילים הפתוחים של CL הדרושים. הכנס את גזע המתכת CL למכסה הבקבוקון הממוגנט, וודא שהוא מחזיק היטב (השתמש בטפטוף דבק זעיר במידת הצורך).
- מלאו את הקריובוקס המבודד בחנקן נוזלי (LN2). הנח מתלה לתוך הקריובוקס כדי להחזיק את הקריוביאלים כך ש-LN2 יהיה מתחת לחלק העליון של הבקבוקון.
- מלאו את הבקבוקון הממוגנט והמאוורר המיוחד ב-LN2. הניחו אותו על המתלה. בצע את שלבי הזיגוג כמתואר בשלבים 6.1.3 עד 6.1.5. ההבדל היחיד הוא שאנו בדרך כלל מעבדים חמישה זקיקים בכל פעם. שוב, הקפד למזער את נוזל המעקב מטיפה לטיפה.
- כדי להעמיס זקיקים, אחוז במנשא הפתוח CL במכסה המגנטי המצורף באמצעות שרביט המתכת. טבלו את המנשא הפתוח CL בטיפה נפרדת של VS2 כדי ליצור סרט של קריופרוטקטנט.
- בעזרת מיקרופיפטה, הרם את כל הזקיקים או את אשכול ה-FL והנח אותם על הסרט עם מינימום נוזלים. עבדו במהירות, מכיוון שיש להעמיס זקיקים לפני שהסרט מתחיל להתייבש.
- טבלו מיד את ה-CL לתוך הקריוביאל המלא ב-LN2 כדי לזגג את הדגימה. מכסים ומניחים בקבוקון על הקריוקן. מכסים בשרוול פלסטיק. צללו את המקל למיכל אחסון חנקן נוזלי.
6. התחממות של זקיקים מזוגגים ואשכולות FL
- התחממות מוביל סגורה של RI
- מכינים צלחת באר מרכזית עם 3 מ"ל FCM מאוזן מראש בבאר החיצונית ו -1 מ"ל בבאר המרכזית. כיסוי בשמן ומניחים בחממה.
- מניחים 0.5 מ"ל של WS1 ו- WS2 מחוממים מראש לשני מרכזים מסומנים היטב. העבירו קנים עם דגימות ממיכל האחסון לתוך קופסת קריוקופסה מלאה ב-LN2.
- הסר את מכסה קנה הפלסטיק. הסר את הקש מהגביע, השאיר אותו שקוע והחלק אותו לתוך חריץ האחיזה בקופסת הקריו.
- בעזרת מספריים עדינים, חותכים את הקש החיצוני ממש מעל הנקודה השחורה המציינת את החלק העליון של מנשא ה- RI הפנימי עם זקיקים.
- בעזרת מלקחיים עדינים, הרם מעט את מקל הפלסטיק הפנימי מהקש החיצוני. אחוז במכשיר וטבול במהירות את המקל ב-WS1, מסתובב בעדינות כדי לפרוק זקיקים. מהירות היא קריטית. יש לפרוק זקיקים לתוך WS1 תוך 10 שניות.
- השתמש במיקרוסקופ מנתח כדי לדמיין את הזקיקים וכדי לוודא שכולם נפרקו מהמנשא. לאחר 2 דקות ב-WS1, השתמש במיקרו-פיפטה כדי להעביר את כל הזקיקים (או FL-Cluster) ל-WS2, תוך הקפדה לא לעקוב אחר המדיום.
- לאחר 3 דקות יש לשטוף את הזקיקים בבאר החיצונית של צלחת ה-FCM ולאחר מכן לעבור לבאר המרכזית. יש להחזיר לאינקובטור למשך 1-2 שעות לפני ההטמעה.
- CL התחממות מנשא פתוח
- הכינו מנות FCM ו-WS כמתואר לעיל. העבירו את המקל עם הזקיקים ממיכל אחסון לקופסת קריו מלאה ב-LN2. הסר את מכסה קנה הפלסטיק.
- השתמש בשרביט המגנטי כדי להרים את המכסה הקריוביאלי עד שגזע המתכת של ה-CL נראה לעין.
- בעזרת מלקחיים אחזו בגזע המתכת. הסר את ה-CL מהבקבוקון וטבול מהר מאוד ב-WS 1, מסתחרר בעדינות כדי לפרוק זקיקים. פרוק לתוך WS1 תוך 10 שניות. באמצעות טווח ניתוח, ודא שכל הזקיקים נפרקו
- כל השלבים הנותרים להתחממות זהים לשלבים של מנשא סגור RI החל משלב 7.1.6.
7. הדמיית אשכולות זקיקים ו-FL ושינוי מדיה
- נטר זקיקים ואשכולות FL בבארות במהלך מרווח התרבית של 10-12 ימים באמצעות מיקרוסקופ אור הפוך עם אופטיקה של אפנון ניגודיות הופמן ומצויד במצלמת HD. השתמש בתוכנת הדמיה כדי ללכוד תמונות בהגדלה כוללת של 40x ו-100x או 200x, בהתאם לגודל.
- הדמיה והערכה של זקיקים
- ביום התרבות הראשון, לאחר ההטמעה, דמו את כל בארות התרבות בהגדלה של פי 40 ו-200x באמצעות מיקרוסקופ הפוך כדי לקבוע מורפולוגיה וגודל בסיסיים. מחזירים את המנה לחממה.
- צפה בתמונות ורשום את מספר הזקיקים המוטבעים במלואם בכל חרוז ג'ל. עבור FL-C, בצע הערכה של מספר הזקיקים בתחילת התרבית.
- באמצעות תוכנת הדמיה, מדוד את קוטר הזקיק לאורך מישורים אנכיים ואופקיים מקצה קרום המרתף. מדוד את גודל הביציות באופן דומה מהקצה החיצוני של הזונה. רשום ערכים ממוצעים. קח מדידה אנכית ואופקית של קוטר האשכול.
- המשיכו לצלם תרבויות כל 2-3 ימים. מדוד את קוטר הזקיקים שאינם במגע זה עם זה. עם FL-C, האשכולות מתגלגלים במהלך IVC, כך שניתן למדוד את הצביר כולו במישור האנכי והאופקי.
הערה: עבור זקיקים המקובצים זה לזה, ייתכן שלא ניתן יהיה להבחין בגבולות זקיקים בודדים לאחר היום הרביעי של התרבית, ולכן לא נלקחות מדידות. - סווג זקיקים שהופכים כהים או אפופטוטיים, כמו גם כאלה שבהם הביצית כבר לא מוקפת בתאי גרנולוזה או שחולצה כלא בת קיימא. עקוב אחר כל זקיקים או FL-C שנצמדו למשטח הכלי (ראה איור 5).
- התבונן היטב בזקיקים להיווצרות אנטרום מהיום ה-8 ואילך. זקיקים עם אנטרומים ייראו כאילו יש להם חלל פנוי או מרחב קל יותר בתוכם (איור 6).
- בצע חצי החלפת מדיום תרבית כל יומיים. השתמש בפיפטור P200, המוגדר ל-50 מיקרוליטר. הכנס את הקצה לבאר מתחת לכיסוי השמן והרחק מחרוז הג'ל. משוך לאט לאט 50 מיקרוליטר ממדיום התרבית. החלף את המדיום על ידי פיפטינג איטי של 50 מיקרוליטר של FCM טרי מתחת לכיסוי השמן. הימנע מיצירת בועות.
8. הבשלת ביציות בזקיקים עטופים
הערה: שלב ההתבגרות הסופי מתחיל בדרך כלל כאשר היווצרות אנטרום בקרב סך הזקיקים הזרעים (והקיימא) מגיעה ליותר מ-40%. עם זאת, במקרה שהיווצרות האנטרום נמוכה או אינה נראית לעין, אנו ממליצים להפעיל עד היום ה-12 של התרבית. לא ראינו שום תועלת בהמתנה עוד. עבור תרביות FL-C, ההתבגרות מופעלת בדרך כלל כאשר נצפים אנטרומים ב-40% מהבארות או לכל המאוחר עד היום ה-12.
- הכן מדיום התבגרות במבחנה (IVM) על ידי השלמת FCM עם 1.5 IU/mL של גונדוטרופין כוריוני אנושי (hCG) ו-5 ננוגרם/מ"ל של גורם גדילה אפידרמיס (EGF).
- טריגר התבגרות על ידי החלפת FCM בכל באר ב-100 מיקרוליטר של מדיום IVM בסביבות השעה 17:00. לאחר התבגרות לילה (16-18 שעות לאחר ההדק), השתמש במיקרוסקופ מנתח בהגדלה של פי 40 כדי לבחון כל תרבית היטב עבור קומפלקסים של קומולוס-ביציות (COCs) שביוצו מחרוז הג'ל HA. ה-COCs נמצאים בדרך כלל נחים ממש מעל חרוז הג'ל או בסמיכות.
- אוספים את ה-COCs הביוצים לתוך צלחת באר מרכזית עם 1 מ"ל של FCM מאוזן מראש מכוסה בשמן ומניחים את המנה בחזרה בחממה.
- אסוף ביציות מזקיקים שעדיין מוטבעים על ידי פיפטינג עדין של חרוז ה-HA-באמצעות פיפטור P200 כדי לשחרר COCs שאינם מביוץ. אוספים אותם בכלי נפרד עם FCM.
- מכינים צלחת באר מרכזית עם 1 מ"ל היאלורונידאז (10 IU/mL) ו-3 מ"ל מדיום FCM בדופן החיצונית.
- להעביר COCs מיוצים לתמיסת היאלורונידאז ולחשוף לזמן קצר לאנזים (30-45 שניות) כדי להוציא את הביצית של תאי גרנולוזה על מנת לדמיין את מצב הגרעין של הביצית. יש לשטוף את הביציות כדי להסיר את האנזים לפני הנחת טיפות של 5 מיקרוליטר של חומר טרי מתחת לשמן להערכה מפורטת. מניחים את המנה בחממה. חזור על תהליך זה עבור COCs שאינם מביוץ.
- רשום את המספר הכולל של הביציות הביוציות והלא מבייצות. צלם והעריך את המצב הגרעיני (GV, metaphase I או metaphase II) של כל ביצית ששוחזרה. מדוד ורשום קוטר.
- חשב את שיעור ההישרדות של IVC על סמך סך הזקיקים ברי הקיימא (אלה שהגיעו ליום הטריגר של hCG) וסך הביציות שהוחזרו. חשב את אחוז הביציות של מטפאזה II מה-COCs הביוץ. חזור על פעולה זו עבור כל הביציות שהתאוששו מה-COCs הלא מביוץ.
- קבע את קצב ההתבגרות למטפאזה II באותו אופן עבור FL-C.
תוצאות
מאמר זה מפרט מתודולוגיה לשימוש בג'ל היאלורונן חדשני המקושר לטירמין לתרבית חוץ גופית של זקיקים פרה-אנטרליים של עכבר36,37. איור 6 ממחיש את ההבדלים בין צמיחת זקיקים קדם-אנטרליים כאשר היא מונחת במערכת תרבית דו-ממדית קונבנציונלית לעומת זקיק בודד עטוף בג'ל HA לתרבית תלת מימדית. ארכיטקטורת הזקיקים המקומית נשמרת במהלך 12 ימי התרבות עם אנטרום הנראה בבירור ביום האחרון של הצמיחה.
ג'ל ה- HA הוא תכליתי מאוד, ומאפשר צמיחה של זקיקים מבודדים בנפרד או בקבוצות וגם רקמת השחלה נשברת מכנית לאשכולות קטנים של זקיקים. הג'ל שקוף ומאפשר לדמיין זקיקים גם אם בעומקים שונים. זקיקים עטופים ו-FL-C מציגים התרחבות רדיאלית מהמשך התפשטות תאי גרנולוזה (איור 7). קוטר הזקיקים הראשוני הוא בממוצע 139.8 ±-28 מיקרומטר כאשר קוטר ביצית GV הוא 63.5 ±-4.6 מיקרומטר. בזקיקים מתורבתים בודדים, הקוטר הסופי נמדד בכ-385.6 ±-36.7 מיקרומטר, עלייה של פי 3 בערך. ביציות מטפאזה II מיוססות נמדדות בסביבות 84.8 ± 3.8 מיקרומטר. בתוך אשכולות FL מתורבתים, גודל הזקיק מגוון למדי (איור 5, איור 7). ביציות מבוקרות לאחר טריגר hCG נמצאות ליד הזקיק (איור 8). רוב הביציות המטאפאזה II יוחזרו מה-COCs הביוץ. זקיקים שעדיין מוטבעים לאחר ההדק מכילים בדרך כלל ביציות GV ומטפאזה I.
טבלה 1 מנגידה את שיעורי ההתבגרות בין זקיקים מבודדים ואשכולות FL משחלות טריות או קפואות. ל-FL-C משחלות שמורות בהקפאה היו שיעורי התבגרות נמוכים משמעותית. תצפיות מיקרוסקופיות הראו שלעתים קרובות יש להם למינה בסיסית שבורה, מה שהופך אותם לרגישים למדי לשחול ביציות מוקדם מדי. האופי השברירי של אשכולות זקיקים נוטרל במידת מה על ידי אנקפסולציה. טיפול בקולגנאז בשחלות שמורות בהקפאה נמנע מכיוון שהוא היה מזיק במיוחד עם הישרדות נמוכה ותפוקה נמוכה של זקיקים שלמים.
שימור בהקפאה של זקיקים מבודדים יעיל בהרבה משימור שחלות שלמות. ניתן להשיג שיעורי התבגרות גבוהים בשתי שיטות הזיגוג שנבדקו (טבלה 2). למרות הבדלים גדולים בשיעורי הקירור, הבשלת הביציות לאחר IVC לא הייתה שונה. המנשא הפתוח CL אכן מאפשר יעילות רבה יותר מכיוון שניתן להעמיס עד עשרה זקיקים על מנשא פתוח CL יחיד. זה גם מקצר את הזמן הכולל לשחזור זקיקים מרובים בהקפאה. עם זאת, עבור כל יישום קליני בסופו של דבר של ויטריפיקציה לזקיקים אנושיים, המערכת הסגורה עשויה להיות עדיפה.
ניתן להשתמש בסידור כרומטין סביב הגרעין של ביצית GV כדי לזהות ביציות הסבירות ביותר להפרות לאחר הביוץ ולהתפתח לבלסטוציסטים38. איור 9 ממחיש צביעה חיה של ביציות כדי להמחיש את דפוס התפלגות הכרומטין.
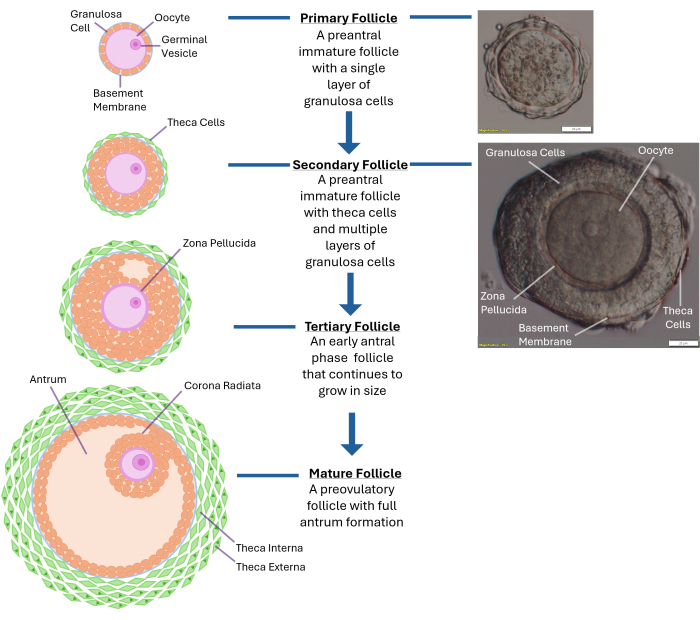
איור 1: סכמטי של צמיחת זקיקים. תרשים זה ממחיש את השלבים השונים של התפתחות הזקיק מזקיק ראשוני לשלב הפרה-אנטרלי המשני ולבסוף לזקיק שלישוני בוגר לחלוטין המוכן לביוץ. תמונה מיקרוסקופית של זקיק פרה-אנטרלי טיפוסי מוצגת גם עם התכונות המורפולוגיות השונות שלו. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
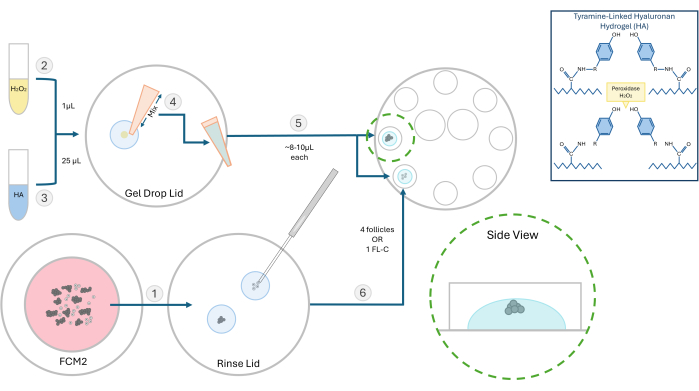
איור 2: סכמטי של שיטת אנקפסולציה של HA. מבנה הג'ל ההיאלורונן והשלבים השונים להטמעת זקיקים מומחשים בתרשים זה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
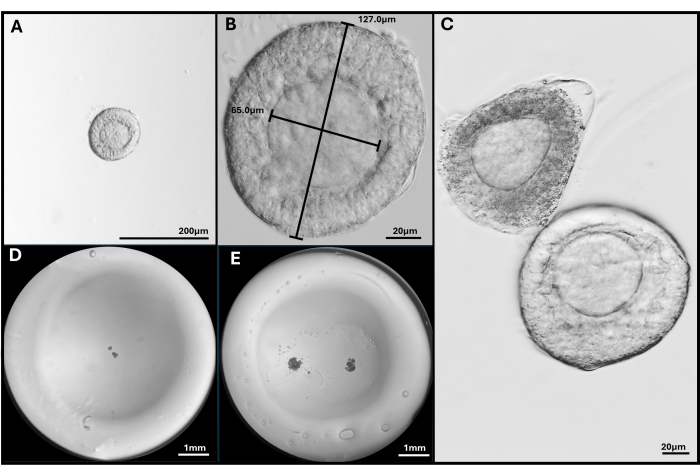
איור 3: בידוד זקיק ואנקפסולציה. (A, B) זקיק פרה-אנטרלי שנבחר להטמעה בהגדלה של פי 40 ו-200x. (C) זקיק אפופטוטי מוצג עם זקיק פרה-אנטרלי בריא עם ביצית לא ממש מרכזית. (D) תמונה של חרוז ג'ל HA עם זקיקים ו-(E) עם שני FL-C. תמונות שצולמו בסטריאומיקרוסקופ כדי להראות את כל חרוז הג'ל. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: התקני ויטריפיקציה לשימור בהקפאה של זקיקים מבודדים. עם מכשיר הנשא הפתוח CL, שלב הזיגוג מתבצע על ידי טבילה ישירה של זקיקים בחנקן נוזלי. קצב הקירור הוא, אם כן, גבוה ביותר, מעל -20,000 מעלות צלזיוס לדקה. לעומת זאת, עם המנשא הסגור RI, זקיקים נטענים על מקל הפלסטיק הפנימי ונופלים לתוך קש חיצוני שקוע בחנקן נוזלי. שיטת ויטריפיקציה סגורה זו נמנעת ממגע ישיר עם חנקן נוזלי. עם זאת, קצב הקירור נמוך משמעותית ב-1220 מעלות צלזיוס לדקה. העמסה והתאוששות של זקיקים מכל אחד מהנשאים היא קלה. המנשא הפתוח CL הכיל טעינה של עד עשרה זקיקים למכשיר בהשוואה לשניים בלבד עם המנשא הסגור RI. נתון זה שונהמ-35. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
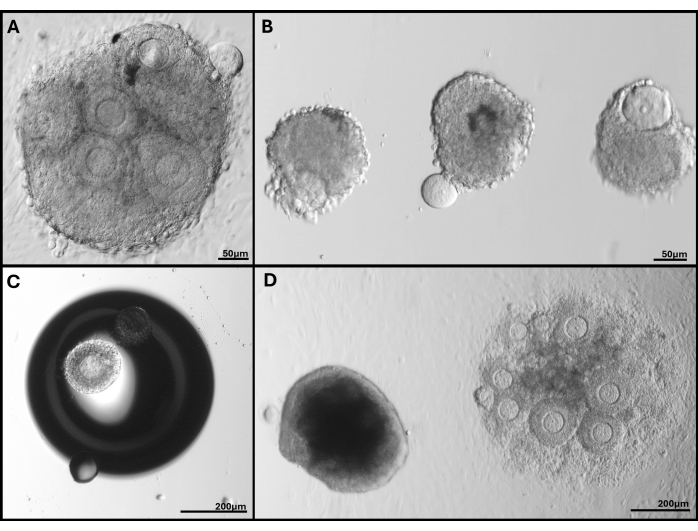
איור 5: תמונות מייצגות של בעיות שנתקלו בהן. (A) אשכול זקיקים עם ביצית מוחצנת. (B) זקיקים מבודדים עם קרום למינה בזאלי שבור ואחד עם ביצית מוחצנת. (C) זקיק מוטבע מתחת לבועה בג'ל. (D) אשכול זקיקים שנשאר בג'ל (משמאל) בהשוואה לאשכול שהוטבע עמוק מדי שבסופו של דבר התחבר לצלחת. המגוון הרחב של גדלי הזקיקים ב-FL-C נראה בבירור. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
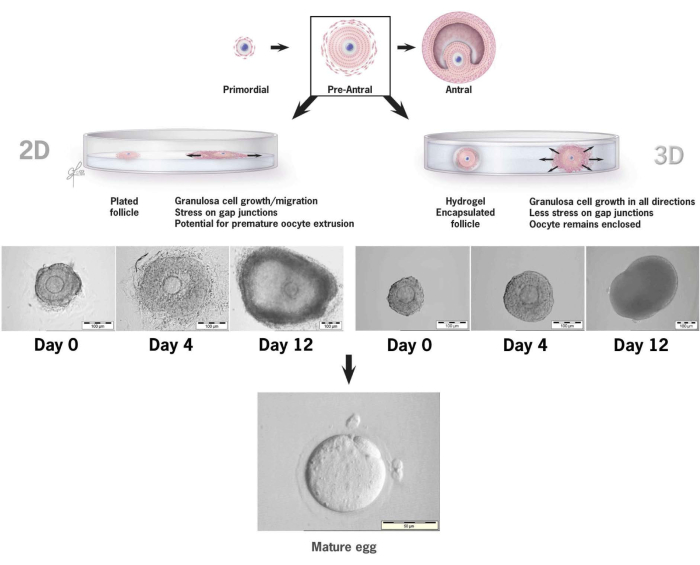
איור 6: השוואה של צמיחת זקיקים במוסכמות דו-ממדיות לעומת תרבית תלת-ממדית ב-HA. עם צמיחה דו-ממדית, השטחה של הזקיק והצמדה של תאי גרנולוזה לצלחת תרבית הרקמה נצפתה ביום הרביעי, מה שהותיר את הביצית פגיעה לנדידת תאי גרנולוזה, שיבוש צמתי פערים ושחול ביציות מוקדם. הזקיק המכוסה ב-HA נותר לא מחובר לאורך כל מרווח התרבית. התרחבות תאי גרנולוזה התרחשה לכל הכיוונים, עטפה את הביצית ושמרה על ארכיטקטורה תלת מימדית. נתון זה שונהמ-36. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 7: תמונות מייצגות של זקיקים עטופים בג'ל היאלורונן המקושר לטירמין. (A) זקיק קדם-אנטרלי שנאסף לאחר עיכול קולגנאז של שחלה טרייה ביום הראשון. (B) טיפת ג'ל עם ארבעה זקיקים קדם-אנטרליים שצולמו ביום 1 ו-(C) ביום 4 של התרבית (D) אשכול זקיקים משחלה טרייה ביום 2 (E) ביום 6 ו-(F) ביום 9 של התרבית. (G) אשכול זקיקים שנותח מכנית משחלה שלמה מזוגגת המוצגת ביום 2 ו-(H) ביום 6 של התרבית. (I) זקיק עם היווצרות אנטרום נראה בבירור ביום התשיעי של התרבות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
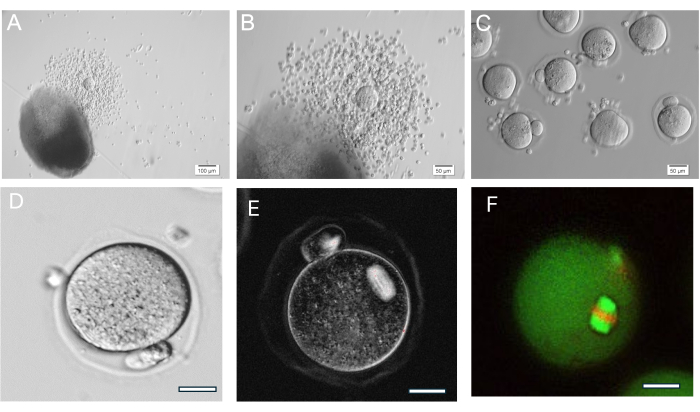
איור 8: ביוץ ביציות. (A, B) קומפלקס קומולוס-ביצית (COC) מוצג הבא של חרוז ג'ל HA. (C) ביציות צולמו לאחר טיפול אנזימטי ב-COCs עם היאלורונידאז כדי להסיר תאי קומולוס מסביב. ביציות מטפאזה II רבות. (D) ביצית מטפאזה II עם גוף קוטבי בולט. הגדלה 400x. (E) הדמיה חיה של ביצית מטפאזה II באמצעות אור מקוטב ומערכת הדמיה להדמיית ציר מיוטי ולהערכת ארגון, שנעשתה כמתוארב-37. הגדלה פי 400. ציר דו-שביר רגיל גלוי. (F) ביצית Metaphase II קבועה ומוכתמת באנטי-אלפא/בטא-טובולין ופרופידיום יודיד כדי להמחיש את ארגון הציר המיוטי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
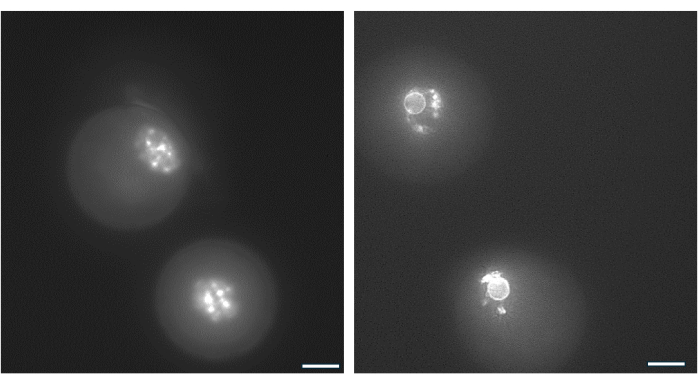
איור 9: ארגון מחדש של כרומטין בביציות GV. סידור הכרומטין בביציות GV לאחר היווצרות אנטרום נבדק על ידי צביעת DNA עם Hoechst 33342 (50 ננוגרם/מ"ל). זקיקים מייצגים נקטפו מחרוזי HA על ידי פיפטינג עדין. תאי גרנולוזה הוסרו באמצעות היאלורונידאז. ביציות GV הוכתמו לאחר מכן במשך 15 דקות (ראה פרוטוקול של Monti et al.38). התמונות צולמו בהגדלה של פי 40. (A) ביצית GV שמוצגת ביום הראשון בהתחלת התרבית ומציגה את דפוס הצביעה של כרומטין לא מוקף (NSN). (B) ביצית GV מזקיק גדל עם אנטרום שמוצג ביום הטריגר של hCG. הכרומטין התעבה ויצר טבעת פרי-גרעינית סביב הגרעין. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| פרמטר | שחלה טרייה | שחלה קפואה | |
| מבודד FL | אשכול FL | אשכול FL | |
| זקיקים שנצפו במהלך IVC | 130 | 154 | 69 |
| ביוץ לאחר HCG (%) | 71% | 66% | 93% |
| (92/130) | (101/154) | (64/69) | |
| GVBD (%) | 30% | 28% | 52% |
| (28/92) | (28/101) | (33/64) | |
| היווצרות ביציות MII (%) | 59% | 55% | *34% |
| (54//92) | (56/101) | (22/64) | |
טבלה 1: תוצאות עם זקיקים משובצים ב-HA משחלות טריות ומזוגגות. זקיקים ו-FL-C משחלות טריות הבשילו במבחנה לאחר אנקפסולציה בג'ל HA. ג'ל HA נבדק גם על זקיקים משחלות מזוגגות באמצעות פרוטוקול EG/DMSO39. עם שחלות טריות, גם זקיקים בודדים (FL) וגם אשכולות זקיקים (FL-C) נאספו לאחר עיכול קולגנאז. עבור שחלות מזוגגות, חשיפה לקולגנאז הייתה למעשה מזיקה לזקיקים. הגישה הטובה ביותר עם שחלות שמורות בהקפאה הייתה לבודד אשכולות FL במקום זקיקים בודדים ולהשתמש רק בדיסקציה מכנית עם מחטים. הטבלה מנגידה את התוצאות בין חרוזי HA שנזרעו עם זקיקים בקבוצות של 4-6 לעומת חרוזים עם FL-C יחיד המכיל 6-10 זקיקים. *שיעור ההתבגרות עם FL-C משחלות שמורות בהקפאה היה נמוך משמעותית (p = 0.008; ניתוח חי בריבוע לבדיקת מובהקות).
| נושאת | RI | קלרנית |
| (סגור) | (פתוח) | |
| הישרדות (%) | 100% (24/24) | 100% (41/41) |
| היווצרות אנטרום* (%) | 25.0% (6/24) | 75.6% (31/41)* |
| שיעור ביוץ (%) | 66.7% (16/24) | 87.8% (36/41) |
| קצב התבגרות (% MIIs) | 81.3% (13/16) | 69.4% (25/36) |
טבלה 2: תוצאות לאחר שימור בהקפאה של זקיקים מבודדים בשני מכשירי ויטריפיקציה שונים. שיעורי התבגרות גבוהים הושגו הן עם מכשיר ה-CL הפתוח והן עם נושא ה-RI הסגור, עם קצב הקירור הנמוך יותר שלו. היווצרות אנטרום הייתה מדד התוצאה היחיד שנצפה כמשמעותי אך לא השפיע על קצב ההתבגרות הכולל (עמ' < 0.05; ניתוח חי בריבוע לבדיקת מובהקות).
Discussion
היכולת לשלוט בתכונות המכניות והפירוק הביולוגי של הידרוג'ל HA המקושר לטירמין מציעה יתרונות רבים ליישומי הנדסת רקמות. המעבדה שלנו היא הראשונה שמרחה את ג'ל ה-HA הספציפי הזה לצמיחת זקיקי שחלות. ג'ל נתרן היאלורונאט המוגן בפטנט (TS-NAHY) הוא מערכת הידרוג'ל חדשה מבוססת היאלורונן שפותחה בקליבלנד קליניק. קישור צולב של הג'ל מונע על ידי חשיפה של הפרוקסידאז בתערובת הג'ל המופעלת לחומר מחמצן. ניתן לעשות זאת גם במבחנה וגם ב- vivo. הידרוג'לים שנוצרו TS-NAHY מציגים קשת רחבה של תכונות מג'ל חלש, משחה למוצק שביר, תלוי בריכוז הג'ל40.
ההתקדמות המאכזבת בתרבות זקיקי השחלות מדגישה את הצורך בעיצוב מודלים חדשים של תרבויות. יצירת מערכת תרבית המבוססת אך ורק על רכיבי מטריצה חוץ-תאיים מקוריים עשויה להיות גישה מועילה יותר. מודל תרבית ה-HA המתואר קל לשימוש בצורה פיזיולוגית ללא דרישה לרכיבי ECM נוספים. הג'ל שקוף, ומאפשר הדמיה מפורטת של הזקיקים. התכונות הויסקו-אלסטיות של ג'ל HA מקלות על התאמת הנוקשות כמו גם על יכולת התבנית. תכונה זו מגדילה את הרבגוניות של ביומטריצה זו. קשיחות של ביומטריצה יכולה להשפיע על התפשטות תאי גרנולוזה והיווצרות אנטרום 30,41,42. דווח כי לזקיקים שמקורם בסביבות תרבית המתירניות להיווצרות אנטרום יש פרופילי ביטוי גנים שונים מאלה במערכת תרבית שאינה תומכת43. נראה כי זקיקי פרימטים דורשים מטריצה נוקשהיותר 44. התאמת הביומטריצה כך שתעמוד בדרישות של מינים שונים של בעלי חיים, כולל בני אדם, תהיה ככל הנראה חשובה להבשלה מוצלחת במבחנה.
עבור צמיחת זקיקים פרה-אנטרליים של עכברים, בדקנו ריכוזי ג'ל הנעים בין 2-5 מ"ג/מ"ל36. שיעורי הבשלת הביציות נעו בין 44% ל-58%. ריכוזים גבוהים יותר של ג'ל HA אפשרו יותר יכולת עיצוב ושמירה על מבנה תלת מימדי, אך התרחבות הזקיקים הושפעה. ריכוזי HA נמוכים יותר אפשרו התרחבות רדיאלית רבה יותר של הזקיק אך הגדילו את הסיכון ליציאה ספונטנית של הזקיק לפני סוף IVC. ריכוז 3-3.5 מ"ג/מ"ל של HA עבד בצורה הטובה ביותר עבור זקיקים פרה-אנטרליים של עכברים. שמירה על טיפת הג'ל קטנה הייתה חיונית ליצירת חרוזי ג'ל HA עם עומק מספיק כדי לשמור על זקיקים בתצורה תלת מימדית לאורך IVC. טיפות גדולות יותר השתטחו, וכתוצאה מכך ירידת זקיקים דרך הג'ל והיצמדות למשטח הצלחת. מגבלה אחת של השימוש בחומר ביולוגי זה להטמעה היא זמן הג'לציה המהיר במיוחד. זה מקשה על זריעה של יותר משני חרוזי ג'ל HA בכל פעם. הגדלת היעילות של זריעת זקיקים לג'ל HA היא תחום אחד שאנו מנסים לשפר בו.
לתרבית אשכולות זקיקים בסביבה תלת מימדית באמצעות HA יש פוטנציאל גדול. ארכיטקטורת השחלות הרגילה נשמרת, עם זקיקים בגדלים שונים במגע זה עם זה והסטרומה התומכת. LH עשוי לסייע לצמיחה של זקיקים פרה-אנטרליים קטנים יותר ב-FL-C על ידי גרימת שינויים בתאי התמיינות מוקדמים, ולכן הוא נכלל במדיום FCM45. המשך התרבית של FL-C לאחר 12 הימים כדי לראות אם ניתן להתחיל גל חדש של גדילה בכל אחד מהזקיקים הקטנים יותר שעדיין מוטבעים לאחר טריגר ה-hCG זקוק למחקר נוסף. אופטימיזציה נוספת של סביבת התרבות עשויה להיות תנאי מוקדם לגידול זקיקים בטווחי גדלים שונים בשבר רקמה. היתרון של מודל תרבית HA תלת-ממדי זה עם FL-C הוא שהוא מאפשר חיקוי קרוב של סידור ואינטראקציות זקיקים in vivo . תכונה חשובה נוספת היא שבניגוד לסידן אלגינט ומערכות פולימריות אחרות, ניתן לגרום לביוץ והתבגרות מבלי להסיר פיזית את הזקיקים מהרקמה או ממטריצת הג'ל.
הזמן הדרוש לתרבית זקיקים במבחנה והשגת ביציות בוגרות להקפאה הוא ארוך, במיוחד ביונקים גדולים. היכולת לשמר בהקפאה זקיקים שנקטפו או אשכולות זקיקים מהווה דרך לדחות שלב זה לזמן מאוחר יותר ואולי נוח יותר. אם יום אחד ניתן יהיה ליישם טכנולוגיה כזו על זקיקים אנושיים במהלך קציר השחלות, היא עשויה להועיל. שימור הקפאה של שחלות שלמות לשימור פוריות הוא, נכון לעכשיו, האפשרות היחידה עבור המטופלים. אך עדיין לא ברור אם זו אכן השיטה הטובה ביותר. במאמר זה, אנו מציגים מתודולוגיית ויטריפיקציה לשימור הקפאה של זקיקים פרה-אנטרליים המעניקה שיעורי הישרדות והתבגרות מצוינים לאחר התחממות לאחר תרבית תלת מימדית.
לסיכום, תיארנו מודל תרבית תלת-ממדי חדש באמצעות היאלורונן, מרכיב של ECM מקורי. טכניקת אנקפסולציה של HA מאפשרת שמירה על גורמים טרופיים בסמיכות לזקיקים המתפתחים. המתודולוגיה לאנקפסולציה בביומטריצה היא פשוטה ויכולה להכיל זקיקים מבודדים כמו גם אשכולות זקיקים. האחרון עשוי לפתוח אפיקי מחקר חדשים ולספק תובנה לגבי הביולוגיה הבסיסית של הזקיקים והוויסות שלה. ביציות מזקיקים עטופים ב-HA הוכחו כמוכשרות מבחינה תפקודית37. ניתן להפרות את הביציות הללו, ליצור בלסטוציסטים במבחנה ולהשתיל אותם עם העברתם לעכברים פסאודו-בהריון. נתונים אלה מאמתים את השימוש בהיאלורונן המקושר לטירמין כביומטריצה לתרבית זקיקים תלת מימדית ולהבשלת ביציות במבחנה. פרוטוקול זה יכול להיות מיושם על תרבית זקיקי שחלות במודלים אחרים של בעלי חיים, כולל בני אדם. יישומים אפשריים אחרים למערכת ג'ל HA תלת מימדית זו עשויים להיות גוף עוברי ותרבית אורגנואידים.
Disclosures
אין ניגודי אינטרסים או גילויים.
Acknowledgements
אנו רוצים להודות לכל צוות האמבריולוגיה בקליבלנד קליניק על הסיוע, כמו גם למחלקת REI ובמיוחד לד"ר פלקון על התמיכה. פרויקט זה מומן באמצעות קרן מחקר בקליבלנד קליניק.
Materials
| Name | Company | Catalog Number | Comments |
| Anti-alpha tubulin-FITC labelled | Sigma-Aldrich | F2168 | |
| Anti-beta tubulin-FITC labelled | Sigma-Aldrich | F2043 | |
| BZ-X700 | Keyence | ||
| Center well dish | Fisher Scientific | 08-772-12 | |
| Collagenase Type I | Worthington Biochemical Corporation | LS004196 | |
| Crycap vial-vented | Hampton Research | HR4-904 | |
| Cryoloop | Hampton Research | HR4-974 | |
| Crystal cap | Hampton Research | HR4-733 | |
| Culture dish 60mm | Fisher Scientific | 08-772B | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Epidermal growth factor (EGF) | R &D Systems | 236-EG | |
| Ethylene Glycol (EG) | Sigma-Aldrich | 293237 | |
| Fetal Bovine Serum-Heat Inactivated | ThermoFisher Scientific | 10082-147 | |
| Follicle Stimulating Hormone (FSH) | Sigma-Aldrich | F4021 | |
| Global-Hepes medium | CooperSurgical | LGGH-100 | |
| Hoechst 33342 | Sigma-Aldrich | B2261 | |
| Human chorionic gonadotrophin (hCG) | Sigma-Aldrich | CG10 | |
| Human serum albumin | CooperSurgical | GHSA-125 | |
| Hyaluronidase | CooperSurgical | ART-4007-A | |
| Hydrogen Peroxide | CVS Pharmacy Inc. | 372441 | |
| Insulin-transferrin-selenium (ITS) | ThermoFisher Scientific | 41400-045 | |
| Leibovitz medium (L-15) | ThermoFisher Scientific | 11415-064 | |
| Luteinizing hormone | Sigma-Aldrich | L9773 | |
| Magnetic wand | Hampton Research | HR4-729 | |
| Micropipettes (1000 µm) | Minitube | 19025/0050 | |
| Micropipettes (175 , 200, and 275µm) | CooperSurgical | MXL3-175, MXL3-200, MXL3-275 | |
| Millex GV filter 0.22 µm | Millipore | SLGU033RS | |
| Mineral oil | CooperSurgical | LGOL-500 | |
| Minimum Essential Medium alpha (MEM) | ThermoFisher Scientific | 32561-037 | |
| Oocyte Imaging System-Spindleview | Hamilton Thorne | ||
| Phosphate buffered saline (PBS) | ThermoFisher Scientific | 10010-023 | |
| Propidium iodide | Sigma-Aldrich | P4170 | |
| Rapid i | VitroLife | 14406 | |
| SmartBox | VitroLife | 14423 | |
| Synthetic Protein Substitute (SPS) | CooperSurgical | ART-3011 | |
| Tyramine -linked Hyaluronan Biohydrogel Kit | LifeCore | ENG-00151 | |
| Ultrasonic sealer | VitroLife | 14415 | |
| Universal GPS Culture dish 8x 100 µl wells | CooperSurgical | UGPS-010 |
References
- Telfer, E. E., Andersen, C. Y. In vitro growth and maturation of primordial follicles and immature oocytes. Fertil Steril. 115 (5), 1116-1125 (2021).
- Telfer, E. E., McLaughlin, M. Natural history of the mammalian oocyte. Reprod Biomed Online. 15 (3), 288-295 (2007).
- Xiao, S., et al. In vitro follicle growth supports human oocyte meiotic maturation. Sci Rep. 5, 17323 (2015).
- Carabatsos, M. J., Sellitto, C., Goodenough, D. A., Albertini, D. F. Oocyte-granulosa cell heterologous gap junctions are required for the coordination of nuclear and cytoplasmic meiotic competence. Dev Biol. 226 (2), 167-179 (2000).
- Diaz, F. J., Wigglesworth, K., Eppig, J. J. Oocytes are required for the preantral granulosa cell to cumulus cell transition in mice. Dev Biol. 305 (1), 300-311 (2007).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biol Reprod. 73 (2), 351-357 (2005).
- Dadashzadeh, A., Moghassemi, S., Shavandi, A., Amorim, C. A. A review on biomaterials for ovarian tissue engineering. Acta Biomater. 135, 48-63 (2021).
- Simon, L. E., Kumar, T. R., Duncan, F. E. In vitro ovarian follicle growth: a comprehensive analysis of key protocol variablesdagger. Biol Reprod. 103 (3), 455-470 (2020).
- Belli, M., et al. Towards a 3D culture of mouse ovarian follicles. Int J Dev Biol. 56 (10-12), 931-937 (2012).
- Berkholtz, C. B., Shea, L. D., Woodruff, T. K. Extracellular matrix functions in follicle maturation. Semin Reprod Med. 24 (4), 262-269 (2006).
- Desai, N., et al. Three-dimensional in vitro follicle growth: overview of culture models, biomaterials, design parameters and future directions. Reprod Biol Endocrinol. 8, 119 (2010).
- Shea, L. D., Woodruff, T. K., Shikanov, A. Bioengineering the ovarian follicle microenvironment. Annu Rev Biomed Eng. 16, 29-52 (2014).
- Paulini, F., et al. Survival and growth of human preantral follicles after cryopreservation of ovarian tissue, follicle isolation and short-term xenografting. Reprod Biomed Online. 33 (3), 425-432 (2016).
- West, E. R., Xu, M., Woodruff, T. K., Shea, L. D. Physical properties of alginate hydrogels and their effects on in vitro follicle development. Biomaterials. 28 (30), 4439-4448 (2007).
- Joo, S., et al. The effect of collagen hydrogel on 3D culture of ovarian follicles. Biomed Mater. 11 (6), 065009 (2016).
- Telfer, E., Torrance, C., Gosden, R. G. Morphological study of cultured preantral ovarian follicles of mice after transplantation under the kidney capsule. J Reprod Fertil. 89 (2), 565-571 (1990).
- Torrance, C., Telfer, E., Gosden, R. G. Quantitative study of the development of isolated mouse pre-antral follicles in collagen gel culture. J Reprod Fertil. 87 (1), 367-374 (1989).
- Dong, C., Yonggang, L. V. Application of collagen scaffold in tissue engineering: recent advances and new perspectives. Polymers. 8 (2), 42 (2016).
- Le, B. A. M., et al. Agarose-based 3D culture improved the developmental competence of oocyte-granulosa complex isolated from porcine preantral follicle. Theriogenology. 223, 11-21 (2024).
- Park, J. E., et al. In vitro maturation on an agarose matrix improves the developmental competence of porcine oocytes. Theriogenology. 157, 7-17 (2020).
- Zaniker, E. J., et al. Three-dimensionally printed agarose Micromold supports scaffold-free mouse ex vivo follicle growth, ovulation, and luteinization. Bioengineering. 11 (7), 719 (2024).
- Pangas, S. A., Saudye, H., Shea, L. D., Woodruff, T. K. Novel approach for the three-dimensional culture of granulosa cell-oocyte complexes. Tissue Eng. 9 (5), 1013-1021 (2003).
- West, E. R., Shea, L. D., Woodruff, T. K. Engineering the follicle microenvironment. Semin Reprod Med. 25 (4), 287-299 (2007).
- Xu, J., et al. Survival, growth, and maturation of secondary follicles from prepubertal, young, and older adult rhesus monkeys during encapsulated three-dimensional culture: effects of gonadotropins and insulin. Reproduction. 140 (5), 685-697 (2010).
- Xu, M., Kreeger, P. K., Shea, L. D., Woodruff, T. K. Tissue-engineered follicles produce live, fertile offspring. Tissue Eng. 12 (10), 2739-2746 (2006).
- Amorim, C. A., Van Langendonckt, A., David, A., Dolmans, M. M., Donnez, J. Survival of human pre-antral follicles after cryopreservation of ovarian tissue, follicular isolation and in vitro culture in a calcium alginate matrix. Hum Reprod. 24 (1), 92-99 (2009).
- Converse, A., Zaniker, E. J., Amargant, F., Duncan, F. E. Recapitulating folliculogenesis and oogenesis outside the body: encapsulated in vitro follicle growth dagger. Biol Reprod. 108 (1), 5-22 (2023).
- Mainigi, M. A., Ord, T., Schultz, R. M. Meiotic and developmental competence in mice are compromised following follicle development in vitro using an alginate-based culture system. Biol Reprod. 85 (2), 269-276 (2011).
- Kreeger, P. K., Deck, J. W., Woodruff, T. K., Shea, L. D. The in vitro regulation of ovarian follicle development using alginate-extracellular matrix gels. Biomaterials. 27 (5), 714-723 (2006).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. Interpenetrating fibrin-alginate matrices for in vitro ovarian follicle development. Biomaterials. 30 (29), 5476-5485 (2009).
- Griffith, L. G., Swartz, M. A. Capturing complex 3D tissue physiology in vitro. Nat Rev Mol Cell Biol. 7 (3), 211-224 (2006).
- Irving-Rodgers, H. F., Rodgers, R. J. Extracellular matrix of the developing ovarian follicle. Semin Reprod Med. 24 (4), 195-203 (2006).
- Salustri, A., Camaioni, A., Di Giacomo, M., Fulop, C., Hascall, V. Hyaluronan and proteoglycans in ovarian follicles. Hum Reprod Update. 5, 293 (1999).
- Rashki Ghaleno, L., Cristian, P. P., Shahverdi, A., Dardmeh, F., Alipour, H., Valojerd, M. R. Exploring the role of hyaluronic acid in reproductive biology and beyond: Applications in assisted reproduction and tissue engineering. Adv. Biology. 8 (6), e202300621 (2024).
- Desai, N. N., Goldberg, J. M., Austin, C., Falcone, T. The new Rapid-i carrier is an effective system for human embryo vitrification at both the blastocyst and cleavage stage. Reprod Biol Endocrinol. 11, 41 (2013).
- Desai, N., Abdelhafez, F., Calabro, A., Falcone, T. Three dimensional culture of fresh and vitrified mouse pre-antral follicles in a hyaluronan-based hydrogel: a preliminary investigation of a novel biomaterial for in vitro follicle maturation. Reprod Biol Endocrinol. 10 (1), 29 (2012).
- Desai, N., Spangler, M., Nanavaty, V., Gishto, A., Brown, A. New hyaluronan-based biomatrix for 3-D follicle culture yields functionally competent oocytes. Reprod Biol Endocrinol. 20 (1), 148 (2022).
- Monti, M., Redi, C. A. Isolation and characterization of mouse antral oocytes based on nucleolar chromatin organization. J Vis Exp. (107), e53616 (2016).
- Huang, L., et al. Cryopreservation of human ovarian tissue by solid-surface vitrification. Eur J Obstet Gynecol Reprod Biol. 139 (2), 193-198 (2008).
- Chan, J., Darr, A., Alam, D., Calabro, A. Investigation of a novel cross-linked hyaluronan hydrogel for use as a soft-tissue filler. Am J Cosmetic Sur. 22, 105-108 (2005).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. A method for ovarian follicle encapsulation and culture in a proteolytically degradable 3-dimensional system. J Vis Exp. (49), e2695 (2011).
- Xu, M., West, E., Shea, L. D., Woodruff, T. K. Identification of a stage-specific permissive in vitro culture environment for follicle growth and oocyte development. Biol Reprod. 75 (6), 916-923 (2006).
- West-Farrell, E. R., et al. The mouse follicle microenvironment regulates antrum formation and steroid production: alterations in gene expression profiles. Biol Reprod. 80 (3), 432-439 (2009).
- Xu, M., et al. Encapsulated three-dimensional culture supports development of nonhuman primate secondary follicles. Biol Reprod. 81 (3), 587-594 (2009).
- Wu, J., Nayudu, P. L., Kiesel, P. S., Michelmann, H. W. Luteinizing hormone has a stage-limited effect on preantral follicle development in vitro. Biol Reprod. 63 (1), 320-327 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved