Method Article
新規ヒアルロン酸ハイドロゲルの三次元卵胞培養への応用とマウス卵巣卵胞凍結保存の方法論
要約
このプロトコールは、チラミン結合ヒアルロン酸ハイドロゲルを用いてマウス卵巣から前胞状卵胞をカプセル化し、培養するための新しい3次元(3D)培養モデルについて述べています。また、ガラス化による卵巣卵胞凍結保存への2つのアプローチについても詳しく説明します。
要約
卵巣卵胞の3D構造と、細胞質および核の成熟に必要な体細胞成分と卵子との間の複雑な相互作用は、従来の2次元(2D)培養システムでは維持が困難です。我々は、チラミン結合ヒアルロン酸ハイドロゲルを用いたマウス卵巣卵胞のカプセル化と培養のための新しい3次元培養モデルについて述べる。ヒアルロン酸カプセル化技術は、卵胞の3次元成長と、発生中の卵胞に近接した栄養因子の保持を可能にする。このハイドロゲルは非常に汎用性が高く、単離された卵胞だけでなく、卵巣組織の断片にも適用できます。HAゲルの粘弾性特性により、ゲル濃度に応じた成形性だけでなく、剛性の調整も可能です。この培養モデルで発達する前胞卵胞は、培養後10〜12日以内に減数分裂成熟を完了し、hCGでトリガーされると中期II卵子を排卵することができます。この論文では、ガラス化による卵巣卵胞凍結保存への2つのアプローチについても詳しく説明しています。
概要
ヒトの体外受精による卵胞形成は、体外受精による最初の誕生から40年経った今でも課題となっています。現在まで、生存可能な胚の生産を支援し、健康な赤ちゃんを産むヒト卵巣卵胞培養の方法論はまだ不足しています1。ヒトのin vitro卵胞の成長に必要な最適な物理的特性は、まだ決定されていません。無傷の卵巣には、さまざまな発達段階にある何千もの卵胞が生息しており、その成長の調節は複雑なプロセスです(図1)2。ヒト前胞卵胞由来の胚小胞期(GV)卵母細胞は、培養中に30日もかけて減数分裂的に成熟し、中期IIステージ3に到達します。ギャップ結合を介した卵母細胞と周囲の顆粒膜細胞との間の双方向のコミュニケーションは、細胞質および核の成熟にとって重要である4,5,6。
従来の二次元培養システムは、卵胞培養、特に培養に長時間かかる大型哺乳類モデルには適していません。卵胞が皿に付着し、顆粒膜細胞が移動するにつれて、顆粒膜細胞と卵母細胞との間のリンクがより希薄になります。したがって、卵胞の3次元(3D)培養システムは、in vivoの生理学7,8をより厳密に模倣する手段として登場した。
3D成長を促進するためのマトリックス内の卵胞のカプセル化は、in vitro培養(IVC)中に卵胞の構造を保存するための1つのアプローチです。天然ポリマー(コラーゲン、アガロース、フィブリン、アルギン酸、ヒアルロン酸など)および合成ポリマー(ポリエチレングリコール、ポリビニルアルコール、ポリグリコール酸など)からのバイオマトリックスは、7,9,10,11,12,13で試験されています。バイオマトリックスの機械的特性は、栄養素の拡散、髄膜細胞の分化、前庭部の形成、およびホルモン分泌に影響を与えることが示されています14。コラーゲンは、細胞の天然の細胞外マトリックス(ECM)の一部として、最も早く試験されたマトリックスの1つであり、当初は有望視されていました15,16,17。しかし、コラーゲンの調製物を標準化するための物流、貧弱な機械的特性、および安定性により、その使用は制限されています18。アガロースは、胞状卵胞から放出される卵丘-卵母細胞複合体(COC)および原始卵胞19,20で試験されています。最近では、プリントされた3Dアガロース型が、足場のない卵胞培養に有望であることが示されています21。2003年に初めて報告されたアルギン酸カルシウムのカプセル化は、今日まで、IVC22の最も広く研究されているシステムです。マウス、ウシ、サル、およびヒトの卵胞23,24,25,26,27でテストされています。アルギン酸カルシウムでは、卵胞が単独でポリマーの微量滴にロードされ、塩化カルシウムにさらされてゲルビーズが生成されます。ビーズから卵胞を抽出するには、キレート剤による治療が必要です。ただし、このマトリックスにはいくつかの欠点があります。アルギン酸塩は藻類から単離された多糖類であり、サポートを提供しますが、卵胞の自然な細胞外マトリックスの一部ではありません。データは、アルギン酸塩28のIVC後の紡錘体欠損の発生率が高いことを示唆しています。アルギン酸をフィブリンまたは他の細胞外マトリックス成分(ECM)と組み合わせることによるシステムのその後の変更は、アルギン酸カルシウムシステムをより効果的にするのに役立ちました29,30。
細胞外マトリックスが細胞増殖の主要な調節因子であることを示す証拠が増えています10,31,32。それはサポートを提供するだけでなく、細胞の付着、機能、成長、およびコミュニケーションにおいて重要な役割を果たします。ECMの主要な成分の一つは、天然に存在するグリコサミノグリカンであるヒアルロン酸である。卵巣卵胞では、ヒアルロン酸は顆粒膜細胞によって産生され、発生中の卵胞の構造的完全性と機能に寄与している33,34。したがって、ヒアルロン酸を卵胞培養モデルに統合することは、より生理学的な環境を作り出し、機能的に適格な卵子の産生を促進するのに役立つかもしれない。
この研究は、新鮮および凍結卵巣卵胞の培養および卵子の in vitro 成熟(IVM)のためのバイオマトリックスとしてのチラミン結合HAの新規な応用について述べている。また、2種類のデバイスによるガラス固化による卵胞凍結保存の技術についても詳しく説明します。1つの方法は液体窒素に直接浸すことですが、2番目の方法では、卵胞をストローで囲んでから浸します。主な目的は、違いがあっても、方法論とデバイスの両方が卵胞の凍結保存に確実に使用できることを示すことです。
プロトコル
すべての動物実験は、クリーブランドクリニックの施設である動物使用およびケアプロトコルの下で、国立衛生研究所の実験動物のケアおよび使用に関するガイドラインと規制に従って実施されました。
1.培地の準備
注:以下に説明する培地は、この手順のさまざまなステップに使用されます:卵巣組織(OT)の取り扱い、OTコラゲナーゼ消化、卵胞培養(FCM)、およびガラス化。すべての培地を組織培養フードで滅菌技術を使用して調製します。
- 卵巣組織ハンドリング媒体
- 50 mLの組織培養フラスコ(T-50)に、0.1%ウシ胎児血清(FBS)を含む20 mLのLeibovitz培地(L-15)を補給します。
- しっかりと蓋をしてフラスコをインキュベーターに一晩置き、使用前に37°Cに温めます。この培地は、インキュベーターの外側の卵巣組織や卵胞の取り扱いに使用され、7.2〜7.4のpHを維持するためにCO2 を必要としません
注意: 皿をCO2ガスにさらさないでください、または媒体が酸性になります。
- コラゲナーゼ消化培地
- 卵胞採取の朝に、1 mg のタイプ I コラゲナーゼ (295 U/mg) を試験管に加え、2.2 mL の予熱済み OT 処理培地を加えます。コラゲナーゼの最終的な所望濃度は134 U/mLです フィルター 0.22 μmシリンジフィルターを使用して滅菌します。しっかりと蓋をして、保温ブロックに入れます。
- 卵胞培養培地と油
- T-50フラスコに5%ウシ胎児血清を添加した30 mLのMinimum Essential Medium alphaを調製します。.100 mIU/mL FSH、10 mIU/mL LH、10 μg/mL インスリン、5 μg/mL トランスフェリン、5 ng/m セレンを補給します。
- FCMを37°Cで6%CO2 と空気で事前に平衡化し、使用前にインキュベーター内で一晩。
- 50 mLの鉱油をフラスコに入れ、ゆるくキャップをしてインキュベーターで一晩平衡化します。
- FLおよびFLクラスター用のガラス固化メディア
- すべての溶液の基礎培地は、20%の合成タンパク質代替品を添加したGlobal-Hepesです。基礎培地に7.5%エチレングリコール(EG)と7.5%ジメチルスルホキシド(DMSO)を含むVS1溶液20mLを調製します。
- 基礎培地に15% EG、15% DMSO、0.5 Mスクロースを含むVS2 20 mLを調製します。すべての溶液を0.22 μmシリンジフィルターで滅菌し、使用するまで4°Cで保存します。ソリューションは最大4週間使用できます。
- ガラス固化卵胞およびFLクラスター用の温暖化媒体
- すべての溶液の基礎培地は、20%の合成タンパク質代替品を添加したGlobal-Hepesです。0.25 Mスクロースを含む20 mLの基礎培地を調製します。WS1 というラベルを付けます。
- 0.125 Mスクロースを含む20 mLの基礎培地を調製し、WS2として標識します。フィルターは0.22μmシリンジフィルターで滅菌します。溶液は4°Cで最大4週間保存してください。
2.卵巣の収穫
- 10〜14日齢のB6D2F1の子犬を頸部脱臼(麻酔なし)で安楽死させます。実験のために250-300の無傷の胞子前卵胞を得るために3〜4匹の子犬を使用してください。
- 動物を仰向けに寝かせ、70%イソプロピルアルコールで腹を拭きます。きれいなハサミを使用して、正中線で小さな水平カットを行います。細かい鉗子で切って上下の皮膚をつかみ、両方向(頭と足に向かって)引っ張って腹部を露出させます。
- 2セット目のきれいなはさみと細い鉗子を使用して、腹壁を切断します。腸のコイルを持ち上げて離します。子宮角、卵管、卵巣を見つけます。卵巣を摘出し、37°Cに温めた1mLのOT取り扱い培地を含むセンターウェルディッシュに入れます。
- 解剖顕微鏡を使用して、脂肪と卵管組織を切り取ります。卵巣を二等分します。
3. 卵胞とFL-クラスター(FL-C)の分離
- 卵胞の分離と取り扱いには、表面が37°Cの加熱を備えた層流フードを使用してください。ボンネットの中で無菌的に作業します。FCMディッシュには注意が必要です。バブラーを使用して、層流フードで作業するときに皿を5%CO2 でガス化します。
注:すべての溶液は37°Cに予熱する必要があります。FCM培地および鉱油は、使用前に37°Cのインキュベーターで6%CO2 と一晩前平衡化する必要があります。中程度のpHは、インキュベーターの外に10分以上いるとシフトします。 - 6 mLの平衡化済みFCMを2つの60 mmディッシュにピペットで移し、鉱物油で重ねます。インキュベーターに戻します。
- コラゲナーゼ1 mLをセンターウェルディッシュに、3 mLのOT培地を外壁にピペットで移します。ガラスマイクロピペット(1000μm)を使用して卵巣をコラゲナーゼ溶液に移します。層流フードの加熱面で皿を30〜40分間インキュベートします。
- コラゲナーゼインキュベーションの終了時に、6 mLのOT培地を1および2とラベル付けされた2つの60 mm組織培養皿にピペットで移します。フードの暖かい表面に置きます。
- マイクロピペットを使用して、コラゲナーゼ処理した卵巣を外側のウェルに移し、コラゲナーゼが付着しないように洗い流します。マイクロピペットを交換してから、卵巣をOTディッシュ1に移動します。
- P200ピペッターを使用して各卵巣から卵胞を採取します。酵素処理された卵巣を異なるサイズにカットしたピペットチップを通じて繰り返し吸引および排出することにより、卵胞を放出します。ピペッティング前に2本の27G針で組織を機械的にバラバラにすることで、個々の卵胞を放出するのにも役立ちます。各マウスの子犬は、所望のサイズの60〜75個の無傷の卵胞を産むべきである。
- 必要に応じて、未解離の卵巣片をさらに5〜10分間コラゲナーゼに戻し、すすぎ、ピペッティングを繰り返してより多くの卵胞を放出します。
注:コラゲナーゼへの過度の曝露は、卵母細胞を取り巻く顆粒膜細胞層の破壊をもたらします。卵巣全体を壊そうとしないでください。250〜300個の卵胞が集まったら停止します。 - 放出された卵胞を解剖顕微鏡で40倍の倍率で検査します。無傷の基底膜(基底膜)に囲まれた中央に位置する卵子を持つ二次前胞状卵胞(直径120~140μm)を特定します。このサイズの卵胞には、通常、卵子を取り囲む2〜4層の顆粒膜細胞があります( 図1を参照)。
注:卵胞を175μmマイクロピペットチップの開口部と比較して、おおよその卵胞サイズを確認します。卵胞のサイズは、ピペットの直径の約3/4にする必要があります。これは、目的のサイズの卵胞を選択する最も簡単な方法です。 - 175 μmのマイクロピペットを使用して、選択した卵胞をOT2ディッシュに移します。収集が完了したら、FCM1ディッシュ内のすべての卵胞をすすぎ、OT培地の痕跡を取り除きます。その後、FCM2ディッシュに移します。
- インキュベーターにディッシュを60分間入れてから、埋め込みプロセスを開始します。
- 卵胞クラスターの分離については、手順 3.1 から 3.5 を実行します。2つのツベルクリン注射器(27 G)を使用して、卵巣を断片に引き裂き、次に6〜10個の卵胞の小さなクラスターにからかいます。
注:卵胞クラスターの培養(FL-C)は、個々の卵胞を培養する代わりに使用できます。この方法は、間質成分とともに天然の卵胞構造を保持します。FL-Cの卵胞サイズは均一ではありません。卵胞は、原始卵胞、一次卵胞、二次卵胞が存在するin vivo 構造を保持します。 - これらの卵胞クラスター(FL-C)を200μmマイクロピペットでOT2ディッシュに集めます。回収が完了したら、すべてのFL-Cをすすぎ、FCM2に移して埋め込みを待ちます。
4. 卵胞と卵胞クラスターの埋め込み
- 活性化チラミン結合ヒアルロン酸ヒドロゲル(HA)の10 mg/mL原液を調製してください。250 mgのチラミン置換ヒアルロン酸ナトリウム粉末を、25 mLの西洋ワサビペルオキシダーゼ酵素(HRP; 10 IU / mL)とリン酸緩衝生理食塩水で再水和します。.可溶化したら、この活性化HAストックの500 μLアリコートを-4°Cで保存し、将来の実験に備えます。
- 卵胞実験では、HAストック溶液を解凍し、37°Cに温めたグローバル培地で3 mg/mLの濃度に希釈します。 ベンチ表面を37°Cに加熱した層流フードですべての埋め込みステップを実行します。 60 mmディッシュと8つの100 μLウェルを使用して、包埋およびその後の卵胞培養を行います。
- 埋込する卵胞またはFLクラスターをFCMディッシュからHAゲルの滴に移し、培地を洗い流さずに済みます。トラッキング媒体はゲル形成を妨げます。FCMディッシュをバブラーの下に戻し、ガスを入れます。
注:単離された卵胞は、実験に応じて、単独で、またはグループで埋め込むことができます。私たちは一般的に、ビーズごとに2〜4個の卵胞を播種することを好みます。 - 0.03%過酸化水素(H2O2)1 μLをシャーレに置きます。25 μL の 3 mg/mL HA ゲルを過酸化水素滴下に加え、ピペッティングで混合して架橋を開始します( 図 2 を参照)。
- P20ピペッターを使用して、HA-H2O2 Mixを引き上げ、1滴(~8-10 μL)を8ウェル培養皿の2つの別々のウェルにピペットします。泡を作らないようにしてください。
- 200 μmのマイクロピペットを使用して、卵胞またはFL-Cを各滴の中心にすばやく移します(図3)。HAが触媒(過酸化物)にさらされると、1〜2分以内にゲル化し始めるため、速度が重要です。播種中に気泡が入らないように注意してください。
注意: 個々の卵胞の成長を追跡するには、卵胞を互いに離して配置します。卵胞をゲルの底に近づけすぎると、IVC中に付着するほど下降する可能性があります。 - ~3分間でゲル化プロセスを完了させ、各ウェルに100 μLの平衡化済みFCMを添加します。このプロセスを繰り返し、卵胞を8つのウェルすべてにロードします。温かい平衡化済みの鉱油で覆い、皿をインキュベーターに入れます。
5. 卵胞およびFLクラスターのガラス化
注:ガラス化は、オープンキャリア(Cryoloop;CL)、液体窒素との直接接触を可能にする、または閉じた担体(Rapid I;RI)、サンプルは外側のストロー内に密封されているため、液体窒素と接触することはありません。 図4 は、2つのガラス化システムのデバイスとコントラストを示しています。両装置のガラス固化は、胚凍結保存に有効であることが示されている35。
- クローズドキャリアRIガラス固化
- VS溶液の2mLアリコートを加熱ブロック中で37°Cに予温します。解剖顕微鏡を使用して、層流フードの加熱された表面ですべてのガラス化ステップを実行し、卵胞とキャリアを視覚化します。
- 断熱クライオボックスに液体窒素(LN2)を入れます。デバイスの外側のストローをボックス内の保持スロットに配置して、部分的に液体窒素に浸します。ロードの準備として、シャーレの蓋に小さな穴を開けた内側のプラスチックスティックを置きます。
- 上部近くのシャーレにVS1を2滴並べて置きます。200 μmのマイクロピペットを使用して、最初の一滴に2つの卵胞を入れます。すすぎ、すぐにVS1の2番目のドロップに移動します。5分間インキュベートします。FLクラスターをガラス化する場合は、一度に1つのクラスターを処理します。
- 最初のインキュベーションがほぼ完了したら、VS2を3滴同じ皿に並べて置きます。次に、60秒以内に3つのVS2ドロップを介して卵胞を順番に動かし、キャリアに負荷をかけます。毛包と一緒に最小限の液体を引き寄せるように注意して、培地を1滴から別の滴に追跡しないようにしてください。
- キャリアをロードするには、2つの卵胞を拾い上げ、プラスチックスティックの小さな穴に最小限の液体で堆積させます。穴の最終的な液体量は0.5μL<ごくわずかです。穴から液体がプラスチックスティックにこぼれる原因となる過剰充填は避けてください。
- スティックを予冷した外側のストローに落とします。超音波シーラーを使用して、ストローを閉じて密封します。クライオケーンに取り付けられたゴブレットにストローを置きます。同じゴブレットに最大4本のストローを入れることができます。
- 杖をプラスチック製の保護スリーブで覆います。サトウキビを液体窒素貯蔵(LN2)タンクに沈めます。
- オープンキャリアCLガラス化
- VS溶液を37°Cに予温します。 層流フードの加熱面ですべてのガラス固化ステップを実行します。CLオープンキャリアを事前に必要な数に備えてください。金属製のCLステムを磁化されたバイアルキャップに挿入し、しっかりと保持されていることを確認します(必要に応じて接着剤を少し軽くたたきます)。
- 断熱クライオボックスに液体窒素(LN2)を充填します。LN2がバイアルの上部より下にくるようにクライオバイアルを保持するために、クライオボックスにラックを置きます。
- 特殊な磁化および通気バイアルにLN2を充填します。ラックに置きます。手順 6.1.3 から 6.1.5 で説明されているように、ガラス化手順を実行します。唯一の違いは、通常、一度に5つの卵胞を処理することです。繰り返しになりますが、液滴から滴へのトラッキングを最小限に抑えるように注意してください。
- 卵胞をロードするには、金属製のワンドを使用して、CLオープンキャリアを付属の磁気キャップでつかみます。CLオープンキャリアをVS2の別の滴に浸して、凍結保護剤の膜を作成します。
- マイクロピペットを使用して、すべての卵胞またはFL-Clusterをピックアップし、最小限の液体でフィルム上に置きます。フィルムが乾燥し始める前に毛包を装填する必要があるため、迅速に作業します。
- すぐにCLをLN2で満たされたクライオバイアルに浸して、サンプルをガラス化します。キャップをして、バイアルをクライオケーンに置きます。プラスチックスリーブで覆います。杖を液体窒素貯蔵タンクに突っ込みます。
6. ガラス固化卵胞とFLクラスターの温暖化
- RIクローズドキャリアウォーミング
- 3 mLの予め平衡化されたFCMを外側のウェルに、1 mLをセンターウェルにセットしたセンターウェルディッシュを調製します。オイルで覆い、インキュベーターに入れます。
- 0.5 mLの予熱したWS1とWS2を、ラベルの付いた2つのウェルディッシュに入れます。サンプルの入った杖を貯蔵タンクからLN2で満たされたクライオボックスに移します。
- プラスチック製の杖カバーを取り外します。ゴブレットからストローを取り出し、浸したままにして、クライオボックスの保持スロットにスライドさせます。
- 細いハサミを使用して、卵胞のある内側のRIキャリアの上部を示す黒い点のすぐ上で外側のストローを切ります。
- 細い鉗子を使用して、内側のプラスチックスティックを外側のストローから少し持ち上げます。デバイスをつかみ、スティックをWS1にすばやく浸し、静かに渦巻いて卵胞を降ろします。スピードは非常に重要です。卵胞は10秒以内にWS1にアンロードする必要があります。
- 解剖顕微鏡を使用して卵胞を視覚化し、すべてがキャリアからアンロードされたことを確認します。WS1で2分後、マイクロピペットを使用して、培地を追跡しないように注意しながら、すべての卵胞(またはFL-Cluster)をWS2に移動します。
- 3分後、FCMディッシュの外側のウェルで卵胞をすすぎ、次に中央のウェルに移動します。埋込する前に、インキュベーターに1〜2時間戻します。
- CLオープンキャリアウォーミング
- 上記のようにFCMとWSの料理を準備します。卵胞付きの杖を貯蔵タンクからLN2で満たされたクライオボックスに移動します。プラスチック製の杖カバーを外します。
- 磁気ワンドを使用して、CLの金属ステムが見えるまでクライオバイアルキャップを持ち上げます。
- 鉗子を使用して、金属ステムをつかみます。バイアルからCLを取り出し、非常に迅速にWS1に浸し、穏やかに渦巻いて卵胞を降ろします。10 秒以内に WS1 にアンロードします。解剖スコープを使用して、すべての卵胞がアンロードされたことを確認します
- ウォーミングの残りのすべてのステップは、ステップ 7.1.6 から始まる RI クローズドキャリアステップと同じです。
7. 卵胞およびFLクラスターのイメージングと培地の変更
- 10〜12日間の培養間隔で、ホフマンコントラスト変調光学系と高解像度カメラを装備した倒立型光学顕微鏡を使用して、ウェル内の卵胞とFLクラスターをモニターします。イメージングソフトウェアを使用して、サイズに応じて40倍、および合計倍率100倍または200倍で画像をキャプチャします。
- 卵胞のイメージングと評価
- 培養1日目に、包埋後、倒立顕微鏡を使用してすべての培養ウェルを40倍および200倍の倍率で画像化し、ベースラインの形態とサイズを確立します。皿をインキュベーターに戻します。
- 画像を表示し、各ゲルビーズに完全に埋め込まれた卵胞の数を記録します。FL-Cの場合、培養開始時の卵胞数を推定します。
- イメージングソフトウェアを使用して、基底膜の端から垂直面と水平面に沿って卵胞の直径を測定します。同様に、帯の外縁から卵子のサイズを測定します。平均値を記録します。クラスターの直径を垂直および水平に測定します。
- 2〜3日ごとに培養をイメージ化します。互いに接触していない卵胞の直径を測定します。FL-Cでは、IVC中にクラスターがボールアップするため、クラスター全体を垂直面と水平面で測定できます。
注:密集した卵胞の場合、培養4日目以降は個々の卵胞の境界が識別できない可能性があるため、測定は行われません。 - 卵胞が黒ずむかアポトーシスになる卵胞、および卵母細胞が顆粒膜細胞に囲まれなくなった卵胞、または押し出された卵胞を生存不能として分類します。皿の表面に付着した卵胞またはFL-Cを追跡します( 図5を参照)。
- 8日目以降、卵胞の形成を注意深く観察します。前庭部のある卵胞は、その中に空き地または明るいスペースがあるように見えます(図6)。
- 2日ごとに培地の半交換を行います。P200ピペッターを50 μLに設定し、チップをオイルオーバーレイの下のウェルに挿入し、ゲルビーズから離します。培地50μLをゆっくりと引き出します。オイルオーバーレイの下に50 μLの新鮮なFCMをゆっくりとピペッティングして、培地を交換します。泡を作らないようにしてください。
8. 被包卵胞における卵子の成熟
注:最終的な成熟ステップは、通常、播種された(および生存可能な)卵胞全体の前庭部形成が40%を超えたときに開始されます。ただし、前庭部の形成が少ないか、目に見えない場合は、培養の12日目までにトリガーすることをお勧めします。これ以上待つことには何の利益も見られません。FL-C培養の場合、成熟は通常、井戸の40%で前庭部が観察されたとき、または遅くとも12日目までに引き起こされます。
- FCMに1.5 IU/mLのヒト絨毛性ゴナドトロピン(hCG)と5 ng/mLの上皮成長因子(EGF)を補給して、 in vitro 成熟培地(IVM)を調製します。
- 午後5時頃に各ウェルのFCMを100 μLのIVM培地に置き換えることにより、成熟を開始します。一晩熟成した後(トリガー後16-18時間後)、40倍の倍率で解剖顕微鏡を使用して、HAゲルビーズから排卵した卵丘-卵母細胞複合体(COC)の各培養物をよく調べます。COCは通常、ゲルビーズのすぐ上、または近接して静止しています。
- 排卵したCOCをセンターウェルディッシュに集め、1 mLの平衡化済みFCMをオイルで覆い、ディッシュをインキュベーターに戻します。
- P200ピペッターを使用してHAビーズを穏やかにピペッティングし、排卵していないCOCを放出することにより、まだ埋め込まれている卵胞から卵子を採取します。これらをFCMと一緒に別の皿に集めます。
- 外壁にヒアルロニダーゼ1mL(10 IU/mL)とFCM培地3mLを入れたセンターウェルディッシュを調製します。
- 排卵したCOCをヒアルロニダーゼ溶液に移し、顆粒膜細胞の卵母細胞を短時間(30-45秒)さらして卵子の核状態を可視化する。卵子をすすぎ、酵素を除去してから、5 μLの新鮮な培地を油の下に入れて詳細に評価します。皿をインキュベーターに入れます。排卵していないCOCに対してこのプロセスを繰り返します。
- 回収された排卵卵子と非排卵卵子の合計数を記録します。回収された各卵子の核状態(GV、中期Iまたは中期II)を撮影し、評価します。直径を測定して記録します。
- 生存可能な卵胞の総数(hCGトリガーの日までに成功した卵胞)と回収された卵子の総数に基づいて、IVC生存率を計算します。排卵したCOCから中期II卵母細胞の割合を計算します。排卵していないCOCから回収された卵母細胞について、これを繰り返します。
- FL-Cについても同様にして、中期IIへの成熟速度を決定します。
結果
この論文では、新規のチラミン結合ヒアルロン酸ゲルをマウス前胞胞のin vitro培養に用いる方法論を詳述している36,37。図 6 は、従来の 2 次元培養システムに置いた場合と、HA ゲルにカプセル化して 3 次元培養を行った場合の 1 つの卵胞との違いを示しています。在来の卵胞の建築は、12日間の培養期間中維持され、成長の最終日には前庭部がはっきりと見えます。
HAゲルは非常に汎用性が高く、孤立した卵胞を単独またはグループで成長させることができ、また卵巣組織は機械的に小さな卵胞の塊に分解されます。ゲルは透明であるため、深さが異なっていても卵胞を視覚化することができます。カプセル化された卵胞とFL-Cは、継続的な顆粒膜細胞の増殖から半径方向の増殖を示します(図7)。初期の卵胞の直径は平均139.8±28μmで、GV卵子の直径は63.5±4.6μmです。単体培養卵胞では、最終直径は約385.6±36.7μmで、サイズは約3倍に増加します。排卵した中期II卵子は、約84.8±3.8μmを測定します。培養FLクラスター内では、卵胞のサイズはかなり多様です(図5、 図7)。hCGトリガー後の排卵細胞は、卵胞の近くに見られます(図8)。中期 II 卵子の大部分は、排卵した COC から回収されます。トリガー後も埋め込まれた卵胞には、通常、GVおよび中期I卵子が含まれています。
表1 は、単離された卵胞と新鮮または凍結卵巣のFLクラスターとの間の成熟速度を対比しています。凍結保存された卵巣由来のFL-Cは、成熟率が有意に低かった。顕微鏡観察では、基底板が頻繁に壊れていることが示され、卵母細胞の早期押し出しに非常に敏感でした。卵胞クラスターの壊れやすい性質は、カプセル化によっていくらか打ち消されました。凍結保存された卵巣のコラゲナーゼ処理は、生存率が低く、無傷の卵胞の収量が少ないため、特に損傷を与えるため、避けられました。
単離された卵胞の凍結保存は、卵巣全体の保存よりもはるかに効果的です。高い成熟速度は、検討した両方のガラス化方法で達成できます(表2)。冷却速度には大きな差があるにもかかわらず、IVC後の卵子の成熟には差はありませんでした。CLオープンキャリアは、1つのCLオープンキャリアに最大10個の卵胞を装填できるため、効率が向上します。これにより、複数の凍結保存された卵胞を回収するための全体的な時間も短縮されます。しかし、ヒト卵胞に対するガラス化の最終的な臨床応用には、クローズドシールシステムが好ましい場合があります。
GV卵子の核小体周りのクロマチン配列は、排卵後に受精し、胚盤胞に発達する可能性が最も高い卵子を特定するために使用できる38。 図9 は、クロマチン分布パターンを視覚化するための卵子の生染色を示しています。
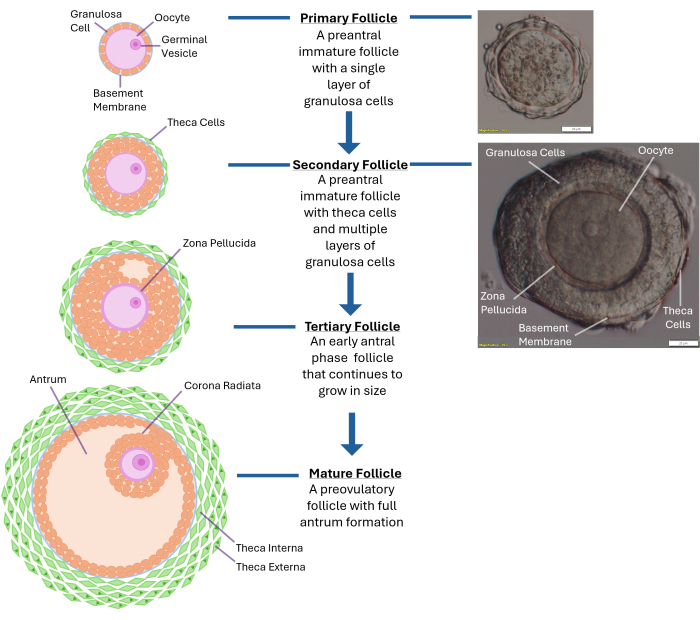
図1:卵胞の成長の概略図。 この図は、一次卵胞から二次前胞期、そして最終的には排卵の準備が整った完全に成熟した三次卵胞までの卵胞発達のさまざまな段階を示しています。典型的な前胞状卵胞の顕微鏡画像も、その異なる形態学的特徴とともに示されています。 この図の拡大版を表示するには、ここをクリックしてください。
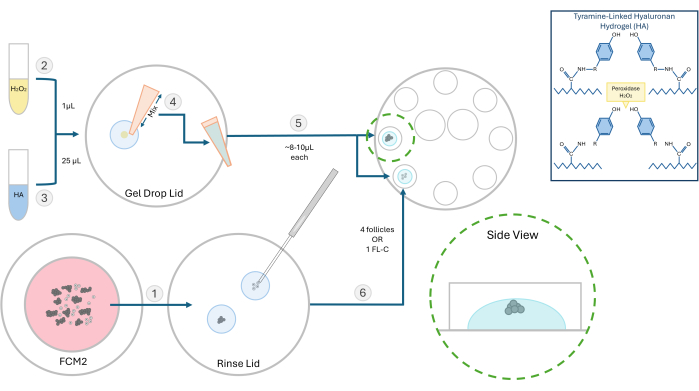
図2:HAカプセル化方式の概略図。この図には、ヒアルロン酸ゲルの構造と卵胞包埋のさまざまなステップが示されています。この図の拡大版を見るには、ここをクリックしてください。
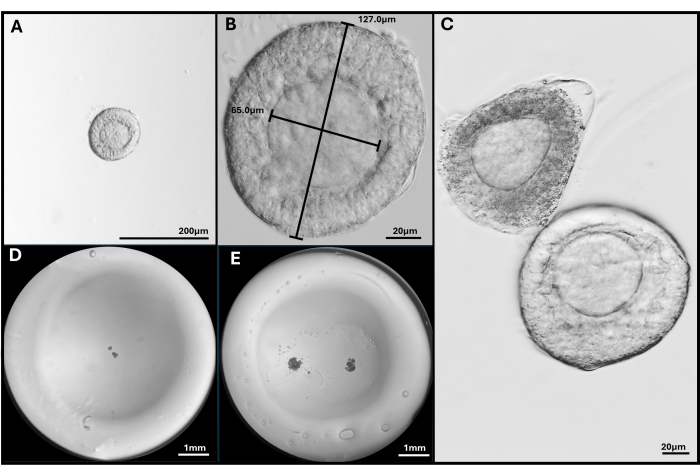
図3:卵胞の単離とカプセル化 (A、B)倍率40倍および200倍で埋埋込するために選択された前傘下卵胞 (C)アポトーシス卵胞は、卵母細胞が中心ではない健康な前胞状卵胞で示されています。(D)卵胞を播種したHAゲルビーズのイメージと、(E)FL-Cを2個播種したイメージ。実体顕微鏡で撮影した画像で、ゲルビーズ全体を示しています。 この図の拡大版を表示するには、ここをクリックしてください。

図4:単離された卵胞の凍結保存のためのガラス化装置。 CLオープンキャリアデバイスでは、卵胞を液体窒素に直接浸すことによりガラス化ステップが行われます。したがって、冷却速度は-20,000°C/minを超える非常に高速です。対照的に、RIクローズドキャリアでは、卵胞は内側のプラスチックスティックにロードされ、液体窒素に浸された外側のストローに落とされます。この閉鎖的なガラス化方法は、液体窒素との直接接触を避けます。ただし、冷却速度は-1220°C/minで大幅に低下します。どちらのキャリアからでも卵胞のローディングと回収は簡単です。CLオープンキャリアは、RIクローズドキャリアではわずか2個であったのに対し、デバイスあたり最大10個の卵胞のローディングに対応しました。この数値は35から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
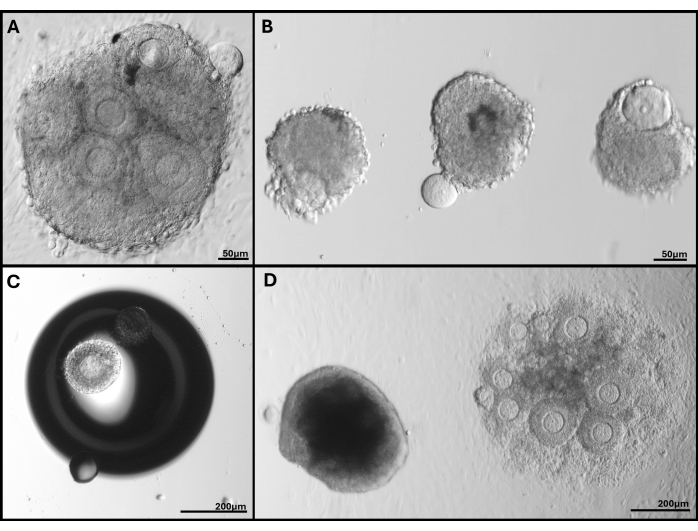
図5:発生した問題の代表的な画像 (A)卵子が押し出された卵胞クラスター。(B)基底層膜が壊れた単離された卵胞と、卵母細胞が押し出された卵胞。(C)ゲル内の気泡の下に包埋された卵胞。(D)ゲル状に残った卵胞クラスター(左)と、深すぎて最終的に皿に付着したクラスターと比較。FL-Cの幅広い卵胞サイズがはっきりと見えます。 この図の拡大版を表示するには、ここをクリックしてください。
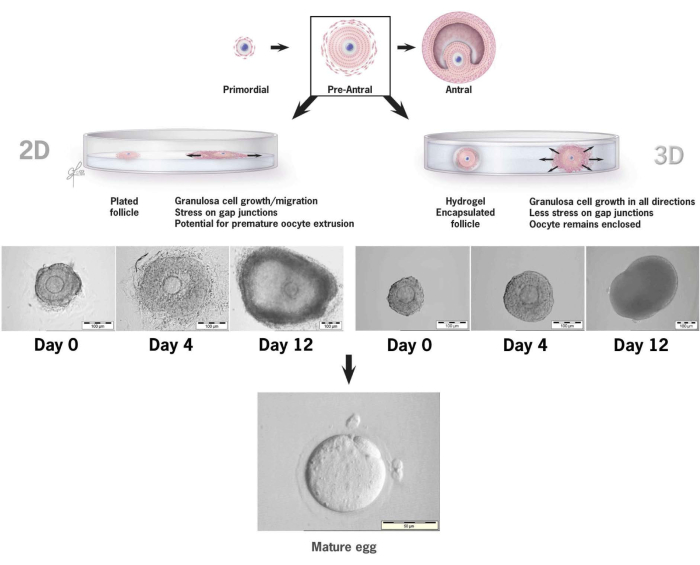
図6:従来の2D培養とHAの3D培養における卵胞成長の比較。 2次元成長では、卵胞の平坦化と組織培養皿への顆粒膜細胞の付着が4日目までに観察され、卵子は顆粒膜細胞の遊走、ギャップ結合の破壊、および早期卵子の押し出しに対して脆弱になりました。HAカプセル化された卵胞は、培養間隔全体を通して付着しないままでした。顆粒膜細胞の増殖は全方向に起こり、卵子を包み込み、3D構造を維持しました。この数値は36から変更されています。 この図の拡大版を表示するには、ここをクリックしてください。

図7:チラミン結合HAゲルに包まれた卵胞の代表的な画像 (A)1日目に新鮮な卵巣のコラゲナーゼ消化後に採取した胞体前卵胞。(B)1日目および(C)培養4日目に画像化された4つの前胞卵胞を播種したゲルドロップ(D)2日目に新鮮な卵巣からの卵胞クラスター、(E)6日目および(F)培養9日目。(G)培養の2日目と(H)6日目に示されているガラス化全卵巣から機械的に解剖された卵胞クラスター。(I)前庭部形成を伴う卵胞は、培養の9日目にはっきりと見えます。 この図の拡大版を表示するには、ここをクリックしてください。
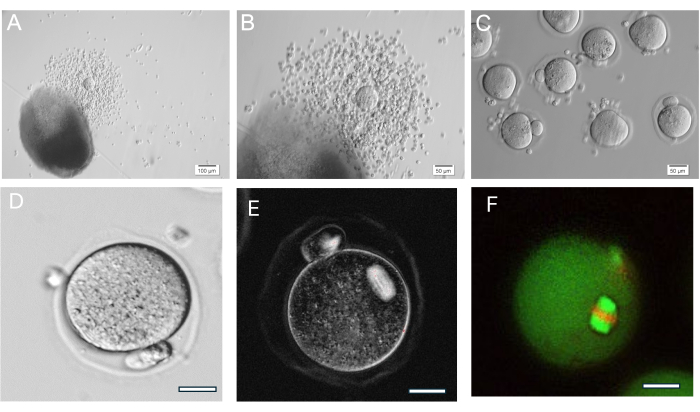
図8:卵子の排卵 (A, B) 排卵卵丘-卵母細胞複合体(COC)を次に示すHA-gelビーズ。(C)COCをヒアルロニダーゼで酵素処理した後、卵母細胞をイメージングし、周囲の卵丘細胞を除去した。多数の中期II卵子。(D)顕著な極性体を持つ中期II卵子。倍率400倍 (E) 偏光を用いた中期II卵子のライブイメージングと、減数分裂紡錘体を可視化し組織を評価するイメージングシステム、37に記載されているように行われる。倍率400倍。通常の複屈折スピンドルが見えます。(F)中期II卵子を固定し、抗α/β-チューブリンとヨウ化プロピジウムで染色して、減数分裂紡錘体組織を視覚化します。 この図の拡大版を表示するには、ここをクリックしてください。
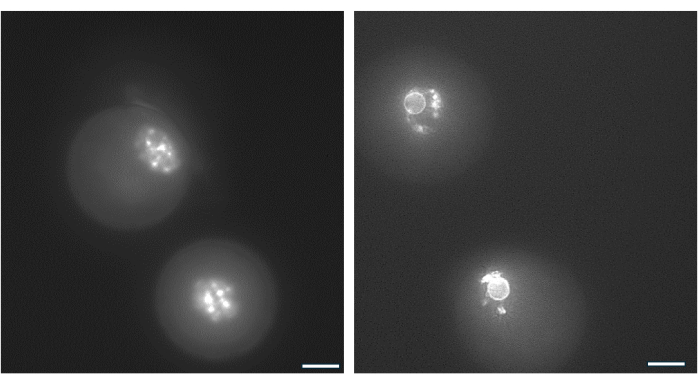
図9:GV卵子におけるクロマチン再編成。 前庭部形成後のGV卵子のクロマチン配列を、Hoechst 33342(50 ng/mL)によるDNA染色により検討した。代表的な卵胞は、穏やかなピペッティングによりHAビーズから採取しました。顆粒膜細胞はヒアルロニダーゼを用いて除去した。その後、GV卵子を15分間染色した(Monti et al.38によるプロトコールを参照)。画像は40倍の倍率で撮影されました。(A)培養開始時の1日目に示されたGV卵子で、非囲型クロマチン(NSN)染色パターンが認められた。(B)hCGトリガーの日に示された前庭部の成長卵胞からのGV卵子。クロマチンは凝縮し、核小体の周りに核周囲環を形成しました。 この図の拡大版を表示するには、ここをクリックしてください。
| パラメーター | 新鮮な卵巣 | 凍結卵巣 | |
| FL絶縁 | FLクラスタ | FLクラスタ | |
| IVC中に観察された卵胞 | 130 | 154 | 69 |
| HCG後の排卵(%) | 71% | 66% | 93% |
| (92/130) | (101/154) | (64/69) | |
| GVBD(%) | 30% | 28% | 52% |
| (28/92) | (28/101) | (33/64) | |
| MII卵子形成(%) | 59% | 55% | *34% |
| (54//92) | (56/101) | (22/64) | |
表1:新鮮卵巣およびガラス化卵巣からのHA包埋卵子による転帰。 新鮮卵巣由来の卵胞とFL-Cは、HAゲルにカプセル化した後、 in vitro で成熟させました。HAゲルは、EG/DMSOプロトコル39を用いてガラス化した卵巣の卵胞でも試験した。新鮮な卵巣では、コラゲナーゼ消化後に個々の卵胞(FL)と卵胞クラスター(FL-C)の両方を採取しました。ガラス化した卵巣の場合、コラゲナーゼへの曝露は、実際には卵胞に損傷を与えていました。凍結保存された卵巣の最善のアプローチは、個々の卵胞ではなくFLクラスターを分離し、針による機械的解剖のみを行うことであった。この表は、4〜6個の卵胞を播種したHAビーズと、6〜10個の卵胞を含む単一のFL-Cビーズの結果を対比したものです。*凍結保存された卵巣からのFL-Cによる成熟率は有意に低かった(p = 0.008;有意性を検定するためのカイ 2 乗分析)。
| キャリア | RIの | CLの |
| (終了しました) | (オープン) | |
| 生存率(%) | 100% (24/24) | 100% (41/41) |
| アントラム形成* (%) | 25.0% (6/24) | 75.6% (31/41)* |
| 排卵率(%) | 66.7% (16/24) | 87.8% (36/41) |
| 成熟率(% MIIs) | 81.3% (13/16) | 69.4% (25/36) |
表2:2つの異なるガラス固化装置で単離された卵胞を凍結保存した後の結果。 オープンCLデバイスとクローズドRIキャリアの両方で高い成熟速度が達成され、冷却速度は低くなっています。前庭部形成は、有意であると観察された唯一のアウトカム指標であったが、全体的な成熟率に影響を与えなかった(p < 0.05;有意性を検定するためのカイ 2 乗分析)。
ディスカッション
チラミン結合HAハイドロゲルの機械的特性と生分解性を制御する能力は、組織工学アプリケーションに多くの利点をもたらします。私たちの研究室は、この特定のHAゲルを卵巣卵胞の成長に適用した最初の研究室です。この特許取得済みのチラミン置換ヒアルロン酸ナトリウムゲル(TS-NAHY)は、クリーブランドクリニックで開発された新しいヒアルロン酸ベースのハイドロゲルシステムである。ゲルの架橋は、活性化ゲル混合物中のペルオキシダーゼが酸化剤に曝露されることによって駆動されます。これは、 in vitro または in vivoの両方で行うことができます。形成されたTS-NAHYハイドロゲルは、ゲル40の濃度に応じて、弱いゲル、ペースト状から壊れやすい固体まで、幅広い特性を示します。
卵巣卵胞培養の残念な進展は、新しい培養モデルを設計する必要性を浮き彫りにしています。天然の細胞外マトリックス成分のみに基づく培養システムの作成は、より有利なアプローチである可能性があります。記載されているHA培養モデルは、追加のECM成分を必要とせずに、生理学的に使いやすくなっています。ゲルは透明で、卵胞を詳細に視覚化できます。HAゲルの粘弾性特性は、剛性と成形性の調整を容易にします。この機能により、このバイオマトリックスの汎用性が向上します。バイオマトリックスの剛性は、顆粒膜細胞の増殖および前庭部形成に影響を与える可能性がある30,41,42。前庭部形成に寛容な培養環境に由来する卵胞は、非支持的な培養系のものとは異なる遺伝子発現プロファイルを有することが報告されている43。霊長類の卵胞は、より硬いマトリックス44を必要とするようである。ヒトを含むさまざまな動物種の要件を満たすようにバイオマトリックスを調整することは、in vitro成熟を成功させるために重要になる可能性があります。
マウス胞子前卵胞の成長については、2〜5 mg / mL36の範囲のゲル濃度をテストしました。卵子の成熟率は44%から58%の範囲でした。HAゲルの濃度が高いほど、3D構造の成形性と保持性が向上しましたが、卵胞の拡張が影響を受けました。HA濃度が低いと、卵胞の半径方向の拡張が促進されましたが、IVCの終了前に卵胞が自発的に押し出されるリスクが高まりました。3-3.5 mg/mL の HA 濃度は、マウスの胞子前卵胞に最も効果的でした。ゲル滴を小さく保つことは、IVC全体で卵胞を3次元構造に保つのに十分な深さのHAゲルビーズを形成するために不可欠でした。大きな液滴が平らになり、その結果、卵胞がゲルを通って降下し、プレート表面に付着します。この生体材料を埋め込みに使用する際の制限の1つは、ゲル化時間が非常に速いことです。そのため、一度に2つ以上のHAゲルビーズを播種するのが難しくなります。HAゲルへの卵胞播種の効率を高めることは、私たちが改善しようとしている分野の1つです。
HAを用いた3次元環境での卵胞クラスターの培養は、大きな可能性を秘めています。正常な卵巣構造は保持されており、異なるサイズの卵胞が互いに接触し、支持する間質があります。LHは、早期分化した髄腔細胞に変化を誘導することにより、FL−Cにおけるより小さな胞状卵胞の成長を助ける可能性があるため、FCM培地45に含まれた。過去12日間FL-Cの培養を続けて、hCGトリガーの後にまだ埋め込まれている小さな卵胞のいずれかで新しい成長の波を開始できるかどうかを確認するには、さらなる研究が必要です。培養環境のさらなる最適化は、組織断片中の異なるサイズ範囲の卵胞を培養するための前提条件となり得る。FL-Cを用いたこの3次元HA培養モデルの利点は、 in vivo の卵胞配置と相互作用を厳密に模倣できることです。もう一つの重要な特性は、アルギン酸カルシウムや他のポリマー系とは異なり、排卵と成熟は、組織またはゲルマトリックスから卵胞を物理的に除去することなく誘発できることです。
in vitro卵胞培養や凍結のための成熟卵子の取得に必要な時間は、特に大型哺乳類では長くなります。採取した卵胞または卵胞クラスターを凍結保存する能力は、このステップを遅らせる方法を提供し、おそらくはより好ましい時期まで遅らせることができる。このような技術がいつの日か卵巣摘出中に人間の卵胞に適用できれば、それは有益かもしれません。現在、妊孕性保存のための卵巣全凍結保存が患者にとって唯一の選択肢です。しかし、それが実際に最善の方法であるかどうかは、まだ決定されていません。この論文では、3D培養後の優れた加温後の生存率と成熟率を提供する、胞状卵胞前凍結保存のガラス化方法論を紹介します。
結論として、我々は天然ECMの成分であるヒアルロン酸を用いた新しい3次元培養モデルについて説明した。HAカプセル化技術により、発生中の卵胞に近接した栄養因子を保持することができます。バイオマトリックスへのカプセル化の方法論はシンプルで、単離された卵胞だけでなく、卵胞クラスターにも対応できます。後者は、新たな研究の道を開き、卵胞形成とその調節に関する基本的な生物学への洞察を提供する可能性があります。HAカプセル化卵胞からの卵子は、機能的に有能であることが示されている37。これらの卵子は受精し、in vitroで胚盤胞を形成し、偽妊娠マウスに移すと着床することができます。これらのデータは、チラミン結合型HAを3次元卵胞培養およびin vitro卵子成熟のためのバイオマトリックスとして使用することを実証している。このプロトコルは、ヒトを含む他の動物モデルの卵巣卵胞培養に適用できる可能性があります。この3-D HAゲルシステムの他の可能なアプリケーションは、胚様体およびオルガノイド培養である可能性があります。
開示事項
利益相反や開示はありません。
謝辞
クリーブランドクリニックの発生学チーム全体に感謝し、REI部門、特にファルコーネ博士の支援に感謝したいと思います。このプロジェクトは、クリーブランドクリニックの研究基金を通じて資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| Anti-alpha tubulin-FITC labelled | Sigma-Aldrich | F2168 | |
| Anti-beta tubulin-FITC labelled | Sigma-Aldrich | F2043 | |
| BZ-X700 | Keyence | ||
| Center well dish | Fisher Scientific | 08-772-12 | |
| Collagenase Type I | Worthington Biochemical Corporation | LS004196 | |
| Crycap vial-vented | Hampton Research | HR4-904 | |
| Cryoloop | Hampton Research | HR4-974 | |
| Crystal cap | Hampton Research | HR4-733 | |
| Culture dish 60mm | Fisher Scientific | 08-772B | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Epidermal growth factor (EGF) | R &D Systems | 236-EG | |
| Ethylene Glycol (EG) | Sigma-Aldrich | 293237 | |
| Fetal Bovine Serum-Heat Inactivated | ThermoFisher Scientific | 10082-147 | |
| Follicle Stimulating Hormone (FSH) | Sigma-Aldrich | F4021 | |
| Global-Hepes medium | CooperSurgical | LGGH-100 | |
| Hoechst 33342 | Sigma-Aldrich | B2261 | |
| Human chorionic gonadotrophin (hCG) | Sigma-Aldrich | CG10 | |
| Human serum albumin | CooperSurgical | GHSA-125 | |
| Hyaluronidase | CooperSurgical | ART-4007-A | |
| Hydrogen Peroxide | CVS Pharmacy Inc. | 372441 | |
| Insulin-transferrin-selenium (ITS) | ThermoFisher Scientific | 41400-045 | |
| Leibovitz medium (L-15) | ThermoFisher Scientific | 11415-064 | |
| Luteinizing hormone | Sigma-Aldrich | L9773 | |
| Magnetic wand | Hampton Research | HR4-729 | |
| Micropipettes (1000 µm) | Minitube | 19025/0050 | |
| Micropipettes (175 , 200, and 275µm) | CooperSurgical | MXL3-175, MXL3-200, MXL3-275 | |
| Millex GV filter 0.22 µm | Millipore | SLGU033RS | |
| Mineral oil | CooperSurgical | LGOL-500 | |
| Minimum Essential Medium alpha (MEM) | ThermoFisher Scientific | 32561-037 | |
| Oocyte Imaging System-Spindleview | Hamilton Thorne | ||
| Phosphate buffered saline (PBS) | ThermoFisher Scientific | 10010-023 | |
| Propidium iodide | Sigma-Aldrich | P4170 | |
| Rapid i | VitroLife | 14406 | |
| SmartBox | VitroLife | 14423 | |
| Synthetic Protein Substitute (SPS) | CooperSurgical | ART-3011 | |
| Tyramine -linked Hyaluronan Biohydrogel Kit | LifeCore | ENG-00151 | |
| Ultrasonic sealer | VitroLife | 14415 | |
| Universal GPS Culture dish 8x 100 µl wells | CooperSurgical | UGPS-010 |
参考文献
- Telfer, E. E., Andersen, C. Y. In vitro growth and maturation of primordial follicles and immature oocytes. Fertil Steril. 115 (5), 1116-1125 (2021).
- Telfer, E. E., McLaughlin, M. Natural history of the mammalian oocyte. Reprod Biomed Online. 15 (3), 288-295 (2007).
- Xiao, S., et al. In vitro follicle growth supports human oocyte meiotic maturation. Sci Rep. 5, 17323 (2015).
- Carabatsos, M. J., Sellitto, C., Goodenough, D. A., Albertini, D. F. Oocyte-granulosa cell heterologous gap junctions are required for the coordination of nuclear and cytoplasmic meiotic competence. Dev Biol. 226 (2), 167-179 (2000).
- Diaz, F. J., Wigglesworth, K., Eppig, J. J. Oocytes are required for the preantral granulosa cell to cumulus cell transition in mice. Dev Biol. 305 (1), 300-311 (2007).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biol Reprod. 73 (2), 351-357 (2005).
- Dadashzadeh, A., Moghassemi, S., Shavandi, A., Amorim, C. A. A review on biomaterials for ovarian tissue engineering. Acta Biomater. 135, 48-63 (2021).
- Simon, L. E., Kumar, T. R., Duncan, F. E. In vitro ovarian follicle growth: a comprehensive analysis of key protocol variablesdagger. Biol Reprod. 103 (3), 455-470 (2020).
- Belli, M., et al. Towards a 3D culture of mouse ovarian follicles. Int J Dev Biol. 56 (10-12), 931-937 (2012).
- Berkholtz, C. B., Shea, L. D., Woodruff, T. K. Extracellular matrix functions in follicle maturation. Semin Reprod Med. 24 (4), 262-269 (2006).
- Desai, N., et al. Three-dimensional in vitro follicle growth: overview of culture models, biomaterials, design parameters and future directions. Reprod Biol Endocrinol. 8, 119 (2010).
- Shea, L. D., Woodruff, T. K., Shikanov, A. Bioengineering the ovarian follicle microenvironment. Annu Rev Biomed Eng. 16, 29-52 (2014).
- Paulini, F., et al. Survival and growth of human preantral follicles after cryopreservation of ovarian tissue, follicle isolation and short-term xenografting. Reprod Biomed Online. 33 (3), 425-432 (2016).
- West, E. R., Xu, M., Woodruff, T. K., Shea, L. D. Physical properties of alginate hydrogels and their effects on in vitro follicle development. Biomaterials. 28 (30), 4439-4448 (2007).
- Joo, S., et al. The effect of collagen hydrogel on 3D culture of ovarian follicles. Biomed Mater. 11 (6), 065009 (2016).
- Telfer, E., Torrance, C., Gosden, R. G. Morphological study of cultured preantral ovarian follicles of mice after transplantation under the kidney capsule. J Reprod Fertil. 89 (2), 565-571 (1990).
- Torrance, C., Telfer, E., Gosden, R. G. Quantitative study of the development of isolated mouse pre-antral follicles in collagen gel culture. J Reprod Fertil. 87 (1), 367-374 (1989).
- Dong, C., Yonggang, L. V. Application of collagen scaffold in tissue engineering: recent advances and new perspectives. Polymers. 8 (2), 42 (2016).
- Le, B. A. M., et al. Agarose-based 3D culture improved the developmental competence of oocyte-granulosa complex isolated from porcine preantral follicle. Theriogenology. 223, 11-21 (2024).
- Park, J. E., et al. In vitro maturation on an agarose matrix improves the developmental competence of porcine oocytes. Theriogenology. 157, 7-17 (2020).
- Zaniker, E. J., et al. Three-dimensionally printed agarose Micromold supports scaffold-free mouse ex vivo follicle growth, ovulation, and luteinization. Bioengineering. 11 (7), 719 (2024).
- Pangas, S. A., Saudye, H., Shea, L. D., Woodruff, T. K. Novel approach for the three-dimensional culture of granulosa cell-oocyte complexes. Tissue Eng. 9 (5), 1013-1021 (2003).
- West, E. R., Shea, L. D., Woodruff, T. K. Engineering the follicle microenvironment. Semin Reprod Med. 25 (4), 287-299 (2007).
- Xu, J., et al. Survival, growth, and maturation of secondary follicles from prepubertal, young, and older adult rhesus monkeys during encapsulated three-dimensional culture: effects of gonadotropins and insulin. Reproduction. 140 (5), 685-697 (2010).
- Xu, M., Kreeger, P. K., Shea, L. D., Woodruff, T. K. Tissue-engineered follicles produce live, fertile offspring. Tissue Eng. 12 (10), 2739-2746 (2006).
- Amorim, C. A., Van Langendonckt, A., David, A., Dolmans, M. M., Donnez, J. Survival of human pre-antral follicles after cryopreservation of ovarian tissue, follicular isolation and in vitro culture in a calcium alginate matrix. Hum Reprod. 24 (1), 92-99 (2009).
- Converse, A., Zaniker, E. J., Amargant, F., Duncan, F. E. Recapitulating folliculogenesis and oogenesis outside the body: encapsulated in vitro follicle growth dagger. Biol Reprod. 108 (1), 5-22 (2023).
- Mainigi, M. A., Ord, T., Schultz, R. M. Meiotic and developmental competence in mice are compromised following follicle development in vitro using an alginate-based culture system. Biol Reprod. 85 (2), 269-276 (2011).
- Kreeger, P. K., Deck, J. W., Woodruff, T. K., Shea, L. D. The in vitro regulation of ovarian follicle development using alginate-extracellular matrix gels. Biomaterials. 27 (5), 714-723 (2006).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. Interpenetrating fibrin-alginate matrices for in vitro ovarian follicle development. Biomaterials. 30 (29), 5476-5485 (2009).
- Griffith, L. G., Swartz, M. A. Capturing complex 3D tissue physiology in vitro. Nat Rev Mol Cell Biol. 7 (3), 211-224 (2006).
- Irving-Rodgers, H. F., Rodgers, R. J. Extracellular matrix of the developing ovarian follicle. Semin Reprod Med. 24 (4), 195-203 (2006).
- Salustri, A., Camaioni, A., Di Giacomo, M., Fulop, C., Hascall, V. Hyaluronan and proteoglycans in ovarian follicles. Hum Reprod Update. 5, 293 (1999).
- Rashki Ghaleno, L., Cristian, P. P., Shahverdi, A., Dardmeh, F., Alipour, H., Valojerd, M. R. Exploring the role of hyaluronic acid in reproductive biology and beyond: Applications in assisted reproduction and tissue engineering. Adv. Biology. 8 (6), e202300621 (2024).
- Desai, N. N., Goldberg, J. M., Austin, C., Falcone, T. The new Rapid-i carrier is an effective system for human embryo vitrification at both the blastocyst and cleavage stage. Reprod Biol Endocrinol. 11, 41 (2013).
- Desai, N., Abdelhafez, F., Calabro, A., Falcone, T. Three dimensional culture of fresh and vitrified mouse pre-antral follicles in a hyaluronan-based hydrogel: a preliminary investigation of a novel biomaterial for in vitro follicle maturation. Reprod Biol Endocrinol. 10 (1), 29 (2012).
- Desai, N., Spangler, M., Nanavaty, V., Gishto, A., Brown, A. New hyaluronan-based biomatrix for 3-D follicle culture yields functionally competent oocytes. Reprod Biol Endocrinol. 20 (1), 148 (2022).
- Monti, M., Redi, C. A. Isolation and characterization of mouse antral oocytes based on nucleolar chromatin organization. J Vis Exp. (107), e53616 (2016).
- Huang, L., et al. Cryopreservation of human ovarian tissue by solid-surface vitrification. Eur J Obstet Gynecol Reprod Biol. 139 (2), 193-198 (2008).
- Chan, J., Darr, A., Alam, D., Calabro, A. Investigation of a novel cross-linked hyaluronan hydrogel for use as a soft-tissue filler. Am J Cosmetic Sur. 22, 105-108 (2005).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. A method for ovarian follicle encapsulation and culture in a proteolytically degradable 3-dimensional system. J Vis Exp. (49), e2695 (2011).
- Xu, M., West, E., Shea, L. D., Woodruff, T. K. Identification of a stage-specific permissive in vitro culture environment for follicle growth and oocyte development. Biol Reprod. 75 (6), 916-923 (2006).
- West-Farrell, E. R., et al. The mouse follicle microenvironment regulates antrum formation and steroid production: alterations in gene expression profiles. Biol Reprod. 80 (3), 432-439 (2009).
- Xu, M., et al. Encapsulated three-dimensional culture supports development of nonhuman primate secondary follicles. Biol Reprod. 81 (3), 587-594 (2009).
- Wu, J., Nayudu, P. L., Kiesel, P. S., Michelmann, H. W. Luteinizing hormone has a stage-limited effect on preantral follicle development in vitro. Biol Reprod. 63 (1), 320-327 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved