Method Article
Application d’un nouvel hydrogel d’hyaluronane pour la culture tridimensionnelle de follicules et méthodologie pour la cryoconservation de follicules ovariens de souris
Dans cet article
Résumé
Ce protocole décrit un nouveau modèle de culture tridimensionnel (3D) utilisant un hydrogel d’hyaluronane lié à la tyramine pour encapsuler et cultiver des follicules préantraux à partir de l’ovaire de souris. Nous détaillons également deux approches de la cryoconservation des follicules ovariens par vitrification.
Résumé
L’architecture 3D du follicule ovarien et les interactions complexes entre les composants des cellules somatiques et l’ovocyte qui sont nécessaires à la maturation cytoplasmique et nucléaire sont difficiles à maintenir dans les systèmes de culture bidimensionnels (2D) conventionnels. Nous décrivons un nouveau modèle de culture 3D utilisant un hydrogel d’hyaluronane lié à la tyramine pour l’encapsulation et la culture de follicules ovariens de souris. La technique d’encapsulation de l’acide hyaluronique permet la croissance 3D des follicules et la rétention des facteurs trophiques à proximité des follicules en développement. Cet hydrogel est très polyvalent et peut être appliqué sur des follicules isolés ainsi que sur des fragments de tissu ovarien. Les propriétés viscoélastiques du gel HA permettent d’ajuster la rigidité ainsi que la moulabilité en fonction de la concentration du gel. Les follicules préantraux qui se développent dans ce modèle de culture sont capables de terminer la maturation méiotique dans les 10 à 12 jours suivant la culture et d’ovuler un ovocyte de métaphase II lors du déclenchement avec hCG. Cet article détaille également deux approches de la cryoconservation des follicules ovariens par vitrification.
Introduction
La folliculogenèse humaine in vitro reste un défi, même quatre décennies après la première naissance de la fécondation in vitro. À ce jour, il n’existe toujours pas de méthodologie pour la culture de follicules ovariens humains qui soutient la production d’un embryon viable résultant en un bébé en bonne santé1. Les propriétés physiques optimales nécessaires à la croissance des follicules humains in vitro restent à déterminer. L’ovaire intact est peuplé de milliers de follicules à différents stades de développement, et la régulation de leur croissance est un processus complexe (Figure 1)2. Les ovocytes au stade de vésicule germinale (GV) des follicules préantraux humains prennent jusqu’à 30 jours en culture pour atteindre leur maturité méiotique et atteindre le stade3 de la métaphase II. La communication bidirectionnelle entre l’ovocyte et les cellules de la granulosa environnantes par le biais de jonctions lacunaires est essentielle pour la maturation cytoplasmique et nucléaire 4,5,6.
Les systèmes de culture 2D conventionnels ne sont pas idéaux pour la culture de follicules, en particulier dans les modèles de mammifères plus grands qui nécessitent un temps de culture prolongé. Les follicules se fixent à la boîte et le lien entre les cellules de la granulosa et l’ovocyte devient plus ténu à mesure que les cellules de la granulosa migrent. Les systèmes de culture tridimensionnelle (3D) pour les follicules sont donc apparus comme un moyen d’imiter plus fidèlement la physiologie in vivo 7,8.
L’encapsulation des follicules dans une matrice pour favoriser la croissance 3D a été une approche pour préserver l’architecture folliculaire lors de la culture in vitro (IVC). Des biomatrices de polymères naturels (tels que le collagène, l’agarose, la fibrine, l’alginate et l’acide hyaluronique), ainsi que des polymères synthétiques (tels que le polyéthylène glycol, l’alcool polyvinylique et l’acide polyglycolique), ont été testés 7,9,10,11,12,13. Il a été démontré que les propriétés mécaniques d’une biomatrice influencent la diffusion des nutriments, la différenciation des cellules thécales, la formation de l’antre ainsi que la sécrétion hormonale14. Le collagène, en tant que partie de la matrice extracellulaire naturelle (MEC) de la cellule, est l’une des premières matrices testées et était initialement prometteuse 15,16,17. Cependant, la logistique de normalisation des préparations de collagène, les mauvaises propriétés mécaniques et la stabilité ont limité son utilisation18. L’agarose a été testée sur des complexes cumulus-ovocytes (COC) libérés par les follicules antraux ainsi que sur les follicules primordiaux19,20. Plus récemment, un moule d’agarose imprimé en 3D s’est révélé prometteur pour la culture de follicules sans échafaudage21. L’encapsulation de l’alginate de calcium, signalée pour la première fois en 2003, a été, à ce jour, le système le plus étudié pour la VCI22. Il a été testé sur des souris, des bovins, des singes ainsi que sur des follicules humains 23,24,25,26,27. Avec l’alginate de calcium, les follicules sont chargés individuellement en micro-gouttes du polymère et exposés au chlorure de calcium pour générer une bille de gel. L’extraction des follicules de la perle nécessite un traitement avec un agent chélateur. Cependant, cette matrice présente quelques inconvénients. L’alginate est un polysaccharide isolé d’algues et, bien qu’il fournisse un soutien, il ne fait pas partie de la matrice extracellulaire naturelle du follicule. Les données suggèrent une incidence plus élevée de défauts du fuseau après VCI dans l’alginate28. Des modifications ultérieures du système en combinant l’alginate avec de la fibrine ou d’autres composants de la matrice extracellulaire (MEC) ont contribué à rendre le système d’alginate de calcium plus efficace29,30.
De plus en plus de preuves indiquent que la matrice extracellulaire est un modulateur clé de la croissance cellulaire 10,31,32 . Il fournit non seulement un soutien, mais joue également un rôle essentiel dans l’attachement, la fonction, la croissance et la communication des cellules. L’un des principaux composants de la MEC est l’hyaluronane, un glycosaminoglycane naturel. Dans le follicule ovarien, l’hyaluronane est produit par les cellules de la granulosa et contribue à l’intégrité structurelle et à la fonction du follicule en développement33,34. L’intégration de l’hyaluronane dans un modèle de culture de follicules peut donc aider à créer un environnement plus physiologique et à améliorer la production d’ovocytes fonctionnellement compétents.
Ce travail décrit l’application novatrice d’un hyaluronane lié à la tyramine en tant que biomatrice pour la culture de follicules ovariens frais et congelés et la maturation in vitro des ovocytes (MIV). Nous détaillons également les techniques de cryoconservation des follicules par vitrification sur deux types de dispositifs. Une méthode implique une immersion directe dans de l’azote liquide, tandis que dans la seconde, les follicules sont enfermés dans une paille avant l’immersion. L’objectif principal est de montrer que, malgré les différences, les méthodologies et les dispositifs peuvent être utilisés de manière fiable pour la cryoconservation des follicules.
Protocole
Toutes les expériences sur les animaux ont été menées conformément aux protocoles institutionnels d’utilisation et de soins aux animaux de la Cleveland Clinic et conformément aux directives et réglementations des National Institutes of Health pour le soin et l’utilisation des animaux de laboratoire.
1. Préparation moyenne
REMARQUE : Les milieux décrits ci-dessous seront utilisés pour les différentes étapes de cette procédure : manipulation du tissu ovarien (OT), digestion de la collagénase OT, culture folliculaire (FCM) et vitrification. Préparez tout le milieu dans une hotte de culture tissulaire en utilisant une technique stérile.
- Milieu de manipulation du tissu ovarien
- Compléter 20 mL de milieu de Leibovitz (L-15) avec 0,1 % de sérum fœtal bovin (FBS) dans une fiole de culture tissulaire de 50 mL (T-50).
- Fermez hermétiquement et placez le ballon dans l’incubateur pendant la nuit pour le réchauffer à 37 °C avant utilisation. Ce milieu est utilisé pour manipuler le tissu ovarien et les follicules à l’extérieur de l’incubateur et ne nécessite pas de CO2 pour maintenir un pH de 7,2 à 7,4
ATTENTION : N’exposez pas la vaisselle au gaz CO2 ou le milieu deviendra acide.
- Milieu de digestion à la collagénase
- Le matin de la récolte des follicules, ajoutez 1 mg de collagénase de type I (295 U/mg) dans un tube à essai avec 2,2 ml de milieu de manipulation OT préchauffé. La concentration finale souhaitée de collagénase est de 134 U/mL Filtrer stériliser à l’aide d’un filtre à seringue de 0,22 μm. Fermez hermétiquement et placez dans le bloc chauffant.
- Milieu de culture de follicules et huile
- Préparer 30 mL de milieu essentiel minimum alpha complété par 5 % de sérum fœtal bovin dans une fiole T-50. Compléter avec 100 mUI/mL de FSH, 10 mUI/mL de LH, 10 μg/mL d’insuline, 5 μg/mL de transferrine et 5 ng/m de sélénium.
- Prééquilibrez le FCM à 37 °C avec 6 % de CO2 et l’air pendant la nuit dans l’incubateur avant utilisation.
- Déposer 50 ml d’huile minérale dans la fiole, boucher sans serrer et équilibrer toute la nuit dans l’incubateur.
- Milieux de vitrification pour FL et FL-Clusters
- Le milieu de base pour toutes les solutions est Global-Hepes complété par 20 % de substitut de protéines synthétiques. Préparez 20 mL de solution VS1 avec 7,5 % d’éthylène glycol (EG) et 7,5 % de diméthylsulfoxyde (DMSO) dans un milieu basal.
- Préparez 20 mL de VS2 avec 15 % EG, 15 % de DMSO et 0,5 M de saccharose dans un milieu basal. Stérilisez toutes les solutions à l’aide d’un filtre à seringue de 0,22 μm et conservez-les à 4 °C jusqu’à utilisation. Les solutions peuvent être utilisées jusqu’à 4 semaines.
- Milieux chauffants pour follicules vitrifiés et FL-Clusters
- Le milieu de base pour toutes les solutions est Global-Hepes complété par 20 % de substitut de protéines synthétiques. Préparez 20 ml de milieu de base avec 0,25 M de saccharose. Étiquetez comme WS1.
- Préparez 20 mL de milieu de base avec 0,125 M de saccharose et étiquetez comme WS2. Stériliser par filtre avec un filtre à seringue de 0,22 μm. Conservez les solutions à 4 °C jusqu’à 4 semaines.
2. Prélèvement des ovaires
- Euthanasier les petits B6D2F1 âgés de 10 à 14 jours par luxation cervicale (sans anesthésie). Utilisez 3-4 chiots pour obtenir 250-300 follicules préantraux intacts pour l’expérimentation.
- Allongez l’animal sur le dos et tamponnez le ventre avec de l’alcool isopropylique à 70 %. Faites une petite coupe horizontale à mi-chemin à l’aide de ciseaux propres. Saisissez la peau au-dessus et en dessous de la coupe avec des pinces fines et tirez dans les deux sens (vers la tête et les pieds) pour exposer l’abdomen.
- À l’aide d’une deuxième paire de ciseaux propres et d’une pince fine, coupez la paroi abdominale. Soulevez les serpentins intestinaux. Localisez les cornes utérines, les oviductes et les ovaires. Exciser les ovaires et les placer dans un plat central contenant 1 mL de milieu de manipulation d’ergothérapie chauffé à 37 °C.
- À l’aide d’un microscope à dissection, coupez la graisse et le tissu oviductal. Coupez les ovaires en deux.
3. Isolement des follicules et des grappes FL (FL-C)
- Utilisez une hotte à flux laminaire avec une surface chauffée à 37 °C pour l’isolation et la manipulation des follicules. Travaillez de manière aseptique dans la hotte. Soyez prudent avec l’antenne FCM. Utilisez le bubbler pour maintenir le plat gazé avec 5 % de CO2 lorsque vous travaillez dans la hotte à flux laminaire.
REMARQUE : Toutes les solutions doivent être préchauffées à 37 °C. Le milieu FCM, ainsi que l’huile minérale, doivent être pré-équilibrés pendant la nuit dans un incubateur à 37 °C avec 6 % de CO2 avant utilisation. Le pH moyen se déplacera à l’extérieur de l’incubateur pendant plus de 10 minutes. - Pipeter 6 ml de FCM pré-équilibré dans deux boîtes de 60 mm et recouvrir d’huile minérale. Remettez dans l’incubateur.
- Pipeter 1 mL de collagénase dans un plat central et 3 mL de milieu OT dans la paroi externe. Déplacer les ovaires dans une solution de collagénase à l’aide d’une micropipette en verre (1000 μm). Incuber la parabole pendant 30-40 min sur la surface chauffée de la hotte à flux laminaire.
- À la fin de l’incubation de la collagénase, pipeter 6 mL de milieu OT dans deux boîtes de culture tissulaire de 60 mm étiquetées 1 et 2. Placer sur la surface chaude de la hotte.
- À l’aide d’une micropipette, déplacez les ovaires traités à la collagénase vers le puits externe pour les rincer sans collagénase. Changez les micropipettes, puis déplacez les ovaires vers la boîte d’ergothérapie 1.
- Prélevez les follicules de chaque ovaire à l’aide d’une pipette P200. Libération des follicules par aspiration et expulsion répétées de l’ovaire traité aux enzymes à travers l’extrémité de la pipette coupée à différentes tailles. La séparation mécanique du tissu en fragments à l’aide de deux aiguilles 27G avant le pipetage est également utile pour libérer des follicules individuels. Chaque bébé souris doit produire 60 à 75 follicules intacts de la taille souhaitée.
- Si nécessaire, remettez les morceaux d’ovaire non dissociés dans la collagénase pendant encore 5 à 10 minutes, rincez et répétez le pipetage pour libérer plus de follicules.
REMARQUE : Une surexposition à la collagénase entraînera une perturbation des couches de cellules de la granulosa entourant l’ovocyte. N’essayez pas de briser tout l’ovaire. Arrêtez-vous une fois que 250 à 300 follicules sont collectés. - Examinez les follicules libérés à l’aide d’un microscope de dissection à un grossissement de 40x. Identifier les follicules pré-antraux secondaires (~120 à 140 μm de diamètre) avec un ovocyte situé au centre enfermé dans une membrane basale intacte (limbe basal). Cette taille de follicule aura généralement 2 à 4 couches de cellules de la granulosa entourant l’ovule (voir Figure 1).
REMARQUE : Comparez les follicules à l’ouverture d’une pointe de micropipette de 175 μm pour obtenir une taille approximative du follicule. Le follicule doit être dimensionné à environ 3/4 du diamètre de la pipette. C’est la méthode la plus rapide pour sélectionner les follicules de la taille souhaitée. - À l’aide d’une micropipette de 175 μm, déplacez les follicules sélectionnés dans la boîte OT2. Une fois le prélèvement terminé, rincez tous les follicules dans la boîte FCM1 pour éliminer toute trace de milieu OT. Transférez ensuite dans la parabole FCM2.
- Placez le plat dans un incubateur pendant 60 min avant de commencer le processus d’enrobage.
- Pour l’isolement du groupe de follicules, effectuez les étapes 3.1 à 3.5. À l’aide de deux seringues à la tuberculine (27 g), séparez l’ovaire en fragments, puis en petits groupes de 6 à 10 follicules.
REMARQUE : La culture de grappes de follicules (FL-C) est une alternative à la culture de follicules individuels. Cette méthode conserve l’architecture folliculaire native ainsi que les composants stromaux. La taille des follicules en FL-C n’est pas uniforme. Les follicules conservent leur configuration in vivo avec la présence de follicules primordiaux, primaires et secondaires. - Prélevez ces amas de follicules (FL-C) à l’aide d’une micropipette de 200 μm dans la boîte OT2. Une fois la collecte terminée, rincez tous les FL-C et transférez-les dans FCM2 en attendant l’incorporation.
4. Intégration des follicules et des amas de follicules
- Préparez une solution mère de 10 mg/mL d’hydrogel d’hyaluronane (HA) lié à la tyramine activée. Réhydrater 250 mg de poudre d’hyaluronate de sodium substitué par la tyramine avec 25 mL d’enzyme peroxydase de raifort (HRP ; 10 UI/mL) dans une solution saline tamponnée au phosphate. Une fois solubilisé, stocker 500 μL d’aliquotes de ce stock d’AH activé à -4 °C pour de futures expériences.
- Pour les expériences sur les follicules, décongeler la solution mère d’AH et la diluer à une concentration de 3 mg/mL dans un milieu global réchauffé à 37 °C. Effectuez toutes les étapes d’enrobage dans une hotte à flux laminaire avec une surface d’établi chauffée à 37 °C. Utilisez une boîte de 60 mm avec huit puits de 100 μL pour l’enrobage et la culture folliculaire ultérieure.
- Déplacez les follicules ou les amas de FL à incorporer de la boîte FCM vers une goutte de gel HA pour rincer sans milieu de culture. Le support de suivi interférera avec la formation de gel. Remettez l’antenne FCM sous le bulleur pour gazer.
REMARQUE : Les follicules isolés peuvent être intégrés, seuls ou en groupes selon l’expérience. Nous préférons généralement semer 2 à 4 follicules par perle. - Placez 1 μL de peroxyde d’hydrogène à 0,03 % (H2O2) sur une boîte de Pétri. Ajouter 25 μL de gel d’AH à 3 mg/mL sur la goutte de peroxyde d’hydrogène et mélanger par pipetage pour initier la réticulation (voir figure 2).
- À l’aide d’une pipette P20, prélevez le mélange HA-H2O2 et pipetez une goutte (~8-10 μL) dans deux puits séparés de la boîte de culture à 8 puits. Évitez de faire des bulles.
- À l’aide d’une micropipette de 200 μm, transférez rapidement les follicules ou un FL-C au centre de chaque goutte (Figure 3). La vitesse est importante car une fois que l’AH est exposé au catalyseur (peroxyde), il commence à se gélifier en 1 à 2 minutes. Attention à ne pas introduire de bulles lors de l’ensemencement.
REMARQUE : Pour suivre la croissance des follicules individuels, positionnez les follicules à une distance les uns des autres. Ne placez pas les follicules trop près du fond du gel, sinon pendant la VCI, ils peuvent descendre suffisamment pour se fixer. - Attendez ~ 3 min pour terminer le processus de gélification, puis ajoutez 100 μL de FCM pré-équilibré dans chaque puits. Répétez ce processus et chargez les follicules dans les huit puits. Recouvrir d’huile minérale chaude pré-équilibrée et placer le plat dans un incubateur.
5. Vitrification des follicules et des amas de FL
REMARQUE : La vitrification peut être effectuée à l’aide d’un support ouvert (Cryoloop ; CL), permettant un contact direct avec de l’azote liquide, ou bien un transporteur fermé (Rapid I ; RI), où l’échantillon est scellé dans une paille extérieure et, par conséquent, n’entre jamais en contact avec de l’azote liquide. La figure 4 montre les dispositifs et les contrastes des deux systèmes de vitrification. La vitrification sur les deux dispositifs s’est avérée efficace pour la cryoconservation d’embryons35.
- Vitrifiation RI à support fermé
- Préchauffer 2 mL d’aliquotes de solutions VS à 37 °C dans un bloc chauffé. Effectuez toutes les étapes de vitrification sur la surface chauffée de la hotte à flux laminaire à l’aide d’un microscope de dissection pour visualiser le follicule et le porteur.
- Remplissez la boîte cryogénique isotherme avec de l’azote liquide (LN2). Placez la paille extérieure de l’appareil dans une fente de maintien à l’intérieur de la boîte afin qu’elle soit partiellement immergée dans de l’azote liquide. Posez le bâtonnet intérieur en plastique avec un petit trou sur le couvercle d’une boîte de Pétri en préparation du chargement.
- Placez deux gouttes de VS1 côte à côte sur une boîte de Pétri près du haut. À l’aide d’une micropipette de 200 μm, placez deux follicules dans la première goutte. Rincez et passez rapidement à la deuxième goutte de VS1. Incuber pendant 5 min. Si vous vitrifiez des grappes FL, traitez une seule grappe à la fois.
- Placez trois gouttes de VS2 côte à côte sur la même parabole lorsque la première incubation est presque terminée. Ensuite, déplacez rapidement les follicules séquentiellement à travers les trois gouttes VS2 en 60 s et chargez-les sur le support. Veillez à prélever un minimum de liquide avec les follicules pour éviter de suivre le milieu d’une goutte à l’autre.
- Pour charger le support, prélevez deux follicules et déposez-les avec un minimum de liquide dans le petit trou du bâtonnet en plastique. Le volume final de liquide dans le trou est minuscule < 0,5 μL. Évitez de trop remplir, ce qui fait que le liquide se déverse hors du trou et sur le bâtonnet en plastique.
- Déposez le bâtonnet dans la paille extérieure pré-refroidie. Utilisez la scelleuse à ultrasons pour fermer et sceller la paille. Placez la paille dans un gobelet attaché à la cryocanne. Jusqu’à 4 pailles peuvent être placées dans le même gobelet.
- Couvrez la canne avec un manchon de protection en plastique. Plongez la canne dans une cuve de stockage d’azote liquide (LN2).
- Vitrification CL à support ouvert
- Solutions de préchauffage VS à 37 °C. Effectuez toutes les étapes de vitrification sur la surface chauffée de la hotte à flux laminaire. Préparez à l’avance le nombre de transporteurs ouverts CL nécessaires. Insérez la tige métallique CL dans le capuchon du flacon aimanté, en vous assurant qu’elle tient fermement (utilisez une petite noisette d’adhésif si nécessaire).
- Remplissez la cryobox isotherme avec de l’azote liquide (LN2). Placez un support dans la cryoboîte pour maintenir les cryoflacons de sorte que LN2 se trouve sous le haut du flacon.
- Remplissez le flacon spécial aimanté et ventilé avec du LN2. Placez-le sur la grille. Effectuez les étapes de vitrification comme décrit aux étapes 6.1.3 à 6.1.5. La seule différence est que nous traitons généralement cinq follicules à la fois. Encore une fois, veillez à minimiser le suivi du liquide d’une goutte à l’autre.
- Pour charger les follicules, saisissez le support ouvert CL par son capuchon magnétique attaché à l’aide de la baguette métallique. Trempez le support ouvert CL dans une goutte séparée de VS2 pour créer un film de cryoprotecteur.
- À l’aide d’une micropipette, prélevez tous les follicules ou le FL-Cluster et placez-les sur le film avec un minimum de liquide. Travaillez rapidement, car les follicules doivent être chargés avant que le film ne commence à sécher.
- Immergez immédiatement le CL dans le cryoflacon rempli de LN2 pour vitrifier l’échantillon. Boucher et placer le flacon sur la cryocanne. Couvrir avec un manchon en plastique. Plongez la canne dans une cuve de stockage d’azote liquide.
6. Réchauffement des follicules vitrifiés et des amas de FL
- Réchauffage de la porteuse fermée RI
- Préparez un plat à puits central avec 3 ml de FCM pré-équilibré dans le puits extérieur et 1 ml dans le puits central. Recouvrir d’huile et placer dans l’incubateur.
- Placer 0,5 mL de WS1 et WS2 préchauffés dans deux plats centraux bien étiquetés. Déplacez les cannes contenant des échantillons du réservoir de stockage dans une cryoboîte remplie de LN2.
- Retirez le couvercle de la canne en plastique. Retirez la paille du gobelet, en la gardant immergée, et glissez-la dans la fente de maintien de la boîte cryo.
- À l’aide de ciseaux fins, coupez la paille extérieure juste au-dessus du point noir indiquant le haut du support RI intérieur avec les follicules.
- À l’aide d’une pince fine, soulevez légèrement le bâtonnet en plastique intérieur de la paille extérieure. Saisissez l’appareil et plongez rapidement le bâtonnet dans WS1, en tournant doucement pour décharger les follicules. La vitesse est essentielle. Les follicules doivent être déchargés dans WS1 dans les 10 s.
- Utilisez un microscope de dissection pour visualiser les follicules et vous assurer qu’ils ont tous été déchargés du support. Après 2 min dans WS1, utilisez une micropipette pour déplacer tous les follicules (ou FL-Cluster) vers WS2, en prenant soin de ne pas suivre le milieu.
- Après 3 min, rincez les follicules dans le puits extérieur de la boîte FCM, puis déplacez-vous vers le puits central. Remettez dans l’incubateur pendant 1 à 2 h avant de l’encastrer.
- CL Échauffement du porteur ouvert
- Préparez les plats FCM et WS comme décrit ci-dessus. Déplacez la canne avec les follicules d’un réservoir de stockage dans une boîte cryogénique remplie de LN2. Retirez le couvercle de la canne en plastique.
- Utilisez la baguette magnétique pour soulever le capuchon du cryoflacon jusqu’à ce que la tige métallique du CL soit visible.
- À l’aide d’une pince, saisissez la tige métallique. Retirez le CL du flacon et plongez-le très rapidement dans WS 1, en remuant doucement pour décharger les follicules. Déchargement dans WS1 en 10 s. À l’aide d’une lunette de dissection, vérifiez que tous les follicules ont été déchargés
- Toutes les étapes restantes de réchauffement sont les mêmes qu’avec les étapes de support fermé RI à partir de l’étape 7.1.6.
7. Imagerie des follicules et des amas FL et changement de milieu
- Surveillez les follicules et les amas de FL dans les puits pendant l’intervalle de culture de 10 à 12 jours à l’aide d’un microscope à lumière inversée doté d’une optique de modulation de contraste Hoffman et équipé d’une caméra haute définition. Utilisez un logiciel d’imagerie pour capturer des images à 40x et à un grossissement total de 100x ou 200x, selon la taille.
- Imagerie et évaluation des follicules
- Le jour 1 de la culture, après l’encastrement, imagez tous les puits de culture à 40x et 200x à l’aide d’un microscope inversé pour établir la morphologie et la taille de base. Remettez le plat dans l’incubateur.
- Regardez des images et enregistrez le nombre de follicules entièrement incrustés dans chaque bille de gel. Pour le FL-C, faites une estimation du nombre de follicules au début de la culture.
- À l’aide d’un logiciel d’imagerie, mesurez le diamètre du follicule le long de plans verticaux et horizontaux à partir du bord de la membrane basale. Mesurez la taille de l’ovocyte de la même manière à partir du bord extérieur de la zone. Enregistrez les valeurs moyennes. Prenez une mesure verticale et horizontale du diamètre de la grappe.
- Continuez à imager les cultures tous les 2-3 jours. Mesurez le diamètre des follicules qui ne sont pas en contact les uns avec les autres. Avec FL-C, les grappes se mettent en boule pendant l’IVC, de sorte que l’ensemble de la grappe peut être mesuré dans le plan vertical et horizontal.
REMARQUE : Pour les follicules regroupés étroitement ensemble, les bords individuels des follicules peuvent ne pas être discernables après le jour 4 de la culture, de sorte que des mesures ne sont pas prises. - Classez les follicules qui deviennent foncés ou apoptotiques ainsi que ceux dans lesquels l’ovocyte n’est plus entouré de cellules de la granulosa ou a été extrudé comme non viables. Gardez une trace de tous les follicules ou FL-C qui se sont attachés à la surface de la boîte (voir Figure 5).
- Observez attentivement les follicules pour la formation de l’antre à partir du 8e jour. Les follicules avec des antres auront l’air d’avoir un espace clair ou plus clair à l’intérieur (Figure 6).
- Effectuez un demi-changement de milieu de culture tous les 2 jours. Utilisez une pipette P200, réglée pour 50 μL. Insérez la pointe dans le puits sous le revêtement d’huile et loin de la bille de gel. Prélever lentement 50 μL du milieu de culture. Remplacez le fluide en pipetant lentement 50 μL de FCM frais sous le revêtement d’huile. Évitez de faire des bulles.
8. Maturation des ovocytes dans les follicules encapsulés
REMARQUE : L’étape finale de maturation est généralement initiée lorsque la formation d’antres parmi le nombre total de follicules ensemencés (et viables) atteint plus de 40 %. Cependant, dans le cas où la formation d’antres est faible ou non visible, nous recommandons de déclencher au 12e jour de culture. Nous n’avons observé aucun avantage à attendre plus longtemps. Pour les cultures FL-C, la maturation est généralement déclenchée lorsque des antres sont observés dans 40 % des puits ou au plus tard au 12e jour.
- Préparez le milieu de maturation in vitro (MIV) en complétant le FCM avec 1,5 UI/mL de gonadotrophine chorionique humaine (hCG) et 5 ng/mL de facteur de croissance épidermique (EGF).
- Déclenchez la maturation en remplaçant le FCM dans chaque puits par 100 μL de milieu IVM vers 17 heures. Après une maturation d’une nuit (16 à 18 h après le déclenchement), utilisez un microscope de dissection à un grossissement de 40x pour bien examiner chaque culture à la recherche de complexes cumulus-ovocytes (COC) qui ont ovulé à partir de la bille de gel HA. Les COC se trouvent généralement au repos juste au-dessus de la bille de gel ou bien à proximité.
- Recueillez les COC ovulés dans un puits central avec 1 ml de FCM pré-équilibré recouvert d’huile et remettez le plat dans l’incubateur.
- Prélevez les ovocytes des follicules qui sont encore encastrés en pipetant doucement la perle HA à l’aide d’une pipette P200 pour libérer les COC non ovulés. Rassemblez-les dans un plat séparé avec FCM.
- Préparez un plat central avec 1 mL d’hyaluronidase (10 UI/mL) et 3 mL de milieu FCM dans la paroi extérieure.
- Transférez les COC ovulés dans une solution d’hyaluronidase et exposez-les brièvement à l’enzyme (30-45 s) pour dénuder l’ovocyte des cellules de la granulosa afin de visualiser l’état nucléaire de l’ovocyte. Rincer les ovocytes pour éliminer l’enzyme avant de les placer dans 5 gouttes de milieu frais sous l’huile pour une évaluation détaillée. Placez le plat dans l’incubateur. Répétez ce processus pour les COC non ovulés.
- Enregistrez le nombre total d’ovules ovulés et non ovulés récupérés. Photographier et évaluer l’état nucléaire (GV, métaphase I ou métaphase II) de chaque ovocyte récupéré. Mesurez et enregistrez le diamètre.
- Calculez le taux de survie IVC sur la base du nombre total de follicules viables (ceux qui atteignent le jour du déclenchement de l’hCG) et du nombre total d’ovules récupérés. Calculez le pourcentage d’ovocytes de métaphase II à partir des COC ovulés. Répétez cette opération pour tous les ovocytes récupérés à partir des COC non ovulés.
- Déterminer le taux de maturation jusqu’à la métaphase II de la même manière pour le FL-C.
Résultats
Cet article détaille la méthodologie d’utilisation d’un nouveau gel d’hyaluronane lié à la tyramine pour la culture in vitro de follicules préantraux de souris36,37. La figure 6 illustre les différences entre la croissance des follicules préantraux lorsqu’ils sont placés dans un système de culture 2D conventionnel et un seul follicule encapsulé dans un gel HA pour la culture 3D. L’architecture folliculaire native est maintenue pendant les 12 jours de culture avec un antre clairement visible le dernier jour de croissance.
Le gel HA est très polyvalent, permettant la croissance de follicules isolés individuellement ou en groupes et le tissu ovarien est également divisé mécaniquement en petits groupes de follicules. Le gel est transparent, ce qui permet de visualiser les follicules même s’ils sont à des profondeurs différentes. Les follicules encapsulés et le FL-C présentent une expansion radiale due à la prolifération continue des cellules de la granulosa (Figure 7). Le diamètre initial des follicules est en moyenne de 139,8 ± 28 μm, le diamètre de l’ovocyte GV mesurant 63,5 ± 4,6 μm. Chez les follicules cultivés individuellement, les diamètres finaux mesurent environ 385,6 ± 36,7 μm, soit une augmentation d’environ 3 fois la taille. Les ovocytes ovulés en métaphase II mesurent environ 84,8 ± 3,8 μm. Au sein des grappes de FL en culture, la taille des follicules est assez diverse (Figure 5, Figure 7). Les ovocytes ovulés après le déclenchement de l’hCG se trouvent près du follicule (Figure 8). La majorité des ovocytes de la métaphase II seront prélevés à partir des COC ovulés. Les follicules encore intégrés après le déclenchement contiennent généralement des ovocytes GV et de métaphase I.
Le tableau 1 compare les taux de maturation entre les follicules isolés et les amas de FL provenant d’ovaires frais ou congelés. Les FL-C des ovaires cryoconservés avaient des taux de maturation significativement plus faibles. Des observations microscopiques ont montré qu’ils avaient fréquemment une lame basale cassée, ce qui les rendait très sensibles à l’extrusion prématurée des ovocytes. La nature fragile des amas de follicules a été quelque peu contrée par l’encapsulation. Le traitement à la collagénase des ovaires cryoconservés a été évité car il était particulièrement dommageable avec un faible taux de survie et un faible rendement de follicules intacts.
La cryoconservation de follicules isolés est beaucoup plus efficace que la conservation de l’ovaire entier. Des taux de maturation élevés peuvent être obtenus avec les deux méthodes de vitrification examinées (tableau 2). Malgré de grandes différences dans les vitesses de refroidissement, la maturation des ovocytes après VCI n’a pas différé. Le support ouvert CL permet une plus grande efficacité car jusqu’à dix follicules peuvent être chargés sur un seul support ouvert CL. Cela raccourcit également le temps global de récupération de plusieurs follicules cryoconservés. Cependant, pour toute application clinique éventuelle de la vitrification pour les follicules humains, le système fermé scellé peut être préférable.
La disposition de la chromatine autour du nucléole de l’ovocyte GV peut être utilisée pour identifier les ovocytes les plus susceptibles de féconder après l’ovulation et de se développer en blastocystes38. La figure 9 illustre la coloration en direct des ovocytes pour visualiser le modèle de distribution de la chromatine.
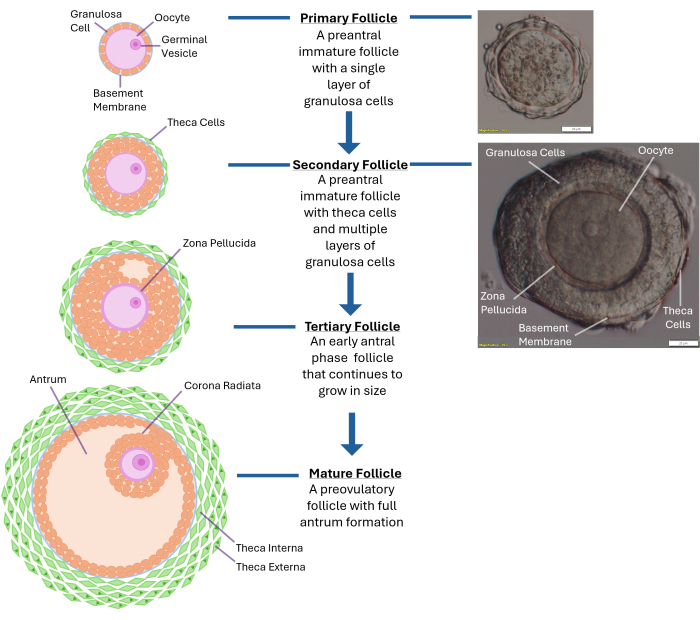
Figure 1 : Schéma de la croissance des follicules. Ce schéma illustre les différentes étapes du développement du follicule, d’un follicule primaire au stade préantral secondaire et enfin à un follicule tertiaire complètement mature prêt pour l’ovulation. Une image microscopique d’un follicule préantral typique est également montrée avec ses différentes caractéristiques morphologiques. Veuillez cliquer ici pour voir une version agrandie de cette figure.
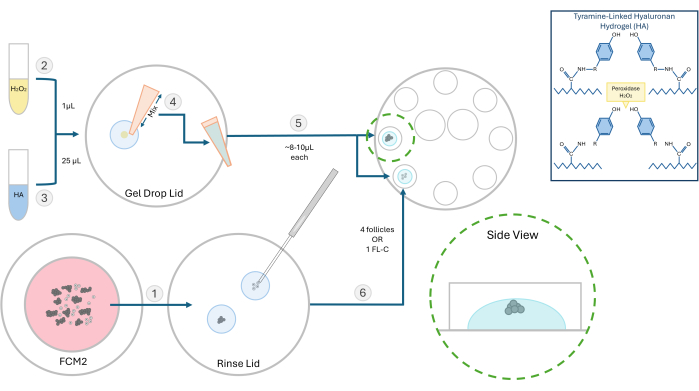
Figure 2 : Schéma de la méthode d’encapsulation HA. La structure du gel d’acide hyaluronique et les différentes étapes de l’intégration des follicules sont illustrées dans ce schéma. Veuillez cliquer ici pour voir une version plus grande de cette figure.
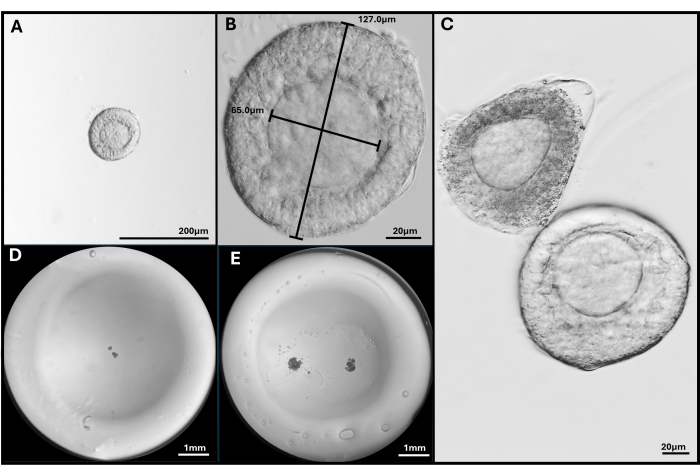
Figure 3 : Isolement et encapsulation du follicule. (A, B) Follicule préantral sélectionné pour l’intégration à un grossissement de 40x et 200x. (C) Le follicule apoptotique est représenté avec un follicule préantral sain avec un ovocyte pas tout à fait central. (D) Image d’une perle de gel HA ensemencée avec des follicules et (E) avec deux FL-C. Images prises avec un stéréomicroscope pour montrer l’ensemble de la bille de gel. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Dispositifs de vitrification pour la cryoconservation de follicules isolés. Avec le dispositif à support ouvert CL, l’étape de vitrification est réalisée par immersion directe des follicules dans l’azote liquide. Le taux de refroidissement est donc extrêmement élevé, supérieur à -20 000 °C/min. En revanche, avec le support fermé RI, les follicules sont chargés sur le bâtonnet en plastique intérieur et déposés dans une paille extérieure immergée dans de l’azote liquide. Cette méthode de vitrification fermée évite le contact direct avec l’azote liquide. Cependant, la vitesse de refroidissement est nettement inférieure à -1220 °C/min. Le chargement et la récupération des follicules de l’un ou l’autre porteur sont faciles. Le support ouvert CL pouvait charger jusqu’à dix follicules par dispositif, contre seulement deux avec le support fermé RI. Ce chiffre a été modifié au lieu de35. Veuillez cliquer ici pour voir une version agrandie de cette figure.
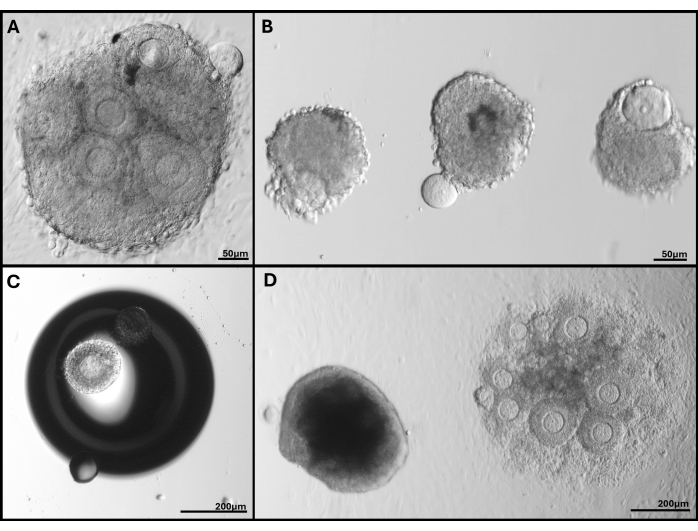
Figure 5 : Images représentatives des problèmes rencontrés. (A) Amas de follicules avec extrudation de l’ovocyte. (B) Follicules isolés avec une membrane de lame basale brisée et un avec un ovocyte extrudé. (C) Follicule incrusté sous une bulle dans le gel. (D) Amas de follicules qui est resté dans le gel (à gauche) par rapport à l’amas incrusté trop profondément qui s’est finalement attaché à la boîte. La large gamme de tailles de follicules dans FL-C est clairement visible. Veuillez cliquer ici pour voir une version agrandie de cette figure.
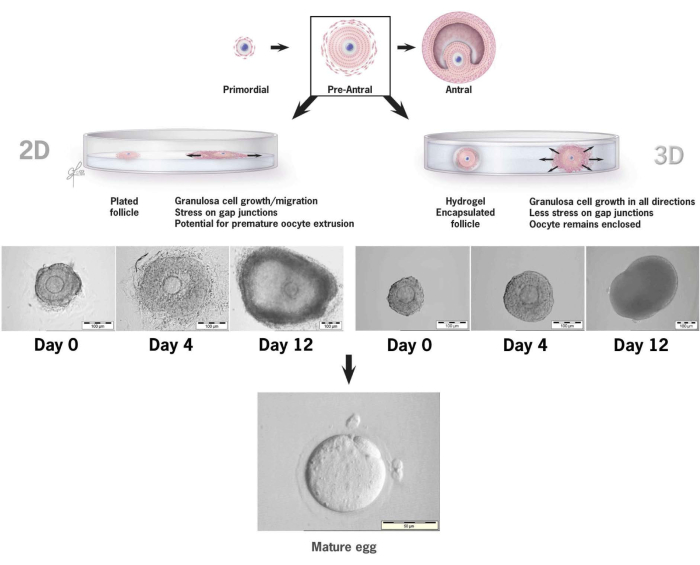
Figure 6 : Comparaison de la croissance folliculaire dans les conventions 2D par rapport à la culture 3D dans l’HA. Avec la croissance 2D, l’aplatissement du follicule et la fixation des cellules de la granulosa à la boîte de culture tissulaire ont été observés au jour 4, laissant l’ovocyte vulnérable à la migration des cellules de la granulosa, à la perturbation des jonctions lacunaires et à l’extrusion prématurée de l’ovocyte. Le follicule encapsulé dans l’HA est resté détaché tout au long de l’intervalle de culture. L’expansion cellulaire de la granulosa s’est produite dans toutes les directions, enveloppant l’ovocyte et maintenant l’architecture 3D. Ce chiffre a été modifié au lieu de36. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Images représentatives de follicules encapsulés dans un gel d’hyaluronane lié à la tyramine. (A) Follicule préantral prélevé après digestion par collagénase de l’ovaire frais le jour 1. (B) Goutte de gel ensemencée avec quatre follicules préantraux imagés le jour 1 et (C) Jour 4 de la culture, (D) Amas de follicules de l’ovaire frais le jour 2, (E) le jour 6 et (F) le jour 9 de la culture. (G) Amas de follicules disséqué mécaniquement à partir de l’ovaire entier vitrifié montré le jour 2 et (H) le jour 6 de la culture. (I) Le follicule avec formation d’antre est clairement visible au jour 9 de la culture. Veuillez cliquer ici pour voir une version agrandie de cette figure.
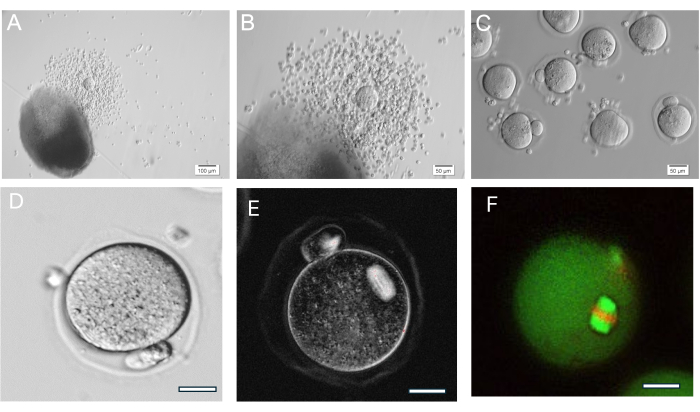
Figure 8 : Ovulation de l’ovocyte. (A, B) Cumulus-ovocytes (COC) ovulé montré à côté de la perle de gel HA. (C) Les ovocytes ont été imagés après un traitement enzymatique des COC avec de l’hyaluronidase pour éliminer les cellules cumulus environnantes. De nombreux ovocytes en métaphase II. (D) Ovocyte de métaphase II avec corps polaire proéminent. Grossissement 400x. (E) Imagerie en direct de l’ovocyte en métaphase II à l’aide d’une lumière polarisée et d’un système d’imagerie pour visualiser le fuseau méiotique et évaluer l’organisation, effectuée comme décrit en37. Grossissement 400x. Fuseau biréfringent normal visible. (F) Ovocyte de métaphase II fixé et coloré avec de l’anti-alpha/bêta-tubuline et de l’iodure de propidium pour visualiser l’organisation du fuseau méiotique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
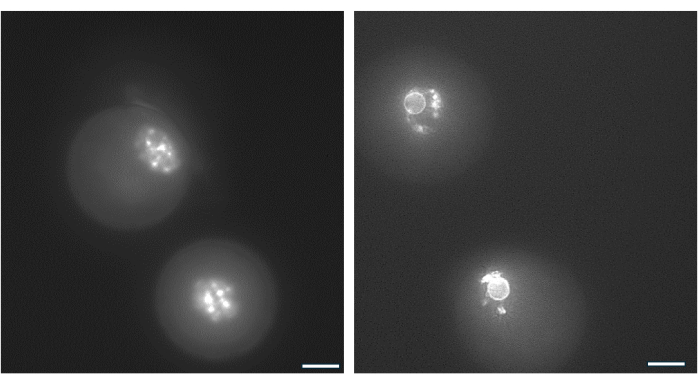
Figure 9 : Réorganisation de la chromatine dans les ovocytes GV. La disposition de la chromatine dans les ovocytes GV après la formation de l’antre a été examinée par coloration de l’ADN avec Hoechst 33342 (50 ng/mL). Des follicules représentatifs ont été prélevés à partir de billes d’AH par pipetage doux. Les cellules de la granulosa ont été éliminées à l’aide de la hyaluronidase. Les ovocytes de GV ont ensuite été colorés pendant 15 min. (Voir protocole par Monti et al.38). Les images ont été prises à un grossissement de 40x. (A) Ovocyte GV montré au jour 1 au début de la culture présentant le motif de coloration de la chromatine non entourée (NSN). (B) Ovocyte GV du follicule en croissance avec antre montré le jour du déclenchement de l’hCG. La chromatine s’est condensée et a formé un anneau périnucléaire autour du nucléole. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Paramètre | Ovaire frais | Ovary congelé | |
| Isolé FL | Cluster FL | Cluster FL | |
| Follicules observés lors de la VCI | 130 | 154 | 69 |
| Ovulation après HCG ( %) | 71% | 66% | 93% |
| (92/130) | (101/154) | (64/69) | |
| GVBD ( %) | 30% | 28% | 52% |
| (28/92) | (28/101) | (33/64) | |
| Formation d’ovocytes ( %) | 59% | 55% | *34% |
| (54//92) | (56/101) | (22/64) | |
Tableau 1 : Résultats avec des follicules inclus dans l’HA à partir d’ovaires frais et vitrifiés. Les follicules et les FL-C d’ovaires frais ont été mûris in vitro après encapsulation dans un gel HA. Le gel HA a également été testé sur des follicules d’ovaires vitrifiés à l’aide d’un protocole EG/DMSO39. Avec des ovaires frais, les follicules individuels (FL) et les amas de follicules (FL-C) ont été collectés après la digestion de la collagénase. Pour les ovaires vitrifiés, l’exposition à la collagénase était, en fait, dommageable pour les follicules. La meilleure approche avec des ovaires cryoconservés était d’isoler les amas de FL plutôt que les follicules individuels et de n’utiliser que la dissection mécanique avec des aiguilles. Le tableau compare les résultats entre les billes d’AH ensemencées avec des follicules en groupes de 4 à 6 et les billes avec un seul FL-C contenant 6 à 10 follicules. *Le taux de maturation avec le FL-C à partir d’ovaires cryoconservés était significativement plus faible (p = 0,008 ; analyse du khi-deux pour tester la signification).
| Transporteur | RI | CL |
| (Fermé) | (Ouvrir) | |
| Survie ( %) | 100% (24/24) | 100% (41/41) |
| Formation de l’antre* ( %) | 25.0% (6/24) | 75.6% (31/41)* |
| Taux d’ovulation ( %) | 66.7% (16/24) | 87.8% (36/41) |
| Taux de maturation ( % MII) | 81.3% (13/16) | 69.4% (25/36) |
Tableau 2 : Résultats après cryoconservation de follicules isolés sur deux dispositifs de vitrification différents. Des taux de maturation élevés ont été atteints à la fois avec le dispositif CL ouvert et avec le support RI fermé, avec sa vitesse de refroidissement plus faible. La formation de l’antre était le seul critère de jugement significatif observé, mais n’a pas eu d’impact sur le taux de maturation global (p < 0,05 ; Analyse du khi-deux pour tester la signification).
Discussion
La capacité de contrôler les propriétés mécaniques et la biodégradabilité de l’hydrogel HA lié à la tyramine offre de nombreux avantages pour les applications d’ingénierie tissulaire. Notre laboratoire est le premier à appliquer ce gel HA spécifique pour la croissance des follicules ovariens. Ce gel breveté d’hyaluronate de sodium substitué par la tyramine (TS-NAHY) est un nouveau système d’hydrogel à base d’hyaluronane développé à la Cleveland Clinic. La réticulation du gel est entraînée par l’exposition de la peroxydase dans le mélange de gel activé à un agent oxydant. Cela peut être fait à la fois in vitro ou in vivo. Les hydrogels TS-NAHY formés présentent un large éventail de propriétés allant d’un gel faible, d’une pâte à un solide fragile, en fonction de la concentration de gel40.
Les progrès décevants de la culture des follicules ovariens soulignent la nécessité de concevoir de nouveaux modèles de culture. La création d’un système de culture basé exclusivement sur des composants natifs de la matrice extracellulaire peut être une approche plus avantageuse. Le modèle de culture d’AH décrit est facile à utiliser de manière physiologique et ne nécessite pas de composants ECM supplémentaires. Le gel est transparent, ce qui permet une visualisation détaillée des follicules. Les propriétés viscoélastiques du gel HA facilitent l’ajustement de la rigidité ainsi que de la moulabilité. Cette caractéristique augmente la polyvalence de cette biomatrice. La rigidité d’une biomatrice peut avoir un impact sur la prolifération cellulaire de la granulosa et la formation de l’antre 30,41,42. Il a été rapporté que les follicules dérivés d’environnements de culture favorables à la formation d’antres ont des profils d’expression génique différents de ceux d’un système de culture non favorable43. Les follicules des primates semblent nécessiter une matrice plus rigide44. Il sera probablement important d’adapter la biomatrice aux exigences des différentes espèces animales, y compris les humains, pour une maturation in vitro réussie.
Pour la croissance des follicules préantraux de souris, nous avons testé des concentrations de gel allant de 2 à 5 mg/mL36. Les taux de maturation des ovocytes variaient de 44 % à 58 %. Des concentrations plus élevées de gel HA permettaient une plus grande moulabilité et une meilleure rétention d’une structure 3D, mais l’expansion des follicules était affectée. Des concentrations plus faibles d’AH permettaient une plus grande expansion radiale du follicule, mais augmentaient le risque que le follicule soit expulsé spontanément avant la fin de la VCI. La concentration de 3 à 3,5 mg/mL d’AH a fonctionné le mieux pour les follicules préantraux de souris. Il était essentiel de maintenir la goutte de gel à un niveau faible pour former des billes de gel HA d’une profondeur suffisante pour maintenir les follicules dans une configuration 3D tout au long de l’IVC. Les gouttes plus grosses s’aplatissent, ce qui entraîne la descente des follicules à travers le gel et leur fixation à la surface de la plaque. L’une des limites de l’utilisation de ce biomatériau pour l’enrobage est le temps de gélification extrêmement rapide. Il est donc difficile d’ensemencer plus de deux billes de gel HA à la fois. L’augmentation de l’efficacité de l’ensemencement des follicules dans le gel HA est un domaine que nous essayons d’améliorer.
La culture d’amas de follicules dans un environnement 3D à l’aide de l’AH a un grand potentiel. L’architecture ovarienne normale est conservée, avec des follicules de différentes tailles en contact les uns avec les autres et le stroma de soutien. La LH peut aider à la croissance de follicules préantraux plus petits dans le FL-C en induisant des changements dans les cellules thécales différenciatrices précoces, elle a donc été incluse dans le milieu FCM45. La poursuite de la culture de FL-C au-delà de 12 jours pour voir si une nouvelle vague de croissance peut être initiée dans l’un des follicules plus petits encore intégrés après le déclencheur de hCG nécessite une étude plus approfondie. Une optimisation supplémentaire du milieu de culture peut être une condition préalable à la culture de follicules de différentes tailles dans un fragment de tissu. L’un des avantages de ce modèle de culture 3D HA avec FL-C est qu’il permet d’imiter étroitement l’arrangement et les interactions folliculaires in vivo . Un autre attribut important est que, contrairement à l’alginate de calcium et à d’autres systèmes polymères, l’ovulation et la maturation peuvent être induites sans retirer physiquement les follicules du tissu ou de la matrice de gel.
Le temps nécessaire à la culture folliculaire in vitro et à l’obtention d’ovocytes matures pour la congélation est long, en particulier chez les grands mammifères. La possibilité de cryoconserver les follicules récoltés ou les amas de follicules présente un moyen de retarder cette étape jusqu’à un moment ultérieur et peut-être plus favorable. Si une telle technologie peut un jour être appliquée aux follicules humains pendant le prélèvement ovarien, elle pourrait être bénéfique. La cryoconservation de l’ovaire entier pour la préservation de la fertilité est, à l’heure actuelle, la seule option pour les patientes. Mais il reste à déterminer si c’est, en fait, la meilleure méthode. Dans cet article, nous présentons une méthodologie de vitrification pour la cryoconservation des follicules préantraux qui donne d’excellents taux de survie et de maturation après réchauffement après culture 3D.
En conclusion, nous avons décrit un nouveau modèle de culture 3D utilisant l’hyaluronane, un composant de l’ECM natif. La technique d’encapsulation HA permet de retenir les facteurs trophiques à proximité des follicules en développement. La méthodologie d’encapsulation dans la biomatrice est simple et peut s’adapter aussi bien aux follicules isolés qu’aux amas de follicules. Ce dernier pourrait ouvrir de nouvelles voies de recherche et donner un aperçu de la biologie fondamentale de la folliculogenèse et de sa régulation. Il a été démontré que les ovocytes des follicules encapsulés dans l’HA sont fonctionnellement compétents37. Ces ovocytes peuvent être fécondés, former des blastocystes in vitro et s’implanter lors du transfert à des souris pseudo-enceintes. Ces données valident l’utilisation de l’hyaluronane lié à la tyramine comme biomatrice pour la culture de follicules 3D et la maturation in vitro des ovocytes. Ce protocole pourrait potentiellement être appliqué à la culture de follicules ovariens dans d’autres modèles animaux, y compris chez l’homme. D’autres applications possibles de ce système de gel HA 3D pourraient être la culture de corps embryoïdes et d’organoïdes.
Déclarations de divulgation
Pas de conflits d’intérêts ni de divulgations.
Remerciements
Nous tenons à remercier toute l’équipe d’embryologie de la Cleveland Clinic pour leur aide, ainsi que le département REI et surtout le Dr Falcone pour son soutien. Ce projet a été financé par un fonds de recherche de la Cleveland Clinic.
matériels
| Name | Company | Catalog Number | Comments |
| Anti-alpha tubulin-FITC labelled | Sigma-Aldrich | F2168 | |
| Anti-beta tubulin-FITC labelled | Sigma-Aldrich | F2043 | |
| BZ-X700 | Keyence | ||
| Center well dish | Fisher Scientific | 08-772-12 | |
| Collagenase Type I | Worthington Biochemical Corporation | LS004196 | |
| Crycap vial-vented | Hampton Research | HR4-904 | |
| Cryoloop | Hampton Research | HR4-974 | |
| Crystal cap | Hampton Research | HR4-733 | |
| Culture dish 60mm | Fisher Scientific | 08-772B | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Epidermal growth factor (EGF) | R &D Systems | 236-EG | |
| Ethylene Glycol (EG) | Sigma-Aldrich | 293237 | |
| Fetal Bovine Serum-Heat Inactivated | ThermoFisher Scientific | 10082-147 | |
| Follicle Stimulating Hormone (FSH) | Sigma-Aldrich | F4021 | |
| Global-Hepes medium | CooperSurgical | LGGH-100 | |
| Hoechst 33342 | Sigma-Aldrich | B2261 | |
| Human chorionic gonadotrophin (hCG) | Sigma-Aldrich | CG10 | |
| Human serum albumin | CooperSurgical | GHSA-125 | |
| Hyaluronidase | CooperSurgical | ART-4007-A | |
| Hydrogen Peroxide | CVS Pharmacy Inc. | 372441 | |
| Insulin-transferrin-selenium (ITS) | ThermoFisher Scientific | 41400-045 | |
| Leibovitz medium (L-15) | ThermoFisher Scientific | 11415-064 | |
| Luteinizing hormone | Sigma-Aldrich | L9773 | |
| Magnetic wand | Hampton Research | HR4-729 | |
| Micropipettes (1000 µm) | Minitube | 19025/0050 | |
| Micropipettes (175 , 200, and 275µm) | CooperSurgical | MXL3-175, MXL3-200, MXL3-275 | |
| Millex GV filter 0.22 µm | Millipore | SLGU033RS | |
| Mineral oil | CooperSurgical | LGOL-500 | |
| Minimum Essential Medium alpha (MEM) | ThermoFisher Scientific | 32561-037 | |
| Oocyte Imaging System-Spindleview | Hamilton Thorne | ||
| Phosphate buffered saline (PBS) | ThermoFisher Scientific | 10010-023 | |
| Propidium iodide | Sigma-Aldrich | P4170 | |
| Rapid i | VitroLife | 14406 | |
| SmartBox | VitroLife | 14423 | |
| Synthetic Protein Substitute (SPS) | CooperSurgical | ART-3011 | |
| Tyramine -linked Hyaluronan Biohydrogel Kit | LifeCore | ENG-00151 | |
| Ultrasonic sealer | VitroLife | 14415 | |
| Universal GPS Culture dish 8x 100 µl wells | CooperSurgical | UGPS-010 |
Références
- Telfer, E. E., Andersen, C. Y. In vitro growth and maturation of primordial follicles and immature oocytes. Fertil Steril. 115 (5), 1116-1125 (2021).
- Telfer, E. E., McLaughlin, M. Natural history of the mammalian oocyte. Reprod Biomed Online. 15 (3), 288-295 (2007).
- Xiao, S., et al. In vitro follicle growth supports human oocyte meiotic maturation. Sci Rep. 5, 17323 (2015).
- Carabatsos, M. J., Sellitto, C., Goodenough, D. A., Albertini, D. F. Oocyte-granulosa cell heterologous gap junctions are required for the coordination of nuclear and cytoplasmic meiotic competence. Dev Biol. 226 (2), 167-179 (2000).
- Diaz, F. J., Wigglesworth, K., Eppig, J. J. Oocytes are required for the preantral granulosa cell to cumulus cell transition in mice. Dev Biol. 305 (1), 300-311 (2007).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biol Reprod. 73 (2), 351-357 (2005).
- Dadashzadeh, A., Moghassemi, S., Shavandi, A., Amorim, C. A. A review on biomaterials for ovarian tissue engineering. Acta Biomater. 135, 48-63 (2021).
- Simon, L. E., Kumar, T. R., Duncan, F. E. In vitro ovarian follicle growth: a comprehensive analysis of key protocol variablesdagger. Biol Reprod. 103 (3), 455-470 (2020).
- Belli, M., et al. Towards a 3D culture of mouse ovarian follicles. Int J Dev Biol. 56 (10-12), 931-937 (2012).
- Berkholtz, C. B., Shea, L. D., Woodruff, T. K. Extracellular matrix functions in follicle maturation. Semin Reprod Med. 24 (4), 262-269 (2006).
- Desai, N., et al. Three-dimensional in vitro follicle growth: overview of culture models, biomaterials, design parameters and future directions. Reprod Biol Endocrinol. 8, 119 (2010).
- Shea, L. D., Woodruff, T. K., Shikanov, A. Bioengineering the ovarian follicle microenvironment. Annu Rev Biomed Eng. 16, 29-52 (2014).
- Paulini, F., et al. Survival and growth of human preantral follicles after cryopreservation of ovarian tissue, follicle isolation and short-term xenografting. Reprod Biomed Online. 33 (3), 425-432 (2016).
- West, E. R., Xu, M., Woodruff, T. K., Shea, L. D. Physical properties of alginate hydrogels and their effects on in vitro follicle development. Biomaterials. 28 (30), 4439-4448 (2007).
- Joo, S., et al. The effect of collagen hydrogel on 3D culture of ovarian follicles. Biomed Mater. 11 (6), 065009 (2016).
- Telfer, E., Torrance, C., Gosden, R. G. Morphological study of cultured preantral ovarian follicles of mice after transplantation under the kidney capsule. J Reprod Fertil. 89 (2), 565-571 (1990).
- Torrance, C., Telfer, E., Gosden, R. G. Quantitative study of the development of isolated mouse pre-antral follicles in collagen gel culture. J Reprod Fertil. 87 (1), 367-374 (1989).
- Dong, C., Yonggang, L. V. Application of collagen scaffold in tissue engineering: recent advances and new perspectives. Polymers. 8 (2), 42 (2016).
- Le, B. A. M., et al. Agarose-based 3D culture improved the developmental competence of oocyte-granulosa complex isolated from porcine preantral follicle. Theriogenology. 223, 11-21 (2024).
- Park, J. E., et al. In vitro maturation on an agarose matrix improves the developmental competence of porcine oocytes. Theriogenology. 157, 7-17 (2020).
- Zaniker, E. J., et al. Three-dimensionally printed agarose Micromold supports scaffold-free mouse ex vivo follicle growth, ovulation, and luteinization. Bioengineering. 11 (7), 719 (2024).
- Pangas, S. A., Saudye, H., Shea, L. D., Woodruff, T. K. Novel approach for the three-dimensional culture of granulosa cell-oocyte complexes. Tissue Eng. 9 (5), 1013-1021 (2003).
- West, E. R., Shea, L. D., Woodruff, T. K. Engineering the follicle microenvironment. Semin Reprod Med. 25 (4), 287-299 (2007).
- Xu, J., et al. Survival, growth, and maturation of secondary follicles from prepubertal, young, and older adult rhesus monkeys during encapsulated three-dimensional culture: effects of gonadotropins and insulin. Reproduction. 140 (5), 685-697 (2010).
- Xu, M., Kreeger, P. K., Shea, L. D., Woodruff, T. K. Tissue-engineered follicles produce live, fertile offspring. Tissue Eng. 12 (10), 2739-2746 (2006).
- Amorim, C. A., Van Langendonckt, A., David, A., Dolmans, M. M., Donnez, J. Survival of human pre-antral follicles after cryopreservation of ovarian tissue, follicular isolation and in vitro culture in a calcium alginate matrix. Hum Reprod. 24 (1), 92-99 (2009).
- Converse, A., Zaniker, E. J., Amargant, F., Duncan, F. E. Recapitulating folliculogenesis and oogenesis outside the body: encapsulated in vitro follicle growth dagger. Biol Reprod. 108 (1), 5-22 (2023).
- Mainigi, M. A., Ord, T., Schultz, R. M. Meiotic and developmental competence in mice are compromised following follicle development in vitro using an alginate-based culture system. Biol Reprod. 85 (2), 269-276 (2011).
- Kreeger, P. K., Deck, J. W., Woodruff, T. K., Shea, L. D. The in vitro regulation of ovarian follicle development using alginate-extracellular matrix gels. Biomaterials. 27 (5), 714-723 (2006).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. Interpenetrating fibrin-alginate matrices for in vitro ovarian follicle development. Biomaterials. 30 (29), 5476-5485 (2009).
- Griffith, L. G., Swartz, M. A. Capturing complex 3D tissue physiology in vitro. Nat Rev Mol Cell Biol. 7 (3), 211-224 (2006).
- Irving-Rodgers, H. F., Rodgers, R. J. Extracellular matrix of the developing ovarian follicle. Semin Reprod Med. 24 (4), 195-203 (2006).
- Salustri, A., Camaioni, A., Di Giacomo, M., Fulop, C., Hascall, V. Hyaluronan and proteoglycans in ovarian follicles. Hum Reprod Update. 5, 293 (1999).
- Rashki Ghaleno, L., Cristian, P. P., Shahverdi, A., Dardmeh, F., Alipour, H., Valojerd, M. R. Exploring the role of hyaluronic acid in reproductive biology and beyond: Applications in assisted reproduction and tissue engineering. Adv. Biology. 8 (6), e202300621 (2024).
- Desai, N. N., Goldberg, J. M., Austin, C., Falcone, T. The new Rapid-i carrier is an effective system for human embryo vitrification at both the blastocyst and cleavage stage. Reprod Biol Endocrinol. 11, 41 (2013).
- Desai, N., Abdelhafez, F., Calabro, A., Falcone, T. Three dimensional culture of fresh and vitrified mouse pre-antral follicles in a hyaluronan-based hydrogel: a preliminary investigation of a novel biomaterial for in vitro follicle maturation. Reprod Biol Endocrinol. 10 (1), 29 (2012).
- Desai, N., Spangler, M., Nanavaty, V., Gishto, A., Brown, A. New hyaluronan-based biomatrix for 3-D follicle culture yields functionally competent oocytes. Reprod Biol Endocrinol. 20 (1), 148 (2022).
- Monti, M., Redi, C. A. Isolation and characterization of mouse antral oocytes based on nucleolar chromatin organization. J Vis Exp. (107), e53616 (2016).
- Huang, L., et al. Cryopreservation of human ovarian tissue by solid-surface vitrification. Eur J Obstet Gynecol Reprod Biol. 139 (2), 193-198 (2008).
- Chan, J., Darr, A., Alam, D., Calabro, A. Investigation of a novel cross-linked hyaluronan hydrogel for use as a soft-tissue filler. Am J Cosmetic Sur. 22, 105-108 (2005).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. A method for ovarian follicle encapsulation and culture in a proteolytically degradable 3-dimensional system. J Vis Exp. (49), e2695 (2011).
- Xu, M., West, E., Shea, L. D., Woodruff, T. K. Identification of a stage-specific permissive in vitro culture environment for follicle growth and oocyte development. Biol Reprod. 75 (6), 916-923 (2006).
- West-Farrell, E. R., et al. The mouse follicle microenvironment regulates antrum formation and steroid production: alterations in gene expression profiles. Biol Reprod. 80 (3), 432-439 (2009).
- Xu, M., et al. Encapsulated three-dimensional culture supports development of nonhuman primate secondary follicles. Biol Reprod. 81 (3), 587-594 (2009).
- Wu, J., Nayudu, P. L., Kiesel, P. S., Michelmann, H. W. Luteinizing hormone has a stage-limited effect on preantral follicle development in vitro. Biol Reprod. 63 (1), 320-327 (2000).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon