Method Article
تطبيق هيدروجيل هيالورونان جديد لزراعة البصيلات ثلاثية الأبعاد ومنهجية حفظ بصيلات المبيض بالتبريد في الفأر
In This Article
Summary
يصف هذا البروتوكول نموذجا جديدا ثلاثي الأبعاد (3-D) يستخدم هيدروجيل هيالورونان مرتبط بالتيرامين لتغليف وزراعة بصيلات ما قبل الأنترال من مبيض الفأر. نقوم أيضا بتفصيل طريقتين لحفظ بصيلات المبيض بالتبريد عن طريق التزجيج.
Abstract
يصعب الحفاظ على البنية ثلاثية الأبعاد لبصيلات المبيض والتفاعلات المعقدة بين مكونات الخلية الجسدية والبويضة الضرورية للنضج السيتوبلازمي والنووي في أنظمة الثقافة التقليدية ثنائية الأبعاد (2-D). نصف نموذجا جديدا للثقافة ثلاثية الأبعاد باستخدام هيدروجيل هيالورونان المرتبط بالتيرامين لتغليف وثقافة بصيلات مبيض الفأر. تسمح تقنية تغليف الهيالورونان بنمو 3-D للبصيلات والاحتفاظ بالعوامل الغذائية على مقربة من البصيلات النامية. هذا الهيدروجيل متعدد الاستخدامات ويمكن تطبيقه على البصيلات المعزولة وكذلك شظايا أنسجة المبيض. تتيح الخصائص اللزجة المرنة لهلام HA تعديل الصلابة وكذلك قابلية التشكيل بناء على تركيز الجل. بصيلات ما قبل الأنف النامية في نموذج الثقافة هذا قادرة على إكمال النضج الانتصافي في غضون 10-12 يوما من الثقافة والإباضة ببويضة الطور الثاني عند إطلاق HCG. توضح هذه الورقة أيضا بالتفصيل طريقتين لحفظ بصيلات المبيض بالتبريد عن طريق التزجيج.
Introduction
لا يزال تكوين الجريبات البشري في المختبر يمثل تحديا حتى بعد أربعة عقود من الولادة الأولى من الإخصاب في المختبر . حتى الآن ، لا تزال منهجية زراعة بصيلات المبيض البشرية التي تدعم إنتاج جنين قابل للحياة ينتج عنه طفل سليم تفتقرإلى 1. لا يزال يتعين تحديد الخصائص الفيزيائية المثلى اللازمة لنمو بصيلات الإنسان في المختبر . يملأ المبيض السليم بآلاف البصيلات في مراحل مختلفة من التطور ، وتنظيم نموها عملية معقدة (الشكل 1) 2. تستغرق بويضات مرحلة الحويصلة الجرثومية (GV) من بصيلات ما قبل الأنترال البشرية ما يصل إلى 30 يوما في الثقافة لتصبح ناضجة بشكل انتصافي وتصلإلى المرحلة 3 من الطور الثاني. يعد الاتصال ثنائي الاتجاه بين البويضة والخلايا الحبيبية المحيطة من خلال تقاطعات الفجوة أمرا بالغ الأهمية للنضج السيتوبلازمي والنووي4،5،6.
أنظمة الاستزراع التقليدية ثنائية الأبعاد ليست مثالية لزراعة البصيلات ، خاصة في نماذج الثدييات الكبيرة التي تتطلب وقتا طويلا في الثقافة. تلتصق البصيلات بالطبق ، ويصبح الارتباط بين الخلايا الحبيبية والبويضة أكثر ضعفا مع هجرة الخلايا الحبيبية بعيدا. لذلك ظهرت أنظمة الثقافة ثلاثية الأبعاد (3-D) للبصيلات كوسيلة لتقليد فسيولوجيا الجسم الحي عن كثب 7،8.
كان تغليف البصيلات داخل مصفوفة لتعزيز النمو ثلاثي الأبعاد أحد الأساليب للحفاظ على العمارة الجرابية أثناء الثقافة المختبرية (IVC). تم اختبار المصفوفات الحيوية من البوليمرات الطبيعية (مثل الكولاجين ، والأغاروز ، والفيبرين ، والألجينات ، وحمض الهيالورونيك) ، وكذلك البوليمرات الاصطناعية (مثل البولي إيثيلين جلايكول وكحول البولي فينيل وحمض البولي جليكوليك) ،7،9،10،11،12،13. ثبت أن الخصائص الميكانيكية للمصفوفة الحيوية تؤثر على انتشار المغذيات ، وتمايز الخلايا ، وتكوين وكذلك الإفراز الهرموني14. الكولاجين ، كجزء من المصفوفة الطبيعية خارج الخلية (ECM) ، هي واحدة من أقدم المصفوفات التي تم اختبارها وكانت واعدة في البداية15،16،17. ومع ذلك ، فإن الخدمات اللوجستية لتوحيد مستحضرات الكولاجين ، والخصائص الميكانيكية الضعيفة ، والاستقرار قد حدت من استخدامه18. تم اختبار Agarose على مجمعات البويضات الركامية (COCs) المنبعثة من البصيلات الباطنية وكذلك البصيلات البدائية19،20. في الآونة الأخيرة ، أظهر قالب الاغاروز المطبوع ثلاثي الأبعاد وعدا بثقافة بصيلات خالية من السقالات21. كان تغليف ألجينات الكالسيوم ، الذي تم الإبلاغ عنه لأول مرة في عام 2003 ، حتى الآن ، النظام الأكثر دراسة على نطاق واسع ل IVC22. تم اختباره على الفئران والأبقار وكذلك بصيلات الإنسان23،24،25،26،27. مع ألجينات الكالسيوم ، يتم تحميل البصيلات منفردة في قطرات صغيرة من البوليمر وتعريضها لكلوريد الكالسيوم لتوليد حبة جل. يتطلب استخراج البصيلات من الخرزة العلاج بعامل مخلب. ومع ذلك ، فإن هذه المصفوفة لها بعض العيوب. الجينات هو عديد السكاريد معزول عن الطحالب ، وعلى الرغم من أنه يوفر الدعم ، إلا أنه ليس جزءا من المصفوفة الطبيعية خارج الخلية للجريب تشير البيانات إلى ارتفاع معدل حدوث عيوب المغزل بعد IVC في الجينات28. ساعدت التعديلات اللاحقة للنظام من خلال الجمع بين الجينات والفيبرين أو مكونات المصفوفة الأخرى خارج الخلية (ECM) في جعل نظام ألجينات الكالسيوم أكثر فعالية29،30.
تشير الأدلة المتزايدة إلى المصفوفة خارج الخلية كمغير رئيسي في نمو الخلية10،31،32 . إنه لا يوفر الدعم فحسب ، بل يلعب دورا مهما في ارتباط الخلايا ووظيفتها ونموها وتواصلها. أحد المكونات الرئيسية ل ECM هو الهيالورونان ، وهو جليكوزامينوجليكان طبيعي. في جريب المبيض ، يتم إنتاج الهيالورونان بواسطة الخلايا الحبيبية ويساهم في السلامة الهيكلية ووظيفة المسام النامي33،34. وبالتالي ، فإن دمج الهيالورونان في نموذج زراعة البصيلات قد يساعد في خلق بيئة أكثر فسيولوجية وتعزيز إنتاج البويضات المؤهلة وظيفيا.
يصف هذا العمل التطبيق الجديد للهيالورونان المرتبط بالتيرامين كمصفوفة حيوية لزراعة بصيلات المبيض الطازجة والمجمدة ونضج البويضات في المختبر (IVM). نقوم أيضا بتفصيل تقنيات حفظ البصيلات بالتبريد عن طريق التزجيج على نوعين من الأجهزة. تتضمن إحدى الطرق الغمر المباشر في النيتروجين السائل بينما في الطريقة الثانية يتم وضع البصيلات في قش قبل الغمر. الهدف الأساسي هو إظهار أنه على الرغم من الاختلافات ، يمكن استخدام كل من المنهجيات والأجهزة بشكل موثوق لحفظ البصيلات بالتبريد.
Protocol
تم إجراء جميع التجارب على بموجب بروتوكولات استخدام ورعايتها المؤسسية في كليفلاند كلينك ووفقا للإرشادات واللوائح الخاصة بالمعاهد الوطنية للصحة لرعاية واستخدام المختبر.
1. إعداد متوسط
ملاحظة: سيتم استخدام الوسائط الموضحة أدناه للخطوات المختلفة في هذا الإجراء: التعامل مع أنسجة المبيض (OT) ، وهضم الكولاجيناز OT ، وزراعة البصيلات (FCM) والتزجيج. تحضير جميع الوسائط في غطاء مزرعة الأنسجة باستخدام تقنية معقمة.
- وسط مناولة أنسجة المبيض
- مكمل 20 مل من متوسط ليبوفيتز (L-15) مع 0.1٪ مصل بقري للجنين (FBS) في قارورة زراعة الأنسجة سعة 50 مل (T-50).
- قم بتغطيته بإحكام ووضع القارورة في الحاضنة طوال الليل لتسخينها إلى 37 درجة مئوية قبل الاستخدام. يستخدم هذا الوسيط للتعامل مع أنسجة المبيض والبصيلات خارج الحاضنة ولا يتطلب ثاني أكسيد الكربون2 للحفاظ على درجة الحموضة من 7.2 إلى 7.4
تنبيه: لا تعرض الأطباق لغاز ثاني أكسيد الكربون2 وإلا سيصبح الوسط حمضيا.
- وسط هضم الكولاجيناز
- في صباح يوم حصاد البصيلات ، أضف 1 مجم من الكولاجيناز من النوع الأول (295 وحدة / مجم) إلى أنبوب الاختبار مع 2.2 مل من وسط معالجة OT الدافئ مسبقا. التركيز النهائي المطلوب للكولاجيناز هو 134 وحدة / مل فلتر تعقيم باستخدام مرشح حقنة 0.22 ميكرومتر. غطاء بإحكام وضعه في كتلة الاحترار.
- وسط زراعة البصيلات والزيت
- تحضير 30 مل من الحد الأدنى من Essential Medium alpha المكمل بمصل بقري الجنين بنسبة 5٪ في قارورة T-50. مكمل غذائي يحتوي على 100 مللي وحدة دولية / مل FSH ، 10 ملي وحدة دولية / مل LH ، 10 ميكروغرام / مل أنسولين ، 5 ميكروغرام / مل ترانسفيرين و 5 نانوغرام / م من السيلينيوم.
- قم بتوازن FCM مسبقا عند 37 درجة مئوية مع 6٪ ثاني أكسيد الكربون2 والهواء طوال الليل في الحاضنة قبل الاستخدام.
- ضع 50 مل من الزيت المعدني في قارورة ، وغطاءها بشكل غير محكم وتوازن طوال الليل في الحاضنة.
- وسائط التزجيج لمجموعات FL و FL
- الوسط القاعدي لجميع المحاليل هو Global-Hepes المكمل ببديل بروتين اصطناعي بنسبة 20٪. تحضير 20 مل من محلول VS1 مع 7.5٪ إيثيلين جلايكول (EG) و 7.5٪ ثنائي ميثيل سلفوكسيد (DMSO) في الوسط القاعدي.
- تحضير 20 مل من VS2 مع 15٪ EG و 15٪ DMSO و 0.5 M سكروز في الوسط القاعدي. عقم جميع المحاليل بفلتر حقنة 0.22 ميكرومتر واحفظها على حرارة 4 درجات مئوية حتى الاستخدام. يمكن استخدام المحاليل لمدة تصل إلى 4 أسابيع.
- وسائط الاحترار للبصيلات المزججة و FL-Clusters
- الوسط القاعدي لجميع المحاليل هو Global-Hepes المكمل ببديل بروتين اصطناعي بنسبة 20٪. تحضير 20 مل من الوسط القاعدي مع 0.25 م من السكروز. قم بتسمية WS1.
- تحضير 20 مل من الوسط القاعدي مع 0.125 م من السكروز وقم بتسمية WS2. تعقيم الفلتر بفلتر حقنة 0.22 ميكرومتر. قم بتخزين المحاليل في درجة حرارة 4 درجات مئوية لمدة تصل إلى 4 أسابيع.
2. حصاد المبيض
- قتل الجراء B6D2F1 البالغة من العمر 10-14 يوما عن طريق خلع عنق الرحم (بدون تخدير). استخدم 3-4 صغار للحصول على 250-300 بصيلات ما قبل الجنبية سليمة للتجريب.
- ضع على ظهره وامسح بطنه بكحول الأيزوبروبيل بنسبة 70٪. قم بعمل قطع أفقي صغير عند خط الوسط باستخدام مقص نظيف. أمسك الجلد أعلى وأسفل القطع بالملقط الدقيق واسحبه في كلا الاتجاهين (باتجاه الرأس والقدمين) لكشف البطن.
- باستخدام مجموعة ثانية من المقص النظيف والملقط الناعم ، قم بقطع جدار البطن. ارفع الملفات المعوية بعيدا. حدد موقع قرون الرحم وقنوات البيض والمبايض. المبايض المكوس ووضعها في طبق بئر مركزي يحتوي على 1 مل من وسط معالجة OT دافئ إلى 37 درجة مئوية.
- باستخدام مجهر تشريح ، قم بقص أي دهون وأنسجة قناة بيض. تقسيم المبايض.
3. عزل الجريب و FL- العنقودية (FL-C)
- استخدم شفاط تدفق رقائقي بسطح ساخن 37 درجة مئوية لعزل البصيلات والتعامل معها. العمل بشكل معقم في غطاء المحرك. كن حذرا مع طبق FCM. استخدم الفقاعات للحفاظ على الطبق غازا بنسبة 5٪ ثاني أكسيد الكربون2 عند العمل في غطاء التدفق الرقائقي.
ملاحظة: يجب تسخين جميع المحاليل مسبقا إلى 37 درجة مئوية. يجب موازنة وسط FCM ، وكذلك الزيت المعدني ، طوال الليل في حاضنة عند 37 درجة مئوية مع 6٪ ثاني أكسيدالكربون 2 قبل الاستخدام. سوف يتحول الرقم الهيدروجيني المتوسط عندما يكون خارج الحاضنة لأكثر من 10 دقائق. - Pipet 6 مل من FCM متوازن مسبقا في طبقين بحجم 60 مم وتغطى بالزيت المعدني. ضعه مرة أخرى في الحاضنة.
- Pipet 1 مل من الكولاجيناز في طبق بئر مركزي و 3 مل من وسط OT في الجدار الخارجي. انقل المبايض إلى محلول الكولاجيناز باستخدام ماصة زجاجية دقيقة (1000 ميكرومتر). احتضان الطبق لمدة 30-40 دقيقة على السطح الساخن لغطاء التدفق الصفحي.
- في نهاية حضانة الكولاجيناز ، قم بتقطيع 6 مل من وسط OT إلى طبقين لزراعة الأنسجة مقاس 60 مم المسمى 1 و 2. ضعها على السطح الدافئ للغطاء.
- باستخدام ماصة دقيقة، انقل المبايض المعالجة بالكولاجيناز إلى البئر الخارجي لشطفها خالية من الكولاجيناز. قم بتغيير الماصات الدقيقة ثم انقل المبايض إلى طبق OT 1.
- احصد بصيلات من كل مبيض باستخدام ماصة P200. إطلاق البصيلات عن طريق الشفط المتكرر وطرد المبيض المعالج بالإنزيم من خلال طرف الماصة المقطوع بأحجام مختلفة. كما أن المضايقة الميكانيكية للأنسجة إلى شظايا بإبرتين 27G قبل سحب العينات مفيدة أيضا في إطلاق البصيلات الفردية. يجب أن ينتج كل جرو فأر 60-75 بصيلات سليمة بالحجم المطلوب.
- إذا لزم الأمر، أعد قطعا غير منفصلة من المبيض مرة أخرى إلى الكولاجيناز لمدة 5-10 دقائق أخرى، ثم اشطفها وكرر سحب العينة لإطلاق المزيد من البصيلات.
ملاحظة: سيؤدي التعرض المفرط للكولاجيناز إلى تعطيل طبقات الخلايا الحبيبية المحيطة بالبويضة. لا تحاول تفتيت المبيض بأكمله. توقف بمجرد جمع 250-300 بصيلة. - افحص البصيلات المنبعثة باستخدام مجهر تشريح بتكبير 40 ضعفا. تحديد بصيلات ما قبل التشريحية الثانوية (~ 120 -140 ميكرومتر قطرها) مع بويضة مركزية محاطة بغشاء القاعدي السليم (الصفيحة القاعدية). عادة ما تحتوي هذه الجريب بالحجم على 2-4 طبقات من الخلايا الحبيبية المحيطة بالبويضة (انظر الشكل 1).
ملاحظة: قارن البصيلات بفتحة طرف ماصة دقيقة 175 ميكرومتر لحجم البصيلات التقريبي. يجب أن يكون حجم المسام حوالي 3/4 من قطر الماصة. هذه هي أسرع طريقة لتحديد بصيلات بالحجم المطلوب. - باستخدام ماصة دقيقة 175 ميكرومتر، انقل البصيلات المحددة إلى طبق OT2. عند الانتهاء من التجميع ، اشطف جميع البصيلات في طبق FCM1 لإزالة أي آثار لوسط OT. ثم انقله إلى طبق FCM2.
- ضع الطبق في حاضنة لمدة 60 دقيقة قبل البدء في عملية التضمين.
- لعزل مجموعة البصيلات ، قم بتنفيذ الخطوات من 3.1 إلى 3.5. استخدم حقنتين من حقنة السل (27 جم) لفصل المبيض إلى شظايا ثم إلى مجموعات صغيرة من 6-10 بصيلات.
ملاحظة: زراعة مجموعات البصيلات (FL-C) هي بديل لزراعة البصيلات الفردية. تحتفظ هذه الطريقة بالعمارة المسامية الأصلية جنبا إلى جنب مع المكونات اللحمة. حجم المسام في FL-C ليس موحدا. تحتفظ البصيلات بتكوينها في الجسم الحي مع وجود بصيلات بدائية وأولية وثانوية. - اجمع مجموعات البصيلات هذه (FL-C) باستخدام ماصة دقيقة 200 ميكرومتر في طبق OT2. عند الانتهاء من التجميع ، اشطف كل FL-C وانقله إلى FCM2 في انتظار التضمين.
4. تضمين البصيلات ومجموعات البصيلات
- تحضير محلول مخزون 10 ملغم/مل من هيدروجيل الهيالورونان المرتبط بالتيرامين المنشط (HA). أعد ترطيب 250 مجم من مسحوق هيالورونات الصوديوم البديل بالتيرامين مع 25 مل من إنزيم بيروكسيداز الفجل (HRP ؛ 10 وحدة دولية / مل) في محلول ملحي مخزن بالفوسفات. بمجرد الذوبان ، قم بتخزين 500 ميكرولتر من مخزون HA المنشط هذا عند -4 درجة مئوية للتجارب المستقبلية.
- بالنسبة لتجارب البصيلات ، قم بإذابة محلول مخزون HA وتخفيفه إلى تركيز 3 مجم / مل في وسط عالمي دافئ إلى 37 درجة مئوية. قم بتنفيذ جميع خطوات التضمين في غطاء التدفق الصفحي مع سطح مقعد مسخن إلى 37 درجة مئوية. استخدم طبقا مقاس 60 مم مع ثمانية آبار سعة 100 ميكرولتر للتضمين وزراعة البصيلات اللاحقة.
- انقل البصيلات أو مجموعات FL ليتم دمجها من طبق FCM إلى قطرة من جل HA لشطفها خالية من وسط المزرعة. سوف يتداخل وسيط التتبع مع تكوين الجل. ضع طبق FCM مرة أخرى أسفل الفقاعات حتى يصبح الغاز.
ملاحظة: يمكن تضمين البصيلات المعزولة ، منفردة أو في مجموعات حسب التجربة. نفضل عموما بذر 2-4 بصيلات لكل حبة. - ضع 1 ميكرولتر من 0.03٪ بيروكسيد الهيدروجين (H2O2) على طبق بتري. أضف 25 ميكرولتر من هلام حمض الهيالورونيك 3 مجم / مل على قطرة بيروكسيد الهيدروجين واخلطها عن طريق سحب العينة لبدء التشابك (انظر الشكل 2).
- باستخدام ماصة P20، ارسم مزيجHA-H 2O2 وقم بسحب قطرة واحدة (~8-10 ميكرولتر) في بئرين منفصلين من طبق الاستزراع المكون من 8 آبار. تجنب صنع الفقاعات.
- باستخدام ماصة دقيقة 200 ميكرومتر ، انقل البصيلات بسرعة أو FL-C إلى وسط كل قطرة (الشكل 3). السرعة مهمة لأنه بمجرد تعرض HA للمحفز (البيروكسيد) ، سيبدأ في الهلام في غضون 1-2 دقيقة. احرص على عدم إدخال الفقاعات أثناء البذر.
ملاحظة: لتتبع نمو البصيلات الفردية ، ضع البصيلات على مسافة من بعضها البعض. لا تضع البصيلات بالقرب من قاع الجل وإلا فقد تنزل أثناء IVC بدرجة كافية للالتصاق. - اترك ~ 3 دقائق لإكمال عملية التبلور ثم أضف 100 ميكرولتر من FCM المتوازن مسبقا إلى كل بئر. كرر هذه العملية وقم بتحميل البصيلات في جميع الآبار الثمانية. يتراكب بالزيت المعدني الدافئ المتوازن مسبقا ويوضع الطبق في حاضنة.
5. تزجيج البصيلات ومجموعات FL
ملاحظة: يمكن إجراء التزجيج إما باستخدام حامل مفتوح (Cryoloop; CL) ، مما يسمح بالاتصال المباشر بالنيتروجين السائل ، أو ناقل مغلق (Rapid I ؛ RI) ، حيث يتم إغلاق العينة داخل قش خارجي ، وبالتالي ، لا تتلامس أبدا مع النيتروجين السائل. يوضح الشكل 4 الأجهزة والتباينات بين نظامي التزجيج. ثبت أن التزجيج على كلا الجهازين فعال في حفظ الأجنةبالتبريد 35.
- تزجيج RI للناقل المغلق
- قم بتسخين 2 مل من محاليل VS مسبقا إلى 37 درجة مئوية في كتلة ساخنة. قم بتنفيذ جميع خطوات التزجيج على السطح الساخن لغطاء التدفق الصفحي باستخدام مجهر تشريح لتصور المسام والحامل.
- املأ صندوق التبريد المعزول بالنيتروجين السائل (LN2). ضع المصاصة الخارجية للجهاز في فتحة تثبيت داخل الصندوق بحيث يتم غمرها جزئيا في النيتروجين السائل. ضع العصا البلاستيكية الداخلية بفتحة صغيرة عبر غطاء طبق بتري استعدادا للتحميل.
- ضع قطرتين من VS1 جنبا إلى جنب على طبق بتري بالقرب من الجزء العلوي. استخدم ماصة دقيقة 200 ميكرومتر لوضع بصيلات في القطرة الأولى. اشطفها وانتقل بسرعة إلى القطرة الثانية من VS1. احتضن لمدة 5 دقائق. في حالة تزجيج مجموعات FL، قم بمعالجة مجموعة واحدة في كل مرة.
- ضع ثلاث قطرات من VS2 جنبا إلى جنب على نفس الطبق عندما تكتمل الحضانة الأولى تقريبا. بعد ذلك ، حرك البصيلات بسرعة بالتتابع من خلال قطرات VS2 الثلاثة في غضون 60 ثانية وقم بتحميلها على الناقل. احرص على سحب كمية قليلة من السوائل باستخدام البصيلات لتجنب تتبع الوسط من قطرة إلى أخرى.
- لتحميل الناقل ، التقط بصيلين وقم بإيداع أقل قدر من السوائل في الفتحة الصغيرة في العصا البلاستيكية. حجم السائل النهائي في الحفرة ضئيل < 0.5 ميكرولتر تجنب الإفراط في الملء ، مما يؤدي إلى انسكاب السوائل من الحفرة إلى العصا البلاستيكية.
- أسقط العصا في القشة الخارجية المبردة مسبقا. استخدم مانع التسرب بالموجات فوق الصوتية لإغلاق القشة وإغلاقها. ضع القشة في كأس متصل بالكريوكان. يمكن وضع ما يصل إلى 4 قش في نفس الكأس.
- قم بتغطية العصا بغطاء واقي بلاستيكي. اغمر القصب في خزان تخزين النيتروجين السائل (LN2).
- تزجيج الحامل المفتوح CL
- محاليل VS قبل التسخين إلى 37 درجة مئوية. قم بتنفيذ جميع خطوات التزجيج على السطح الساخن لغطاء التدفق الرقائقي. قم بإعداد عدد الناقلات المفتوحة CL المطلوبة مسبقا. أدخل جذع CL المعدني في غطاء القارورة الممغنطة ، وتأكد من تثبيته بإحكام (استخدم لمسة صغيرة من المادة اللاصقة إذا لزم الأمر).
- املأ صندوق التبريد المعزول بالنيتروجين السائل (LN2). ضع رفا في صندوق التبريد لتثبيت المبردات بحيث يكون LN2 أسفل الجزء العلوي من القارورة.
- املأ القارورة الخاصة الممغنطة والمنفوذة ب LN2. ضعه على الرف. قم بتنفيذ خطوات التزجيج كما هو موضح في الخطوات 6.1.3 إلى 6.1.5. الفرق الوحيد هو أننا عادة نعالج خمس بصيلات في المرة الواحدة. مرة أخرى ، احرص على تقليل تتبع السوائل من قطرة إلى أخرى.
- لتحميل البصيلات ، أمسك الحامل المفتوح CL بواسطة الغطاء المغناطيسي المرفق باستخدام العصا المعدنية. اغمس الحامل المفتوح CL في قطرة منفصلة من VS2 لإنشاء طبقة من مادة التجميد.
- باستخدام ماصة دقيقة، التقط جميع البصيلات أو FL-Cluster وضعها على الفيلم بأقل قدر من السوائل. اعمل بسرعة ، حيث يجب تحميل البصيلات قبل أن يبدأ الفيلم في الجفاف.
- اغمر CL على الفور في التبريد المملوء ب LN2 لتزجيج العينة. غطي القارورة وضعيها على الكريوكان. غطيها بغطاء بلاستيكي. اغمر العصا في خزان تخزين النيتروجين السائل.
6. ارتفاع درجة حرارة البصيلات المزججة ومجموعات FL
- RI مغلق الناقل الاحترار
- قم بإعداد طبق بئر مركزي يحتوي على 3 مل من FCM المتوازن مسبقا في البئر الخارجي و 1 مل في البئر الأوسط. تراكب بالزيت ووضعه في الحاضنة.
- ضع 0.5 مل من WS1 و WS2 المسخنين مسبقا في مركزين مصنفين أطباق جيدا. انقل العصي مع عينات من خزان التخزين إلى صندوق تبريد مملوء ب LN2.
- قم بإزالة غطاء القصب البلاستيكي. قم بإزالة القشة من الكأس ، واحتفظ بها مغمورة ، ثم حركها في فتحة التثبيت في صندوق التبريد.
- باستخدام مقص ناعم ، قم بقص القشة الخارجية فوق النقطة السوداء مباشرة التي تشير إلى الجزء العلوي من حامل RI الداخلي بالبصيلات.
- باستخدام ملقط دقيق ، ارفع العصا البلاستيكية الداخلية قليلا من القشة الخارجية. أمسك الجهاز واغمر العصا بسرعة في WS1 ، مع التدوير برفق لتفريغ البصيلات. السرعة أمر بالغ الأهمية. يجب تفريغ البصيلات في WS1 في غضون 10 ثوان.
- استخدم مجهر تشريح لتصور البصيلات والتأكد من تفريغها جميعا من الناقل. بعد دقيقتين في WS1، استخدم ماصة دقيقة لنقل جميع البصيلات (أو FL-Cluster) إلى WS2، مع الحرص على عدم تتبع الوسط.
- بعد 3 دقائق ، اشطف البصيلات في البئر الخارجي لطبق FCM ثم انتقل إلى المركز جيدا. ضعه مرة أخرى في الحاضنة لمدة 1-2 ساعة قبل التضمين.
- CL الاحترار الناقل المفتوح
- قم بإعداد أطباق FCM و WS كما هو موضح أعلاه. انقل العصا مع بصيلات من خزان تخزين إلى صندوق التبريد المملوء ب LN2. انزع غطاء القصب البلاستيكي.
- استخدم العصا المغناطيسية لرفع الغطاء المبرد حتى يصبح الجذع المعدني ل CL مرئيا.
- باستخدام الملقط ، أمسك الجذع المعدني. قم بإزالة CL من القارورة واغمرها بسرعة كبيرة في WS 1 ، مع التحريك برفق لتفريغ البصيلات. تفريغ التحميل في WS1 في غضون 10 ثوان. باستخدام نطاق تشريح ، تحقق من تفريغ جميع البصيلات
- جميع الخطوات المتبقية للاحترار هي نفسها كما هو الحال مع خطوات الموجة الحاملة المغلقة RI بدءا من الخطوة 7.1.6.
7. تصوير البصيلات و FL-cluster وتغيير الوسائط
- راقب البصيلات والمجموعات FL في الآبار خلال فترة الاستزراع من 10 إلى 12 يوما باستخدام مجهر ضوئي مقلوب مع بصريات تعديل التباين هوفمان ومجهزة بكاميرا عالية الدقة. استخدم برنامج التصوير لالتقاط الصور بمعدل 40 ضعفا وتكبير إجمالي 100x أو 200x ، اعتمادا على الحجم.
- تصوير وتقييم البصيلات
- في اليوم الثقافي 1 ، بعد التضمين ، قم بتصوير جميع آبار الثقافة بتكبير 40x و 200x باستخدام مجهر مقلوب لتحديد مورفولوجيا وحجم خط الأساس. أعد الطبق إلى الحاضنة.
- عرض الصور وتسجيل عدد البصيلات المدمجة بالكامل في كل حبة جل. بالنسبة ل FL-C ، قم بتقدير عدد البصيلات في بداية الثقافة.
- باستخدام برنامج التصوير ، قم بقياس قطر الجريب على طول المستويين الرأسي والأفقي من حافة الغشاء القاعدي. قم بقياس حجم البويضة بالمثل من الحافة الخارجية للمنطقة. سجل متوسط القيم. خذ مقياسا رأسيا وأفقيا لقطر العنقود.
- استمر في تصوير الثقافات كل 2-3 أيام. قم بقياس أقطار البصيلات غير الملامسة لبعضها البعض. مع FL-C ، يتم رفع المجموعات أثناء IVC ، لذلك يمكن قياس المجموعة بأكملها في المستوى الرأسي والأفقي.
ملاحظة: بالنسبة للبصيلات المجمعة معا بشكل وثيق ، قد لا يمكن تمييز حدود البصيلات الفردية بعد اليوم الرابع من الثقافة ، لذلك لا يتم أخذ القياسات. - صنف البصيلات التي تصبح داكنة أو موت الخلايا المبرمج وكذلك تلك التي لم تعد فيها البويضة محاطة بخلايا حبيبية أو تم بثقها على أنها غير قابلة للحياة. تتبع أي بصيلات أو FL-C متصلة بسطح الطبق (انظر الشكل 5).
- راقب بعناية بصيلات تكوين الجناء من اليوم 8 فصاعدا. ستبدو البصيلات التي تحتوي على الأنتروم وكأنها تحتوي على مساحة خالية أو أخف بداخلها (الشكل 6).
- قم بإجراء نصف تغيير في وسط الثقافة كل يومين. استخدم ماصة P200 ، مضبوطة على 50 ميكرولتر. أدخل طرفها في بئر أسفل تراكب الزيت وبعيدا عن حبة الجل. اسحب ببطء 50 ميكرولتر من وسط الاستزراع. استبدل الوسط عن طريق سحب 50 ميكرولتر من FCM الطازج ببطء تحت تراكب الزيت. تجنب صنع الفقاعات.
8. نضوج البويضات في البصيلات المغلفة
ملاحظة: تبدأ خطوة النضج النهائية عادة عندما يصل تكوين الأنتروم بين إجمالي البصيلات المصنفة (والقابلة للحياة) إلى أكثر من 40٪. ومع ذلك ، في حالة انخفاض تكوين أو عدم رؤيته ، نوصي بتشغيله بحلول اليوم 12 من الثقافة. لم نلاحظ أي فائدة من الانتظار بعد الآن. بالنسبة لثقافات FL-C ، يتم تشغيل النضج عادة عند ملاحظة الأنتروم في 40٪ من الآبار أو على أبعد تقدير بحلول اليوم 12.
- تحضير وسط النضج في المختبر (IVM) عن طريق استكمال FCM ب 1.5 وحدة دولية / مل من موجهة الغدد التناسلية المشيمية البشرية (hCG) و 5 نانوغرام / مل من عامل نمو البشرة (EGF).
- قم بتشغيل النضج عن طريق استبدال FCM في كل بئر ب 100 ميكرولتر من وسط IVM في حوالي الساعة 5 مساء. بعد النضج بين عشية وضحاها (16-18 ساعة بعد الزناد) ، استخدم مجهر تشريح بتكبير 40 ضعفا لفحص كل مزرعة جيدا بحثا عن مجمعات البويضات الركامية (COCs) التي تبيضت من حبة هلام HA. عادة ما يتم العثور على COCs تستريح فوق حبة الجل مباشرة أو على مقربة من ذلك.
- اجمع COCs المبويضة في طبق بئر مركزي مع 1 مل من FCM المتوازن مسبقا مغطى بالزيت وضع الطبق مرة أخرى في الحاضنة.
- اجمع البويضات من البصيلات التي لا تزال مدمجة عن طريق سحب حبة HA-HAAD برفق باستخدام ماصة P200 لإطلاق COCs غير المبوضة. اجمعها في طبق منفصل مع FCM.
- قم بإعداد طبق بئر مركزي يحتوي على 1 مل من الهيالورونيداز (10 وحدة دولية / مل) و 3 مل من وسط FCM في الجدار الخارجي.
- انقل COCs المبويضة إلى محلول الهيالورونيداز وعرضها لفترة وجيزة للإنزيم (30-45 ثانية) لنزع البويضات من الخلايا الحبيبية من أجل تصور الحالة النووية للبويضة. اشطف البويضات لإزالة الإنزيم قبل وضعها في قطرات 5 ميكرولتر من الوسط الطازج تحت الزيت لإجراء تقييم مفصل. ضع الطبق في الحاضنة. كرر هذه العملية مع COCs غير المباضة.
- سجل العدد الإجمالي للبويضات المبيضة وغير المبوضة التي تم استردادها. تصوير وتقييم الحالة النووية (GV أو الطور الأول أو الطور الثاني) لكل بويضة مستعادة. قياس وتسجيل القطر.
- احسب معدل بقاء IVC بناء على إجمالي البصيلات القابلة للحياة (تلك التي تصل إلى يوم زناد هرس السواحل الهايتية) وإجمالي البويضات المستعادة. احسب النسبة المئوية لبويضات الطور الثاني من COCs المبيضة. كرر هذا مع أي بويضات يتم استردادها من COCs غير المبوضة.
- تحديد معدل النضج للطور الثاني بنفس الطريقة ل FL-C.
النتائج
توضح هذه الورقة بالتفصيل منهجية استخدام هلام الهيالورونان الجديد المرتبط بالتيرامين للزراعة المختبرية لبصيلات الفئران قبل الأنفسية36،37. يوضح الشكل 6 الاختلافات بين نمو البصيلات قبل الأنفسية عند وضعها في نظام ثقافة ثنائي الأبعاد التقليدي مقابل بصيلات واحدة مغلفة في هلام HA للثقافة ثلاثية الأبعاد. يتم الحفاظ على بنية البصيلات الأصلية خلال 12 يوما من الثقافة مع ظهور أنتروم بوضوح في اليوم الأخير من النمو.
جل HA متعدد الاستخدامات للغاية ، مما يسمح بنمو البصيلات المعزولة منفردة أو في مجموعات ، كما يتم تقسيم أنسجة المبيض ميكانيكيا إلى مجموعات صغيرة من البصيلات. الجل شفاف مما يجعل من الممكن تصور البصيلات حتى لو كانت على أعماق مختلفة. تظهر البصيلات المغلفة و FL-C تمددا شعاعيا من استمرار تكاثر الخلايا الحبيبية (الشكل 7). يبلغ متوسط أقطار البصيلات الأولية 139.8 ± 28 ميكرومتر مع قطر البويضة الإجمالية 63.5 ± 4.6 ميكرومتر. في البصيلات المستزرعة منفردة ، تبلغ الأقطار النهائية حوالي 385.6 ± 36.7 ميكرومتر ، بزيادة في الحجم بمقدار 3 أضعاف تقريبا. يبلغ قياس البويضات المبيضية الطور الثاني حوالي 84.8 ± 3.8 ميكرومتر. داخل مجموعات FL المستنبتة ، يكون حجم المسام متنوعا إلى حد ما (الشكل 5 ، الشكل 7). تم العثور على البويضات المبيضية بعد محفز قوات حرس السواحل الهايتية بالقرب من المسام (الشكل 8). سيتم استرداد غالبية بويضات الطور الثاني من COCs المبيضة. عادة ما تحتوي البصيلات التي لا تزال مدمجة بعد الزناد على بويضات GV و metaphase I.
يقارن الجدول 1 معدلات النضج بين البصيلات المعزولة ومجموعات FL من المبايض الطازجة أو المجمدة. FL-C من المبايض المحفوظة بالتبريد لديها معدلات نضج أقل بكثير. أظهرت الملاحظات المجهرية أنهم كثيرا ما تعرضوا لكسر الصفيحة القاعدية ، مما يجعلهم عرضة تماما لبثق البويضات المبكر. تمت مواجهة الطبيعة الهشة لمجموعات البصيلات إلى حد ما عن طريق التغليف. تم تجنب معالجة الكولاجيناز للمبايض المحفوظة بالتبريد لأنها كانت ضارة بشكل خاص مع انخفاض البقاء على قيد الحياة وانخفاض إنتاجية البصيلات السليمة.
يعد حفظ البصيلات المعزولة بالتبريد أكثر فعالية من الحفاظ على المبيض بالكامل. يمكن تحقيق معدلات نضج عالية من خلال فحص كلتا طريقتي التزجيج (الجدول 2). على الرغم من الاختلافات الكبيرة في معدلات التبريد ، لم يختلف نضج البويضات بعد IVC. يسمح الموجة الحاملة المفتوحة CL بمزيد من الكفاءة حيث يمكن تحميل ما يصل إلى عشر بصيلات على حامل CL مفتوح واحد. يؤدي هذا أيضا إلى تقصير الوقت الإجمالي لاستعادة العديد من البصيلات المحفوظة بالتبريد. ومع ذلك ، بالنسبة لأي تطبيق سريري نهائي للتزجيج للبصيلات البشرية ، قد يكون النظام المغلق المغلق هو الأفضل.
يمكن استخدام ترتيب الكروماتين حول نواة البويضة GV لتحديد البويضات التي من المرجح أن تخصب بعد الإباضة وتتطور إلى الكيسات الأريمية38. يوضح الشكل 9 تلطيخا حيا للبويضات لتصور نمط توزيع الكروماتين.
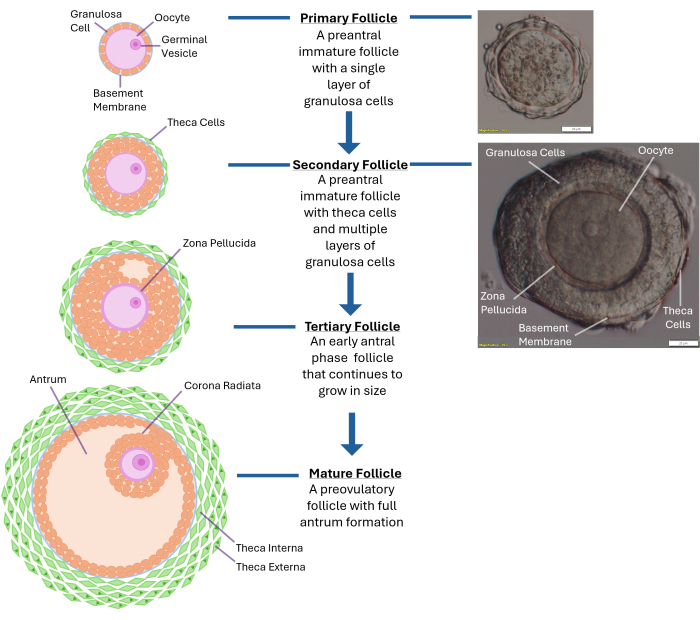
الشكل 1: تخطيطي لنمو البصيلات. يوضح هذا الرسم البياني المراحل المختلفة لتطور البصيلات من المسام الأولي إلى المرحلة قبل الإشعاعية الثانوية وأخيرا إلى جريب ثلاثي ناضج تماما جاهز للإباضة. تظهر أيضا صورة مجهرية لبصيلات ما قبل الأنترالية النموذجية بخصائصها المورفولوجية المختلفة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
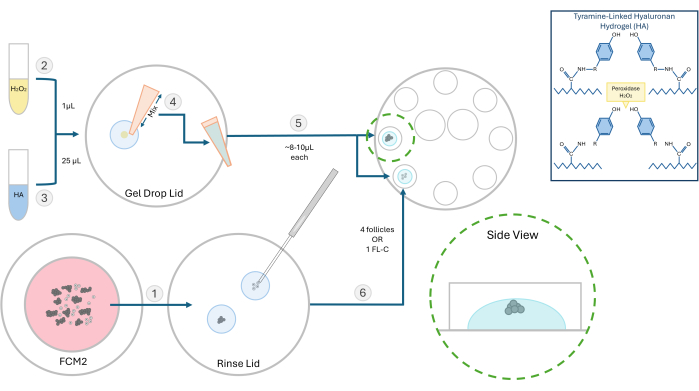
الشكل 2: تخطيطي لطريقة تغليف HA. يتم توضيح بنية هلام الهيالورونان والخطوات المختلفة لتضمين البصيلات في هذا الرسم التخطيطي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
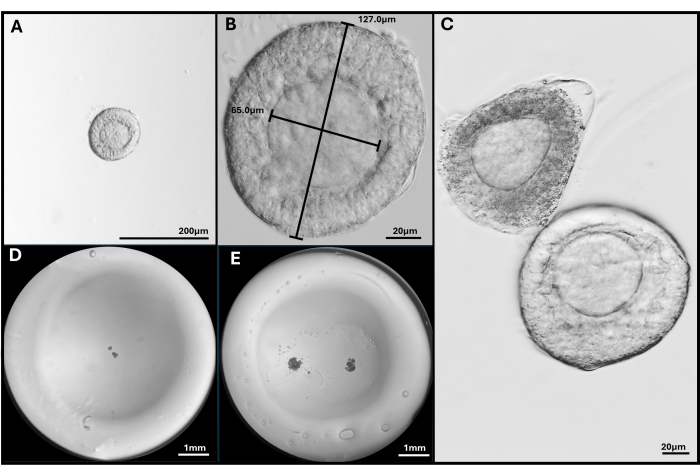
الشكل 3: عزل البصيلات وتغليفها. (أ ، ب) تم اختيار جريب ما قبل البصيلات للتضمين عند التكبير 40x و 200x. (ج) يظهر جريب موت الخلايا المبرمج مع بصيلات ما قبل الأنترال السليمة مع البويضة ليست مركزية تماما. (د) صورة حبة جل HA المصنفة بالبصيلات و (E) مع اثنين من FL-C. الصور التي تم التقاطها باستخدام مجهر مجسمة لإظهار حبة الجل بأكملها. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: أجهزة التزجيج لحفظ البصيلات المعزولة بالتبريد. باستخدام جهاز الناقل المفتوح CL ، يتم إجراء خطوة التزجيج عن طريق الغمر المباشر للبصيلات في النيتروجين السائل. وبالتالي ، فإن معدل التبريد مرتفع للغاية ، أكثر من -20،000 درجة مئوية / دقيقة. في المقابل ، مع الناقل المغلق RI ، يتم تحميل البصيلات على العصا البلاستيكية الداخلية وإسقاطها في قش خارجي مغمور في النيتروجين السائل. تتجنب طريقة التزجيج المغلقة هذه الاتصال المباشر بالنيتروجين السائل. ومع ذلك ، فإن معدل التبريد أقل بكثير عند -1220 درجة مئوية / دقيقة. من السهل تحميل واستعادة البصيلات من أي من الناقلين. استوعبت الموجة الحاملة المفتوحة CL تحميل ما يصل إلى عشرة بصيلات لكل جهاز مقارنة باثنين فقط مع الموجة الحاملة المغلقة RI. تم تعديل هذا الرقم من35. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
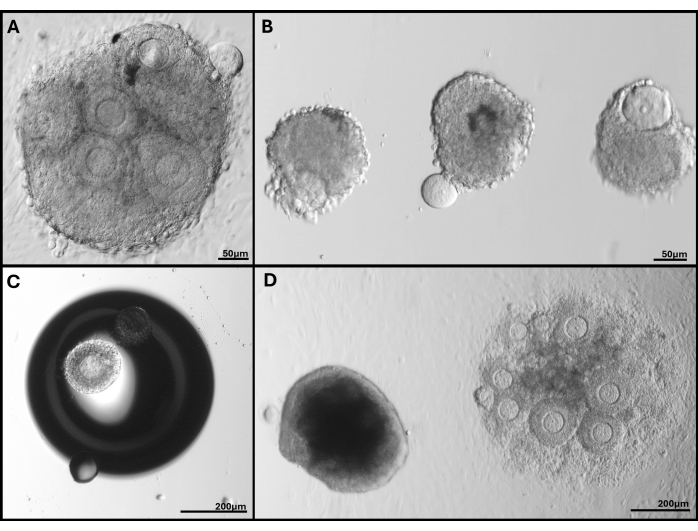
الشكل 5: صور تمثيلية للمشاكل التي تمت مواجهتها. (أ) مجموعة البصيلات مع بثق البويضة. (ب) بصيلات معزولة ذات غشاء صفيحة قاعدية مكسورة وواحدة بها بويضة مقذوفة. (ج) جريب مغروس تحت فقاعة في الجل. (د) مجموعة البصيلات التي بقيت في هلام (يسار) مقارنة بالكتلة المضمنة بعمق شديد والتي تم ربطها في النهاية بالطبق. مجموعة واسعة من أحجام البصيلات في FL-C مرئية بوضوح. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
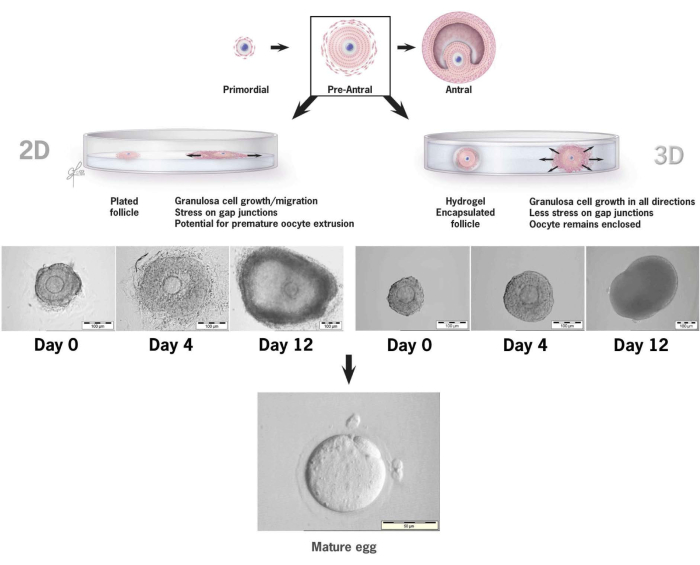
الشكل 6: مقارنة نمو البصيلات في الأعراف 2-D مقابل ثقافة 3-D في HA. مع نمو 2-D ، لوحظ تسطيح المسام وتعلق الخلايا الحبيبية بطبق زراعة الأنسجة بحلول اليوم 4 ، مما يترك البويضة عرضة لهجرة الخلايا الحبيبية ، وتعطيل تقاطعات الفجوة ، وبثق البويضات المبكر. ظلت المسام المغلفة ب HA غير متصلة طوال فترة الاستزراع. حدث توسع الخلايا الحبيبية في جميع الاتجاهات ، مما أدى إلى تغليف البويضة والحفاظ على بنية ثلاثية الأبعاد. تم تعديل هذا الرقم من36. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: صور تمثيلية للبصيلات المغلفة في هلام الهيالورونان المرتبط بالتيرامين. (أ) جريب ما قبل الجنبية التي تم جمعها بعد هضم الكولاجيناز للمبيض الطازج في اليوم الأول. (ب) قطرة جل بذرة بأربعة بصيلات قبل الجنبية تم تصويرها في اليوم 1 و (ج) اليوم 4 من الثقافة (د) مجموعة البصيلات من المبيض الطازج في اليوم 2 (ه) في اليوم 6 و (F) في اليوم 9 من الاستزراع. (ز) عنقود البصيلات التي تم تشريحها ميكانيكيا من المبيض الكامل المزجج الموضح في اليوم 2 و (H) في اليوم 6 من الثقافة. (I) يمكن رؤية المسام مع تكوين المجريات بوضوح في اليوم 9 من الثقافة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
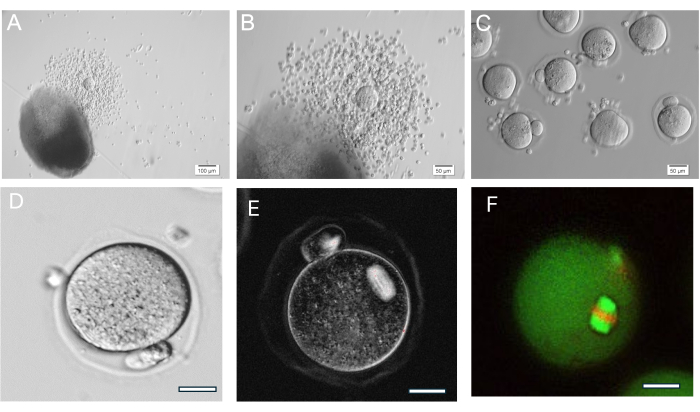
الشكل 8: إباضة البويضة. (أ ، ب) مركب البويضات الركامية المبيضية (COC) الموضح بعد حبة HA-gel. (ج) تم تصوير البويضات بعد المعالجة الأنزيمية لمركبات الكربون الكراسية بالهيالورونيداز لإزالة الخلايا الركامية المحيطة. العديد من البويضات الطورية الثانية. (د) بويضة الطور الثاني ذات الجسم القطبي البارز. التكبير 400x. (E) التصوير المباشر لبويضة الطور الثاني باستخدام الضوء المستقطب ونظام التصوير لتصور المغزل الانتصافي وتقييم التنظيم ، كما هو موضح في37. التكبير 400x. المغزل ثنائي الانكسار العادي مرئي. (و) الطور الثاني ، البويضة الثابتة والملطخة بمضاد ألفا / بيتا توبولين ويوديد البروبيديوم لتصور تنظيم المغزل الانتصافي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
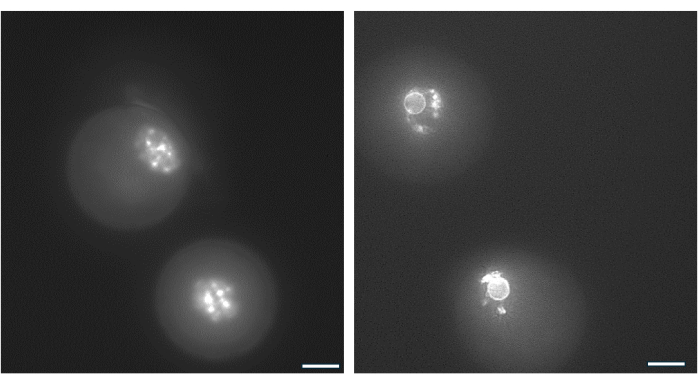
الشكل 9: إعادة تنظيم الكروماتين في بويضات GV. تم فحص ترتيب الكروماتين في بويضات GV بعد تكوين الأنتروم عن طريق تلطيخ الحمض النووي باستخدام Hoechst 33342 (50 نانوغرام / مل). تم حصاد البصيلات التمثيلية من حبات HA عن طريق ماصة لطيفة. تمت إزالة الخلايا الحبيبية باستخدام الهيالورونيداز. ثم تم تلطيخ البويضات الإجمالية لمدة 15 دقيقة (انظر بروتوكول مونتي وآخرون 38). تم التقاط الصور بتكبير 40x. (أ) البويضة الإجمالية المعروضة في اليوم 1 عند بدء الثقافة وتظهر نمط تلطيخ الكروماتين غير المحاط (NSN). (ب) البويضة GV من نمو الجريب مع المجريات الموضحة في يوم زناد قوات حرس السواحل الهايتية. تكثف الكروماتين وشكل حلقة حول النواة حول النواة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| البارامتر | المبيض الطازج | المبيض المجمد | |
| FL-معزولة | FL-الكتلة | FL-الكتلة | |
| البصيلات التي لوحظت أثناء IVC | 130 | 154 | 69 |
| الإباضة بعد قوات حرس السواحل الهايتية (٪) | 71% | 66% | 93% |
| (92/130) | (101/154) | (64/69) | |
| GVBD (٪) | 30% | 28% | 52% |
| (28/92) | (28/101) | (33/64) | |
| تكوين بويضات MII (٪) | 59% | 55% | *34% |
| (54//92) | (56/101) | (22/64) | |
الجدول 1: الحصائل مع بصيلات HA المدمجة من المبايض الطازجة والمزججة. نضجت البصيلات و FL-C من المبايض الطازجة في المختبر بعد التغليف في هلام HA. تم اختبار هلام HA أيضا على بصيلات المبايض المزججة باستخدام بروتوكول EG / DMSO39. مع المبايض الطازجة ، تم جمع كل من البصيلات الفردية (FL) ومجموعات البصيلات (FL-C) بعد هضم الكولاجيناز. بالنسبة للمبايض المزججة ، كان التعرض للكولاجيناز ، في الواقع ، ضارا بالبصيلات. كان أفضل نهج مع المبايض المحفوظة بالتبريد هو عزل مجموعات FL بدلا من البصيلات الفردية واستخدام التشريح الميكانيكي بالإبر فقط. يقارن الجدول النتائج بين حبات HA المصنفة بالبصيلات في مجموعات من 4-6 مقابل الخرز مع FL-C واحد يحتوي على 6-10 بصيلات. * كان معدل النضج مع FL-C من المبايض المحفوظة بالتبريد أقل بكثير (p = 0.008 ؛ p = 0.008 ؛ p = 0.008 ؛ تحليل مربع كاي لاختبار الأهمية).
| حمال | ري | سي إل |
| (مغلق) | (مفتوح) | |
| البقاء على قيد الحياة (٪) | 100% (24/24) | 100% (41/41) |
| تكوين أنتروم * (٪) | 25.0% (6/24) | 75.6% (31/41)* |
| معدل الإباضة (٪) | 66.7% (16/24) | 87.8% (36/41) |
| معدل النضج (٪ MIIs) | 81.3% (13/16) | 69.4% (25/36) |
الجدول 2: النتائج بعد حفظ البصيلات المعزولة بالتبريد على جهازين مختلفين للتزجيج. تم تحقيق معدلات نضج عالية مع كل من جهاز CL المفتوح وكذلك حامل RI المغلق ، مع معدل تبريد أقل. كان تكوين أنتروم هو مقياس النتيجة الوحيد الذي لوحظ أنه مهم ولكنه لم يؤثر على معدل النضج الكلي (ص < 0.05; تحليل مربع كاي لاختبار الأهمية).
Discussion
توفر القدرة على التحكم في الخواص الميكانيكية وقابلية التحلل البيولوجي لهيدروجيل HA المرتبط بالتيرامين العديد من المزايا لتطبيقات هندسة الأنسجة. مختبرنا هو أول من يطبق جل HA المحدد هذا لنمو بصيلات المبيض. هلام هيالورونات الصوديوم البديل بالتيرامين الحاصل على براءة اختراع (TS-NAHY) هو نظام هيدروجيل جديد قائم على الهيالورنان تم تطويره في كليفلاند كلينك. يتم الربط المتشابك للهلام عن طريق تعرض البيروكسيديز في مزيج الهلام المنشط لعامل مؤكسد. يمكن القيام بذلك في المختبر أو في الجسم الحي. تعرض الهلاميات المائية TS-NAHY المشكلة مجموعة واسعة من الخصائص من الجل الضعيف ، والمعجون إلى المادة الصلبة الهشة ، اعتمادا على تركيز الجل40.
يسلط التقدم المخيب للآمال في زراعة بصيلات المبيض الضوء على الحاجة إلى تصميم نماذج ثقافة جديدة. قد يكون إنشاء نظام استزراع يعتمد حصريا على مكونات المصفوفة الأصلية خارج الخلية نهجا أكثر فائدة. نموذج ثقافة HA الموصوف سهل الاستخدام بطريقة فسيولوجية دون الحاجة إلى مكونات ECM إضافية. الجل شفاف ، مما يسمح بالتصور التفصيلي للبصيلات. تسهل الخصائص اللزجة المرنة لجل HA تعديل الصلابة وكذلك قابلية التشكيل. تزيد هذه الميزة من تعدد استخدامات هذه المصفوفة الحيوية. يمكن أن تؤثر صلابة المصفوفة الحيوية على تكاثر الخلايا الحبيبية وتكوين30،41،42. تم الإبلاغ عن أن البصيلات المشتقة من بيئات الاستزراع المسموح بها لتكوين لها ملامح تعبير جينية مختلفة عن تلك الموجودة في نظام الثقافة غير الداعم43. يبدو أن بصيلات الرئيسيات تتطلب مصفوفة أكثر صلابة44. من المحتمل أن يكون تصميم المصفوفة الحيوية لتلبية متطلبات الأنواع الحيوانية المختلفة ، بما في ذلك البشر ، مهما للنضج الناجح في المختبر .
لنمو بصيلات الفئران قبل الجنبية ، اختبرنا تركيزات الجل التي تتراوح من 2-5 مجم / مل36. تراوحت معدلات نضج البويضات من 44٪ إلى 58٪. سمحت التركيزات العالية من هلام HA بمزيد من قابلية التشكيل والاحتفاظ بهيكل ثلاثي الأبعاد ، لكن تمدد البصيلات تأثر. سمحت تركيزات HA المنخفضة بمزيد من التمدد الشعاعي للجريب ولكنها زادت من خطر بثق الجريب تلقائيا قبل نهاية IVC. كان تركيز 3-3.5 مجم / مل من HA يعمل بشكل أفضل مع بصيلات الفئران قبل الجنائية. كان الحفاظ على قطرة الجل صغيرة أمرا ضروريا لتشكيل حبات هلام HA بعمق كاف للحفاظ على البصيلات في تكوين ثلاثي الأبعاد في جميع أنحاء IVC. يتم تسطيح القطرات الكبيرة ، مما يؤدي إلى نزول البصيلات من خلال الجل والالتصاق بسطح اللوحة. أحد قيود استخدام هذه المادة الحيوية للتضمين هو وقت التبلور السريع للغاية. يجعل بذر أكثر من حبتين من جل HA في وقت واحد أمرا صعبا. تعد زيادة كفاءة بذر البصيلات في هلام HA أحد المجالات التي نحاول تحسينها.
تتمتع ثقافة مجموعات البصيلات في بيئة ثلاثية الأبعاد باستخدام HA بإمكانيات كبيرة. يتم الاحتفاظ ببنية المبيض الطبيعية ، مع وجود بصيلات مختلفة الأحجام على اتصال مع بعضها البعض والسدى الداعم. قد يساعد LH في نمو بصيلات ما قبل الأنف الأصغر في FL-C عن طريق إحداث تغييرات في الخلايا المتمايزة المبكرة ، لذلك تم تضمينه في وسط FCM45. إن الاستمرار في ثقافة FL-C خلال ال 12 يوما الماضية لمعرفة ما إذا كان يمكن بدء موجة جديدة من النمو في أي من البصيلات الصغيرة التي لا تزال جزءا لا يتجزأ بعد محفز قوات حرس السواحل الهايتية يحتاج إلى مزيد من الدراسة. قد يكون التحسين الإضافي لبيئة الثقافة شرطا أساسيا لزراعة بصيلات ذات نطاقات مختلفة من الأحجام في جزء من الأنسجة. تتمثل إحدى مزايا نموذج ثقافة HA ثلاثي الأبعاد مع FL-C في أنه يسمح بمحاكاة الترتيب والتفاعلات المسامية في الجسم الحي . سمة أخرى مهمة هي أنه على عكس ألجينات الكالسيوم وأنظمة البوليمر الأخرى ، يمكن تحفيز الإباضة والنضج دون إزالة البصيلات جسديا من الأنسجة أو مصفوفة الجل.
الوقت اللازم لزراعة البصيلات في المختبر والحصول على البويضات الناضجة للتجميد طويل ، خاصة في الثدييات الكبيرة. توفر القدرة على حفظ البصيلات المحصودة أو مجموعات البصيلات بالتبريد طريقة لتأخير هذه الخطوة حتى وقت لاحق وربما أكثر ملاءمة. إذا كان من الممكن تطبيق هذه التكنولوجيا يوما ما على بصيلات الإنسان أثناء حصاد المبيض ، فقد تكون مفيدة. يعد حفظ المبيض الكامل بالتبريد للحفاظ على الخصوبة ، في الوقت الحالي ، الخيار الوحيد للمرضى. ولكن ما إذا كانت ، في الواقع ، أفضل طريقة لا يزال يتعين تحديدها. في هذه الورقة ، نقدم منهجية التزجيج للحفظ بالتبريد للجريب قبل الاحترار والتي تعطي معدلات بقاء ممتازة بعد الاحترار ومعدلات نضوج بعد ثقافة ثلاثية الأبعاد.
في الختام ، وصفنا نموذجا جديدا للثقافة ثلاثية الأبعاد باستخدام الهيالورونان ، وهو أحد مكونات ECM الأصلي. تسمح تقنية تغليف HA بالاحتفاظ بالعوامل الغذائية على مقربة من البصيلات النامية. منهجية التغليف في المصفوفة الحيوية بسيطة ويمكن أن تستوعب البصيلات المعزولة وكذلك مجموعات البصيلات. قد يفتح هذا الأخير طرقا جديدة للبحث ويوفر نظرة ثاقبة لعلم الأحياء الأساسي لتكوين الجريبات وتنظيمه. ثبت أن البويضات من بصيلات مغلفة ب HA مؤهلةوظيفيا 37. يمكن تخصيب هذه البويضات ، وتشكيل الأكياس الأريمية في المختبر ، وزرعها عند نقلها إلى الفئران الحوامل الزائفة. تتحقق هذه البيانات من صحة استخدام الهيالورونان المرتبط بالتيرامين كمصفوفة حيوية لزراعة البصيلات ثلاثية الأبعاد ونضج البويضات في المختبر. يمكن تطبيق هذا البروتوكول على زراعة بصيلات المبيض في نماذج حيوانية أخرى ، بما في ذلك البشر. قد تكون التطبيقات الأخرى المحتملة لنظام هلام HA ثلاثي الأبعاد هي الجسم الجنيني والثقافة العضوية.
Disclosures
لا يوجد تضارب في المصالح أو الإفصاحات.
Acknowledgements
نريد أن نتوجه بخالص الشكر إلى فريق طب الأجنة بأكمله في كليفلاند كلينك لمساعدتهم بالإضافة إلى قسم REI وخاصة الدكتور فالكون على الدعم. تم تمويل هذا المشروع من خلال صندوق أبحاث في كليفلاند كلينك.
Materials
| Name | Company | Catalog Number | Comments |
| Anti-alpha tubulin-FITC labelled | Sigma-Aldrich | F2168 | |
| Anti-beta tubulin-FITC labelled | Sigma-Aldrich | F2043 | |
| BZ-X700 | Keyence | ||
| Center well dish | Fisher Scientific | 08-772-12 | |
| Collagenase Type I | Worthington Biochemical Corporation | LS004196 | |
| Crycap vial-vented | Hampton Research | HR4-904 | |
| Cryoloop | Hampton Research | HR4-974 | |
| Crystal cap | Hampton Research | HR4-733 | |
| Culture dish 60mm | Fisher Scientific | 08-772B | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Epidermal growth factor (EGF) | R &D Systems | 236-EG | |
| Ethylene Glycol (EG) | Sigma-Aldrich | 293237 | |
| Fetal Bovine Serum-Heat Inactivated | ThermoFisher Scientific | 10082-147 | |
| Follicle Stimulating Hormone (FSH) | Sigma-Aldrich | F4021 | |
| Global-Hepes medium | CooperSurgical | LGGH-100 | |
| Hoechst 33342 | Sigma-Aldrich | B2261 | |
| Human chorionic gonadotrophin (hCG) | Sigma-Aldrich | CG10 | |
| Human serum albumin | CooperSurgical | GHSA-125 | |
| Hyaluronidase | CooperSurgical | ART-4007-A | |
| Hydrogen Peroxide | CVS Pharmacy Inc. | 372441 | |
| Insulin-transferrin-selenium (ITS) | ThermoFisher Scientific | 41400-045 | |
| Leibovitz medium (L-15) | ThermoFisher Scientific | 11415-064 | |
| Luteinizing hormone | Sigma-Aldrich | L9773 | |
| Magnetic wand | Hampton Research | HR4-729 | |
| Micropipettes (1000 µm) | Minitube | 19025/0050 | |
| Micropipettes (175 , 200, and 275µm) | CooperSurgical | MXL3-175, MXL3-200, MXL3-275 | |
| Millex GV filter 0.22 µm | Millipore | SLGU033RS | |
| Mineral oil | CooperSurgical | LGOL-500 | |
| Minimum Essential Medium alpha (MEM) | ThermoFisher Scientific | 32561-037 | |
| Oocyte Imaging System-Spindleview | Hamilton Thorne | ||
| Phosphate buffered saline (PBS) | ThermoFisher Scientific | 10010-023 | |
| Propidium iodide | Sigma-Aldrich | P4170 | |
| Rapid i | VitroLife | 14406 | |
| SmartBox | VitroLife | 14423 | |
| Synthetic Protein Substitute (SPS) | CooperSurgical | ART-3011 | |
| Tyramine -linked Hyaluronan Biohydrogel Kit | LifeCore | ENG-00151 | |
| Ultrasonic sealer | VitroLife | 14415 | |
| Universal GPS Culture dish 8x 100 µl wells | CooperSurgical | UGPS-010 |
References
- Telfer, E. E., Andersen, C. Y. In vitro growth and maturation of primordial follicles and immature oocytes. Fertil Steril. 115 (5), 1116-1125 (2021).
- Telfer, E. E., McLaughlin, M. Natural history of the mammalian oocyte. Reprod Biomed Online. 15 (3), 288-295 (2007).
- Xiao, S., et al. In vitro follicle growth supports human oocyte meiotic maturation. Sci Rep. 5, 17323 (2015).
- Carabatsos, M. J., Sellitto, C., Goodenough, D. A., Albertini, D. F. Oocyte-granulosa cell heterologous gap junctions are required for the coordination of nuclear and cytoplasmic meiotic competence. Dev Biol. 226 (2), 167-179 (2000).
- Diaz, F. J., Wigglesworth, K., Eppig, J. J. Oocytes are required for the preantral granulosa cell to cumulus cell transition in mice. Dev Biol. 305 (1), 300-311 (2007).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biol Reprod. 73 (2), 351-357 (2005).
- Dadashzadeh, A., Moghassemi, S., Shavandi, A., Amorim, C. A. A review on biomaterials for ovarian tissue engineering. Acta Biomater. 135, 48-63 (2021).
- Simon, L. E., Kumar, T. R., Duncan, F. E. In vitro ovarian follicle growth: a comprehensive analysis of key protocol variablesdagger. Biol Reprod. 103 (3), 455-470 (2020).
- Belli, M., et al. Towards a 3D culture of mouse ovarian follicles. Int J Dev Biol. 56 (10-12), 931-937 (2012).
- Berkholtz, C. B., Shea, L. D., Woodruff, T. K. Extracellular matrix functions in follicle maturation. Semin Reprod Med. 24 (4), 262-269 (2006).
- Desai, N., et al. Three-dimensional in vitro follicle growth: overview of culture models, biomaterials, design parameters and future directions. Reprod Biol Endocrinol. 8, 119 (2010).
- Shea, L. D., Woodruff, T. K., Shikanov, A. Bioengineering the ovarian follicle microenvironment. Annu Rev Biomed Eng. 16, 29-52 (2014).
- Paulini, F., et al. Survival and growth of human preantral follicles after cryopreservation of ovarian tissue, follicle isolation and short-term xenografting. Reprod Biomed Online. 33 (3), 425-432 (2016).
- West, E. R., Xu, M., Woodruff, T. K., Shea, L. D. Physical properties of alginate hydrogels and their effects on in vitro follicle development. Biomaterials. 28 (30), 4439-4448 (2007).
- Joo, S., et al. The effect of collagen hydrogel on 3D culture of ovarian follicles. Biomed Mater. 11 (6), 065009 (2016).
- Telfer, E., Torrance, C., Gosden, R. G. Morphological study of cultured preantral ovarian follicles of mice after transplantation under the kidney capsule. J Reprod Fertil. 89 (2), 565-571 (1990).
- Torrance, C., Telfer, E., Gosden, R. G. Quantitative study of the development of isolated mouse pre-antral follicles in collagen gel culture. J Reprod Fertil. 87 (1), 367-374 (1989).
- Dong, C., Yonggang, L. V. Application of collagen scaffold in tissue engineering: recent advances and new perspectives. Polymers. 8 (2), 42 (2016).
- Le, B. A. M., et al. Agarose-based 3D culture improved the developmental competence of oocyte-granulosa complex isolated from porcine preantral follicle. Theriogenology. 223, 11-21 (2024).
- Park, J. E., et al. In vitro maturation on an agarose matrix improves the developmental competence of porcine oocytes. Theriogenology. 157, 7-17 (2020).
- Zaniker, E. J., et al. Three-dimensionally printed agarose Micromold supports scaffold-free mouse ex vivo follicle growth, ovulation, and luteinization. Bioengineering. 11 (7), 719 (2024).
- Pangas, S. A., Saudye, H., Shea, L. D., Woodruff, T. K. Novel approach for the three-dimensional culture of granulosa cell-oocyte complexes. Tissue Eng. 9 (5), 1013-1021 (2003).
- West, E. R., Shea, L. D., Woodruff, T. K. Engineering the follicle microenvironment. Semin Reprod Med. 25 (4), 287-299 (2007).
- Xu, J., et al. Survival, growth, and maturation of secondary follicles from prepubertal, young, and older adult rhesus monkeys during encapsulated three-dimensional culture: effects of gonadotropins and insulin. Reproduction. 140 (5), 685-697 (2010).
- Xu, M., Kreeger, P. K., Shea, L. D., Woodruff, T. K. Tissue-engineered follicles produce live, fertile offspring. Tissue Eng. 12 (10), 2739-2746 (2006).
- Amorim, C. A., Van Langendonckt, A., David, A., Dolmans, M. M., Donnez, J. Survival of human pre-antral follicles after cryopreservation of ovarian tissue, follicular isolation and in vitro culture in a calcium alginate matrix. Hum Reprod. 24 (1), 92-99 (2009).
- Converse, A., Zaniker, E. J., Amargant, F., Duncan, F. E. Recapitulating folliculogenesis and oogenesis outside the body: encapsulated in vitro follicle growth dagger. Biol Reprod. 108 (1), 5-22 (2023).
- Mainigi, M. A., Ord, T., Schultz, R. M. Meiotic and developmental competence in mice are compromised following follicle development in vitro using an alginate-based culture system. Biol Reprod. 85 (2), 269-276 (2011).
- Kreeger, P. K., Deck, J. W., Woodruff, T. K., Shea, L. D. The in vitro regulation of ovarian follicle development using alginate-extracellular matrix gels. Biomaterials. 27 (5), 714-723 (2006).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. Interpenetrating fibrin-alginate matrices for in vitro ovarian follicle development. Biomaterials. 30 (29), 5476-5485 (2009).
- Griffith, L. G., Swartz, M. A. Capturing complex 3D tissue physiology in vitro. Nat Rev Mol Cell Biol. 7 (3), 211-224 (2006).
- Irving-Rodgers, H. F., Rodgers, R. J. Extracellular matrix of the developing ovarian follicle. Semin Reprod Med. 24 (4), 195-203 (2006).
- Salustri, A., Camaioni, A., Di Giacomo, M., Fulop, C., Hascall, V. Hyaluronan and proteoglycans in ovarian follicles. Hum Reprod Update. 5, 293 (1999).
- Rashki Ghaleno, L., Cristian, P. P., Shahverdi, A., Dardmeh, F., Alipour, H., Valojerd, M. R. Exploring the role of hyaluronic acid in reproductive biology and beyond: Applications in assisted reproduction and tissue engineering. Adv. Biology. 8 (6), e202300621 (2024).
- Desai, N. N., Goldberg, J. M., Austin, C., Falcone, T. The new Rapid-i carrier is an effective system for human embryo vitrification at both the blastocyst and cleavage stage. Reprod Biol Endocrinol. 11, 41 (2013).
- Desai, N., Abdelhafez, F., Calabro, A., Falcone, T. Three dimensional culture of fresh and vitrified mouse pre-antral follicles in a hyaluronan-based hydrogel: a preliminary investigation of a novel biomaterial for in vitro follicle maturation. Reprod Biol Endocrinol. 10 (1), 29 (2012).
- Desai, N., Spangler, M., Nanavaty, V., Gishto, A., Brown, A. New hyaluronan-based biomatrix for 3-D follicle culture yields functionally competent oocytes. Reprod Biol Endocrinol. 20 (1), 148 (2022).
- Monti, M., Redi, C. A. Isolation and characterization of mouse antral oocytes based on nucleolar chromatin organization. J Vis Exp. (107), e53616 (2016).
- Huang, L., et al. Cryopreservation of human ovarian tissue by solid-surface vitrification. Eur J Obstet Gynecol Reprod Biol. 139 (2), 193-198 (2008).
- Chan, J., Darr, A., Alam, D., Calabro, A. Investigation of a novel cross-linked hyaluronan hydrogel for use as a soft-tissue filler. Am J Cosmetic Sur. 22, 105-108 (2005).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. A method for ovarian follicle encapsulation and culture in a proteolytically degradable 3-dimensional system. J Vis Exp. (49), e2695 (2011).
- Xu, M., West, E., Shea, L. D., Woodruff, T. K. Identification of a stage-specific permissive in vitro culture environment for follicle growth and oocyte development. Biol Reprod. 75 (6), 916-923 (2006).
- West-Farrell, E. R., et al. The mouse follicle microenvironment regulates antrum formation and steroid production: alterations in gene expression profiles. Biol Reprod. 80 (3), 432-439 (2009).
- Xu, M., et al. Encapsulated three-dimensional culture supports development of nonhuman primate secondary follicles. Biol Reprod. 81 (3), 587-594 (2009).
- Wu, J., Nayudu, P. L., Kiesel, P. S., Michelmann, H. W. Luteinizing hormone has a stage-limited effect on preantral follicle development in vitro. Biol Reprod. 63 (1), 320-327 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved