Method Article
Akut Miyeloid Lösemi Hasta Kaynaklı Ksenotransplantların Hücre İçi Fosfoflow Sitometrisi
Bu Makalede
Özet
Burada, farelere ksenogreftlenmiş ve kemik iliği aspiratlarından elde edilen akut insan miyeloid lösemi hücrelerinde mTORC1, JAK/STAT5 ve MAPK yollarının aşağı akışındaki sinyalleri analiz etmek için fosfoflow sitometri tabanlı bir yöntem açıklanmaktadır. p-STAT5, p-4EBP1, p-RPS6 ve p-ERK1/2 seviyeleri, yüksek duyarlılığa sahip yeni nesil spektral akış sitometresi kullanılarak eş zamanlı olarak ölçülür.
Özet
Onaylanmış tedavilere uyum sağlamak ve direnmek için akut miyeloid lösemi (AML) hücreleri, gen ekspresyonu, protein seviyeleri ve aktivitede değişikliklere yol açan spesifik moleküler yolları aktive eder. Bu protokolde, AML'de onkojenik sinyallemenin aşağı akışında fosforile edilen hedefleri araştırmak için bir yaklaşım bildirilmiştir: p-STAT5 (Tyr694), p-4EBP1 (Thr37/46), p-RPS6 (Ser240/244) ve p-ERK1/2 (Thr202/Tyr204). Bu yöntem, bu yolakların - saplılık bakımı, bağışıklık kaçışı, protein sentezi ve oksidatif ve metabolik strese adaptasyonun ana düzenleyicileri - tedavi aşamasından önce ve sonra aspirasyon yoluyla canlı farelerden toplanan kemik iliği hücrelerinde bir veya daha fazla test edilen bileşik tarafından nasıl modüle edildiğinin değerlendirilmesini sağlar. Bu minimal invaziv yöntem, hücre bütünlüğünü korur ve kemik kırma tekniklerine kıyasla stresi azaltır, bu da hasara neden olabilir ve deneysel sonuçları potansiyel olarak etkileyebilir. Akış sitometrik analizi için hücre içi antikor boyamayı optimize etmek için, paraformaldehit fiksasyonu ve metanol geçirgenliği kullanılarak bir protokol geliştirilmiştir. Bu yaklaşım, yüksek boyama hassasiyeti sağlar ve arka plan gürültüsünü en aza indirerek hücre içi sinyal belirteçlerinin güvenilir bir şekilde algılanmasını sağlar. Bu protokolün ana avantajlarından biri, aynı numune içindeki dört yolun aynı anda değerlendirilmesine izin veren multiparametrik bir antikor panelinin geliştirilmesidir. Yüksek hassasiyete sahip yeni nesil bir spektral akış sitometresi kullanılarak, aynı farelerde tedavi öncesi başlangıç seviyelerine kıyasla tedavi koşullarına bağlı olarak yol aktivasyonunda dinamik kaymalar gözlendi. Bu metodoloji, hayvanlarda ötenazi gerektirmeden hastadan türetilmiş ksenogreft kemik iliği örneklerinde sinyal yolu modülasyonunun hassas in vivo analizini sağlar, AML hücrelerinin adaptif mekanizmaları hakkında değerli bilgiler sağlar ve direncin üstesinden gelmek için bu yolları hedeflemeyi amaçlayan terapötik stratejilerin değerlendirilmesine rehberlik edebilir.
Giriş
Akut miyeloid lösemi (AML), kemik iliği ve periferik kanda immatür miyeloid progenitör hücrelerin birikimi ile karakterize agresif bir hematolojik malignitedir. Bu, normal hematopoezi bozarak hayatı tehdit eden sitopeni ve sistemik komplikasyonlara yol açar. Kemoterapötik rejimler, hedefe yönelik tedaviler ve hematopoietik kök hücre naklindeki gelişmeler bazı hastalar için sonuçları iyileştirmiş olsa da, genel olarak, 5 yıllık sağkalım oranları %30 civarındadır ve yaşlı hastalarda veya olumsuz genetik profillere sahip hastalarda daha kötü prognozvardır 1. AML'nin yönetiminde önemli bir zorluk, nüks ve tedavi başarısızlığına katkıda bulunan ilaç direncinin sıklıkla ortaya çıkmasıdır2. Bu, AML'nin ilerlemesini ve terapötik direncini yönlendiren moleküler ve hücresel mekanizmalar hakkında daha derin bir anlayış kazanmanın önemini vurgulamaktadır.
Bu zorluğun üstesinden gelmek için, AML hasta kaynaklı ksenogreft (PDX) modellerinde hücre içi sinyal yolaklarını araştırmak için güçlü bir araç sunan, multipleks hücre içi fosfoflow sitometri ile birlikte kemik iliği aspirasyonları için yeni bir yöntem sunulmuştur (Şekil 1A,B). PDX modellerinde kemik iliği aspirasyonu daha önce tanımlanmış olmasına rağmen3, bu protokol fosfoakış analizi için lösemik hücreleri korumak üzere optimize edilmiştir. Bu yöntemin genel amacı, lösemi ilerlemesi ve tek hücre çözünürlüğü ile terapötik yanıt sırasında uzunlamasına uygulanabilen minimal invaziv bir prosedür sağlamaktır. Bu teknik, aynı hayvandan tekrar tekrar numune alınmasına izin vererek, tedavi altındaki hastalık evriminin daha doğru bir temsilini sunar. Bu tekniğin geliştirilmesinin ardındaki mantık, AML hücrelerinde hücre içi sinyalleşmenin yüksek çözünürlüklü, dinamik bir değerlendirmesine duyulan ihtiyaçta yatmaktadır. Western blotlama gibi geleneksel yöntemler, büyük hücre sayıları gerektirir, tek hücre çözünürlüğünden yoksundur ve çoğullama4. Buna karşılık, fosfoflow sitometri hücresel heterojenliği korur ve farklı lösemik alt popülasyonlarda5 çoklu fosforile sinyal proteinlerinin saptanmasını sağlar ve AML tedavilerine yanıt olarak yol aktivasyonu hakkında önemli bilgiler sunar.
AML'nin biyolojisinin merkezinde, Mitojenle Aktive Edilmiş Protein Kinaz (MAPK), Rapamisin Kompleksi 1'in Mekanistik Hedefi (mTORC1) ve Janus Kinaz / Sinyal Dönüştürücü ve Transkripsiyon 5'in Aktivatörü (JAK / STAT5) dahil olmak üzere hücresel proliferasyon, sağkalım ve metabolik adaptasyonu düzenleyen sinyal yolları bulunur. Lösemik hücre proliferasyonu ve sağkalımındaki rollerinin ötesinde, bu yollar aynı zamanda saplılık bakımı, bağışıklıktan kaçınma ve oksidatif ve metabolik strese adaptasyon gibi önemli onkojenik süreçlerde de kritik bir rol oynar4. Hücre büyümesini ve sağkalımını teşvik etmenin yanı sıra, bu yollar arasındaki çapraz konuşma, transkripsiyon, translasyon ve hücresel metabolizma gibi kritik süreçleri düzenleyerek AML hücrelerinin büyümelerini sürdürmelerini ve terapötik müdahaleler karşısında bile apoptotik sinyallere direnmelerini sağlar 6,7 (Şekil 1A).
p-ERK1/2 (Hücre dışı sinyal regüle kinaz 1/2) gibi anahtar efektörleri içeren MAPK yolu, hücre proliferasyonunu ve sağkalımını düzenlemek için büyüme faktörleri ve sitokinler gibi hücre dışı sinyallerin entegrasyonunda çok önemli bir rol oynar. ERK1/2 aktivasyonu, RAS (Sıçan Sarkomu)-RAF (Hızla Hızlandırılmış Fibrosarkom)-MEK (MAPK/ERK Kinaz)-ERK kaskad yoluyla gerçekleşir, burada RAS-GTP RAF'ı işe alır ve MEK1/2'nin sıralı fosforilasyonuna yol açar ve ardından Thr202/Tyr204'te ERK1/2. Fosforile edildikten sonra, ERK1/2 dimerize olur ve çekirdeğe yer değiştirir, burada MYC (Myelocytomatosis viral onkogen homologu), ELK1 (ETS Like-1 Protein) ve AP-1 (Aktivatör Protein-1) gibi transkripsiyon faktörlerini fosforile ederek hücre proliferasyonunu, farklılaşma bloğunu ve hayatta kalmayı teşvik eder8. AML'de, FLT3 (fms benzeri tirozin kinaz 3), RAS veya KIT'teki mutasyonlar sıklıkla yapısal ERK aktivasyonu 9,10 ile sonuçlanır (Şekil 1A).
FLT3, RAS veya KIT'teki mutasyonlar ayrıca metabolik yeniden kablolama, protein sentezinin modülasyonu, ribozom biyogenezi ve otofaji gibi onkojenik süreçleri destekleyerek AML büyümesini ve terapötik direnci sağlayan mTORC1 sinyalinin yukarı regülasyonuna neden olur11. mRNA translasyonunun düzenlenmesi yoluyla mTORC1, AML'nin ilerlemesi için onkojenik proteinlerin ve diğer temel faktörlerin üretimini kolaylaştırır. mTORC1 substratlarının önemli bir grubu, 4E-BP'leri (Ökaryotik başlatma faktörü 4E bağlayıcı proteinler) içerir. Hipofosforile hallerinde, 4E-BP'ler eIF4E'ye (Ökaryotik başlatma faktörü 4E) bağlanır ve kapağa bağlı translasyonu inhibe eder. 4E-BP1'in mTORC1 tarafından Thr37/46'da fosforilasyonu, eIF4E'nin salınmasına neden olarak MYC, CCND1 (Siklin D1) ve MCL-1 (Miyeloid hücreli lösemi 1) gibi anahtar onkojenik mRNA'lar için translasyonun başlatılmasını sağlar, böylece lösemik proliferasyonu ve sağkalımı teşvik eder 8,12. Ek olarak, mTORC1'in aşağı akışında S6K1 (Ribozomal protein S6 kinaz beta-1) aracılık ettiği Ser240/244'te RPS1 fosforilasyonu, ribozom biyogenezini ve mRNA translasyonunu artırarak metabolik adaptasyon, stres direnci ve hızlı proliferasyon için gerekli proteinlerin sentezini arttırır 8,13. Özellikle, mTORC1 aktivitesi, terapötik stres 13,14,15 altında AML hücreleri tarafından kullanılan kritik bir sağkalım stratejisi olan metabolik adaptasyon ile sıkı bir şekilde bağlantılıdır (Şekil 1A).
JAK/STAT5 yolu, özellikle sitokin reseptörlerini veya JAK2, FLT3 ve CALR (kalretikülin) gibi sinyal aracılarını etkileyen mutasyonların olduğu durumlarda, AML'deki bir diğer önemli sinyal eksenidir16,17. STAT5, FLT3 ve JAK2 gibi reseptörler aracılığıyla sitokin sinyaline yanıt olarak aktive edilir. Ligand bağlanması üzerine, ilişkili Janus kinazlar (JAK'lar) Tyr694'te STAT5'i fosforile eder. Fosforile STAT5, hücre sağkalımı, çoğalması ve farklılaşmasında rol oynayan genlerin transkripsiyonunu düzenlemek için spesifik DNA dizilerine bağlandığı çekirdeğe dimerleşir ve yer değiştirir8. AML'de, genellikle FLT3 veya JAK2'deki mutasyonlara bağlı olarak STAT5'in yapısal aktivasyonu, lösemogenez18'i destekleyen genlerin kalıcı ekspresyonuna yol açar (Şekil 1A).
Bireysel katkılarının ötesinde, bu yollar hem transkripsiyonu hem de translasyonu düzenlemek için birleşir ve AML hücrelerinin proteomunu hayatta kalmayı ve direnci teşvik edecek şekilde şekillendirir. Özellikle, mRNA translasyonu, AML hücrelerinin çevresel zorluklara uyum sağlamasını ve hedefe yönelik tedavilerin etkilerinden kaçmasını sağlayan onkojenik proteinlerin ve stres yanıt faktörlerinin hızlı üretimine izin verdiği için AML patofizyolojisinde önemli bir faktör olarak ortaya çıkmaktadır. Ökaryotik başlatma faktörleri (eIF'ler) veya ribozomal proteinler gibi translasyon mekanizmasının düzensizliği, AML19'da terapötik direnç ve kötü prognozda rol oynamaktadır. AML ilerlemesi ve direncinin altında yatan moleküler mekanizmaların kapsamlı bir şekilde anlaşılması için MAPK, mTORC1 ve JAK/STAT5 yolaklarının transkripsiyonel ve translasyonel düzenlemedeki rollerinin ayrıntılı bir şekilde araştırılması esastır. Bu tür içgörüler, tedavi yanıtının yeni biyobelirteçlerini belirlemek ve direncin üstesinden gelmek için bu yolları hedefleyen yeni terapötik stratejiler tasarlamak için kritik öneme sahiptir. Bu makale, AML hastadan türetilmiş ksenogreft (PDX) modellerinde bu sinyal ağlarını araştırmak için özel olarak tasarlanmış bir protokol sağlar.
Bu protokolün en önemli avantajlarından biri, kemik iliği aspirasyonunun hücre içi fosfoflow sitometri ile entegrasyonudur ve AML hasta kaynaklı ksenogreft (PDX) modellerinde sinyal yolu aktivasyonunun dinamik ve minimal invaziv bir değerlendirmesine izin verir. Bu, hedefe yönelik tedavilere yanıt olarak MAPK, mTORC1 ve JAK/STAT5 gibi anahtar yolların aktivasyon durumunu izlemek için özellikle değerlidir. Bu tekniklerin kombinasyonu, AML biyolojisinin kapsamlı ve yüksek çözünürlüklü bir anlayışının kazanılmasını sağlar ve sonuçta daha etkili terapötik stratejilerin geliştirilmesine yardımcı olur.
Protokol
Aşağıdaki deneyler, McGill Üniversitesi Hayvan Bakım Komitesi (CIHR PJT-186019) ve Yahudi Genel Hastanesi Kurumsal İnceleme Kurulu'nun (11-047) onayı ile gerçekleştirildi. Bu protokolde, yaşları 8 haftadan 6 aya kadar olan ve 20-30 g ağırlığındaki erkek NOD-scid IL2Rg^null-3/GM/SF (NSGS) farelerine daha önce insan hasta kaynaklı AML hücreleri nakledildi. Bu çalışmada kullanılan reaktiflerin ve ekipmanların detayları Malzeme Tablosunda listelenmiştir.
1. Kemik iliği aspirasyonu
DİKKAT: İğne kullanımını çevreleyen güvenlik önlemlerine uyulmalıdır.
- Perioperatif analjezi: Kemik iliği aspirasyonundan 1-4 saat önce, farelere deri altına (s.c.) 0.1 mg / kg buprenorfin yavaş salınımı enjekte edin. Bu, işlem sonrası 72 saate kadar analjezi sağlar.
- Laminer akış başlığının altındaki cerrahi alanı bir kirurjik ped, saç düzeltici, ısıtma lambası ve kemik iliği aspirasyonu için gerekli tüm malzemelerle hazırlayın (25 G şırıngalar, buz üzerinde 0,5 mL PBS içeren 1,5 mL mikrosantrifüj tüpleri,% 70 izopropanol sürüntüleri). Yapışkan bant kullanarak burun konisini izofluran inhalasyonu için sabitleyin (Şekil 2A).
- Her aspirat için iki adet 25 G şırınga hazırlayın, biri kemik ponksiyonu için ("kuru iğne") ve diğeri göbeği aspirasyon için PBS ile yıkanmış ("kızarmış iğne").
- Üreticinin talimatlarına ve veterinerlik yönergelerine göre, sertifikalı bir buharlaştırıcı tarafından sağlanan izofluran inhalasyonunu kullanarak fareyi uyuşturun. Yerel prosedürler değişiklik gösterebilir. Referans olarak, bu protokol McGill Üniversitesi'nin fare anestezisi için standart işletim prosedürlerini takip etti20.
- Ayak sıkışması ve kas gevşemesine yanıt vermeyerek anestezi derinliğini onaylayın. Hayvan anestezi altındayken kuruluğu önlemek için gözlere veteriner merhemi sürün. Anestezi sırasında solunum hızını sürekli olarak izleyin.
- Saç düzeltici kullanarak aspirasyonun yapılacağı tüm bacağı tıraş edin. Aspirasyon bölgesini (femur) izopropil alkole doyurulmuş antiseptik bir ped ile dezenfekte edin (Şekil 2B).
- Delinme bölgesinin bulunduğu uyluk kemiğinin eklem yüzeyini, dizini bükerek ve baskın olmayan eli kullanarak bacağı hareketsiz hale getirerek ortaya çıkarın. Başparmağınızı tibiaya, işaret parmağını uyluk kemiğine ve orta parmağınızı iki kemiğin dış tarafındaki her şeyi sabitleyerek yerleştirin (Şekil 2C).
NOT: Aspirasyon sırasında bacağın başarısızlığa veya yaralanmaya yol açabilecek herhangi bir hareketini önlemek için baskın olmayan elinizi kullanarak bacağın çok sabit bir şekilde konumlandırıldığından emin olun. Bacağın hareketsizliği stabil değilse, elinizi yeniden konumlandırın ve herhangi bir delinmeden önce tekrar deneyin. - Baskın olmayan el ile hareketsiz hale getirirken, kemik yapısının görselleştirilmesini iyileştirmek için kalan kılları uzaklaştırmak için diz bölgesini izopropil alkol ile tekrar dezenfekte edin (Şekil 2C).
- Femoral eklem yüzeyinde bir delik oluşturmak için ilk kuru 25 G şırıngayı femur ekleminin ortasına yerleştirerek ve zorlamadan döndürerek kullanın (Şekil 2D,E). İliğe doğru bir şekilde girmek için şırınganın iğnesinin uyluk kemiğinin uzunlamasına ekseni ile tamamen hizalandığından (0° sapma) emin olun.
NOT: Çevredeki dokulara gereksiz zarar vermeden düzgün giriş sağlamak için bu hizalamayı koruyun. İğne femur kemiğinin ortasına girdiğinde, dirençte hafif bir azalma ilik boşluğuna başarılı bir şekilde penetrasyonu gösterir (Şekil 2F). Doğru hizalama kaybına, kırılmaya veya travmaya neden olabileceğinden bu adımda iğneye aşırı kuvvet uygulamaktan kaçının. Döner bir delme hareketi kullanarak, iğnenin en az dirençli yolu takip etmesi ve femur boşluğuna doğru bir şekilde girmesi olasılığı daha yüksektir. Femurun içine düzgün bir şekilde yerleştirilmiş bir iğne, onu tutan el çıkarıldığında bile dikey kalmalıdır. - İliğe girdikten sonra, şırıngayı döndürerek yavaş yavaş çıkarın (Şekil 2G) ve ikinci yıkanmış şırıngayı ilk iğnenin açtığı deliğe yerleştirin (Şekil 2H,I).
NOT: İkinci bir şırınga kullanılır, çünkü ilki delme sırasında genellikle kemik tarafından bloke edilir. - Şırıngayı hafifçe döndürürken ve yavaş yavaş çekerken uyluk kemiği içine yerleştirilen şırıngaya vakum uygulayın. Şırınganın göbeğinde yaklaşık 10-20 μL kemik iliği görünmelidir (Şekil 2J).
NOT: Gerekirse, ilik ekstraksiyonunu optimize etmek için iğneyi kemik içinde nazikçe yeniden ilerletin. - Şırınganın içeriğini 500 μL PBS içeren soğutulmuş mikrosantrifüj tüpüne akıtarak kemik iliğini aktarın (Şekil 2K). Buz üzerinde tutun ve mümkün olan en kısa sürede 2-3. adımlara geçin.
- Herhangi bir kanamayı durdurmak için bir izopropanol çubukla delinme bölgesine 30 saniye boyunca hafif bir baskı uygulayın (Şekil 2L).
- Fareyi, bir ısıtma lambası kullanılarak ısıtılan temiz bir kurtarma kafesine yerleştirin. Hayvan uyanana ve tamamen iyileşene kadar solunum ve hareketliliği izleyin, ardından farelerin geri kalanıyla birlikte ortak kafeslere yerleştirin. Kanama belirtisi olup olmadığını kontrol edin.
2. Canlı / ölü ve yüzey işaretleyici boyama
NOT: Tüm prosedür boyunca hücreleri buz üzerinde tutun. Adım 2 ve adım 3'ten önce antikor boyama solüsyonlarının ana karışımlarını (adım 2.4 ve adım 2.7 için) hazırlayın ve bunları 4 ° C'de ışıktan koruyun. Taze bir %1.6 formaldehit çözeltisi (adım 3.1) ve -20 °C'de tutarak %100 metanol çözeltisi (adım 3.6) hazırlayın.
- Hücre sayacı21 ile akridin portakal / propidyum iyodür (AO / PI) kullanarak canlı hücreleri sayın.
- 1 milyon hücre için uygun hacmi 1,5 mL'lik yeni bir tüpe aktarın. Ses seviyesi yeterli değilse, hacmin tamamını alın. Kalan hücreleri ve alikotu izotip kontrol boyama için 3 çoğaltma tüpüne (her biri 1 M) ve lekesiz kontrol için 1 tüpe toplayın.
- Hücreleri 4 ° C'de 5 dakika boyunca 500 x g'da santrifüjleyin. Nazikçe aspire edin ve bir vakum aspirasyon sistemi kullanarak süpernatanı atın.
- Ölü hücreleri etiketlemek için PBS'de 1/100 oranında seyreltilmiş floresan hücre boyama çözeltisi örneği başına 200 μL ekleyin. Hücreleri pipetle nazikçe yeniden süspanse edin. İzotip kontrol boyama için ekstra tüpler için de aynısını yapın.
- Işıktan koruyarak 10 dakika buz üzerinde inkübe edin.
- Hücreleri 500 ° C'de 5 dakika boyunca 4 x g'da santrifüjleyin. Nazikçe aspire edin ve süpernatanı bir vakum sistemi kullanarak atın.
- İnsan hematopoetik hücrelerini etiketlemek için% 2 fetal sığır serumu içeren PBS'de 1/100 oranında seyreltilmiş hCD45-BUV395 antikor numunesi başına 100 μL ekleyin. İzotip kontrolleri için tutulan ekstra tüpler için de aynısını yapın.
- Işıktan koruyarak 15 dakika buz üzerinde inkübe edin. Hemen 3. adıma geçin.
3. Fiksasyon ve geçirgenlik
- Taze bir %1,6 formaldehit/PBS çözeltisi hazırlayın: Her numune için 29,5 μL %37 formaldehit stok çözeltisi + 970,5 μL PBS'yi karıştırın (önlem olarak biraz ekstra hacim ekleyin). %1.6 formaldehit/PBS çözeltisini oda sıcaklığında tutun.
DİKKAT: Formaldehit, kimyasal bir başlık içinde kullanılmalı ve kurumsal güvenlik düzenlemelerine uygun olarak atılmalıdır. - Hücreleri 500 ° C'de 5 dakika boyunca 4 x g'da santrifüjleyin. Bir vakum sistemi kullanarak süpernatanı aspire edin ve atın.
- 1 mL% 1.6 formaldehit / PBS çözeltisi içinde yeniden süspanse edin.
- Işıktan koruyarak oda sıcaklığında 10 dakika inkübe edin.
- Hücreleri 500 ° C'de 5 dakika boyunca 4 x g'da santrifüjleyin. Bir vakum sistemi kullanarak süpernatanı aspire edin ve atın.
- -20 °C'de soğutulmuş 1 mL %100 metanolü doğrudan tüpe ekleyin.
- Numuneleri -20 °C'de 30 dakika boyunca ışıktan koruyarak inkübe edin.
NOT: Bu noktada, sabit ve geçirgen hücreleri analizden önce bir aya kadar -80 °C'de saklamak mümkündür.
4. Fosfo akış boyama
NOT: Aşağıdaki antikor paneli, aşağıdaki lazerlerle donatılmış akış sitometresi kullanılarak doğrulanmıştır: 320 nm, 355 nm, 405 nm, 488 nm, 561 nm, 637 nm ve 808 nm. Farklı lazer ve dedektör kurulumları ile farklı sitometreler kullanılıyorsa bu panel yeniden doğrulanmalıdır.
- Her numune için 50 μL'lik bir hacim hesaplayarak, ticari olarak temin edilebilen bir boyama tamponunda (Tablo 1) aşağıdaki seyreltmelerle bir antikor ana karışım çözeltisi hazırlayın. Işıktan koruyarak 4 °C'de saklayın.
- Yıkamalar için (adım 4.8, 4.10), PBS'yi buz üzerinde tutun (her numune için 2 mL).
- Boyama tamponunda (Tablo 1) izotip kontrolü teknik kopyaları için ikinci bir ana karışım çözeltisi hazırlayın ve her numune için 50 μL'lik bir hacim hesaplayın. Işıktan koruyarak 4 °C'de saklayın. Teknik tekrarlanabilirlik için en az iki izotip kontrol numunesi önerilir.
- Hücreleri adım 3.7'den itibaren 500 x g'da 4 ° C'de 5 dakika santrifüjleyin. Bir vakum sistemi kullanarak süpernatanı aspire edin ve atın.
NOT: Fiksasyon ve geçirgenlikten sonra, hücreler daha yarı saydam görünebilir. - 50 μL antikor karışım çözeltisi (adım 4.1) veya izotip kontrol karışım çözeltisi (adım 4.2) ekleyin. Hücreleri bir pipetle nazikçe yeniden süspanse edin.
- Tüm numuneleri gece boyunca 4 °C'de ışıktan koruyarak inkübe edin.
- Hücreleri 4 ° C'de 5 dakika boyunca 500 x g'da santrifüjleyin. Bir vakum sistemi kullanarak süpernatanı aspire edin ve atın.
- 1000 μL PBS ile pipet ile nazikçe tekrar süspanse ederek yıkayın.
- Hücreleri 4 ° C'de 5 dakika boyunca 500 x g'da santrifüjleyin. Bir vakum sistemi kullanarak süpernatanı aspire edin ve atın.
- Pipetle hafifçe yeniden süpürerek 1000 μL PBS ile ikinci bir yıkama gerçekleştirin.
- Hücreleri 4 ° C'de 5 dakika boyunca 500 x g'da santrifüjleyin. Bir vakum sistemi kullanarak süpernatanı aspire edin ve atın.
- Numuneleri 200 μL PBS'de yeniden süspanse edin. Akış sitometrisi kullanılarak analiz için FACS tüplerine veya plakalarına aktarın (Şekil 3).
- Üreticinin talimatlarına göre, her antikorun 0.1 μL'sini kompanzasyon boncukları ile inkübe ederek boncuklarla tek renkli kompanzasyon kontrolleri hazırlayın (bkz. Malzeme Tablosu).
Sonuçlar
Deneysel tasarım, seçilen proteinlerin fosforilasyon durumunu farklı zaman noktalarında, örneğin 1 günlük tedavi öncesi başlatma ve 15 günlük tedavi sonrası başlatma gibi izlemeyi amaçlamaktadır. Bu taban çizgisi, tedaviden sonra sinyal yolu aktivasyonundaki sonraki değişikliklerin doğruluğunu doğrulamak için kritik bir kontrol görevi görür. On beş günlük tedaviden sonra, tedavi edilen farelerde araç ile tedavi edilen kontrollere karşı yol modülasyonunu değerlendirmek için ikinci bir karşılaştırma yapılır (Şekil 4). Bu iki aşamalı yaklaşım, tedaviye bağlı etkilerin başlangıç değişkenliğinden ayırt edilmesine izin verir.
Bu çalışma için bir AML PDX fare modeli kullanılmıştır. Farelere, aşağıdaki mutasyonlarla karakterize edilen hasta kaynaklı AML hücreleri nakledildi: DNMT3AMR882H %48'lik bir varyant alel fraksiyonu (VAF), NPM1W288fs VAF %36, FLT3ITD VAF %10 ve IDH2R140Q VAF %44. Transplantasyondan sonra, tedaviye başlamadan önce tümör büyümesi için üç hafta izin verildi. FLT3 mutant nakledilen PDX fareleri on beş gün boyunca üç rejimden biriyle tedavi edildi: plasebo, gilteritinib (günde 15 mg / kg) veya venetoklaks (günde 50 mg / kg), 5-azasitidin (günde 2.5 mg / kg) ve sedarizudin (günde 3 mg / kg) kombinasyonu (Şekil 4A).
Elde edilen sonuçlarla ilgili olarak, venetoklaks bazlı bir rejimle tedavinin önemli ölçüde artmış STAT5 ve RPS6 fosforilasyonu ile sonuçlandığını belirtmek dikkat çekicidir, bu da bu yolların tedavi direncine katkıda bulunduğunu düşündürmektedir (Şekil 4E). Buna karşılık, FLT3'ü hedefleyen bir ilaç olan gilteritinib, mutant FLT3 efektörlerinin fosforilasyon durumunu azaltmadı. Test edilen AML örneğinde, FLT3-ITD (örneğin, IDH2) dışındaki ek ikincil mutasyonların varlığının bu yolların aktivasyonuna katkıda bulunması veya iki hafta boyunca ilaç tedavisinin, azalmış sinyalleme ile AML hücrelerinin seçici olarak elimine edilmesiyle sonuçlanması mümkündür. Analiz edilen tüm fosfoproteinler aynı hücre popülasyonundan kapılı olduğundan, fosfoprotein aktivasyonunu karşılaştırmak mümkündür. Bu deneyde, fosfoprotein boyamasındaki en güçlü korelasyon, her ikisi de tedaviden sonra bu deney grubunda yukarı regüle edilen p-STAT5 ve p-RPS6 (Ek Şekil 1A) arasında görünmektedir (Şekil 4E). p-STAT5 ve p-ERK arasında daha az bir ilişki var gibi görünmektedir (Ek Şekil 1B). Daha da önemlisi, hücre boyutu (FSC-A kullanılarak değerlendirilen) genel p-STAT5 pozitifliğine önemli bir katkıda bulunmaz, bu da boyama pozitifliğinin sadece hücre boyutunun bir ürünü olmadığını vurgular (Ek Şekil 1C). Bu deneysel çerçeve, bu tedavilerin sinyal yolu modülasyonu üzerindeki etkilerinin kapsamlı bir değerlendirmesini sağlar.
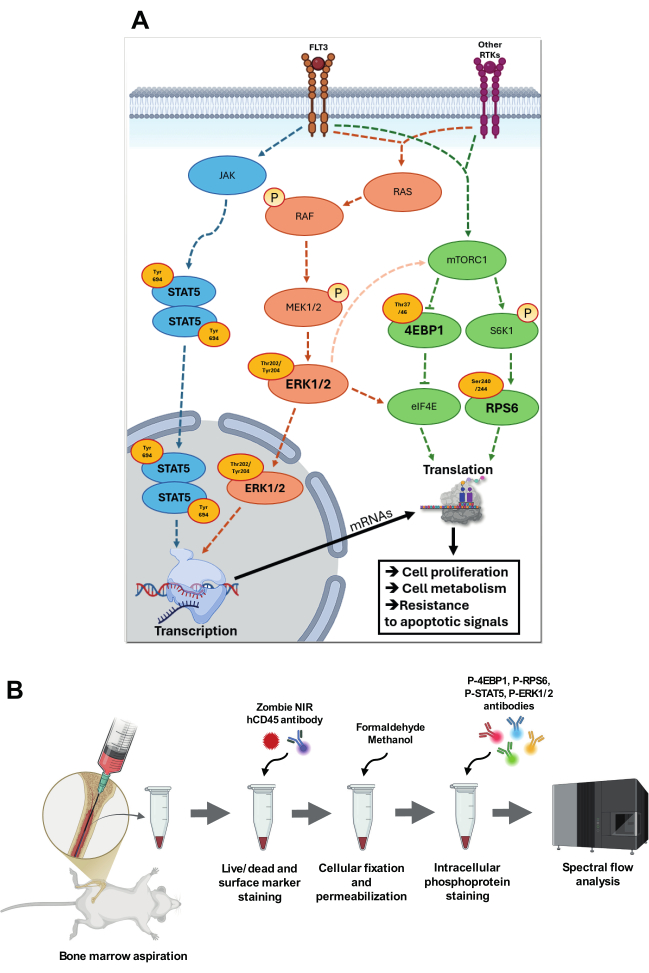
Şekil 1: Hedef sinyal yollarının görselleştirilmesi ve bunların analizi için strateji. (A) p-STAT5 (Tyr694), p-4EBP1 (Thr37/46), p-RPS6 (Ser240/244) ve p-ERK1/2 (Thr202/Tyr204) içeren sinyal yollarına genel bakış. P-STAT5 yolunda, JAK otofosforilasyona uğrar, katalitik aktivitesini arttırır, daha sonra spesifik tirozin kalıntılarını fosforile ederek STAT proteinleri için kenetlenme bölgeleri oluşturur. Fosforile STAT5 (Tyr694) homojenize olur ve çekirdeğe yer değiştirir, burada hedef genlerin promotör bölgelerindeki spesifik STAT'a duyarlı elementlere bağlanır. RAS-RAF-MEK-ERK kaskadında, ligand bağlanması üzerine FLT3 reseptörünün veya diğer reseptör tirozin kinazların (RTK'ler) otofosforilasyonu, RAS üzerinde GTP için GSYİH'nın değişimine yol açar ve böylece RAS'ı aktive eder. Aktive edilmiş RAS-GTP, RAF'ı plazma zarına alır, burada RAF konformasyonel bir değişikliğe uğrar ve aktif hale gelir. RAF daha sonra çift özgüllüklü bir kinaz olan MEK1/2'yi fosforile eder ve aktive eder, bu da ERK'yi Thr202/Tyr204 kalıntılarında fosforile eder. Aktive edilmiş ERK1/2, spesifik transkripsiyon faktörlerini fosforile ettiği çekirdeğe yer değiştirir. ERK1/2 ayrıca, ara sinyal yolları aracılığıyla, mTORC1 aktivitesini artırabilir ve translasyon aktivitesini artırmak için belirli bölgelerde eIF4E'yi fosforile edebilir. FLT3 ve diğer RTK'lar aracılığıyla besinler ve büyüme faktörleri tarafından aktive edilen mTORC1, S6K1 ve 4E-BP1 gibi aşağı akış hedeflerini fosforile eder. S6K1, sırayla, ribozom fonksiyonunu artıran ve translasyonu aktive eden RPS6'yı fosforile eder. 4E-BP1'in hiperfosforilasyonu, eIF4E'yi serbest bırakır ve çeviri başlatma kompleksi eIF4F'nin montajına ve kapağa bağlı çevirinin aktivasyonuna izin verir. Bu yolların tümü AML'de yüksek oranda yer alır ve hücre proliferasyonunu, metabolizmasını ve apoptotik sinyallere direnci artırarak edinilmiş adaptasyonlara katkıda bulunur. (B) kemik iliği aspirasyonu ve hücre içi fosfoflow boyama birleştirilmiş protokolünün ana adımlarını sunar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
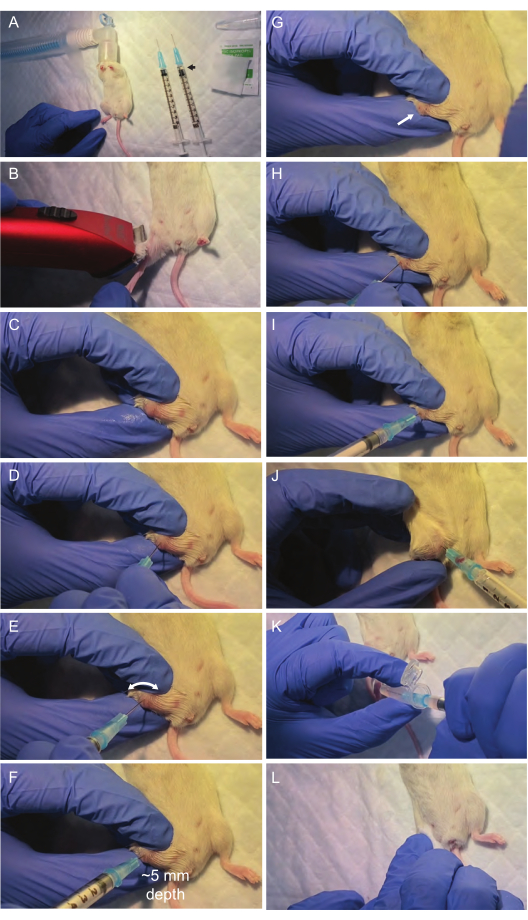
Şekil 2: Kemik iliği aspirasyon prosedürü sırasında kritik adımların görselleştirilmesi. Cerrahi alan ve gerekli malzemeler laminer akış başlığı altına yerleştirilir. İzofluran inhalasyonu (A) ile anestezi yapıldıktan sonra, femoral eklem yüzeyi aspirasyon için hazırlanır (B,C). Femur kemiği, femur kemiğinin (D) ortasına hizalanmış bir ilk şırınga ile delinir. İğneye güçlü basınç uygulamaktan kaçınmak ve bunun yerine döner bir delme hareketi gerçekleştirmek çok önemlidir; Bu genellikle iğnenin kemiğin yüzeyini delmesi ve femur boşluğunun yolunu takip etmesi için yeterlidir. Daha sonra, kemik iliği delinme bölgesinden (I, J) ikinci bir şırınga ile aspire edilir. Kemik iliği aspiratı bir mikrosantrifüj tüpüne (K) aktardıktan sonra, bölgedeki (L) kanamayı durdurmak için hafif bir basınç uygulanır ve fare iyileşme için ılık ve temiz bir kafese yerleştirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
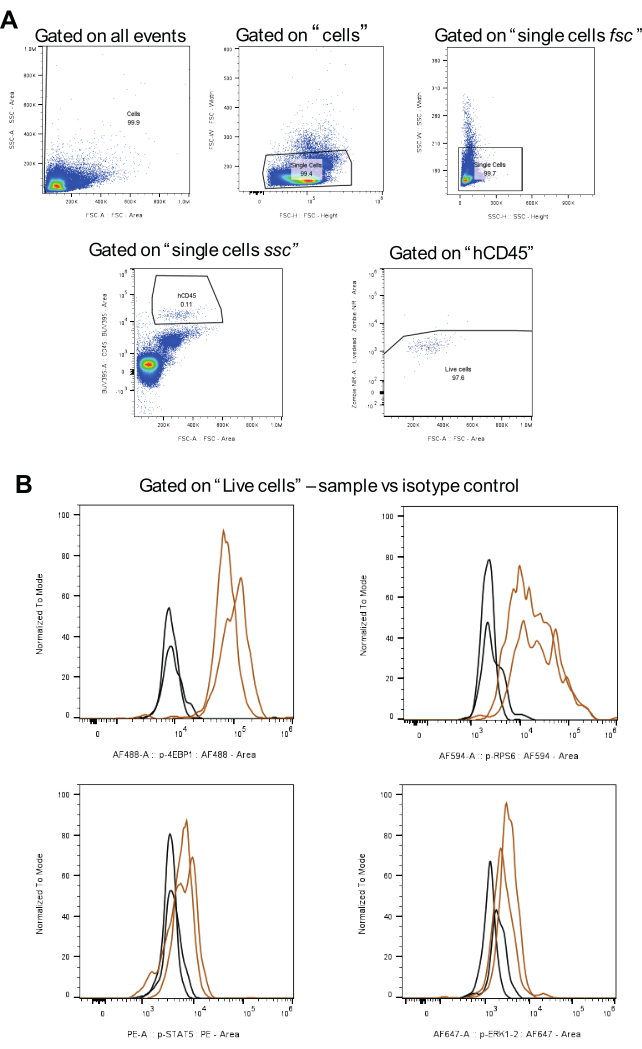
Şekil 3: İzotip kontrolleri de dahil olmak üzere geçit stratejisi analizi için iş akışı. (A), canlı hücreler için geçit stratejilerini, çiftlerin dışlanmasını ve hCD45 pozitif AML hücrelerini temsil eder. (B) her bir fosfoprotein için sinyalleri kahverengi ve izotip kontrollerini siyah renkte (iki biyolojik kopya) gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
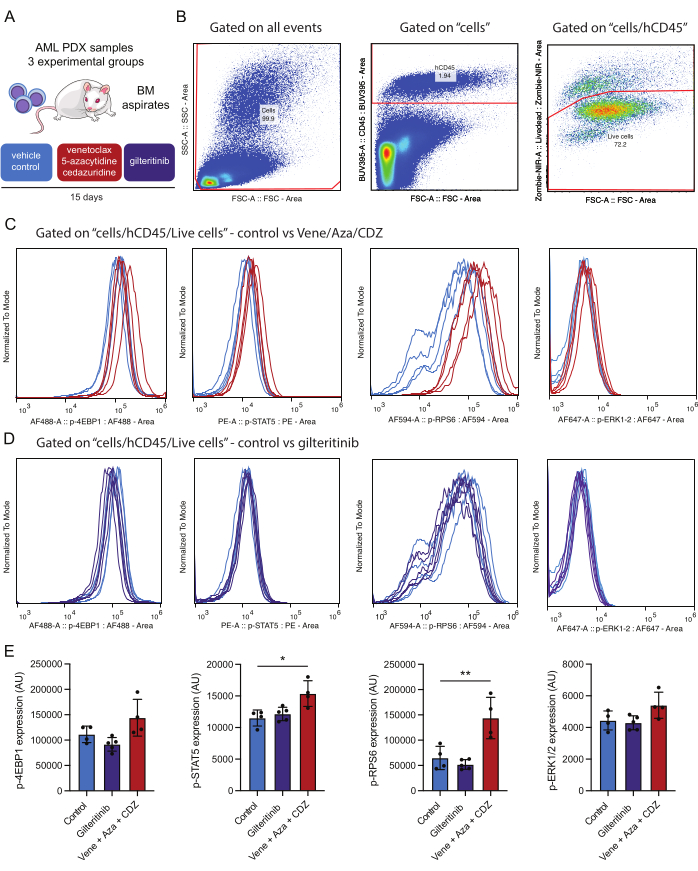
Şekil 4: Canlı kemik iliği AML hücrelerinin immüno-belirtilmesinden sonra hücre içi fosfoproteinlerin tespiti ve analizi için iş akışı. (A) Hasta tarafından bağışlanan AML hücreleri ile aşılanmış NSG-SGM3 fareleri, araç (kontrol) veya venetoklaks, 5-azasitidin ve sedazuridin (vene / aza / CDZ) veya gilteritinib ile tedavi edildi. 15 gün sonra Kemik İliği (BM) aspiratları işlendi. (B), tedaviden 15 gün sonra canlı AML hücrelerinin (örneğin, hCD45 / Zombi-NIR pozitif) analizi için geçit stratejisini temsil eder. (C, D), venetoklaks / 5-azasitidin / sedazuridin veya araç (B) veya gilteritinib veya araç (C) ile tedavi edilen farelerden izole edilen 10.000 AML hücresinde, belirtildiği gibi fosfoantikorların her biri için sinyalin normalizasyonunu temsil eder. İzler, araç (açık mavi), vene/aza/CDZ (kırmızı) veya gilteritinib (mor) ile tedavi edilen kontrol faresinden izole edilen AML hücrelerindeki sinyalleri temsil eder. (E) Histogram, üç fareden ve SD'den canlı insan AML CD45 + hücreleri üzerinde test edilen her bir fosfoprotein için boyama yoğunluklarındaki ortalama değer değişikliklerini temsil eder. Hata çubukları standart sapmayı temsil eder. Yıldız işaretleri, 0.05 (*) ve 0.01 (**) altındaki p değerleri ile ANOVA tarafından değerlendirilen boyama yoğunluklarında önemli farklılıklar olduğunu göstermektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Antikor | Florokrom | Seyreltme |
| p-RPS6 (Ser240/244) | AF594 Serisi | 1/50 |
| p-4EBP1 (Thr37/46) | AF488 Serisi | 1/50 |
| p-STAT5 (Tyr694) | PE | 1/100 |
| p-ERK1/2 (Thr202/Tyr204) | AF647 Serisi | 1/100 |
| Tavşan IgG kontrolü | AF594 Serisi | 1/50 |
| Tavşan IgG kontrolü | AF488 Serisi | 1/50 |
| Tavşan IgG kontrolü | PE | 1/100 |
| Tavşan IgG kontrolü | AF647 Serisi | 1/100 |
Tablo 1: Antikorlar için optimize edilmiş seyreltmelerin listesi.
Ek Şekil 1: Temsili bir AML PDX numunesinde p-STAT5, p-RPS6, p-ERK1/2 ve FSC-A'nın karşılaştırılması. Bu şekil, venetoklaks / 5-azasitidin / sedazuridin ile tedavinin 15. gününde fare "E9" da p-STAT5, p-ERK ve p-RPS6 arasındaki ilişkinin bir örneğini göstermektedir ( Şekil 4C'den elde edilen sonuç). Bu örnekte, fosfoprotein boyamasındaki en güçlü korelasyon, her ikisi de tedaviden sonra bu deney grubunda yukarı regüle edilen p-STAT5 ve p-RPS6 (A) arasında görünmektedir (Şekil 4E). p-STAT5 ve p-ERK (B) arasında daha az bir ilişki var gibi görünmektedir. Daha da önemlisi, hücre boyutu (FSC-A kullanılarak değerlendirilir) genel p-STAT5 pozitifliğine önemli bir katkıda bulunmaz, bu da boyama pozitifliğinin sadece hücre boyutunun (C) bir ürünü olmadığını vurgular. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Kritik adımlar
Fosfoproteinlerin spesifik tespiti yoluyla karmaşık sinyal yollarının çalışmasında immünolojik temelli tekniklerin kullanılması, deneysel değişkenlerin sıkı bir şekilde kontrol edilmesini22, numune hazırlamanın titiz olmasını ve doğrulama için tamamlayıcı tekniklerin kullanılmasını gerektirir. Bu uygulamaları entegre etmek, verilerin tekrarlanabilirliğini, kesinliğini ve sağlamlığını sağlayarak sonuçta daha güvenilir biyolojik sonuçlara katkıda bulunur. Bu çabalar sadece yöntemin bilimsel titizliğini arttırmakla kalmaz, aynı zamanda hücre sinyalizasyonu ve regülasyonu ile ilgili karmaşık çalışmalarda uygulanabilirliğini de genişletir. Uygun anestezi ve nazik kullanım, özellikle bağışıklık tepkilerine veya sinyal yollarına odaklanan çalışmalarda deneysel sonuçları önemli ölçüde değiştirebilen fizyolojik stresi en aza indirmek için kritik öneme sahiptir. Uygun analjezik protokollerin sağlanması, verilere müdahale edebilecek ağrı ile ilgili stresi önlerken hayvan refahının korunmasına daha fazla yardımcı olur. Prosedür sırasında aseptik koşulların korunması, enflamatuar yanıtlara yol açabilecek ve potansiyel olarak kafa karıştırıcı deneysel sonuçlara yol açabilecek enfeksiyonları önlemek için hayati önem taşır. Bu, ekipmanın sterilize edilmesini, temiz eldivenlerin kullanılmasını ve aspirasyon bölgesinin iyice dezenfekte edilmesini içerir.
Fosforile proteinler, biyolojik örneklerinmanipülasyonu sırasında fosfatazlar tarafından defosforilasyona karşı oldukça hassastır 22,23. İşleme sırasında fosforilasyon durumlarını korumak için hemen fiksasyon şarttır. İki farklı fiksasyon/geçirgenleştirme yöntemi test edildi: bir cytofix/cytoperm kiti ve protokolde belirtilen ortak formaldehit/metanol yöntemi. Bunlar arasında metanol bazlı yöntem, daha parlak floresan sinyalleri ile daha temiz sonuçlar sağladı ve bu da onu tercih edilen seçenek haline getirdi. Fiksasyonu takiben, numuneler -20 °C'de kısa süreli veya -80 °C'de uzun süreli olarak saklanabilir. Deneylerde, -80 °C'de üç aya kadar saklanan sabit numuneler tutarlı sonuçlar verdi. Antikor boyama için, bir gece inkübasyonu, özellikle ince fosforilasyon kaymaları için doğruluğu artırabilir, ancak bu, araştırılan spesifik deneye ve ilaç etkilerine bağlıdır. Daha kısa bir 1 saatlik inkübasyon da buz üzerinde test edildi, ışıktan korundu ve bu da bazı durumlarda kabul edilebilir sonuçlar verdi. Arka plan gürültüsünün doğru bir şekilde değerlendirilmesini sağlamak için, Şekil 3'te gösterildiği gibi, spesifik olmayan bağlama için referans olarak izotip kontrolleri önerilir.
Tekniğin modifikasyonları ve sorun giderme
Teknik yeterliliği geliştirmek için, grubumuzdaki kursiyerler, uygun yerleştirmenin diseksiyon ile doğrulanabileceği ötenazi fareler üzerinde iğne yerleştirme tekniğini uygularlar. Canlı hayvan prosedürü, iki operatör tarafından en verimli şekilde gerçekleştirilir, burada bir asistan hayvan izleme ve numune işleme görevlerine tahsis edilirken biri aspirasyonlara odaklanabilir. Birkaç denemeden sonra aspirasyon elde etmenin mümkün olmadığı nadir durumlarda, her denemede yaralanma riski arttığı için prosedürün iptal edilmesi tavsiye edilir. Hayvanların işlem sonrası izlenmesi de aynı derecede önemlidir. Enfeksiyon, ağrı veya stres belirtilerini gözlemlemek, farelerin refahını ve çalışmanın güvenilirliğini sağlar. Barınma koşulları, dış stres faktörlerini en aza indirmek için uygun yatak takımları ve beslenme ile iyileşmeyi desteklemelidir.
Akım sitometrik analiz için, farklı kemik iliği aspirasyon günlerinden alınan tüm sabit ve korunmuş örneklerin aynı anda işlenmesi önerilir. Kullanım günlerindeki veya operatörlerdeki farklılıklar nedeniyle numune rehidrasyonu ve lekelenmesindeki değişiklikler, sitometre tarafından algılanan floresan hassasiyetini etkileyebilir. Tutarlı sonuçlar elde etmek için, devam etmeden önce tüm lekeli numuneleri algılama aralığında tutmak için sitometre voltaj ayarlarını optimize edin. Alexa Fluor 488 konjuge p-4EBP1 proteini, bu paneldeki işaretleyiciler arasında en yüksek parlaklığı sergiler ve bu da onu maksimum algılama aralığını ayarlamak için güvenilir bir referans haline getirir. Bu protokolde sunulan antikor paneli kompanzasyon ayarlamaları gerektirmese de, bu kullanılan spektral akış sitometresine bağlı olarak değişebilir.
Sınırlama
Bu tekniğin en önemli sınırlamalarından biri, kemik iliği aspirasyonu sırasında çıkarılan hücre sayısıdır. Güvenilir sonuçlar elde etmek için, numune başına en az yaklaşık 10.000 hücreyi analiz edecek kadar hücreyi boyamak önemlidir. Çok az hücreyi analiz etmek, numuneler arasında önemli farklılıklara yol açarak verilerin doğruluğunu ve yorumlanabilirliğini tehlikeye atabilir. Yeterli sayıda hücrenin sağlanması, sağlam ve tekrarlanabilir mekanik çalışmalar için kritik öneme sahiptir.
Veri analizi için Şekil 3A'da gösterilen geçit stratejisi uygulanır. İlk olarak, çiftler hariç tutulduktan sonra, ilgilenilen hücreler BUV395 ile birleştirilmiş bir insan CD45 antikoru kullanılarak tanımlanır. Daha sonra, canlı hücreler için geçit Zombie NIR kullanılarak yapılır. Son olarak, her bir fosfoprotein için medyan floresan yoğunluğu (MFI) hesaplanır (Şekil 3B). Tüm fosforile proteinler için analiz edilen tüm hücreler, AML hücre popülasyonları arasında tutarlılık ve karşılaştırılabilirlik sağlamak için aynı strateji kullanılarak kapılandı.
Bu yöntemin bir başka sınırlaması, spesifik olmayan antikor bağlanması, yetersiz yıkama, hücre otofloresansı veya uygun olmayan geçirgenlikten kaynaklanabilen arka plan gürültüsü potansiyelidir. Bu, sinyal özgüllüğünü etkileyebilir ve fosfoflow sitometri analizinin doğruluğunu azaltabilir. Bu sorunlarla karşılaşan kullanıcılar için, arka plan gürültüsünü azaltmak için ek bir yıkama adımı önerilir ve spesifik olmayan bağlanmayı en aza indirmek için Fc bloke edici reaktifler kullanılabilir. Ek olarak, ölü hücre floresansı sonuçlara müdahale edebilir ve bu da canlılık boyalarının kullanımını gerekli kılar. Daha da önemlisi, doğru analiz için, güvenilir ve tekrarlanabilir sonuçlar elde etmek için analiz edilen hücre sayısı 500 AML hücresinden az olmamalıdır. Numuneler arasında tutarlılığı korumak için boyama sırasında benzer sayıda hücre kullanıldığından emin olmak da önemlidir. Bu sınırlamalara rağmen, kontrollerin ve geçit stratejilerinin dikkatli bir şekilde optimize edilmesi, yöntemin güvenilirliğini artırabilir.
Tekniğin önemi
Kemik iliği aspirasyon tekniği daha önce yayınlanmıştır3; Bununla birlikte, bu protokole iki avantajı vurgulayan bir açıklama ile güncellenmiş bir teknik dahil edilmiştir: gelişmiş immobilizasyon ve kemik iliği aspirasyonunda hassasiyet ve tutarlılığı artırmak için iki iğneli bir yaklaşımın kullanılması, iğnenin kemik parçalarıyla tıkanmasıyla ilgili herhangi bir sorunu önleme. Uzunlamasına çalışmalar için, femoral aspirasyon birden çok kez gerçekleştirilebilir ve bu da bireysel hayvanlarda zaman içindeki biyolojik değişiklikleri izlemek için güçlü bir yöntem sağlar. Yeterli kemik iyileşmesi ve kemik iliğinin yenilenmesini sağlamak için aynı uyluk kemiğindeki aspirasyonlar arasında en az bir aylık bir iyileşme aralığı önerilir. Kontralateral femur kullanılırken, farenin aşırı stres veya fizyolojik değişkenlik yaratmadan analjezi ve anestezinin etkilerinden kurtulmasını sağlamak için bir haftalık daha kısa bir aralık yeterlidir.
Toplamda, bu kombine murin kemik iliği aspirasyonu ve akış sitometrisi tekniği, JAK / p-STAT5, mTORC1 / p-4EBP1, mTORC1 / p-RPS6 ve MEK / p-ERK1 / 2 dahil olmak üzere anahtar sinyal yolları hakkında değerli bilgiler sağlar. Bu yolaklar AML'de tedavi direncinde önemli rol oynamaktadır. Bu teknik, aynı hayvandan tekrar tekrar numune alınmasına izin vererek, hastalığın ilerlemesinin ve tedavi yanıtının tek hücre düzeyinde gerçek zamanlı olarak izlenmesini sağlar.
Fosfoflow sitometri, fosforilasyon olaylarını yakalar ve hücresel heterojenliği korur 4,23,24. Bu, spesifik lösemik alt popülasyonlarda tedaviye dinamik hücresel yanıtları anlamak için özellikle değerli kılar.
Gelecekteki uygulamalar
Bu protokol, tedavi adaptasyonunun altında yatan mekanizmaları ve AML'de direncin ortaya çıkışını incelemek için değerli bir araç sağlar ve daha derin içgörüler ve potansiyel terapötik ilerlemeler için yol açar. Gelecekteki çalışmalar, direnci ve hastalığın ilerlemesini yönlendiren moleküler mekanizmaları daha fazla incelemek için bu yaklaşımı tek hücreli transkriptomik veya proteomik ile entegre edebilir25. Ek olarak, bu yöntemin diğer hematolojik malignitelere veya inflamatuar durumlara uygulanması, translasyonel araştırmalardaki etkisini genişletebilir.
Bu protokolü rafine ederek ve sınırlamalarını ele alarak, bu yaklaşım hematolojik hastalıklarda fosfoprotein sinyalizasyonunu incelemek için standart bir yöntem haline gelebilir ve sonuçta daha etkili terapötik stratejilerin geliştirilmesine yardımcı olabilir. Sonuç olarak, bu protokol, tedavi adaptasyonunun altında yatan mekanizmaları ve AML'de direncin ortaya çıkışını incelemek için değerli bir araç sağlayarak daha derin içgörüler ve potansiyel terapötik ilerlemeler için yol açar.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma, Cole Vakfı'ndan LH ve FEM için Geçiş Hibeleri ve Kanada Lösemi ve Lenfoma Derneği ve Kanada Sağlık Araştırmaları Enstitüleri'nden (PJT-186019) LH ve FEM'e hibeler ile desteklenmiştir. FEM bir FRSQ Junior 2 Klinik Bilim Adamıdır ve LH bir FRSQ Junior 2 Bilim İnsanıdır. VG, Cole Vakfı'ndan doktora bursuna sahiptir. Şekil 1 , lisanslı bir anlaşma kapsamında BioRender ile oluşturulmuştur. Akış sitometrisi grafikleri FlowJo yazılımı kullanılarak oluşturuldu. Dr. Colin Crist ve Victoria Richard'a hayvan cerrahisi tesislerine erişim sağladıkları için özel teşekkürler.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL syringes 25G x 5/8 TW | BD Biosciences | #309626 | Syringes for bone marrow aspiration |
| 1.7 mL Microcentrifuge Tubes | FroggaBio | #LMCT1.7B | To aliquot the cells recovered by bone marrow aspiration |
| BD Horizon Brilliant Stain Buffer | BD Biosciences | #563794 | For staining processes |
| Buprenorphine | Fidelis Animal Health | Ethiqa XR | Analgesia for mice |
| CellDrop FL Unlimited | FroggaBio | #CellDrop FL- UNLTD | For cell count |
| D-PBS | Wisent Inc. | #311-425-CL | Media for cells recovered by bone marrow aspiration |
| Eppendorf Centrifuge 5427 R | Millipore Sigma | #EP5429000260 | |
| Fetal Bovine Serum Heat Inactivated Premium CA | Wisent Inc. | #090-450 | For staining processes |
| Formaldehyde solution | Millipore Sigma | #F1635 | Cells Permeabilization |
| humanCD45 [HI30] antibody | BD Biosciences | #563792 | Antibody coupled with BUV395 |
| ID7000 Spectral Cell Analyzer | Sony | Spectral flow cytometer analyzer | |
| Isoflurane 99.9% liquid | McKesson | #803250 | Anesthesia for mice |
| Isospire (isoflurane) Inhalation Anesthetic | Dechra | Anesthesia for mice | |
| Live/dead AO/PI | FroggaBio | CD-AO/PI-1.5 | For cell count |
| Live/dead Zombie NIR | BioLegend+B6:C12 | #423106 | For spectral flow cytometry |
| Methanol solution | Millipore Sigma | #179957 | Cells Fixation |
| P-4EBP1 (Thr37/46) [236B4] antibody | Cell Signaling Technology | #2846 | Antibody coupled with Alexa Fluor 488 |
| p-Erk1/2 (Thr202/Tyr204) [197G2] antibody | Cell Signaling Technology | #13148 | Antibody coupled with Alexa Fluor 647 |
| p-RPS6 (Ser240/244) [D68F8] antibody | Cell Signaling Technology | #9468 | Antibody coupled with Alexa Fluor 594 |
| p-STAT5 (Tyr694) [D47E7] antibody | Cell Signaling Technology | #14603 | Antibody coupled with PE |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #2975 | Antibody coupled with Alexa Fluor 488 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #2985 | Antibody coupled with Alexa Fluor 647 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #8760 | Antibody coupled with Alexa Fluor 594 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #5742S | Antibody coupled with PE |
| Sanitizing wipes | United Canada | #UCDWPR-9022 | Disinfection for bone marrow aspiration |
Referanslar
- Ferrara, F., Schiffer, C. A. Acute myeloid leukaemia in adults. Lancet. 381 (9865), 484-495 (2013).
- Döhner, H., et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 129 (4), 424-447 (2017).
- Chung, Y. R., Kim, E., Abdel-Wahab, O. Femoral bone marrow aspiration in live mice. J Vis Exp. (89), e51660(2014).
- Haas, A., Weckbecker, G., Welzenbach, K. Intracellular Phospho-Flow cytometry reveals novel insights into TCR proximal signaling events. A comparison with Western blot. Cytometry A. 73 (9), 799-807 (2008).
- Perbellini, O., Cavallini, C., Chignola, R., Galasso, M., Scupoli, M. T. Phospho-specific flow cytometry reveals signaling heterogeneity in t-cell acute lymphoblastic leukemia cell lines. Cells. 11 (13), 2072(2022).
- Kornblau, S. M., et al. Simultaneous activation of multiple signal transduction pathways confers poor prognosis in acute myelogenous leukemia. Blood. 108 (7), 2358-2365 (2006).
- Perl, A. E. The role of targeted therapy in the management of patients with AML. Hematology Am Soc Hematol Educ Program. 2017 (1), 54µ65(2017).
- Márton, A., et al. The roles of phosphorylation of signaling proteins in the prognosis of acute myeloid leukemia. Pathol Oncol Res. 30, 1611747(2024).
- Levis, M. FLT3 mutations in acute myeloid leukemia: what is the best approach in 2013. Hematology Am Soc Hematol Educ Program. 2013, 220-226 (2013).
- Roux, P. P., Topisirovic, I. Signaling pathways involved in the regulation of mRNA translation. Mol Cell Biol. 38 (12), e00070-e00118 (2018).
- Nepstad, I., Hatfield, K. J., Grønningsæter, I. S., Reikvam, H. The PI3K-Akt-mTOR signaling pathway in human Acute Myeloid Leukemia (AML) Cells. Int J Mol Sci. 21 (8), ijms21082907(2020).
- Jia, X., Zhou, H. Phospho-eIF4E: A new target for acute myeloid leukemia. Curr Protein Pept Sci. 22 (4), 328-335 (2021).
- Ghosh, J., Kapur, R. Role of mTORC1-S6K1 signaling pathway in regulation of hematopoietic stem cell and acute myeloid leukemia. Exp Hematol. 50, 13-21 (2017).
- Park, H. J., et al. Therapeutic resistance in acute myeloid leukemia cells is mediated by a novel ATM/mTOR pathway regulating oxidative phosphorylation. Elife. 11, 79940(2022).
- Oki, T., et al. Imaging dynamic mTORC1 pathway activity in vivo reveals marked shifts that support time-specific inhibitor therapy in AML. Nat Commun. 12 (1), 245(2021).
- Lee, H. J., Daver, N., Kantarjian, H. M., Verstovsek, S., Ravandi, F. The role of JAK pathway dysregulation in the pathogenesis and treatment of acute myeloid leukemia. Clin Cancer Res. 19 (2), 327-335 (2013).
- Liu, A. C. H., et al. Targeting STAT5 signaling overcomes resistance to IDH Inhibitors in acute myeloid leukemia through suppression of stemness. Cancer Res. 82 (23), 4325-4339 (2022).
- Sung, P. J., Sugita, M., Koblish, H., Perl, A. E., Carroll, M. Hematopoietic cytokines mediate resistance to targeted therapy in FLT3-ITD acute myeloid leukemia. Blood Adv. 3 (7), 1061-1072 (2019).
- Song, P., Yang, F., Jin, H., Wang, X. The regulation of protein translation and its implications for cancer. Signal Transduct Target Ther. 6 (1), 68(2021).
- This Standard Operating Procedure (SOP) describes methods for anesthetizing mice. , McGill University. https://www.mcgill.ca/research/files/research/110-mouse_anesthesia-2024-06-17.pdf (2024).
- Tech Team Tips: Preparing a Sample with AO/PI. , DeNovix. https://www.denovix.com/webinars/tech-team-tips-preparing-a-sample-with-ao-pi (2021).
- Suni, M. A., Maino, V. C. Flow cytometric analysis of cell signaling proteins. Methods Mol Biol. 717, 155-169 (2011).
- Krutzik, P. O., Irish, J. M., Nolan, G. P., Perez, O. D. Analysis of protein phosphorylation and cellular signaling events by flow cytometry: techniques and clinical applications. Clin Immunol. 110 (3), 206-221 (2004).
- Chen, W., Luu, H. S. Immunophenotyping by multiparameter flow cytometry. Methods Mol Biol. 1633, 51-73 (2017).
- Perez, O. D., Nolan, G. P. Phospho-proteomic immune analysis by flow cytometry: From mechanism to translational medicine at the single-cell level. Immunol Rev. 210, 208-228 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır