Method Article
急性髓性白血病患者来源的异种移植的细胞内磷酸流式细胞术
摘要
在这里,描述了一种基于磷酸流式细胞术的方法,用于分析异种移植到小鼠中并从骨髓抽吸物中获得的急性人髓性白血病细胞中 mTORC1、JAK/STAT5 和 MAPK 通路下游的信号传导。使用具有高灵敏度的新一代光谱流式细胞仪同时测量 p-STAT5、p-4EBP1、p-RPS6 和 p-ERK1/2 水平。
摘要
为了适应和抵抗批准的治疗方法,急性髓系白血病 (AML) 细胞激活特定的分子途径,导致基因表达、蛋白质水平和活性发生变化。在该方案中,据报道了一种方法来探索 AML 中致癌信号转导下游磷酸化的靶标:p-STAT5 (Tyr694)、p-4EBP1 (Thr37/46)、p-RPS6 (Ser240/244) 和 p-ERK1/2 (Thr202/Tyr204)。该方法能够评估这些途径(干性维持、免疫逃避、蛋白质合成和适应氧化和代谢应激的主要调节因子)如何在治疗阶段前后通过抽吸从活小鼠收获的骨髓细胞中的一种或多种测试化合物进行调节。与碎骨技术相比,这种微创方法可以保持细胞完整性并减轻压力,因为碎骨技术会诱导损伤并可能影响实验结果。为了优化流式细胞术分析的细胞内抗体染色,开发了一种使用多聚甲醛固定和甲醇透化的方案。这种方法可确保高染色精度并最大限度地减少背景噪音,从而能够可靠地检测细胞内信号转导标志物。该方案的主要优点之一是开发了多参数抗体组,允许同时评估同一样品中的四种途径。使用具有高灵敏度的下一代光谱流式细胞仪,与同一小鼠的治疗前基线水平相比,根据治疗条件观察到通路激活的动态变化。该方法能够对患者来源的异种移植骨髓样本中的信号通路调节进行精确的 体内 分析,而无需对动物实施安乐死,为 AML 细胞的适应机制提供了有价值的见解,并且可以指导旨在靶向这些通路以克服耐药性的治疗策略的评估。
引言
急性髓系白血病 (AML) 是一种侵袭性血液系统恶性肿瘤,其特征是未成熟的髓系祖细胞在骨髓和外周血中积累。这会破坏正常的造血功能,导致危及生命的血细胞减少症和全身并发症。尽管化疗方案、靶向治疗和造血干细胞移植的进步改善了一些患者的预后,但总体而言,5 年生存率仍保持在 30% 左右,老年患者或具有不良遗传特征的患者预后较差1。AML 管理的一个重大挑战是耐药性的频繁出现,这会导致复发和治疗失败2。这强调了更深入地了解驱动 AML 进展和治疗耐药性的分子和细胞机制的重要性。
为了应对这一挑战,提出了一种骨髓穿刺与多重细胞内磷酸流式细胞术相结合的新方法,为研究 AML 患者来源的异种移植物 (PDX) 模型中的细胞内信号通路提供了强大的工具(图 1A、B)。尽管之前已经描述了 PDX 模型中的骨髓穿刺3,但该方案已经过优化,以保留白血病细胞用于磷酸血流分析。该方法的总体目标是提供一种微创手术,该手术在白血病进展和治疗反应期间具有单细胞分辨率。通过允许从同一只动物中重复采样,该技术可以更准确地表示治疗下的疾病演变。开发这项技术的基本原理在于需要对 AML 细胞中的细胞内信号传导进行高分辨率、动态评估。传统方法(如 Western 印迹)需要大量细胞,缺乏单细胞分辨率,并且需要多重检测4。相比之下,磷酸流式细胞术保留了细胞异质性,并能够检测不同白血病亚群中的多种磷酸化信号转导蛋白5,从而为响应 AML 治疗的通路激活提供关键见解。
AML 生物学的核心是调节细胞增殖、存活和代谢适应的信号通路,包括丝裂原活化蛋白激酶 (MAPK)、雷帕霉素复合物 1 的机械靶标 (mTORC1) 以及 Janus 激酶/信号转导和转录激活因子 5 (JAK/STAT5) 信号通路。除了在白血病细胞增殖和存活中的作用外,这些通路还关键参与关键的致癌过程,例如干性维持、免疫逃避以及对氧化和代谢应激的适应4。除了促进细胞生长和存活外,这些通路之间的串扰还协调转录、翻译和细胞代谢等关键过程,使 AML 细胞能够维持生长并抵抗凋亡信号,即使面对治疗干预也是如此 6,7(图 1A)。
MAPK 通路包括 p-ERK1/2(细胞外信号调节激酶 1/2)等关键效应子,在细胞外信号(如生长因子和细胞因子)的整合中起着至关重要的作用,以调节细胞增殖和存活。ERK1/2 激活通过 RAS(大鼠肉瘤)-RAF(快速加速纤维肉瘤)-MEK(MAPK/ERK 激酶)-ERK 级联反应发生,其中 RAS-GTP 募集 RAF,导致 MEK1/2 连续磷酸化,然后在 Thr202/Tyr204 位点磷酸化 ERK1/2。磷酸化后,ERK1/2 二聚化并转位到细胞核,在那里它磷酸化 MYC(骨髓瘤病毒癌基因同源物)、ELK1(ETS Like-1 蛋白)和 AP-1(激活蛋白-1)等转录因子,促进细胞增殖、分化阻断和存活8。在 AML 中,FLT3(fms 样酪氨酸激酶 3)、RAS 或 KIT 突变经常导致组成型 ERK 激活 9,10(图 1A)。
FLT3、RAS 或 KIT 突变也会导致 mTORC1 信号转导上调,通过支持代谢重新布线、蛋白质合成调节、核糖体生物发生和自噬等致癌过程,使 AML 生长和治疗耐药性11。通过调节 mRNA 翻译,mTORC1 促进致癌蛋白和 AML 进展的其他重要因子的产生。mTORC1 底物的一个关键组包括 4E-BP(真核起始因子 4E 结合蛋白)。在低磷酸化状态下,4E-BP 与 eIF4E(真核起始因子 4E)结合,抑制帽依赖性翻译。mTORC1 在 Thr37/46 位点磷酸化 4E-BP1 导致 eIF4E 释放,从而能够启动关键致癌 mRNA(如 MYC、CCND1(细胞周期蛋白 D1)和 MCL-1(髓系细胞白血病 1)的翻译,从而促进白血病增殖和存活 8,12。此外,由 mTORC1 下游的 S6K1(核糖体蛋白 S6 激酶 β-1)介导的 RPS6 在 Ser240/244 位点的磷酸化可增强核糖体生物发生和 mRNA 翻译,从而增加代谢适应、抗应激和快速增殖所需的蛋白质合成 8,13。值得注意的是,mTORC1 活性与代谢适应密切相关,代谢适应是 AML 细胞在治疗应激下采用的关键生存策略 13,14,15(图 1A)。
JAK/STAT5 通路是 AML 中的另一个关键信号转导轴,尤其是在发生影响细胞因子受体或信号转导介质(如 JAK2、FLT3 和 CARR(钙网蛋白))16,17 的突变的情况下。STAT5 响应细胞因子信号转导,通过 FLT3 和 JAK2 等受体被激活。配体结合后,相关 Janus 激酶 (JAK) 在 Tyr694 位点磷酸化 STAT5。磷酸化的 STAT5 二聚化并转位到细胞核,在那里它与特定的 DNA 序列结合,以调节参与细胞存活、增殖和分化的基因的转录8。在 AML 中,STAT5 的组成型激活,通常是由于 FLT3 或 JAK2 突变,导致促进白血病生成的基因持续表达18(图 1A)。
除了它们的个体贡献之外,这些通路还汇聚以调节转录和翻译,以促进存活和抵抗的方式塑造 AML 细胞的蛋白质组。特别是,mRNA 翻译正在成为 AML 病理生理学中的一个关键因素,因为它允许快速产生致癌蛋白和应激反应因子,使 AML 细胞能够适应环境挑战并逃避靶向治疗的影响。真核起始因子 (eIF) 或核糖体蛋白等翻译机制失调与 AML19 的治疗耐药性和不良预后有关。详细研究 MAPK、mTORC1 和 JAK/STAT5 通路在转录和翻译调控中的作用对于全面了解 AML 进展和耐药的分子机制至关重要。这些见解对于识别治疗反应的新生物标志物和设计针对这些途径以克服耐药性的新型治疗策略至关重要。本文提供了一种专门设计用于研究 AML 患者来源的异种移植物 (PDX) 模型中的这些信号网络的协议。
该方案的主要优势之一是将骨髓穿刺与细胞内磷酸流式细胞术相结合,允许在 AML 患者来源的异种移植物 (PDX) 模型中对信号通路激活进行动态和微创评估。这对于监测响应靶向治疗的关键通路(如 MAPK、mTORC1 和 JAK/STAT5)的激活状态特别有价值。这些技术的结合使人们能够获得对 AML 生物学的全面和高分辨率的理解,最终有助于开发更有效的治疗策略。
研究方案
以下实验经麦吉尔大学动物护理委员会 (CIHR PJT-186019) 和犹太总医院机构审查委员会 (11-047) 批准进行。在该方案中,雄性 NOD-scid IL2Rg^null-3/GM/SF (NSGS) 小鼠,年龄为 8 周至 6 个月,体重为 20-30 g,先前移植了人类患者来源的 AML 细胞。本研究中使用的试剂和设备的详细信息列在 材料表中。
1. 骨髓穿刺
注意: 应遵循有关使用针头的安全预防措施。
- 围手术期镇痛:骨髓穿刺前 1-4 小时,皮下 (sc) 注射小鼠 0.1 mg/kg 丁丙诺啡缓释剂。这确保了术后长达 72 小时的镇痛效果。
- 在层流罩下准备手术区域,用手垫、头发修剪器、加热灯和骨髓抽吸所需的所有材料(25 G 注射器、1.5 mL 微量离心管,含有 0.5 mL 冰上 PBS,70% 异丙醇拭子)。使用胶带固定鼻锥以吸入异氟醚(图 2A)。
- 为每个抽吸物准备两个 25 G 注射器,一个用于骨穿刺(“干针”),另一个其中心已用 PBS 冲洗以进行抽吸(“冲洗针”)。
- 根据制造商的说明和兽医指南,使用经过认证的蒸发器提供的异氟醚吸入麻醉小鼠。当地程序可能有所不同。作为参考,该协议遵循麦吉尔大学小鼠麻醉20 的标准作程序。
- 通过对足部捏和肌肉松弛缺乏反应 来 确认麻醉深度。在动物麻醉期间,将兽用药膏涂抹在眼睛上,以防止干燥。麻醉期间持续监测呼吸频率。
- 使用毛发修剪器剃掉将进行抽吸的整个腿部。用浸有异丙醇的消毒垫对抽吸部位(股骨)进行消毒(图 2B)。
- 通过弯曲膝盖并使用非惯用手固定腿部,暴露穿刺部位所在的股骨关节面。将拇指放在胫骨上,食指放在股骨上,将中指放在两块骨头外侧,稳定两块骨头外侧的所有内容(图 2C)。
注意: 使用非惯用手确保腿部位置非常稳定,以防止在抽吸过程中腿部移动,从而导致失败或受伤。如果腿部固定不稳定,请在穿刺前重新定位手并重试。 - 在用非惯用手固定的同时,再次用异丙醇对膝盖区域进行消毒(图 2C),以将剩余的毛发移走,以改善骨骼结构的可视化。
- 使用第一个干燥的 25 G 注射器在股骨关节表面打一个孔,将其放置在股骨关节的中间并在不用力的情况下旋转它(图 2D,E)。确保注射器的针头与股骨的纵轴完全对齐(0° 偏差),以正确进入骨髓。
注意:保持此对齐以确保顺利进入而不会对周围组织造成不必要的伤害。当针头进入股骨中部时,阻力略有降低表明成功渗透到骨髓腔中(图 2F)。在此步骤中,避免对针头施加过大的力,因为这可能会导致无法正确对齐、断裂或创伤。通过使用旋转钻孔运动,针头沿着阻力最小的路径正确进入股骨腔的机会更大。即使移开握住它的手,正确定位在股骨内的针也应保持垂直。 - 进入骨髓后,通过旋转逐渐取出注射器(图 2G),然后将第二个冲洗的注射器插入第一个针头形成的孔中(图 2H,I)。
注意:使用第二个注射器,因为第一个注射器在钻孔过程中经常被骨头堵塞。 - 对插入股骨内的注射器施加真空,同时轻轻旋转并逐渐抽出注射器。在注射器的轮毂内应该可以看到大约 10-20 μL 的骨髓(图 2J)。
注意:如果需要,轻轻地将针头重新推进骨骼内以优化骨髓提取。 - 通过将注射器的内容物冲洗到含有 500 μL PBS 的冷冻微量离心管中来转移骨髓(图 2K)。保持冰上并尽快进行步骤 2-3。
- 用异丙醇棉签轻轻按压穿刺部位 30 秒以止血(图 2L)。
- 将鼠标放入使用加热灯加热的干净恢复笼中。监测呼吸和活动能力,直到动物醒来并完全恢复,然后再将其与其他小鼠一起放入公共笼子中。检查是否有出血迹象。
2. 活/死和表面标志物染色
注意:在整个过程中将细胞置于冰上。在步骤 2 和步骤 3 之前准备抗体染色溶液的预混液(用于步骤 2.4 和步骤 2.7),将它们保持在 4 °C 避光。制备新鲜的 1.6% 甲醛溶液(步骤 3.1)和保持在 -20 °C 的 100% 甲醇溶液(步骤 3.6)。
- 使用吖啶橙/碘化丙啶 (AO/PI) 和细胞计数器21 计数活细胞。
- 将 100 万个细胞的适当体积转移到新的 1.5 mL 试管中。如果体积不够,请取整个体积。汇集剩余的细胞并分装到 3 个重复管(每个 1 M)中用于同种型对照染色,1 个试管用于未染色对照。
- 在 4°C 下以 500 x g 离心细胞 5 分钟。 轻轻吸出并使用真空吸液系统丢弃上清液。
- 每份用 PBS 稀释 1/100 的荧光细胞染色溶液样品中加入 200 μL,以标记死细胞。用移液管轻轻重悬细胞。对额外的试管进行相同的同种型对照染色。
- 在冰上避光孵育 10 分钟。
- 将细胞在 4 °C 下以 500 x g 离心 5 分钟。 轻轻吸出并使用真空系统弃去上清液。
- 在含有 2% 胎牛血清的 PBS 中,以 1/100 的比例稀释的 hCD45-BUV395 抗体,每份样品加入 100 μL,以标记人造血细胞。对为同种型对照保留的额外试管执行相同的作。
- 在冰上避光孵育 15 分钟。立即进入步骤 3。
3. 固定和透化
- 准备新鲜的 1.6% 甲醛/PBS 溶液:对于每个样品,混合 29.5 μL 37% 甲醛储备溶液 + 970.5 μL PBS(作为预防措施,请增加一些体积)。将 1.6% 甲醛/PBS 溶液保存在室温下。
注意:甲醛应在化学罩中处理,并按照机构安全规定进行处理。 - 将细胞在 4 °C 下以 500 x g 离心 5 分钟。 使用真空系统吸出并丢弃上清液。
- 重悬于 1 mL 的 1.6% 甲醛/PBS 溶液中。
- 在室温下避光孵育 10 分钟。
- 将细胞在 4 °C 下以 500 x g 离心 5 分钟。 使用真空系统吸出并丢弃上清液。
- 将 1 mL 在 -20 °C 下冷却的 100% 甲醇直接加入试管中。
- 将样品在 -20 °C 下避光孵育 30 分钟。
注意:此时,可以在分析前将固定和透化的细胞在 -80 °C 下储存长达一个月。
4. Phosphoflow 染色
注:以下抗体组合使用配备以下激光器的流式细胞仪进行了验证:320 nm、355 nm、405 nm、488 nm、561 nm、637 nm 和 808 nm。如果不同的细胞仪使用不同的激光器和检测器设置,则应重新验证此面板。
- 在市售染色缓冲液中制备具有以下稀释度的抗体预混液溶液(表 1),计算每个样品的体积为 50 μL。在 4 °C 避光保存。
- 对于洗涤(步骤 4.8、4.10),将 PBS 保存在冰上(每个样品 2 mL)。
- 在染色缓冲液中为同种型对照技术重复准备第二种预混液溶液(表 1),计算每个样品的体积为 50 μL。在 4 °C 避光保存。建议至少使用两个同种型对照样品,以确保技术重现性。
- 将步骤 3.7 中的细胞在 4 °C 下以 500 x g 离心 5 分钟。 使用真空系统吸出并丢弃上清液。
注:固定和透化后,细胞可能看起来更透明。 - 加入 50 μL 抗体混合物溶液(步骤 4.1)或同种型对照混合物溶液(步骤 4.2)。用移液管轻轻重悬细胞。
- 将所有样品在 4 °C 避光孵育过夜。
- 在 4 °C 下以 500 x g 离心细胞 5 分钟。 使用真空系统吸出并丢弃上清液。
- 用移液管轻轻重悬,用 1000 μL PBS 洗涤。
- 在 4 °C 下以 500 x g 离心细胞 5 分钟。 使用真空系统吸出并丢弃上清液。
- 用移液管轻轻重悬,用 1000 μL PBS 进行第二次洗涤。
- 在 4 °C 下以 500 x g 离心细胞 5 分钟。 使用真空系统吸出并丢弃上清液。
- 在 200 μL PBS 中重悬样品。转移到 FACS 管或板中,使用流式细胞术进行分析(图 3)。
- 根据制造商的说明,通过将每种抗体与 0.1 μL 补偿微珠一起孵育,制备带有微珠的单色补偿对照(参见 材料表)。
结果
实验设计旨在监测所选目标蛋白在不同时间点的磷酸化状态,例如,处理前 1 天和处理开始后 15 天。该基线作为关键对照,以验证治疗后信号通路激活后续变化的真实性。治疗 15 天后,进行第二次比较以评估治疗小鼠与载体处理的对照的通路调节(图 4)。这种两步方法允许区分治疗诱导的影响与基线变异性。
在本研究中,使用了 AML PDX 小鼠模型。小鼠移植了患者来源的 AML 细胞,其特征如下:变异等位基因分数 (VAF) 为 48% 的 DNMT3AMR882H 、 NPM1W288fs VAF 36%、 FLT3ITD VAF 10% 和 IDH2R140Q VAF 44%。移植后,在开始治疗前允许 3 周的肿瘤生长。FLT3 突变体移植的 PDX 小鼠用三种方案中的一种治疗 15 天:安慰剂、吉替替尼(每天 15 mg/kg)或维奈托克(每天 50 mg/kg)、5-阿扎胞苷(每天 2.5 mg/kg)和西达芦定(每天 3 mg/kg)的组合(图 4A)。
关于获得的结果,值得注意的是,用基于维奈托克的方案治疗导致 STAT5 和 RPS6 磷酸化显着增强,表明这些途径导致治疗耐药性(图 4E)。相比之下,靶向 FLT3 的药物吉替替尼并没有降低突变 FLT3 效应子的磷酸化状态。在测试的 AML 标本中,除 FLT3-ITD 以外的其他继发突变(例如 IDH2)的存在可能有助于这些通路的激活,或者两周内的药物治疗导致选择性消除 AML 细胞,信号转导减少。由于分析的所有磷蛋白都来自同一细胞群,因此可以比较磷蛋白活化。在该实验中,磷蛋白染色中最强的相关性似乎是 p-STAT5 和 p-RPS6 之间(补充图 1A),它们在处理后在该实验组中均上调(图 4E)。p-STAT5 和 p-ERK 之间的关系似乎较小(补充图 1B)。重要的是,细胞大小(使用 FSC-A 评估)并不是整体 p-STAT5 阳性的主要贡献者,这突出表明染色阳性不仅仅是细胞大小的产物(补充图 1C)。该实验框架能够全面评估这些处理对信号通路调节的影响。
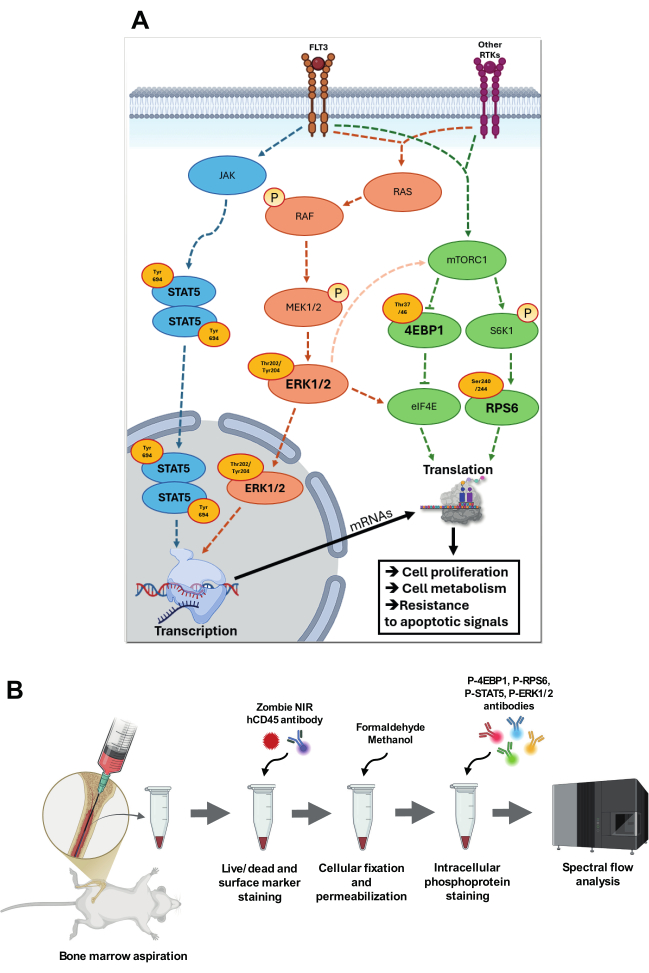
图 1:目标信号通路及其分析策略的可视化。 (A) 涉及 p-STAT5 (Tyr694)、p-4EBP1 (Thr37/46)、p-RPS6 (Ser240/244) 和 p-ERK1/2 (Thr202/Tyr204) 的信号通路概述。在 p-STAT5 通路中,JAK 发生自磷酸化,增加其催化活性,然后磷酸化特异性酪氨酸残基,为 STAT 蛋白创建停靠位点。磷酸化 STAT5 (Tyr694) 同源二聚化并转位到细胞核中,在那里它与靶基因启动子区域中的特异性 STAT 反应元件结合。在 RAS-RAF-MEK-ERK 级联反应中,配体结合后 FLT3 受体或其他受体酪氨酸激酶 (RTK) 的自磷酸化导致 RAS 上的 GDP 与 GTP 交换,从而激活 RAS。激活的 RAS-GTP 将 RAF 募集到质膜上,在那里 RAF 发生构象变化并变得活跃。然后,RAF 磷酸化并激活 MEK1/2,MEK1/2 是一种双特异性激酶,进而磷酸化 ERK 的 Thr202/Tyr204 残基。激活的 ERK1/2 易位到细胞核中,在那里它磷酸化特定的转录因子。ERK1/2 还能够通过中间信号通路增加 mTORC1 活性并在特定位点磷酸化 eIF4E 以增加翻译活性。mTORC1 通过 FLT3 和其他 RTK 被营养物质和生长因子激活,磷酸化下游靶标,如 S6K1 和 4E-BP1。反过来,S6K1 磷酸化 RPS6,从而增强核糖体功能并激活翻译。4E-BP1 的过度磷酸化释放 eIF4E,允许组装翻译起始复合物 eIF4F 并激活帽依赖性翻译。所有这些通路都高度参与 AML,通过增加细胞增殖、代谢和对凋亡信号的抵抗来促进获得性适应。(B) 介绍了骨髓穿刺和细胞内 phosphoflow 染色偶联方案的主要步骤。 请单击此处查看此图的较大版本。
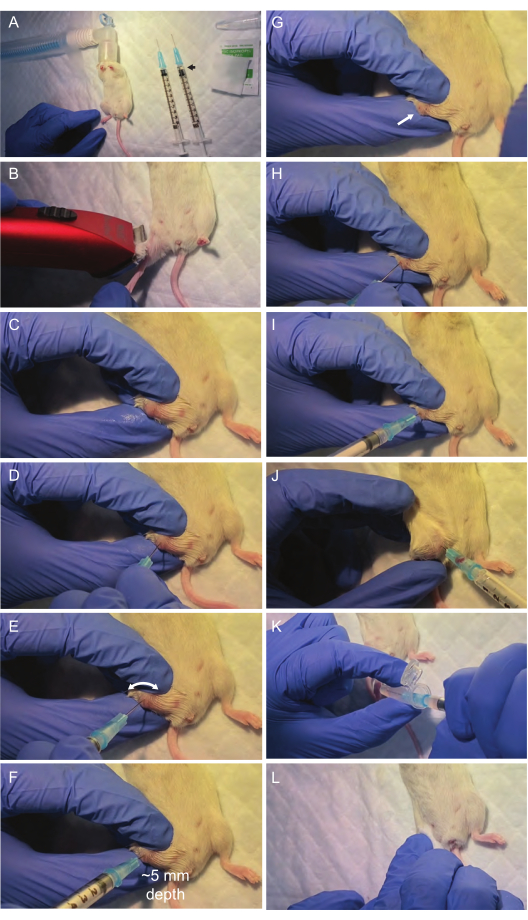
图 2:骨髓穿刺过程中关键步骤的可视化。 手术区域和必要的材料设置在层流罩下。异氟醚吸入麻醉后 (A),股骨关节面为抽吸做好准备 (B,C)。股骨由与股骨中间对齐的第一个注射器 (D) 刺穿。避免对针头施加强力压力,而是进行旋转钻孔运动,这一点至关重要;这通常足以让针头刺穿骨骼表面并沿着股骨腔的路径。接下来,用第二个注射器通过穿刺部位 (I,J) 抽吸骨髓。将骨髓抽吸物转移到微量离心管 (K) 后,轻轻按压以停止该区域 (L) 的出血,并将小鼠放入温暖干净的笼子中进行休养。 请单击此处查看此图的较大版本。
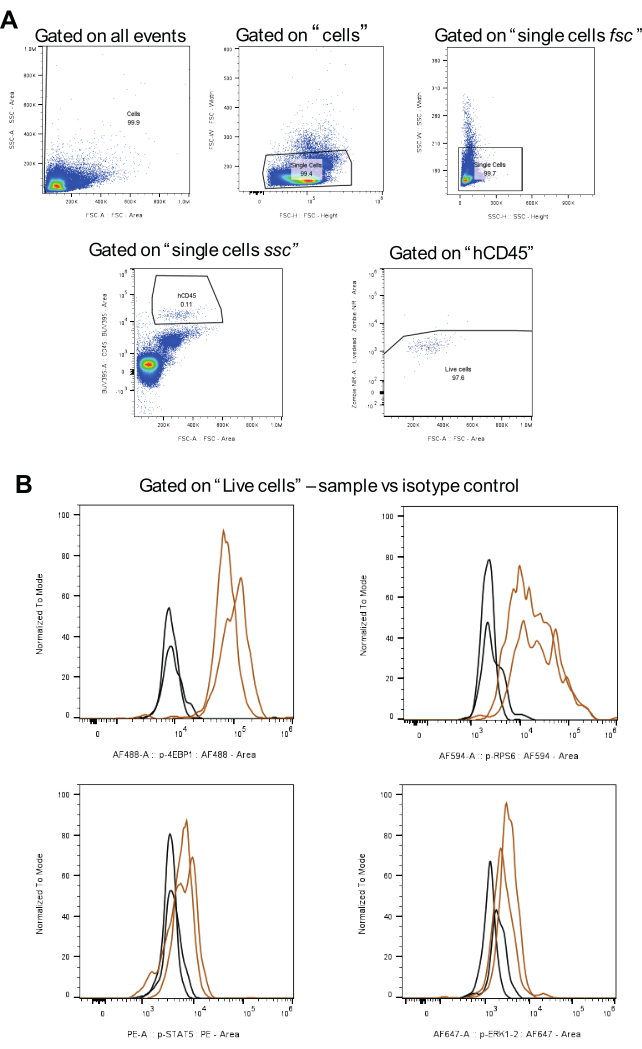
图 3:设门策略分析的工作流程,包括同种型对照。 (A) 代表活细胞的门控策略、双峰的排除和 hCD45 阳性 AML 细胞。(B) 以棕色显示每种磷蛋白的信号,以黑色显示同种型对照的信号(两次生物学重复)。 请单击此处查看此图的较大版本。
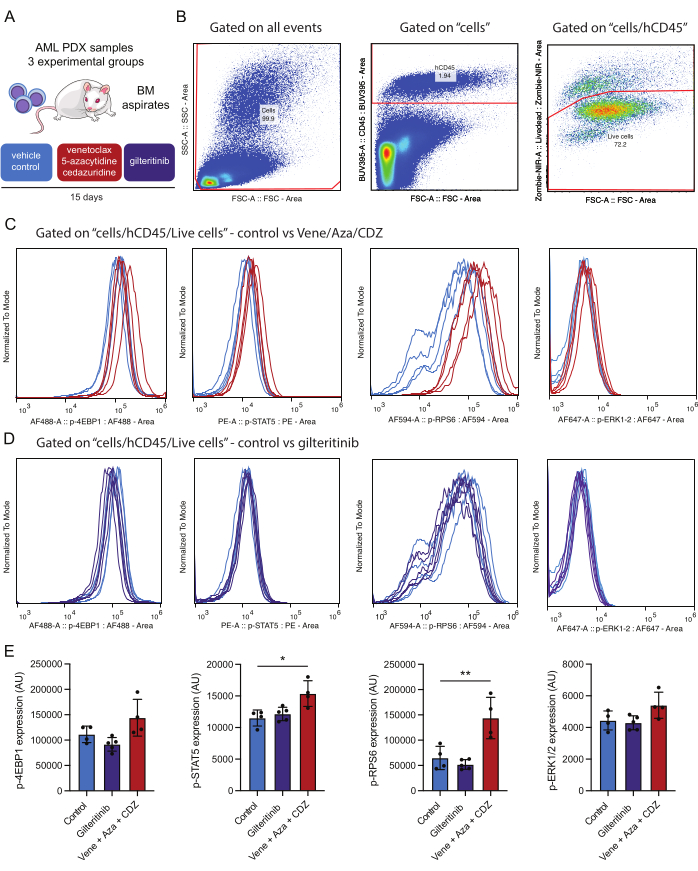
图 4:免疫状态活骨髓 AML 细胞后细胞内磷蛋白的检测和分析工作流程。 (A) 用载体(对照)或维奈托克、5-氮杂胞苷和西达珠啶 (vene/aza/CDZ) 或吉尔替尼处理植入患者捐赠的 AML 细胞的 NSG-SGM3 小鼠。15 天后,处理骨髓 (BM) 抽吸物。(B) 代表治疗后 15 天分析活 AML 细胞(例如,hCD45/Zombie-NIR 阳性)的门控策略。(C,D) 表示从用维奈托克/5-氮杂胞苷/西达珠啶或载体 (B) 或吉替替尼或载体 (C) 处理的小鼠中分离的 10,000 个 AML 细胞中每种磷酸化抗体的信号正常化。迹线代表从用载体(浅蓝色)、vene/aza/CDZ(红色)或 gilteritinib(紫色)处理的对照小鼠中分离的 AML 细胞中的信号。(E) 直方图表示在三只小鼠和 SD 的活人 AML CD45 + 细胞上测试的每种磷蛋白染色强度的平均值变化。误差线表示标准偏差。星号表示通过方差分析评估的染色强度存在显着差异, p 值低于 0.05 (*) 和 0.01 (**)。 请单击此处查看此图的较大版本。
| 抗体 | 荧光染料 | 稀释 |
| p-RPS6 (Ser240/244) | AF594 系列 | 1/50 |
| p-4EBP1 (Thr37/46) | AF488 系列 | 1/50 |
| p-STAT5 (Tyr694) | 体育 | 1/100 |
| p-ERK1/2 (Thr202/Tyr204) | AF647 系列 | 1/100 |
| 兔 IgG 对照 | AF594 系列 | 1/50 |
| 兔 IgG 对照 | AF488 系列 | 1/50 |
| 兔 IgG 对照 | 体育 | 1/100 |
| 兔 IgG 对照 | AF647 系列 | 1/100 |
表 1:抗体的优化稀释度列表。
补充图 1: 代表性 AML PDX 样本中 p-STAT5、p-RPS6、p-ERK1/2 和 FSC-A 的比较。该图显示了小鼠“E9”中 p-STAT5、p-ERK 和 p-RPS6 之间关系的一个例子,在用维奈托克/5-阿扎胞苷/西达珠啶治疗第 15 天(结果来自 图 4C)。在该样品中,磷蛋白染色中最强的相关性似乎是 p-STAT5 和 p-RPS6 (A) 之间,它们在处理后在该实验组中均上调(图 4E)。p-STAT5 和 p-ERK (B) 之间的关系似乎较小。重要的是,细胞大小(使用 FSC-A 评估)并不是整体 p-STAT5 阳性的主要贡献者,这凸显了染色阳性不仅仅是细胞大小 (C) 的产物。 请点击此处下载此文件。
讨论
关键步骤
通过磷蛋白的特异性检测来研究复杂的信号通路,使用基于免疫学的技术需要严格控制实验变量22,样品制备细致,并采用互补技术进行验证。整合这些做法可确保数据的可重复性、精确性和稳健性,最终有助于得出更可靠的生物学结论。这些努力不仅提高了该方法的科学严谨性,而且拓宽了其在细胞信号转导和调控的复杂研究中的适用性。适当的麻醉和轻柔的处理对于最大限度地减少生理压力至关重要,生理压力可以显着改变实验结果,尤其是在专注于免疫反应或信号通路的研究中。确保适当的镇痛方案进一步有助于维护动物福利,同时防止可能干扰数据的疼痛相关压力。在手术过程中保持无菌条件对于预防感染至关重要,感染可能导致炎症反应并可能混淆实验结果。这包括对设备进行消毒,使用干净的手套,并对抽吸部位进行彻底消毒。
在生物样本的作过程中,磷酸化蛋白极易被磷酸酶去磷酸化22,23。为了在加工过程中保持磷酸化状态,必须立即固定。测试了两种不同的固定/透化方法:Cytofix/Cytoperm 试剂盒和方案中概述的常见甲醛/甲醇方法。其中,基于甲醇的方法提供了更清晰的结果和更亮的荧光信号,使其成为首选。固定后,样品可在 -20 °C 下短期储存或在 -80 °C 下长期储存。 在实验中,固定样品在 -80 °C 下储存长达三个月,可产生一致的结果。对于抗体染色,过夜孵育可以提高准确性,特别是对于细微的磷酸化变化,尽管这取决于具体实验和正在研究的药物效应。还在冰上测试了较短的 1 小时孵育,避光,这在某些情况下产生了可接受的结果。为确保准确评估背景噪声,建议使用同种型对照作为非特异性结合的参考,如图 3 所示。
技术的修改和故障排除
为了提高技术熟练程度,我们小组的学员在安乐死的小鼠身上练习进针技术,通过解剖可以确认正确的放置。活体动物程序由两名作员最有效地执行,其中一名作员可以专注于吸液,而一名助手则专门负责动物监测和样本处理任务。在极少数情况下,如果多次尝试后仍无法进行误吸,建议中止手术,因为每次尝试都会增加受伤的风险。对动物的术后监测同样重要。观察感染、疼痛或压力的迹象可确保小鼠的健康和研究的可靠性。住房条件应支持恢复,并提供适当的垫料和营养,以尽量减少外部压力。
对于流式细胞术分析,建议同时处理来自不同骨髓穿刺日的所有固定和保存的样品。由于处理天数或作人员的不同而导致的样品再水化和染色变化会影响细胞仪检测的荧光灵敏度。为确保结果一致,请优化细胞仪电压设置,将所有染色样品保持在检测范围内,然后再继续。Alexa Fluor 488 偶联的 p-4EBP1 蛋白在该检测组合的标记物中表现出最高的亮度,使其成为设置最大检测范围的可靠参考。虽然本方案中提供的抗体组合不需要补偿调整,但这可能会因所使用的光谱流式细胞仪而异。
局限性
该技术的主要限制之一是骨髓抽吸过程中提取的细胞数量。为确保可靠的结果,必须对足够的细胞进行染色,以便每个样品至少分析 10,000 个细胞。分析的细胞太少会导致样品之间的显著差异,从而影响数据的准确性和可解释性。确保足够数量的细胞对于稳健且可重复的机制研究至关重要。
对于数据分析,应用 图 3A 中所示的门控策略。首先,在排除双联体后,使用人 CD45 抗体与 BUV395 偶联来识别目标细胞。接下来,使用 Zombie NIR 完成活细胞的门控。最后,计算每种磷蛋白的中位荧光强度 (MFI)(图 3B)。使用相同的策略对所有磷酸化蛋白分析的所有细胞进行门控,确保 AML 细胞群之间的一致性和可比性。
该方法的另一个限制是可能存在背景噪声,这可能是由非特异性抗体结合、洗涤不充分、细胞自发荧光或透化不当引起的。这可能会影响信号特异性并降低磷酸流式细胞术分析的准确性。对于遇到这些问题的用户,建议进行额外的洗涤步骤以降低背景噪音,并且可以使用 Fc 封闭试剂来最大限度地减少非特异性结合。此外,死细胞荧光会干扰结果,因此必须使用活性染料。重要的是,为了进行准确分析,分析的细胞数量不应少于 500 个 AML 细胞,以确保可靠和可重复的结果。确保在染色过程中使用相似数量的细胞以保持样品之间的一致性也很重要。尽管存在这些限制,但仔细优化对照和设门策略可以提高方法的可靠性。
该技术的意义
骨髓穿刺技术已经发表3;然而,该协议中包括一项更新的技术,并解释了两个优点:改进的固定和使用双针方法来提高骨髓穿刺的精度和一致性,防止骨碎片堵塞针头的任何问题。对于纵向研究,股骨抽吸可以多次进行,提供了一种强大的方法来跟踪个体动物随时间推移的生物变化。建议在同一股骨上抽吸之间至少间隔一个月的恢复间隔,以允许足够的骨愈合和骨髓再生。当使用对侧股骨时,一周的较短间隔足以确保小鼠从镇痛和麻醉的作用中恢复过来,而不会引入过度的压力或生理变异。
总而言之,这种小鼠骨髓穿刺和流式细胞术相结合的技术为关键信号通路提供了有价值的见解,包括 JAK/p-STAT5、mTORC1/p-4EBP1、mTORC1/p-RPS6 和 MEK/p-ERK1/2。这些通路在 AML 的治疗耐药性中起着重要作用。该技术允许对同一只动物进行重复采样,从而能够在单细胞水平上实时监测疾病进展和治疗反应。
磷酸流式细胞术可捕获磷酸化事件并保留细胞异质性 4,23,24。这使得它对于了解特定白血病亚群中细胞对治疗的动态反应特别有价值。
未来的应用
该方案为研究治疗适应的潜在机制和 AML 耐药性的出现提供了有价值的工具,为更深入的见解和潜在的治疗进展铺平了道路。未来的研究可以将这种方法与单细胞转录组学或蛋白质组学相结合,以进一步剖析驱动耐药性和疾病进展的分子机制25。此外,将这种方法应用于其他血液系统恶性肿瘤或炎症性疾病可能会扩大其在转化研究中的影响。
通过改进该方案并解决其局限性,这种方法可以成为研究血液疾病中磷蛋白信号传导的标准方法,最终有助于开发更有效的治疗策略。总之,该方案为研究治疗适应的潜在机制和 AML 耐药性的出现提供了有价值的工具,为更深入的见解和潜在的治疗进展铺平了道路。
披露声明
作者没有什么可披露的。
致谢
这项工作得到了科尔基金会对 LH 和 FEM 的过渡补助金的支持,以及加拿大白血病和淋巴瘤协会和加拿大卫生研究院 (PJT-186019) 对 LH 和 FEM 的资助。FEM 是 FRSQ Junior 2 临床科学家,LH 是 FRSQ Junior 2 科学家。VG 拥有 Cole 基金会的博士奖学金。 图 1 是根据许可协议使用 BioRender 创建的。使用 FlowJo 软件生成流式细胞术图。特别感谢 Colin Crist 博士和 Victoria Richard 允许使用他们的动物手术设施。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL syringes 25G x 5/8 TW | BD Biosciences | #309626 | Syringes for bone marrow aspiration |
| 1.7 mL Microcentrifuge Tubes | FroggaBio | #LMCT1.7B | To aliquot the cells recovered by bone marrow aspiration |
| BD Horizon Brilliant Stain Buffer | BD Biosciences | #563794 | For staining processes |
| Buprenorphine | Fidelis Animal Health | Ethiqa XR | Analgesia for mice |
| CellDrop FL Unlimited | FroggaBio | #CellDrop FL- UNLTD | For cell count |
| D-PBS | Wisent Inc. | #311-425-CL | Media for cells recovered by bone marrow aspiration |
| Eppendorf Centrifuge 5427 R | Millipore Sigma | #EP5429000260 | |
| Fetal Bovine Serum Heat Inactivated Premium CA | Wisent Inc. | #090-450 | For staining processes |
| Formaldehyde solution | Millipore Sigma | #F1635 | Cells Permeabilization |
| humanCD45 [HI30] antibody | BD Biosciences | #563792 | Antibody coupled with BUV395 |
| ID7000 Spectral Cell Analyzer | Sony | Spectral flow cytometer analyzer | |
| Isoflurane 99.9% liquid | McKesson | #803250 | Anesthesia for mice |
| Isospire (isoflurane) Inhalation Anesthetic | Dechra | Anesthesia for mice | |
| Live/dead AO/PI | FroggaBio | CD-AO/PI-1.5 | For cell count |
| Live/dead Zombie NIR | BioLegend+B6:C12 | #423106 | For spectral flow cytometry |
| Methanol solution | Millipore Sigma | #179957 | Cells Fixation |
| P-4EBP1 (Thr37/46) [236B4] antibody | Cell Signaling Technology | #2846 | Antibody coupled with Alexa Fluor 488 |
| p-Erk1/2 (Thr202/Tyr204) [197G2] antibody | Cell Signaling Technology | #13148 | Antibody coupled with Alexa Fluor 647 |
| p-RPS6 (Ser240/244) [D68F8] antibody | Cell Signaling Technology | #9468 | Antibody coupled with Alexa Fluor 594 |
| p-STAT5 (Tyr694) [D47E7] antibody | Cell Signaling Technology | #14603 | Antibody coupled with PE |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #2975 | Antibody coupled with Alexa Fluor 488 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #2985 | Antibody coupled with Alexa Fluor 647 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #8760 | Antibody coupled with Alexa Fluor 594 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #5742S | Antibody coupled with PE |
| Sanitizing wipes | United Canada | #UCDWPR-9022 | Disinfection for bone marrow aspiration |
参考文献
- Ferrara, F., Schiffer, C. A. Acute myeloid leukaemia in adults. Lancet. 381 (9865), 484-495 (2013).
- Döhner, H., et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 129 (4), 424-447 (2017).
- Chung, Y. R., Kim, E., Abdel-Wahab, O. Femoral bone marrow aspiration in live mice. J Vis Exp. (89), e51660(2014).
- Haas, A., Weckbecker, G., Welzenbach, K. Intracellular Phospho-Flow cytometry reveals novel insights into TCR proximal signaling events. A comparison with Western blot. Cytometry A. 73 (9), 799-807 (2008).
- Perbellini, O., Cavallini, C., Chignola, R., Galasso, M., Scupoli, M. T. Phospho-specific flow cytometry reveals signaling heterogeneity in t-cell acute lymphoblastic leukemia cell lines. Cells. 11 (13), 2072(2022).
- Kornblau, S. M., et al. Simultaneous activation of multiple signal transduction pathways confers poor prognosis in acute myelogenous leukemia. Blood. 108 (7), 2358-2365 (2006).
- Perl, A. E. The role of targeted therapy in the management of patients with AML. Hematology Am Soc Hematol Educ Program. 2017 (1), 54µ65(2017).
- Márton, A., et al. The roles of phosphorylation of signaling proteins in the prognosis of acute myeloid leukemia. Pathol Oncol Res. 30, 1611747(2024).
- Levis, M. FLT3 mutations in acute myeloid leukemia: what is the best approach in 2013. Hematology Am Soc Hematol Educ Program. 2013, 220-226 (2013).
- Roux, P. P., Topisirovic, I. Signaling pathways involved in the regulation of mRNA translation. Mol Cell Biol. 38 (12), e00070-e00118 (2018).
- Nepstad, I., Hatfield, K. J., Grønningsæter, I. S., Reikvam, H. The PI3K-Akt-mTOR signaling pathway in human Acute Myeloid Leukemia (AML) Cells. Int J Mol Sci. 21 (8), ijms21082907(2020).
- Jia, X., Zhou, H. Phospho-eIF4E: A new target for acute myeloid leukemia. Curr Protein Pept Sci. 22 (4), 328-335 (2021).
- Ghosh, J., Kapur, R. Role of mTORC1-S6K1 signaling pathway in regulation of hematopoietic stem cell and acute myeloid leukemia. Exp Hematol. 50, 13-21 (2017).
- Park, H. J., et al. Therapeutic resistance in acute myeloid leukemia cells is mediated by a novel ATM/mTOR pathway regulating oxidative phosphorylation. Elife. 11, 79940(2022).
- Oki, T., et al. Imaging dynamic mTORC1 pathway activity in vivo reveals marked shifts that support time-specific inhibitor therapy in AML. Nat Commun. 12 (1), 245(2021).
- Lee, H. J., Daver, N., Kantarjian, H. M., Verstovsek, S., Ravandi, F. The role of JAK pathway dysregulation in the pathogenesis and treatment of acute myeloid leukemia. Clin Cancer Res. 19 (2), 327-335 (2013).
- Liu, A. C. H., et al. Targeting STAT5 signaling overcomes resistance to IDH Inhibitors in acute myeloid leukemia through suppression of stemness. Cancer Res. 82 (23), 4325-4339 (2022).
- Sung, P. J., Sugita, M., Koblish, H., Perl, A. E., Carroll, M. Hematopoietic cytokines mediate resistance to targeted therapy in FLT3-ITD acute myeloid leukemia. Blood Adv. 3 (7), 1061-1072 (2019).
- Song, P., Yang, F., Jin, H., Wang, X. The regulation of protein translation and its implications for cancer. Signal Transduct Target Ther. 6 (1), 68(2021).
- This Standard Operating Procedure (SOP) describes methods for anesthetizing mice. , McGill University. https://www.mcgill.ca/research/files/research/110-mouse_anesthesia-2024-06-17.pdf (2024).
- Tech Team Tips: Preparing a Sample with AO/PI. , DeNovix. https://www.denovix.com/webinars/tech-team-tips-preparing-a-sample-with-ao-pi (2021).
- Suni, M. A., Maino, V. C. Flow cytometric analysis of cell signaling proteins. Methods Mol Biol. 717, 155-169 (2011).
- Krutzik, P. O., Irish, J. M., Nolan, G. P., Perez, O. D. Analysis of protein phosphorylation and cellular signaling events by flow cytometry: techniques and clinical applications. Clin Immunol. 110 (3), 206-221 (2004).
- Chen, W., Luu, H. S. Immunophenotyping by multiparameter flow cytometry. Methods Mol Biol. 1633, 51-73 (2017).
- Perez, O. D., Nolan, G. P. Phospho-proteomic immune analysis by flow cytometry: From mechanism to translational medicine at the single-cell level. Immunol Rev. 210, 208-228 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。