Method Article
Cytométrie phosphoflow intracellulaire des xénogreffes dérivées de patients atteints de leucémie myéloïde aiguë
Dans cet article
Résumé
Ici, une méthode basée sur la cytométrie phosphoflow est décrite pour analyser la signalisation en aval des voies mTORC1, JAK/STAT5 et MAPK dans des cellules de leucémie myéloïde humaine aiguë xénogreffées chez la souris et obtenues à partir d’aspirations de moelle osseuse. Les niveaux de p-STAT5, p-4EBP1, p-RPS6 et p-ERK1/2 sont mesurés simultanément à l’aide d’un cytomètre en flux spectral de nouvelle génération à haute sensibilité.
Résumé
Pour s’adapter et résister aux traitements approuvés, les cellules de la leucémie myéloïde aiguë (LMA) activent des voies moléculaires spécifiques qui entraînent des changements dans l’expression des gènes, les niveaux de protéines et l’activité. Dans ce protocole, une approche est rapportée pour explorer des cibles phosphorylées en aval de la signalisation oncogénique dans la LMA : p-STAT5 (Tyr694), p-4EBP1 (Thr37/46), p-RPS6 (Ser240/244) et p-ERK1/2 (Thr202/Tyr204). Cette méthode permet d’évaluer comment ces voies – régulateurs majeurs du maintien de la souche, de l’évasion immunitaire, de la synthèse des protéines et de l’adaptation au stress oxydatif et métabolique – sont modulées par un ou plusieurs composés testés dans des cellules de moelle osseuse prélevées sur des souris vivantes par aspiration avant et après la phase de traitement. Cette méthode peu invasive préserve l’intégrité cellulaire et réduit le stress par rapport aux techniques de broyage des os, qui peuvent induire des dommages et potentiellement affecter les résultats expérimentaux. Afin d’optimiser la coloration intracellulaire des anticorps pour l’analyse cytométrique en flux, un protocole a été développé utilisant la fixation au paraformaldéhyde et la perméabilisation au méthanol. Cette approche garantit une grande précision de coloration et minimise le bruit de fond, ce qui permet une détection fiable des marqueurs de signalisation intracellulaires. L’un des principaux avantages de ce protocole est le développement d’un panel d’anticorps multiparamétriques, permettant d’évaluer simultanément les quatre voies au sein d’un même échantillon. À l’aide d’un cytomètre en flux spectral de nouvelle génération à haute sensibilité, des changements dynamiques dans l’activation des voies ont été observés en fonction des conditions de traitement par rapport aux niveaux de base avant le traitement chez les mêmes souris. Cette méthodologie permet une analyse in vivo précise de la modulation de la voie de signalisation dans des échantillons de moelle osseuse de xénogreffe dérivée de patients sans nécessiter l’euthanasie des animaux, fournissant ainsi des informations précieuses sur les mécanismes adaptatifs des cellules LMA, et peut guider l’évaluation des stratégies thérapeutiques visant à cibler ces voies pour surmonter la résistance.
Introduction
La leucémie myéloïde aiguë (LMA) est une tumeur maligne hématologique agressive caractérisée par l’accumulation de cellules progénitrices myéloïdes immatures dans la moelle osseuse et le sang périphérique. Cela perturbe l’hématopoïèse normale, entraînant une cytopénie potentiellement mortelle et des complications systémiques. Bien que les progrès réalisés dans les schémas chimiothérapeutiques, les thérapies ciblées et la greffe de cellules souches hématopoïétiques aient amélioré les résultats pour certains patients, dans l’ensemble, les taux de survie à 5 ans restent autour de 30 %, avec un pronostic plus sombre chez les patients plus âgés ou ceux ayant des profils génétiques défavorables1. L’émergence fréquente d’une résistance aux médicaments, qui contribue à la rechute et àl’échec du traitement, constitue un défi important dans la prise en charge de la LAM 2. Cela souligne l’importance d’acquérir une compréhension plus approfondie des mécanismes moléculaires et cellulaires à l’origine de la progression et de la résistance thérapeutique de la LAM.
Pour relever ce défi, une nouvelle méthode est présentée pour les aspirations de la moelle osseuse couplée à la cytométrie phosphoflow intracellulaire multiplexe, offrant un outil puissant pour étudier les voies de signalisation intracellulaire dans des modèles de xénogreffes dérivées de patients atteints de LMA (PDX) (Figure 1A,B). Bien que l’aspiration de la moelle osseuse dans des modèles PDX ait déjà été décrite3, ce protocole a été optimisé pour préserver les cellules leucémiques pour l’analyse phosphoflow. L’objectif global de cette méthode est de fournir une procédure peu invasive qui est applicable longitudinalement pendant la progression de la leucémie et la réponse thérapeutique avec une résolution unicellulaire. En permettant un échantillonnage répété sur le même animal, cette technique offre une représentation plus précise de l’évolution de la maladie sous traitement. La raison d’être du développement de cette technique réside dans la nécessité d’une évaluation dynamique à haute résolution de la signalisation intracellulaire dans les cellules LMA. Les méthodes traditionnelles, telles que le western blot, nécessitent un grand nombre de cellules, manquent de résolution de cellule unique et de multiplexage4. En revanche, la cytométrie phosphoflow préserve l’hétérogénéité cellulaire et permet la détection de plusieurs protéines de signalisation phosphorylées dans des sous-populations leucémiques distinctes5, offrant des informations clés sur l’activation des voies en réponse aux traitements de la LMA.
Au cœur de la biologie de la LMA se trouvent les voies de signalisation qui régulent la prolifération cellulaire, la survie et l’adaptation métabolique, y compris la protéine kinase activée par les mitogènes (MAPK), la cible mécaniste du complexe de rapamycine 1 (mTORC1) et les voies de signalisation Janus Kinase/Signal Transducer and Activator of Transcription 5 (JAK/STAT5). Au-delà de leur rôle dans la prolifération et la survie des cellules leucémiques, ces voies sont également impliquées de manière critique dans des processus oncogéniques clés tels que le maintien de la souche, l’évasion immunitaire et l’adaptation au stress oxydatif et métabolique4. En plus de favoriser la croissance et la survie cellulaires, la diaphonie entre ces voies orchestre des processus critiques tels que la transcription, la traduction et le métabolisme cellulaire, permettant aux cellules LMA de maintenir leur croissance et de résister aux signaux apoptotiques, même face aux interventions thérapeutiques 6,7 (Figure 1A).
La voie MAPK, qui comprend des effecteurs clés tels que p-ERK1/2 (Extracellular signal regulated kinase 1/2), joue un rôle crucial dans l’intégration des signaux extracellulaires, tels que les facteurs de croissance et les cytokines, pour réguler la prolifération cellulaire et la survie. L’activation d’ERK1/2 se produit par le biais de la cascade RAS (Rat Sarcoma)-RAF (Fastest Accelerated Fibrosarcoma)-MEK (MAPK/ERK Kinase)-ERK, où RAS-GTP recrute RAF, conduisant à une phosphorylation séquentielle de MEK1/2 puis de ERK1/2 à Thr202/Tyr204. Une fois phosphorylé, ERK1/2 se dimérise et se déplace vers le noyau, où il phosphoryle des facteurs de transcription tels que MYC (homologue de l’oncogène viral de la myélocytomatose), ELK1 (ETS Like-1 Protein) et AP-1 (Activator Protein-1), favorisant la prolifération cellulaire, le blocage de la différenciation et la survie8. Dans la LAM, les mutations de FLT3 (tyrosine kinase 3 de type fms), RAS ou KIT entraînent fréquemment une activation constitutive de ERK 9,10 (Figure 1A).
Les mutations de FLT3, RAS ou KIT provoquent également la régulation positive de la signalisation mTORC1, qui permet la croissance de la LMA et la résistance thérapeutique en soutenant les processus oncogéniques tels que le recâblage métabolique, la modulation de la synthèse des protéines, la biogenèse des ribosomes et l’autophagie11. Grâce à la régulation de la traduction de l’ARNm, mTORC1 facilite la production de protéines oncogènes et d’autres facteurs essentiels à la progression de la LAM. Un groupe clé de substrats mTORC1 comprend les 4E-BP (protéines de liaison au facteur d’initiation eucaryote 4E). Dans leur état hypophosphorylé, les 4E-BP se lient à eIF4E (facteur d’initiation eucaryote 4E), inhibant la traduction dépendante de la coiffe. La phosphorylation de 4E-BP1 à Thr37/46 par mTORC1 provoque la libération d’eIF4E, permettant l’initiation de la traduction pour les principaux ARNm oncogènes, tels que MYC, CCND1 (Cyclin D1) et MCL-1 (leucémie à cellules myéloïdes 1), favorisant ainsi la prolifération leucémique et la survie 8,12. De plus, la phosphorylation de RPS6 à Ser240/244, médiée par S6K1 (protéine ribosomique S6 kinase bêta-1) en aval de mTORC1, améliore la biogenèse des ribosomes et la traduction de l’ARNm, augmentant la synthèse des protéines nécessaires à l’adaptation métabolique, à la résistance au stress et à la prolifération rapide 8,13. Notamment, l’activité de mTORC1 est étroitement liée à l’adaptation métabolique, une stratégie de survie essentielle employée par les cellules AML sous stress thérapeutique 13,14,15 (Figure 1A).
La voie JAK/STAT5 est un autre axe de signalisation crucial dans la LAM, en particulier dans les cas de mutations affectant les récepteurs de cytokines ou les médiateurs de signalisation tels que JAK2, FLT3 et CALR (calréticuline)16,17. STAT5 est activé en réponse à la signalisation des cytokines par des récepteurs tels que FLT3 et JAK2. Lors de la liaison du ligand, les Janus kinases associées (JAKs) phosphorylent STAT5 à Tyr694. STAT5 phosphorylé se dimérise et se déplace vers le noyau, où il se lie à des séquences d’ADN spécifiques pour réguler la transcription des gènes impliqués dans la survie, la prolifération et la différenciation cellulaires8. Dans la LAM, l’activation constitutive de STAT5, souvent due à des mutations de FLT3 ou JAK2, conduit à l’expression persistante de gènes qui favorisent la leucémogenèse18 (Figure 1A).
Au-delà de leurs contributions individuelles, ces voies convergent pour réguler à la fois la transcription et la traduction, façonnant le protéome des cellules AML de manière à favoriser la survie et la résistance. En particulier, la traduction de l’ARNm est en train de devenir un facteur clé de la physiopathologie de la LAM, car elle permet la production rapide de protéines oncogéniques et de facteurs de réponse au stress qui permettent aux cellules de la LMA de s’adapter aux défis environnementaux et d’échapper aux effets des thérapies ciblées. La dérégulation de la machinerie de traduction, comme les facteurs d’initiation eucaryotes (FEe) ou les protéines ribosomiques, a été impliquée dans la résistance thérapeutique et le mauvais pronostic dans la LMA19. Une étude détaillée des rôles des voies MAPK, mTORC1 et JAK/STAT5 dans la régulation transcriptionnelle et translationnelle est essentielle pour obtenir une compréhension complète des mécanismes moléculaires sous-jacents à la progression et à la résistance de la LMA. Ces connaissances sont essentielles pour identifier de nouveaux biomarqueurs de la réponse au traitement et concevoir de nouvelles stratégies thérapeutiques qui ciblent ces voies pour surmonter la résistance. Cet article fournit un protocole spécifiquement conçu pour étudier ces réseaux de signalisation dans des modèles de xénogreffes dérivées de patients atteints de LMA (PDX).
L’un des principaux avantages de ce protocole est l’intégration de l’aspiration de la moelle osseuse avec la cytométrie phosphoflow intracellulaire, permettant une évaluation dynamique et peu invasive de l’activation de la voie de signalisation dans des modèles de xénogreffes dérivées de patients atteints de LMA (PDX). Ceci est particulièrement utile pour surveiller l’état d’activation de voies clés telles que MAPK, mTORC1 et JAK/STAT5 en réponse à des thérapies ciblées. La combinaison de ces techniques permet d’acquérir une compréhension complète et à haute résolution de la biologie de la LMA, ce qui contribue finalement au développement de stratégies thérapeutiques plus efficaces.
Protocole
Les expériences suivantes ont été réalisées avec l’approbation du Comité de protection des animaux de l’Université McGill (IRSC PJT-186019) et du Comité d’examen institutionnel de l’Hôpital général juif (11-047). Dans ce protocole, des souris mâles NOD-scid IL2Rg^null-3/GM/SF (NSGS), âgées de 8 semaines à 6 mois et pesant de 20 à 30 g, ont été préalablement transplantées avec des cellules de LMA dérivées de patients humains. Les détails des réactifs et de l’équipement utilisés dans cette étude sont répertoriés dans la table des matériaux.
1. Ponction de la moelle osseuse
ATTENTION : Les précautions de sécurité entourant l’utilisation des aiguilles doivent être suivies.
- Analgésie périopératoire : 1 à 4 h avant l’aspiration de la moelle osseuse, injecter aux souris par voie sous-cutanée (s.c.) 0,1 mg/kg de buprénorphine à libération lente. Cela garantit une analgésie jusqu’à 72 heures après l’intervention.
- Préparez la zone chirurgicale sous la hotte à flux laminaire à l’aide d’un tampon chirurgical, d’une tondeuse à cheveux, d’une lampe chauffante et de tout le matériel nécessaire à la ponction de la moelle osseuse (seringues de 25 g, tubes de microcentrifugation de 1,5 mL contenant 0,5 mL de PBS sur glace, écouvillons d’isopropanol à 70 %). Fixez le cône nasal pour l’inhalation d’isoflurane à l’aide d’un ruban adhésif (figure 2A).
- Préparez deux seringues de 25 G pour chaque aspiration, une pour la ponction osseuse (« aiguille sèche ») et une dont le moyeu a été rincé avec du PBS pour l’aspiration (« aiguille rincé »).
- Anesthésez la souris à l’aide de l’inhalation d’isoflurane délivrée par un vaporisateur certifié, conformément aux instructions du fabricant et aux directives vétérinaires. Les procédures locales peuvent varier. À titre de référence, ce protocole suivait les procédures opératoires standard de l’Université McGill pour l’anesthésie chez la souris20.
- Confirmer la profondeur de l’anesthésie par l’absence de réponse au pincement du pied et à la relaxation musculaire. Appliquez une pommade vétérinaire sur les yeux pour prévenir la sécheresse pendant que l’animal est sous anesthésie. Surveillez en permanence la fréquence respiratoire pendant l’anesthésie.
- Rasez toute la jambe où l’aspiration sera effectuée à l’aide de la tondeuse à cheveux. Désinfectez le site d’aspiration (fémur) à l’aide d’un tampon antiseptique saturé d’alcool isopropylique (Figure 2B).
- Exposez la surface articulaire du fémur, où se trouve le site de ponction, en pliant le genou et en immobilisant la jambe à l’aide de la main non dominante. Placez le pouce sur le tibia, l’index sur le fémur et le majeur, en stabilisant le tout sur la face externe des deux os (Figure 2C).
REMARQUE : Assurez-vous d’un positionnement très stable de la jambe à l’aide de la main non dominante pour éviter tout mouvement de la jambe pendant l’aspiration qui pourrait entraîner une défaillance ou des blessures. Si l’immobilisation de la jambe n’est pas stable, repositionnez la main et réessayez avant toute ponction. - Tout en immobilisant avec la main non dominante, désinfectez à nouveau la zone du genou avec de l’alcool isopropylique (Figure 2C) pour éloigner les poils restants afin d’améliorer la visualisation de la structure osseuse.
- À l’aide de la première seringue sèche de 25 G, créez un trou dans la surface articulaire fémorale en la positionnant au milieu de l’articulation du fémur et en la faisant pivoter sans forcer (Figure 2D,E). Assurez-vous que l’aiguille de la seringue est complètement alignée (déviation de 0°) avec l’axe longitudinal du fémur pour pénétrer correctement dans la moelle.
REMARQUE : Maintenez cet alignement pour assurer une entrée en douceur sans causer de dommages inutiles aux tissus environnants. Lorsque l’aiguille pénètre au milieu de l’os fémoral, une légère diminution de la résistance indique une pénétration réussie dans la cavité médullaire (Figure 2F). Évitez d’appliquer une force excessive sur l’aiguille à cette étape, car cela pourrait entraîner une perte d’alignement correct, une fracture ou un traumatisme. En utilisant un mouvement de forage rotatif, les chances sont plus grandes que l’aiguille suive le chemin de moindre résistance et pénètre correctement dans la cavité fémorale. Une aiguille correctement positionnée à l’intérieur du fémur doit rester verticale même lorsque la main qui la tient est retirée. - Une fois dans la moelle, retirez progressivement la seringue en la tournant (Figure 2G) et insérez la deuxième seringue rincée dans le trou pratiqué par la première aiguille (Figure 2H,I).
REMARQUE : Une deuxième seringue est utilisée car la première est souvent bloquée par l’os lors du forage. - Appliquez le vide sur la seringue insérée dans le fémur tout en tournant doucement et en retirant progressivement la seringue. Environ 10 à 20 μL de moelle osseuse doivent être visibles à l’intérieur du moyeu de la seringue (figure 2J).
REMARQUE : Si nécessaire, faites avancer doucement l’aiguille à l’intérieur de l’os pour optimiser l’extraction de la moelle. - Transférez la moelle osseuse en rinçant le contenu de la seringue dans le tube de microcentrifugation réfrigéré contenant 500 μL de PBS (figure 2K). Gardez la glace et passez aux étapes 2 et 3 dès que possible.
- Appliquez une légère pression sur le site de ponction pendant 30 s à l’aide d’un écouvillon d’isopropanol pour arrêter tout saignement (figure 2L).
- Placez la souris dans une cage de récupération propre réchauffée à l’aide d’une lampe chauffante. Surveillez la respiration et la mobilité jusqu’à ce que l’animal soit réveillé et complètement rétabli avant de le placer dans des cages communes avec le reste des souris. Vérifiez s’il y a des signes de saignement.
2. Coloration vivante/morte et marqueur de surface
REMARQUE : Gardez les cellules sur la glace tout au long de la procédure. Préparez des mélanges maîtres de solutions de coloration d’anticorps (pour les étapes 2.4 et 2.7) avant les étapes 2 et 3, en les maintenant à 4 °C à l’abri de la lumière. Préparez une solution fraîche de formaldéhyde à 1,6 % (étape 3.1) et une solution de méthanol à 100 % à -20 °C (étape 3.6).
- Comptez les cellules viables à l’aide d’orange d’acridine/iodure de propidium (AO/PI) avec le compteur de cellules21.
- Transférez le volume approprié pour 1 million de cellules dans un nouveau tube de 1,5 ml. Si le volume n’est pas suffisant, prenez tout le volume. Regrouper les cellules et l’aliquote restantes dans 3 tubes répétés (1 M chacun) pour la coloration de contrôle des isotypes et 1 tube pour le contrôle non coloré.
- Cellules de centrifugation à 500 x g pendant 5 min à 4°C. Aspirez doucement et jetez le surnageant à l’aide d’un système d’aspiration sous vide.
- Ajouter 200 μL par échantillon de solution de coloration cellulaire fluorescente diluée 1/100 dans du PBS pour marquer les cellules mortes. Remettez doucement les cellules en suspension à l’aide de la pipette. Faites de même avec les tubes supplémentaires pour la coloration de contrôle des isotypes.
- Incuber sur glace pendant 10 min à l’abri de la lumière.
- Centrifuger les cellules à 500 x g pendant 5 min à 4 °C. Aspirez doucement et jetez le surnageant à l’aide d’un système de vide.
- Ajouter 100 μL par échantillon d’anticorps hCD45-BUV395 dilué 1/100 dans du PBS contenant 2 % de sérum fœtal bovin pour marquer les cellules hématopoïétiques humaines. Faites de même avec les tubes supplémentaires conservés pour les contrôles d’isotype.
- Incuber sur glace pendant 15 min à l’abri de la lumière. Passez immédiatement à l’étape 3.
3. Fixation et perméabilisation
- Préparez une solution fraîche de formaldéhyde/PBS à 1,6 % : Pour chaque échantillon, mélangez 29,5 μL de solution mère de formaldéhyde à 37 % + 970,5 μL de PBS (prévoyez un peu de volume supplémentaire par précaution). Conservez la solution de formaldéhyde/PBS à 1,6 % à température ambiante.
ATTENTION : Le formaldéhyde doit être manipulé dans une hotte chimique et éliminé conformément aux réglementations de sécurité institutionnelles. - Centrifuger les cellules à 500 x g pendant 5 min à 4 °C. Aspirez et jetez le surnageant à l’aide d’un système de vide.
- Mettre en suspension dans 1 mL de solution de formaldéhyde/PBS à 1,6 %.
- Incuber 10 min à température ambiante, à l’abri de la lumière.
- Centrifuger les cellules à 500 x g pendant 5 min à 4 °C. Aspirez et jetez le surnageant à l’aide d’un système de vide.
- Ajouter 1 ml de méthanol 100 % refroidi à -20 °C directement dans le tube.
- Incuber les échantillons à -20 °C pendant 30 min à l’abri de la lumière.
REMARQUE : À ce stade, il est possible de stocker des cellules fixes et perméabilisées à -80 °C jusqu’à un mois avant l’analyse.
4. Coloration au phosphoflow
REMARQUE : Le panel d’anticorps suivant a été validé à l’aide du cytomètre en flux équipé des lasers suivants : 320 nm, 355 nm, 405 nm, 488 nm, 561 nm, 637 nm et 808 nm. Ce panel doit être revalidé si différents cytomètres sont utilisés avec différentes configurations de laser et de détecteur.
- Préparez une solution maîtresse de mélange d’anticorps avec les dilutions suivantes dans un tampon de coloration disponible dans le commerce (tableau 1), en calculant un volume de 50 μL pour chaque échantillon. Conserver à 4 °C à l’abri de la lumière.
- Pour les lavages (étapes 4.8, 4.10), conservez le PBS sur de la glace (2 ml pour chaque échantillon).
- Préparer une deuxième solution de mélange maître pour les répétitions techniques de contrôle des isotypes dans le tampon de coloration (tableau 1), en calculant un volume de 50 μL pour chaque échantillon. Conserver à 4 °C à l’abri de la lumière. Un minimum de deux échantillons de contrôle isotype est recommandé pour la reproductibilité technique.
- Centrifuger les cellules à partir de l’étape 3.7 à 500 x g pendant 5 min à 4 °C. Aspirez et jetez le surnageant à l’aide d’un système de vide.
REMARQUE : Après fixation et perméabilisation, les cellules peuvent apparaître plus translucides. - Ajouter 50 μL de solution de mélange d’anticorps (étape 4.1) ou de solution de mélange de contrôle d’isotype (étape 4.2). Remettez doucement les cellules en suspension à l’aide d’une pipette.
- Incuber tous les échantillons pendant la nuit à 4 °C à l’abri de la lumière.
- Cellules de centrifugation à 500 x g pendant 5 min à 4 °C. Aspirez et jetez le surnageant à l’aide d’un système de vide.
- Laver avec 1000 μL de PBS en remettant doucement en suspension avec la pipette.
- Cellules de centrifugation à 500 x g pendant 5 min à 4 °C. Aspirez et jetez le surnageant à l’aide d’un système de vide.
- Effectuez un second lavage avec 1000 μL de PBS en remettant doucement en suspension avec la pipette.
- Cellules de centrifugation à 500 x g pendant 5 min à 4 °C. Aspirez et jetez le surnageant à l’aide d’un système de vide.
- Remettre en suspension les échantillons dans 200 μL de PBS. Transfert dans des tubes ou des plaques FACS pour analyse par cytométrie en flux (figure 3).
- Préparez des contrôles de compensation unicolore avec des billes en incubant 0,1 μL de chaque anticorps avec des billes de compensation, conformément aux instructions du fabricant (voir le tableau des matériaux).
Résultats
La conception expérimentale vise à surveiller l’état de phosphorylation de protéines d’intérêt sélectionnées à différents moments, par exemple, 1 jour avant le début du traitement et 15 jours après le début du traitement. Cette ligne de base sert de contrôle critique pour vérifier la véracité des changements ultérieurs dans l’activation de la voie de signalisation après le traitement. Après quinze jours de traitement, une deuxième comparaison est effectuée pour évaluer la modulation des voies chez les souris traitées par rapport aux témoins traités par véhicule (Figure 4). Cette approche en deux étapes permet de distinguer les effets induits par le traitement de la variabilité initiale.
Pour cette étude, un modèle murin AML PDX a été utilisé. Les souris ont été transplantées avec des cellules LMA dérivées de patients caractérisées par les mutations suivantes : DNMT3AMR882H avec une fraction allélique variant (VAF) de 48 %, NPM1W288fs VAF 36 %, FLT3ITD VAF 10 % et IDH2R140Q VAF 44 %. Après la transplantation, trois semaines ont été accordées à la croissance tumorale avant de commencer le traitement. Les souris PDX transplantées avec le mutant FLT3 ont été traitées pendant quinze jours avec l’un des trois schémas suivants : placebo, giltéritinib (15 mg/kg par jour) ou une combinaison de vénétoclax (50 mg/kg par jour), de 5-azacitidine (2,5 mg/kg par jour) et de cedarizudine (3 mg/kg par jour) (figure 4A).
En ce qui concerne les résultats obtenus, il convient de mentionner que le traitement avec un régime à base de vénétoclax a entraîné une augmentation significative de la phosphorylation de STAT5 et RPS6, suggérant que ces voies contribuent à la résistance au traitement (Figure 4E). En revanche, le giltéritinib, un médicament ciblant FLT3, n’a pas réduit l’état de phosphorylation des effecteurs mutants de FLT3. Il est possible que dans l’échantillon de LAM testé, la présence de mutations secondaires supplémentaires autres que FLT3-ITD (par exemple, IDH2) contribue à l’activation de ces voies ou que le traitement médicamenteux de plus de deux semaines entraîne une élimination sélective des cellules LMA avec une diminution de la signalisation. Étant donné que toutes les phosphoprotéines analysées proviennent de la même population cellulaire, il est possible de comparer l’activation des phosphoprotéines. Dans cette expérience, la corrélation la plus forte dans la coloration des phosphoprotéines semble être entre p-STAT5 et p-RPS6 (Figure supplémentaire 1A), qui sont toutes deux régulées à la hausse dans ce groupe expérimental après traitement (Figure 4E). Il semble y avoir une relation moindre entre p-STAT5 et p-ERK (figure supplémentaire 1B). Il est important de noter que la taille des cellules (évaluée à l’aide de FSC-A) n’est pas un contributeur majeur à la positivité globale de p-STAT5, ce qui souligne que la positivité de la coloration n’est pas simplement un produit de la taille de la cellule (figure supplémentaire 1C). Ce cadre expérimental permet une évaluation complète des effets de ces traitements sur la modulation des voies de signalisation.
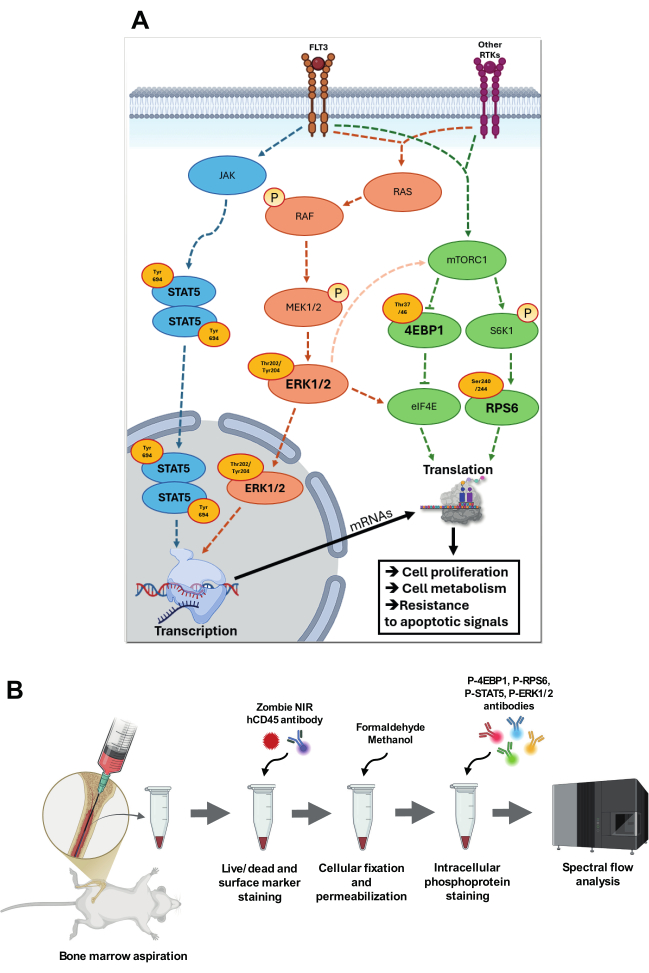
Figure 1 : Visualisation des voies de signalisation cibles et stratégie d’analyse. (A) Vue d’ensemble des voies de signalisation impliquant p-STAT5 (Tyr694), p-4EBP1 (Thr37/46), p-RPS6 (Ser240/244) et p-ERK1/2 (Thr202/Tyr204). Dans la voie p-STAT5, JAK subit une autophosphorylation, augmentant son activité catalytique, puis phosphoryle des résidus de tyrosine spécifiques, créant ainsi des sites d’amarrage pour les protéines STAT. STAT5 phosphorylé (Tyr694) s’homodimérise et se déplace dans le noyau, où il se lie à des éléments spécifiques sensibles à STAT dans les régions promotrices des gènes cibles. Dans la cascade RAS-RAF-MEK-ERK, l’autophosphorylation du récepteur FLT3 ou d’autres récepteurs tyrosine kinases (RTK) lors de la liaison du ligand conduit à l’échange de GDP pour GTP sur RAS, activant ainsi RAS. Le RAS-GTP activé recrute la RAF dans la membrane plasmique, où la RAF subit un changement de conformation et devient active. RAF phosphoryle et active MEK1/2, une kinase à double spécificité, qui à son tour phosphoryle ERK au niveau des résidus Thr202/Tyr204. ERK1/2 activé se déplace dans le noyau, où il phosphoryle des facteurs de transcription spécifiques. ERK1/2 est également capable, par des voies de signalisation intermédiaires, d’augmenter l’activité de mTORC1 et de phosphoryler eIF4E à des sites spécifiques pour augmenter l’activité de traduction. Activé par les nutriments et les facteurs de croissance via FLT3 et d’autres RTK, mTORC1 phosphoryle des cibles en aval comme S6K1 et 4E-BP1. S6K1, à son tour, phosphoryle RPS6, ce qui améliore la fonction des ribosomes et active la traduction. L’hyperphosphorylation de 4E-BP1 libère eIF4E, permettant l’assemblage du complexe d’initiation de traduction eIF4F et l’activation de la traduction dépendante de la coiffe. Toutes ces voies sont fortement impliquées dans la LAM, contribuant aux adaptations acquises en augmentant la prolifération cellulaire, le métabolisme et la résistance aux signaux apoptotiques. (B) présente les principales étapes du protocole couplé d’aspiration de la moelle osseuse et de coloration phosphoflow intracellulaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
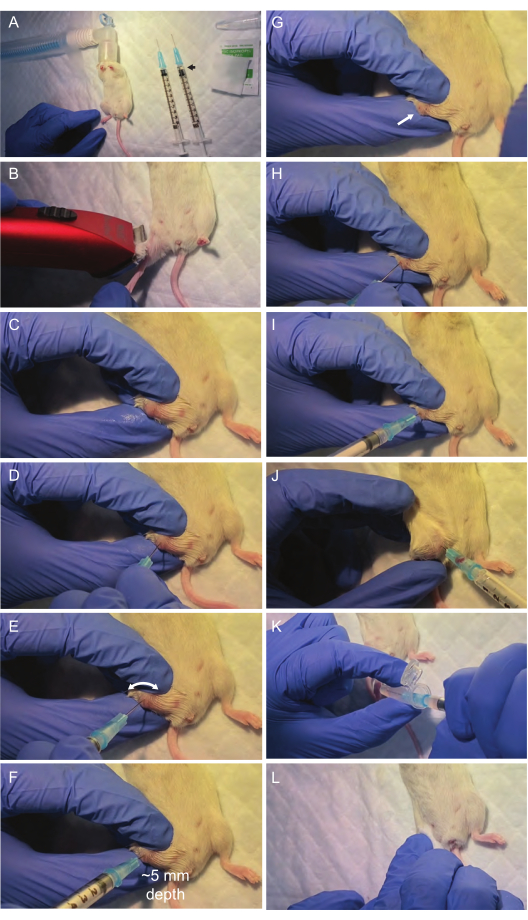
Figure 2 : Visualisation des étapes critiques de la procédure d’aspiration de la moelle osseuse. La zone chirurgicale et le matériel nécessaire sont mis en place sous une hotte à flux laminaire. Après une anesthésie par inhalation d’isoflurane (A), la surface articulaire fémorale est préparée pour l’aspiration (B,C). L’os fémoral est perforé par une première seringue alignée au milieu de l’os fémoral (D). Il est essentiel d’éviter d’appliquer une forte pression sur l’aiguille et d’effectuer plutôt un mouvement de forage rotatif ; Cela suffit généralement à l’aiguille pour perforer la surface de l’os et suivre le chemin de la cavité fémorale. Ensuite, la moelle osseuse est aspirée avec une deuxième seringue à travers le site de ponction (I, J). Après avoir transféré l’aspiration de moelle osseuse dans un tube de microcentrifugation (K), une légère pression est appliquée pour arrêter le saignement dans la zone (L), et la souris est placée dans une cage chaude et propre pour la récupération. Veuillez cliquer ici pour voir une version agrandie de cette figure.
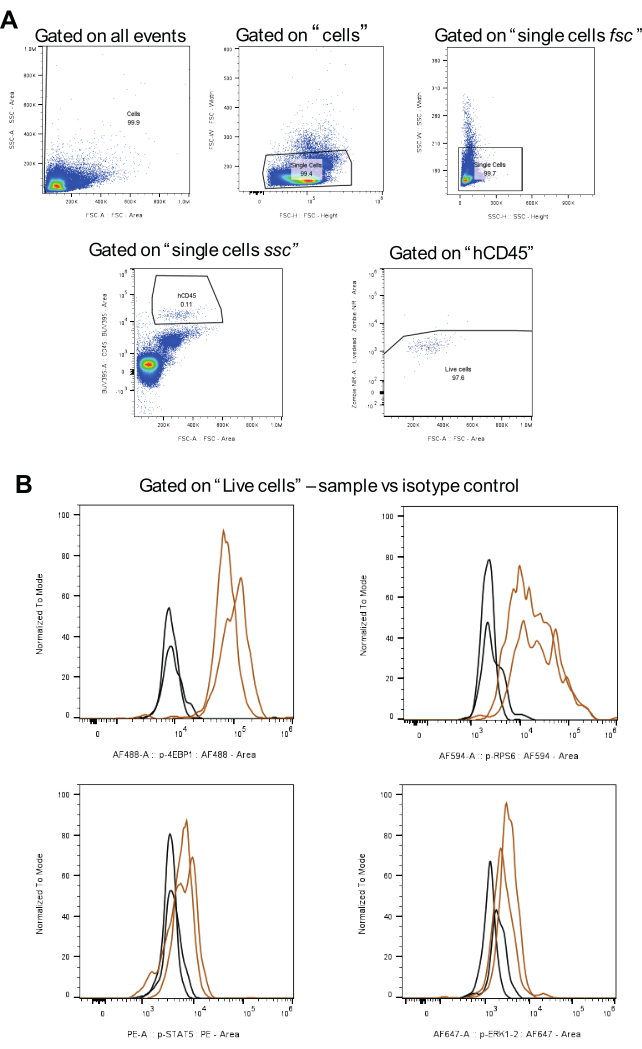
Figure 3 : Flux de travail pour l’analyse de la stratégie de contrôle, y compris les contrôles d’isotype. (A) représente les stratégies de contrôle pour les cellules vivantes, l’exclusion des doublets et des cellules AML hCD45-positives. (B) montre des signaux pour chaque phosphoprotéine en brun et des contrôles d’isotype en noir (deux réplicats biologiques). Veuillez cliquer ici pour voir une version agrandie de cette figure.
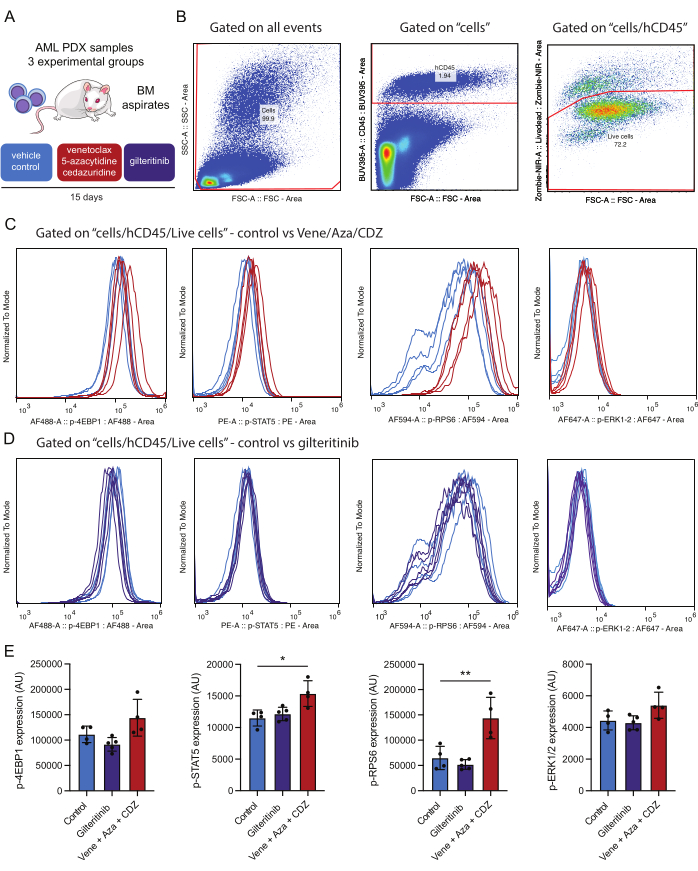
Figure 4 : Flux de travail pour la détection et l’analyse des phosphoprotéines intracellulaires après immunodétermination de cellules LMA viables dans la moelle osseuse. (A) Des souris NSG-SGM3 greffées avec des cellules LMA données par le patient ont été traitées avec un véhicule (contrôle) ou vénétoclax, de la 5-azacytidine et de la cédazuridine (vene/aza/CDZ) ou du giltéritinib. Après 15 jours, les ponctions de moelle osseuse (BM) ont été traitées. (B) représente la stratégie de contrôle pour l’analyse des cellules LMA viables (p. ex., hCD45/Zombie-NIR positives) 15 jours après le traitement. (C,D) représentent la normalisation du signal pour chacun des phosphoanticorps indiqués, dans 10 000 cellules de LMA isolées de souris traitées avec du vénétoclax/5-azacytidine/cédazuridine ou véhicule (B) ou gilteritinib ou véhicule (C). Les traces représentent les signaux dans les cellules LMA isolées de la souris témoin traitée avec véhicule (bleu clair), vene/aza/CDZ (rouge) ou gilteritinib (violet). (E) L’histogramme représente les variations moyennes de la valeur des intensités de coloration pour chaque phosphoprotéine testée sur des cellules CD45+ de LMA humaines vivantes provenant de trois souris et de l’écart-type. Les astérisques indiquent des différences significatives dans les intensités de coloration évaluées par ANOVA avec des valeurs p inférieures à 0,05 (*) et 0,01 (**). Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Anticorps | Fluorochrome | Dilution |
| p-RPS6 (Ser240/244) | AF594 | 1/50 |
| p-4EBP1 (Thr37/46) | AF488 | 1/50 |
| p-STAT5 (Tyr694) | PE | 1/100 |
| p-Erk1/2 (Thr202/Tyr204) | AF647 | 1/100 |
| Contrôle des IgG chez le lapin | AF594 | 1/50 |
| Contrôle des IgG chez le lapin | AF488 | 1/50 |
| Contrôle des IgG chez le lapin | PE | 1/100 |
| Contrôle des IgG chez le lapin | AF647 | 1/100 |
Tableau 1 : Liste des dilutions optimisées pour les anticorps.
Figure supplémentaire 1 : Comparaison de p-STAT5, p-RPS6, p-ERK1/2 et FSC-A dans un échantillon représentatif de PDX AML. Cette figure montre un exemple de la relation entre p-STAT5, p-ERK et p-RPS6 chez la souris « E9 » au 15e jour du traitement par vénétoclax/5-azacitidine/cédazuridine (résultat de la figure 4C). Dans cet échantillon, la corrélation la plus forte dans la coloration des phosphoprotéines semble être entre p-STAT5 et p-RPS6 (A), qui sont toutes deux régulées à la hausse dans ce groupe expérimental après traitement (Figure 4E). Il semble y avoir une relation moindre entre p-STAT5 et p-ERK (B). Il est important de noter que la taille des cellules (évaluée à l’aide de FSC-A) n’est pas un contributeur majeur à la positivité globale de p-STAT5, ce qui souligne que la positivité de la coloration n’est pas simplement un produit de la taille de la cellule (C). Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Étapes critiques
L’utilisation de techniques immunologiques dans l’étude de voies de signalisation complexes par la détection spécifique de phosphoprotéines nécessite que les variables expérimentales soient étroitement contrôlées22, que la préparation des échantillons soit méticuleuse et que des techniques complémentaires soient utilisées pour la validation. L’intégration de ces pratiques garantit la reproductibilité, la précision et la robustesse des données, contribuant ainsi à des conclusions biologiques plus fiables. Ces efforts permettent non seulement d’améliorer la rigueur scientifique de la méthode, mais aussi d’élargir son applicabilité dans des études complexes de la signalisation et de la régulation cellulaires. Une anesthésie appropriée et une manipulation douce sont essentielles pour minimiser le stress physiologique, qui peut modifier considérablement les résultats expérimentaux, en particulier dans les études axées sur les réponses immunitaires ou les voies de signalisation. La mise en place de protocoles analgésiques appropriés contribue également au maintien du bien-être des animaux tout en prévenant le stress lié à la douleur qui pourrait interférer avec les données. Le maintien de conditions aseptiques pendant la procédure est essentiel pour prévenir les infections, qui peuvent entraîner des réponses inflammatoires et potentiellement fausser les résultats expérimentaux. Cela implique de stériliser le matériel, d’utiliser des gants propres et de désinfecter soigneusement le site d’aspiration.
Les protéines phosphorylées sont très sensibles à la déphosphorylation par les phosphatases lors de la manipulation d’échantillons biologiques22,23. Pour préserver les états de phosphorylation pendant le traitement, une fixation immédiate est essentielle. Deux méthodes différentes de fixation/perméabilisation ont été testées : un kit cytofix/cytoperm et la méthode commune formaldéhyde/méthanol décrite dans le protocole. Parmi celles-ci, la méthode à base de méthanol a fourni des résultats plus propres avec des signaux de fluorescence plus brillants, ce qui en fait le choix préféré. Après fixation, les échantillons peuvent être stockés à court terme à -20 °C ou à long terme à -80 °C. Dans les expériences, des échantillons fixes conservés jusqu’à trois mois à -80 °C ont donné des résultats cohérents. Pour la coloration des anticorps, une incubation d’une nuit peut améliorer la précision, en particulier pour les changements subtils de phosphorylation, bien que cela dépende de l’expérience spécifique et des effets du médicament à l’étude. Une incubation plus courte de 1 h a également été testée sur de la glace, à l’abri de la lumière, ce qui a donné des résultats acceptables dans certains cas. Pour assurer une évaluation précise du bruit de fond, il est recommandé d’utiliser des contrôles d’isotype comme référence pour la liaison non spécifique, comme le montre la figure 3.
Modifications et dépannage de la technique
Pour développer leurs compétences techniques, les stagiaires de notre groupe pratiquent la technique d’insertion d’aiguille sur des souris euthanasiées, où la mise en place correcte peut être confirmée par dissection. La procédure sur les animaux vivants est effectuée de manière plus efficace par deux opérateurs, l’un pouvant se concentrer sur les aspirations tandis qu’un assistant est dédié aux tâches de surveillance des animaux et de manipulation des échantillons. Dans les rares cas où il n’est pas possible d’obtenir une aspiration après plusieurs tentatives, il est conseillé d’interrompre l’intervention car le risque de blessure augmente à chaque tentative. Le suivi post-procédure des animaux est tout aussi important. L’observation des signes d’infection, de douleur ou de stress garantit le bien-être des souris et la fiabilité de l’étude. Les conditions de logement doivent favoriser le rétablissement, avec une litière et une alimentation appropriées pour minimiser les facteurs de stress externes.
Pour l’analyse cytométrique en flux, il est recommandé de traiter simultanément tous les échantillons fixes et conservés provenant de différents jours d’aspiration de la moelle osseuse. Les variations de réhydratation et de coloration des échantillons dues à des différences dans les jours de manipulation ou les opérateurs peuvent affecter la sensibilité à la fluorescence détectée par le cytomètre. Pour garantir des résultats cohérents, optimisez les paramètres de tension du cytomètre pour maintenir tous les échantillons colorés dans la plage de détection avant de continuer. La protéine p-4EBP1 conjuguée à Alexa Fluor 488 présente la luminosité la plus élevée parmi les marqueurs de ce panneau, ce qui en fait une référence fiable pour le réglage de la plage de détection maximale. Bien que le panel d’anticorps présenté dans ce protocole n’ait pas nécessité d’ajustements de compensation, celui-ci peut varier en fonction du cytomètre en flux spectral utilisé.
Limitations
L’une des principales limites de cette technique est le nombre de cellules extraites lors de l’aspiration de la moelle osseuse. Pour garantir des résultats fiables, il est essentiel de colorer suffisamment de cellules pour analyser un minimum d’environ 10 000 cellules par échantillon. L’analyse d’un nombre insuffisant de cellules peut entraîner des variations importantes entre les échantillons, compromettant ainsi la précision et l’intelligibilité des données. Il est essentiel de garantir un nombre adéquat de cellules pour des études mécanistes robustes et reproductibles.
Pour l’analyse des données, la stratégie de contrôle illustrée à la figure 3A est appliquée. Dans un premier temps, après exclusion des doublets, les cellules d’intérêt sont identifiées à l’aide d’un anticorps CD45 humain couplé à BUV395. Ensuite, le contrôle des cellules vivantes se fait à l’aide de Zombie NIR. Enfin, l’intensité médiane de fluorescence (MFI) est calculée pour chaque phosphoprotéine (Figure 3B). Toutes les cellules analysées pour toutes les protéines phosphorylées ont été contrôlées à l’aide de la même stratégie, assurant la cohérence et la comparabilité entre les populations de cellules LMA.
Une autre limite de cette méthode est le risque de bruit de fond, qui peut résulter d’une liaison d’anticorps non spécifiques, d’un lavage insuffisant, d’une autofluorescence cellulaire ou d’une perméabilisation inadéquate. Cela peut affecter la spécificité du signal et réduire la précision de l’analyse par cytométrie phosphoflow. Pour les utilisateurs qui rencontrent ces problèmes, une étape de lavage supplémentaire est recommandée pour réduire le bruit de fond, et des réactifs bloquant Fc peuvent être utilisés pour minimiser la liaison non spécifique. De plus, la fluorescence des cellules mortes peut interférer avec les résultats, ce qui rend l’utilisation de colorants de viabilité essentielle. Il est important de noter que, pour une analyse précise, le nombre de cellules analysées ne doit pas être inférieur à 500 cellules AML afin de garantir des résultats fiables et reproductibles. Il est également important de s’assurer qu’un nombre similaire de cellules est utilisé pendant la coloration pour maintenir l’uniformité entre les échantillons. Malgré ces limites, une optimisation minutieuse des contrôles et des stratégies de contrôle peut améliorer la fiabilité de la méthode.
Signification de la technique
La technique d’aspiration de la moelle osseuse a déjà été publiée3 ; Cependant, une technique mise à jour est incluse dans ce protocole avec une explication mettant en évidence deux avantages : une meilleure immobilisation et l’utilisation d’une approche à deux aiguilles pour améliorer la précision et la cohérence de l’aspiration de la moelle osseuse, évitant ainsi tout problème de blocage de l’aiguille avec des fragments osseux. Pour les études longitudinales, l’aspiration fémorale peut être effectuée plusieurs fois, ce qui constitue une méthode puissante pour suivre les changements biologiques au fil du temps chez des animaux individuels. Un intervalle de récupération d’au moins un mois est recommandé entre les aspirations sur le même fémur pour permettre une cicatrisation osseuse suffisante et une régénération de la moelle osseuse. Lors de l’utilisation du fémur controlatéral, un intervalle plus court d’une semaine est suffisant pour s’assurer que la souris s’est rétablie des effets de l’analgésie et de l’anesthésie sans introduire de stress excessif ou de variabilité physiologique.
Dans l’ensemble, cette technique combinée d’aspiration de la moelle osseuse murine et de cytométrie en flux fournit des informations précieuses sur les principales voies de signalisation, notamment JAK/p-STAT5, mTORC1/p-4EBP1, mTORC1/p-RPS6 et MEK/p-ERK1/2. Ces voies jouent un rôle important dans la résistance au traitement de la LAM. Cette technique permet d’effectuer des prélèvements répétés sur le même animal, ce qui permet de surveiller en temps réel la progression de la maladie et la réponse au traitement au niveau de la cellule unique.
La cytométrie phosphoflow capture les événements de phosphorylation et préserve l’hétérogénéité cellulaire 4,23,24. Cela le rend particulièrement précieux pour comprendre les réponses cellulaires dynamiques au traitement dans des sous-populations leucémiques spécifiques.
Applications futures
Ce protocole constitue un outil précieux pour étudier les mécanismes sous-jacents de l’adaptation du traitement et de l’émergence de résistances dans la LAM, ouvrant la voie à des connaissances plus approfondies et à des avancées thérapeutiques potentielles. Des études futures pourraient intégrer cette approche à la transcriptomique unicellulaire ou à la protéomique pour disséquer davantage les mécanismes moléculaires à l’origine de la résistance et de la progression de la maladie25. De plus, l’application de cette méthode à d’autres hémopathies malignes ou affections inflammatoires pourrait élargir son impact dans la recherche translationnelle.
En affinant ce protocole et en s’attaquant à ses limites, cette approche pourrait devenir une méthode standard pour étudier la signalisation de la phosphoprotéine dans les maladies hématologiques, contribuant ainsi au développement de stratégies thérapeutiques plus efficaces. En conclusion, ce protocole constitue un outil précieux pour étudier les mécanismes sous-jacents de l’adaptation au traitement et de l’émergence de résistances dans la LAM, ouvrant la voie à des connaissances plus approfondies et à des avancées thérapeutiques potentielles.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par des subventions de transition pour LH et FEM de la Fondation Cole, ainsi que par des subventions de la Société de leucémie et de lymphome du Canada et des Instituts de recherche en santé du Canada (PJT-186019) à LH et FEM. FEM est un scientifique clinique junior 2 du FRSQ et LH est un scientifique junior 2 du FRSQ. VG est titulaire d’une bourse de doctorat de la Fondation Cole. La figure 1 a été créée avec BioRender dans le cadre d’un accord de licence. Des graphiques de cytométrie en flux ont été générés à l’aide du logiciel FlowJo. Un merci spécial au Dr Colin Crist et à Victoria Richard pour avoir accordé l’accès à leur installation de chirurgie animale.
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL syringes 25G x 5/8 TW | BD Biosciences | #309626 | Syringes for bone marrow aspiration |
| 1.7 mL Microcentrifuge Tubes | FroggaBio | #LMCT1.7B | To aliquot the cells recovered by bone marrow aspiration |
| BD Horizon Brilliant Stain Buffer | BD Biosciences | #563794 | For staining processes |
| Buprenorphine | Fidelis Animal Health | Ethiqa XR | Analgesia for mice |
| CellDrop FL Unlimited | FroggaBio | #CellDrop FL- UNLTD | For cell count |
| D-PBS | Wisent Inc. | #311-425-CL | Media for cells recovered by bone marrow aspiration |
| Eppendorf Centrifuge 5427 R | Millipore Sigma | #EP5429000260 | |
| Fetal Bovine Serum Heat Inactivated Premium CA | Wisent Inc. | #090-450 | For staining processes |
| Formaldehyde solution | Millipore Sigma | #F1635 | Cells Permeabilization |
| humanCD45 [HI30] antibody | BD Biosciences | #563792 | Antibody coupled with BUV395 |
| ID7000 Spectral Cell Analyzer | Sony | Spectral flow cytometer analyzer | |
| Isoflurane 99.9% liquid | McKesson | #803250 | Anesthesia for mice |
| Isospire (isoflurane) Inhalation Anesthetic | Dechra | Anesthesia for mice | |
| Live/dead AO/PI | FroggaBio | CD-AO/PI-1.5 | For cell count |
| Live/dead Zombie NIR | BioLegend+B6:C12 | #423106 | For spectral flow cytometry |
| Methanol solution | Millipore Sigma | #179957 | Cells Fixation |
| P-4EBP1 (Thr37/46) [236B4] antibody | Cell Signaling Technology | #2846 | Antibody coupled with Alexa Fluor 488 |
| p-Erk1/2 (Thr202/Tyr204) [197G2] antibody | Cell Signaling Technology | #13148 | Antibody coupled with Alexa Fluor 647 |
| p-RPS6 (Ser240/244) [D68F8] antibody | Cell Signaling Technology | #9468 | Antibody coupled with Alexa Fluor 594 |
| p-STAT5 (Tyr694) [D47E7] antibody | Cell Signaling Technology | #14603 | Antibody coupled with PE |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #2975 | Antibody coupled with Alexa Fluor 488 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #2985 | Antibody coupled with Alexa Fluor 647 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #8760 | Antibody coupled with Alexa Fluor 594 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #5742S | Antibody coupled with PE |
| Sanitizing wipes | United Canada | #UCDWPR-9022 | Disinfection for bone marrow aspiration |
Références
- Ferrara, F., Schiffer, C. A. Acute myeloid leukaemia in adults. Lancet. 381 (9865), 484-495 (2013).
- Döhner, H., et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 129 (4), 424-447 (2017).
- Chung, Y. R., Kim, E., Abdel-Wahab, O. Femoral bone marrow aspiration in live mice. J Vis Exp. (89), e51660(2014).
- Haas, A., Weckbecker, G., Welzenbach, K. Intracellular Phospho-Flow cytometry reveals novel insights into TCR proximal signaling events. A comparison with Western blot. Cytometry A. 73 (9), 799-807 (2008).
- Perbellini, O., Cavallini, C., Chignola, R., Galasso, M., Scupoli, M. T. Phospho-specific flow cytometry reveals signaling heterogeneity in t-cell acute lymphoblastic leukemia cell lines. Cells. 11 (13), 2072(2022).
- Kornblau, S. M., et al. Simultaneous activation of multiple signal transduction pathways confers poor prognosis in acute myelogenous leukemia. Blood. 108 (7), 2358-2365 (2006).
- Perl, A. E. The role of targeted therapy in the management of patients with AML. Hematology Am Soc Hematol Educ Program. 2017 (1), 54µ65(2017).
- Márton, A., et al. The roles of phosphorylation of signaling proteins in the prognosis of acute myeloid leukemia. Pathol Oncol Res. 30, 1611747(2024).
- Levis, M. FLT3 mutations in acute myeloid leukemia: what is the best approach in 2013. Hematology Am Soc Hematol Educ Program. 2013, 220-226 (2013).
- Roux, P. P., Topisirovic, I. Signaling pathways involved in the regulation of mRNA translation. Mol Cell Biol. 38 (12), e00070-e00118 (2018).
- Nepstad, I., Hatfield, K. J., Grønningsæter, I. S., Reikvam, H. The PI3K-Akt-mTOR signaling pathway in human Acute Myeloid Leukemia (AML) Cells. Int J Mol Sci. 21 (8), ijms21082907(2020).
- Jia, X., Zhou, H. Phospho-eIF4E: A new target for acute myeloid leukemia. Curr Protein Pept Sci. 22 (4), 328-335 (2021).
- Ghosh, J., Kapur, R. Role of mTORC1-S6K1 signaling pathway in regulation of hematopoietic stem cell and acute myeloid leukemia. Exp Hematol. 50, 13-21 (2017).
- Park, H. J., et al. Therapeutic resistance in acute myeloid leukemia cells is mediated by a novel ATM/mTOR pathway regulating oxidative phosphorylation. Elife. 11, 79940(2022).
- Oki, T., et al. Imaging dynamic mTORC1 pathway activity in vivo reveals marked shifts that support time-specific inhibitor therapy in AML. Nat Commun. 12 (1), 245(2021).
- Lee, H. J., Daver, N., Kantarjian, H. M., Verstovsek, S., Ravandi, F. The role of JAK pathway dysregulation in the pathogenesis and treatment of acute myeloid leukemia. Clin Cancer Res. 19 (2), 327-335 (2013).
- Liu, A. C. H., et al. Targeting STAT5 signaling overcomes resistance to IDH Inhibitors in acute myeloid leukemia through suppression of stemness. Cancer Res. 82 (23), 4325-4339 (2022).
- Sung, P. J., Sugita, M., Koblish, H., Perl, A. E., Carroll, M. Hematopoietic cytokines mediate resistance to targeted therapy in FLT3-ITD acute myeloid leukemia. Blood Adv. 3 (7), 1061-1072 (2019).
- Song, P., Yang, F., Jin, H., Wang, X. The regulation of protein translation and its implications for cancer. Signal Transduct Target Ther. 6 (1), 68(2021).
- This Standard Operating Procedure (SOP) describes methods for anesthetizing mice. , McGill University. https://www.mcgill.ca/research/files/research/110-mouse_anesthesia-2024-06-17.pdf (2024).
- Tech Team Tips: Preparing a Sample with AO/PI. , DeNovix. https://www.denovix.com/webinars/tech-team-tips-preparing-a-sample-with-ao-pi (2021).
- Suni, M. A., Maino, V. C. Flow cytometric analysis of cell signaling proteins. Methods Mol Biol. 717, 155-169 (2011).
- Krutzik, P. O., Irish, J. M., Nolan, G. P., Perez, O. D. Analysis of protein phosphorylation and cellular signaling events by flow cytometry: techniques and clinical applications. Clin Immunol. 110 (3), 206-221 (2004).
- Chen, W., Luu, H. S. Immunophenotyping by multiparameter flow cytometry. Methods Mol Biol. 1633, 51-73 (2017).
- Perez, O. D., Nolan, G. P. Phospho-proteomic immune analysis by flow cytometry: From mechanism to translational medicine at the single-cell level. Immunol Rev. 210, 208-228 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon