Method Article
ציטומטריית פוספו-פלואו תוך-תאית של השתלות קסנו-השתלות שמקורן בלוקמיה מיאלואידית חריפה
In This Article
Summary
כאן, מתוארת שיטה מבוססת ציטומטריית פוספופלואו לניתוח איתות במורד הזרם של מסלולי mTORC1, JAK/STAT5 ו-MAPK בתאי לוקמיה מיאלואידית אנושית חריפה שהושתלו בעכברים ומתקבלים מאספיראטים של מח עצם. רמות p-STAT5, p-4EBP1, p-RPS6 ו-p-ERK1/2 נמדדות בו זמנית באמצעות ציטומטר זרימה ספקטרלי מהדור הבא עם רגישות גבוהה.
Abstract
כדי להסתגל ולהתנגד לטיפולים מאושרים, תאי לוקמיה מיאלואידית חריפה (AML) מפעילים מסלולים מולקולריים ספציפיים המובילים לשינויים בביטוי הגנים, ברמות החלבון ובפעילותם. בפרוטוקול זה, מדווח על גישה לחקור מטרות זרחניות במורד הזרם של איתות אונקוגני ב-AML: p-STAT5 (Tyr694), p-4EBP1 (Thr37/46), p-RPS6 (Ser240/244) ו-p-ERK1/2 (Thr202/Tyr204). שיטה זו מאפשרת להעריך כיצד מסלולים אלה - מווסתים עיקריים של תחזוקת גזע, התחמקות חיסונית, סינתזת חלבונים והסתגלות לעקה חמצונית ומטבולית - מווסתים על ידי תרכובת אחת או יותר שנבדקו בתאי מח עצם שנקטפו מעכברים חיים על ידי שאיפה לפני ואחרי שלב הטיפול. שיטה זעיר פולשנית זו שומרת על שלמות התאים ומפחיתה מתח בהשוואה לטכניקות ריסוק עצם, שעלולות לגרום לנזק ופוטנציאלית להשפיע על תוצאות הניסוי. כדי לייעל את צביעת הנוגדנים התוך תאית לניתוח זרימה ציטומטרי, פותח פרוטוקול המשתמש בקיבוע פרפורמלדהיד וחדירות מתנול. גישה זו מבטיחה דיוק צביעה גבוה וממזערת רעשי רקע, ומאפשרת זיהוי אמין של סמני איתות תוך-תאיים. אחד היתרונות העיקריים של פרוטוקול זה הוא פיתוח פאנל נוגדנים רב-פרמטרי, המאפשר הערכה סימולטנית של ארבעת המסלולים באותה דגימה. באמצעות ציטומטר זרימה ספקטרלי מהדור הבא עם רגישות גבוהה, נצפו שינויים דינמיים בהפעלת המסלול בהתאם לתנאי הטיפול בהשוואה לרמות הבסיס לפני הטיפול באותם עכברים. מתודולוגיה זו מאפשרת ניתוח מדויק in vivo של אפנון מסלול איתות בדגימות מח עצם xenograft שמקורן בחולה ללא צורך בהמתת חסד של בעלי החיים, ומספקת תובנה חשובה לגבי מנגנוני ההסתגלות של תאי AML, ויכולה להנחות את הערכת האסטרטגיות הטיפוליות שמטרתן למקד מסלולים אלה כדי להתגבר על עמידות.
Introduction
לוקמיה מיאלואידית חריפה (AML) היא ממאירות המטולוגית אגרסיבית המאופיינת בהצטברות של תאי אב מיאלואידים לא בשלים במח העצם ובדם ההיקפי. זה משבש את ההמטופואיזיס הרגיל, מה שמוביל לציטופניה מסכנת חיים ולסיבוכים מערכתיים. למרות שהתקדמות במשטרי טיפול כימותרפי, טיפולים ממוקדים והשתלת תאי גזע המטופויאטיים שיפרו את התוצאות עבור חלק מהחולים, בסך הכל, שיעורי ההישרדות ל-5 שנים נותרו בסביבות 30%, עם פרוגנוזה גרועה יותר בחולים מבוגרים או כאלה עם פרופיל גנטי שלילי1. אתגר משמעותי בניהול AML הוא הופעה תכופה של עמידות לתרופות, התורמת להישנות וכישלון הטיפול2. זה מדגיש את החשיבות של השגת הבנה מעמיקה יותר של המנגנונים המולקולריים והתאיים המניעים את ההתקדמות והעמידות הטיפולית של AML.
כדי להתמודד עם אתגר זה, מוצגת שיטה חדשה לשאיפות מח עצם בשילוב עם ציטומטריית פוספו-פלואו תוך-תאית מרובה, המציעה כלי רב עוצמה לחקירת מסלולי איתות תוך-תאיים במודלים של קסנוגרפט שמקורם בחולה AML (PDX) (איור 1A,B). למרות ששאיבת מח עצם במודלים PDX תוארה בעבר3, פרוטוקול זה עבר אופטימיזציה לשימור תאים לוקמיים לניתוח פוספו-פלו. המטרה הכוללת של שיטה זו היא לספק הליך זעיר פולשני הניתן ליישום לאורך זמן במהלך התקדמות לוקמיה ותגובה טיפולית ברזולוציה של תא בודד. על ידי מתן אפשרות לדגימה חוזרת מאותה חיה, טכניקה זו מציעה ייצוג מדויק יותר של התפתחות המחלה המטופלת. הרציונל מאחורי פיתוח טכניקה זו טמון בצורך בהערכה דינמית ברזולוציה גבוהה של איתות תוך תאי בתאי AML. שיטות מסורתיות, כגון Western Blotting, דורשות מספרי תאים גדולים, חסרות רזולוציה של תא בודד וריבוב4. לעומת זאת, ציטומטריית פוספופלו שומרת על הטרוגניות תאית ומאפשרת זיהוי של חלבוני איתות זרחניים מרובים בתת-אוכלוסיות לוקמיות נפרדות5, ומציעה תובנות מפתח לגבי הפעלת מסלול בתגובה לטיפולי AML.
מרכזיים בביולוגיה של AML הם מסלולי איתות המווסתים את התפשטות התאים, ההישרדות וההסתגלות המטבולית, כולל חלבון קינאז המופעל על ידי מיטוגן (MAPK), יעד מכניסטי של קומפלקס רפמיצין 1 (mTORC1), ומסלולי איתות Janus Kinase/Signal Transducer and Activator of Transcription 5 (JAK/STAT5). מעבר לתפקידם בשגשוג ובהישרדות של תאים לוקמיים, מסלולים אלה מעורבים באופן קריטי גם בתהליכים אונקוגניים מרכזיים כגון תחזוקת גזע, התחמקות חיסונית והסתגלות לעקה חמצונית ומטבולית4. בנוסף לקידום צמיחת תאים והישרדותם של תאים, הדיבור ההדדי בין מסלולים אלה מתזמר תהליכים קריטיים כגון שעתוק, תרגום ומטבוליזם תאי, ומאפשר לתאי AML לשמור על צמיחתם ולהתנגד לאותות אפופטוטיים, אפילו מול התערבויות טיפוליות 6,7 (איור 1A).
מסלול MAPK, הכולל אפקטורים מרכזיים כגון p-ERK1/2 (קינאז מווסת אות חוץ-תאי 1/2), ממלא תפקיד מכריע באינטגרציה של אותות חוץ-תאיים, כגון גורמי גדילה וציטוקינים, כדי לווסת את התפשטות התאים והישרדותם הפעלת ERK1/2 מתרחשת באמצעות מפל RAS (Rat Sarcoma)-RAF (Rapid Accelerated Fibrosarcoma)-MEK (MAPK/ERK Kinase)-ERK, שבו RAS-GTP מגייס RAF, מה שמוביל לזרחון רציף של MEK1/2 ולאחר מכן ERK1/2 ב-Thr202/Tyr204. לאחר הזרחון, ERK1/2 מתעמעם ועובר טרנסלוקציה לגרעין, שם הוא מזרחן גורמי שעתוק כגון MYC (הומולוג אונקוגן ויראלי מיאלוציטומטוזיס)), ELK1 (חלבון ETS Like-1) ו-AP-1 (חלבון מפעיל-1), מקדם התפשטות תאים, חסימת התמיינות והישרדות8. ב-AML, מוטציות ב-FLT3 (טירוזין קינאז 3 דמוי fms), RAS או KIT גורמות לעתים קרובות להפעלת ERK מכוננת 9,10 (איור 1A).
מוטציות ב-FLT3, RAS או KIT גורמות גם להגברת הוויסות של איתות mTORC1, המאפשר צמיחת AML ועמידות טיפולית על ידי תמיכה בתהליכים אונקוגניים כגון חיווט מחדש מטבולי, אפנון של סינתזת חלבונים, ביוגנזה של ריבוזום ואוטופגיה11. באמצעות ויסות תרגום mRNA, mTORC1 מקל על ייצור חלבונים אונקוגניים וגורמים חיוניים אחרים להתקדמות AML. קבוצת מפתח של מצעי mTORC1 כוללת 4E-BPs (חלבונים קושרים גורם התחלה אוקריוטי 4E). במצבם ההיפו-זרחני, 4E-BPs נקשרים ל-eIF4E (גורם התחלה אוקריוטי 4E), ומעכבים תרגום תלוי כובע. זרחון של 4E-BP1 ב-Thr37/46 על ידי mTORC1 גורם לשחרור של eIF4E, ומאפשר התחלת תרגום עבור mRNAs אונקוגניים מרכזיים, כגון MYC, CCND1 (Cyclin D1) ו-MCL-1 (לוקמיה של תאים מיאלואידיים 1), ובכך מקדם התפשטות לוקמית והישרדות 8,12. בנוסף, זרחון RPS6 ב-Ser240/244, בתיווך S6K1 (חלבון ריבוזומלי S6 קינאז בטא-1) במורד הזרם של mTORC1, משפר את הביוגנזה של הריבוזום ותרגום mRNA, ומגביר את הסינתזה של חלבונים הדרושים להסתגלות מטבולית, עמידות בפני מתח והתפשטות מהירה 8,13. יש לציין כי פעילות mTORC1 קשורה קשר הדוק להסתגלות מטבולית, אסטרטגיית הישרדות קריטית המופעלת על ידי תאי AML תחת לחץ טיפולי 13,14,15 (איור 1A).
מסלול JAK/STAT5 הוא ציר איתות מכריע נוסף ב-AML, במיוחד במקרים עם מוטציות המשפיעות על קולטני ציטוקינים או מתווכי איתות כגון JAK2, FLT3 ו-CALR (קלרטיקולין)16,17. STAT5 מופעל בתגובה לאיתות ציטוקינים באמצעות קולטנים כגון FLT3 ו-JAK2. עם קשירת ליגנד, קשירת Janus kinases (JAKs) זרחנית STAT5 ב-Tyr694. STAT5 זרחני מתעמעם ועובר טרנסלוקציה לגרעין, שם הוא נקשר לרצפי DNA ספציפיים כדי לווסת את שעתוק הגנים המעורבים בהישרדות התא, התפשטות והתמיינות8. ב-AML, הפעלה מכוננת של STAT5, לעתים קרובות עקב מוטציות ב-FLT3 או JAK2, מובילה לביטוי מתמשך של גנים המקדמים לוקמוגנזה18 (איור 1A).
מעבר לתרומות האישיות שלהם, מסלולים אלה מתכנסים כדי לווסת הן את השעתוק והן את התרגום, ומעצבים את הפרוטאום של תאי AML בדרכים המקדמות הישרדות ועמידות. בפרט, תרגום mRNA מתגלה כגורם מפתח בפתופיזיולוגיה של AML, מכיוון שהוא מאפשר ייצור מהיר של חלבונים אונקוגניים וגורמי תגובה ללחץ המאפשרים לתאי AML להסתגל לאתגרים סביבתיים ולהתחמק מההשפעות של טיפולים ממוקדים. חוסר ויסות של מנגנוני תרגום, כגון גורמי התחלה אוקריוטיים (eIFs) או חלבונים ריבוזומליים, היה מעורב בעמידות טיפולית ופרוגנוזה גרועה ב-AML19. חקירה מפורטת של התפקידים של מסלולי MAPK, mTORC1 ו-JAK/STAT5 בוויסות שעתוק ותרגום חיונית כדי להשיג הבנה מקיפה של המנגנונים המולקולריים העומדים בבסיס התקדמות ועמידות AML. תובנות כאלה הן קריטיות לזיהוי סמנים ביולוגיים חדשים של תגובה לטיפול ולעיצוב אסטרטגיות טיפוליות חדשות המכוונות למסלולים אלה כדי להתגבר על עמידות. מאמר זה מספק פרוטוקול שתוכנן במיוחד כדי לחקור את רשתות האיתות הללו במודלים של xenograft (PDX) שמקורם בחולה AML.
אחד היתרונות המרכזיים של פרוטוקול זה הוא השילוב של שאיבת מח עצם עם ציטומטריית פוספו-פלו-פלומטריה תוך תאית, המאפשרת הערכה דינמית וזעיר פולשנית של הפעלת מסלול איתות במודלים של קסנוגרפט שמקורו בחולה AML (PDX). זה חשוב במיוחד לניטור מצב ההפעלה של מסלולי מפתח כגון MAPK, mTORC1 ו-JAK/STAT5 בתגובה לטיפולים ממוקדים. השילוב של טכניקות אלו מאפשר רכישת הבנה מקיפה וברזולוציה גבוהה של ביולוגיה של AML, ובסופו של דבר מסייע בפיתוח אסטרטגיות טיפוליות יעילות יותר.
Protocol
הניסויים הבאים בוצעו באישור הוועדה לטיפול בבעלי חיים של אוניברסיטת מקגיל (CIHR PJT-186019) ומועצת הביקורת המוסדית של בית החולים היהודי הכללי (11-047). בפרוטוקול זה, עכברי NOD-scid IL2Rg^null-3/GM/SF (NSGS), בגילאי 8 שבועות עד 6 חודשים ובמשקל 20-30 גרם, הושתלו בעבר בתאי AML שמקורם בחולה אנושי. פרטים על הריאגנטים והציוד המשמש במחקר זה מפורטים בטבלת החומרים.
1. שאיבת מח עצם
זהירות: יש להקפיד על אמצעי זהירות סביב השימוש במחטים.
- שיכוך כאבים סביב הניתוח: 1-4 שעות לפני שאיבת מח העצם, יש להזריק לעכברים תת עורית (s.c.) 0.1 מ"ג/ק"ג של בופרנורפין בשחרור איטי. זה מבטיח שיכוך כאבים עד 72 שעות לאחר ההליך.
- הכן את אזור הניתוח מתחת למכסה הזרימה הלמינרי עם כרית כירורגית, גוזם שיער, מנורת חימום וכל החומר הדרוש לשאיבת מח עצם (מזרקים 25 גרם, צינורות מיקרוצנטריפוגה של 1.5 מ"ל המכילים 0.5 מ"ל PBS על קרח, 70% ספוגיות איזופרופנול). אבטח את חרוט האף לשאיפת איזופלורן באמצעות סרט דבק (איור 2A).
- הכינו שני מזרקים של 25 גרם לכל שאיבה, אחד לניקוב עצם ("מחט יבשה") ואחד שהרכזת שלו נשטפה ב-PBS לשאיפה ("מחט שטופה").
- יש להרדים את העכבר באמצעות שאיפת איזופלורן הניתנת על ידי מכשיר אידוי מוסמך, בהתאם להוראות היצרן ולהנחיות הווטרינריות. הנהלים המקומיים עשויים להשתנות. לעיון, פרוטוקול זה עקב אחר נהלי ההפעלה הסטנדרטיים של אוניברסיטת מקגיל להרדמת עכברים20.
- אשר את עומק ההרדמה באמצעות חוסר תגובה לצביטה בכף הרגל והרפיית שרירים. מרחו משחה וטרינרית על העיניים כדי למנוע יובש בזמן שהחיה תחת הרדמה. עקוב באופן רציף אחר קצב הנשימה במהלך ההרדמה.
- לגלח את כל הרגל שבה תבוצע השאיפה באמצעות גוזם השיער. חיטוי אתר השאיפה (עצם הירך) עם כרית חיטוי רוויה באלכוהול איזופרופיל (איור 2B).
- חשוף את המשטח המפרקי של עצם הירך, שם נמצא אתר הניקוב, על ידי כיפוף הברך ושיתוק הרגל באמצעות היד הלא דומיננטית. הניחו את האגודל על השוקה, את האצבע המורה על עצם הירך ואת האצבע האמצעית, וייצבו את כל מה שנמצא בצד החיצוני של שתי העצמות (איור 2C).
הערה: הקפידו על מיקום יציב מאוד של הרגל באמצעות היד הלא דומיננטית כדי למנוע כל תנועה של הרגל במהלך השאיפה שעלולה להוביל לכשל או לפציעה. אם קיבוע הרגל אינו יציב, מקם מחדש את היד ונסה שוב לפני כל פנצ'ר. - תוך כדי קיבוע עם היד הלא דומיננטית, חטאו שוב את אזור הברך עם אלכוהול איזופרופיל (איור 2C) כדי להרחיק את השערות הנותרות כדי לשפר את ההדמיה של מבנה העצם.
- השתמש במזרק היבש הראשון של 25 גרם כדי ליצור חור במשטח המפרקי של עצם הירך על ידי מיקומו באמצע מפרק הירך וסיבובו מבלי להכריח אותו (איור 2D,E). ודא שהמחט של המזרק מיושרת לחלוטין (סטייה של 0°) עם ציר האורך של עצם הירך כדי להיכנס למח בצורה נכונה.
הערה: שמור על יישור זה כדי להבטיח כניסה חלקה מבלי לגרום נזק מיותר לרקמות שמסביב. כאשר המחט נכנסת לאמצע עצם הירך, ירידה קלה בהתנגדות מעידה על חדירה מוצלחת לחלל מח העצם (איור 2F). הימנע מהפעלת כוח מופרז על המחט בשלב זה, מכיוון שהוא עלול לגרום לאובדן יישור נכון, שבר או טראומה. על ידי שימוש בתנועת קידוח סיבובית, הסיכויים גדולים יותר שהמחט תעקוב אחר הנתיב בעל ההתנגדות הנמוכה ביותר ותיכנס נכון לחלל הירך. מחט הממוקמת כראוי בתוך עצם הירך צריכה להישאר אנכית גם כאשר היד המחזיקה אותה מוסרת. - לאחר הכניסה למח, הסר את המזרק בהדרגה על ידי סיבוב (איור 2G) והכנס את המזרק השטוף השני לתוך החור שנוצר על ידי המחט הראשונה (איור 2H,I).
הערה: נעשה שימוש במזרק שני מכיוון שהראשון נחסם לעתים קרובות על ידי עצם במהלך הקידוח. - מרחו ואקום על המזרק המוחדר לעצם הירך תוך סיבוב עדין ומשיכה הדרגתית של המזרק. כ-10-20 מיקרוליטר של מח עצם צריכים להיות גלויים בתוך רכזת המזרק (איור 2J).
הערה: במידת הצורך, קדם בעדינות את המחט בתוך העצם כדי לייעל את מיצוי מח העצם. - העבירו את מח העצם על ידי שטיפת תוכן המזרק לתוך צינור המיקרו-צנטריפוגה המקורר שמכיל 500 מיקרוליטר של PBS (איור 2K). המשיכו על הקרח והמשיכו לשלבים 2-3 בהקדם האפשרי.
- הפעל לחץ עדין על מקום הניקוב למשך 30 שניות עם ספוגית איזופרופנול כדי לעצור כל דימום (איור 2L).
- הנח את העכבר בכלוב התאוששות נקי שחומם באמצעות מנורת חימום. עקוב אחר הנשימה והניידות עד שהחיה ערה ומתאוששת לחלוטין לפני הכנסתה לכלובים משותפים עם שאר העכברים. בדוק אם יש סימני דימום.
2. צביעת סמן חי/מת ומשטח
הערה: שמור תאים על קרח לאורך כל ההליך. הכינו תערובות מאסטר של תמיסות צביעת נוגדנים (לשלב 2.4 ושלב 2.7) לפני שלב 2 ושלב 3, ושמרו אותן בטמפרטורה של 4 מעלות צלזיוס מוגנות מפני אור. הכינו תמיסת פורמלדהיד טרייה של 1.6% (שלב 3.1) ותמיסת מתנול 100% תוך שמירה על -20 מעלות צלזיוס (שלב 3.6).
- ספור את התאים ברי קיימא באמצעות כתום אקרידין / פרופידיום יודיד (AO / PI) עם מונה התאים21.
- העבירו את הנפח המתאים למיליון תאים לצינור חדש של 1.5 מ"ל. אם הנפח אינו מספיק, קח את כל הנפח. אסוף את התאים הנותרים וחלק ל-3 צינורות משוכפלים (1 M כל אחד) לצביעה של בקרת איזוטיפ וצינור אחד לבקרה לא מוכתמת.
- תאי צנטריפוגה ב-500 x גרם למשך 5 דקות ב-4 מעלות צלזיוס. שאפו בעדינות והשליכו את הסופרנטנט באמצעות מערכת שאיבת ואקום.
- הוסף 200 מיקרוליטר לכל דגימה של תמיסת צביעת תאים פלואורסצנטיים מדוללת 1/100 ב-PBS כדי לסמן את התאים המתים. השעו בעדינות את התאים בעזרת הפיפטה. עשה את אותו הדבר עם הצינורות הנוספים לצביעה של בקרת איזוטיפ.
- דגירה על קרח למשך 10 דקות מוגן מאור.
- צנטריפוגה את התאים ב-500 x גרם למשך 5 דקות ב-4 מעלות צלזיוס. שאפו בעדינות והשליכו את הסופרנטנט באמצעות מערכת ואקום.
- הוסף 100 מיקרוליטר לכל דגימה של נוגדן hCD45-BUV395 מדולל 1/100 ב-PBS המכיל 2% סרום בקר עוברי כדי לסמן את התאים ההמטופויאטיים האנושיים. עשה את אותו הדבר עם הצינורות הנוספים שנשמרו לבקרות איזוטיפ.
- דגירה על קרח למשך 15 דקות מוגן מאור. המשך מיד לשלב 3.
3. קיבוע וחדירות
- הכן תמיסת פורמלדהיד/PBS טרייה של 1.6%: עבור כל דגימה, מערבבים 29.5 מיקרוליטר של תמיסת מלאי פורמלדהיד 37% + 970.5 מיקרוליטר PBS (קחו בחשבון נפח נוסף כאמצעי זהירות). שמור את תמיסת הפורמלדהיד/PBS 1.6% בטמפרטורת החדר.
זהירות: יש לטפל בפורמלדהיד במכסה מנוע כימי ולהשליך אותו בהתאם לתקנות הבטיחות המוסדיות. - צנטריפוגה את התאים ב-500 x גרם למשך 5 דקות ב-4 מעלות צלזיוס. שאפו והשליכו את הסופרנטנט באמצעות מערכת ואקום.
- השעו מחדש ב-1 מ"ל של תמיסת פורמלדהיד/PBS של 1.6%.
- דגירה למשך 10 דקות בטמפרטורת החדר, מוגנת מפני אור.
- צנטריפוגה את התאים ב-500 x גרם למשך 5 דקות ב-4 מעלות צלזיוס. שאפו והשליכו את הסופרנטנט באמצעות מערכת ואקום.
- הוסף 1 מ"ל של 100% מתנול צונן ב-20 מעלות צלזיוס ישירות לתוך הצינור.
- דגירה של דגימות בטמפרטורה של -20 מעלות צלזיוס למשך 30 דקות מוגנות מפני אור.
הערה: בשלב זה, ניתן לאחסן תאים קבועים וחדירים בטמפרטורה של -80 מעלות צלזיוס עד חודש לפני הניתוח.
4. צביעת פוספופלו
הערה: לוח הנוגדנים הבא אומת באמצעות ציטומטר הזרימה המצויד בלייזרים הבאים: 320 ננומטר, 355 ננומטר, 405 ננומטר, 488 ננומטר, 561 ננומטר, 637 ננומטר ו-808 ננומטר. יש לאמת מחדש פאנל זה אם נעשה שימוש בציטומטרים שונים עם מערכי לייזר וגלאי שונים.
- הכן תמיסת תערובת מאסטר של נוגדנים עם הדילולים הבאים במאגר צביעה זמין מסחרית (טבלה 1), תוך חישוב נפח של 50 מיקרוליטר לכל דגימה. יש לשמור בטמפרטורה של 4 מעלות צלזיוס מוגן מפני אור.
- לשטיפות (שלבים 4.8, 4.10), שמור PBS על קרח (2 מ"ל לכל דגימה).
- הכן תמיסת תערובת מאסטר שנייה עבור השכפולים הטכניים של בקרת האיזוטיפ במאגר הצביעה (טבלה 1), חישוב נפח של 50 מיקרוליטר עבור כל דגימה. יש לשמור בטמפרטורה של 4 מעלות צלזיוס מוגן מפני אור. מומלץ לפחות שתי דגימות בקרת איזוטיפ לשחזור טכני.
- צנטריפוגה את התאים משלב 3.7 ב-500 x גרם למשך 5 דקות ב-4 מעלות צלזיוס. שאפו והשליכו את הסופרנטנט באמצעות מערכת ואקום.
הערה: לאחר קיבוע וחדירה, התאים עשויים להיראות שקופים יותר. - הוסף 50 מיקרוליטר של תמיסת תערובת נוגדנים (שלב 4.1) או תמיסת תערובת בקרת איזוטיפ (שלב 4.2). השעו בעדינות את התאים בעזרת פיפטה.
- דגרו את כל הדגימות למשך הלילה בטמפרטורה של 4 מעלות צלזיוס מוגנות מאור.
- תאי צנטריפוגה ב-500 x גרם למשך 5 דקות ב-4 מעלות צלזיוס. שאפו והשליכו את הסופרנטנט באמצעות מערכת ואקום.
- שוטפים עם 1000 מיקרוליטר PBS על ידי השעיה בעדינות עם הפיפטה.
- תאי צנטריפוגה ב-500 x גרם למשך 5 דקות ב-4 מעלות צלזיוס. שאפו והשליכו את הסופרנטנט באמצעות מערכת ואקום.
- בצע שטיפה שנייה עם 1000 מיקרוליטר PBS על ידי השעיה בעדינות עם הפיפטה.
- תאי צנטריפוגה ב-500 x גרם למשך 5 דקות ב-4 מעלות צלזיוס. שאפו והשליכו את הסופרנטנט באמצעות מערכת ואקום.
- השעיה מחדש של דגימות ב-200 מיקרוליטר של PBS. העברה לצינורות או לוחות FACS לניתוח באמצעות ציטומטריית זרימה (איור 3).
- הכן בקרות פיצוי בצבע יחיד עם חרוזים על ידי דגירה של 0.1 מיקרוליטר מכל נוגדן עם חרוזי פיצוי, בהתאם להוראות היצרן (ראה טבלת חומרים).
תוצאות
תכנון הניסוי נועד לנטר את מצב הזרחן של חלבונים נבחרים מעניינים בנקודות זמן שונות, למשל, יום אחד לפני תחילת הטיפול ו-15 יום לאחר התחלת הטיפול. קו בסיס זה משמש כבקרה קריטית לאימות אמיתות השינויים הבאים בהפעלת מסלול האיתות לאחר הטיפול. לאחר חמישה עשר יום של טיפול, מתבצעת השוואה שנייה כדי להעריך את אפנון המסלול בעכברים שטופלו לעומת בקרות שטופלו ברכב (איור 4). גישה דו-שלבית זו מאפשרת להבחין בין השפעות הנגרמות על ידי טיפול לבין שונות בסיסית.
לצורך מחקר זה, נעשה שימוש במודל עכבר AML PDX. העכברים הושתלו בתאי AML שמקורם בחולה המאופיינים במוטציות הבאות: DNMT3AMR882H עם מקטע אלל וריאנט (VAF) של 48%, NPM1W288fs VAF 36%, FLT3ITD VAF 10% ו-IDH2R140Q VAF 44%. לאחר ההשתלה, הותרו שלושה שבועות לצמיחת הגידול לפני תחילת הטיפול. עכברי PDX שהושתלו במוטציה FLT3 טופלו במשך חמישה עשר יום באחד משלושה משטרי טיפול: פלצבו, גילטריטיניב (15 מ"ג/ק"ג ביום), או שילוב של ונטוקלקס (50 מ"ג/ק"ג ביום), 5-אזציטידין (2.5 מ"ג/ק"ג ביום) וסדריזודין (3 מ"ג/ק"ג ביום) (איור 4A).
ביחס לתוצאות שהתקבלו, ראוי להזכיר כי טיפול במשטר מבוסס ונטוקלקס הביא לשיפור משמעותי בזרחון STAT5 ו-RPS6, מה שמצביע על כך שמסלולים אלה תורמים לעמידות לטיפול (איור 4E). לעומת זאת, גילטריטיניב, תרופה המכוונת ל-FLT3, לא הפחיתה את מצב הזרחן של אפקטורים מוטנטיים של FLT3. ייתכן שבדגימת AML שנבדקה, נוכחות של מוטציות משניות נוספות מלבד FLT3-ITD (למשל, IDH2) תורמת להפעלת מסלולים אלה או שהטיפול התרופתי במשך שבועיים מביא לחיסול סלקטיבי של תאי AML עם ירידה באיתות. מכיוון שכל הפוספופרוטאינים שנותחו מגודרים מאותה אוכלוסיית תאים, ניתן להשוות את הפעלת הפוספופרוטאין. בניסוי זה, נראה כי המתאם החזק ביותר בצביעת פוספופרוטאין הוא בין p-STAT5 ל-p-RPS6 (איור משלים 1A), ששניהם מווסתים בקבוצת ניסוי זו לאחר הטיפול (איור 4E). נראה שיש קשר פחות טוב בין p-STAT5 ל-p-ERK (איור משלים 1B). חשוב לציין, גודל התא (המוערך באמצעות FSC-A) אינו תורם משמעותי לחיוביות הכוללת של p-STAT5, מה שמדגיש כי צביעה חיובית אינה רק תוצר של גודל התא (איור משלים 1C). מסגרת ניסויית זו מאפשרת הערכה מקיפה של ההשפעות של טיפולים אלה על אפנון מסלול האיתות.
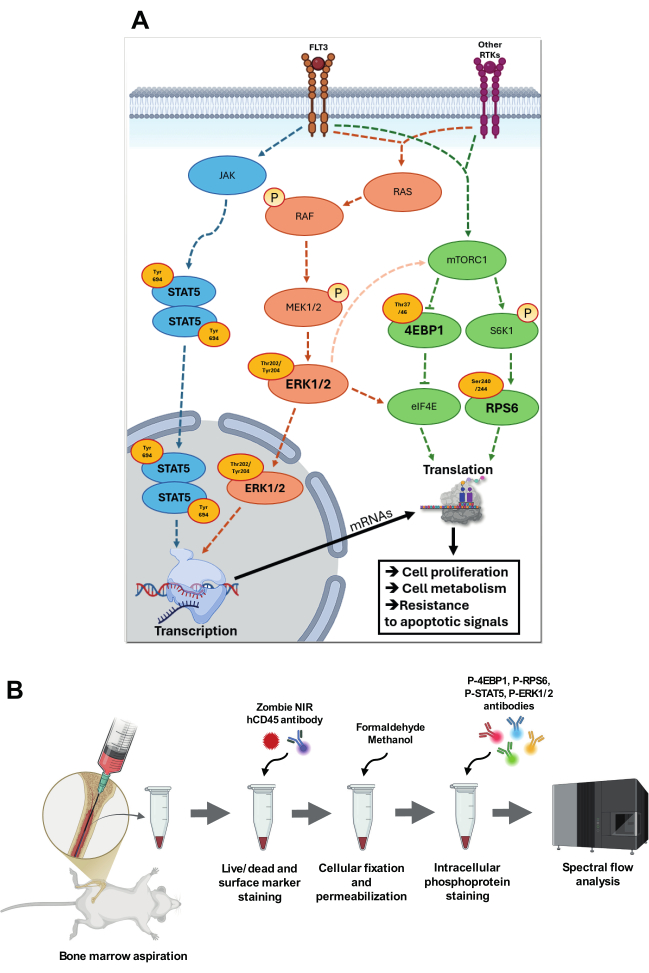
איור 1: הדמיה של מסלולי איתות המטרה והאסטרטגיה לניתוחם. (A) סקירה כללית של מסלולי האיתות הכוללים p-STAT5 (Tyr694), p-4EBP1 (Thr37/46), p-RPS6 (Ser240/244) ו-p-ERK1/2 (Thr202/Tyr204). במסלול p-STAT5, JAK עובר אוטו-פוספורילציה, מגביר את הפעילות הקטליטית שלו, ואז מזרחן שאריות טירוזין ספציפיות, ויוצר אתרי עגינה לחלבוני STAT. STAT5 זרחני (Tyr694) עובר הומודימר ועובר טרנסלוקציה לגרעין, שם הוא נקשר לאלמנטים ספציפיים המגיבים ל-STAT באזורי המקדם של גני המטרה. במפל RAS-RAF-MEK-ERK, זרחון עצמי של קולטן FLT3 או קולטן אחר טירוזין קינאזות (RTKs) עם קשירת ליגנד מוביל להחלפת תמ"ג עבור GTP ב-RAS, ובכך מפעיל את RAS. RAS-GTP מופעל מגייס את RAF לקרום הפלזמה, שם RAF עובר שינוי קונפורמציה והופך לפעיל. לאחר מכן RAF מזרחן ומפעיל MEK1/2, קינאז בעל סגוליות כפולה, אשר בתורו מזרחן ERK בשאריות Thr202/Tyr204. ERK1/2 מופעל עובר טרנסלוקציה לגרעין, שם הוא מזרחן גורמי שעתוק ספציפיים. ERK1/2 מסוגל גם, באמצעות מסלולי איתות ביניים, להגביר את פעילות mTORC1 ולזרחן eIF4E באתרים ספציפיים כדי להגביר את פעילות התרגום. מופעל על ידי חומרים מזינים וגורמי גדילה באמצעות FLT3 ו-RTKs אחרים, mTORC1 מזרחן מטרות במורד הזרם כמו S6K1 ו-4E-BP1. S6K1, בתורו, זרחן RPS6, מה שמשפר את תפקוד הריבוזום ומפעיל תרגום. היפר-זרחון של 4E-BP1 משחרר eIF4E, ומאפשר הרכבה של קומפלקס התחלת התרגום eIF4F והפעלת תרגום תלוי כובע. כל המסלולים הללו מעורבים מאוד ב-AML, ותורמים להסתגלות נרכשת על ידי הגברת התפשטות התאים, חילוף החומרים והעמידות לאותות אפופטוטיים. (B) מציג את השלבים העיקריים של שאיבת מח העצם ופרוטוקול צימוד צביעת פוספו-פלואו תוך תאי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
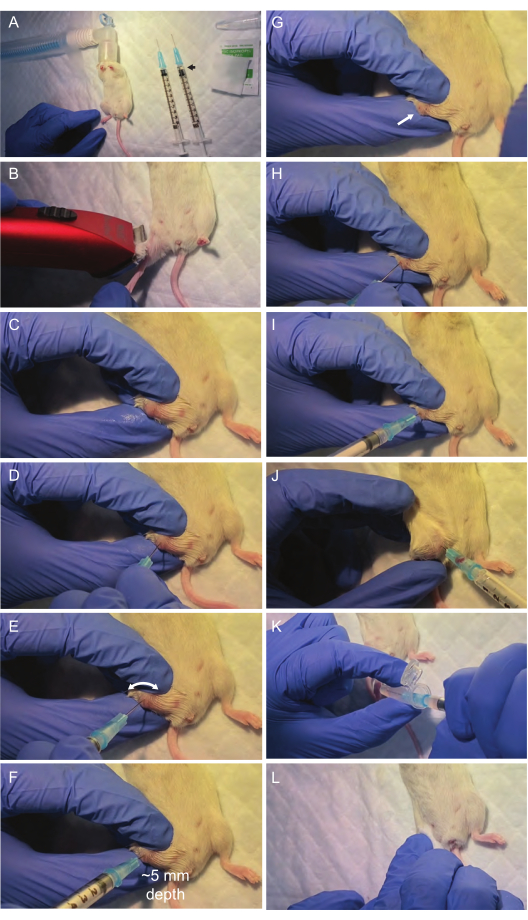
איור 2: הדמיה של שלבים קריטיים במהלך הליך שאיבת מח העצם. אזור הניתוח והחומרים הדרושים מוגדרים מתחת למכסה זרימה למינר. לאחר הרדמה על ידי שאיפת איזופלורן (A), משטח מפרקי הירך מוכן לשאיפה (B,C). עצם הירך מנוקבת על ידי מזרק ראשון המיושר לאמצע עצם הירך (D). זה קריטי להימנע מהפעלת לחץ חזק על המחט ובמקום זאת לבצע תנועת קידוח סיבובית; זה בדרך כלל מספיק כדי שהמחט תנקב את פני העצם ותעקוב אחר נתיב חלל הירך. לאחר מכן, מח העצם נשאב במזרק שני דרך אתר הניקוב (I,J). לאחר העברת שאיבת מח העצם לצינור מיקרוצנטריפוגה (K), מופעל לחץ עדין כדי לעצור את הדימום באזור (L), והעכבר מכניס לכלוב חם ונקי להתאוששות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
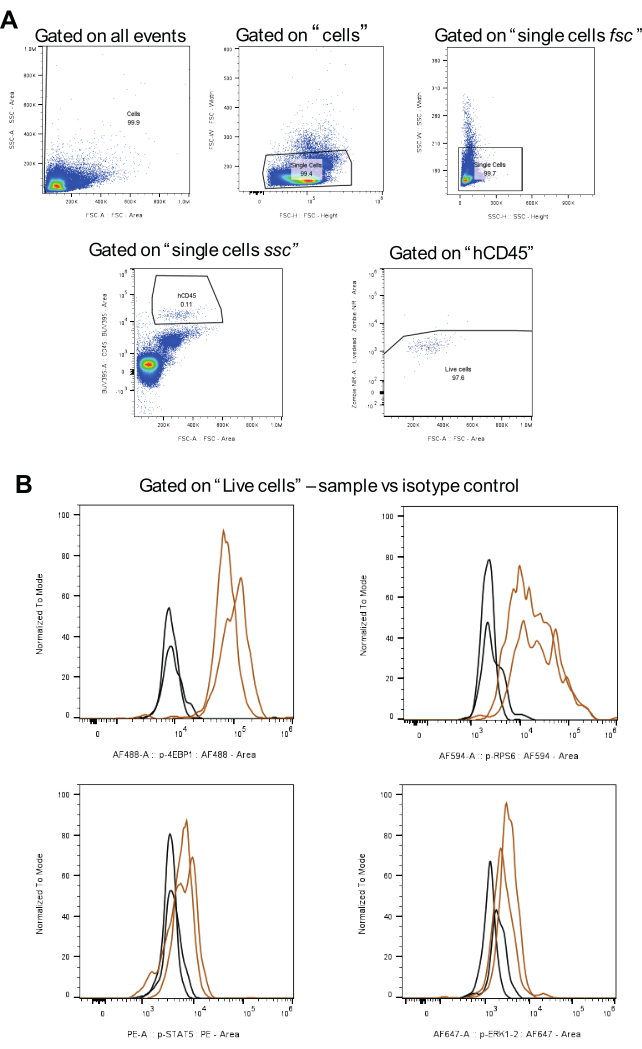
איור 3: זרימת עבודה לניתוח אסטרטגיית השער, כולל בקרות איזוטיפ. (A) מייצג אסטרטגיות שער עבור תאים חיים, אי הכללה של כפולות ותאי AML חיוביים ל-hCD45. (B) מראה אותות עבור כל פוספופרוטאין בחום ואיזוטיפ בשחור (שני שכפולים ביולוגיים). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
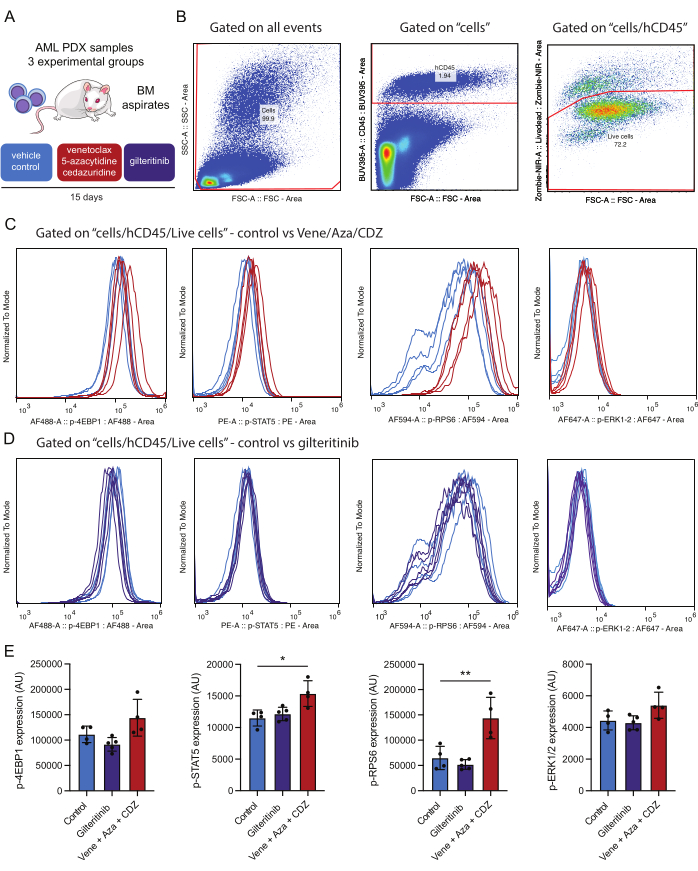
איור 4: זרימת עבודה לאיתור וניתוח של פוספופרוטאינים תוך-תאיים לאחר הצהרה חיסונית של תאי AML ברי קיימא במח העצם. (A) עכברי NSG-SGM3 שהושתלו בתאי AML שנתרמו על ידי המטופל טופלו ברכב (ביקורת) או ונטוקלקס, 5-אזציטידין וסדזורידין (vene/aza/CDZ) או gilteritinib. לאחר 15 יום עובדו שאיבות מח עצם (BM). (B) מייצג את אסטרטגיית השער לניתוח תאי AML ברי קיימא (למשל, hCD45/Zombie-NIR חיובי) 15 יום לאחר הטיפול. (C,D) מייצגים את הנורמליזציה של האות עבור כל אחד מהפוספונוגדנים כפי שצוין, ב-10,000 תאי AML שבודדו מעכברים שטופלו בוונטוקלקס/5-אזציטידין/סדזורידין או רכב (B) או גילטריטיניב או רכב (C). העקבות מייצגים את האותות בתאי AML שבודדו מעכבר הביקורת שטופל ברכב (כחול בהיר), vene/aza/CDZ (אדום) או gilteritinib (סגול). (E) ההיסטוגרמה מייצגת את שינויי הערך הממוצעים בעוצמות הצביעה עבור כל פוספופרוטאין שנבדק על תאי AML CD45+ אנושיים חיים משלושה עכברים ו-SD. פסי שגיאה מייצגים סטיית תקן. הכוכביות מצביעות על הבדלים משמעותיים בעוצמות הצביעה כפי שהוערכו על ידי ANOVA עם ערכי p מתחת ל-0.05 (*) ו-0.01 (**). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| נוגדן | פלואורוכרום | דילול |
| p-RPS6 (Ser240/244) | AF594 | 1/50 |
| p-4EBP1 (Thr37/46) | AF488 | 1/50 |
| p-STAT5 (Tyr694) | PE | 1/100 |
| p-Erk1/2 (Thr202/Tyr204) | AF647 | 1/100 |
| בקרת IgG של ארנב | AF594 | 1/50 |
| בקרת IgG של ארנב | AF488 | 1/50 |
| בקרת IgG של ארנב | PE | 1/100 |
| בקרת IgG של ארנב | AF647 | 1/100 |
טבלה 1: רשימת דילולים אופטימליים לנוגדנים.
תרשים משלים 1: השוואה בין p-STAT5, p-RPS6, p-ERK1/2 ו-FSC-A במדגם מייצג של AML PDX. איור זה מציג דוגמה לקשר בין p-STAT5, p-ERK ו-p-RPS6 בעכבר "E9" ביום ה-15 לטיפול בוונטוקלקס/5-אזציטידין/סדזורידין (תוצאה מאיור 4C). במדגם זה, נראה כי המתאם החזק ביותר בצביעת פוספופרוטאין הוא בין p-STAT5 ל-p-RPS6 (A), ששניהם מווסתים בקבוצת ניסוי זו לאחר הטיפול (איור 4E). נראה שיש קשר פחות טוב בין p-STAT5 ל-p-ERK (B). חשוב לציין, גודל התא (המוערך באמצעות FSC-A) אינו תורם משמעותי לחיוביות הכוללת של p-STAT5, מה שמדגיש כי צביעה חיובית אינה רק תוצר של גודל התא (C). אנא לחץ כאן להורדת קובץ זה.
Discussion
שלבים קריטיים
השימוש בטכניקות מבוססות אימונולוגית בחקר מסלולי איתות מורכבים באמצעות זיהוי ספציפי של פוספופרוטאינים דורש שמשתני הניסוי יהיו מבוקרים היטב22, הכנת הדגימה קפדנית וטכניקות משלימות משמשות לצורך אימות. שילוב שיטות אלה מבטיח את יכולת השחזור, הדיוק והחוסן של הנתונים, ובסופו של דבר תורם למסקנות ביולוגיות אמינות יותר. מאמצים אלה לא רק משפרים את הקפדנות המדעית של השיטה, אלא גם מרחיבים את ישימות השיטה במחקרים מורכבים של איתות וויסות תאים. הרדמה נכונה וטיפול עדין הם קריטיים למזעור מתח פיזיולוגי, שיכול לשנות באופן משמעותי את תוצאות הניסוי, במיוחד במחקרים המתמקדים בתגובות חיסוניות או במסלולי איתות. הקפדה על פרוטוקולים מתאימים לשיכוך כאבים מסייעת עוד יותר בשמירה על רווחת בעלי החיים תוך מניעת מתח הקשור לכאב שעלול להפריע לנתונים. שמירה על תנאים אספטיים במהלך ההליך חיונית למניעת זיהומים, שעלולים להוביל לתגובות דלקתיות ועלולות לבלבל את תוצאות הניסוי. זה כולל עיקור ציוד, שימוש בכפפות נקיות וחיטוי יסודי של אתר השאיפה.
חלבונים זרחניים רגישים מאוד לדפוספורילציה על ידי פוספטאזים במהלך מניפולציה של דגימות ביולוגיות22,23. כדי לשמר מצבי זרחון במהלך העיבוד, קיבוע מיידי הוא חיוני. נבדקו שתי שיטות קיבוע/חדירות שונות: ערכת ציטופיקס/ציטופרם ושיטת הפורמלדהיד/מתנול הנפוצה המתוארת בפרוטוקול. בין אלה, השיטה המבוססת על מתנול סיפקה תוצאות נקיות יותר עם אותות פלואורסצנטיים בהירים יותר, מה שהופך אותה לבחירה המועדפת. לאחר הקיבוע, ניתן לאחסן דגימות לטווח קצר ב-20 מעלות צלזיוס או לטווח ארוך ב-80 מעלות צלזיוס. בניסויים, דגימות קבועות שאוחסנו עד שלושה חודשים בטמפרטורה של -80 מעלות צלזיוס הניבו תוצאות עקביות. עבור צביעת נוגדנים, דגירה של לילה יכולה לשפר את הדיוק, במיוחד עבור שינויי זרחון עדינים, אם כי זה תלוי בניסוי הספציפי ובהשפעות התרופות הנחקרות. דגירה קצרה יותר של שעה נבדקה גם על קרח, מוגן מפני אור, מה שהניב תוצאות מקובלות במקרים מסוימים. כדי להבטיח הערכה מדויקת של רעשי רקע, בקרות איזוטיפ מומלצות כהתייחסות לכריכה לא ספציפית, כפי שמוצג באיור 3.
שינויים ופתרון בעיות בטכניקה
כדי לפתח מיומנות טכנית, החניכים בקבוצה שלנו מתרגלים את טכניקת החדרת המחט בעכברים שעברו המתת חסד, שבה ניתן לאשר מיקום נכון על ידי דיסקציה. הליך בעלי החיים מבוצע בצורה היעילה ביותר על ידי שני מפעילים, כאשר ניתן להתמקד בשאיפות בזמן שעוזר מוקדש למשימות ניטור בעלי חיים וטיפול בדגימות. במקרים נדירים בהם לא ניתן לקבל שאיבה לאחר מספר ניסיונות, רצוי לבטל את ההליך מכיוון שהסיכון לפציעה עולה עם כל ניסיון. ניטור לאחר ההליך של בעלי החיים חשוב לא פחות. התבוננות בסימני זיהום, כאב או מתח מבטיחה את רווחתם של העכברים ואת אמינות המחקר. תנאי הדיור צריכים לתמוך בהתאוששות, עם מצעים ותזונה מתאימים כדי למזער גורמי לחץ חיצוניים.
לניתוח זרימה ציטומטרית, מומלץ לעבד את כל הדגימות הקבועות והשמורות מימי שאיבת מח עצם שונים בו זמנית. שינויים בהתייבשות הדגימה והצביעה עקב הבדלים בימי הטיפול או במפעילים יכולים להשפיע על רגישות הקרינה שזוהתה על ידי הציטומטר. כדי להבטיח תוצאות עקביות, בצע אופטימיזציה של הגדרות מתח הציטומטר כדי לשמור על כל הדגימות המוכתמות בטווח הזיהוי לפני שתמשיך. חלבון ה-p-4EBP1 המצומד של Alexa Fluor 488 מציג את הבהירות הגבוהה ביותר מבין הסמנים בפאנל זה, מה שהופך אותו להתייחסות אמינה לקביעת טווח הזיהוי המקסימלי. בעוד שפאנל הנוגדנים המוצג בפרוטוקול זה לא דרש התאמות פיצוי, זה עשוי להשתנות בהתאם לציטומטר הזרימה הספקטרלי בו נעשה שימוש.
מגבלות
אחת המגבלות העיקריות של טכניקה זו היא מספר התאים המופקים במהלך שאיבת מח עצם. כדי להבטיח תוצאות אמינות, חיוני לצבוע מספיק תאים כדי לנתח מינימום של כ-10,000 תאים לדגימה. ניתוח תאים מעטים מדי עלול להוביל לשינויים משמעותיים בין דגימות, ולפגוע בדיוק וביכולת הפרשנות של הנתונים. הבטחת מספר מספיק של תאים היא קריטית למחקרים מכניסטיים חזקים וניתנים לשחזור.
לניתוח נתונים, מיושמת אסטרטגיית השער המוצגת באיור 3A . ראשית, לאחר אי הכללת כפולות, התאים המעניינים מזוהים באמצעות נוגדן CD45 אנושי בשילוב עם BUV395. לאחר מכן, השער לתאים חיים נעשה באמצעות Zombie NIR. לבסוף, עוצמת הקרינה החציונית (MFI) מחושבת עבור כל פוספופרוטאין (איור 3B). כל התאים שנותחו עבור כל החלבונים הזרחניים גודרו באותה אסטרטגיה, מה שמבטיח עקביות והשוואה בין אוכלוסיות תאי AML.
מגבלה נוספת של שיטה זו היא הפוטנציאל לרעשי רקע, שיכולים לנבוע מקשירת נוגדנים לא ספציפיים, שטיפה לא מספקת, אוטופלואורסצנטיות תאים או חדירות לא תקינה. זה עשוי להשפיע על ספציפיות האות ולהפחית את הדיוק של ניתוח ציטומטריית פוספו-פלו. עבור משתמשים שנתקלים בבעיות אלו, מומלץ שלב כביסה נוסף כדי להפחית רעשי רקע, וניתן להשתמש בריאגנטים חוסמי FC כדי למזער כריכה לא ספציפית. בנוסף, פלואורסצנטיות של תאים מתים עלולה להפריע לתוצאות, מה שהופך את השימוש בצבעי חיוניות לחיוני. חשוב לציין, לניתוח מדויק, מספר התאים שנותחו לא צריך להיות פחות מ-500 תאי AML כדי להבטיח תוצאות אמינות וניתנות לשחזור. חשוב גם לוודא שנעשה שימוש במספר דומה של תאים במהלך הצביעה כדי לשמור על עקביות בין דגימות. למרות מגבלות אלו, אופטימיזציה זהירה של בקרות ואסטרטגיות שער יכולה לשפר את אמינות השיטה.
משמעות הטכניקה
טכניקת שאיבת מח העצם כבר פורסמה3; עם זאת, טכניקה מעודכנת כלולה בפרוטוקול זה עם הסבר המדגיש שני יתרונות: קיבוע משופר ושימוש בגישה דו-מחטית לשיפור הדיוק והעקביות בשאיבת מח העצם, מניעת כל בעיה של חסימת המחט עם שברי עצם. עבור מחקרי אורך, ניתן לבצע שאיבת עצם הירך מספר פעמים, ולספק שיטה רבת עוצמה למעקב אחר שינויים ביולוגיים לאורך זמן בבעלי חיים בודדים. מומלץ מרווח החלמה של חודש לפחות בין שאיפות על אותו עצם הירך כדי לאפשר ריפוי עצם מספיק והתחדשות של מח העצם. בעת שימוש בעצם הירך הנגדית, מרווח קצר יותר של שבוע מספיק כדי להבטיח שהעכבר התאושש מהשפעות שיכוך כאבים והרדמה מבלי להכניס מתח מיותר או שונות פיזיולוגית.
בסך הכל, טכניקה משולבת זו של שאיבת מח עצם עכברים וזרימה ציטומטרית מספקת תובנות חשובות לגבי מסלולי איתות מרכזיים, כולל JAK/p-STAT5, mTORC1/p-4EBP1, mTORC1/p-RPS6 ו-MEK/p-ERK1/2. מסלולים אלה ממלאים תפקידים משמעותיים בעמידות לטיפול ב-AML. טכניקה זו מאפשרת דגימה חוזרת מאותה חיה, ומאפשרת ניטור בזמן אמת של התקדמות המחלה ותגובת הטיפול ברמת התא הבודד.
ציטומטריית פוספופלואו לוכדת אירועי זרחון ושומרת על הטרוגניות תאית 4,23,24. זה הופך אותו לבעל ערך במיוחד להבנת התגובות התאיות הדינמיות לטיפול בתת-אוכלוסיות לוקמיות ספציפיות.
יישומים עתידיים
פרוטוקול זה מספק כלי רב ערך לחקר המנגנונים הבסיסיים של הסתגלות לטיפול והופעת עמידות ב-AML, וסולל את הדרך לתובנות עמוקות יותר והתקדמות טיפולית פוטנציאלית. מחקרים עתידיים יוכלו לשלב גישה זו עם טרנסקריפטומיקה של תא בודד או פרוטאומיקה כדי לנתח עוד יותר את המנגנונים המולקולריים המניעים את העמידות והתקדמות המחלה25. בנוסף, יישום שיטה זו על ממאירויות המטולוגיות אחרות או מצבים דלקתיים יכול להרחיב את השפעתה במחקר תרגומי.
על ידי חידוד פרוטוקול זה והתייחסות למגבלותיו, גישה זו יכולה להפוך לשיטה סטנדרטית לחקר איתות פוספופרוטאין במחלות המטולוגיות, ובסופו של דבר לסייע בפיתוח אסטרטגיות טיפוליות יעילות יותר. לסיכום, פרוטוקול זה מספק כלי רב ערך לחקר המנגנונים הבסיסיים של הסתגלות לטיפול והופעת עמידות ב-AML, וסולל את הדרך לתובנות עמוקות יותר והתקדמות טיפולית פוטנציאלית.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענקי מעבר עבור LH ו-FEM מקרן קול, ומענקים מאגודת הלוקמיה והלימפומה של קנדה והמכונים הקנדיים לחקר הבריאות (PJT-186019) ל-LH ו-FEM. FEM הוא מדען קליני FRSQ Junior 2 ו-LH הוא מדען FRSQ Junior 2. VG מחזיקה במלגת דוקטורט מקרן קול. איור 1 נוצר עם BioRender תחת הסכם מורשה. עלילות ציטומטריית זרימה נוצרו באמצעות תוכנת FlowJo. תודה מיוחדת לד"ר קולין כריסט וויקטוריה ריצ'רד על הענקת גישה למתקן הניתוחים שלהם לבעלי חיים.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringes 25G x 5/8 TW | BD Biosciences | #309626 | Syringes for bone marrow aspiration |
| 1.7 mL Microcentrifuge Tubes | FroggaBio | #LMCT1.7B | To aliquot the cells recovered by bone marrow aspiration |
| BD Horizon Brilliant Stain Buffer | BD Biosciences | #563794 | For staining processes |
| Buprenorphine | Fidelis Animal Health | Ethiqa XR | Analgesia for mice |
| CellDrop FL Unlimited | FroggaBio | #CellDrop FL- UNLTD | For cell count |
| D-PBS | Wisent Inc. | #311-425-CL | Media for cells recovered by bone marrow aspiration |
| Eppendorf Centrifuge 5427 R | Millipore Sigma | #EP5429000260 | |
| Fetal Bovine Serum Heat Inactivated Premium CA | Wisent Inc. | #090-450 | For staining processes |
| Formaldehyde solution | Millipore Sigma | #F1635 | Cells Permeabilization |
| humanCD45 [HI30] antibody | BD Biosciences | #563792 | Antibody coupled with BUV395 |
| ID7000 Spectral Cell Analyzer | Sony | Spectral flow cytometer analyzer | |
| Isoflurane 99.9% liquid | McKesson | #803250 | Anesthesia for mice |
| Isospire (isoflurane) Inhalation Anesthetic | Dechra | Anesthesia for mice | |
| Live/dead AO/PI | FroggaBio | CD-AO/PI-1.5 | For cell count |
| Live/dead Zombie NIR | BioLegend+B6:C12 | #423106 | For spectral flow cytometry |
| Methanol solution | Millipore Sigma | #179957 | Cells Fixation |
| P-4EBP1 (Thr37/46) [236B4] antibody | Cell Signaling Technology | #2846 | Antibody coupled with Alexa Fluor 488 |
| p-Erk1/2 (Thr202/Tyr204) [197G2] antibody | Cell Signaling Technology | #13148 | Antibody coupled with Alexa Fluor 647 |
| p-RPS6 (Ser240/244) [D68F8] antibody | Cell Signaling Technology | #9468 | Antibody coupled with Alexa Fluor 594 |
| p-STAT5 (Tyr694) [D47E7] antibody | Cell Signaling Technology | #14603 | Antibody coupled with PE |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #2975 | Antibody coupled with Alexa Fluor 488 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #2985 | Antibody coupled with Alexa Fluor 647 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #8760 | Antibody coupled with Alexa Fluor 594 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #5742S | Antibody coupled with PE |
| Sanitizing wipes | United Canada | #UCDWPR-9022 | Disinfection for bone marrow aspiration |
References
- Ferrara, F., Schiffer, C. A. Acute myeloid leukaemia in adults. Lancet. 381 (9865), 484-495 (2013).
- Döhner, H., et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 129 (4), 424-447 (2017).
- Chung, Y. R., Kim, E., Abdel-Wahab, O. Femoral bone marrow aspiration in live mice. J Vis Exp. (89), e51660(2014).
- Haas, A., Weckbecker, G., Welzenbach, K. Intracellular Phospho-Flow cytometry reveals novel insights into TCR proximal signaling events. A comparison with Western blot. Cytometry A. 73 (9), 799-807 (2008).
- Perbellini, O., Cavallini, C., Chignola, R., Galasso, M., Scupoli, M. T. Phospho-specific flow cytometry reveals signaling heterogeneity in t-cell acute lymphoblastic leukemia cell lines. Cells. 11 (13), 2072(2022).
- Kornblau, S. M., et al. Simultaneous activation of multiple signal transduction pathways confers poor prognosis in acute myelogenous leukemia. Blood. 108 (7), 2358-2365 (2006).
- Perl, A. E. The role of targeted therapy in the management of patients with AML. Hematology Am Soc Hematol Educ Program. 2017 (1), 54µ65(2017).
- Márton, A., et al. The roles of phosphorylation of signaling proteins in the prognosis of acute myeloid leukemia. Pathol Oncol Res. 30, 1611747(2024).
- Levis, M. FLT3 mutations in acute myeloid leukemia: what is the best approach in 2013. Hematology Am Soc Hematol Educ Program. 2013, 220-226 (2013).
- Roux, P. P., Topisirovic, I. Signaling pathways involved in the regulation of mRNA translation. Mol Cell Biol. 38 (12), e00070-e00118 (2018).
- Nepstad, I., Hatfield, K. J., Grønningsæter, I. S., Reikvam, H. The PI3K-Akt-mTOR signaling pathway in human Acute Myeloid Leukemia (AML) Cells. Int J Mol Sci. 21 (8), ijms21082907(2020).
- Jia, X., Zhou, H. Phospho-eIF4E: A new target for acute myeloid leukemia. Curr Protein Pept Sci. 22 (4), 328-335 (2021).
- Ghosh, J., Kapur, R. Role of mTORC1-S6K1 signaling pathway in regulation of hematopoietic stem cell and acute myeloid leukemia. Exp Hematol. 50, 13-21 (2017).
- Park, H. J., et al. Therapeutic resistance in acute myeloid leukemia cells is mediated by a novel ATM/mTOR pathway regulating oxidative phosphorylation. Elife. 11, 79940(2022).
- Oki, T., et al. Imaging dynamic mTORC1 pathway activity in vivo reveals marked shifts that support time-specific inhibitor therapy in AML. Nat Commun. 12 (1), 245(2021).
- Lee, H. J., Daver, N., Kantarjian, H. M., Verstovsek, S., Ravandi, F. The role of JAK pathway dysregulation in the pathogenesis and treatment of acute myeloid leukemia. Clin Cancer Res. 19 (2), 327-335 (2013).
- Liu, A. C. H., et al. Targeting STAT5 signaling overcomes resistance to IDH Inhibitors in acute myeloid leukemia through suppression of stemness. Cancer Res. 82 (23), 4325-4339 (2022).
- Sung, P. J., Sugita, M., Koblish, H., Perl, A. E., Carroll, M. Hematopoietic cytokines mediate resistance to targeted therapy in FLT3-ITD acute myeloid leukemia. Blood Adv. 3 (7), 1061-1072 (2019).
- Song, P., Yang, F., Jin, H., Wang, X. The regulation of protein translation and its implications for cancer. Signal Transduct Target Ther. 6 (1), 68(2021).
- This Standard Operating Procedure (SOP) describes methods for anesthetizing mice. , McGill University. https://www.mcgill.ca/research/files/research/110-mouse_anesthesia-2024-06-17.pdf (2024).
- Tech Team Tips: Preparing a Sample with AO/PI. , DeNovix. https://www.denovix.com/webinars/tech-team-tips-preparing-a-sample-with-ao-pi (2021).
- Suni, M. A., Maino, V. C. Flow cytometric analysis of cell signaling proteins. Methods Mol Biol. 717, 155-169 (2011).
- Krutzik, P. O., Irish, J. M., Nolan, G. P., Perez, O. D. Analysis of protein phosphorylation and cellular signaling events by flow cytometry: techniques and clinical applications. Clin Immunol. 110 (3), 206-221 (2004).
- Chen, W., Luu, H. S. Immunophenotyping by multiparameter flow cytometry. Methods Mol Biol. 1633, 51-73 (2017).
- Perez, O. D., Nolan, G. P. Phospho-proteomic immune analysis by flow cytometry: From mechanism to translational medicine at the single-cell level. Immunol Rev. 210, 208-228 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved