Method Article
Intrazelluläre Phosphoflow-Zytometrie von Xenotransplantaten bei akuter myeloischer Leukämie
In diesem Artikel
Zusammenfassung
Hier wird eine auf Phosphoflow-Zytometrie basierende Methode zur Analyse der Signalwege stromabwärts der mTORC1-, JAK/STAT5- und MAPK-Signalwege in akuten humanen myeloischen Leukämiezellen beschrieben, die in Mäuse xenotransplantiert und aus Knochenmarkaspiraten gewonnen wurden. Die Werte von p-STAT5, p-4EBP1, p-RPS6 und p-ERK1/2 werden gleichzeitig mit einem spektralen Durchflusszytometer der nächsten Generation mit hoher Empfindlichkeit gemessen.
Zusammenfassung
Um zugelassene Behandlungen anzupassen und ihnen zu widerstehen, aktivieren Zellen der akuten myeloischen Leukämie (AML) spezifische molekulare Signalwege, die zu Veränderungen der Genexpression, des Proteinspiegels und der Aktivität führen. In diesem Protokoll wird über einen Ansatz berichtet, um Ziele zu untersuchen, die stromabwärts der onkogenen Signalübertragung bei AML phosphoryliert sind: p-STAT5 (Tyr694), p-4EBP1 (Thr37/46), p-RPS6 (Ser240/244) und p-ERK1/2 (Thr202/Tyr204). Mit dieser Methode kann beurteilt werden, wie diese Signalwege – wichtige Regulatoren der Stammzellerhaltung, der Immunevasion, der Proteinsynthese und der Anpassung an oxidativen und metabolischen Stress – durch eine oder mehrere getestete Verbindungen in Knochenmarkzellen moduliert werden, die vor und nach der Behandlungsphase durch Aspiration von lebenden Mäusen entnommen wurden. Diese minimal-invasive Methode bewahrt die Zellintegrität und reduziert den Stress im Vergleich zu Knochenzerkleinerungstechniken, die Schäden verursachen und möglicherweise die Versuchsergebnisse beeinträchtigen können. Um die intrazelluläre Antikörperfärbung für die durchflusszytometrische Analyse zu optimieren, wurde ein Protokoll entwickelt, das Paraformaldehyd-Fixierung und Methanol-Permeabilisierung verwendet. Dieser Ansatz gewährleistet eine hohe Färbepräzision und minimiert das Hintergrundrauschen, was eine zuverlässige Detektion intrazellulärer Signalmarker ermöglicht. Einer der Hauptvorteile dieses Protokolls ist die Entwicklung eines multiparametrischen Antikörper-Panels, das eine gleichzeitige Bewertung der vier Signalwege innerhalb derselben Probe ermöglicht. Unter Verwendung eines spektralen Durchflusszytometers der nächsten Generation mit hoher Empfindlichkeit wurden dynamische Verschiebungen in der Signalwegaktivierung in Abhängigkeit von den Behandlungsbedingungen im Vergleich zu den Ausgangswerten vor der Behandlung bei denselben Mäusen beobachtet. Diese Methodik ermöglicht eine präzise In-vivo-Analyse der Modulation des Signalwegs in patienteneigenen Xenotransplantat-Knochenmarkproben, ohne dass eine Euthanasie der Tiere erforderlich ist, und bietet wertvolle Einblicke in die Anpassungsmechanismen von AML-Zellen und kann die Bewertung therapeutischer Strategien leiten, die darauf abzielen, diese Signalwege zur Überwindung von Resistenzen zu überwinden.
Einleitung
Die akute myeloische Leukämie (AML) ist eine aggressive hämatologische Malignität, die durch die Anhäufung unreifer myeloischer Vorläuferzellen im Knochenmark und im peripheren Blut gekennzeichnet ist. Dies stört die normale Hämatopoese und führt zu lebensbedrohlicher Zytopenie und systemischen Komplikationen. Obwohl Fortschritte bei Chemotherapien, zielgerichteten Therapien und hämatopoetischer Stammzelltransplantation die Ergebnisse für einige Patienten verbessert haben, liegt die 5-Jahres-Überlebensrate insgesamt bei etwa 30 %, wobei die Prognose bei älteren Patienten oder Patienten mit ungünstigen genetischen Profilen schlechter ist1. Eine große Herausforderung bei der Behandlung von AML ist das häufige Auftreten von Arzneimittelresistenzen, die zu Rückfällen und Behandlungsversagen beitragen2. Dies unterstreicht, wie wichtig es ist, ein tieferes Verständnis der molekularen und zellulären Mechanismen zu erlangen, die das Fortschreiten und die therapeutische Resistenz der AML antreiben.
Um dieser Herausforderung zu begegnen, wird eine neue Methode für Knochenmarkaspirationen in Verbindung mit der intrazellulären Multiplex-Phosphoflow-Zytometrie vorgestellt, die ein leistungsfähiges Werkzeug zur Untersuchung intrazellulärer Signalwege in AML-Patientenmodellen (PDX) bietet (Abbildung 1A,B). Obwohl die Knochenmarkaspiration in PDX-Modellen bereits beschrieben wurde3, wurde dieses Protokoll optimiert, um leukämische Zellen für die Phosphoflow-Analyse zu erhalten. Das übergeordnete Ziel dieser Methode ist es, ein minimal-invasives Verfahren zur Verfügung zu stellen, das während des Fortschreitens der Leukämie und des therapeutischen Ansprechens mit Einzelzellauflösung longitudinal anwendbar ist. Durch die Möglichkeit, wiederholte Proben desselben Tieres zu nehmen, bietet diese Technik eine genauere Darstellung der Krankheitsentwicklung während der Behandlung. Der Grund für die Entwicklung dieser Technik liegt in der Notwendigkeit einer hochauflösenden, dynamischen Bewertung der intrazellulären Signalübertragung in AML-Zellen. Traditionelle Methoden, wie z. B. Western Blotting, erfordern eine große Zellzahl, es fehlt an Einzelzellauflösung und Multiplexing4. Im Gegensatz dazu bewahrt die Phosphoflow-Zytometrie die zelluläre Heterogenität und ermöglicht den Nachweis mehrerer phosphorylierter Signalproteine in unterschiedlichen leukämischen Subpopulationen5, was wichtige Einblicke in die Aktivierung des Signalwegs als Reaktion auf AML-Behandlungen bietet.
Von zentraler Bedeutung für die Biologie der AML sind Signalwege, die die zelluläre Proliferation, das Überleben und die metabolische Anpassung regulieren, einschließlich der Mitogen-aktivierten Proteinkinase (MAPK), des Mechanistic Target of Rapamycin Complex 1 (mTORC1) und der Janus-Kinase/Signal Transducer and Activator of Transcription 5 (JAK/STAT5) Signalwege. Neben ihrer Rolle bei der Proliferation und dem Überleben leukämischer Zellen sind diese Signalwege auch entscheidend an wichtigen onkogenen Prozessen wie der Aufrechterhaltung der Stammzellen, der Immunevasion und der Anpassung an oxidativen und metabolischen Stressbeteiligt 4. Neben der Förderung des Zellwachstums und des Überlebens orchestriert die Wechselwirkung zwischen diesen Signalwegen kritische Prozesse wie Transkription, Translation und Zellstoffwechsel, so dass AML-Zellen ihr Wachstum aufrechterhalten und apoptotischen Signalen widerstehen können, selbst angesichts therapeutischer Eingriffe 6,7 (Abbildung 1A).
Der MAPK-Signalweg, der Schlüsseleffektoren wie p-ERK1/2 (Extracellular signal-regulated kinase 1/2) umfasst, spielt eine entscheidende Rolle bei der Integration extrazellulärer Signale wie Wachstumsfaktoren und Zytokine, um die Zellproliferation und das Überleben zu regulieren. Die ERK1/2-Aktivierung erfolgt durch die Kaskade RAS (Rattensarkom)-RAF (Rapid Accelerated Fibrosarcoma)-MEK (MAPK/ERK-Kinase)-ERK, in der RAS-GTP RAF rekrutiert, was zu einer sequentiellen Phosphorylierung von MEK1/2 und dann von ERK1/2 an Thr202/Tyr204 führt. Nach der Phosphorylierung dimerisiert ERK1/2 und transloziert in den Zellkern, wo es Transkriptionsfaktoren wie MYC (Myelocytomatosis virales Onkogen-Homolog), ELK1 (ETS Like-1 Protein) und AP-1 (Aktivatorprotein-1) phosphoryliert und so die Zellproliferation, den Differenzierungsblock und das Überleben fördert8. Bei der AML führen Mutationen in FLT3 (fms-ähnliche Tyrosinkinase 3), RAS oder KIT häufig zu einer konstitutiven ERK-Aktivierung 9,10 (Abbildung 1A).
Mutationen in FLT3, RAS oder KIT bewirken auch die Hochregulierung des mTORC1-Signalwegs, was das AML-Wachstum und die therapeutische Resistenz ermöglicht, indem onkogene Prozesse wie die metabolische Neuverdrahtung, die Modulation der Proteinsynthese, die Ribosomenbiogenese und die Autophagie unterstütztwerden 11. Durch die Regulation der mRNA-Translation erleichtert mTORC1 die Produktion von onkogenen Proteinen und anderen essentiellen Faktoren für das Fortschreiten der AML. Eine Schlüsselgruppe von mTORC1-Substraten sind 4E-BPs (Eukaryotische Initiationsfaktor-4E-bindende Proteine). In ihrem hypophosphorylierten Zustand binden 4E-BPs an eIF4E (eukaryotischer Initiationsfaktor 4E) und hemmen so die cap-abhängige Translation. Die Phosphorylierung von 4E-BP1 an Thr37/46 durch mTORC1 bewirkt die Freisetzung von eIF4E und ermöglicht die Initiierung der Translation für wichtige onkogene mRNAs wie MYC, CCND1 (Cyclin D1) und MCL-1 (myeloische Zellleukämie 1), wodurch die leukämische Proliferation und das Überleben gefördertwerden 8,12. Darüber hinaus verbessert die RPS6-Phosphorylierung an Ser240/244, vermittelt durch S6K1 (Ribosomales Protein S6-Kinase beta-1) stromabwärts von mTORC1, die Ribosomenbiogenese und die mRNA-Translation, wodurch die Synthese von Proteinen erhöht wird, die für die metabolische Anpassung, Stressresistenz und schnelle Proliferation notwendig sind 8,13. Bemerkenswert ist, dass die mTORC1-Aktivität eng mit der metabolischen Anpassung verbunden ist, einer kritischen Überlebensstrategie, die von AML-Zellen unter therapeutischem Stress eingesetzt wird 13,14,15 (Abbildung 1A).
Der JAK/STAT5-Signalweg ist eine weitere entscheidende Signalachse bei AML, insbesondere in Fällen mit Mutationen, die Zytokinrezeptoren oder Signalmediatoren wie JAK2, FLT3 und CALR (Calreticulin) betreffen16,17. STAT5 wird als Reaktion auf die Zytokin-Signalübertragung über Rezeptoren wie FLT3 und JAK2 aktiviert. Nach der Ligandenbindung phosphorylieren assoziierte Januskinasen (JAKs) STAT5 an Tyr694. Phosphoryliertes STAT5 dimerisiert und transloziert in den Zellkern, wo es an spezifische DNA-Sequenzen bindet, um die Transkription von Genen zu regulieren, die am Überleben, der Proliferation und der Differenzierung von Zellen beteiligt sind8. Bei AML führt die konstitutive Aktivierung von STAT5, oft aufgrund von Mutationen in FLT3 oder JAK2, zu einer persistenten Expression von Genen, die die Leukämogenese fördern18 (Abbildung 1A).
Über ihre individuellen Beiträge hinaus laufen diese Signalwege zusammen, um sowohl die Transkription als auch die Translation zu regulieren und das Proteom von AML-Zellen so zu gestalten, dass das Überleben und die Resistenz gefördert werden. Insbesondere die mRNA-Translation entwickelt sich zu einem Schlüsselfaktor in der AML-Pathophysiologie, da sie die schnelle Produktion von onkogenen Proteinen und Stressreaktionsfaktoren ermöglicht, die es AML-Zellen ermöglichen, sich an Umwelteinflüsse anzupassen und den Auswirkungen gezielter Therapien zu entgehen. Eine Dysregulation der Translationsmaschinerie, wie z. B. eukaryotische Initiationsfaktoren (eIFs) oder ribosomale Proteine, wurde mit der therapeutischen Resistenz und der schlechten Prognose bei AML in Verbindung gebracht19. Eine detaillierte Untersuchung der Rolle der MAPK-, mTORC1- und JAK/STAT5-Signalwege bei der transkriptionellen und translationalen Regulation ist unerlässlich, um ein umfassendes Verständnis der molekularen Mechanismen zu erlangen, die der AML-Progression und -Resistenz zugrunde liegen. Solche Erkenntnisse sind entscheidend für die Identifizierung neuer Biomarker für das Ansprechen auf die Behandlung und die Entwicklung neuartiger therapeutischer Strategien, die auf diese Signalwege abzielen, um Resistenzen zu überwinden. Dieser Artikel stellt ein Protokoll vor, das speziell für die Untersuchung dieser Signalnetzwerke in AML-Patienten-abgeleiteten Xenotransplantatmodellen (PDX) entwickelt wurde.
Einer der wichtigsten Vorteile dieses Protokolls ist die Integration der Knochenmarkaspiration mit der intrazellulären Phosphoflow-Zytometrie, die eine dynamische und minimal-invasive Bewertung der Aktivierung des Signalwegs in AML-Patienten-abgeleiteten Xenotransplantatmodellen (PDX) ermöglicht. Dies ist besonders wertvoll für die Überwachung des Aktivierungsstatus von Schlüsselsignalwegen wie MAPK, mTORC1 und JAK/STAT5 als Reaktion auf zielgerichtete Therapien. Die Kombination dieser Techniken ermöglicht den Erwerb eines umfassenden und hochauflösenden Verständnisses der AML-Biologie, was letztendlich zur Entwicklung effektiverer therapeutischer Strategien beiträgt.
Protokoll
Die folgenden Versuche wurden mit Genehmigung des McGill University Animal Care Committee (CIHR PJT-186019) und des Institutional Review Board des Jewish General Hospital (11-047) durchgeführt. In diesem Protokoll wurden männliche NOD-scid IL2Rg^null-3/GM/SF (NSGS) Mäuse im Alter von 8 Wochen bis 6 Monaten und einem Gewicht von 20-30 g zuvor mit humanen AML-Zellen von Patienten transplantiert. Einzelheiten zu den in dieser Studie verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Knochenmark-Aspiration
VORSICHT: Sicherheitsvorkehrungen für die Verwendung von Nadeln sollten befolgt werden.
- Perioperative Analgesie: 1-4 h vor der Knochenmarkaspiration den Mäusen subkutan (s.c.) 0,1 mg/kg Buprenorphin mit langsamer Freisetzung injizieren. Dies gewährleistet eine Analgesie für bis zu 72 Stunden nach dem Eingriff.
- Bereiten Sie den Operationsbereich unter der Laminar-Flow-Haube mit einem chirurgischen Pad, einem Haarschneider, einer Heizlampe und allen notwendigen Materialien für die Knochenmarkaspiration vor (25 g Spritzen, 1,5 ml Mikrozentrifugenröhrchen mit 0,5 ml PBS auf Eis, 70 % Isopropanol-Tupfer). Sichern Sie den Nasenkegel für die Isofluran-Inhalation mit Klebeband (Abbildung 2A).
- Bereiten Sie für jedes Aspirat zwei 25-G-Spritzen vor, eine für die Knochenpunktion ("trockene Nadel") und eine Spritze, deren Nabe für die Aspiration mit PBS gespült wurde ("gespülte Nadel").
- Betäuben Sie die Maus mit einer Isofluran-Inhalation, die von einem zertifizierten Verdampfer gemäß den Anweisungen des Herstellers und den tierärztlichen Richtlinien verabreicht wird. Örtliche Verfahren können variieren. Zum Vergleich: Dieses Protokoll folgte den Standardarbeitsanweisungen der McGill University für die Mausanästhesie20.
- Bestätigen Sie die Narkosetiefe durch mangelnde Reaktion auf das Einklemmen des Fußes und die Muskelentspannung. Tragen Sie Tiersalbe auf die Augen auf, um Trockenheit zu verhindern, während das Tier unter Narkose steht. Kontinuierliche Überwachung der Atemfrequenz während der Anästhesie.
- Rasieren Sie das gesamte Bein, an dem die Aspiration durchgeführt wird, mit dem Haarschneider. Desinfizieren Sie die Aspirationsstelle (Femur) mit einem antiseptischen Pad, das mit Isopropylalkohol getränkt ist (Abbildung 2B).
- Legen Sie die Gelenkfläche des Femurs, an der sich die Einstichstelle befindet, frei, indem Sie das Knie beugen und das Bein mit der nicht dominanten Hand ruhigstellen. Legen Sie den Daumen auf das Schienbein, den Zeigefinger auf den Oberschenkelknochen und den Mittelfinger, um alles an der Außenseite der beiden Knochen zu stabilisieren (Abbildung 2C).
HINWEIS: Sorgen Sie für eine sehr stabile Positionierung des Beins mit der nicht dominanten Hand, um jegliche Bewegung des Beins während der Aspiration zu verhindern, die zu Versagen oder Verletzungen führen kann. Wenn die Ruhigstellung des Beins nicht stabil ist, positionieren Sie die Hand neu und versuchen Sie es erneut, bevor Sie eine Punktion vornehmen. - Während der Ruhigstellung mit der nicht-dominanten Hand wird der Kniebereich erneut mit Isopropylalkohol desinfiziert (Abbildung 2C), um die verbleibenden Haare zu entfernen und die Sichtbarkeit der Knochenstruktur zu verbessern.
- Mit der ersten trockenen 25 G Spritze ein Loch in die Oberschenkelgelenkfläche bohren, indem Sie sie in der Mitte des Oberschenkelgelenks positionieren und ohne Kraftaufwand drehen (Abbildung 2D,E). Stellen Sie sicher, dass die Nadel der Spritze vollständig mit der Längsachse des Oberschenkelknochens ausgerichtet ist (0° Abweichung), um korrekt in das Knochenmark einzudringen.
HINWEIS: Behalten Sie diese Ausrichtung bei, um einen reibungslosen Eintritt zu gewährleisten, ohne das umgebende Gewebe unnötig zu beschädigen. Wenn die Nadel in die Mitte des Oberschenkelknochens eintritt, deutet eine leichte Abnahme des Widerstands auf ein erfolgreiches Eindringen in die Knochenmarkhöhle hin (Abbildung 2F). Vermeiden Sie bei diesem Schritt übermäßige Kraft auf die Nadel, da dies zum Verlust der korrekten Ausrichtung, zu Frakturen oder Traumata führen kann. Durch die Verwendung einer rotatorischen Bohrbewegung sind die Chancen größer, dass die Nadel den Weg des geringsten Widerstands einschlägt und korrekt in die Femurhöhle eintritt. Eine Nadel, die richtig im Oberschenkelknochen positioniert ist, sollte auch dann senkrecht bleiben, wenn die Hand, die sie hält, entfernt wird. - Sobald Sie sich im Knochenmark befinden, entfernen Sie die Spritze allmählich durch Drehen (Abbildung 2G) und führen Sie die zweite gespülte Spritze in das Loch ein, das mit der ersten Nadel entstanden ist (Abbildung 2H,I).
HINWEIS: Es wird eine zweite Spritze verwendet, da die erste beim Bohren oft durch Knochen blockiert wird. - Üben Sie ein Vakuum auf die in den Oberschenkelknochen eingeführte Spritze aus, während Sie die Spritze sanft drehen und allmählich zurückziehen. Etwa 10-20 μl Knochenmark sollten in der Nabe der Spritze sichtbar sein (Abbildung 2J).
HINWEIS: Führen Sie die Nadel bei Bedarf vorsichtig wieder in den Knochen ein, um die Knochenmarkentnahme zu optimieren. - Übertragen Sie das Knochenmark, indem Sie den Inhalt der Spritze in das gekühlte Mikrozentrifugenröhrchen spülen, das 500 μl PBS enthält (Abbildung 2K). Bleiben Sie auf Eis und fahren Sie so schnell wie möglich mit den Schritten 2-3 fort.
- Üben Sie 30 s lang mit einem Isopropanol-Tupfer sanften Druck auf die Einstichstelle aus, um Blutungen zu stoppen (Abbildung 2L).
- Legen Sie die Maus in einen sauberen Aufwachkäfig, der mit einer Wärmelampe erwärmt wurde. Überwachen Sie Atmung und Mobilität, bis das Tier wach und vollständig genesen ist, bevor Sie es mit den anderen Mäusen in Gemeinschaftskäfige setzen. Prüfen Sie auf Anzeichen von Blutungen.
2. Lebende/tote und Oberflächenmarkierungsflecken
HINWEIS: Halten Sie die Zellen während des gesamten Vorgangs auf Eis. Bereiten Sie vor Schritt 2 und Schritt 3 Mastermixe mit Antikörper-Färbelösungen vor (für Schritt 2.4 und Schritt 2.7) vor und bewahren Sie sie bei 4 °C lichtgeschützt auf. Eine frische 1,6%ige Formaldehydlösung (Schritt 3.1) und eine 100%ige Methanollösung werden bei -20 °C (Schritt 3.6) hergestellt.
- Zählen Sie die lebensfähigen Zellen unter Verwendung von Acridinorange/Propidiumiodid (AO/PI) mit dem Zellzähler21.
- Übertragen Sie das entsprechende Volumen für 1 Million Zellen in ein neues 1,5-ml-Röhrchen. Wenn die Lautstärke nicht ausreicht, nehmen Sie die gesamte Lautstärke. Poolen Sie die restlichen Zellen und aliquotieren Sie in 3 Replikatröhrchen (je 1 M) für die Isotyp-Kontrollfärbung und 1 Röhrchen für die ungefärbte Kontrolle.
- Zellen bei 500 x g für 5 min bei 4°C zentrifugieren. Saugen Sie vorsichtig an und entsorgen Sie den Überstand mit einem Vakuum-Absaugsystem.
- Fügen Sie 200 μl pro Probe fluoreszierender Zellfärbelösung hinzu, die 1/100 in PBS verdünnt ist, um die toten Zellen zu markieren. Suspendieren Sie die Zellen vorsichtig mit der Pipette. Machen Sie dasselbe mit den zusätzlichen Röhrchen für die Isotyp-Kontrollfärbung.
- 10 min auf Eis lichtgeschützt inkubieren.
- Die Zellen bei 500 x g für 5 min bei 4 °C zentrifugieren. Saugen Sie vorsichtig an und entsorgen Sie den Überstand mit einem Vakuumsystem.
- 100 μl hCD45-BUV395-Antikörper pro Probe verdünnt 1/100 in PBS mit 2 % fötalem Rinderserum zur Markierung der menschlichen hämatopoetischen Zellen hinzufügen. Machen Sie dasselbe mit den zusätzlichen Röhrchen, die für die Isotypkontrolle aufbewahrt werden.
- 15 Minuten auf Eis lichtgeschützt inkubieren. Fahren Sie sofort mit Schritt 3 fort.
3. Fixierung und Permeabilisierung
- Bereiten Sie eine frische 1,6%ige Formaldehyd/PBS-Lösung vor: Mischen Sie für jede Probe 29,5 μl 37%ige Formaldehyd-Stammlösung + 970,5 μl PBS (berücksichtigen Sie vorsichtshalber ein zusätzliches Volumen). Bewahren Sie die 1,6%ige Formaldehyd/PBS-Lösung bei Raumtemperatur auf.
ACHTUNG: Formaldehyd sollte in einer Chemikalienhaube gehandhabt und gemäß den institutionellen Sicherheitsvorschriften entsorgt werden. - Die Zellen bei 500 x g für 5 min bei 4 °C zentrifugieren. Der Überstand wird mit einem Vakuumsystem abgesaugt und entsorgt.
- In 1 ml 1,6%iger Formaldehyd/PBS-Lösung resuspendieren.
- 10 min bei Raumtemperatur vor Licht geschützt inkubieren.
- Die Zellen bei 500 x g für 5 min bei 4 °C zentrifugieren. Der Überstand wird mit einem Vakuumsystem abgesaugt und entsorgt.
- 1 ml 100 % Methanol, gekühlt bei -20 °C, direkt in das Röhrchen geben.
- Inkubieren Sie die Proben 30 Minuten lang bei -20 °C lichtgeschützt.
HINWEIS: Zu diesem Zeitpunkt ist es möglich, fixierte und permeabilisierte Zellen bis zu einem Monat vor der Analyse bei -80 °C zu lagern.
4. Phosphoflow-Färbung
HINWEIS: Das folgende Antikörper-Panel wurde mit einem Durchflusszytometer validiert, das mit den folgenden Lasern ausgestattet ist: 320 nm, 355 nm, 405 nm, 488 nm, 561 nm, 637 nm und 808 nm. Dieses Panel sollte erneut validiert werden, wenn unterschiedliche Zytometer mit unterschiedlichen Laser- und Detektoraufbauten verwendet werden.
- Bereiten Sie eine Antikörper-Mastermix-Lösung mit den folgenden Verdünnungen in einem handelsüblichen Färbepuffer vor (Tabelle 1), wobei ein Volumen von 50 μl für jede Probe berechnet wird. Bei 4 °C lichtgeschützt aufbewahren.
- Halten Sie PBS für Waschvorgänge (Schritte 4.8, 4.10) auf Eis (2 mL für jede Probe).
- Bereiten Sie eine zweite Mastermix-Lösung für die technischen Replikate der Isotypkontrolle im Färbepuffer vor (Tabelle 1), wobei für jede Probe ein Volumen von 50 μl berechnet wird. Bei 4 °C lichtgeschützt aufbewahren. Für die technische Reproduzierbarkeit wird eine Mindestanzahl von zwei Isotyp-Kontrollproben empfohlen.
- Die Zellen aus Schritt 3.7 bei 500 x g für 5 min bei 4 °C zentrifugieren. Der Überstand wird mit einem Vakuumsystem abgesaugt und entsorgt.
HINWEIS: Nach der Fixierung und Permeabilisierung können die Zellen durchscheinender erscheinen. - 50 μl Antikörper-Mix-Lösung (Schritt 4.1) oder Isotyp-Kontroll-Mix-Lösung (Schritt 4.2) zugeben. Suspendieren Sie die Zellen vorsichtig mit einer Pipette.
- Alle Proben über Nacht bei 4 °C lichtgeschützt inkubieren.
- Zellen bei 500 x g für 5 min bei 4 °C zentrifugieren. Der Überstand wird mit einem Vakuumsystem abgesaugt und entsorgt.
- Waschen Sie mit 1000 μl PBS, indem Sie es vorsichtig mit der Pipette resuspendieren.
- Zellen bei 500 x g für 5 min bei 4 °C zentrifugieren. Der Überstand wird mit einem Vakuumsystem abgesaugt und entsorgt.
- Führen Sie eine zweite Wäsche mit 1000 μl PBS durch, indem Sie vorsichtig mit der Pipette resuspendieren.
- Zellen bei 500 x g für 5 min bei 4 °C zentrifugieren. Der Überstand wird mit einem Vakuumsystem abgesaugt und entsorgt.
- Proben in 200 μl PBS resuspendieren. Transfer auf FACS-Röhrchen oder -Platten zur Analyse mittels Durchflusszytometrie (Abbildung 3).
- Bereiten Sie einfarbige Kompensationskontrollen mit Kügelchen vor, indem Sie 0,1 μl jedes Antikörpers mit Kompensationskügelchen inkubieren, gemäß den Anweisungen des Herstellers (siehe Materialtabelle).
Ergebnisse
Das Versuchsdesign zielt darauf ab, den Phosphorylierungszustand ausgewählter Proteine von Interesse zu verschiedenen Zeitpunkten zu überwachen, z. B. 1 Tag vor Beginn der Behandlung und 15 Tage nach Beginn der Behandlung. Diese Baseline dient als kritische Kontrolle, um die Richtigkeit nachfolgender Veränderungen in der Aktivierung des Signalwegs nach der Behandlung zu überprüfen. Nach fünfzehn Tagen Behandlung wird ein zweiter Vergleich durchgeführt, um die Signalwegmodulation bei behandelten Mäusen im Vergleich zu Vehikel-behandelten Kontrollen zu bewerten (Abbildung 4). Dieser zweistufige Ansatz ermöglicht die Unterscheidung von behandlungsinduzierten Effekten von der Variabilität der Ausgangswerte.
Für diese Studie wurde ein AML-PDX-Mausmodell verwendet. Den Mäusen wurden patienteneigene AML-Zellen transplantiert, die durch die folgenden Mutationen gekennzeichnet waren: DNMT3AMR882H mit einer varianten Allelfraktion (VAF) von 48 %, NPM1W288fs VAF 36 %, FLT3ITD VAF 10 % und IDH2R140Q VAF 44 %. Nach der Transplantation wurden drei Wochen Zeit für das Tumorwachstum eingeräumt, bevor mit der Behandlung begonnen wurde. Die mit FLT3-Mutanten transplantierten PDX-Mäuse wurden fünfzehn Tage lang mit einem von drei Schemata behandelt: Placebo, Golderitinib (15 mg/kg täglich) oder eine Kombination aus Venetoclax (50 mg/kg täglich), 5-Azacitidin (2,5 mg/kg täglich) und Cedarizudin (3 mg/kg täglich) (Abbildung 4A).
In Bezug auf die erzielten Ergebnisse ist es erwähnenswert, dass die Behandlung mit einem Venetoclax-basierten Schema zu einer signifikant erhöhten STAT5- und RPS6-Phosphorylierung führte, was darauf hindeutet, dass diese Signalwege zur Therapieresistenz beitragen (Abbildung 4E). Im Gegensatz dazu reduzierte gilteritinib, ein Medikament, das auf FLT3 abzielt, den Phosphorylierungsstatus mutierter FLT3-Effektoren nicht. Es ist möglich, dass in der getesteten AML-Probe das Vorhandensein zusätzlicher sekundärer Mutationen neben FLT3-ITD (z. B. IDH2) zur Aktivierung dieser Signalwege beiträgt oder dass die medikamentöse Behandlung über zwei Wochen zu einer selektiven Eliminierung von AML-Zellen mit verminderter Signalübertragung führt. Da alle analysierten Phosphoproteine aus der gleichen Zellpopulation stammen, ist es möglich, die Phosphoproteinaktivierung zu vergleichen. In diesem Experiment scheint die stärkste Korrelation bei der Phosphoproteinfärbung zwischen p-STAT5 und p-RPS6 zu bestehen (Ergänzende Abbildung 1A), die beide in dieser Versuchsgruppe nach der Behandlung hochreguliert sind (Abbildung 4E). Es scheint eine geringere Beziehung zwischen p-STAT5 und p-ERK zu geben (Ergänzende Abbildung 1B). Wichtig ist, dass die Zellgröße (gemessen mit FSC-A) keinen wesentlichen Beitrag zur Gesamtpositivität von p-STAT5 leistet, was unterstreicht, dass die Positivität der Färbung nicht nur ein Produkt der Zellgröße ist (Ergänzende Abbildung 1C). Dieser experimentelle Rahmen ermöglicht eine umfassende Bewertung der Auswirkungen dieser Behandlungen auf die Modulation des Signalwegs.
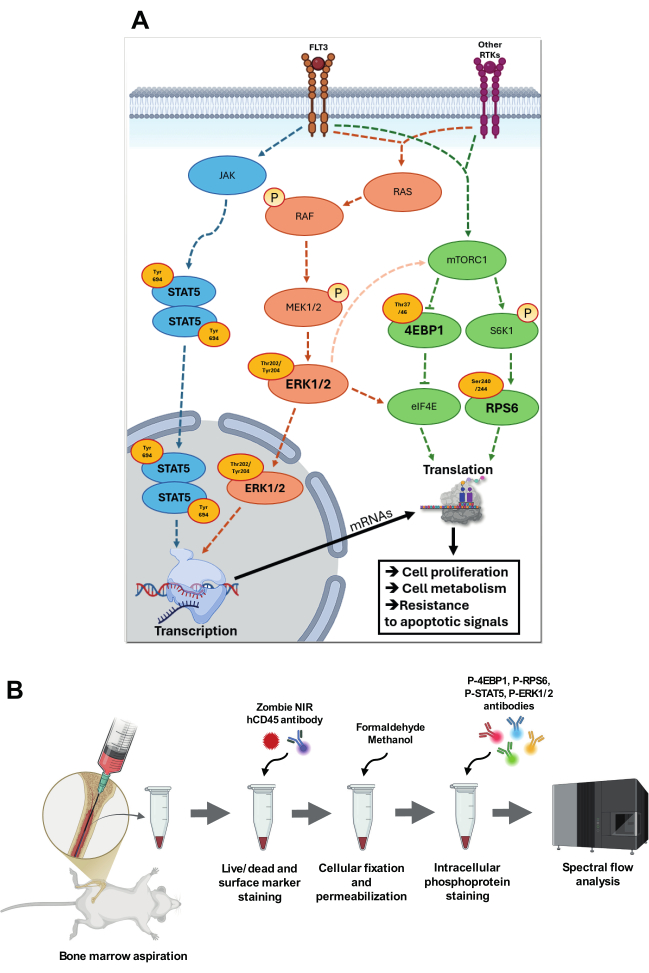
Abbildung 1: Visualisierung der Zielsignalwege und der Strategie zu deren Analyse. (A) Überblick über die Signalwege, an denen p-STAT5 (Tyr694), p-4EBP1 (Thr37/46), p-RPS6 (Ser240/244) und p-ERK1/2 (Thr202/Tyr204) beteiligt sind. Im p-STAT5-Signalweg durchläuft JAK eine Autophosphorylierung, die seine katalytische Aktivität erhöht, dann phosphoryliert es spezifische Tyrosinreste und schafft Andockstellen für STAT-Proteine. Phosphoryliertes STAT5 (Tyr694) homodimerisiert und transloziert in den Zellkern, wo es an spezifische STAT-responsive Elemente in den Promotorregionen der Zielgene bindet. In der RAS-RAF-MEK-ERK-Kaskade führt die Autophosphorylierung des FLT3-Rezeptors oder anderer Rezeptor-Tyrosinkinasen (RTKs) bei der Ligandenbindung zum Austausch von GDP gegen GTP auf RAS, wodurch RAS aktiviert wird. Aktiviertes RAS-GTP rekrutiert RAF an die Plasmamembran, wo RAF eine Konformationsänderung durchläuft und aktiv wird. RAF phosphoryliert und aktiviert dann MEK1/2, eine Kinase mit doppelter Spezifität, die wiederum ERK an Thr202/Tyr204-Resten phosphoryliert. Aktiviertes ERK1/2 transloziert in den Zellkern, wo es spezifische Transkriptionsfaktoren phosphoryliert. ERK1/2 ist auch in der Lage, über intermediäre Signalwege die mTORC1-Aktivität zu erhöhen und eIF4E an bestimmten Stellen zu phosphorylieren, um die Translationsaktivität zu erhöhen. mTORC1 wird durch Nährstoffe und Wachstumsfaktoren durch FLT3 und andere RTKs aktiviert und phosphoryliert nachgeschaltete Ziele wie S6K1 und 4E-BP1. S6K1 wiederum phosphoryliert RPS6, was die Ribosomenfunktion verbessert und die Translation aktiviert. Die Hyperphosphorylierung von 4E-BP1 setzt eIF4E frei, was die Assemblierung des Translationsinitiationskomplexes eIF4F und die Aktivierung der cap-abhängigen Translation ermöglicht. Alle diese Signalwege sind stark an der AML beteiligt und tragen zu erworbenen Anpassungen bei, indem sie die Zellproliferation, den Stoffwechsel und die Resistenz gegen apoptotische Signale erhöhen. (B) stellt die Hauptschritte des gekoppelten Protokolls für Knochenmarkaspiration und intrazelluläre Phosphoflow-Färbung vor. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
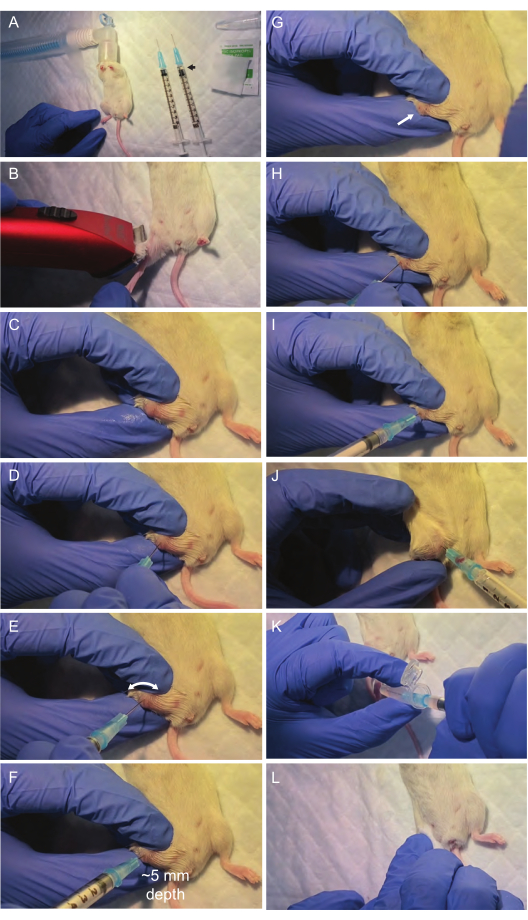
Abbildung 2: Visualisierung kritischer Schritte während der Knochenmarkaspiration . Das Operationsgebiet und die notwendigen Materialien werden unter einer Laminar-Flow-Haube eingerichtet. Nach der Anästhesie durch Isofluran-Inhalation (A) wird die Femurgelenkfläche für die Aspiration vorbereitet (B,C). Der Oberschenkelknochen wird mit einer ersten Spritze punktiert, die in der Mitte des Oberschenkelknochens (D) ausgerichtet ist. Es ist wichtig, keinen starken Druck auf die Nadel auszuüben und stattdessen eine rotatorische Bohrbewegung auszuführen. Dies reicht in der Regel aus, damit die Nadel die Oberfläche des Knochens perforiert und dem Weg der Oberschenkelhöhle folgt. Anschließend wird das Knochenmark mit einer zweiten Spritze durch die Einstichstelle (I,J) aspiriert. Nach dem Transfer des Knochenmarkaspirats in ein Mikrozentrifugenröhrchen (K) wird sanfter Druck ausgeübt, um die Blutung im Bereich (L) zu stoppen, und die Maus wird zur Genesung in einen warmen und sauberen Käfig gelegt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
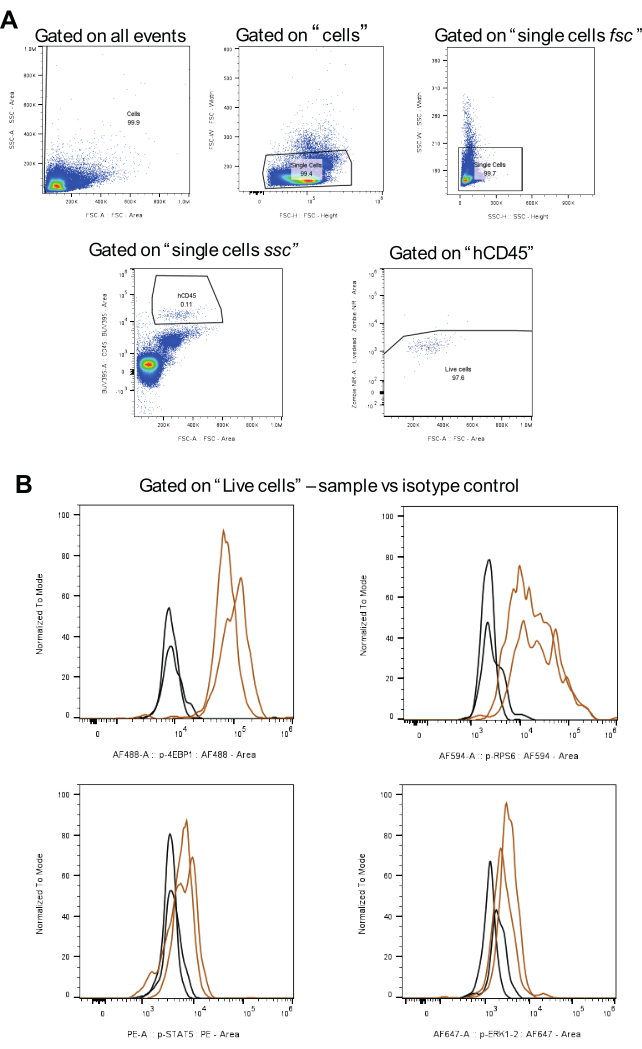
Abbildung 3: Arbeitsablauf für die Analyse der Gating-Strategie, einschließlich Isotypsteuerungen. (A) stellt Gating-Strategien für lebende Zellen, den Ausschluss von Dubletten und hCD45-positiven AML-Zellen dar. (B) zeigt Signale für jedes Phosphoprotein in Braun und Isotyp-Kontrollen in Schwarz (zwei biologische Replikate). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
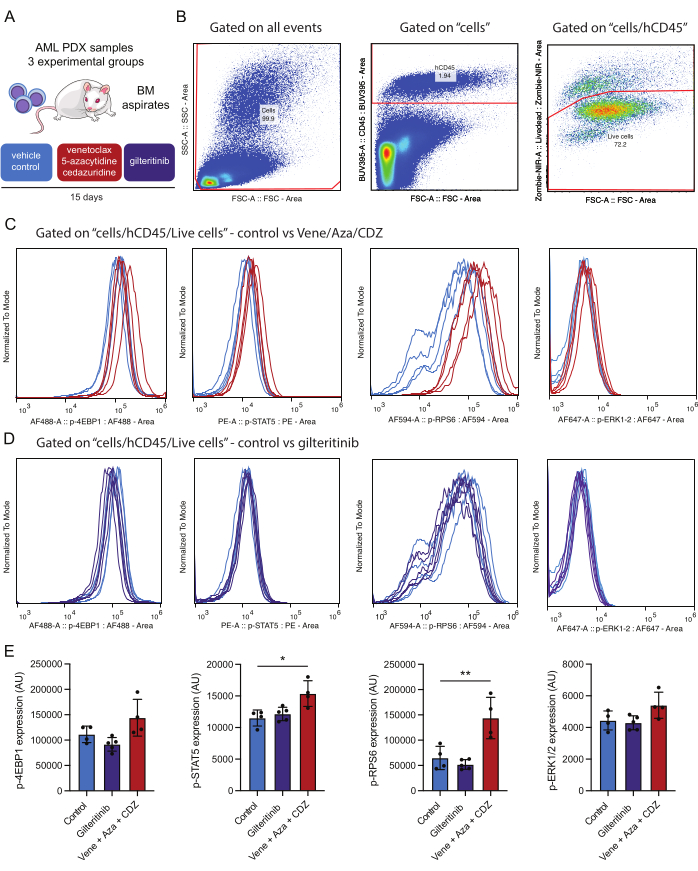
Abbildung 4: Arbeitsablauf für den Nachweis und die Analyse intrazellulärer Phosphoproteine nach Immunstatisierung lebensfähiger AML-Zellen im Knochenmark. (A) NSG-SGM3-Mäuse, die mit von Patienten gespendeten AML-Zellen transplantiert wurden, wurden mit Vehikel (Kontrolle) oder Venetoclax, 5-Azacytidin und Cedazuridin (vene/aza/CDZ) oder gilteritinib behandelt. Nach 15 Tagen wurden Knochenmarkaspirate (BM) aufbereitet. (B) stellt die Gating-Strategie für die Analyse lebensfähiger AML-Zellen (z. B. hCD45/Zombie-NIR-positiv) 15 Tage nach der Behandlung dar. (C,D) stellen die Normalisierung des Signals für jeden der Phosphoantikörper dar, wie angegeben, in 10.000 AML-Zellen, die von Mäusen isoliert wurden, die mit Venetoclax/5-Azacytidin/Cedazuridin oder Vehikel (B) oder Gilteritinib oder Vehikel (C) behandelt wurden. Die Spuren repräsentieren die Signale in AML-Zellen, die von der Kontrollmaus isoliert wurden, die mit Vehikel (hellblau), vene/aza/CDZ (rot) oder Gilteritinib (violett) behandelt wurde. (E) Das Histogramm stellt die mittleren Wertänderungen der Färbeintensitäten für jedes Phosphoprotein dar, das an lebenden menschlichen AML-CD45+ -Zellen von drei Mäusen und SD getestet wurde. Fehlerbalken stellen die Standardabweichung dar. Die Sternchen weisen auf signifikante Unterschiede in den Färbeintensitäten hin, die durch die ANOVA mit p-Werten unter 0,05 (*) und 0,01 (**) beurteilt wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Antikörper | Fluorochrom | Verdünnung |
| p-RPS6 (Ser240/244) | Nr. AF594 | 1/50 |
| p-4EBP1 (Thr37/46) | Nr. AF488 | 1/50 |
| p-STAT5 (Tyr694) | PE | 1/100 |
| P-ERK1/2 (Thr202/Tyr204) | Nr. AF647 | 1/100 |
| Kaninchen-IgG-Kontrolle | Nr. AF594 | 1/50 |
| Kaninchen-IgG-Kontrolle | Nr. AF488 | 1/50 |
| Kaninchen-IgG-Kontrolle | PE | 1/100 |
| Kaninchen-IgG-Kontrolle | Nr. AF647 | 1/100 |
Tabelle 1: Liste der optimierten Verdünnungen für Antikörper.
Ergänzende Abbildung 1: Vergleich von p-STAT5, p-RPS6, p-ERK1/2 und FSC-A in einer repräsentativen AML-PDX-Probe. Diese Abbildung zeigt ein Beispiel für die Beziehung zwischen p-STAT5, p-ERK und p-RPS6 bei Maus "E9" am Tag 15 der Behandlung mit Venetoclax/5-Azacitidin/Cedazuridin (Ergebnis aus Abbildung 4C). In dieser Probe scheint die stärkste Korrelation bei der Phosphoproteinfärbung zwischen p-STAT5 und p-RPS6 (A) zu bestehen, die beide in dieser Versuchsgruppe nach der Behandlung hochreguliert sind (Abbildung 4E). Es scheint eine geringere Beziehung zwischen p-STAT5 und p-ERK (B) zu geben. Wichtig ist, dass die Zellgröße (gemessen mit FSC-A) keinen wesentlichen Beitrag zur Gesamtpositivität von p-STAT5 leistet, was unterstreicht, dass die Positivität der Färbung nicht nur ein Produkt der Zellgröße (C) ist. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Kritische Schritte
Der Einsatz immunologisch basierter Techniken bei der Untersuchung komplexer Signalwege durch spezifischen Nachweis von Phosphoproteinen erfordert, dass experimentelle Variablen streng kontrolliertwerden 22, die Probenvorbereitung akribisch ist und ergänzende Techniken zur Validierung eingesetzt werden. Die Integration dieser Praktiken gewährleistet die Reproduzierbarkeit, Präzision und Robustheit der Daten und trägt letztendlich zu zuverlässigeren biologischen Schlussfolgerungen bei. Diese Bemühungen verbessern nicht nur die wissenschaftliche Strenge der Methode, sondern erweitern auch ihre Anwendbarkeit in komplexen Studien zur Zellsignalisierung und -regulation. Die richtige Anästhesie und eine schonende Handhabung sind entscheidend für die Minimierung von physiologischem Stress, der die experimentellen Ergebnisse erheblich verändern kann, insbesondere in Studien, die sich auf Immunantworten oder Signalwege konzentrieren. Die Sicherstellung geeigneter Analgetika-Protokolle trägt weiter zur Aufrechterhaltung des Tierschutzes bei und verhindert gleichzeitig schmerzbedingten Stress, der die Daten beeinträchtigen könnte. Die Aufrechterhaltung aseptischer Bedingungen während des Eingriffs ist von entscheidender Bedeutung, um Infektionen zu verhindern, die zu Entzündungsreaktionen führen und möglicherweise experimentelle Ergebnisse verfälschen können. Dazu gehören das Sterilisieren von Geräten, das Tragen sauberer Handschuhe und die gründliche Desinfektion der Aspirationsstelle.
Phosphorylierte Proteine sind bei der Manipulation biologischer Proben sehr anfällig für die Dephosphorylierung durch Phosphatasen22,23. Um die Phosphorylierungszustände während der Verarbeitung zu erhalten, ist eine sofortige Fixierung unerlässlich. Es wurden zwei verschiedene Fixierungs-/Permeabilisierungsmethoden getestet: ein Cytofix/Cytoperm-Kit und die gängige Formaldehyd/Methanol-Methode, die im Protokoll beschrieben ist. Unter diesen lieferte die methanolbasierte Methode sauberere Ergebnisse mit helleren Fluoreszenzsignalen, was sie zur bevorzugten Wahl machte. Nach der Fixierung können die Proben kurzfristig bei -20 °C oder langfristig bei -80 °C gelagert werden. In Experimenten lieferten fixierte Proben, die bis zu drei Monate bei -80 °C gelagert wurden, konsistente Ergebnisse. Bei der Antikörperfärbung kann eine Inkubation über Nacht die Genauigkeit erhöhen, insbesondere bei subtilen Phosphorylierungsverschiebungen, obwohl dies vom spezifischen Experiment und den untersuchten Arzneimittelwirkungen abhängt. Eine kürzere Inkubation von 1 h wurde auch auf Eis getestet, das vor Licht geschützt war, was in bestimmten Fällen zu akzeptablen Ergebnissen führte. Um eine genaue Bewertung des Hintergrundrauschens zu gewährleisten, werden Isotypkontrollen als Referenz für unspezifische Bindungen empfohlen, wie in Abbildung 3 dargestellt.
Modifikationen und Fehlerbehebung der Technik
Um technische Fähigkeiten zu entwickeln, üben die Auszubildenden in unserer Gruppe die Nadeleinstichtechnik an euthanasierten Mäusen, wobei die korrekte Platzierung durch Sektion bestätigt werden kann. Das Verfahren an lebenden Tieren wird am effizientesten von zwei Bedienern durchgeführt, wobei sich einer auf die Aspirationen konzentrieren kann, während ein Assistent sich den Aufgaben der Tierüberwachung und der Probenhandhabung widmet. In seltenen Fällen, in denen es nicht möglich ist, nach mehreren Versuchen eine Aspiration zu erhalten, ist es ratsam, den Eingriff abzubrechen, da das Verletzungsrisiko mit jedem Versuch steigt. Ebenso wichtig ist die Überwachung der Tiere nach dem Eingriff. Die Beobachtung auf Anzeichen von Infektionen, Schmerzen oder Stress gewährleistet das Wohlbefinden der Mäuse und die Zuverlässigkeit der Studie. Die Wohnbedingungen sollten die Genesung unterstützen, mit angemessener Einstreu und Ernährung, um äußere Stressfaktoren zu minimieren.
Für die durchflusszytometrische Analyse wird empfohlen, alle fixierten und konservierten Proben von verschiedenen Knochenmarkaspirationstagen gleichzeitig zu verarbeiten. Schwankungen bei der Rehydrierung und Färbung der Probe aufgrund unterschiedlicher Handhabungstage oder Bediener können die vom Zytometer erfasste Fluoreszenzempfindlichkeit beeinträchtigen. Um konsistente Ergebnisse zu gewährleisten, optimieren Sie die Zytometer-Spannungseinstellungen, um alle gefärbten Proben innerhalb des Nachweisbereichs zu halten, bevor Sie fortfahren. Das Alexa Fluor 488-konjugierte p-4EBP1-Protein weist die höchste Helligkeit unter den Markern in diesem Panel auf, was es zu einer zuverlässigen Referenz für die Einstellung des maximalen Nachweisbereichs macht. Obwohl das in diesem Protokoll vorgestellte Antikörperpanel keine Kompensationsanpassungen erforderte, kann dies je nach verwendetem spektralem Durchflusszytometer variieren.
Begrenzungen
Eine der größten Einschränkungen dieser Technik ist die Anzahl der Zellen, die während der Knochenmarkpunktion entnommen werden. Um zuverlässige Ergebnisse zu gewährleisten, ist es wichtig, genügend Zellen zu färben, um mindestens etwa 10.000 Zellen pro Probe zu analysieren. Die Analyse von zu wenigen Zellen kann zu erheblichen Abweichungen zwischen den Proben führen, was die Genauigkeit und Interpretierbarkeit der Daten beeinträchtigt. Die Sicherstellung einer ausreichenden Anzahl von Zellen ist entscheidend für robuste und reproduzierbare mechanistische Studien.
Für die Datenanalyse wird die in Abbildung 3A dargestellte Gating-Strategie angewendet. Zunächst werden nach Ausschluss von Dubletten die interessierenden Zellen mit einem humanen CD45-Antikörper identifiziert, der mit BUV395 gekoppelt ist. Als nächstes erfolgt das Gating für lebende Zellen mit Zombie NIR. Schließlich wird für jedes Phosphoprotein die mediane Fluoreszenzintensität (MFI) berechnet (Abbildung 3B). Alle Zellen, die auf alle phosphorylierten Proteine analysiert wurden, wurden mit der gleichen Strategie gegatet, um Konsistenz und Vergleichbarkeit zwischen den AML-Zellpopulationen zu gewährleisten.
Eine weitere Einschränkung dieser Methode ist das Potenzial für Hintergrundrauschen, das durch unspezifische Antikörperbindung, unzureichendes Waschen, Zellautofluoreszenz oder unsachgemäße Permeabilisierung entstehen kann. Dies kann die Signalspezifität beeinträchtigen und die Genauigkeit der Phosphoflow-Zytometrie-Analyse verringern. Für Benutzer, die auf diese Probleme stoßen, wird ein zusätzlicher Waschschritt empfohlen, um Hintergrundgeräusche zu reduzieren, und Fc-blockierende Reagenzien können verwendet werden, um unspezifische Bindungen zu minimieren. Darüber hinaus kann die Fluoreszenz toter Zellen die Ergebnisse beeinträchtigen, was die Verwendung von Viabilitätsfarbstoffen unerlässlich macht. Wichtig ist, dass für eine genaue Analyse die Anzahl der analysierten Zellen nicht weniger als 500 AML-Zellen betragen sollte, um zuverlässige und reproduzierbare Ergebnisse zu gewährleisten. Es ist auch wichtig sicherzustellen, dass während der Färbung eine ähnliche Anzahl von Zellen verwendet wird, um die Konsistenz zwischen den Proben zu wahren. Trotz dieser Einschränkungen kann eine sorgfältige Optimierung der Steuerungen und Gating-Strategien die Zuverlässigkeit der Methode erhöhen.
Bedeutung der Technik
Die Technik der Knochenmarkpunktion wurde bereits veröffentlicht3; In diesem Protokoll ist jedoch eine aktualisierte Technik enthalten, die zwei Vorteile hervorhebt: eine verbesserte Immobilisierung und die Verwendung eines Zwei-Nadel-Ansatzes, um die Präzision und Konsistenz bei der Knochenmarkaspiration zu verbessern und Probleme mit einer Verstopfung der Nadel mit Knochenfragmenten zu vermeiden. Für Längsschnittstudien kann die Femuraspiration mehrmals durchgeführt werden, was eine leistungsstarke Methode zur Verfolgung biologischer Veränderungen im Laufe der Zeit bei einzelnen Tieren darstellt. Zwischen den Aspirationen am selben Oberschenkelknochen wird ein Erholungsintervall von mindestens einem Monat empfohlen, um eine ausreichende Knochenheilung und Regeneration des Knochenmarks zu ermöglichen. Bei der Verwendung des kontralateralen Femurs ist ein kürzeres Intervall von einer Woche ausreichend, um sicherzustellen, dass sich die Maus von den Auswirkungen der Analgesie und der Anästhesie erholt hat, ohne übermäßigen Stress oder physiologische Variabilität zu verursachen.
Insgesamt bietet diese kombinierte murine Knochenmarkaspirations- und Durchflusszytometrie-Technik wertvolle Einblicke in wichtige Signalwege, einschließlich JAK/p-STAT5, mTORC1/p-4EBP1, mTORC1/p-RPS6 und MEK/p-ERK1/2. Diese Signalwege spielen eine wichtige Rolle bei der Behandlungsresistenz bei AML. Diese Technik ermöglicht die wiederholte Probenahme desselben Tieres und ermöglicht so die Echtzeitüberwachung des Krankheitsverlaufs und des Therapieansprechens auf Einzelzellebene.
Die Phosphoflow-Zytometrie erfasst Phosphorylierungsereignisse und bewahrt die zelluläre Heterogenität 4,23,24. Dies macht es besonders wertvoll für das Verständnis der dynamischen zellulären Reaktionen auf die Therapie in bestimmten leukämischen Subpopulationen.
Zukünftige Anwendungen
Dieses Protokoll bietet ein wertvolles Instrument zur Untersuchung der zugrunde liegenden Mechanismen der Therapieanpassung und des Auftretens von Resistenzen bei AML und ebnet den Weg für tiefere Einblicke und potenzielle therapeutische Fortschritte. Zukünftige Studien könnten diesen Ansatz mit Einzelzell-Transkriptomik oder Proteomik integrieren, um die molekularen Mechanismen, die Resistenz und Krankheitsprogression antreiben, weiter zu untersuchen25. Darüber hinaus könnte die Anwendung dieser Methode auf andere hämatologische Malignome oder entzündliche Erkrankungen ihren Einfluss in der translationalen Forschung erweitern.
Durch die Verfeinerung dieses Protokolls und die Beseitigung seiner Grenzen könnte dieser Ansatz zu einer Standardmethode für die Untersuchung der Phosphoprotein-Signalübertragung bei hämatologischen Erkrankungen werden und letztendlich zur Entwicklung effektiverer therapeutischer Strategien beitragen. Zusammenfassend lässt sich sagen, dass dieses Protokoll ein wertvolles Instrument zur Untersuchung der zugrunde liegenden Mechanismen der Therapieanpassung und des Auftretens von Resistenzen bei AML darstellt und den Weg für tiefere Einblicke und potenzielle therapeutische Fortschritte ebnet.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde durch Transition Grants für LH und FEM von der Cole Foundation sowie durch Zuschüsse der Leukemia and Lymphoma Society of Canada und der Canadian Institutes for Health Research (PJT-186019) für LH und FEM unterstützt. FEM ist ein FRSQ Junior 2 Clinical Scientist und LH ist ein FRSQ Junior 2 Scientist. VG hat ein Promotionsstipendium der Cole Foundation. Abbildung 1 wurde mit BioRender im Rahmen einer Lizenzvereinbarung erstellt. Die Diagramme für die Durchflusszytometrie wurden mit der FlowJo-Software erstellt. Besonderer Dank geht an Dr. Colin Crist und Victoria Richard für den Zugang zu ihrer tierchirurgischen Einrichtung.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL syringes 25G x 5/8 TW | BD Biosciences | #309626 | Syringes for bone marrow aspiration |
| 1.7 mL Microcentrifuge Tubes | FroggaBio | #LMCT1.7B | To aliquot the cells recovered by bone marrow aspiration |
| BD Horizon Brilliant Stain Buffer | BD Biosciences | #563794 | For staining processes |
| Buprenorphine | Fidelis Animal Health | Ethiqa XR | Analgesia for mice |
| CellDrop FL Unlimited | FroggaBio | #CellDrop FL- UNLTD | For cell count |
| D-PBS | Wisent Inc. | #311-425-CL | Media for cells recovered by bone marrow aspiration |
| Eppendorf Centrifuge 5427 R | Millipore Sigma | #EP5429000260 | |
| Fetal Bovine Serum Heat Inactivated Premium CA | Wisent Inc. | #090-450 | For staining processes |
| Formaldehyde solution | Millipore Sigma | #F1635 | Cells Permeabilization |
| humanCD45 [HI30] antibody | BD Biosciences | #563792 | Antibody coupled with BUV395 |
| ID7000 Spectral Cell Analyzer | Sony | Spectral flow cytometer analyzer | |
| Isoflurane 99.9% liquid | McKesson | #803250 | Anesthesia for mice |
| Isospire (isoflurane) Inhalation Anesthetic | Dechra | Anesthesia for mice | |
| Live/dead AO/PI | FroggaBio | CD-AO/PI-1.5 | For cell count |
| Live/dead Zombie NIR | BioLegend+B6:C12 | #423106 | For spectral flow cytometry |
| Methanol solution | Millipore Sigma | #179957 | Cells Fixation |
| P-4EBP1 (Thr37/46) [236B4] antibody | Cell Signaling Technology | #2846 | Antibody coupled with Alexa Fluor 488 |
| p-Erk1/2 (Thr202/Tyr204) [197G2] antibody | Cell Signaling Technology | #13148 | Antibody coupled with Alexa Fluor 647 |
| p-RPS6 (Ser240/244) [D68F8] antibody | Cell Signaling Technology | #9468 | Antibody coupled with Alexa Fluor 594 |
| p-STAT5 (Tyr694) [D47E7] antibody | Cell Signaling Technology | #14603 | Antibody coupled with PE |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #2975 | Antibody coupled with Alexa Fluor 488 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #2985 | Antibody coupled with Alexa Fluor 647 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #8760 | Antibody coupled with Alexa Fluor 594 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #5742S | Antibody coupled with PE |
| Sanitizing wipes | United Canada | #UCDWPR-9022 | Disinfection for bone marrow aspiration |
Referenzen
- Ferrara, F., Schiffer, C. A. Acute myeloid leukaemia in adults. Lancet. 381 (9865), 484-495 (2013).
- Döhner, H., et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 129 (4), 424-447 (2017).
- Chung, Y. R., Kim, E., Abdel-Wahab, O. Femoral bone marrow aspiration in live mice. J Vis Exp. (89), e51660(2014).
- Haas, A., Weckbecker, G., Welzenbach, K. Intracellular Phospho-Flow cytometry reveals novel insights into TCR proximal signaling events. A comparison with Western blot. Cytometry A. 73 (9), 799-807 (2008).
- Perbellini, O., Cavallini, C., Chignola, R., Galasso, M., Scupoli, M. T. Phospho-specific flow cytometry reveals signaling heterogeneity in t-cell acute lymphoblastic leukemia cell lines. Cells. 11 (13), 2072(2022).
- Kornblau, S. M., et al. Simultaneous activation of multiple signal transduction pathways confers poor prognosis in acute myelogenous leukemia. Blood. 108 (7), 2358-2365 (2006).
- Perl, A. E. The role of targeted therapy in the management of patients with AML. Hematology Am Soc Hematol Educ Program. 2017 (1), 54µ65(2017).
- Márton, A., et al. The roles of phosphorylation of signaling proteins in the prognosis of acute myeloid leukemia. Pathol Oncol Res. 30, 1611747(2024).
- Levis, M. FLT3 mutations in acute myeloid leukemia: what is the best approach in 2013. Hematology Am Soc Hematol Educ Program. 2013, 220-226 (2013).
- Roux, P. P., Topisirovic, I. Signaling pathways involved in the regulation of mRNA translation. Mol Cell Biol. 38 (12), e00070-e00118 (2018).
- Nepstad, I., Hatfield, K. J., Grønningsæter, I. S., Reikvam, H. The PI3K-Akt-mTOR signaling pathway in human Acute Myeloid Leukemia (AML) Cells. Int J Mol Sci. 21 (8), ijms21082907(2020).
- Jia, X., Zhou, H. Phospho-eIF4E: A new target for acute myeloid leukemia. Curr Protein Pept Sci. 22 (4), 328-335 (2021).
- Ghosh, J., Kapur, R. Role of mTORC1-S6K1 signaling pathway in regulation of hematopoietic stem cell and acute myeloid leukemia. Exp Hematol. 50, 13-21 (2017).
- Park, H. J., et al. Therapeutic resistance in acute myeloid leukemia cells is mediated by a novel ATM/mTOR pathway regulating oxidative phosphorylation. Elife. 11, 79940(2022).
- Oki, T., et al. Imaging dynamic mTORC1 pathway activity in vivo reveals marked shifts that support time-specific inhibitor therapy in AML. Nat Commun. 12 (1), 245(2021).
- Lee, H. J., Daver, N., Kantarjian, H. M., Verstovsek, S., Ravandi, F. The role of JAK pathway dysregulation in the pathogenesis and treatment of acute myeloid leukemia. Clin Cancer Res. 19 (2), 327-335 (2013).
- Liu, A. C. H., et al. Targeting STAT5 signaling overcomes resistance to IDH Inhibitors in acute myeloid leukemia through suppression of stemness. Cancer Res. 82 (23), 4325-4339 (2022).
- Sung, P. J., Sugita, M., Koblish, H., Perl, A. E., Carroll, M. Hematopoietic cytokines mediate resistance to targeted therapy in FLT3-ITD acute myeloid leukemia. Blood Adv. 3 (7), 1061-1072 (2019).
- Song, P., Yang, F., Jin, H., Wang, X. The regulation of protein translation and its implications for cancer. Signal Transduct Target Ther. 6 (1), 68(2021).
- This Standard Operating Procedure (SOP) describes methods for anesthetizing mice. , McGill University. https://www.mcgill.ca/research/files/research/110-mouse_anesthesia-2024-06-17.pdf (2024).
- Tech Team Tips: Preparing a Sample with AO/PI. , DeNovix. https://www.denovix.com/webinars/tech-team-tips-preparing-a-sample-with-ao-pi (2021).
- Suni, M. A., Maino, V. C. Flow cytometric analysis of cell signaling proteins. Methods Mol Biol. 717, 155-169 (2011).
- Krutzik, P. O., Irish, J. M., Nolan, G. P., Perez, O. D. Analysis of protein phosphorylation and cellular signaling events by flow cytometry: techniques and clinical applications. Clin Immunol. 110 (3), 206-221 (2004).
- Chen, W., Luu, H. S. Immunophenotyping by multiparameter flow cytometry. Methods Mol Biol. 1633, 51-73 (2017).
- Perez, O. D., Nolan, G. P. Phospho-proteomic immune analysis by flow cytometry: From mechanism to translational medicine at the single-cell level. Immunol Rev. 210, 208-228 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten