Method Article
급성 골수성 백혈병 환자 유래 이종이이식의 세포내 인류 세포분석
요약
여기에서는 인류 세포 분석 기반 방법을 사용하여 마우스에 이종 이식하고 골수 흡인에서 얻은 급성 인간 골수성 백혈병 세포에서 mTORC1, JAK/STAT5 및 MAPK 경로의 다운스트림 신호를 분석합니다. p-STAT5, p-4EBP1, p-RPS6 및 p-ERK1/2 수준은 고감도의 차세대 스펙트럼 유세포 분석기를 사용하여 동시에 측정됩니다.
초록
승인된 치료법에 적응하고 저항하기 위해 급성 골수성 백혈병(AML) 세포는 유전자 발현, 단백질 수준 및 활성의 변화를 일으키는 특정 분자 경로를 활성화합니다. 이 프로토콜에서는 AML에서 발암 신호의 인산화 다운스트림 표적을 탐색하는 접근 방식이 보고되었습니다: p-STAT5 (Tyr694), p-4EBP1 (Thr37/46), p-RPS6 (Ser240/244) 및 p-ERK1/2 (Thr202/Tyr204). 이 방법을 사용하면 줄기세포 유지, 면역 회피, 단백질 합성, 산화 및 대사 스트레스에 대한 적응의 주요 조절자인 이러한 경로가 처리 단계 전후에 흡인에 의해 살아있는 쥐에서 수확한 하나 이상의 테스트된 화합물에 의해 어떻게 조절되는지 평가할 수 있습니다. 이 최소 침습적 방법은 손상을 유발하고 잠재적으로 실험 결과에 영향을 미칠 수 있는 뼈 분쇄 기술에 비해 세포 무결성을 보존하고 스트레스를 줄입니다. 유세포 분석을 위한 세포 내 항체 염색을 최적화하기 위해 파라포름알데히드 고정 및 메탄올 투과화를 사용하는 프로토콜이 개발되었습니다. 이 접근법은 높은 염색 정밀도를 보장하고 배경 잡음을 최소화하여 세포 내 신호 마커를 안정적으로 검출할 수 있습니다. 이 프로토콜의 주요 장점 중 하나는 다중 파라미터 항체 패널의 개발로, 동일한 샘플 내에서 4가지 경로를 동시에 평가할 수 있습니다. 고감도의 차세대 스펙트럼 유세포 분석기를 사용하여 동일한 마우스에서 전처리 기준선 수준과 비교하여 처리 조건에 따라 경로 활성화의 동적 변화가 관찰되었습니다. 이 방법론은 동물을 안락사할 필요 없이 환자 유래 이종이식 골수 샘플에서 신호 경로 조절에 대한 정확한 생체 내 분석을 가능하게 하여 AML 세포의 적응 메커니즘에 대한 귀중한 통찰력을 제공하고 내성을 극복하기 위해 이러한 경로를 표적으로 하는 것을 목표로 하는 치료 전략의 평가를 안내할 수 있습니다.
서문
급성 골수성 백혈병(AML)은 골수와 말초 혈액에 미성숙 골수성 전구 세포가 축적되는 것을 특징으로 하는 공격적인 혈액 악성 종양입니다. 이는 정상적인 조혈을 방해하여 생명을 위협하는 세포감소증과 전신 합병증을 유발합니다. 화학요법, 표적 요법 및 조혈모세포 이식의 발전으로 일부 환자의 예후가 개선되었지만, 전체적으로 5년 생존율은 약 30%에 머물러 있으며, 고령 환자나 유전적 프로필이 좋지 않은 환자의 예후는 더 나쁘다1. AML 관리의 중요한 과제는 약물 내성이 자주 발생한다는 것인데, 이는 재발 및 치료 실패의 원인이 됩니다2. 이는 AML의 진행과 치료 저항성을 주도하는 분자 및 세포 메커니즘에 대한 더 깊은 이해를 얻는 것이 중요하다는 점을 강조합니다.
이 문제를 해결하기 위해 다중 세포 내 인유세포 분석법과 결합된 골수 흡인을 위한 새로운 방법이 제시되어 AML 환자 유래 이종이식(PDX) 모델에서 세포 내 신호 전달 경로를 조사할 수 있는 강력한 도구를 제공합니다(그림 1A, B). PDX 모델의 골수 흡인은 이전에설명되었지만3, 이 프로토콜은 인류 분석을 위해 백혈병 세포를 보존하도록 최적화되었습니다. 이 방법의 전반적인 목표는 백혈병 진행 및 단일 세포 해상도로 치료 반응 중에 종단적으로 적용할 수 있는 최소 침습 절차를 제공하는 것입니다. 이 기술은 동일한 동물에서 반복적으로 샘플링할 수 있으므로 치료 중인 질병의 진화를 보다 정확하게 표현할 수 있습니다. 이 기술 개발의 근거는 AML 세포의 세포 내 신호 전달에 대한 고해상도의 동적 평가가 필요하다는 데 있습니다. 웨스턴 블로팅(Western blotting)과 같은 전통적인 방법은 많은 세포 수가 필요하고 단일 세포 해상도가 부족하며 다중화(multiplexing)4가 필요합니다. 이와 대조적으로, 인유세포 분석법은 세포 이질성을 보존하고 뚜렷한 백혈병 하위집단에서 여러 인산화 신호 단백질을 검출할 수 있게 하며5, AML 치료에 대한 반응으로 경로 활성화에 대한 중요한 통찰력을 제공합니다.
AML 생물학의 핵심은 미토겐 활성화 단백질 키나아제(MAPK), 라파마이신 복합체 1의 기계론적 표적(mTORC1), JAK/STAT5(Janus Kinase/Signal Transducer and Activator of Transcription 5) 신호 경로를 포함하여 세포 증식, 생존 및 대사 적응을 조절하는 신호 경로입니다. 백혈병 세포의 증식 및 생존에 대한 역할 외에도, 이러한 경로는 줄기세포 유지, 면역 회피, 산화 및 대사 스트레스에 대한 적응과 같은 주요 발암 과정에도 매우 중요합니다4. 세포 성장과 생존을 촉진하는 것 외에도 이러한 경로 간의 누화는 전사, 번역 및 세포 대사와 같은 중요한 과정을 조정하여 AML 세포가 치료를 위한 개입에도 불구하고 성장을 유지하고 세포사멸 신호에 저항할 수 있도록 합니다 6,7(그림 1A).
p-ERK1/2(Extracellular signal-regulated kinase 1/2)와 같은 주요 효과기를 포함하는 MAPK 경로는 세포 증식과 생존을 조절하기 위해 성장 인자 및 사이토카인과 같은 세포 외 신호의 통합에 중요한 역할을 합니다. ERK1/2 활성화는 RAS(Rat Sarcoma)-RAF(Rapid Accelerated Fibrosarcoma)-MEK(MAPK/ERK Kinase)-ERK 캐스케이드를 통해 발생하며, 여기서 RAS-GTP는 RAF를 모집하여 MEK1/2의 순차적 인산화를 유도한 다음 Thr202/Tyr204에서 ERK1/2를 생성합니다. ERK1/2는 인산화되면 이합체화되어 핵으로 전위되어 MYC(Myelocytomatosis viral oncogene homolog), ELK1(ETS Like-1 Protein) 및 AP-1(Activator Protein-1)과 같은 전사 인자를 인산화하여 세포 증식, 분화 차단 및 생존을 촉진합니다8. AML에서 FLT3(fms 유사 티로신 키나아제 3), RAS 또는 KIT의 돌연변이는 종종 구조적 ERK 활성화를 초래합니다 9,10(그림 1A).
FLT3, RAS 또는 KIT의 돌연변이는 또한 mTORC1 신호의 상향 조절을 유발하며, 이는 대사 재배선, 단백질 합성 조절, 리보솜 생물 발생 및 자가포식과 같은 발암 과정을 지원함으로써 AML 성장 및 치료 내성을 가능하게 합니다11. mTORC1은 mRNA 번역 조절을 통해 발암성 단백질 및 AML 진행에 필요한 기타 필수 인자의 생성을 촉진합니다. mTORC1 기질의 주요 그룹에는 4E-BP(진핵생물 개시 인자 4E-결합 단백질)가 포함됩니다. 하이포인산화된 상태에서 4E-BP는 eIF4E(진핵생물 개시 인자 4E)에 결합하여 캡 의존적 번역을 억제합니다. mTORC1에 의한 Thr37/46에서 4E-BP1의 인산화는 eIF4E의 방출을 유발하여 MYC, CCND1 (Cyclin D1) 및 MCL-1 (골수성 세포 백혈병 1)과 같은 주요 발암성 mRNA에 대한 번역 시작을 가능하게 하여 백혈병 증식 및 생존을 촉진합니다 8,12. 또한, mTORC1의 다운스트림에서 S6K1(리보솜 단백질 S6 키나아제 베타-1)에 의해 매개되는 Ser240/244에서의 RPS6 인산화는 리보솜 생물 발생 및 mRNA 번역을 향상시켜 대사 적응, 스트레스 저항성 및 빠른 증식에 필요한 단백질의 합성을 증가시킵니다 8,13. 특히, mTORC1 활성은 치료 스트레스 하에서 AML 세포가 사용하는 중요한 생존 전략인 대사 적응과 밀접한 관련이 있습니다 13,14,15(그림 1A).
JAK/STAT5 경로는 AML의 또 다른 중요한 신호축이며, 특히 사이토카인 수용체 또는 JAK2, FLT3 및 CALR(칼레티큘린)과 같은 신호 매개체에 영향을 미치는 돌연변이가 있는 경우 16,17. STAT5는 FLT3 및 JAK2와 같은 수용체를 통한 사이토카인 신호에 대한 반응으로 활성화됩니다. 리간드 결합 시, 관련 Janus kinases(JAK)는 Tyr694에서 STAT5를 인산화합니다. 인산화된 STAT5는 이합체화되어 핵으로 전위되어 특정 DNA 염기서열에 결합하여 세포 생존, 증식 및 분화에 관여하는 유전자의 전사를 조절합니다8. AML에서 종종 FLT3 또는 JAK2의 돌연변이로 인한 STAT5의 구조적 활성화는 백혈병 발생을 촉진하는 유전자의 지속적인 발현으로 이어집니다18(그림 1A).
이러한 경로는 개별적인 기여를 넘어 전사와 번역을 모두 조절하기 위해 수렴하여 생존과 저항을 촉진하는 방식으로 AML 세포의 단백질체를 형성합니다. 특히, mRNA 번역은 AML 세포가 환경 문제에 적응하고 표적 치료의 영향을 회피할 수 있도록 하는 발암 단백질 및 스트레스 반응 인자의 빠른 생산을 가능하게 하기 때문에 AML 병태생리학의 핵심 인자로 부상하고 있습니다. 진핵생물 개시 인자(eIF) 또는 리보솜 단백질과 같은 번역 기전의 조절 장애는 AML에서 치료 저항성 및 나쁜 예후와 관련이 있습니다19. 전사 및 번역 조절에서 MAPK, mTORC1 및 JAK/STAT5 경로의 역할에 대한 자세한 조사는 AML 진행 및 저항성의 기저에 있는 분자 메커니즘에 대한 포괄적인 이해를 얻는 데 필수적입니다. 이러한 통찰력은 치료 반응의 새로운 바이오마커를 식별하고 내성을 극복하기 위해 이러한 경로를 표적으로 하는 새로운 치료 전략을 설계하는 데 중요합니다. 이 논문은 AML 환자 유래 이종이식(PDX) 모델에서 이러한 신호 전달 네트워크를 조사하기 위해 특별히 설계된 프로토콜을 제공합니다.
이 프로토콜의 주요 장점 중 하나는 골수 흡인과 세포 내 인류 세포 분석법을 통합하여 AML 환자 유래 이종이식(PDX) 모델에서 신호 경로 활성화에 대한 동적이고 최소 침습적인 평가를 수행할 수 있다는 것입니다. 이는 표적 치료에 대한 반응으로 MAPK, mTORC1 및 JAK/STAT5와 같은 주요 경로의 활성화 상태를 모니터링하는 데 특히 유용합니다. 이러한 기술의 결합을 통해 AML 생물학에 대한 포괄적이고 해상도가 높은 이해를 얻을 수 있으며, 궁극적으로 보다 효과적인 치료 전략의 개발을 지원할 수 있습니다.
프로토콜
다음 실험은 McGill University Animal Care Committee(CIHR PJT-186019)와 Jewish General Hospital의 Institutional Review Board(11-047)의 승인을 받아 수행되었습니다. 이 프로토콜에서는 8주에서 6개월 사이이고 체중이 20-30g인 수컷 NOD-scid IL2Rg^null-3/GM/SF (NSGS) 마우스에 이전에 인간 환자 유래 AML 세포를 이식했습니다. 이 연구에 사용된 시약 및 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다.
1. 골수 흡인
주의 : 바늘 사용과 관련된 안전 예방 조치를 따라야 합니다.
- 수술 전후 진통 : 골수 흡인 1-4 시간 전, 마우스에 0.1 mg / kg의 부프레 노르핀 서방성을 피하 (s.c.) 주입합니다. 이것은 시술 후 최대 72시간 동안 진통을 보장합니다.
- 척추 패드, 헤어 트리머, 가열 램프 및 골수 흡인에 필요한 모든 재료(주사기 25G, 얼음에 PBS 0.5mL가 함유된 1.5mL 마이크로 원심분리 튜브, 70% 이소프로판올 면봉)로 층류 후드 아래의 수술 부위를 준비합니다. 접착 테이프를 사용하여 이소플루란 흡입을 위해 노즈콘을 고정합니다(그림 2A).
- 각 흡인에 대해 25G 주사기 2개를 준비하는데, 하나는 뼈 천자("마른 바늘")를 위한 것이고 다른 하나는 흡입을 위해 허브를 PBS로 씻어낸 것("세척된 바늘")을 준비합니다.
- 제조업체의 지침과 수의학 지침에 따라 인증된 기화기에서 전달하는 이소플루란 흡입을 사용하여 마우스를 마취합니다. 지역별 절차는 다를 수 있습니다. 참고로, 이 프로토콜은 마우스 마취에 대한 McGill University의 표준 운영 절차를 따랐습니다20.
- 발 꼬집음 및 근육 이완에 대한 반응 부족을 통해 마취 깊이를 확인합니다. 동물이 마취되는 동안 건조를 방지하기 위해 눈에 동물용 연고를 바르십시오. 마취 중 호흡수를 지속적으로 모니터링합니다.
- 헤어 트리머를 사용하여 흡인이 수행될 다리 전체를 면도합니다. 이소프로필 알코올로 적신 소독 패드로 흡인 부위(대퇴골)를 소독합니다(그림 2B).
- 천자 부위가 위치한 대퇴골의 관절 표면을 무릎을 구부리고 주로 사용하지 않는 손을 사용하여 다리를 움직이지 못하게 하여 노출시킵니다. 엄지손가락을 경골에, 검지손가락을 대퇴골에, 중지를 두 뼈의 바깥쪽에 있는 모든 것을 안정화합니다(그림 2C).
알림: 실패나 부상으로 이어질 수 있는 흡인 중 다리의 움직임을 방지하기 위해 주로 사용하지 않는 손을 사용하여 다리의 매우 안정적인 위치를 확인하십시오. 다리의 고정이 안정적이지 않으면 손의 위치를 조정하고 구멍을 뚫기 전에 다시 시도하십시오. - 주로 사용하지 않는 손으로 움직이지 않는 동안 무릎 부위를 이소프로필 알코올(그림 2C)로 다시 소독하여 남아 있는 털을 제거하여 뼈 구조를 더 잘 시각화합니다.
- 첫 번째 건조 25G 주사기를 사용하여 대퇴골 관절 중앙에 놓고 무리하지 않고 회전시켜 대퇴골 관절 표면에 구멍을 만듭니다(그림 2D, E). 주사기의 바늘이 대퇴골의 세로축과 완전히 정렬(0° 편차)되어 골수에 올바르게 들어가는지 확인합니다.
알림: 주변 조직에 불필요한 손상을 주지 않고 원활하게 들어갈 수 있도록 이 정렬을 유지하십시오. 바늘이 대퇴골 중앙으로 들어갈 때 저항이 약간 감소하면 골수 구멍에 성공적으로 침투했음을 나타냅니다(그림 2F). 이 단계에서 바늘에 과도한 힘을 가하면 올바른 정렬의 손실, 골절 또는 외상을 유발할 수 있으므로 피하십시오. 회전식 드릴링 동작을 사용하면 바늘이 저항이 가장 적은 경로를 따라 대퇴골강에 올바르게 들어갈 가능성이 더 커집니다. 대퇴골 내부에 적절하게 배치된 바늘은 바늘을 잡고 있는 손이 제거되어도 수직을 유지해야 합니다. - 일단 골수에 들어가면 회전하여 주사기를 서서히 제거하고(그림 2G) 첫 번째 바늘로 만든 구멍에 두 번째 플러시 주사기를 삽입합니다(그림 2H, I).
참고: 두 번째 주사기는 드릴링 중에 뼈에 의해 막히는 경우가 많기 때문에 두 번째 주사기가 사용됩니다. - 대퇴골 내에 삽입된 주사기에 진공을 가하면서 주사기를 부드럽게 회전시키고 서서히 빼냅니다. 약 10-20 μL의 골수가 주사기 허브 내에서 볼 수 있어야 합니다(그림 2J).
참고: 필요한 경우 골수 추출을 최적화하기 위해 뼈 내의 바늘을 부드럽게 다시 전진시킵니다. - 주사기의 내용물을 500μL의 PBS가 들어 있는 냉각된 마이크로 원심분리 튜브로 씻어내어 골수를 옮깁니다(그림 2K). 얼음 위에 두고 가능한 한 빨리 2-3단계를 진행하십시오.
- 이소프로판올 면봉으로 30초 동안 천자 부위에 부드러운 압력을 가하여 출혈을 멈춥니다(그림 2L).
- 마우스를 보온을 사용하여 예열된 깨끗한 복구 케이지에 넣습니다.amp. 동물이 깨어나 완전히 회복될 때까지 호흡과 움직임을 모니터링한 후 다른 쥐와 함께 공동 우리에 넣습니다. 출혈의 징후가 있는지 확인하십시오.
2. Live/Dead 및 표면 마커 염색
알림: 전체 절차 동안 세포를 얼음 위에 보관하십시오. 2단계 및 3단계 전에 항체 염색 용액(2.4단계 및 2.7단계)의 마스터 믹스를 준비하여 빛으로부터 보호된 4°C로 유지합니다. 신선한 1.6% 포름알데히드 용액(3.1단계)과 -20°C(3.6단계)를 유지하는 100% 메탄올 용액을 준비합니다.
- 세포 계수기21과 함께 acridine orange/propidium iodide(AO/PI)를 사용하여 생존 가능한 세포를 계수합니다.
- 100만 개의 세포에 적합한 부피를 새로운 1.5mL 튜브로 옮깁니다. 볼륨이 충분하지 않으면 전체 볼륨을 사용하십시오. 나머지 세포와 분취액을 isotype control 염색을 위해 3개의 복제 튜브(각 1M)에 모으고 염색되지 않은 제어를 위해 1개의 튜브에 넣습니다.
- 500 x g 의 원심분리기 셀, 4°C에서 5분 동안. 부드럽게 흡입하고 진공 흡입 시스템을 사용하여 상층액을 폐기합니다.
- PBS에서 1/100로 희석된 형광 세포 염색 용액 샘플당 200μL를 추가하여 죽은 세포를 라벨링합니다. 피펫으로 세포를 부드럽게 재현탁시킵니다. isotype control 염색을 위해 여분의 튜브로 동일한 작업을 수행합니다.
- 빛으로부터 보호된 얼음 위에서 10분 동안 배양합니다.
- 500 x g 에서 4°C에서 5분 동안 셀을 원심분리합니다. 부드럽게 흡입하고 진공 시스템을 사용하여 상등액을 버립니다.
- 2% 소 태아 혈청을 함유한 PBS에 1/100으로 희석된 hCD45-BUV395 항체 샘플당 100μL를 추가하여 인간 조혈 세포를 라벨링합니다. isotype 제어를 위해 보관 된 여분의 튜브에 대해서도 동일한 작업을 수행하십시오.
- 빛으로부터 보호된 얼음 위에서 15분 동안 배양합니다. 즉시 3단계로 진행합니다.
3. 정착과 투과성
- 새로운 1.6% 포름알데히드/PBS 용액 준비: 모든 샘플에 대해 29.5μL의 37% 포름알데히드 원액 + 970.5μL의 PBS를 혼합합니다(예방 조치로 일부 추가 부피 고려). 1.6% 포름알데히드/PBS 용액을 실온에 보관하십시오.
주의 : 포름알데히드는 화학 물질 후드에서 취급해야 하며 기관 안전 규정에 따라 폐기해야 합니다. - 500 x g에서 4°C에서 5분 동안 셀을 원심분리합니다. 흡입하고 진공 시스템을 사용하여 상층액을 폐기합니다.
- 1.6% 포름알데히드/PBS 용액 1mL에 재현탁합니다.
- 빛으로부터 보호된 실온에서 10분 동안 배양합니다.
- 500 x g 에서 4°C에서 5분 동안 셀을 원심분리합니다. 흡입하고 진공 시스템을 사용하여 상층액을 폐기합니다.
- -20°C에서 냉각된 100% 메탄올 1mL를 튜브에 직접 추가합니다.
- -20°C에서 30분 동안 빛을 차단하여 샘플을 배양합니다.
참고: 이 시점에서는 분석 전에 최대 1개월 동안 -80°C에서 고정 및 투과성 셀을 보관할 수 있습니다.
4. Phosphoflow 염색
참고: 다음 항체 패널은 320nm, 355nm, 405nm, 488nm, 561nm, 637nm 및 808nm 레이저가 장착된 유세포 분석기를 사용하여 검증되었습니다. 이 패널은 다른 레이저 및 검출기 설정과 함께 다른 유세포 분석기를 사용하는 경우 다시 검증해야 합니다.
- 시판되는 염색 완충액(표 1)에서 다음 희석액을 사용하여 항체 마스터 믹스 용액을 준비하고 모든 샘플에 대해 50μL의 부피를 계산합니다. 빛으로부터 보호된 4°C에서 보관하십시오.
- 세척(단계 4.8, 4.10)의 경우 PBS를 얼음에 보관하십시오(모든 샘플에 대해 2mL).
- 염색 완충액에서 isotype control 기술 복제물을 위한 두 번째 마스터 믹스 용액을 준비하여(표 1) 모든 샘플에 대해 50μL의 부피를 계산합니다. 빛으로부터 보호된 4°C에서 보관하십시오. 기술적 재현성을 위해 최소 2개의 isotype control samples를 사용하는 것이 좋습니다.
- 3.7단계에서 500 x g 에서 4°C에서 5분 동안 세포를 원심분리합니다. 흡입하고 진공 시스템을 사용하여 상층액을 폐기합니다.
참고: 고정 및 투과화 후에는 세포가 더 반투명하게 보일 수 있습니다. - 50μL의 항체 혼합 용액(단계 4.1) 또는 동형 대조 혼합 용액(단계 4.2)을 추가합니다. 피펫으로 세포를 부드럽게 재현탁합니다.
- 모든 시료를 빛으로부터 보호된 4°C에서 밤새 배양합니다.
- 500 x g 의 원심분리기 셀, 4°C에서 5분 동안 사용. 흡입하고 진공 시스템을 사용하여 상층액을 폐기합니다.
- 피펫으로 부드럽게 재현탁하여 1000μL의 PBS로 세척합니다.
- 500 x g 의 원심분리기 셀, 4°C에서 5분 동안 사용. 흡입하고 진공 시스템을 사용하여 상층액을 폐기합니다.
- 피펫으로 부드럽게 재현탁하여 1000μL의 PBS로 두 번째 세척을 수행합니다.
- 500 x g 의 원심분리기 셀, 4°C에서 5분 동안 사용. 흡입하고 진공 시스템을 사용하여 상층액을 폐기합니다.
- 200μL의 PBS에 시료를 재현탁합니다. 유세포 분석을 사용한 분석을 위해 FACS 튜브 또는 플레이트로 이동합니다(그림 3).
- 제조업체의 지침에 따라 모든 항체의 0.1 μL를 보상 비드로 배양하여 비드를 사용한 단색 보상 대조군을 준비합니다( 재료 표 참조).
결과
실험 설계는 예를 들어 1일 전처리 시작 및 15일 처리 후 시작과 같은 다양한 시점에서 선택한 관심 단백질의 인산화 상태를 모니터링하는 것을 목표로 합니다. 이 기준선은 치료 후 신호 경로 활성화에서 후속 변화의 진실성을 확인하기 위한 중요한 대조군 역할을 합니다. 치료 15일 후, 투여된 마우스와 비히클 처리된 대조군의 경로 조절을 평가하기 위해 두 번째 비교가 수행됩니다(그림 4). 이 2단계 접근법을 통해 치료로 인한 효과와 기준선 변동성을 구별할 수 있습니다.
본 연구에서는 AML PDX 마우스 모델을 활용하였다. 마우스는 다음과 같은 돌연변이를 특징으로 하는 환자 유래 AML 세포를 이식하였다: 변이 대립유전자 분획(VAF)이 48%인 DNMT3AMR882H , NPM1W288fs VAF 36%, FLT3ITD VAF 10% 및 IDH2R140Q VAF 44%. 이식 후, 치료를 시작하기 전에 종양이 자랄 수 있도록 3주가 허용되었습니다. FLT3 돌연변이 이식 PDX 마우스는 위약, 길테리티닙(매일 15mg/kg) 또는 베네토클락스(매일 50mg/kg), 5-아자시티딘(매일 2.5mg/kg) 및 세다리주딘(매일 3mg/kg)의 세 가지 요법 중 하나로 15일 동안 치료했습니다(그림 4A).
얻어진 결과와 관련하여, 베네토클락스 기반 요법을 사용한 치료가 STAT5 및 RPS6 인산화를 크게 향상시켰다는 점을 언급할 필요가 있으며, 이는 이러한 경로가 치료 내성에 기여한다는 것을 시사합니다(그림 4E). 이와는 대조적으로, FLT3를 표적으로 하는 약물인 길테리티닙은 돌연변이 FLT3 효과기의 인산화 상태를 감소시키지 않았다. 테스트한 AML 검체에서 FLT3-ITD 이외의 추가적인 2차 돌연변이(예: IDH2)의 존재가 이러한 경로의 활성화에 기여하거나 2주에 걸친 약물 치료로 신호 전달이 감소된 AML 세포의 선택적 제거가 가능할 수 있습니다. 분석된 모든 인단백질은 동일한 세포 집단에서 게이트화되었기 때문에 인단백질 활성화를 비교할 수 있습니다. 이 실험에서 인단백질 염색에서 가장 강력한 상관관계는 p-STAT5와 p-RPS6 사이인 것으로 보이며(보충 그림 1A), 둘 다 처리 후 이 실험군에서 상향 조절됩니다(그림 4E). p-STAT5와 p-ERK 사이에는 덜 관계가 있는 것으로 보입니다(보충 그림 1B). 중요한 것은 세포 크기(FSC-A를 사용하여 평가)가 전체 p-STAT5 양성에 큰 영향을 미치지 않는다는 점이며, 염색 양성이 단순히 세포 크기의 산물이 아니라는 점을 강조합니다(보충 그림 1C). 이 실험적 프레임워크를 통해 신호 경로 조절에 대한 이러한 치료의 효과를 종합적으로 평가할 수 있습니다.
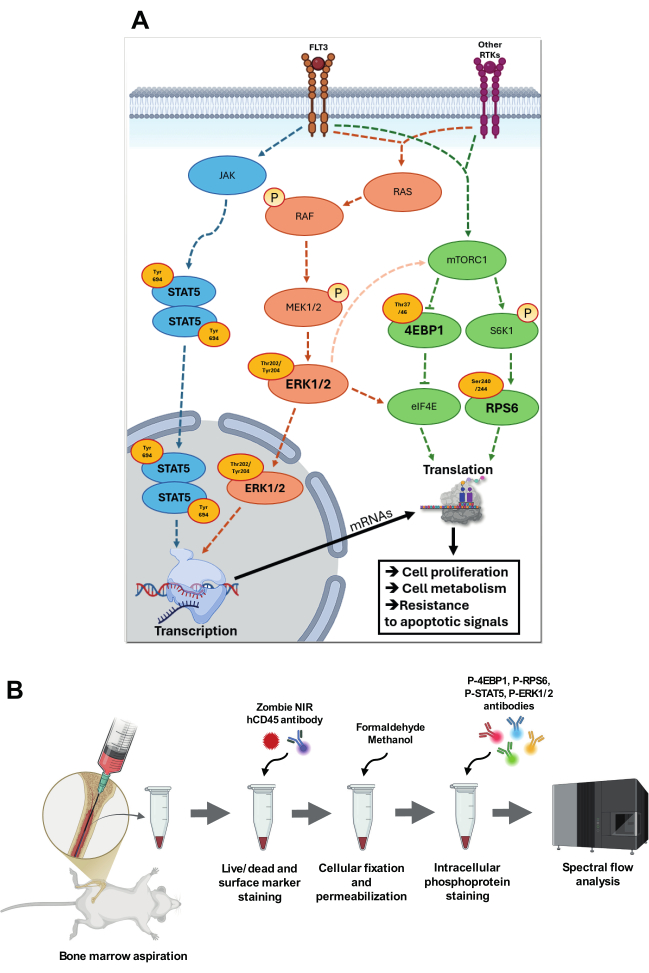
그림 1: 표적 신호 경로의 시각화 및 분석 전략. (A) p-STAT5 (Tyr694), p-4EBP1 (Thr37/46), p-RPS6 (Ser240/244) 및 p-ERK1/2 (Thr202/Tyr204)와 관련된 신호 전달 경로의 개요. p-STAT5 경로에서 JAK는 자가인산화를 거쳐 촉매 활성을 증가시킨 다음 특이적 티로신 잔기를 인산화하여 STAT 단백질을 위한 도킹 부위를 생성합니다. 인산화된 STAT5(Tyr694)는 동형합체화되어 핵으로 전위되어 표적 유전자의 프로모터 영역에 있는 특정 STAT 반응 요소에 결합합니다. RAS-RAF-MEK-ERK 캐스케이드에서 리간드 결합 시 FLT3 수용체 또는 기타 수용체 티로신 키나아제(RTK)의 자가인산화는 RAS에서 GDP를 GTP로 교환하여 RAS를 활성화합니다. 활성화된 RAS-GTP는 RAF를 원형질막으로 모집하여 RAF가 구조적 변화를 겪고 활성화됩니다. 그런 다음 RAF는 이중 특이성 키나아제인 MEK1/2를 인산화하고 활성화하며, 이는 다시 Thr202/Tyr204 잔기에서 ERK를 인산화합니다. 활성화된 ERK1/2는 핵으로 전위되어 특정 전사 인자를 인산화합니다. ERK1/2는 또한 중간 신호 전달 경로를 통해 mTORC1 활성을 증가시키고 특정 부위에서 eIF4E를 인산화하여 번역 활성을 증가시킬 수 있습니다. FLT3 및 기타 RTK를 통해 영양소 및 성장 인자에 의해 활성화되는 mTORC1은 S6K1 및 4E-BP1과 같은 다운스트림 표적을 인산화합니다. S6K1은 RPS6를 인산화하여 리보솜 기능을 향상시키고 번역을 활성화합니다. 4E-BP1의 과인산화는 eIF4E를 방출하여 번역 시작 복합체 eIF4F의 조립 및 캡 의존성 번역의 활성화를 가능하게 합니다. 이러한 모든 경로는 AML에 밀접하게 관련되어 세포 증식, 신진대사 및 세포자멸 신호에 대한 저항을 증가시켜 후천적 적응에 기여합니다. (B)는 골수 흡인 및 세포 내 인류 염색 결합 프로토콜의 주요 단계를 제시합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
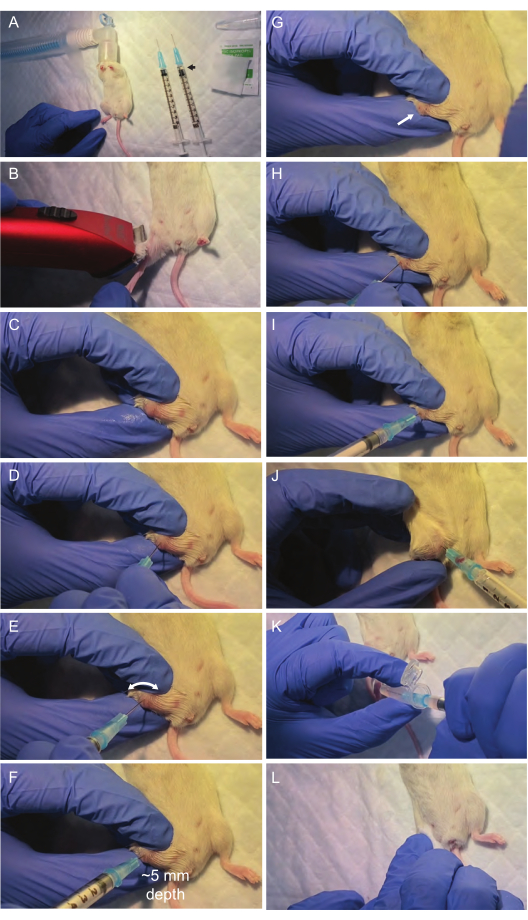
그림 2: 골수 흡인 절차 중 중요한 단계의 시각화. 수술 부위와 필요한 재료는 층류 후드 아래에 설치됩니다. 이소플루란 흡입(A)에 의한 마취 후 대퇴 관절 표면은 흡인(B, C)을 위해 준비됩니다. 대퇴골은 대퇴골(D)의 중앙에 정렬된 첫 번째 주사기로 구멍을 뚫습니다. 바늘에 강한 압력을 가하지 말고 대신 회전 드릴링 동작을 수행하는 것이 중요합니다. 이것은 일반적으로 바늘이 뼈 표면을 뚫고 대퇴강의 경로를 따라가기에 충분합니다. 다음으로, 천자 부위(I,J)를 통해 두 번째 주사기로 골수를 흡인합니다. 골수 흡인을 미세 원심분리기 튜브(K)로 옮긴 후 해당 부위(L)의 출혈을 멈추기 위해 부드러운 압력을 가하고 마우스를 따뜻하고 깨끗한 케이지에 넣어 회복합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
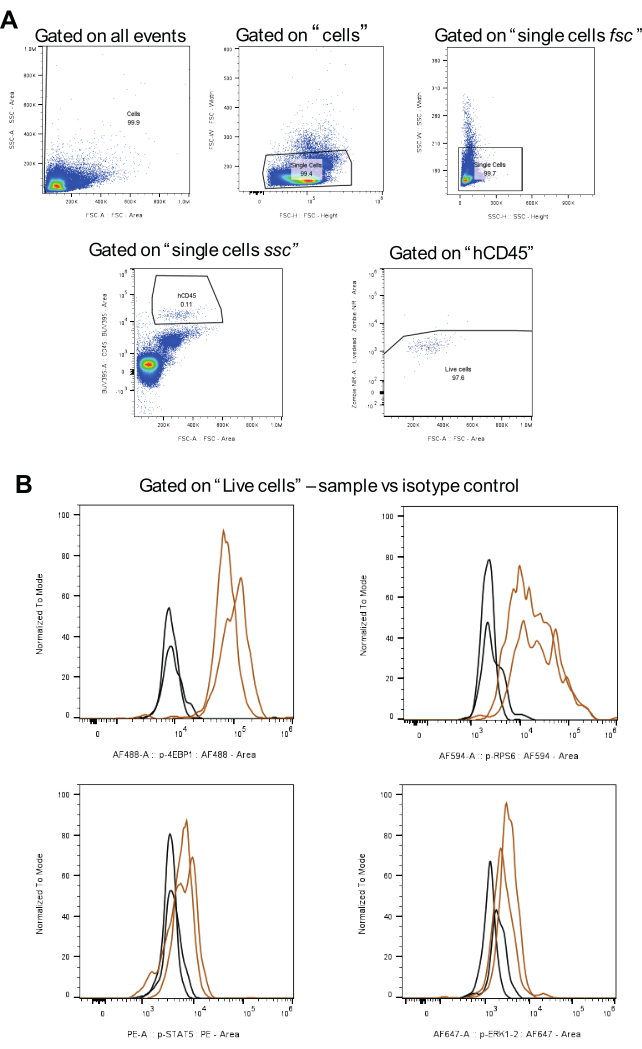
그림 3: isotype 컨트롤을 포함한 게이팅 전략 분석을 위한 워크플로우. (A)는 살아있는 세포, 이중선 배제 및 hCD45 양성 AML 세포에 대한 게이팅 전략을 나타냅니다. (B)는 갈색의 각 인단백질과 검은색의 동형 대조군에 대한 신호를 보여줍니다(두 개의 생물학적 복제). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
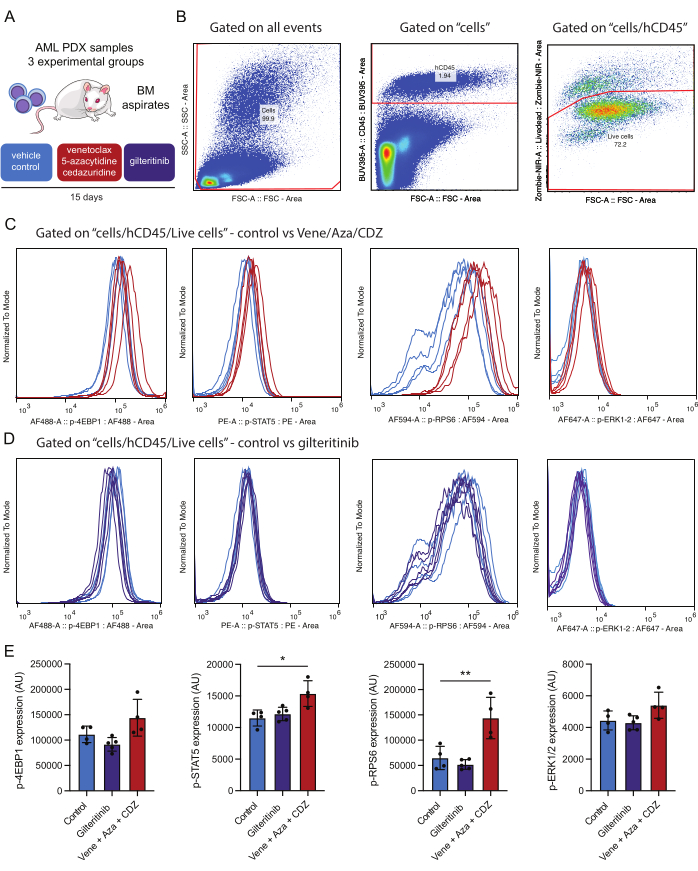
그림 4: 생존 가능한 골수 AML 세포의 면역 진술 후 세포 내 인단백질의 검출 및 분석을 위한 워크플로우. (A) 환자 기증된 AML 세포를 생착한 NSG-SGM3 마우스는 비히클(대조군) 또는 베네토클락스, 5-아자시티딘 및 세다주리딘(vene/aza/CDZ) 또는 길테리티닙으로 처리되었습니다. 15일 후, 골수(BM) 흡인을 처리했습니다. (B)는 치료 15일 후 생존 가능한 AML 세포(예: hCD45/Zombie-NIR 양성)를 분석하기 위한 게이팅 전략을 나타냅니다. (C,D)는 베네토클락스/5-아자시티딘/세다주리딘 또는 비히클(B) 또는 길테리티닙 또는 비히클(C)로 처리된 마우스에서 분리된 10,000개의 AML 세포에서 표시된 바와 같이 각 인항체에 대한 신호의 정상화를 나타냅니다. 트레이스는 비히클(연한 파란색), vene/aza/CDZ(빨간색) 또는 길테리티닙(자주색)으로 처리된 대조 마우스에서 분리된 AML 세포의 신호를 나타냅니다. (E) 히스토그램은 3개의 마우스와 SD의 살아있는 인간 AML CD45+ 세포에서 테스트한 각 인단백질에 대한 염색 강도의 평균 값 변화를 나타냅니다. 오차 막대는 표준 편차를 나타냅니다. 별표는 p 값이 0.05(*) 및 0.01(**) 미만인 ANOVA로 평가한 염색 강도의 유의미한 차이를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 항체 | 형광 색소 | 희석 |
| P-RPS6 (Ser240/244) | AF594 | 1/50 |
| P-4EBP1 (Thr37/46) | AF488 | 1/50 |
| p-STAT5 (티르694) | 체육 | 1/100 |
| P-Erk1/2 (Thr202/Tyr204) | AF647 시리즈 | 1/100 |
| 토끼 IgG 제어 | AF594 | 1/50 |
| 토끼 IgG 제어 | AF488 | 1/50 |
| 토끼 IgG 제어 | 체육 | 1/100 |
| 토끼 IgG 제어 | AF647 시리즈 | 1/100 |
표 1: 항체에 최적화된 희석액 목록.
보충 그림 1: 대표적인 AML PDX 샘플에서 p-STAT5, p-RPS6, p-ERK1/2 및 FSC-A를 비교합니다. 이 그림은 venetoclax/5-azacitidine/cedazuridine으로 치료한 지 15일째에 마우스 "E9"에서 p-STAT5, p-ERK 및 p-RPS6 간의 관계의 예를 보여줍니다( 그림 4C의 결과). 이 샘플에서 인단백질 염색에서 가장 강력한 상관관계는 p-STAT5와 p-RPS6(A) 사이에 있는 것으로 보이며, 둘 다 처리 후 이 실험군에서 상향 조절됩니다(그림 4E). p-STAT5와 p-ERK(B) 사이에는 관계가 적은 것으로 보입니다. 중요한 것은 세포 크기(FSC-A를 사용하여 평가)가 전체 p-STAT5 양성에 큰 영향을 미치지 않는다는 점이며, 염색 양성이 단순히 세포 크기(C)의 산물이 아니라는 점을 강조합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
중요한 단계
인단백질의 특이적 검출을 통한 복잡한 신호 전달 경로 연구에서 면역학적 기반 기술을 사용하려면 실험 변수를 엄격하게 제어하고22 샘플 준비를 세심하게 수행하며, 검증을 위해 보완 기술을 사용해야 합니다. 이러한 관행을 통합하면 데이터의 재현성, 정밀도 및 견고성이 보장되어 궁극적으로 보다 신뢰할 수 있는 생물학적 결론에 기여할 수 있습니다. 이러한 노력은 이 방법의 과학적 엄격성을 강화할 뿐만 아니라 세포 신호 전달 및 조절에 대한 복잡한 연구에서 적용 가능성을 넓힙니다. 적절한 마취와 부드러운 취급은 생리적 스트레스를 최소화하는 데 매우 중요하며, 이는 특히 면역 반응 또는 신호 경로에 초점을 맞춘 연구에서 실험 결과를 크게 바꿀 수 있습니다. 적절한 진통제 프로토콜을 확보하면 동물 복지를 유지하는 동시에 데이터를 방해할 수 있는 통증 관련 스트레스를 예방하는 데 도움이 됩니다. 시술 중 무균 상태를 유지하는 것은 염증 반응으로 이어지고 잠재적으로 실험 결과를 혼란스럽게 할 수 있는 감염을 예방하는 데 필수적입니다. 여기에는 장비 살균, 깨끗한 장갑 사용, 흡인 부위를 철저히 소독하는 것이 포함됩니다.
인산화된 단백질은 생물학적 표본을 조작하는 동안 인산화효소에 의한 탈인산화에 매우 취약합니다22,23. 처리 중 인산화 상태를 유지하려면 즉각적인 고정이 필수적입니다. 두 가지 다른 고정/투과화 방법이 테스트되었습니다: cytofix/cytoperm 키트와 프로토콜에 설명된 일반적인 포름알데히드/메탄올 방법. 이 중 메탄올 기반 방법은 더 밝은 형광 신호로 더 깨끗한 결과를 제공했기 때문에 선호되는 선택이 되었습니다. 고정 후 샘플은 -20 °C에서 단기적으로 보관하거나 -80 °C에서 장기간 보관할 수 있습니다. 실험에서 -80°C에서 최대 3개월 동안 고정된 샘플을 보관하면 일관된 결과가 나왔습니다. 항체 염색의 경우, 하룻밤 배양은 특히 미묘한 인산화 변화의 정확도를 향상시킬 수 있지만, 이는 조사 중인 특정 실험 및 약물 효과에 따라 다릅니다. 더 짧은 1 시간의 배양 과정도 빛으로부터 보호 된 얼음 위에서 테스트하여 특정 경우에 허용 가능한 결과를 얻었습니다. 배경 소음에 대한 정확한 평가를 보장하기 위해 그림 3과 같이 비특이적 결합에 대한 참조로 isotype 대조군이 권장됩니다.
기술의 수정 및 문제 해결
기술적 숙련도를 개발하기 위해 우리 그룹의 교육생들은 안락사된 쥐에서 바늘 삽입 기술을 연습하며, 해부를 통해 적절한 배치를 확인할 수 있습니다. 살아있는 동물 절차는 두 명의 작업자에 의해 가장 효율적으로 수행되며, 한 명의 작업자는 포부에 집중하고 보조 작업자는 동물 모니터링 및 샘플 처리 작업을 전담합니다. 드문 경우지만 여러 번의 시도 후에도 흡인을 얻을 수 없는 경우, 시도할 때마다 부상의 위험이 증가하므로 절차를 중단하는 것이 좋습니다. 동물에 대한 시술 후 모니터링도 마찬가지로 중요합니다. 감염, 통증 또는 스트레스의 징후를 관찰하면 생쥐의 웰빙과 연구의 신뢰성을 보장할 수 있습니다. 주거 환경은 외부 스트레스 요인을 최소화하기 위해 적절한 침구와 영양과 함께 회복을 지원해야 합니다.
유세포 분석의 경우, 서로 다른 골수 흡인일의 모든 고정 및 보존된 샘플을 동시에 처리하는 것이 좋습니다. 취급 요일 또는 작업자의 차이로 인한 시료 재수화 및 염색의 변화는 세포 분석기에서 감지하는 형광 감도에 영향을 미칠 수 있습니다. 일관된 결과를 보장하려면 진행하기 전에 염색된 모든 샘플을 검출 범위 내로 유지하도록 세포분석기 전압 설정을 최적화하십시오. Alexa Fluor 488-conjugated p-4EBP1 단백질은 이 패널의 마커 중 가장 높은 밝기를 나타내므로 최대 검출 범위를 설정하기 위한 신뢰할 수 있는 기준이 됩니다. 이 프로토콜에 제시된 항체 패널은 보상 조정이 필요하지 않았지만 이는 사용된 스펙트럼 유세포 분석기에 따라 달라질 수 있습니다.
제한
이 기술의 주요 한계 중 하나는 골수 흡인 중에 추출된 세포의 수입니다. 신뢰할 수 있는 결과를 보장하려면 샘플당 최소 약 10,000개의 세포를 분석할 수 있을 만큼 충분한 세포를 염색하는 것이 중요합니다. 너무 적은 수의 세포를 분석하면 샘플 간에 상당한 차이가 발생하여 데이터의 정확성과 해석 가능성이 손상될 수 있습니다. 적절한 수의 세포를 확보하는 것은 강력하고 재현 가능한 기계론적 연구를 위해 매우 중요합니다.
데이터 분석을 위해 그림 3A 에 표시된 게이팅 전략이 적용됩니다. 먼저, 이중항을 배제한 후, BUV395와 결합된 인간 CD45 항체를 사용하여 관심 세포를 식별한다. 다음으로, 살아있는 세포에 대한 게이팅은 좀비 NIR을 사용하여 수행됩니다. 마지막으로, 각 인단백질에 대해 중앙값 형광 강도(MFI)를 계산합니다(그림 3B). 모든 인산화 단백질에 대해 분석된 모든 세포는 동일한 전략을 사용하여 게이트를 처리하여 AML 세포 집단 전반에 걸쳐 일관성과 비교 가능성을 보장했습니다.
이 방법의 또 다른 한계는 비특이적 항체 결합, 불충분한 세척, 세포 자가형광 또는 부적절한 투과성으로 인해 발생할 수 있는 배경 잡음의 가능성입니다. 이는 신호 특이성에 영향을 미치고 인류 세포 분석의 정확도를 감소시킬 수 있습니다. 이러한 문제가 발생하는 사용자의 경우 배경 소음을 줄이기 위해 추가 세척 단계를 수행하는 것이 좋으며, Fc 차단 시약을 사용하여 비특이적 결합을 최소화할 수 있습니다. 또한 사세포 형광은 결과를 방해할 수 있으므로 생존능 염료의 사용이 필수적입니다. 중요한 것은 정확한 분석을 위해 분석된 세포의 수가 500 AML 세포 이상이어야 신뢰할 수 있고 재현 가능한 결과를 보장할 수 있다는 것입니다. 또한 시료 간에 일관성을 유지하기 위해 염색 중에 비슷한 수의 세포가 사용되도록 하는 것도 중요합니다. 이러한 한계에도 불구하고 제어 및 게이팅 전략을 신중하게 최적화하면 방법의 신뢰성을 향상시킬 수 있습니다.
이 기술의 중요성
골수 흡인 기법은 이미 발표되었습니다3; 그러나 이 프로토콜에는 두 가지 장점을 강조하는 설명과 함께 업데이트된 기술이 포함되어 있습니다: 향상된 고정과 골수 흡인의 정밀도와 일관성을 향상시키기 위한 두 개의 바늘 접근법 사용, 뼈 조각으로 인한 바늘 막힘 문제를 방지합니다. 종단 연구의 경우 대퇴부 흡인을 여러 번 수행할 수 있어 개별 동물에서 시간 경과에 따른 생물학적 변화를 추적할 수 있는 강력한 방법을 제공합니다. 충분한 뼈 치유와 골수 재생을 위해 동일한 대퇴골에 대한 흡인 사이에 최소 1개월의 회복 간격이 권장됩니다. 반대쪽 대퇴골을 사용할 때 1주일의 짧은 간격은 마우스가 과도한 스트레스나 생리적 변동성을 유발하지 않고 진통제 및 마취의 영향에서 회복되었는지 확인하기에 충분합니다.
이 결합된 쥐 골수 흡인 및 유세포 분석 기술은 JAK/p-STAT5, mTORC1/p-4EBP1, mTORC1/p-RPS6 및 MEK/p-ERK1/2를 포함한 주요 신호 경로에 대한 귀중한 통찰력을 제공합니다. 이러한 경로는 AML의 치료 내성에 중요한 역할을 합니다. 이 기술을 사용하면 동일한 동물에서 반복적으로 샘플링할 수 있으므로 단일 세포 수준에서 질병 진행 및 치료 반응을 실시간으로 모니터링할 수 있습니다.
Phosphoflow cytometry는 인산화 이벤트를 포착하고 세포 이질성을 보존합니다 4,23,24. 이는 특정 백혈병 하위 집단에서 치료에 대한 동적 세포 반응을 이해하는 데 특히 중요합니다.
미래의 응용 분야
이 프로토콜은 치료 적응의 기본 메커니즘과 AML에서 내성의 출현을 연구하기 위한 귀중한 도구를 제공하여 더 깊은 통찰력과 잠재적인 치료 발전을 위한 길을 닦습니다. 향후 연구에서는 이 접근법을 단세포 전사체학 또는 단백질체학과 통합하여 내성과 질병 진행을 유발하는 분자 메커니즘을 추가로 해부할 수 있을 것입니다25. 또한 이 방법을 다른 혈액 악성 종양 또는 염증성 질환에 적용하면 중개 연구에서 그 영향력을 확대할 수 있습니다.
이 프로토콜을 개선하고 한계를 해결함으로써 이 접근법은 혈액 질환에서 인단백질 신호 전달을 연구하기 위한 표준 방법이 될 수 있으며, 궁극적으로 보다 효과적인 치료 전략의 개발을 지원할 수 있습니다. 결론적으로, 이 프로토콜은 치료 적응의 기본 메커니즘과 AML에서 내성의 출현을 연구하는 데 유용한 도구를 제공하여 더 깊은 통찰력과 잠재적인 치료 발전을 위한 길을 닦습니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 작업은 Cole Foundation의 LH 및 FEM에 대한 전환 보조금과 캐나다 백혈병 및 림프종 협회 및 캐나다 보건 연구소(PJT-186019)의 LH 및 FEM에 대한 보조금의 지원을 받았습니다.FEM은 FRSQ Junior 2 임상 과학자이고 LH는 FRSQ Junior 2 과학자입니다. VG는 Cole Foundation에서 박사 학위 소지 학위를 받았습니다. 그림 1 은 라이선스 계약에 따라 BioRender를 사용하여 제작되었습니다. 유세포 분석 플롯은 FlowJo 소프트웨어를 사용하여 생성되었습니다. 동물 수술 시설에 대한 접근을 허락해 주신 Colin Crist 박사와 Victoria Richard에게 특별한 감사를 드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 mL syringes 25G x 5/8 TW | BD Biosciences | #309626 | Syringes for bone marrow aspiration |
| 1.7 mL Microcentrifuge Tubes | FroggaBio | #LMCT1.7B | To aliquot the cells recovered by bone marrow aspiration |
| BD Horizon Brilliant Stain Buffer | BD Biosciences | #563794 | For staining processes |
| Buprenorphine | Fidelis Animal Health | Ethiqa XR | Analgesia for mice |
| CellDrop FL Unlimited | FroggaBio | #CellDrop FL- UNLTD | For cell count |
| D-PBS | Wisent Inc. | #311-425-CL | Media for cells recovered by bone marrow aspiration |
| Eppendorf Centrifuge 5427 R | Millipore Sigma | #EP5429000260 | |
| Fetal Bovine Serum Heat Inactivated Premium CA | Wisent Inc. | #090-450 | For staining processes |
| Formaldehyde solution | Millipore Sigma | #F1635 | Cells Permeabilization |
| humanCD45 [HI30] antibody | BD Biosciences | #563792 | Antibody coupled with BUV395 |
| ID7000 Spectral Cell Analyzer | Sony | Spectral flow cytometer analyzer | |
| Isoflurane 99.9% liquid | McKesson | #803250 | Anesthesia for mice |
| Isospire (isoflurane) Inhalation Anesthetic | Dechra | Anesthesia for mice | |
| Live/dead AO/PI | FroggaBio | CD-AO/PI-1.5 | For cell count |
| Live/dead Zombie NIR | BioLegend+B6:C12 | #423106 | For spectral flow cytometry |
| Methanol solution | Millipore Sigma | #179957 | Cells Fixation |
| P-4EBP1 (Thr37/46) [236B4] antibody | Cell Signaling Technology | #2846 | Antibody coupled with Alexa Fluor 488 |
| p-Erk1/2 (Thr202/Tyr204) [197G2] antibody | Cell Signaling Technology | #13148 | Antibody coupled with Alexa Fluor 647 |
| p-RPS6 (Ser240/244) [D68F8] antibody | Cell Signaling Technology | #9468 | Antibody coupled with Alexa Fluor 594 |
| p-STAT5 (Tyr694) [D47E7] antibody | Cell Signaling Technology | #14603 | Antibody coupled with PE |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #2975 | Antibody coupled with Alexa Fluor 488 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #2985 | Antibody coupled with Alexa Fluor 647 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #8760 | Antibody coupled with Alexa Fluor 594 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #5742S | Antibody coupled with PE |
| Sanitizing wipes | United Canada | #UCDWPR-9022 | Disinfection for bone marrow aspiration |
참고문헌
- Ferrara, F., Schiffer, C. A. Acute myeloid leukaemia in adults. Lancet. 381 (9865), 484-495 (2013).
- Döhner, H., et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 129 (4), 424-447 (2017).
- Chung, Y. R., Kim, E., Abdel-Wahab, O. Femoral bone marrow aspiration in live mice. J Vis Exp. (89), e51660(2014).
- Haas, A., Weckbecker, G., Welzenbach, K. Intracellular Phospho-Flow cytometry reveals novel insights into TCR proximal signaling events. A comparison with Western blot. Cytometry A. 73 (9), 799-807 (2008).
- Perbellini, O., Cavallini, C., Chignola, R., Galasso, M., Scupoli, M. T. Phospho-specific flow cytometry reveals signaling heterogeneity in t-cell acute lymphoblastic leukemia cell lines. Cells. 11 (13), 2072(2022).
- Kornblau, S. M., et al. Simultaneous activation of multiple signal transduction pathways confers poor prognosis in acute myelogenous leukemia. Blood. 108 (7), 2358-2365 (2006).
- Perl, A. E. The role of targeted therapy in the management of patients with AML. Hematology Am Soc Hematol Educ Program. 2017 (1), 54µ65(2017).
- Márton, A., et al. The roles of phosphorylation of signaling proteins in the prognosis of acute myeloid leukemia. Pathol Oncol Res. 30, 1611747(2024).
- Levis, M. FLT3 mutations in acute myeloid leukemia: what is the best approach in 2013. Hematology Am Soc Hematol Educ Program. 2013, 220-226 (2013).
- Roux, P. P., Topisirovic, I. Signaling pathways involved in the regulation of mRNA translation. Mol Cell Biol. 38 (12), e00070-e00118 (2018).
- Nepstad, I., Hatfield, K. J., Grønningsæter, I. S., Reikvam, H. The PI3K-Akt-mTOR signaling pathway in human Acute Myeloid Leukemia (AML) Cells. Int J Mol Sci. 21 (8), ijms21082907(2020).
- Jia, X., Zhou, H. Phospho-eIF4E: A new target for acute myeloid leukemia. Curr Protein Pept Sci. 22 (4), 328-335 (2021).
- Ghosh, J., Kapur, R. Role of mTORC1-S6K1 signaling pathway in regulation of hematopoietic stem cell and acute myeloid leukemia. Exp Hematol. 50, 13-21 (2017).
- Park, H. J., et al. Therapeutic resistance in acute myeloid leukemia cells is mediated by a novel ATM/mTOR pathway regulating oxidative phosphorylation. Elife. 11, 79940(2022).
- Oki, T., et al. Imaging dynamic mTORC1 pathway activity in vivo reveals marked shifts that support time-specific inhibitor therapy in AML. Nat Commun. 12 (1), 245(2021).
- Lee, H. J., Daver, N., Kantarjian, H. M., Verstovsek, S., Ravandi, F. The role of JAK pathway dysregulation in the pathogenesis and treatment of acute myeloid leukemia. Clin Cancer Res. 19 (2), 327-335 (2013).
- Liu, A. C. H., et al. Targeting STAT5 signaling overcomes resistance to IDH Inhibitors in acute myeloid leukemia through suppression of stemness. Cancer Res. 82 (23), 4325-4339 (2022).
- Sung, P. J., Sugita, M., Koblish, H., Perl, A. E., Carroll, M. Hematopoietic cytokines mediate resistance to targeted therapy in FLT3-ITD acute myeloid leukemia. Blood Adv. 3 (7), 1061-1072 (2019).
- Song, P., Yang, F., Jin, H., Wang, X. The regulation of protein translation and its implications for cancer. Signal Transduct Target Ther. 6 (1), 68(2021).
- This Standard Operating Procedure (SOP) describes methods for anesthetizing mice. , McGill University. https://www.mcgill.ca/research/files/research/110-mouse_anesthesia-2024-06-17.pdf (2024).
- Tech Team Tips: Preparing a Sample with AO/PI. , DeNovix. https://www.denovix.com/webinars/tech-team-tips-preparing-a-sample-with-ao-pi (2021).
- Suni, M. A., Maino, V. C. Flow cytometric analysis of cell signaling proteins. Methods Mol Biol. 717, 155-169 (2011).
- Krutzik, P. O., Irish, J. M., Nolan, G. P., Perez, O. D. Analysis of protein phosphorylation and cellular signaling events by flow cytometry: techniques and clinical applications. Clin Immunol. 110 (3), 206-221 (2004).
- Chen, W., Luu, H. S. Immunophenotyping by multiparameter flow cytometry. Methods Mol Biol. 1633, 51-73 (2017).
- Perez, O. D., Nolan, G. P. Phospho-proteomic immune analysis by flow cytometry: From mechanism to translational medicine at the single-cell level. Immunol Rev. 210, 208-228 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유