Method Article
Memeli embriyolarının vitrifikasyonu için spatula Montevideo cihazı
Bu Makalede
Özet
Burada, ev yapımı bir spatuladan oluşan ve ev yapımı solüsyonlar kullanan fare ve koyun implantasyon öncesi embriyoları vitrifikasyon için Spatula Montevideo protokolünü sunuyoruz. Embriyolar, artan konsantrasyonda iki kriyoprotektan çözelti içinde hızla dengelenir, spatula üzerine yüklenir, sıvı nitrojene daldırılır ve son olarak 0.5 mL'lik bir samanla kapatılır.
Özet
Bu çalışma, Spatula Montevideo (MVD) olarak bilinen fare ve koyun embriyosu kriyoprezervasyonu için verimli ve uygun maliyetli bir vitrifikasyon yöntemini tanımlamaktadır. Bu protokol, taşıyıcı cihaz olarak bir jel yükleyici ucu ile hazırlanan ev yapımı bir spatula kullanır. Embriyolar, artan konsantrasyonda iki ev yapımı kriyoprotektan çözeltisi içinde hızla dengelenir, spatulaya yüklenir ve daha sonra doğrudan sıvı nitrojene daldırılır. Yaklaşık 30-40 implantasyon öncesi aşamadaki fare embriyosu, daha sonra 0.5 mL'lik bir pipetle kapatılan spatula üzerine yüklenebilir. Vitrifiye embriyoları saklamak için sıklıkla kullanılan kriyotüpler yerine spatulaların kullanılması, sıvı nitrojen dewarlarındaki alanı optimize eder. Ek olarak, ısınma işlemi, embriyoları yeniden sulandırmak ve morfolojilerini eski haline getirmek için yalnızca azalan konsantrasyona sahip ev yapımı bir sükroz çözeltisi gerektirir. Laboratuvarımız, 10 yılı aşkın bir süredir fare ve koyun implantasyon öncesi embriyoları için Spatula Montevideo'yu başarıyla kullanmaktadır. Spatula Montevideo, fare embriyolarında ortalama %84'lük bir iyileşme oranı (kurtarılmış/vitrifiye edilmiş embriyolar) ve %97'lik bir hayatta kalma oranı (canlı/iyileşmiş embriyolar) göstermiştir. Üreme sonuçlarında (gebelik, doğum ve doğum oranları) herhangi bir fark gözlenmemesine rağmen, murin embriyolarının vitrifikasyonu yavaş dondurmadan daha iyi sonuçlar vermiştir. Koyun embriyolarında, ticari bir cihaza kıyasla Spatula Montevideo ile benzer sağkalım ve embriyo gelişim oranları elde edilmiştir. Ticari cihaz için gebelik oranı daha yüksek olmasına rağmen, kuzu sağkalım oranı cihazlar arasında anlamlı olarak farklı değildi. Spatula Montevideo vitrifikasyon yöntemi, fazla embriyoları saklamak, genetiği değiştirilmiş fare hatlarını ve koyun modellerini yedeklemek ve dünya çapındaki araştırmacılar arasında değişimini kolaylaştırmak için kullanılabilecek basit bir kriyoprezervasyon tekniğidir.
Giriş
Genetiği değiştirilmiş (GM) hayvan üretiminin etkinliği, endonükleaz bazlı yöntemlerin, özellikle CRISPR/Cas9'un geliştirilmesi nedeniyle önemli ölçüde artmıştır. Dünya çapında birçok laboratuvar, genetik sürüklenmeyi önlemek ve orijinal fenotip1'in bütünlüğünü korumak için dondurularak saklanması gereken çeşitli GM fare ve sıçan hatları üretir. Ek olarak, arşivleme, genellikle aşırı hayvan sayısıyla sonuçlanan sürekli üreme ihtiyacını ortadan kaldırır. Bazı laboratuvarlar, GM fare hatlarını dondurularak saklanmış embriyolar veya spermler olarak uluslararası depolara göndererek, canlı hayvanların taşınmasını önlerken bu modellerin değişimini kolaylaştırır. Bu, aynı GM hayvan modellerinin tekrar tekrar üretilmesi olmadan hatlara erişilebilirlik sağlar2. Bu nedenlerden dolayı, embriyo ve sperm kriyoprezervasyonu, herhangi bir GM hayvan tesisinde çok önemlidir. Genel olarak, embriyo kriyoprezervasyonu, GM hatlarının saklanması için tercih edilir, çünkü embriyolar modifikasyonlarla birlikte tam diploid genomu içerir ve embriyo transferi yoluyla kolayca geri kazanılabilir.
Vitrifikasyon, hücreye giren su ile etrafında hücre dışı kristaller oluşturan su arasındaki dengesizlik ile karakterize edilen dengesiz bir süreçtir. Bu yöntem, hücre içi buz kristallerinin oluşumunu önler ve onu yavaş dondurma yönteminden (SLF)3 ayırır (bkz. Şekil 1). Yüksek kriyoprotektan konsantrasyonu ve sıvı nitrojen (LN2) ile doğrudan temas, ultra hızlı soğutmaya (~40 °C/s) olanak tanıyarak numunelerin saniyeler içinde camsı bir duruma ulaşmasını sağlar. Ayrıca, vitrifikasyon yavaş dondurmadan daha hızlı, daha kolay ve daha ucuzdur4. Minimum LN2 gerektirir ve tipik olarak ticari olarak satın alınabilen veya ev yapımı5 olabilen basit ekipman kullanır (bkz. Şekil 1).
Ek olarak, ısınma süreci genellikle hızlı ve tekrarlanabilir. Kriyoprotektan toksisitesini önlemek ve vitreus durumunu korumak için hızlı bir şekilde yapılmalıdır3. Embriyoları dondururken, birçok laboratuvar taşıyıcı cihazın rahatlığını, güvenilirliğini, sağlamlığını, tutma kapasitesini ve maliyetlerini göz önünde bulundurur.
Koyun ve fare embriyolarının rutin dondurularak saklanması için Spatula Montevideo (MVD) cihazı6 kullanılarak minimum hacimli spatula vitrifikasyon yöntemini tercih ediyoruz. Başlangıçta, yavaş dondurma yöntemi7'yi kullandık, ancak hızlı bir şekilde vitrifikasyona geçtik. LN2 dewar için daha basit ve daha az yer kaplayan bir cihaz oluşturmak için, 0,5 mL'lik bir pipetle kapatılmış Spatula MVD'yi geliştirmek için bir kriyotüpe takılı olan Tsang ve Chow'un (2009)8 ev yapımı spatulasını değiştirdik (bkz. Spatula, ucun ince forsepslerle hafifçe eritilerek yaklaşık 1 mm²'lik bir platformun oluşturulduğu ve embriyoları yüklemek için taç yaprağı benzeri bir plaka oluşturduğu bir jel yükleyici uca (Malzeme Tablosuna bakınız) sahiptir. Bu platform, küçük bir vitrifikasyon damlasında 40'a kadar fare embriyosunu barındırabilir. Jel yükleyici ucunun açık ucuna bir tanımlama tapası çubuğu ( Malzeme Tablosuna bakın) yerleştirilmiştir.
Bu yöntemin amacı, embriyoları basit, hızlı ve ucuz bir yöntemle vitrifiye etmektir, ayrıca nitrojen dewarında yer tasarrufu sağlar. Bu sistem uzun yıllardır başarıyla kullanılmaktadır ve özellikle fare embriyolarında mükemmel embriyo sağkalım oranları (~% 97) ve üreme sonuçları sağlamıştır. Spatula MVD laboratuvarda hazırlandığı için ticari cihazlara göre düşük maliyetli bir yöntemdir9. Ayrıca, kriyotüplerin 8,10 kullanımına kıyasla nitrojen dewar'da yerden tasarruf sağlar.
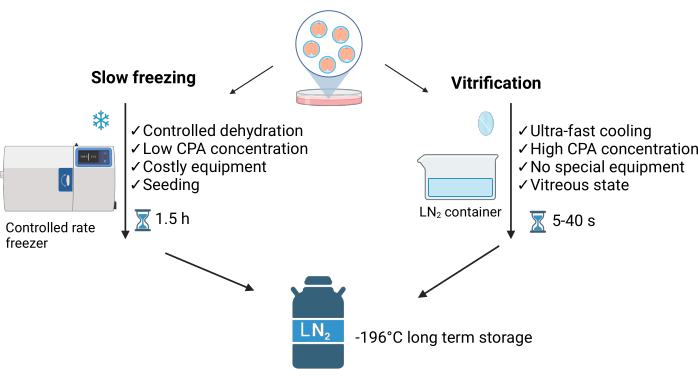
Şekil 1: Embriyo kriyoprezervasyonu için kullanılan ana iki tekniğin karşılaştırılması. Bu rakam Crispo ve ark.1'in izniyle değiştirilmiştir. BioRender.com yılında oluşturuldu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
Fare embriyoları elde etmek için kullanılan hayvanlar, ulusal yasa 18.611 ve uluslararası hayvan bakım yönergelerinegöre barındırıldı ve ele alındı 11. Deney protokolü (izin numarası #007-18) Institut Pasteur de Montevideo Hayvan Bakım ve Kullanım Komitesi tarafından uygun bir şekilde onaylandı (yazılı izin verildi). Koyun oositleri/embriyoları için deneysel protokoller, Kurumsal Hayvan Bakım Komitesi Fundación IRAUy (protokol #001-2017) tarafından ARRIVE yönergelerine12 uygun olarak onaylanmıştır ve uluslararası hayvan bakımı yönergelerine11 uygun olarak gerçekleştirilmiştir.
1. Vitrifikasyon (Şekil 2)
- Spatula MVD hazırlama
- İlk 10 mm'yi ve uç konisini keserek jel yükleyici ucunu kısaltın ( Malzeme Tablosuna bakın).
NOT: Bu, 0.5 mL pipetle son sızdırmazlığı kolaylaştıran daha kısa, düz bir uç oluşturur (bkz. Malzeme Tablosu). - Jel yükleyici ucunun ucunu saatçinin #5 forsepsiyle ( Malzeme Tablosuna bakın) uçtan yaklaşık 1.0 cm uzakta tutun. Ucu yavaşça bir Bunsen brülörünün alevine yerleştirin ( Malzeme Tablosuna bakın) ve yaklaşık 1 mm2'lik taç yaprağı benzeri bir platform oluşturmak için 8-10 saniye tutun.
- Alevden çıkarın ve forseps ile 5 saniye sıkıca tutun.
- Bir stereomikroskop kullanarak (bkz . Malzeme Tablosu), taç yaprağı benzeri platformun (~ 1 mm2) oluştuğunu ve distal kenarın kapatıldığını kontrol edin.
NOT: Vitrifikasyon sırasında LN2 sızmasını önlemek için platform distal uçta kapatılmalıdır. Platformun temiz olduğundan ve plastik iplik içermediğinden emin olun. Çok küçükse veya dişleri varsa, ucu kesin ve işlemi tekrarlayın. - Gerekli sayıda spatula hazırlamak için 1.1.1-1.1.4 adımlarını tekrarlayın (1 spatula = 40 fare embriyosuna kadar).
- Spatulaları ultraviyole (UV) ışınları veya etilen oksit kullanarak sterilize edin ve steril bir tüp veya kutuda saklayın.
- Vitrifikasyon gününde, spatulaları platformun diğer ucundan tutarak alın. Her spatulaya bir tanımlama çubuğu ( Malzeme Tablosuna bakın) yerleştirin ve bunları stereomikroskop tabanına yerleştirin. Çubuğu kalıcı bir işaretleyici veya sıvı nitrojene dayanıklı etiket etiketi ile etiketleyin.
NOT: Spatulaları tutarken daima platforma dokunmaktan kaçının. Komple cihazın toplam uzunluğu (spatula + 0,5 mL saman + tanımlama çubuğu) kadehin uzunluğunun 1 cm'den fazla olmamalıdır.
- İlk 10 mm'yi ve uç konisini keserek jel yükleyici ucunu kısaltın ( Malzeme Tablosuna bakın).
- Vitrifikasyon solüsyonlarının hazırlanması
- FS çözeltisini hazırlayın: 1.5 g yoğunluk gradyan ortamını (Malzeme Tablosuna bakınız) ve 0.85 g sakarozu (Malzeme Tablosuna bakınız) 5 mL fosfat tamponlu salin (PBS; Malzeme Tablosuna bakınız) içinde çözün. Tamamen eriyene kadar kaynar su banyosunda ısıtın, ardından 0,22 μm'lik bir filtre kullanarak sterilize edin (Malzeme Tablosuna bakınız).
NOT: Bu çözelti 4 °C'de 6 aya kadar saklanabilir. - Ön vitrifikasyon solüsyonunu (PV) hazırlayın: Vitrifikasyon gününde, %10 etilen glikol (Malzeme Tablosuna bakınız), %10 dimetil sülfoksit (Malzeme Tablosuna bakınız) ve %80 M2 ortamı (Malzeme Tablosuna bakınız) karıştırın. 5 spatula için toplam 100 μL hacme ihtiyaç vardır.
- Vitrifikasyon solüsyonunu (V) hazırlayın: Vitrifikasyon gününde %15 etilen glikol, %15 dimetil sülfoksit, %10 M2 ortamı ve %60 FS solüsyonunu birleştirin. 5 spatula için toplam 100 μL hacim gereklidir.
- FS çözeltisini hazırlayın: 1.5 g yoğunluk gradyan ortamını (Malzeme Tablosuna bakınız) ve 0.85 g sakarozu (Malzeme Tablosuna bakınız) 5 mL fosfat tamponlu salin (PBS; Malzeme Tablosuna bakınız) içinde çözün. Tamamen eriyene kadar kaynar su banyosunda ısıtın, ardından 0,22 μm'lik bir filtre kullanarak sterilize edin (Malzeme Tablosuna bakınız).
- Embriyo dehidrasyonu ve vitrifikasyon işlemi
- LN2'yi hazırlayın: LN2'yi uygun bir kaba (örn. 10 cm x 30 cm x 20 cm yalıtımlı polistiren kap) dökün ve kullanılacak spatula kadar 0,5 mL pipet yerleştirin.
NOT: LN2 altında manipülasyon sırasında spatula platformunun görselleştirilmesini kolaylaştırmak için, bir kontrast efekti oluşturmak için renkli bir alt yalıtımlı polistiren kabın kullanılması önerilir.
DİKKAT: LN2 ile çalışırken uygun gözlük ve eldiven takın (Malzeme Tablosuna bakın). - Solüsyonları hazırlayın: 100 mm'lik plastik bir Petri kabına ( Malzeme Tablosuna bakınız) aşağıdaki damlaları yerleştirin: her spatula için 100 μL M2, 20 μL PV çözeltisi ve 20 μL V çözeltisi.
- Embriyoları vitrifiye edin: Vitrifiye edilecek embriyoları M2 damlasına yerleştirin. Bir seferde 30-40 embriyoyu ele alın, bunları PV çözeltisi damlasında 30 saniye boyunca inkübe edin ve daha sonra oda sıcaklığında (RT) 30 saniye daha V çözeltisi damlasında inkübe edin.
- Bir aspiratör borusu tertibatı ile çekilmiş bir cam kılcal damar kullanın (bkz. Malzeme Tablosu) (bkz. Malzeme Tablosu). Embriyoları yerleştirmeden önce kılcal damarı en az 1 μL ilgili çözelti ile önceden yükleyin.
NOT: Embriyolar damlalarda farklı yüksekliklerde olacaktır, bu nedenle onları bulmak için stereomikroskop mikrometresini ayarlayın. 10 saniye kaldığında her damladan embriyoları alın. Tüm embriyo manipülasyonları stereomikroskop altında yapılmalıdır. - Embriyoları yükleyin: Embriyoları minimal V solüsyonu (örneğin, ~ 0.1 μL) kullanarak aspire edin ve bunları hızlı bir şekilde spatula platformuna yerleştirin.
- LN2'ye daldırma: Embriyoları yükledikten sonra, spatula platformunu hemen 5 saniye boyunca LN2'ye daldırın (spatulayı eliyle, çubuğundan tutarak). Ardından, spatulayı LN2 buharlarında tutarken, uzun paslanmaz çelik cımbız kullanarak 0,5 mL'lik bir pipetle kapatın (bkz. Malzeme Tablosu).
NOT: Isınma sırasında genleşmeyi önlemek için sızdırmazlıktan önce LN2'yi pipetten çıkarın. Embriyo damlası ile saman duvarı arasındaki teması önlemek için spatula ve pipetin düzgün şekilde hizalandığından emin olun. Kolaylık sağlamak için, kapalı spatulalar, tüm spatulalar embriyolarla yüklenene kadar LN2 kabında kalabilir ve gerektiğinde LN2 ile yeniden doldurulabilir. - Prosedürü tekrarlayın: Her bir embriyo grubu için 1.3.3 ila 1.3.7 arasındaki adımları, yeni bir çift PV ve V damlası kullanarak tekrarlayın.
- Depolama: Spatulaları kadehlere aktarın (bkz. Malzeme Tablosu) ve ardından bir LN2 saklama dewarına (bkz. Malzeme Tablosu).
- LN2'yi hazırlayın: LN2'yi uygun bir kaba (örn. 10 cm x 30 cm x 20 cm yalıtımlı polistiren kap) dökün ve kullanılacak spatula kadar 0,5 mL pipet yerleştirin.

Şekil 2: Spatula MVD kullanılarak vitrifikasyon işleminin şeması. Daha fazla ayrıntı için metne bakın. BioRender'da oluşturuldu. Meikle, M. (2025) https://BioRender.com/x96y902. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Isınma (Şekil 3)
- Çözelti hazırlama
- 0.85 g sakarozu 2.5 mL M2 ortamında çözerek 1 M'lik bir sükroz çözeltisi hazırlayın. Çözeltiyi 0.22 μm'lik bir filtre ile sterilize edin.
NOT: Bu çözelti hazırlanabilir ve 4 °C'de 1 haftaya kadar saklanabilir. - 1 M sükroz çözeltisini uygun hacimde M2 ortamı ile seyrelterek 0,5 M ve 0,25 M sükroz çözeltileri hazırlayın.
- Sükroz çözeltilerini ısınma başlayana kadar sıcak bir plaka üzerinde ( Malzeme Tablolarına bakınız) 37 °C'de tutun.
- 0.85 g sakarozu 2.5 mL M2 ortamında çözerek 1 M'lik bir sükroz çözeltisi hazırlayın. Çözeltiyi 0.22 μm'lik bir filtre ile sterilize edin.
- Isıtma plakası hazırlığı
- 100 mm'lik plastik bir Petri kabına aşağıdaki çözelti damlalarını yerleştirin: 500 μL'lik bir damla 0.5 M sükroz, 50 μL'lik bir damla 0.5 M sükroz ve her spatulanın ısıtılması için 50 μL'lik bir damla 0.25 M sükroz. Yıkamak için üç damla M2 ortamı (her biri 100 μL) koyun.
- Isınma süreci
NOT: Isıtma işlemi RT'de, örneğin bir stereomikroskop tabanında 20-22 °C'de gerçekleşir.- Mühürlü spatulaları dewardan alın. Bunları LN2 ile uygun bir kaba koyun. Şekil 3'e bakın.
- Isıtma plakasını stereomikroskobun üzerine yerleştirin. Spatulanın tabanını teker teker paslanmaz çelik cımbızla tutun ve eldivenli bir elinizle tanımlama çubuğunu ve ardından pipeti dışarı çekin. Embriyoları içeren platformu hızlı bir şekilde 500 μL'lik 0,5 M sükroz damlasına daldırın.
- Tüm embriyoların damlaya düştüğünden emin olun; Gerekirse, serbest kalmalarına yardımcı olmak için spatulayı yavaşça hareket ettirin. Embriyoları çekilmiş bir cam kılcal damara yükleyin, 50 μL'lik 0.5 M sükroz çözeltisine yerleştirin ve 2 dakika inkübe edin.
- Embriyoları 50 μL'lik 0.25 M sükroz çözeltisine yerleştirin ve 2 dakika daha inkübe edin.
NOT: Embriyoları her bir solüsyona yerleştirmeden önce, kullanılacak solüsyonu kılcal damara önceden yükleyin. - Son olarak, sakarozları çıkarmak için embriyoları farklı damla M2 ortamında üç kez yıkayın.
- Embriyoları kullanmadan önce en az 1 saat boyunca her tür için uygun koşullar altında inkübe edin.
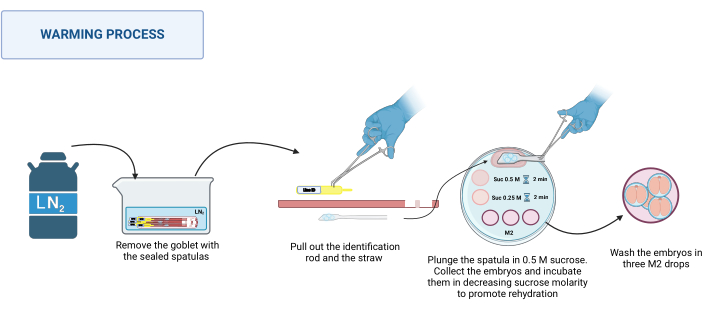
Şekil 3: Spatula MVD ısıtma işleminin şeması. Daha fazla ayrıntı için metne bakın. BioRender'da oluşturuldu. Meikle, M. (2025) https://BioRender.com/k91k191. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Başlangıçta propilen glikol çözeltileri, pipetler ve kontrollü hızlı dondurma ekipmanına dayalı geleneksel yavaş dondurma yöntemini kullandık7. Bununla birlikte, vitrifikasyon yöntemini potansiyel olarak daha kolay ve daha uygun maliyetli bir seçenek olarak gördükten sonra, 8 hücreli in vivo türetilmiş ve 2 hücreli in vitro üretilen fare embriyolarında geleneksel yavaş dondurma (SLF) ile Spatula MVD'nin sonuçlarını karşılaştırmak için bir çalışma yaptık13 (Tablo 1 ve Tablo 2). Sonuçlar, dondurularak saklanmış toplam embriyo sayısı üzerinden ısınma sonrası cihazdan geri kazanılan embriyo sayısını tanımlayan "geri kazanım oranı" cinsinden sunulmaktadır. "Hayatta kalma oranı", cihazdan kurtarılan embriyolar üzerindeki canlı embriyo sayısını ifade eder. Blastomerler sağlamsa (2 hücreli embriyolarda iki blastomer ve 8 hücreli embriyolarda en az dört blastomer) embriyoların canlı olduğu kabul edildi14. Bu terimler, cihazın ve tüm sürecin kriyoprezervasyon için uygun olup olmadığını değerlendirmek için kullanılır.
Spatula MVD için fare embriyolarında SLF grubuna göre anlamlı derecede daha yüksek bir sağkalım oranı (Tablo 1 ve Tablo 2) ve koitumdan 3.5 gün sonra gelişme oranı (dpc; ör., morulae ve blastosist embriyoları, Tablo 1) elde edilmiştir. Her iki yöntem de kabul edilebilir bir kuluçka oranına ulaşmasına rağmen, beklendiği gibi kontrol taze grubundan önemli ölçüde daha düşüktü (vitrifiye edilmemiş embriyolar; Tablo 1). Vitrifiye edilmiş/ısıtılmış ve kontrol edilmiş taze 2 hücreli embriyolar alıcı dişilere transfer edildi ve hem gebelik oranı (gebe/toplam transfer edilen dişiler) hem de doğum oranı (toplam alıcı dişilerde yavrular doğan/transfer edilen embriyolar; Tablo 2). Bu sonuçlar bizi SLF yönteminden vitrifikasyona geçmeye yönlendirmektedir.
| Embriyo sayısı | 2.5 dpc'de hayatta kalma oranı (cihazdan canlı / kurtarılan embriyolar) | 3.5 dpc'de embriyo gelişim hızı (morulae-blastokistler / canlı embriyolar) | 5.5 dpc'de kuluçka oranı (taranmış blastokistler / kültürlenmiş embriyolar) | |
| Yavaş dondurma | 410 | 89,3 % (366/410)a | 91,8 % (336/366)a | 49,7 % (90/181)a |
| Spatula MVD | 341 | 92.7 % (316/341)b | 97.2 % (307/316)b | 41.0 % (68/166)a |
| Taze embriyolar | 458 | - | 98.7 % (452/458)b | 67.8 % (139/205)b |
Tablo 1: Vitrifikasyon veya yavaş dondurmaya tabi tutulan 8 hücreli murin embriyolarının sağkalım ve in vitro gelişim oranları. İn vivo 8 hücreli murin embriyoları Spatula MVD veya yavaş dondurma ile dondurularak saklandı ve taze embriyolarla karşılaştırıldı. Dişilerden 2.5 dpc'de taze embriyolar toplandı ve diğer gruplarla aynı koşullarda kültürlendi. Hayatta kalma oranı (cihazdan canlı/geri kazanılmış embriyolar) ısınma/çözülme sonrası belirlendi. Canlı embriyolar in vitro kültüre alındı. Embriyo gelişim hızı (morula-blastokistler/canlı embriyolar) ve kuluçka hızı (taranmış/kültürlenmiş embriyolar) sırasıyla 3.5 dpc ve 5.5 dpc olarak belirlendi. Farklı üst simgeler önemli farklılıkları gösterir (P < 0.05).
| Embriyo sayısı | İyileşme oranı (cihazdan kurtarılan / dondurularak saklanan embriyolar) | Hayatta kalma oranı (cihazdan canlı/kurtarılan embriyolar) | Gebelik oranı (hamile / transfer edilen kadınlar) | Toplam transfer edilen dişilerde doğum oranı (yavrularda doğan/transfer edilen embriyolar) | |
| Yavaş dondurma | 531 | 88,3 % (469/531)a | 85.1 % (399/469)a | - | - |
| Spatula MVD | 431 | 84,2 % (363/431)a | 94.7 % (344/363)b | 53,3 % (8/15)a | 17,8 % (47/264)a |
| Taze embriyolar | 446 | - | 97.7 % (436/446)b | 53,3 % (8/15)a | 20,6 % (53/257)a |
Tablo 2: Vitrifikasyon veya yavaş dondurmaya tabi tutulan 2 hücreli murin embriyolarının iyileşme ve hayatta kalma oranları. Taze embriyolara karşı vitrifiye / ısıtılmış embriyoların üreme sonuçları.İn vitro üretilen 2 hücreli embriyolar Spatula MVD veya SLF ile dondurularak saklandı. Isınma veya çözülme sonrası iyileşme (cihazdan kurtarılan/dondurularak saklanan embriyolar) ve sağkalım oranı (canlı/cihazdan kurtarılan embriyolar) belirlendi. Canlı ısıtılmış ve taze embriyolar alıcı dişilere transfer edildi (grup başına 15 dişi, dişi başına ~ 17 embriyo). Gebelik (gebe/transfer edilen dişi) ve doğum (yavru doğum/transfer edilen embriyo) oranları belirlendi. Farklı üst simgeler önemli farklılıkları gösterir (P < 0.05).
Spatula MVD ayrıca in vitro üretilen koyun implantasyon öncesi embriyoların vitrifikasyonu için test edildi ve ticari bir cihazla karşılaştırıldı6. Sonuçlar Tablo 3'te gösterilmiştir. Embriyoların kalitesi, Uluslararası Embriyo Teknolojisi Derneği (IETS)15 tarafından önerilen kriterlere göre morfoloji ile değerlendirildi ve bu mükemmel ve iyi Derece 1 embriyolar her deney grubuna tahsis edildi.
Ne hayatta kalma oranı (~% 70 ve ~% 16, ısınmadan 3 saat veya 24 saat sonra) ne de 8. gündeki embriyo yumurtadan çıkma vitrifikasyon yönteminden etkilenmedi. 8. gündeki blastosist yüzdesi, her iki vitrifikasyon tekniği için kontrol grubuna (taze embriyolar) kıyasla daha düşüktü (sırasıyla ~% 8'e karşı% 20.5; P < 0.05). Bu sonuçlar, in vitro üretilen koyun embriyolarının da Spatula MVD kullanılarak vitrifiye edilebileceğini göstermektedir. Ek olarak, önceki sonuçlar, yavaş dondurma, Spatula MVD veya ticari bir cihaza tabi tutulan koyun embriyolarının alıcı dişilereaktarılmasıyla tamamlandı 16. Sonuçlar Tablo 4'te gösterilmiştir. Deney grupları arasında embriyo sağkalım oranı (30. günde canlı embriyolar/transfer edilen embriyolar), gebelik oranı (gebe/transfer edilen koyunlar), gebelikten doğuma kadar fetal kayıp (doğumda değerlendirilen kuzular/30. günde canlı embriyolar) ve kuzu sağkalım oranı (doğumdan 1 hafta sonra canlı kuzular/doğan kuzular) değerlendirildi.
Sonuçlar, embriyo transferi sonrası embriyo sağkalım oranının SLF (%26.5) ve Spatula MVD (%22.2) için benzer olduğunu, ancak ticari cihaz grubu için daha yüksek olduğunu (%52.0, P < 0.05) gösterdi. Üreme sonuçları (gebelik uzunluğu, fetal kayıp, doğum ağırlığı ve kuzu sağkalım oranları) kriyoprezervasyon yönteminden önemli ölçüde etkilenmedi. Genel olarak, Spatula MVD, küçükbaş hayvan implantasyon öncesi embriyoların vitrifikasyonu için de uygun bir yöntemdir.
| Embriyo sayısı | Hayatta kalma oranı % (canlı/dondurularak saklanmış embriyolar) | Gelişme oranı % (6. günde morula-blastokistler / parçalanmış embriyolar) | Kuluçka oranı % (yumurtadan çıkmış blastokistler / parçalanmış embriyolar) | ||
| 3 saat | 24 saat | ||||
| Spatula MVD | 165 | 69,6 ± 2,4A | 14,6 ± 3,5A | 11.1 ± 2.1b | 6.4 ± 1.9b |
| Ticari cihaz | 165 | 71,3 ± 1,3bir | 17,7 ± 4,5A | 12.7 ± 3.2b | 10.2 ± 2.9b |
| Kontrol grubu (taze embriyolar) | 408 | - | - | 41,3 ± 3,7bir | 20,5 ± 4,5A |
Tablo 3: Spatula MVD veya ticari bir cihaz ile vitrifikasyona tabi tutulan küçükbaş embriyolarının sağkalım ve in vitro gelişim oranları.İn vitro olarak üretilen 2-8 hücre aşaması embriyoları (döllenmeden sonraki 2. gün) Spatula MVD veya ticari bir cihaz kullanılarak vitrifiye edildi ve daha sonra ısıtıldı. Hayatta kalma oranı (canlı / kriyoprezervasyon), ısınmadan 3 saat ve 24 saat sonra analiz edildi. Gelişme ve kuluçka oranları, parçalanmış (2-8 hücreli) embriyo sayısı üzerinden sırasıyla 6. günde elde edilen morulae ve blastosist sayısı ve yumurtadan çıkan embriyo sayısı olarak tanımlandı. Aynı sütundaki farklı üst simgeler önemli farklılıklar gösterir (P < 0.05). Veriler Ortalama ± SEM olarak gösterilir.
| Embriyo sağkalımı (30. günde canlı embriyolar / transfer edilen embriyolar) | Gebelik oranı (gebe/transfer edilen koyunlar) | Fetal kayıp (doğumda doğan kuzular/30. günde canlı embriyolar) | Gebelik uzunluğu (d) | Doğum ağırlığı (g) | Kuzu hayatta kalma oranı (doğumdan bir hafta sonra canlı kuzular / doğan kuzular) | |
| Spatula MVD | 22.2 %A (28/126) | %32,9 %A (25/76) | 4.0 %A (1/25) | 150,7 ± 1,8A | 4102 ± 112,4A | 87.5 %A (21/24) |
| Ticari cihaz | 52.0 %B (91/175) | 66.0 %B (62/94) | 11.0 %A (8/73) | 150,4 ± 1,9A | 3980 ± 221,2kg A | 83.1 %A (54/65) |
| Yavaş dondurma | 26.5 %A (36/136) | 38.3 %A (28/73) | 6.7 %A (2/30) | 150,4 ± 2,1A | 4319 ± 107,3kg A | 89.3 %A (25/28) |
Tablo 4: Kriyoprezervasyon yönteminin transfer sonrası embriyo sağkalımı, gebelik bakımı ve kuzu üretimi üzerine etkisi. Morulalardan in vivo veya in vitro üretilen embriyoların genişletilmiş blastosistlerine vitrifikasyon/yavaş dondurma ve ısınma/çözülme işlemlerine tabi tutuldu ve multipar Merinos senkronize koyunlara transfer edildi. Deney grupları arasında embriyo sağkalım oranı (30. günde canlı embriyolar/transfer edilen embriyolar), gebelik oranı (gebe/transfer edilen koyunlar), gebelikten doğuma kadar fetal kayıp (doğumda doğan kuzular/30. günde canlı embriyolar), gebelik süresi (d), doğum ağırlığı (g) ve kuzu sağkalım oranı (doğumdan bir hafta sonra canlı kuzular/doğan kuzular) karşılaştırıldı.
Ayrıca, tesisimizde artık kullanılmayan genetiği değiştirilmiş fare hatları, Spatula MVD yöntemi kullanılarak iki hücreli embriyolar olarak yedeklenmiştir. Esas olarak in vitro fertilizasyon (veya doğal çiftleşme) ile üretilen en az 300 iki hücreli embriyo, her fare hattı için vitrifiye edildi. İşlemin kalite kontrolü, her çizgiden iki veya üç spatula ısıtılarak ve embriyolar psödogebe kadın alıcılara transfer edilerek gerçekleştirildi. Genetik olarak değiştirilmiş farklı fare çizgilerinin temsili sonuçları Tablo 5'te gösterilmektedir. Ortalama olarak, iyileşme oranı %90.4 ve sağkalım oranı %96.8 idi. Gebelik oranı %80, doğum oranı ise ortalama %31,5 idi. Unutulmamalıdır ki, doğum oranı %12 ila %45 arasında geniş bir sonuç yelpazesi göstermiştir, bu da embriyo duyarlılığını ve embriyo transfer sonuçlarını etkileyebilecek farklı genetik modifikasyonlara bağlı olabilir. Genel olarak, bu sonuçlar tesiste daha önce elde edilenlerle tutarlıydı.
| Fare çizgisi | Vitrifiye edilmiş/ısıtılmış embriyo sayısı | İyileşme oranı (cihazdan kurtarılan / dondurularak saklanan embriyolar) | Hayatta kalma oranı (cihazdan canlı/kurtarılan embriyolar) | Gebelik oranı (hamile / transfer edilen kadınlar) | Doğum oranı (yavruların doğduğu/transfer ettiği embriyolar) |
| 1 | 60 | 83.3 % (50/60) | 96.0 % (48/50) | 50 % (1/2) | 19.4 % (7/36) |
| 2 | 35 | 100 % (35/35) | 100 % (35/35) | 100 % (1/1) | 39.1 % (9/23) |
| 3 | 43 | 76.7 % (33/43) | 84.8 % (28/33) | 100 % (1/1) | 38.8 % (7/18) |
| 4 | 41 | 92.6 % (38/41) | 97.3 % (37/38) | 100 % (2/2) | 31.4 % (11/35) |
| 5 | 66 | 98.4 % (65/66) | 100 % (65/65) | 100 % (3/3) | 36.6 % (22/60) |
| 6 | 70 | 94.2 %(66/70) | 95.4 % (63/66) | 33 % (1/3) | 12 % (6/50) |
| 7 | 74 | 87.8 % (65/74) | 100 % (65/65) | 100 % (3/3) | 45 % (27/60) |
| Ortalama | 90.4 % (352/389) | 96.8 % (341/352) | 80 % (12/15) | 31.5 % (89/282) |
Tablo 5: Farklı genetiği değiştirilmiş fare hatlarının 2 hücreli embriyolarında gerçekleştirilen kalite kontrol vitrifikasyon işleminin temsili sonuçları. GM fare hatları, Spatula MVD yöntemi kullanılarak iki hücreli embriyolar (en az 300 embriyo) olarak desteklendi. İşlemin kalite kontrolü, her çizgiden iki veya üç spatula ısıtılarak ve embriyolar psödogebe kadın alıcılara transfer edilerek gerçekleştirildi. Isınma sonrası iyileşme (cihazdan kurtarılan/dondurularak saklanan embriyolar) ve sağkalım oranı (cihazdan canlı/kurtarılan embriyolar) belirlendi. Canlı ısıtılmış embriyolar, 2 hücreli aşamada alıcı dişilere transfer edildi (hat başına 1 ila 3 dişi, dişi başına ~ 18 embriyo). Gebelik (gebe/transfer edilen dişi) ve doğum (yavru doğum/transfer edilen embriyo) oranları belirlendi.
Son olarak, yakın zamanda, taze ve vitrifiye ile ısıtılmış fare zigotlarının CRISPR reaktifleri ile mikroenjekte edildiği ve daha sonra in vitro kültürlendiği veya psödogebe dişilere aktarıldığı karşılaştırmalı bir çalışma gerçekleştirdik17. Amaç, Spatula MVD kullanılarak vitrifiye edilen zigotların B6D2F1/J ve C57BL/6J zigotlarda mikroenjeksiyon için uygun bir embriyo kaynağı olup olamayacağını değerlendirmekti. İyileşme ve sağkalım oranları, 2-8 hücre evresindeki embriyolar için elde edilen önceki sonuçlara benzerdi (Tablo 6). Genel olarak, vitrifiye ile ısıtılmış zigotlar mikroenjeksiyondan kurtuldu, yumurtadan çıkmış blastosistlere dönüştü veya canlı yavrular üretti ve CRISPR / Cas9 sistemi tarafından indüklenen mutasyonları gösterdi. Bununla birlikte, vitrifiye zigotlarda mutasyon oranı taze olanlara göre önemli ölçüde daha düşüktü. Zigot kriyobankacılık, talep üzerine mikroenjeksiyon seansları gerçekleştirmek, tüm yıl boyunca hayvanların üremesini ve bakımını önlemek ve CRISPR teknolojisinde 3R'lerin uygulanmasını geliştirmek için alternatif bir embriyo kaynağı gibi görünmektedir.
| Suş zigot | Dondurularak saklanmış zigot sayısı | İyileşme oranı (cihazdan kurtarılan / dondurularak saklanan embriyolar) | Hayatta kalma oranı (cihazdan canlı/kurtarılan embriyolar) |
| B6D2F1/J | 380 | 97.1 % (369/380) | 90.8 % (335/369) |
| C57BL/6J Serisi | 800 | 84.0 % (672/800) | 92.3 % (620/672) |
Tablo 6: Vitrifiye ile ısıtılmış B6D2F1 / J ve C57BL / 6J zigotlarının geri kazanım ve hayatta kalma oranları. İn vivo üretilen zigotlar, B6D2F1 / J ve C57BL / 6J donör dişilerinden toplandı, Spatula MVD ile vitrifiye edildi ve ısıtıldı. Isınma sonrası geri kazanım (cihazdan kurtarılan/dondurularak saklanan embriyolar) ve sağkalım (canlı/cihazdan kurtarılan embriyolar) oranları belirlendi.
Tartışmalar
Spatula MVD, yüksek embriyo tutma kapasitesine ve optimum sıvı nitrojen dewar doluluğuna sahip, montajı kolay, düşük maliyetli, minimum hacimli bir vitrifikasyon cihazıdır. Bu yöntemin basit, hızlı ve sağlam olduğu kanıtlanmıştır. Ortalama olarak, vitrifiye embriyoların sadece yüksek embriyo geri kazanımı ve hayatta kalma oranları (~% 90) değil, aynı zamanda farelerde embriyo transferi gerçekleştirirken iyi üreme sonuçları (~% 80 gebelik oranı ve ~% 30 doğum oranı) elde ettik, bu da diğer minimum hacimli vitrifikasyon yöntemleriyle karşılaştırılabilir 18,19,20.
Spatula MVD vitrifikasyon yöntemindeki kritik adımlar şunları içerir: (i) Spatula hazırlama. Bu teknik önemli bir uzmanlık gerektirir. Jel yükleyici ucunda forseps ile ısıtılarak üretilen platform ~ 1 mm2 olmalı ve sonunda kapatılmalıdır. Uç açık kalırsa, ısınma işlemi sırasında spatulayı sakaroz damlasına daldırırken sıcaklık farkları nedeniyle kabarcıklar oluşabilir. Kabarcıklar embriyo arama ve iyileşmeyi engeller. (ii) Vitrifikasyon solüsyonlarında embriyo inkübasyonu. Yüksek yoğunluk nedeniyle, embriyolar damlalarda farklı yüksekliklerde kalır. Tüm embriyoların hızlı bir şekilde aspire edilmesi gerekir. Embriyolar bu solüsyonlarda oda sıcaklığında daha uzun süre kalırsa toksisite beklenir. (iii) Spatula vitrifikasyon damlası. Platformdaki embriyoları içeren vitrifikasyon damlasının hacmi ~ 0.5-1.0 μL olmalıdır; Daha büyük kriyoprotektan hacimleri embriyo canlılığını etkiler. İhtiyaç duyulan hacmi taşıyacak bir embriyonun boyutundan biraz daha geniş bir iç çapa sahip çekilmiş kılcal damarların kullanılmasını öneririz. Ek olarak, platformdaki daha büyük düşüşler, sistemi kapatırken duvarın içindeki 0,5 mL pipete takılma olasılığını artırabilir. (iv) Spatula sızdırmazlığı. Spatulayı 0,5 mL samanla kapatırken özel dikkat gösterilmelidir; Her iki elemanın da hizalanması gerekir. Spatula içindeki embriyo damlaları rahatsız edilmemelidir. (v) Isınma sırasında, çubuk tanımlayıcının ve 0.5 mL pipetin çıkarılma sırasını izleyin. Aksi takdirde, tanımlayıcı sıcaklık farkı tarafından dışarı atılabilir.
Bu teknik, farklı aşamalarda operatör eğitimi gerektirir. Ana sorun giderme, embriyoların spatuladan geri kazanılması olabilir. Spatula ısıtılırken vitrifiye embriyoların %70-80'inden daha azı geri kazanılıyorsa, bunun nedeni (i) embriyoların spatula platformuna eksik yüklenmesi veya (ii) sistem kapatıldığında embriyoların 0.5 mL saman iç duvarında tutulması olabilir. İlk sorunun üstesinden gelmek için, embriyoları içeren damlanın yüklenmesi, bir aspiratör tüpü düzeneği ve embriyoları içeren kriyoprotektan ortam ile yüklü çekilmiş bir kılcal damar ve kılcal damar boyunca 2-3 küçük hava kabarcığı kullanılarak stereomikroskop altında gerçekleştirilmelidir, bu da sıvının doğru bir şekilde akmasını sağlar. İkinci konu için, ısınma sırasında platformda hiç embriyo görünmüyorsa, 0.5 mL pipeti açmak için pamuk tapasını kesin ve M2'de 500 μL 0.5 M sükroz ile iki kez yıkayın (bkz. bölüm 2, adım 1), çözeltiyi embriyo geri kazanımı için bir tabakta dışarı atın.
Yöntemin sınırlamaları esas olarak daha önce bahsedilen kritik aşamalarla ilgilidir. Kilit noktanın spatula hazırlığı olduğuna inanıyoruz. İyi bir spatula yapmak eğitim gerektirir, ancak bir kez öğrenildiğinde ustalaşılabilir. Besiyere ev yapımı olduğu için bu yöntem insan üreme kliniklerinde kullanılamaz.
Spatula MVD'nin en büyük avantajı, ticari cihazlara kıyasla düşük maliyetli bir cihaz olmasıdır9. Ayrıca, kriyotüp vitrifikasyonuna8 kıyasla sıvı nitrojen dewar'da yerden tasarruf sağlar. İşlevselliğini fare ve koyun embriyoları üzerinde farklı aşamalarda test ettik. Yavaş dondurma yönteminden özellikle daha basit, daha hızlı, daha ekonomik ve daha etkilidir.
Bu yöntem, çok çeşitli araştırma alanlarında insan olmayan farklı memeli türlerinin embriyolarını vitrifiye etmek için kullanılabilir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Alejo Menchaca'ya Spatula MVD'nin geliştirilmesine yaptığı katkılardan dolayı teşekkür ederiz. GS, Biyoteknoloji Yüksek Lisans Programı - Facultad de Ciencias - Universidad de la República'dan (https://webmasterbiotecnol.wixsite.com/biotec1) fon aldı (Hibe Numarası: GS 2437 347). GS, MNM ve MC, FOCEM - Fondo para la Convergencia Estructural del Mercosur'dan (https://focem.mercosur.int/es/) fon aldı (Hibe Numarası: COF 03/11). GS ve MC, Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación, Uruguay üyesidir. (https://www.anii.org.uy/). Fon sağlayıcılar (Biyoteknoloji Yüksek Lisans Programı - Facultad de Ciencias -Universidad de la República; FOCEM - Fondo para la Convergencia Estructural del Mercosur; Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación, Uruguay) çalışma tasarımı, veri toplama ve analizi, yayınlama kararı veya makalenin hazırlanmasında hiçbir rolü olmamıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter | Sartorius | 16534 | Minisart syringe filter 0.2 µL |
| 0.5 mL straw | Minitube | 13408/0044 | French type medium paillette |
| Aspirator tube assembly | Sigma | A5177 | |
| Bunsen burner | Indulab | 7000134 | |
| Dimethyl sulfoxide | Sigma | D2650 | |
| Ethylene glycol | Sigma | 102466 | |
| Ficoll PM70 | Sigma | F2878 | Density gradient medium |
| Gel-loader tip | Eppendorf | 10411193 | |
| Glass capillary | Marienfeld | 2900000 | Microhaematocrit capillary tube |
| Gloves for LN2 handling | Tempshield | CE0338 | Cryogloves |
| Goblets | Minitube | 16913/1133 | |
| Goggles for LN2 handling | 3M | 40661-00000-10 | Anti-fog, anti-scratch coating |
| Hot plate | Labec | LA-SH-II-5B | Digital model |
| Identification rod | IMV technologies | 6326 | Non steril LG48 mm |
| Insulated styrofoam container | |||
| LN2 storage dewar | Taylor-Wharton | XT21-AI | Cryoscience |
| Long stainless-steel twezeers | Fine Science Tools | 11000-25 | |
| M2 | Sigma | M7167 | |
| PBS | Home-made | Phosphate Buffered saline. Usually 1 L of concentrated 5x buffer is prepared and then diluted to 1x. Recipe: 40 g sodium chloride, 1 g potassium chloride, 7.2 g anhydrous disodium phosphate, 1.2 g monopotassium phosphate. Add distilled water and sterilize by autoclave. | |
| Plastic Petri dish | Falcon | 351029 | Not TC-treated Bacteriological Petri Dish |
| Stereomicroscope | Olympus | SZ2-LGB | |
| Sucrose | Sigma | S1888 | |
| Watchmaker’s #5 forceps | Fine Science Tools | 11254-20 |
Referanslar
- Crispo, M., Meikle, M. N., Rülicke, T. Cryopreservation of Valuable Mouse and Rat Lines. Rodent Quality Control: Genes and Bugs. Laboratory Animal Science and Medicine. , Springer. Cham. (2024).
- Lloyd, K., Franklin, C., Lutz, C., Magnuson, T. Reproducibility: use mouse biobanks or lose them. Nature. 522 (7555), 151-153 (2015).
- Hart-Johnson, S., Mankelow, K. Archiving genetically altered animals: a review of cryopreservation and recovery methods for genome-edited animals. Lab Anim. 56 (1), 26-34 (2022).
- Shaw, J. M., Jones, G. M. Terminology associated with vitrification and other cryopreservation procedures for oocytes and embryos. Hum Reprod Update. 9 (6), 583-605 (2003).
- Arav, A. Cryopreservation of oocytes and embryos. Theriogenology. 81 (1), 96-102 (2014).
- dos Santos Neto, P. C., et al. Cryotolerance of Day 2 or Day 6 in vitro produced ovine embryos after vitrification by Cryotop or Spatula methods. Cryobiology. 70 (1), 17-22 (2015).
- Renard, J. P., Babinet, C. High survival of mouse embryos after rapid freezing and thawing inside plastic straws with 1-2 propanediol as cryoprotectant. J Exp Zool. 230 (3), 443-448 (1984).
- Tsang, W. H., Chow, K. L. Mouse embryo cryopreservation utilizing a novel high-capacity vitrification spatula. Biotechniques. 46 (7), 550-552 (2009).
- Kuwayama, M. Highly efficient vitrification for cryopreservation of human oocytes and embryos: the Cryotop method. Theriogenology. 67 (1), 73-80 (2007).
- Nakao, K., Nakagata, N., Katsuki, M. Simple and efficient vitrification procedure for cryopreservation of mouse embryos. Exp Anim. 46 (3), 231-234 (1997).
- National Research Council. Guide for the Care and Use of Laboratory Animals. , National Academies Press. Washington, DC. (1996).
- du Sert, N. P., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biol. 18 (7), e3000410(2020).
- Meikle, M. N., Schlapp, G., Menchaca, A., Crispo, M. Minimum volume Spatula MVD vitrification method improves embryo survival compared to traditional slow freezing, both for in vivo and in vitro produced mice embryos. Cryobiology. 84, 77-81 (2018).
- Momozawa, K., et al. Efficient vitrification of mouse embryos using the Kitasato Vitrification System as a novel vitrification device. Reprod Biol Endocrinol. 15 (1), 29(2017).
- Stringfellow, D. A., Givens, M. D. Manual of the International Embryo Transfer Society: A Procedural Guide and General Information for the use of Embryo Transfer Technology Emphasizing Sanitary Procedures. , International Embryo Transfer Society. (2010).
- Dos Santos-Neto, P. C., Cuadro, F., Barrera, N., Crispo, M., Menchaca, A. Embryo survival and birth rate after minimum volume vitrification or slow freezing of in vivo and in vitro produced ovine embryos. Cryobiology. 78, 8-14 (2017).
- Schlapp, G., Meikle, M. N., Pórfido, J. L., Menchaca, A., Crispo, M. Zygote cryobanking applied to CRISPR/Cas9 microinjection in mice. PLoS One. 19 (7), e0306617(2024).
- Kamoshita, M., et al. Recent advances of oocyte/embryo vitrification in mammals from rodents and large animals. Anim Sci J. 95 (1), e13931(2024).
- Qiu, J., et al. Equilibrium vitrification of mouse embryos using low concentrations of cryoprotectants. Cryobiology. 98, 127-133 (2021).
- Tsang, W. H., Chow, K. L. Cryopreservation of mammalian embryos: Advancement of putting life on hold. Birth Defects Res C Embryo Today. 90 (3), 163-175 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır