Method Article
מרית מכשיר מונטווידאו לזיגוג של עוברי יונקים
In This Article
Summary
כאן, אנו מציגים את פרוטוקול מרית מונטווידאו לזיגוג עוברים לפני השרשה של עכברים וכבשים, המורכב ממרית תוצרת בית ושימוש בתמיסות תוצרת בית. העוברים מתאזנים במהירות בשתי תמיסות קריופרוטקטנטיות בריכוז הולך וגובר, נטענות על המרית, טובלות בחנקן נוזלי, ולבסוף נאטמות בקשית של 0.5 מ"ל.
Abstract
מחקר זה מתאר שיטת ויטריפיקציה יעילה וחסכונית לשימור הקפאה של עוברי עכברים וכבשים המכונה מרית מונטווידאו (MVD). פרוטוקול זה משתמש במרית תוצרת בית כמכשיר הנשא, המוכן עם קצה מעמיס ג'ל. העוברים מתאזנים במהירות בשתי תמיסות קריופרוטקטנטיות תוצרת בית בריכוז הולך וגובר, נטענות לתוך המרית ולאחר מכן טובלות ישירות בחנקן נוזלי. ניתן להעמיס כ-30-40 עוברי עכברים בשלב טרום ההשתלה על המרית, אשר נאטמת לאחר מכן בקש של 0.5 מ"ל. השימוש במרית במקום קריו-צינורות, המשמשות לעתים קרובות לאחסון עוברים מזוגגים, מייעל את החלל בחצרות החנקן הנוזלי. בנוסף, תהליך ההתחממות דורש רק תמיסת סוכרוז ביתית בריכוז יורד כדי להחזיר לחות לעוברים ולהחזיר את המורפולוגיה שלהם. המעבדה שלנו משתמשת בהצלחה במרית מונטווידאו לעוברים טרום השרשה של עכברים וכבשים במשך למעלה מ-10 שנים. המרית מונטווידאו הדגימה שיעור החלמה ממוצע (עוברים משוחזרים/מזוגגים) של 84% ושיעור הישרדות (עוברים ברי קיימא/משוחזרים) של 97% בעוברי עכברים. ויטריפיקציה של עוברי עכברים הניבה תוצאות טובות יותר מהקפאה איטית, אם כי לא נצפו הבדלים בתוצאות הרבייה (הריון, לידה ושיעורי לידה). בעוברי כבשים, שיעורי הישרדות והתפתחות עוברים דומים הושגו עם מרית מונטווידאו בהשוואה למכשיר מסחרי. למרות ששיעור ההריונות היה גבוה יותר עבור המכשיר המסחרי, שיעור ההישרדות של הכבש לא היה שונה באופן משמעותי בין המכשירים. שיטת הזיגוג של מרית מונטווידאו היא טכניקת שימור הקפאה פשוטה שניתן להשתמש בה כדי לאחסן עודפי עוברים, לגבות קווי עכברים מהונדסים גנטית ומודלים של כבשים, ולהקל על החלפתם בין חוקרים ברחבי העולם.
Introduction
היעילות של יצירת בעלי חיים מהונדסים גנטית (GM) עלתה משמעותית עקב פיתוח שיטות מבוססות אנדונוקלאז, במיוחד CRISPR/Cas9. מעבדות רבות ברחבי העולם מייצרות קווים שונים של עכברים וחולדות מהונדסים גנטית שיש לשמר בהקפאה כדי למנוע סחיפה גנטית ולשמור על שלמות הפנוטיפהמקורי 1. בנוסף, ארכיון מבטל את הצורך בגידול מתמיד, מה שלעתים קרובות מביא למספר מוגזם של בעלי חיים. חלק מהמעבדות שולחות קווי עכברים מהונדסים גנטית כעוברים או זרע שמורים בהקפאה למאגרים בינלאומיים, מה שמקל על החלפת המודלים הללו תוך הימנעות מהובלת בעלי חיים חיים. זה מבטיח נגישות לקווים ללא הדור החוזר של דגמי בעלי חיים מהונדסים גנטית זהים2. מסיבות אלה, שימור עוברים וזרע בהקפאה הוא בעל חשיבות עליונה בכל מתקן לבעלי חיים מהונדסים גנטית. באופן כללי, שימור הקפאה של עוברים מועדף לאחסון קווים מהונדסים גנטית מכיוון שהעוברים מכילים את הגנום הדיפלואידי השלם עם שינויים וניתן לשחזר אותם בקלות באמצעות העברת עוברים.
ויטריפיקציה היא תהליך לא שיווי משקל המאופיין בחוסר איזון בין מים הנכנסים לתא לבין מים היוצרים גבישים חוץ-תאיים סביבו. שיטה זו מונעת היווצרות של גבישי קרח תוך-תאיים, ומבדילה אותה משיטת ההקפאה האיטית (SLF)3 (ראו איור 1). הריכוז הגבוה של חומרים קריופרוטקטנטים ומגע ישיר עם חנקן נוזלי (LN2) מאפשרים קירור מהיר במיוחד (~40 °C/s), ומשיגים מצב זגוגי של הדגימות תוך שניות. יתר על כן, ויטריפיקציה מהירה יותר, קלה יותר וזולה יותר מהקפאה איטית4. הוא דורש LN2 מינימלי ובדרך כלל משתמש בציוד פשוט שניתן לרכוש מסחרית או תוצרת בית5 (ראה איור 1).
בנוסף, תהליך ההתחממות הוא בדרך כלל מהיר וניתן לשכפול. יש לבצע אותו במהירות כדי למנוע רעילות קריאופרוטקטנטית ולשמור על מצב הזגוגית3. בעת הקפאת עוברים, מעבדות רבות שוקלות את הנוחות של מכשיר הנשא, אמינותו, חוסנו, יכולת ההחזקה והעלויות שלו.
אנו מעדיפים את שיטת ויטריפיקציה של מרית בנפח מינימלי לשימור שגרתי בהקפאה של עוברי כבשים ועכברים, באמצעות מכשיר מרית מונטווידאו (MVD)6. בתחילה, השתמשנו בשיטת ההקפאה האיטית7 אך עברנו במהירות לזיגוג. כדי ליצור מכשיר פשוט וחסכוני יותר במקום עבור ה-LN2 dewar, שינינו את המרית הביתית של Tsang and Chow (2009)8, המחוברת לצינור קריו, כדי לפתח את ה-Spatula MVD האטום בקשית של 0.5 מ"ל (ראה טבלת חומרים). המרית כוללת קצה מעמיס ג'ל (ראה טבלת חומרים), שבו נוצרת פלטפורמה של כ-1 מ"מ² על ידי המסה עדינה של הקצה בעזרת מלקחיים עדינים, ויצירת צלחת דמוית עלי כותרת להעמסת העוברים. פלטפורמה זו יכולה להכיל עד 40 עוברי עכברים בטיפת זיגוג קטנה. מוט תקע זיהוי (ראה טבלת חומרים) מוכנס לקצה הפתוח של קצה מעמיס הג'ל.
מטרת שיטה זו היא לזגוג עוברים בשיטה פשוטה, מהירה וזולה אשר בנוסף חוסכת מקום בדיואר החנקן. מערכת זו נמצאת בשימוש מוצלח במשך שנים רבות, ומספקת שיעורי הישרדות עוברים מצוינים (~97%) ותוצאות רבייה, במיוחד בעוברי עכברים. מכיוון שמרית MVD מוכנה במעבדה, מדובר בשיטה בעלות נמוכה בהשוואה למכשירים מסחריים9. יתר על כן, זה חוסך מקום ב-dewar החנקן בהשוואה לשימוש בצינורות קריו-צינורות 8,10.
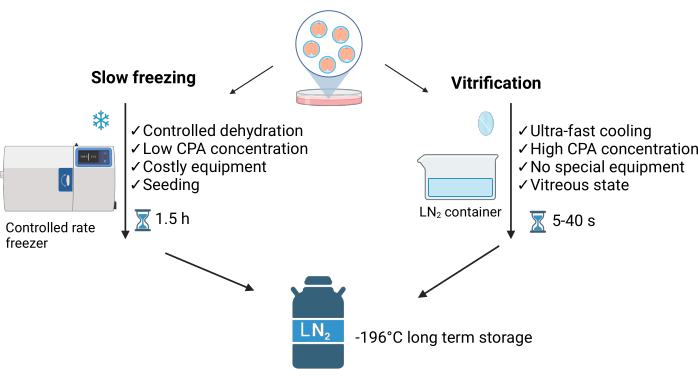
איור 1: השוואה בין שתי הטכניקות העיקריות המשמשות לשימור עוברים בהקפאה. נתון זה שונה באישור Crispo et al.1. נוצר בשנת BioRender.com. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Protocol
בעלי חיים ששימשו להשגת עוברי עכברים שוכנו וטופלו על פי החוק הלאומי 18.611 וההנחיות הבינלאומיות לטיפול בבעלי חיים11. פרוטוקול הניסוי (מספר היתר #007-18) אושר בהזדמנות על ידי הוועדה לטיפול ושימוש בבעלי חיים של מכון פסטר דה מונטווידאו (ניתנה הסכמה בכתב). פרוטוקולים ניסיוניים לביציות/עוברים של כבשים אושרו על ידי הוועדה המוסדית לטיפול בבעלי חיים Fundación IRAUy (פרוטוקול #001-2017), בהתאם להנחיות ARRIVE12 ובוצעו בהתאם להנחיות הבינלאומיות לטיפול בבעלי חיים11.
1. ויטריפיקציה (איור 2)
- הכנת מרית MVD
- קצר את קצה מעמיס הג'ל (ראה טבלת חומרים) על ידי חיתוך 10 מ"מ הראשונים וחרוט הקצה.
הערה: זה יוצר קצה קצר וישר יותר, המקל על האיטום הסופי עם קש 0.5 מ"ל (ראה טבלת חומרים). - החזיקו את קצה קצה מעמיס הג'ל עם מלקחיים #5 של השען (ראו טבלת חומרים) במרחק של כ-1.0 ס"מ מהקצה. הנח בעדינות את הקצה לתוך הלהבה של מבער בונסן (ראה טבלת חומרים) והחזק למשך 8-10 שניות ליצירת פלטפורמה דמוית עלי כותרת של כ-1 מ"מ2.
- מסירים מהלהבה ומחזיקים בחוזקה עם המלקחיים למשך 5 שניות.
- באמצעות סטריאומיקרוסקופ (ראה טבלת חומרים), בדוק שהפלטפורמה דמוית עלי הכותרת (~ 1 מ"מ2) נוצרת והקצה הדיסטלי אטום.
הערה: יש לסגור את הפלטפורמה בקצה הדיסטלי כדי למנוע חדירת LN2 במהלך הזגוגית. ודא שהפלטפורמה נקייה וללא חוטי פלסטיק. אם הוא קטן מדי או שיש לו חוטים, חתוך את הקצה וחזור על ההליך. - חזור על שלבים 1.1.1-1.1.4 כדי להכין את המספר הדרוש של מרית (מרית אחת = עד 40 עוברי עכבר).
- עקרו את המרית באמצעות קרניים אולטרה סגולות (UV) או תחמוצת אתילן ואחסנו אותן בצינור או קופסה סטרילית.
- ביום הזיגוג, שלפו את המרית, טפלו בהן מהקצה הנגדי של הרציף. הכנס מוט זיהוי (ראה טבלת חומרים) לכל מרית והנח אותם על בסיס הסטריאומיקרוסקופ. סמן את המוט בטוש קבוע או בתווית מדבקה עמידה בחנקן נוזלי.
הערה: הימנע תמיד מלגעת בפלטפורמה בעת הטיפול במרית. אורכו הכולל של המכשיר השלם (מרית + קש 0.5 מ"ל + מוט זיהוי) לא יעלה על יותר מ -1 ס"מ מאורך הגביע.
- קצר את קצה מעמיס הג'ל (ראה טבלת חומרים) על ידי חיתוך 10 מ"מ הראשונים וחרוט הקצה.
- הכנת פתרונות ויטריפיקציה
- הכן את תמיסת FS: ממיסים 1.5 גרם של מדיום שיפוע צפיפות (ראה טבלת חומרים) ו-0.85 גרם סוכרוז (ראה טבלת חומרים) ב-5 מ"ל של מי מלח עם חוצץ פוספט (PBS; ראה טבלת חומרים). מחממים באמבט מים רותחים עד להמסה מלאה, ולאחר מכן מעקרים באמצעות מסנן של 0.22 מיקרומטר (ראה טבלת חומרים).
הערה: ניתן לאחסן תמיסה זו בטמפרטורה של 4 מעלות צלזיוס עד 6 חודשים. - הכן את תמיסת הקדם-ויטריפיקציה (PV): ביום הוויטריפיקציה, מערבבים 10% אתילן גליקול (ראה טבלת חומרים), 10% דימתיל סולפוקסיד (ראה טבלת חומרים) ו-80% M2 בינוני (ראה טבלת חומרים). יש צורך בנפח כולל של 100 מיקרוליטר עבור 5 מרית.
- הכן את תמיסת הזיגוג (V): ביום הוויטריפיקציה, שלב 15% אתילן גליקול, 15% דימתיל סולפוקסיד, 10% M2 בינוני ו-60% תמיסת FS. נדרש נפח כולל של 100 מיקרוליטר עבור 5 מרית.
- הכן את תמיסת FS: ממיסים 1.5 גרם של מדיום שיפוע צפיפות (ראה טבלת חומרים) ו-0.85 גרם סוכרוז (ראה טבלת חומרים) ב-5 מ"ל של מי מלח עם חוצץ פוספט (PBS; ראה טבלת חומרים). מחממים באמבט מים רותחים עד להמסה מלאה, ולאחר מכן מעקרים באמצעות מסנן של 0.22 מיקרומטר (ראה טבלת חומרים).
- תהליך התייבשות וזיגוג עוברים
- הכן LN2: יוצקים LN2 למיכל מתאים (למשל, מיכל פוליסטירן מבודד בגודל 10 ס"מ על 30 ס"מ על 20 ס"מ) ומניחים קשיות של 0.5 מ"ל כמו מרית לשימוש.
הערה: כדי להקל על הדמיה של פלטפורמת המרית במהלך מניפולציה תחת LN2, מוצע להשתמש במיכל פוליסטירן צבעוני מבודד תחתון ליצירת אפקט ניגודיות.
זהירות: הרכיבו משקפי מגן וכפפות מתאימות (ראה טבלת החומרים) בעת הטיפול ב-LN2. - הכן פתרונות: על צלחת פטרי מפלסטיק 100 מ"מ (ראה טבלת חומרים), הניחו את הטיפות הבאות: 100 מיקרוליטר של M2, 20 מיקרוליטר של תמיסת PV ו-20 מיקרוליטר של תמיסת V לכל מרית.
- ויטריפיקציה של עוברים: הנח את העוברים המיועדים לזיגוג בטיפה M2. טפל ב-30-40 עוברים בכל פעם, דגר אותם בטיפה של תמיסת ה-PV למשך 30 שניות, ולאחר מכן בתמיסת V טיפה למשך 30 שניות נוספות בטמפרטורת החדר (RT).
- השתמש בנימי זכוכית משוכים (ראה טבלת חומרים) עם מכלול צינור שואב (ראה טבלת חומרים). טען מראש את הנימים עם לפחות 1 מיקרוליטר מהתמיסה המתאימה לפני הנחת העוברים.
הערה: העוברים יהיו בגבהים שונים בטיפות, לכן התאימו את המיקרומטר הסטריאומיקרוסקופ כדי לאתר אותם. אחזר עוברים מכל טיפה כשנותרו 10 שניות. כל מניפולציות העובר חייבות להתבצע תחת סטריאומיקרוסקופ. - העמסת עוברים: שאפו את העוברים באמצעות תמיסת V מינימלית (למשל, ~ 0.1 מיקרוליטר) והניחו אותם במהירות על משטח המרית.
- טבילה ב- LN2: לאחר העמסת העוברים, טבלו מיד את משטח המרית ב- LN2 למשך 5 שניות (החזיקו את המרית ביד, במוט שלה). לאחר מכן, תוך שמירה על המרית באדי LN2 , אטמו אותה בקשית של 0.5 מ"ל באמצעות פינצטה ארוכה מנירוסטה (ראה טבלת חומרים).
הערה: הסר את LN2 מהקשית לפני האיטום כדי למנוע התרחבות במהלך ההתחממות. ודא שהמרית והקש מיושרים כהלכה כדי למנוע מגע בין טיפת העובר לדופן הקש. מטעמי נוחות, מרית אטומה יכולה להישאר במיכל LN2 עד שכל המרית תעמיס בעוברים, ולמלא מחדש ב-LN2 לפי הצורך. - חזור על ההליך: חזור על שלבים 1.3.3 עד 1.3.7 עבור כל קבוצת עוברים, באמצעות זוג טרי של טיפות PV ו-V.
- אחסון: מעבירים את המרית לגביעים (ראה טבלת חומרים) ולאחר מכן לאחסון LN2 (ראה טבלת חומרים).
- הכן LN2: יוצקים LN2 למיכל מתאים (למשל, מיכל פוליסטירן מבודד בגודל 10 ס"מ על 30 ס"מ על 20 ס"מ) ומניחים קשיות של 0.5 מ"ל כמו מרית לשימוש.

איור 2: סכימה של תהליך הזיגוג באמצעות Spatula MVD. ראה את הטקסט לפרטים נוספים. נוצר ב-BioRender. מייקל, מ '(2025) https://BioRender.com/x96y902. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
2. התחממות (איור 3)
- הכנת פתרון
- הכן תמיסת סוכרוז של 1 M הממיסה 0.85 גרם סוכרוז ב -2.5 מ"ל של מדיום M2. עקר את התמיסה עם מסנן של 0.22 מיקרומטר.
הערה: ניתן להכין ולאחסן תמיסה זו בטמפרטורה של 4 מעלות צלזיוס עד שבוע. - הכן תמיסות סוכרוז של 0.5 M ו-0.25 M על ידי דילול תמיסת הסוכרוז של 1 M בנפח המתאים של מדיום M2.
- שמור על תמיסות הסוכרוז בטמפרטורה של 37 מעלות צלזיוס על פלטה חמה (ראה טבלאות חומרים) עד לתחילת ההתחממות.
- הכן תמיסת סוכרוז של 1 M הממיסה 0.85 גרם סוכרוז ב -2.5 מ"ל של מדיום M2. עקר את התמיסה עם מסנן של 0.22 מיקרומטר.
- הכנת צלחת חימום
- על צלחת פטרי מפלסטיק בקוטר 100 מ"מ, הניחו את טיפות התמיסה הבאות: טיפה של 500 מיקרוליטר של 0.5 מ' סוכרוז, טיפה של 50 מיקרוליטר של 0.5 מ' סוכרוז וטיפה של 50 מיקרוליטר של 0.25 מ' סוכרוז לכל מרית לחימום. מניחים שלוש טיפות של M2 בינוני (100 מיקרוליטר כל אחת) לכביסה.
- תהליך התחממות
הערה: תהליך ההתחממות מתרחש ב-RT, למשל, 20-22 מעלות צלזיוס על בסיס סטריאומיקרוסקופ.- מוציאים את המרית החתומה מהדיואר. הניחו אותם בכלי מתאים עם LN2. ראה איור 3.
- הנח את צלחת החימום על הסטריאומיקרוסקופ. בזה אחר זה, החזיקו את בסיס המרית בפינצטה מנירוסטה, וביד עטויה כפפה, שלפו את מוט הזיהוי ולאחר מכן את הקש. טבלו במהירות את הפלטפורמה המכילה את העוברים לתוך טיפת סוכרוז של 0.5 M של 500 מיקרוליטר.
- ודא שכל העוברים נפלו לתוך הטיפה; במידת הצורך, הזיזו בעדינות את המרית כדי לסייע בשחרורם. טען את העוברים לתוך נימי זכוכית משוך, הניח אותם בטיפת 50 מיקרוליטר של תמיסת סוכרוז של 0.5 M, ודגר למשך 2 דקות.
- מניחים את העוברים בטיפת 50 מיקרוליטר של תמיסת סוכרוז של 0.25 M ודוגרים למשך 2 דקות נוספות.
הערה: לפני הנחת העוברים בכל תמיסה, טען מראש את הנימים בתמיסה לשימוש. - לבסוף, שטפו את העוברים שלוש פעמים בטיפות שונות של מדיום M2 כדי להסיר את הסוכרוז.
- לדגור את העוברים בתנאים המתאימים לכל מין לפחות שעה אחת לפני השימוש.
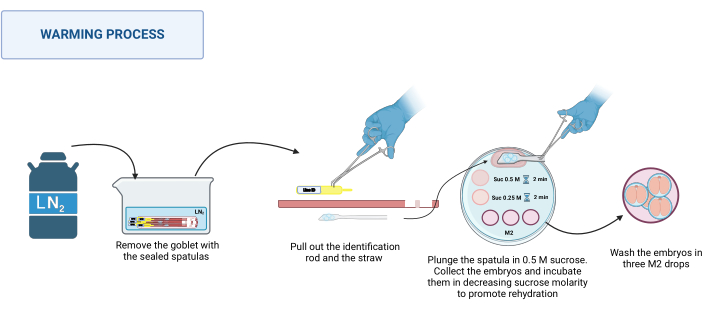
איור 3: סכימה של תהליך ההתחממות MVD של מרית. ראה את הטקסט לפרטים נוספים. נוצר ב-BioRender. מייקל, מ '(2025) https://BioRender.com/k91k191. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
תוצאות
בתחילה השתמשנו בשיטת ההקפאה האיטית המסורתית המבוססת על תמיסות פרופילן גליקול, קשיות וציוד הקפאה בקצב מבוקר7. עם זאת, לאחר ששקלנו את שיטת הזיגוג כאפשרות קלה וחסכונית יותר, ערכנו מחקר להשוואת התוצאות של הקפאה איטית מסורתית (SLF) לעומת MVD מרית בעוברי עכברים שנוצרו על ידי 8 תאים in vivo ו-2 תאים במבחנה 13 (טבלה 1 וטבלה 2). התוצאות מוצגות במונחים של "שיעור התאוששות" המגדיר את מספר העוברים שהוחזרו מהמכשיר לאחר התחממות על פני המספר הכולל של עוברים שמורים בהקפאה. "שיעור הישרדות" מתייחס למספר העוברים ברי הקיימא על פני העוברים שהוחזרו מהמכשיר. עוברים נחשבו ברי קיימא אם הבלסטומרים היו שלמים (שני בלסטומרים בעוברים דו-תאיים ולפחות ארבעה בלסטומרים בעוברים בעלי 8 תאים)14. מונחים אלה משמשים כדי להעריך אם המכשיר והתהליך כולו מתאימים לשימור בהקפאה.
שיעור הישרדות גבוה משמעותית (טבלה 1 וטבלה 2) וקצב התפתחות 3.5 ימים לאחר קיום יחסי מין (dpc; למשל, עוברי מורולה ובלסטוציסט, טבלה 1) הושגו עבור מרית MVD מאשר עבור קבוצת SLF בעוברי עכברים. למרות ששתי השיטות הגיעו לקצב בקיעה מקובל, הוא היה נמוך משמעותית מקבוצת הביקורת הטרייה, כצפוי (עוברים ללא זיגוג; טבלה 1). עוברים דו-תאיים טריים מזוגגים/מחוממים ובקרה הועברו לנקבות המקבלות, ולא חשפו הבדלים הן בשיעור ההריון (נקבות בהריון/סך כל הנקבות שהועברו) והן בשיעור הילודה (גורים שנולדו/הועברו עוברים בסך הנקבות המקבלות; טבלה 2). תוצאות אלה מובילות אותנו לעבור משיטת SLF לזיגוג.
| מספר עוברים | שיעור הישרדות של 2.5 dpc (עוברים ברי קיימא/משוחזרים מהמכשיר) | קצב התפתחות העובר ב-3.5 dpc (מורולה-בלסטוציסטים/עוברים ברי קיימא) | קצב בקיעה ב-5.5 dpc (בלסטוציסטים שבקעו/עוברים מתורבתים) | |
| הקפאה איטית | 410 | 89.3% (366/410)א | 91.8% (336/366)a | 49.7 % (90/181)א |
| מרית MVD | 341 | 92.7% (316/341)ב | 97.2 % (307/316)ב | 41.0 % (68/166)א |
| עוברים טריים | 458 | - | 98.7% (452/458)ב | 67.8 % (139/205)ב |
טבלה 1: שיעורי הישרדות והתפתחות במבחנה של עוברי עכברים בעלי 8 תאים הנתונים לזיגוג או הקפאה איטית. עוברי עכברים בעלי 8 תאים נשמרו בהקפאה על ידי מרית MVD או הקפאה איטית והושוו לעוברים טריים. עוברים טריים נאספו מנקבות במינון של 2.5 dpc וגודלו באותם תנאים כמו הקבוצות האחרות. שיעור ההישרדות (עוברים ברי קיימא/משוחזרים מהמכשיר) נקבע לאחר התחממות/הפשרה. עוברים ברי קיימא תורבו במבחנה . קצב התפתחות העובר (מורולה-בלסטוציסטים/עוברים ברי קיימא) וקצב הבקיעה (עוברים שבקעו/מתורבתים) נקבעו ב-3.5 dpc ו-5.5 dpc, בהתאמה. כתבים עיליים שונים מצביעים על הבדלים משמעותיים (P < 0.05).
| מספר עוברים | שיעור התאוששות (שחזר מהמכשיר/עוברים שמורים בהקפאה) | שיעור הישרדות (עוברים ברי קיימא/משוחזרים מהמכשיר) | שיעור הריונות (נשים בהריון/מועברות) | שיעור הילודה בסך הנקבות המועברות (גורים שנולדו/הועברו) | |
| הקפאה איטית | 531 | 88.3% (469/531)א | 85.1% (399/469)א | - | - |
| מרית MVD | 431 | 84.2% (363/431)א | 94.7% (344/363)ב | 53.3 % (8/15)a | 17.8% (47/264)א |
| עוברים טריים | 446 | - | 97.7% (436/446)ב | 53.3 % (8/15)a | 20.6 % (53/257)א |
טבלה 2: שיעורי התאוששות והישרדות של עוברי עכברים דו-תאיים הנתונים לזיגוג או הקפאה איטית. תוצאות רבייה של עוברים מזוגגים/מחוממים לעומת עוברים טריים.עוברים דו-תאיים שיוצרו במבחנה נשמרו בהקפאה על ידי מרית MVD או SLF. ההתאוששות (ששוחזרה מהמכשיר/עוברים שמורים בהקפאה) ושיעור ההישרדות (עוברים ברי קיימא/משוחזרים מהמכשיר) נקבעו לאחר התחממות או הפשרה. עוברים מחוממים וטריים ברי קיימא הועברו לנקבות המקבלות (15 נקבות לקבוצה, ~17 עוברים לנקבה). נקבעו שיעורי הריון (נקבות בהריון/מועברות) ולידה (גורים שנולדו/הועברו). כתבים עיליים שונים מצביעים על הבדלים משמעותיים (P < 0.05).
מרית MVD נבדקה גם לזיגוג של עוברי כבשים שהופקו במבחנה והושוותה למכשיר מסחרי6. התוצאות מוצגות בטבלה 3. איכות העוברים הוערכה על ידי מורפולוגיה בהתאם לקריטריונים שהומלצו על ידי האגודה הבינלאומית לטכנולוגיית עוברים (IETS)15, ואותם עוברים מצוינים וטובים בדרגה 1 הוקצו לכל קבוצת ניסוי.
לא שיעור ההישרדות (~70% ו~16%, 3 שעות או 24 שעות לאחר ההתחממות, בהתאמה) ולא בקיעת העובר ביום 8 הושפעו משיטת הזיגוג. אחוז הבלסטוציסטים ביום 8 היה נמוך יותר בשתי טכניקות הזיגוג בהשוואה לקבוצת הביקורת (עוברים טריים) (~8% לעומת 20.5%, בהתאמה; P < 0.05). תוצאות אלה מצביעות על כך שניתן לזגג עוברי כבשים המיוצרים במבחנה גם באמצעות ה-MVD של מרית. בנוסף, תוצאות קודמות הושלמו על ידי העברת עוברי כבשים שעברו הקפאה איטית, MVD מרית או מכשיר מסחרי לנקבות המקבלות16. התוצאות מוצגות בטבלה 4. שיעור הישרדות העוברים (עוברים ברי קיימא ביום ה-30/עוברים שהועברו), שיעור ההריון (כבשים בהריון/מועברות), אובדן עובר מההריון ועד הלידה (כבשים שנולדו הוערכו בלידה/עוברים ברי קיימא ביום ה-30) ושיעור הישרדות הטלאים (כבשים חיים שבוע לאחר הלידה/כבשים שנולדו) הוערכו בין קבוצות הניסוי.
התוצאות הראו כי שיעור הישרדות העוברים לאחר העברת העוברים היה דומה עבור SLF (26.5%) ו-MVD מרית (22.2%) אך היה גבוה יותר עבור קבוצת המכשירים המסחריים (52.0%, P < 0.05). תוצאות הרבייה (אורך ההריון, אובדן עובר, משקל לידה ושיעורי הישרדות כבשים) לא הושפעו באופן משמעותי משיטת השימור בהקפאה. בסך הכל, מרית MVD היא גם שיטה מתאימה לזיגוג של עוברים לפני השרשה של ביצים.
| מספר העוברים | % שיעור הישרדות (עוברים ברי קיימא/שמורים בהקפאה) | % קצב התפתחות (מורולה-בלסטוציסטים ביום 6/עוברים מפוצלים) | שיעור הבקיעה % (בלסטוציסטים שבקעו / עוברים שסועים) | ||
| 3 שעות | 24 שעות | ||||
| מרית MVD | 165 | 69.6 ± 2.4א | 14.6 ± 3.5א | 11.1 ± 2.1ב | 6.4 ± 1.9ב |
| מכשיר מסחרי | 165 | 71.3 ± 1.3א | 17.7 ± 4.5A | 12.7 ± 3.2ב | 10.2 ± 2.9ב |
| קבוצת ביקורת (עוברים טריים) | 408 | - | - | 41.3 ± 3.7א | 20.5 ± 4.5א |
טבלה 3: שיעורי הישרדות והתפתחות במבחנה של עוברי בקרים הנתונים לזיגוג על ידי מרית MVD או מכשיר מסחרי.עוברים שנוצרו במבחנה 2-8 בשלב התאים (יום 2 לאחר ההפריה) עברו זיגוג באמצעות מרית MVD או מכשיר מסחרי ולאחר מכן חוממו. שיעור ההישרדות (בר-קיימא/שמור בהקפאה) נותח לאחר 3 שעות ו-24 שעות לאחר ההתחממות. שיעורי ההתפתחות והבקיעה הוגדרו כמספר המורולות והבלסטוציסטים שהתקבלו ביום השישי ומספר העוברים שבקעו, בהתאמה, על פני מספר העוברים המפוצלים (2-8 תאים). כתבים עיליים שונים באותה עמודה מצביעים על הבדלים משמעותיים (P < 0.05). הנתונים מוצגים כממוצע ± SEM.
| הישרדות עוברים (עוברים ברי קיימא ביום ה-30/עוברים שהועברו) | שיעור הריון (כבשים בהריון/מועברות) | אובדן עובר (כבשים שנולדו נגישים בלידה/עוברים ברי קיימא ביום ה-30) | אורך הריון (d) | משקל לידה (גרם) | שיעור הישרדות כבשים (טלאים חיים שבוע לאחר הלידה/כבשים שנולדו) | |
| מרית MVD | 22.2 %a (28/126) | 32.9 %A (25/76) | 4.0% A (1/25) | 150.7 ± 1.8א | 4102 ± 112.4א | 87.5% A (21/24) |
| מכשיר מסחרי | 52.0% B (91/175) | 66.0% B (62/94) | 11.0% A (8/73) | 150.4 ± 1.9א | 3980 ± 221.2א | 83.1% A (54/65) |
| הקפאה איטית | 26.5 %a (36/136) | 38.3% A (28/73) | 6.7% A (2/30) | 150.4 ± 2.1א | 4319 ± 107.3א | 89.3% A (25/28) |
טבלה 4: השפעת שיטת השימור בהקפאה על הישרדות העוברים לאחר העברה, תחזוקת הריון וייצור כבשים. מורולה לבלסטוציסטים מורחבים של עוברים שנוצרו in vivo או in vitro היו נתונים לזיגוג / הקפאה איטית והתחממות / הפשרה והועברו לכבשים מסונכרנות מרובות מרינו. שיעור הישרדות העוברים (עוברים ברי קיימא ביום ה-30/עוברים שהועברו), שיעור ההריון (כבשים בהריון/מועברות), אובדן עובר מההריון ועד הלידה (כבשים שנולדו נגישים בלידה/עוברים ברי קיימא ביום ה-30), אורך ההיריון (d), משקל הלידה (g) ושיעור ההישרדות של הטלאים (כבשים חיים שבוע לאחר הלידה/כבשים שנולדו) הושוו בין קבוצות הניסוי.
יתר על כן, קווי עכברים מהונדסים גנטית שכבר אינם בשימוש במתקן שלנו גובו כעוברים דו-תאיים בשיטת Spatula MVD. מינימום של 300 עוברים דו-תאיים, שנוצרו בעיקר על ידי הפריה חוץ גופית (או הזדווגות טבעית), עברו זיגוג עבור כל קו עכבר. בקרת האיכות של התהליך בוצעה על ידי חימום שתיים או שלוש מרית מכל קו והעברת העוברים לנשים בהריון. תוצאות מייצגות של קווי עכברים שונים מהונדסים גנטית מוצגות בטבלה 5. בממוצע, שיעור ההחלמה היה 90.4%, ושיעור ההישרדות היה 96.8%. שיעור ההריונות היה 80%, ושיעור הילודה היה 31.5% בממוצע. יש לציין כי שיעור הילודה הראה טווח רחב של תוצאות בין 12% ל-45%, מה שיכול לנבוע מהשינויים הגנטיים השונים שיכולים להשפיע על רגישות העוברים ותוצאות העברת העוברים. באופן כללי, תוצאות אלה היו עקביות עם אלה שהושגו בעבר במתקן.
| קו עכבר | מספר עוברים מזוגגים/מחוממים | שיעור התאוששות (התאוששות מהמכשיר/עוברים שמורים בהקפאה) | שיעור הישרדות (עוברים ברי קיימא/משוחזרים מהמכשיר) | שיעור הריונות (נשים בהריון/מועברות) | שיעור ילודה (גורים שנולדו/הועברו עוברים) |
| 1 | 60 | 83.3 % (50/60) | 96.0 % (48/50) | 50 % (1/2) | 19.4 % (7/36) |
| 2 | 35 | 100 % (35/35) | 100 % (35/35) | 100 % (1/1) | 39.1 % (9/23) |
| 3 | 43 | 76.7 % (33/43) | 84.8 % (28/33) | 100 % (1/1) | 38.8 % (7/18) |
| 4 | 41 | 92.6 % (38/41) | 97.3 % (37/38) | 100 % (2/2) | 31.4 % (11/35) |
| 5 | 66 | 98.4 % (65/66) | 100 % (65/65) | 100 % (3/3) | 36.6 % (22/60) |
| 6 | 70 | 94.2 %(66/70) | 95.4 % (63/66) | 33 % (1/3) | 12 % (6/50) |
| 7 | 74 | 87.8 % (65/74) | 100 % (65/65) | 100 % (3/3) | 45 % (27/60) |
| ממוצע | 90.4 % (352/389) | 96.8 % (341/352) | 80 % (12/15) | 31.5 % (89/282) |
טבלה 5: תוצאות מייצגות של תהליך ויטריפיקציה לבקרת איכות שבוצע בעוברים דו-תאיים של קווי עכבר מהונדסים גנטית שונים. קווי עכברים מהונדסים גנטית גובו כעוברים דו-תאיים (מינימום 300 עוברים) בשיטת Spatula MVD. בקרת האיכות של התהליך בוצעה על ידי חימום שתיים או שלוש מרית מכל קו והעברת העוברים לנשים בהריון. התאוששות (התאוששות מהמכשיר/עוברים שמורים בהקפאה) ושיעור ההישרדות (עוברים ברי קיימא/משוחזרים מהמכשיר) נקבעו לאחר ההתחממות. עוברים מחוממים ברי קיימא הועברו בשלב של 2 תאים לנקבות המקבלות (1 עד 3 נקבות בכל שורה, ~18 עוברים לנקבה). נקבעו שיעורי הריון (נקבות בהריון/מועברות) ולידה (גורים שנולדו/הועברו).
לבסוף, ביצענו לאחרונה עבודה השוואתית שבה זיגוטות עכברים טריות ומחוממות בזיגוג הוזרקו במיקרו-ריאגנטים של CRISPR ולאחר מכן תרבית במבחנה או הועברו לנקבות פסאודו-הריוניות17. המטרה הייתה להעריך האם זיגוטות מזוגגות - באמצעות מרית MVD - יכולות להוות מקור מתאים לעוברים להזרקת מיקרו בזיגוטות B6D2F1/J ו-C57BL/6J. שיעורי ההחלמה וההישרדות היו דומים לתוצאות הקודמות שהתקבלו עבור עוברים בשלב 2-8 תאים (טבלה 6). בסך הכל, זיגוטות מחוממות בזיגוג שרדו מיקרו-הזרקה, התפתחו לבלסטוציסטים שבקעו או ייצרו גורים חיים, והדגימו מוטציות שנגרמו על ידי מערכת CRISPR/Cas9. עם זאת, שיעור המוטציות היה נמוך משמעותית בזיגוטות מזוגגות מאשר בטריות. נראה כי קריובנקאות של Zygote היא מקור חלופי לעוברים לביצוע מפגשי מיקרו-הזרקה לפי דרישה, הימנעות מגידול ותחזוקה של בעלי חיים לאורך כל השנה ושיפור היישום של 3Rs בטכנולוגיית CRISPR.
| זן זיגוטה | Nº של זיגוטות שמורות בהקפאה | שיעור התאוששות (שחזר מהמכשיר / עוברים שמורים בהקפאה) | שיעור הישרדות (עוברים ברי קיימא/משוחזרים מהמכשיר) |
| B6D2F1/J | 380 | 97.1 % (369/380) | 90.8 % (335/369) |
| C57BL/6J | 800 | 84.0 % (672/800) | 92.3 % (620/672) |
טבלה 6: שיעורי התאוששות והישרדות של זיגוטות B6D2F1/J ו-C57BL/6J מחוממות בזיגוג.זיגוטות שנוצרו על ידי in vivo נאספו מנקבות תורמות B6D2F1/J ו-C57BL/6J, מזוגגות על ידי מרית MVD, והתחממו. שיעורי ההתאוששות (ששוחזרו מהמכשיר/עוברים שמורים בהקפאה) וההישרדות (עוברים ברי קיימא/משוחזרים מהמכשיר) נקבעו לאחר ההתחממות.
Discussion
ה-Spatula MVD הוא מכשיר ויטריפיקציה קל להרכבה, בעלות נמוכה, בנפח מינימלי עם יכולת החזקת עוברים גבוהה ותפוסה אופטימלית של חנקן נוזלי. שיטה זו הוכיחה את עצמה כפשוטה, מהירה וחזקה. בממוצע, השגנו לא רק שיעורי התאוששות והישרדות גבוהים של עוברים מזוגגים (~90%) אלא גם תוצאות רבייה טובות בעת ביצוע העברת עוברים בעכברים (~80% שיעור הריון ו~30% שיעור לידה), הניתנים להשוואה לשיטות אחרות של זיגוג בנפח מינימלי 18,19,20.
שלבים קריטיים בשיטת הוויטריפיקציה של מרית MVD כוללים: (i) הכנת מרית. טכניקה זו דורשת מומחיות רבה. הפלטפורמה המיוצרת בקצה מעמיס הג'ל על ידי חימום בעזרת מלקחיים צריכה להיות ~ 1 מ"מ2 ויש לסגור אותה בסוף. אם הקצה נשאר פתוח, עלולות להיווצר בועות בעת טבילת המרית בטיפת הסוכרוז במהלך תהליך ההתחממות בגלל הבדלי טמפרטורה. בועות מפריעות לחיפוש העוברים ולהתאוששותם. (ii) דגירה של עוברים בתמיסות זיגוגית. בגלל הצפיפות הגבוהה, העוברים נשארים בגבהים שונים בטיפות. יש צורך בשאיפה מהירה של כל העוברים. רעילות צפויה אם העוברים נשארים בתמיסות אלה לתקופות ארוכות יותר בטמפרטורת החדר. (iii) טיפת זיגוג מרית. נפח טיפת הזיגוג - המכילה את העוברים - בפלטפורמה צריך להיות ~0.5-1.0 מיקרוליטר; נפחי קריופרוטקטנטים גדולים יותר משפיעים על כדאיות העובר. אנו ממליצים להשתמש בנימים משוכים בקוטר פנימי מעט רחב יותר מגודל העובר, אשר יישאו את הנפח הדרוש. בנוסף, טיפות גדולות יותר בפלטפורמה עלולות להגדיל את האפשרות להיתקע בקש של 0.5 מ"ל בתוך הקיר בעת סגירת המערכת. (4) איטום מרית. יש לנקוט בזהירות מיוחדת בעת סגירת המרית עם הקש של 0.5 מ"ל; שני האלמנטים צריכים להיות מיושרים. אסור להפריע לטיפות עובר במרית. (v) במהלך ההתחממות, עקוב אחר סדר ההסרה של מזהה המוט והקש של 0.5 מ"ל. אחרת, המזהה עלול להיפלט על ידי הפרש הטמפרטורה.
טכניקה זו דורשת הכשרת מפעילים בשלבים שונים. פתרון הבעיות העיקרי יכול להיות שחזור העוברים מהמרית. אם פחות מ-70-80% מהעוברים המזוגגים מתאוששים בעת חימום המרית, ייתכן שהדבר נובע מ-(i) העמסה לא שלמה של העוברים על משטח המרית או (ii) עוברים שנשמרים בדופן הפנימית של קש 0.5 מ"ל כאשר המערכת סגורה. כדי להתגבר על הבעיה הראשונה, העמסת הטיפה המכילה את העוברים חייבת להתבצע תחת הסטריאומיקרוסקופ באמצעות מכלול צינור שואב ונימים משוכים טעונים באמצעי ההקפאה המכיל את העוברים ו-2-3 בועות אוויר קטנות לאורך הנימים, מה שמאפשר זרימה נכונה של הנוזל. לנושא השני, אם לא נראים עוברים בפלטפורמה במהלך ההתחממות, חתכו את פקק הכותנה כדי לפתוח את הקש של 0.5 מ"ל ושטפו אותו פעמיים עם 500 מיקרוליטר של 0.5 מ' סוכרוז ב-M2 (ראה סעיף 2, שלב 1), והוציאו את התמיסה בצלחת לשחזור העוברים.
מגבלות השיטה קשורות בעיקר לשלבים הקריטיים שכבר הוזכרו. אנו מאמינים שנקודת המפתח היא הכנת המרית. נדרש אימון כדי לבצע מרית טובה, אך ברגע שלומדים אותה, ניתן לשלוט בה. מכיוון שהמדיה היא תוצרת בית, לא ניתן להשתמש בשיטה זו במרפאות רבייה אנושיות.
היתרון העיקרי של מרית MVD הוא שמדובר במכשיר בעלות נמוכה בהשוואה למסחריים9. יתר על כן, זה חוסך מקום בניקוי החנקן הנוזלי בהשוואה לזיגוג קריוטיוב8. בדקנו את הפונקציונליות שלו על עוברי עכברים וכבשים בשלבים שונים. זה פשוט במיוחד, מהיר יותר, חסכוני יותר ויעיל יותר משיטת ההקפאה האיטית.
ניתן להשתמש בשיטה זו לזיגוג עוברים של מינים שונים של יונקים שאינם אנושיים במגוון רחב של תחומי מחקר.
Disclosures
המחברים מצהירים שאין ניגודי אינטרסים.
Acknowledgements
אנו מודים לאלג'ו מנצ'אקה על תרומתו לפיתוח ה-MVD של מרית. GS קיבלה מימון מהתוכנית לתואר שני בביוטכנולוגיה - Facultad de Ciencias - Universidad de la República (https://webmasterbiotecnol.wixsite.com/biotec1) (מספר מענק: GS 2437 347). GS, MNM ו-MC קיבלו מימון מ-FOCEM - Fondo para la Convergencia Estructural del Mercosur (https://focem.mercosur.int/es/) (מספר מענק: COF 03/11). GS ו-MC הם עמיתים של Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación, Uruguay. (https://www.anii.org.uy/). המממנים (התוכנית לתואר שני בביוטכנולוגיה - Facultad de Ciencias -Universidad de la República; FOCEM - Fondo para la Convergencia Estructural del Mercosur; Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación, Uruguay) לא היה תפקיד בתכנון המחקר, איסוף וניתוח נתונים, החלטה לפרסם או הכנת כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter | Sartorius | 16534 | Minisart syringe filter 0.2 µL |
| 0.5 mL straw | Minitube | 13408/0044 | French type medium paillette |
| Aspirator tube assembly | Sigma | A5177 | |
| Bunsen burner | Indulab | 7000134 | |
| Dimethyl sulfoxide | Sigma | D2650 | |
| Ethylene glycol | Sigma | 102466 | |
| Ficoll PM70 | Sigma | F2878 | Density gradient medium |
| Gel-loader tip | Eppendorf | 10411193 | |
| Glass capillary | Marienfeld | 2900000 | Microhaematocrit capillary tube |
| Gloves for LN2 handling | Tempshield | CE0338 | Cryogloves |
| Goblets | Minitube | 16913/1133 | |
| Goggles for LN2 handling | 3M | 40661-00000-10 | Anti-fog, anti-scratch coating |
| Hot plate | Labec | LA-SH-II-5B | Digital model |
| Identification rod | IMV technologies | 6326 | Non steril LG48 mm |
| Insulated styrofoam container | |||
| LN2 storage dewar | Taylor-Wharton | XT21-AI | Cryoscience |
| Long stainless-steel twezeers | Fine Science Tools | 11000-25 | |
| M2 | Sigma | M7167 | |
| PBS | Home-made | Phosphate Buffered saline. Usually 1 L of concentrated 5x buffer is prepared and then diluted to 1x. Recipe: 40 g sodium chloride, 1 g potassium chloride, 7.2 g anhydrous disodium phosphate, 1.2 g monopotassium phosphate. Add distilled water and sterilize by autoclave. | |
| Plastic Petri dish | Falcon | 351029 | Not TC-treated Bacteriological Petri Dish |
| Stereomicroscope | Olympus | SZ2-LGB | |
| Sucrose | Sigma | S1888 | |
| Watchmaker’s #5 forceps | Fine Science Tools | 11254-20 |
References
- Crispo, M., Meikle, M. N., Rülicke, T. Cryopreservation of Valuable Mouse and Rat Lines. Rodent Quality Control: Genes and Bugs. Laboratory Animal Science and Medicine. , Springer. Cham. (2024).
- Lloyd, K., Franklin, C., Lutz, C., Magnuson, T. Reproducibility: use mouse biobanks or lose them. Nature. 522 (7555), 151-153 (2015).
- Hart-Johnson, S., Mankelow, K. Archiving genetically altered animals: a review of cryopreservation and recovery methods for genome-edited animals. Lab Anim. 56 (1), 26-34 (2022).
- Shaw, J. M., Jones, G. M. Terminology associated with vitrification and other cryopreservation procedures for oocytes and embryos. Hum Reprod Update. 9 (6), 583-605 (2003).
- Arav, A. Cryopreservation of oocytes and embryos. Theriogenology. 81 (1), 96-102 (2014).
- dos Santos Neto, P. C., et al. Cryotolerance of Day 2 or Day 6 in vitro produced ovine embryos after vitrification by Cryotop or Spatula methods. Cryobiology. 70 (1), 17-22 (2015).
- Renard, J. P., Babinet, C. High survival of mouse embryos after rapid freezing and thawing inside plastic straws with 1-2 propanediol as cryoprotectant. J Exp Zool. 230 (3), 443-448 (1984).
- Tsang, W. H., Chow, K. L. Mouse embryo cryopreservation utilizing a novel high-capacity vitrification spatula. Biotechniques. 46 (7), 550-552 (2009).
- Kuwayama, M. Highly efficient vitrification for cryopreservation of human oocytes and embryos: the Cryotop method. Theriogenology. 67 (1), 73-80 (2007).
- Nakao, K., Nakagata, N., Katsuki, M. Simple and efficient vitrification procedure for cryopreservation of mouse embryos. Exp Anim. 46 (3), 231-234 (1997).
- National Research Council. Guide for the Care and Use of Laboratory Animals. , National Academies Press. Washington, DC. (1996).
- du Sert, N. P., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biol. 18 (7), e3000410(2020).
- Meikle, M. N., Schlapp, G., Menchaca, A., Crispo, M. Minimum volume Spatula MVD vitrification method improves embryo survival compared to traditional slow freezing, both for in vivo and in vitro produced mice embryos. Cryobiology. 84, 77-81 (2018).
- Momozawa, K., et al. Efficient vitrification of mouse embryos using the Kitasato Vitrification System as a novel vitrification device. Reprod Biol Endocrinol. 15 (1), 29(2017).
- Stringfellow, D. A., Givens, M. D. Manual of the International Embryo Transfer Society: A Procedural Guide and General Information for the use of Embryo Transfer Technology Emphasizing Sanitary Procedures. , International Embryo Transfer Society. (2010).
- Dos Santos-Neto, P. C., Cuadro, F., Barrera, N., Crispo, M., Menchaca, A. Embryo survival and birth rate after minimum volume vitrification or slow freezing of in vivo and in vitro produced ovine embryos. Cryobiology. 78, 8-14 (2017).
- Schlapp, G., Meikle, M. N., Pórfido, J. L., Menchaca, A., Crispo, M. Zygote cryobanking applied to CRISPR/Cas9 microinjection in mice. PLoS One. 19 (7), e0306617(2024).
- Kamoshita, M., et al. Recent advances of oocyte/embryo vitrification in mammals from rodents and large animals. Anim Sci J. 95 (1), e13931(2024).
- Qiu, J., et al. Equilibrium vitrification of mouse embryos using low concentrations of cryoprotectants. Cryobiology. 98, 127-133 (2021).
- Tsang, W. H., Chow, K. L. Cryopreservation of mammalian embryos: Advancement of putting life on hold. Birth Defects Res C Embryo Today. 90 (3), 163-175 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved