Method Article
Spatule Montevideo Dispositif pour la vitrification d’embryons de mammifères
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, nous présentons le protocole Spatula Montevideo pour vitrifier les embryons préimplantatoires de souris et de moutons, composé d’une spatule faite maison et utilisant des solutions faites maison. Les embryons sont rapidement équilibrés dans deux solutions cryoprotectrices de concentration croissante, chargés sur la spatule, immergés dans de l’azote liquide et enfin scellés avec une paille de 0,5 ml.
Résumé
Cette étude décrit une méthode de vitrification efficace et rentable pour la cryoconservation d’embryons de souris et de moutons, connue sous le nom de Spatula Montevideo (MVD). Ce protocole utilise une spatule faite maison comme dispositif de transport, qui est préparé avec une pointe de chargement de gel. Les embryons sont rapidement équilibrés dans deux solutions cryoprotectrices faites maison de concentration croissante, chargées dans la spatule, puis directement immergées dans de l’azote liquide. Environ 30 à 40 embryons de souris au stade préimplantatoire peuvent être chargés sur la spatule, qui est ensuite scellée avec une paille de 0,5 ml. L’utilisation de spatules au lieu de cryotubes, qui sont fréquemment utilisés pour stocker des embryons vitrifiés, optimise l’espace dans les dewars d’azote liquide. De plus, le processus de réchauffement ne nécessite qu’une solution de saccharose maison de concentration décroissante pour réhydrater les embryons et restaurer leur morphologie. Depuis plus de 10 ans, notre laboratoire utilise avec succès la Spatule Montevideo pour les embryons préimplantatoires de souris et de moutons. La Spatula Montevideo a démontré un taux de récupération moyen (embryons récupérés/vitrifiés) de 84 % et un taux de survie (embryons viables/récupérés) de 97 % chez les embryons de souris. La vitrification des embryons murins a donné de meilleurs résultats que la congélation lente, bien qu’aucune différence n’ait été observée dans les résultats reproductifs (grossesse, accouchement et taux de natalité). Chez les embryons de mouton, des taux de survie et de développement embryonnaire similaires ont été obtenus avec Spatula Montevideo par rapport à un dispositif commercial. Bien que le taux de gestation ait été plus élevé pour le dispositif commercial, le taux de survie des agneaux n’était pas significativement différent entre les dispositifs. La méthode de vitrification Spatula Montevideo est une technique de cryoconservation simple qui peut être utilisée pour stocker des embryons surnuméraires, sauvegarder des lignées de souris génétiquement modifiées et des modèles de moutons, et faciliter leur échange entre les chercheurs du monde entier.
Introduction
L’efficacité de la génération d’animaux génétiquement modifiés (GM) a considérablement augmenté en raison du développement de méthodes basées sur l’endonucléase, en particulier CRISPR/Cas9. De nombreux laboratoires dans le monde produisent diverses lignées de souris et de rats génétiquement modifiés qui doivent être cryopréservées pour empêcher la dérive génétique et maintenir l’intégrité du phénotype1 d’origine. De plus, l’archivage élimine la nécessité d’un élevage constant, ce qui entraîne souvent un nombre excessif d’animaux. Certains laboratoires envoient des lignées de souris génétiquement modifiées sous forme d’embryons ou de spermatozoïdes cryoconservés à des dépôts internationaux, facilitant ainsi l’échange de ces modèles tout en évitant le transport d’animaux vivants. Cela garantit l’accessibilité aux lignes sans la génération répétitive de modèles d’animaux génétiquement modifiésidentiques 2. Pour ces raisons, la cryoconservation des embryons et des spermatozoïdes est primordiale dans toute animalerie génétiquement modifiée. En général, la cryoconservation d’embryons est préférée pour le stockage des lignées GM, car les embryons contiennent le génome diploïde complet avec des modifications et peuvent être facilement récupérés par transfert d’embryons.
La vitrification est un processus de non-équilibre caractérisé par un déséquilibre entre l’eau qui pénètre dans la cellule et l’eau qui forme des cristaux extracellulaires autour d’elle. Cette méthode empêche la formation de cristaux de glace intracellulaires, ce qui la distingue de la méthode de congélation lente (SLF)3 (voir Figure 1). La forte concentration de cryoprotecteurs et le contact direct avec l’azote liquide (LN2) permettent un refroidissement ultra-rapide (~40 °C/s), permettant d’obtenir un état vitreux des échantillons en quelques secondes. De plus, la vitrification est plus rapide, plus facile et moins coûteuse que la congélation lente4. Il nécessite un minimum de LN2 et utilise généralement un équipement simple qui peut être acheté dans le commerce ou fait maison5 (voir Figure 1).
De plus, le processus de réchauffement est généralement rapide et reproductible. Elle doit être réalisée rapidement pour éviter la toxicité cryoprotectrice et maintenir l’état vitré3. Lors de la congélation d’embryons, de nombreux laboratoires tiennent compte de la commodité du dispositif porteur, de sa fiabilité, de sa robustesse, de sa capacité de conservation et de ses coûts.
Nous privilégions la méthode de vitrification à la spatule à volume minimum pour la cryoconservation de routine d’embryons de moutons et de souris, à l’aide du dispositif Spatula Montevideo (MVD)6. Initialement, nous avons utilisé la méthode de congélation lente7 , mais nous sommes rapidement passés à la vitrification. Pour créer un dispositif plus simple et plus peu encombrant pour le dewar LN2 , nous avons modifié la spatule faite maison de Tsang et Chow (2009)8, qui est branchée sur un cryotube, pour développer la spatule MVD qui est scellée avec une paille de 0,5 mL (voir le tableau des matériaux). La spatule est dotée d’une pointe de chargement de gel (voir tableau des matériaux), où une plate-forme d’environ 1 mm² est formée en faisant fondre doucement la pointe avec une pince fine, créant ainsi une plaque en forme de pétale pour le chargement des embryons. Cette plate-forme peut accueillir jusqu’à 40 embryons de souris dans une petite goutte de vitrification. Une tige de bouchon d’identification (voir tableau des matériaux) est insérée dans l’extrémité ouverte de l’embout du chargeur de gel.
L’objectif de cette méthode est de vitrifier les embryons de manière simple, rapide et peu coûteuse qui, en outre, permet de gagner de la place dans le dewar de l’azote. Ce système est utilisé avec succès depuis de nombreuses années, offrant d’excellents taux de survie embryonnaire (~97 %) et de résultats reproductifs, en particulier chez les embryons de souris. Étant donné que la spatule MVD est préparée en laboratoire, il s’agit d’une méthode peu coûteuse par rapport aux dispositifs commerciaux9. De plus, il permet de gagner de la place dans le dewar d’azote par rapport à l’utilisation de cryotubes 8,10.
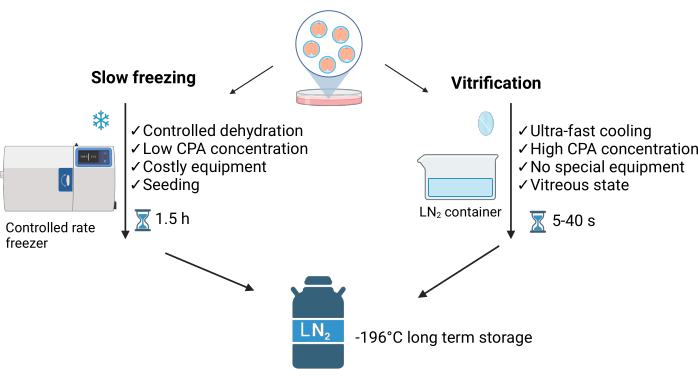
Figure 1 : Comparaison des deux principales techniques utilisées pour la cryoconservation d’embryons. Cette figure a été modifiée avec la permission de Crispo et al.1. Créé en BioRender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
Les animaux utilisés pour obtenir des embryons de souris ont été hébergés et manipulés conformément à la législation nationale 18.611 et aux directives internationales en matière de soins aux animaux11. Le protocole expérimental (permis n° #007-18) a été opportunément approuvé par la Commission de soin et d’utilisation des animaux de l’Institut Pasteur de Montevideo (accord écrit). Les protocoles expérimentaux pour les ovocytes/embryons de moutons ont été approuvés par le Comité Institutionnel de Protection des Animaux Fundación IRAUy (protocole #001-2017), conformément aux directives ARRIVE12 et ont été réalisés conformément aux directives internationales de protection des animaux11.
1. Vitrification (Figure 2)
- Préparation de la spatule MVD
- Raccourcissez l’embout du gel-loader (voir tableau des matériaux) en coupant les premiers 10 mm et le cône de l’embout.
REMARQUE : Cela crée une pointe plus courte et droite, facilitant le scellement final avec la paille de 0,5 mL (voir le tableau des matériaux). - Tenez l’extrémité de l’embout du chargeur de gel à l’aide de la pince d’horloger #5 (voir Tableau des matériaux) à environ 1,0 cm de l’embout. Placez doucement la pointe dans la flamme d’un bec Bunsen (voir le tableau des matériaux) et maintenez-la enfoncée pendant 8 à 10 s pour former une plate-forme en forme de pétale d’environ 1 mm2.
- Retirer du feu et maintenir fermement avec la pince pendant 5 s.
- À l’aide d’un stéréomicroscope (voir Tableau des matières), vérifiez que la plate-forme en forme de pétale (~ 1 mm2) est formée et que le bord distal est scellé.
REMARQUE : La plate-forme doit être fermée à l’extrémité distale pour éviter l’infiltration de LN2 pendant la vitrification. Assurez-vous que la plate-forme est propre et exempte de fils de plastique. S’il est trop petit ou s’il a des fils, coupez la pointe et répétez la procédure. - Répétez les étapes 1.1.1 à 1.1.4 pour préparer le nombre nécessaire de spatules (1 spatule = jusqu’à 40 embryons de souris).
- Stérilisez les spatules à l’aide de rayons ultraviolets (UV) ou d’oxyde d’éthylène et rangez-les dans un tube ou une boîte stérile.
- Le jour de la vitrification, récupérez les spatules en les manipulant par l’extrémité opposée de la plate-forme. Insérez une tige d’identification (voir tableau des matériaux) dans chaque spatule et placez-les sur la base du stéréomicroscope. Étiquetez la tige avec un marqueur permanent ou une étiquette autocollante résistante à l’azote liquide.
REMARQUE : Évitez toujours de toucher la plate-forme lorsque vous manipulez les spatules. La longueur totale de l’appareil complet (spatule + paille de 0,5 mL + tige d’identification) ne doit pas dépasser plus de 1 cm de la longueur du gobelet.
- Raccourcissez l’embout du gel-loader (voir tableau des matériaux) en coupant les premiers 10 mm et le cône de l’embout.
- Préparation des solutions de vitrification
- Préparez la solution FS : Dissoudre 1,5 g de milieu à gradient de densité (voir le tableau des matériaux) et 0,85 g de saccharose (voir le tableau des matériaux) dans 5 mL de solution saline tamponnée au phosphate (PBS ; voir le tableau des matériaux). Chauffer au bain-marie jusqu’à dissolution complète, puis stériliser à l’aide d’un filtre de 0,22 μm (voir tableau des matériaux).
REMARQUE : Cette solution peut être conservée à 4 °C jusqu’à 6 mois. - Préparez la solution de pré-vitrification (PV) : Le jour de la vitrification, mélangez 10 % d’éthylène glycol (voir le tableau des matériaux), 10 % de diméthylsulfoxyde (voir le tableau des matériaux) et 80 % de milieu M2 (voir le tableau des matériaux). Un volume total de 100 μL est nécessaire pour 5 spatules.
- Préparez la solution de vitrification (V) : Le jour de la vitrification, mélangez 15 % d’éthylène glycol, 15 % de diméthylsulfoxyde, 10 % de milieu M2 et 60 % de solution FS. Un volume total de 100 μL est nécessaire pour 5 spatules.
- Préparez la solution FS : Dissoudre 1,5 g de milieu à gradient de densité (voir le tableau des matériaux) et 0,85 g de saccharose (voir le tableau des matériaux) dans 5 mL de solution saline tamponnée au phosphate (PBS ; voir le tableau des matériaux). Chauffer au bain-marie jusqu’à dissolution complète, puis stériliser à l’aide d’un filtre de 0,22 μm (voir tableau des matériaux).
- Processus de déshydratation et de vitrification de l’embryon
- Préparez le LN2 : Versez le LN2 dans un récipient approprié (par exemple, un récipient isolé en polystyrène de 10 cm x 30 cm x 20 cm) et placez autant de pailles de 0,5 ml que de spatules à utiliser.
REMARQUE : Pour faciliter la visualisation de la plate-forme de la spatule lors de la manipulation sous LN2, il est suggéré d’utiliser un récipient en polystyrène coloré isolé par le fond pour créer un effet de contraste.
ATTENTION : Portez des lunettes et des gants appropriés (voir le tableau des matériaux) lors de la manipulation du LN2. - Préparez les solutions : Sur une boîte de Pétri en plastique de 100 mm (voir le tableau des matériaux), placez les gouttes suivantes : 100 μL de M2, 20 μL de solution PV et 20 μL de solution V pour chaque spatule.
- Vitrifier les embryons : Placer les embryons à vitrifier dans la goutte M2. Manipulez 30 à 40 embryons à la fois, en les incubant dans la goutte de solution PV pendant 30 secondes, puis dans la solution en V pendant 30 secondes supplémentaires à température ambiante (RT).
- Utilisez un capillaire en verre tiré (voir le tableau des matériaux) avec un ensemble de tube d’aspirateur (voir le tableau des matériaux). Préchargez le capillaire avec au moins 1 μL de la solution correspondante avant de placer les embryons.
REMARQUE : Les embryons seront à différentes hauteurs dans les gouttes, alors ajustez le micromètre du stéréomicroscope pour les localiser. Récupérez les embryons de chaque goutte lorsqu’il reste 10 s. Toutes les manipulations d’embryons doivent être effectuées au stéréomicroscope. - Chargez les embryons : Aspirez les embryons à l’aide d’une solution minimale en V (par exemple, ~ 0,1 μL) et placez-les rapidement sur la plate-forme de la spatule.
- Immersion dans LN2 : Après le chargement des embryons, immergez immédiatement la plate-forme de la spatule dans LN2 pendant 5 s (en tenant la spatule à la main, par sa tige). Ensuite, tout en maintenant la spatule dans des vapeurs LN2 , scellez-la avec une paille de 0,5 mL à l’aide d’une longue pince à épiler en inox (voir tableau des matériaux).
REMARQUE : Retirez LN2 de la paille avant de sceller pour éviter la dilatation pendant le réchauffement. Assurez-vous que la spatule et la paille sont correctement alignées pour éviter tout contact entre la goutte d’embryon et la paroi de la paille. Pour plus de commodité, les spatules scellées peuvent rester dans le récipient LN2 jusqu’à ce que toutes les spatules soient chargées d’embryons, en les remplissant de LN2 si nécessaire. - Répéter la procédure : Répéter les étapes 1.3.3 à 1.3.7 pour chaque groupe d’embryons, en utilisant une nouvelle paire de gouttes PV et V.
- Stockage : Transférez les spatules dans des gobelets (voir Tableau des matériaux) puis dans un dewar de stockage LN2 (voir Tableau des matériaux).
- Préparez le LN2 : Versez le LN2 dans un récipient approprié (par exemple, un récipient isolé en polystyrène de 10 cm x 30 cm x 20 cm) et placez autant de pailles de 0,5 ml que de spatules à utiliser.

Figure 2 : Schéma du processus de vitrification à l’aide de Spatula MVD. Voir le texte pour plus de détails. Créé dans BioRender. Meikle, M. (2025) https://BioRender.com/x96y902. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Réchauffement (figure 3)
- Préparation de la solution
- Préparez une solution de saccharose à 1 M en dissolvant 0,85 g de saccharose dans 2,5 ml de milieu M2. Stérilisez la solution avec un filtre de 0,22 μm.
REMARQUE : Cette solution peut être préparée et conservée à 4 °C jusqu’à 1 semaine. - Préparez des solutions de saccharose 0,5 M et 0,25 M en diluant la solution de saccharose 1 M avec le volume approprié de milieu M2.
- Maintenir les solutions de saccharose à 37 °C sur une plaque chauffante (voir Tableaux des matières) jusqu’à ce que le réchauffement commence.
- Préparez une solution de saccharose à 1 M en dissolvant 0,85 g de saccharose dans 2,5 ml de milieu M2. Stérilisez la solution avec un filtre de 0,22 μm.
- Préparation de la plaque chauffante
- Sur une boîte de Pétri en plastique de 100 mm, placez les gouttes de solution suivantes : une goutte de 500 μL de saccharose 0,5 M, une goutte de 50 μL de saccharose 0,5 M et une goutte de 50 μL de saccharose 0,25 M pour chaque spatule à réchauffer. Placez trois gouttes de milieu M2 (100 μL chacune) pour le lavage.
- Processus de réchauffement
REMARQUE : Le processus de réchauffement a lieu à RT, par exemple 20-22 °C sur la base d’un stéréomicroscope.- Récupérez les spatules scellées du dewar. Placez-les dans un récipient approprié avec LN2. Voir la figure 3.
- Placez la plaque chauffante sur le stéréomicroscope. Un à la fois, tenez la base de la spatule à l’aide d’une pince à épiler en acier inoxydable et, d’une main gantée, retirez la tige d’identification, puis la paille. Trempez rapidement la plate-forme contenant les embryons dans la goutte de saccharose de 0,5 M de 500 μL.
- Assurez-vous que tous les embryons sont tombés dans la goutte ; Si nécessaire, déplacez doucement la spatule pour faciliter leur libération. Chargez les embryons dans un capillaire en verre tiré, placez-les dans la goutte de 50 μL de solution de saccharose 0,5 M et incubez pendant 2 min.
- Placez les embryons dans la goutte de 50 μL de solution de saccharose 0,25 M et incubez pendant encore 2 min.
REMARQUE : Avant de placer les embryons dans chaque solution, préchargez le capillaire avec la solution à utiliser. - Enfin, lavez les embryons trois fois dans différentes gouttes de milieu M2 pour éliminer le saccharose.
- Incuber les embryons dans des conditions appropriées à chaque espèce pendant au moins 1 h avant utilisation.
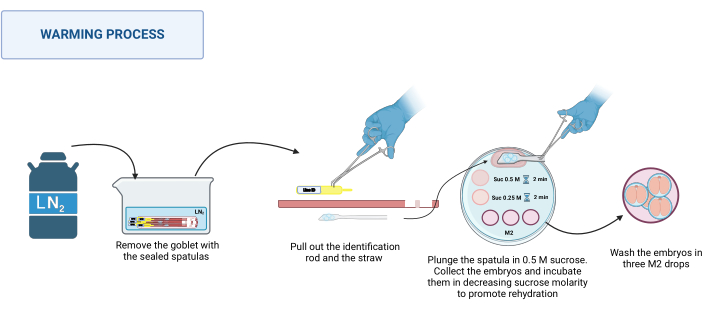
Figure 3 : Schéma du processus de réchauffement de la spatule MVD. Voir le texte pour plus de détails. Créé dans BioRender. Meikle, M. (2025) https://BioRender.com/k91k191. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Nous avons d’abord utilisé la méthode traditionnelle de congélation lente à base de solutions de propylène glycol, de pailles et d’équipements de congélation à vitesse contrôlée7. Cependant, après avoir considéré la méthode de vitrification comme une option potentiellement plus facile et plus rentable, nous avons mené une étude pour comparer les résultats de la congélation lente traditionnelle (SLF) par rapport à la Spatula MVD dans des embryons de souris 8 cellules dérivés in vivo et 2 cellules produits in vitro 13 (Tableau 1 et Tableau 2). Les résultats sont présentés en termes de « taux de récupération », qui définit le nombre d’embryons récupérés du dispositif après réchauffement par rapport au nombre total d’embryons cryoconservés. Le « taux de survie » fait référence au nombre d’embryons viables par rapport aux embryons récupérés dans le dispositif. Les embryons étaient considérés comme viables si les blastomères étaient intacts (deux blastomères chez les embryons à 2 cellules et au moins quatre blastomères chez les embryons à 8 cellules)14. Ces termes sont utilisés pour évaluer si le dispositif et l’ensemble du processus sont adaptés à la cryoconservation.
Un taux de survie (tableau 1 et tableau 2) et un taux de développement significativement plus élevés à 3,5 jours après le coït (dpc ; p. ex., embryons de morules et de blastocystes, tableau 1) ont été obtenus pour Spatula MVD que pour le groupe SLF chez les embryons de souris. Bien que les deux méthodes aient atteint un taux d’éclosion acceptable, il était significativement inférieur à celui du groupe témoin frais, comme prévu (embryons non vitrifiés ; Tableau 1). Des embryons à 2 cellules frais vitrifiés/réchauffés et témoins ont été transférés aux femelles receveuses, ne révélant aucune différence à la fois dans le taux de gestation (femelles gestantes/femelles transférées au total) et le taux de natalité (petits nés/embryons transférés dans le total des femelles receveuses ; Tableau 2). Ces résultats nous amènent à passer de la méthode SLF à la vitrification.
| Nº d’embryons | Taux de survie à 2,5 dpc (embryons viables/récupérés du dispositif) | Taux de développement embryonnaire à 3,5 dpc (morulae-blastocystes/embryons viables) | Taux d’éclosion à 5,5 dpc (blastocystes éclos/embryons en culture) | |
| Congélation lente | 410 | 89,3 % (366/410)a | 91,8 % (336/366)a | 49,7 % (90/181)a |
| Spatule MVD | 341 | 92,7 % (316/341)b | 97,2 % (307/316)b | 41,0 % (68/166)a |
| Embryons frais | 458 | - | 98,7 % (452/458)b | 67,8 % (139/205)b |
Tableau 1 : Taux de survie et de développement in vitro d’embryons murins à 8 cellules soumis à la vitrification ou à la congélation lente. In vivo, des embryons murins à 8 cellules ont été cryoconservés par Spatule MVD ou congélation lente et comparés à des embryons frais. Des embryons frais ont été prélevés sur des femelles à 2,5 dpc et cultivés dans les mêmes conditions que les autres groupes. Le taux de survie (embryons viables/récupérés du dispositif) a été déterminé après réchauffement/décongélation. Les embryons viables ont été cultivés in vitro. Le taux de développement embryonnaire (morulae-blastocystes/embryons viables) et le taux d’éclosion (embryons éclos/cultivés) ont été déterminés à 3,5 dpc et 5,5 dpc, respectivement. Des exposants différents indiquent des différences significatives (P < 0,05).
| Nº d’embryons | Taux de récupération (récupéré à partir du dispositif/embryons cryoconservés) | Taux de survie (embryons viables/récupérés du dispositif) | Taux de gestation (femelles gestantes/transférées) | Taux de natalité chez l’ensemble des femelles transférées (petits nés/embryons transférés) | |
| Congélation lente | 531 | 88,3 % (469/531)a | 85,1 % (399/469)a | - | - |
| Spatule MVD | 431 | 84,2 % (363/431)a | 94,7 % (344/363)b | 53,3 % (8/15)a | 17,8 % (47/264)a |
| Embryons frais | 446 | - | 97,7 % (436/446)b | 53,3 % (8/15)a | 20,6 % (53/257)a |
Tableau 2 : Taux de récupération et de survie d’embryons murins à 2 cellules soumis à la vitrification ou à la congélation lente. Résultats reproductifs des embryons vitrifiés/réchauffés par rapport aux embryons frais.Des embryons à 2 cellules produits in vitro ont été cryoconservés par Spatula MVD ou SLF. Le taux de récupération (récupérés dans le dispositif/embryons cryoconservés) et le taux de survie (embryons viables/récupérés dans le dispositif) ont été déterminés après réchauffement ou décongélation. Des embryons viables réchauffés et frais ont été transférés aux femelles receveuses (15 femelles par groupe, ~17 embryons par femelle). Les taux de gestation (femelles gestantes/transférées) et de naissance (petits/embryons transférés) ont été déterminés. Des exposants différents indiquent des différences significatives (P < 0,05).
Spatula MVD a également été testé pour la vitrification d’embryons préimplantatoires de moutons produits in vitro et comparé à un dispositif commercial6. Les résultats sont présentés au tableau 3. La qualité des embryons a été évaluée en fonction de la morphologie selon les critères recommandés par l’International Embryo Technology Society (IETS)15, et ces excellents et bons embryons de grade 1 ont été attribués à chaque groupe expérimental.
Ni le taux de survie (~70 % et ~16 %, 3 h ou 24 h après l’échauffement, respectivement) ni l’éclosion de l’embryon au jour 8 n’ont été influencés par la méthode de vitrification. Le pourcentage de blastocystes au jour 8 était plus faible pour les deux techniques de vitrification par rapport au groupe témoin (embryons frais) (~ 8 % contre 20,5 %, respectivement ; P < 0,05). Ces résultats suggèrent que les embryons de mouton produits in vitro peuvent également être vitrifiés à l’aide de la Spatula MVD. De plus, les résultats précédents ont été complétés par le transfert d’embryons de mouton soumis à une congélation lente, à une spatule MVD ou à un dispositif commercial à des femelles receveuses16. Les résultats sont présentés dans le tableau 4. Le taux de survie embryonnaire (embryons viables au jour 30/embryons transférés), le taux de gestation (brebis gestantes/transférées), la perte fœtale de la gestation à la naissance (agneaux nés évalués à la naissance/embryons viables au jour 30) et le taux de survie des agneaux (agneaux vivants 1 semaine après la naissance/agneaux nés) ont été évalués entre les groupes expérimentaux.
Les résultats ont montré que le taux de survie embryonnaire après transfert d’embryon était similaire pour le SLF (26,5 %) et la Spatula MVD (22,2 %), mais plus élevé pour le groupe des dispositifs commerciaux (52,0 %, P < 0,05). Les résultats de la reproduction (durée de la gestation, perte fœtale, poids à la naissance et taux de survie des agneaux) n’ont pas été significativement affectés par la méthode de cryoconservation. Dans l’ensemble, Spatula MVD est également une méthode appropriée pour la vitrification d’embryons préimplantatoires ovins.
| N° d’embryons | Taux de survie % (embryons viables/cryoconservés) | Taux de développement % (morulae-blastocystes au jour 6/embryons clivés) | Taux d’éclosion % (blastocystes éclos/embryons clivés) | ||
| 3 h | 24 h | ||||
| Spatule MVD | 165 | 69,6 ± 2,4A | 14,6 ± 3,5A | 11.1 ± 2.1B | 6,4 ± 1,9b |
| Appareil commercial | 165 | 71,3 ± 1,3A | 17,7 ± 4,5A | 12,7 ± 3,2B | 10,2 ± 2,9milliards |
| Groupe témoin (embryons frais) | 408 | - | - | 41,3 ± 3,7A | 20,5 ± 4,5A |
Tableau 3 : Taux de survie et de développement in vitro d’embryons ovins soumis à une vitrification par Spatula MVD ou un dispositif commercial.Des embryons au stade cellulaire de 2 à 8 cellules produits in vitro (jour 2 après la fécondation) ont été vitrifiés à l’aide d’une spatule MVD ou d’un dispositif commercial, puis réchauffés. Le taux de survie (viable/cryoconservé) a été analysé 3 h et 24 h après le réchauffement. Les taux de développement et d’éclosion ont été définis comme le nombre de morules et de blastocystes obtenus au jour 6 et le nombre d’embryons éclos, respectivement, par rapport au nombre d’embryons clivés (2 à 8 cellules). Des exposants différents dans la même colonne indiquent des différences significatives (P < 0,05). Les données sont affichées sous forme de moyenne ± SEM.
| Survie embryonnaire (embryons viables au 30e jour/embryons transférés) | Taux de gestation (brebis gestantes/transférées) | Perte fœtale (agneaux nés accédé à la naissance/embryons viables au jour 30) | Durée de gestation (d) | Poids à la naissance (g) | Taux de survie des agneaux (agneaux vivants une semaine après la naissance/agneaux nés) | |
| Spatule MVD | 22,2 %a (28/126) | 32,9 %a (25/76) | 4,0 %a (1/25) | 150,7 ± 1,8A | 4102 ± 112.4A | 87,5 %a (21/24) |
| Appareil commercial | 52,0 %b (91/175) | 66,0 %b (62/94) | 11,0 %a (8/73) | 150,4 ± 1,9A | 3980 ± 221,2A | 83,1 %a (54/65) |
| Congélation lente | 26,5 %a (36/136) | 38,3 %a (28/73) | 6,7 %a (2/30) | 150,4 ± 2,1A | 4319 ± 107.3A | 89.3 %a (25/28) |
Tableau 4 : Effet de la méthode de cryoconservation sur la survie des embryons après le transfert, le maintien de la gestation et la production d’agneaux. Des morulae à des blastocystes élargis d’embryons produits in vivo ou in vitro ont été soumis à une vitrification/congélation lente et à un réchauffement/décongélation et ont été transférés à des brebis synchronisées avec des mérinos multipares. Le taux de survie embryonnaire (embryons viables au jour 30/embryons transférés), le taux de gestation (brebis gestantes/transférées), la perte fœtale de la gestation à la naissance (agneaux nés accédants à la naissance/embryons viables au jour 30), la durée de gestation (d), le poids à la naissance (g) et le taux de survie des agneaux (agneaux vivants une semaine après la naissance/agneaux nés) ont été comparés entre les groupes expérimentaux.
De plus, des lignées de souris génétiquement modifiées qui n’étaient plus utilisées dans notre établissement ont été sauvegardées sous forme d’embryons à deux cellules à l’aide de la méthode Spatula MVD. Un minimum de 300 embryons bicellulaires, produits principalement par fécondation in vitro (ou accouplement naturel), ont été vitrifiés pour chaque lignée de souris. Le contrôle de la qualité du processus a été effectué en chauffant deux ou trois spatules de chaque ligne et en transférant les embryons à des receveuses pseudo-enceintes. Les résultats représentatifs de différentes lignées de souris génétiquement modifiées sont présentés dans le tableau 5. En moyenne, le taux de guérison était de 90,4 % et le taux de survie était de 96,8 %. Le taux de grossesse était de 80 % et le taux de natalité de 31,5 % en moyenne. Il convient de noter que le taux de natalité a montré un large éventail de résultats allant de 12 % à 45 %, ce qui pourrait être dû aux différentes modifications génétiques qui peuvent affecter la sensibilité de l’embryon et les résultats du transfert d’embryons. En général, ces résultats étaient cohérents avec ceux obtenus précédemment dans l’établissement.
| Ligne de souris | Nombre d’embryons vitrifiés/réchauffés | Taux de récupération (récupéré sur le dispositif / embryons cryoconservés) | Taux de survie (embryons viables/récupérés du dispositif) | Taux de gestation (femelles gestantes/transférées) | Taux de natalité (petits, naissances/transferts d’embryons) |
| 1 | 60 | 83.3 % (50/60) | 96.0 % (48/50) | 50 % (1/2) | 19.4 % (7/36) |
| 2 | 35 | 100 % (35/35) | 100 % (35/35) | 100 % (1/1) | 39.1 % (9/23) |
| 3 | 43 | 76.7 % (33/43) | 84.8 % (28/33) | 100 % (1/1) | 38.8 % (7/18) |
| 4 | 41 | 92.6 % (38/41) | 97.3 % (37/38) | 100 % (2/2) | 31.4 % (11/35) |
| 5 | 66 | 98.4 % (65/66) | 100 % (65/65) | 100 % (3/3) | 36.6 % (22/60) |
| 6 | 70 | 94.2 %(66/70) | 95.4 % (63/66) | 33 % (1/3) | 12 % (6/50) |
| 7 | 74 | 87.8 % (65/74) | 100 % (65/65) | 100 % (3/3) | 45 % (27/60) |
| Moyenne | 90.4 % (352/389) | 96.8 % (341/352) | 80 % (12/15) | 31.5 % (89/282) |
Tableau 5 : Résultats représentatifs du processus de vitrification du contrôle de la qualité réalisé sur des embryons à 2 cellules de différentes lignées de souris génétiquement modifiées. Des lignées de souris GM ont été sauvegardées sous forme d’embryons à deux cellules (minimum 300 embryons) en utilisant la méthode Spatula MVD. Le contrôle de la qualité du processus a été effectué en chauffant deux ou trois spatules de chaque ligne et en transférant les embryons à des receveuses pseudo-enceintes. La récupération (récupérés dans le dispositif/embryons cryoconservés) et le taux de survie (embryons viables/récupérés dans le dispositif) ont été déterminés après réchauffement. Des embryons réchauffés viables ont été transférés au stade de 2 cellules à des femelles receveuses (1 à 3 femelles par lignée, ~18 embryons par femelle). Les taux de gestation (femelles gestantes/transférées) et de naissance (petits/embryons transférés) ont été déterminés.
Enfin, nous avons récemment réalisé un travail comparatif dans lequel des zygotes de souris frais et vitrifiés-réchauffés ont été micro-injectés avec des réactifs CRISPR puis cultivés in vitro ou transférés à des femelles pseudo-enceintes17. L’objectif était d’évaluer si les zygotes vitrifiés -à l’aide de Spatula MVD- pouvaient être une source appropriée d’embryons pour la micro-injection dans les zygotes B6D2F1/J et C57BL/6J. Les taux de récupération et de survie étaient similaires aux résultats précédents obtenus pour les embryons au stade de 2 à 8 cellules (tableau 6). Dans l’ensemble, les zygotes vitrifiés ont survécu à la microinjection, se sont développés en blastocystes éclos ou ont produit des petits vivants, et ont présenté des mutations induites par le système CRISPR/Cas9. Cependant, le taux de mutation était significativement plus faible chez les zygotes vitrifiés que chez les zygotes frais. La cryobanque de zygote semble être une source alternative d’embryons pour effectuer des séances de micro-injection à la demande, évitant l’élevage et l’entretien des animaux tout au long de l’année et améliorant la mise en œuvre des 3R dans la technologie CRISPR.
| Souche zygote | Nº de zygotes cryoconservés | Taux de récupération (récupéré dans le dispositif / embryons cryoconservés) | Taux de survie (embryons viables/récupérés du dispositif) |
| B6D2F1/J | 380 | 97.1 % (369/380) | 90.8 % (335/369) |
| C57BL/6J | 800 | 84.0 % (672/800) | 92.3 % (620/672) |
Tableau 6 : Taux de récupération et de survie des zygotes B6D2F1/J et C57BL/6J vitrifiés. Des zygotes produits in vivo ont été prélevés sur des femelles donneuses B6D2F1/J et C57BL/6J, vitrifiés par Spatula MVD et réchauffés. Les taux de récupération (extraits du dispositif/embryons cryoconservés) et de survie (embryons viables/récupérés du dispositif) ont été déterminés après réchauffement.
Discussion
La spatule MVD est un appareil de vitrification facile à assembler, peu coûteux et de volume minimal, doté d’une grande capacité de rétention d’embryons et d’une occupation optimale de l’azote liquide. Cette méthode s’est avérée simple, rapide et robuste. En moyenne, nous avons obtenu non seulement des taux élevés de récupération embryonnaire et de survie des embryons vitrifiés (~90 %), mais également de bons résultats reproductifs lors du transfert d’embryons chez la souris (~80 % de taux de grossesse et ~30 % de taux de natalité), qui sont comparables à d’autres méthodes de vitrification à volume minimum 18,19,20.
Les étapes critiques de la méthode de vitrification Spatula MVD comprennent : (i) La préparation de la spatule. Cette technique nécessite un savoir-faire considérable. La plate-forme produite dans la pointe du chargeur de gel par chauffage avec des pinces doit être de ~ 1 mm2 et doit être fermée à l’extrémité. Si la pointe reste ouverte, des bulles peuvent se former lors de la plongée de la spatule dans la goutte de saccharose pendant le processus de réchauffement en raison des différences de température. Les bulles interfèrent avec la recherche et la récupération des embryons. (ii) Incubation d’embryons dans des solutions de vitrification. En raison de la haute densité, les embryons restent à des hauteurs différentes dans les gouttes. Une aspiration rapide de tous les embryons est nécessaire. Une toxicité est attendue si les embryons restent dans ces solutions pendant de longues périodes à température ambiante. (iii) Goutte de vitrification à la spatule. Le volume de la goutte de vitrification -contenant les embryons- dans la plate-forme doit être de ~0,5-1,0 μL ; Des volumes plus importants de cryoprotecteurs affectent la viabilité de l’embryon. Nous recommandons d’utiliser des capillaires tirés d’un diamètre intérieur un peu plus large que la taille d’un embryon, qui porteraient le volume nécessaire. De plus, des chutes plus importantes dans la plate-forme peuvent augmenter la possibilité de se coincer dans la paille de 0,5 mL à l’intérieur du mur lors de la fermeture du système. (iv) Etanchéité de la spatule. Des précautions particulières doivent être prises lors de la fermeture de la spatule avec la paille de 0,5 ml ; Les deux éléments doivent être alignés. Les gouttes d’embryon dans la spatule ne doivent pas être dérangées. (v) Pendant le réchauffement, suivre l’ordre de retrait de l’identificateur de la tige et de la paille de 0,5 mL. Dans le cas contraire, l’identifiant peut être expulsé par la différence de température.
Cette technique nécessite une formation de l’opérateur en différentes étapes. Le principal dépannage pourrait être la récupération des embryons de la spatule. Si moins de 70 à 80 % des embryons vitrifiés sont récupérés lors de la réchauffement de la spatule, cela peut être dû à (i) un chargement incomplet des embryons sur la plate-forme de la spatule ou (ii) des embryons conservés dans la paroi interne de la paille de 0,5 mL lorsque le système est fermé. Pour pallier le premier problème, le chargement de la goutte contenant les embryons doit être effectué au stéréomicroscope à l’aide d’un ensemble de tube d’aspiration et d’un capillaire tiré chargé du milieu cryoprotecteur contenant les embryons et de 2-3 petites bulles d’air le long du capillaire, ce qui permet un écoulement correct du liquide. Pour le deuxième problème, si aucun embryon n’est visible dans la plate-forme pendant le réchauffement, coupez le bouchon de coton pour ouvrir la paille de 0,5 ml et lavez-la deux fois avec 500 μL de saccharose 0,5 M dans M2 (voir section 2, étape 1), en expulsant la solution dans une boîte pour la récupération des embryons.
Les limites de la méthode sont principalement liées aux étapes critiques déjà mentionnées. Nous pensons que le point clé est la préparation de la spatule. Il faut de l’entraînement pour réaliser une bonne spatule, mais une fois apprise, elle peut être maîtrisée. Comme les médias sont faits maison, cette méthode ne peut pas être utilisée dans les cliniques de reproduction humaine.
Le principal avantage de la Spatula MVD est qu’il s’agit d’un appareil peu coûteux par rapport aux appareils commerciaux9. De plus, il permet un gain de place dans le dewar d’azote liquide par rapport à la vitrification du cryotube8. Nous avons testé sa fonctionnalité sur des embryons de souris et de moutons à différents stades. Elle est particulièrement plus simple, plus rapide, plus économique et plus efficace que la méthode de congélation lente.
Cette méthode peut être utilisée pour vitrifier des embryons de différentes espèces de mammifères non humains dans un large éventail de domaines de recherche.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Nous remercions Alejo Menchaca pour sa contribution au développement de la Spatula MVD. GS a reçu un financement du programme de troisième cycle en biotechnologie - Facultad de Ciencias - Universidad de la República (https://webmasterbiotecnol.wixsite.com/biotec1) (numéro de subvention : GS 2437 347). GS, MNM et MC ont reçu un financement de FOCEM - Fondo para la Convergencia Estructural del Mercosur (https://focem.mercosur.int/es/) (numéro de subvention : COF 03/11). GS et MC sont membres du Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación, Uruguay. (https://www.anii.org.uy/). Les bailleurs de fonds (Biotechnology Postgraduate Program - Facultad de Ciencias -Universidad de la República ; FOCEM − Fondo para la Convergencia Estructural del Mercosur ; Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación, Uruguay) n’a joué aucun rôle dans la conception de l’étude, la collecte et l’analyse des données, la décision de publication ou la préparation du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter | Sartorius | 16534 | Minisart syringe filter 0.2 µL |
| 0.5 mL straw | Minitube | 13408/0044 | French type medium paillette |
| Aspirator tube assembly | Sigma | A5177 | |
| Bunsen burner | Indulab | 7000134 | |
| Dimethyl sulfoxide | Sigma | D2650 | |
| Ethylene glycol | Sigma | 102466 | |
| Ficoll PM70 | Sigma | F2878 | Density gradient medium |
| Gel-loader tip | Eppendorf | 10411193 | |
| Glass capillary | Marienfeld | 2900000 | Microhaematocrit capillary tube |
| Gloves for LN2 handling | Tempshield | CE0338 | Cryogloves |
| Goblets | Minitube | 16913/1133 | |
| Goggles for LN2 handling | 3M | 40661-00000-10 | Anti-fog, anti-scratch coating |
| Hot plate | Labec | LA-SH-II-5B | Digital model |
| Identification rod | IMV technologies | 6326 | Non steril LG48 mm |
| Insulated styrofoam container | |||
| LN2 storage dewar | Taylor-Wharton | XT21-AI | Cryoscience |
| Long stainless-steel twezeers | Fine Science Tools | 11000-25 | |
| M2 | Sigma | M7167 | |
| PBS | Home-made | Phosphate Buffered saline. Usually 1 L of concentrated 5x buffer is prepared and then diluted to 1x. Recipe: 40 g sodium chloride, 1 g potassium chloride, 7.2 g anhydrous disodium phosphate, 1.2 g monopotassium phosphate. Add distilled water and sterilize by autoclave. | |
| Plastic Petri dish | Falcon | 351029 | Not TC-treated Bacteriological Petri Dish |
| Stereomicroscope | Olympus | SZ2-LGB | |
| Sucrose | Sigma | S1888 | |
| Watchmaker’s #5 forceps | Fine Science Tools | 11254-20 |
Références
- Crispo, M., Meikle, M. N., Rülicke, T. Cryopreservation of Valuable Mouse and Rat Lines. Rodent Quality Control: Genes and Bugs. Laboratory Animal Science and Medicine. , Springer. Cham. (2024).
- Lloyd, K., Franklin, C., Lutz, C., Magnuson, T. Reproducibility: use mouse biobanks or lose them. Nature. 522 (7555), 151-153 (2015).
- Hart-Johnson, S., Mankelow, K. Archiving genetically altered animals: a review of cryopreservation and recovery methods for genome-edited animals. Lab Anim. 56 (1), 26-34 (2022).
- Shaw, J. M., Jones, G. M. Terminology associated with vitrification and other cryopreservation procedures for oocytes and embryos. Hum Reprod Update. 9 (6), 583-605 (2003).
- Arav, A. Cryopreservation of oocytes and embryos. Theriogenology. 81 (1), 96-102 (2014).
- dos Santos Neto, P. C., et al. Cryotolerance of Day 2 or Day 6 in vitro produced ovine embryos after vitrification by Cryotop or Spatula methods. Cryobiology. 70 (1), 17-22 (2015).
- Renard, J. P., Babinet, C. High survival of mouse embryos after rapid freezing and thawing inside plastic straws with 1-2 propanediol as cryoprotectant. J Exp Zool. 230 (3), 443-448 (1984).
- Tsang, W. H., Chow, K. L. Mouse embryo cryopreservation utilizing a novel high-capacity vitrification spatula. Biotechniques. 46 (7), 550-552 (2009).
- Kuwayama, M. Highly efficient vitrification for cryopreservation of human oocytes and embryos: the Cryotop method. Theriogenology. 67 (1), 73-80 (2007).
- Nakao, K., Nakagata, N., Katsuki, M. Simple and efficient vitrification procedure for cryopreservation of mouse embryos. Exp Anim. 46 (3), 231-234 (1997).
- National Research Council. Guide for the Care and Use of Laboratory Animals. , National Academies Press. Washington, DC. (1996).
- du Sert, N. P., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biol. 18 (7), e3000410(2020).
- Meikle, M. N., Schlapp, G., Menchaca, A., Crispo, M. Minimum volume Spatula MVD vitrification method improves embryo survival compared to traditional slow freezing, both for in vivo and in vitro produced mice embryos. Cryobiology. 84, 77-81 (2018).
- Momozawa, K., et al. Efficient vitrification of mouse embryos using the Kitasato Vitrification System as a novel vitrification device. Reprod Biol Endocrinol. 15 (1), 29(2017).
- Stringfellow, D. A., Givens, M. D. Manual of the International Embryo Transfer Society: A Procedural Guide and General Information for the use of Embryo Transfer Technology Emphasizing Sanitary Procedures. , International Embryo Transfer Society. (2010).
- Dos Santos-Neto, P. C., Cuadro, F., Barrera, N., Crispo, M., Menchaca, A. Embryo survival and birth rate after minimum volume vitrification or slow freezing of in vivo and in vitro produced ovine embryos. Cryobiology. 78, 8-14 (2017).
- Schlapp, G., Meikle, M. N., Pórfido, J. L., Menchaca, A., Crispo, M. Zygote cryobanking applied to CRISPR/Cas9 microinjection in mice. PLoS One. 19 (7), e0306617(2024).
- Kamoshita, M., et al. Recent advances of oocyte/embryo vitrification in mammals from rodents and large animals. Anim Sci J. 95 (1), e13931(2024).
- Qiu, J., et al. Equilibrium vitrification of mouse embryos using low concentrations of cryoprotectants. Cryobiology. 98, 127-133 (2021).
- Tsang, W. H., Chow, K. L. Cryopreservation of mammalian embryos: Advancement of putting life on hold. Birth Defects Res C Embryo Today. 90 (3), 163-175 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon