Method Article
哺乳類胚のガラス化のためのスパチュラモンテビデオ
要約
ここでは、マウスとヒツジの着床前胚をガラス化するためのスパチュラモンテビデオプロトコルを紹介します。これは、自家製のヘラで構成され、自家製のソリューションを利用しています。胚を濃度を上げる2つの凍結保護溶液で迅速に平衡化し、スパチュラにロードし、液体窒素に浸漬し、最後に0.5mLストローで密封します。
要約
この研究では、スパチュラモンテビデオ(MVD)として知られるマウスとヒツジの胚凍結保存のための効率的で費用対効果の高いガラス固化法について説明しています。このプロトコルは、自家製のヘラをキャリアデバイスとして使用し、ゲルローダーチップで調製します。胚は、濃度が増加する2つの自家製凍結保護溶液で迅速に平衡化され、スパチュラにロードされ、次いで液体窒素に直接浸される。着床前段階のマウス胚約30〜40個をスパチュラにロードし、その後、0.5mLのストローで密封します。ガラス化した胚の保管によく使用されるクライオチューブの代わりにヘラを使用することで、液体窒素デュワーのスペースが最適化されます。さらに、温暖化プロセスでは、胚を再水和して形態を回復するために、濃度を低下させる自家製のショ糖溶液のみが必要です。当研究室では、10年以上にわたり、マウスやヒツジの着床前胚にスパチュラモンテビデオを使用し、成功を収めてきました。スパチュラモンテビデオは、マウス胚で平均84%の回復率(回収/ガラス化胚)と97%の生存率(生存/回収胚)を示しています。マウス胚のガラス化は、ゆっくりと凍結するよりも良い結果をもたらしましたが、生殖結果(妊娠、出産、出生率)に違いは観察されていません。ヒツジの胚では、市販のデバイスと比較して、スパチュラモンテビデオで同様の生存率と胚発生率が達成されています。妊娠率は商用デバイスの方が高かったが、子羊の生存率はデバイス間で有意差はなかった。スパチュラモンテビデオガラス固化法は、余剰胚の保存、遺伝子組み換えマウス系統やヒツジモデルのバックアップ、世界中の研究者間での交換の促進に使用できる簡単な凍結保存技術です。
概要
遺伝子組み換え(GM)動物の作製効率は、エンドヌクレアーゼベースの方法、特にCRISPR/Cas9の開発により大幅に向上しました。世界中の多くの研究室では、遺伝的浮動を防ぎ、元の表現型1の完全性を維持するために凍結保存すべきさまざまなGMマウスおよびラット系統を製造しています。さらに、アーカイブ化により、動物の数が過剰になることが多い継続的な繁殖の必要性がなくなります。一部の研究室では、GMマウス系統を凍結保存された胚または精子として国際的なリポジトリに送っており、生きた動物の輸送を避けながらこれらのモデルの交換を促進しています。これにより、同一のGM動物モデルを繰り返し生成することなく、ラインへのアクセスが保証されます2。これらの理由から、胚と精子の凍結保存は、どのGM動物施設でも最優先事項です。一般に、胚は修飾された完全な二倍体ゲノムを含み、胚移植によって容易に回復できるため、GM系統の保存には胚凍結保存が好ましい。
ガラス化は、細胞に入る水と細胞の周りに細胞外結晶を形成する水との間の不均衡を特徴とする非平衡プロセスです。この方法は、細胞内の氷の結晶の形成を防ぎ、緩慢凍結法(SLF)3 ( 図1を参照)とは区別されます。高濃度の凍結保護剤と液体窒素(LN2)との直接接触により、超急速冷却(~40°C/s)が可能になり、数秒でサンプルのガラス質状態を達成できます。さらに、ガラス化は、ゆっくりと凍結する4よりも速く、簡単で、安価です。必要なLN2 は最小限で、通常は商用購入または自家製のシンプルな 機器を使用します5 ( 図1を参照)。
さらに、温暖化プロセスは一般的に高速で再現可能です。凍結保護剤の毒性を回避し、硝子体状態を維持するために迅速に実施する必要があります3。胚を凍結する際、多くの研究室では、キャリアデバイスの利便性、信頼性、堅牢性、保持能力、およびコストを考慮します。
私たちは、ヘラモンテビデオ(MVD)デバイス6を使用した、羊とマウスの胚の日常的な凍結保存のための最小容量のスパチュラガラス化法を好みます。当初は緩急凍結法7 を採用していましたが、すぐにガラス固化に移行しました。LN2 デュワー用のよりシンプルでスペース効率の高いデバイスを作成するために、クライオチューブに差し込むTsang and Chow(2009)8の自家製スパチュラを改造して、0.5 mLのストローで密封するスパチュラMVDを開発しました( 材料の表を参照)。スパチュラはゲルローダーチップ( 材料の表を参照)を備えており、細い鉗子で先端を穏やかに溶かすことにより約1mm²のプラットフォームが形成され、胚をロードするための花びらのようなプレートが作成されます。このプラットフォームは、小さなガラス化液滴で最大40個のマウス胚を収容できます。識別プラグロッド( 材料の表を参照)は、ゲルローダーチップの開放端に挿入されます。
この方法の目的は、胚を簡単、迅速、安価な方法でガラス化することであり、さらに窒素デュワーのスペースを節約することです。このシステムは長年にわたって成功裏に使用されており、特にマウス胚において、優れた胚生存率(~97%)と生殖結果をもたらしています。スパチュラMVDは実験室で作製するため、市販の装置9に比べて低コストな方法である。さらに、それはクライオチューブ8,10の使用と比較して窒素デュワーのスペースを節約する。
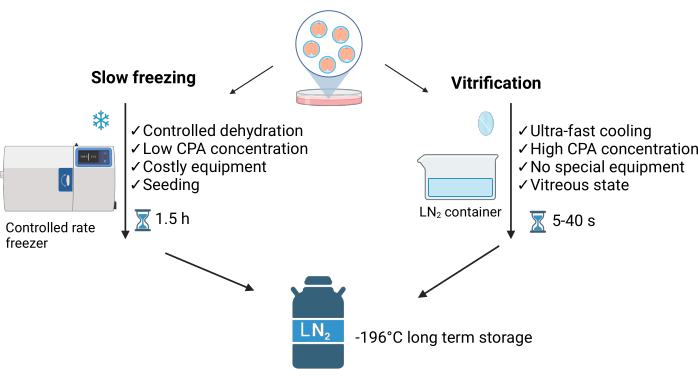
図1:胚の凍結保存に使用される主な2つの技術の比較。 この図は、Crispo et al.1 の許可を得て変更されています。BioRender.com 年に作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
マウス胚を得るために使用された動物は、国内法18.611および国際動物管理ガイドライン11に従って飼育および取り扱われました。実験プロトコル(許可番号#007-18)は、モンテビデオ・パスツール研究所の動物管理・使用委員会によって適宜承認されました(書面による同意が得られました)。ヒツジの卵子/胚の実験プロトコルは、ARRIVEガイドライン12 に準拠し、国際動物管理ガイドライン11に従って実施された、Institutional Animal Care Committee Fundación IRAUy(プロトコル#001-2017)によって承認されました。
1. ガラス固化(図2)
- スパチュラMVDの準備
- ゲルローダーチップ( 材料表を参照)を短くして、最初の10 mmとチップコーンを切り取ります。
注:これにより、先端が短くまっすぐになり、0.5mLストローによる最終的なシーリングが容易になります( 材料の表を参照)。 - ジェルローダーの先端を時計職人の#5鉗子(材料表を参照)で先端から約1.0cmのところに持ちます。先端をブンゼンバーナーの炎にそっと置き(材料の表を参照)、8〜10秒間保持して、約1mm2の花びらのようなプラットフォームを形成します。
- 火から下ろし、鉗子で5秒間しっかりと保持します。
- 実体顕微鏡( 材料の表を参照)を使用して、花びらのようなプラットフォーム(~1 mm2)が形成され、遠位端が密閉されていることを確認します。
注:ガラス化中のLN2 の浸潤を防ぐために、プラットフォームは遠位端で閉じる必要があります。プラットフォームが清潔で、プラスチックの糸がないことを確認してください。小さすぎる場合や糸がついている場合は、先端をトリミングして手順を繰り返します。 - 手順1.1.1〜1.1.4を繰り返して、必要な数のヘラを準備します(1つのヘラ=最大40個のマウス胚)。
- 紫外線(UV)またはエチレンオキシドを使用してスパチュラを滅菌し、滅菌チューブまたはボックスに保管します。
- ガラス化の日には、ヘラを取り出し、プラットフォームの反対側の端から扱います。識別ロッド( 材料の表を参照)を各ヘラに挿入し、実体顕微鏡ベースに置きます。ロッドに油性マーカーまたは液体窒素耐性ステッカーラベルを貼ります。
注意: へらを取り扱うときは、常にプラットフォームに触れないでください。完全なデバイス(ヘラ+ 0.5 mLストロー+識別ロッド)の全長は、ゴブレットの長さの1 cmを超えてはなりません。
- ゲルローダーチップ( 材料表を参照)を短くして、最初の10 mmとチップコーンを切り取ります。
- ガラス固化液の調製
- FS溶液を調製する:1.5 gの密度勾配培地( 材料の表を参照)と0.85 gのスクロース( 材料の表を参照)を5 mLのリン酸緩衝生理食塩水(PBS; 材料の表を参照)に溶解します。沸騰水浴で完全に溶解するまで加熱し、0.22 μmフィルターを使用して滅菌します( 材料の表を参照)。
注:この溶液は、4°Cで最大6ヶ月間保存できます。 - プレガラス化溶液(PV)を準備します:ガラス化の日に、10%エチレングリコール( 材料の表を参照)、10%のジメチルスルホキシド( 材料の表を参照)、および80%M2培地( 材料の表を参照)を混合します。5つのスパチュラに100μLの総容量が必要です。
- ガラス化溶液(V)を準備します:ガラス化の日に、15%エチレングリコール、15%ジメチルスルホキシド、10%M2培地、および60%FS溶液を組み合わせます。5回のスパチュラに合計100μLの容量が必要です。
- FS溶液を調製する:1.5 gの密度勾配培地( 材料の表を参照)と0.85 gのスクロース( 材料の表を参照)を5 mLのリン酸緩衝生理食塩水(PBS; 材料の表を参照)に溶解します。沸騰水浴で完全に溶解するまで加熱し、0.22 μmフィルターを使用して滅菌します( 材料の表を参照)。
- 胚の脱水とガラス化プロセス
- LN2の準備:LN2 を適切な容器(例:10 cm x 30 cm x 20 cmの断熱ポリスチレン容器)に注ぎ、使用するヘラと同じ数の0.5 mLストローを置きます。
注:LN2の下での操作中にスパチュラプラットフォームの視覚化を容易にするために、コントラスト効果を作成するために色付きの底部断熱ポリスチレン容器を使用することをお勧めします。
注意: LN2を取り扱うときは、適切なゴーグルと手袋(材料の表を参照)を着用してください。 - 溶液の準備:100 mmのプラスチック製ペトリ皿( 材料の表を参照)に、各スパチュラに100 μLのM2、20 μLのPV溶液、および20 μLのV溶液を滴下します。
- 胚のガラス化:ガラス化する胚をM2ドロップに入れます。一度に30〜40個の胚を取り扱い、PV溶液滴下で30秒間インキュベートし、次に室温(RT)でさらに30秒間V溶液滴下でインキュベートします。
- プルドガラスキャピラリー( 材料の表を参照)とアスピレーターチューブアセンブリ( 材料の表を参照)を使用します。胚を配置する前に、キャピラリーに少なくとも1 μLのそれぞれの溶液をプレロードします。
注:胚は液滴内で異なる高さにあるため、実体顕微鏡マイクロメーターを調整して胚を特定します。残り10秒で各ドロップから胚を回収します。すべての胚操作は実体顕微鏡下で行わなければなりません。 - 胚をロードする:最小限のV溶液(~0.1 μLなど)を使用して胚を吸引し、スパチュラプラットフォームにすばやく配置します。
- LN2への浸漬:胚をロードした後、すぐにスパチュラプラットフォームをLN2 に5秒間浸します(スパチュラをロッドで手で保持します)。次に、ヘラをLN2 蒸気に保持しながら、長いステンレス鋼ピンセットを使用して0.5mLのストローで密封します( 材料の表を参照)。
注意: 温暖化中の膨張を防ぐために、密封する前にストローからLN2 を取り外してください。胚滴と藁壁が接触しないように、へらとわらが適切に位置合わせされていることを確認してください。便宜上、密封されたスパチュラは、すべてのスパチュラに胚がロードされるまでLN2 コンテナに残し、必要に応じてLN2 を補充することができます。 - 手順を繰り返す:新しいPVドロップとVドロップのペアを使用して、胚の各グループに対してステップ1.3.3から1.3.7を繰り返します。
- 保管:スパチュラをゴブレットに移し( 材料の表を参照)、次にLN2 ストレージデュワー( 材料の表を参照)に移します。
- LN2の準備:LN2 を適切な容器(例:10 cm x 30 cm x 20 cmの断熱ポリスチレン容器)に注ぎ、使用するヘラと同じ数の0.5 mLストローを置きます。

図2:スパチュラMVDを使用したガラス固化プロセスのスキーム。 詳細については、テキストを参照してください。BioRenderで作成。メイクル、M.(2025)https://BioRender.com/x96y902。この図の拡大版を表示するには、ここをクリックしてください。
2. 温暖化(図3)
- 溶液調製
- 1 Mショ糖溶液を調製し、0.85 gのスクロースを2.5 mLのM2培地に溶解します。0.22μmフィルターで溶液を滅菌します。
注:この溶液は調製し、4°Cで最大1週間保存できます。 - 0.5 Mおよび0.25 Mのスクロース溶液を調製するには、1 Mのスクロース溶液を適切な容量のM2培地で希釈します。
- スクロース溶液をホットプレート( 材料表を参照)で温暖化が始まるまで37°Cに維持します。
- 1 Mショ糖溶液を調製し、0.85 gのスクロースを2.5 mLのM2培地に溶解します。0.22μmフィルターで溶液を滅菌します。
- ウォーミングプレートの準備
- 100 mmのプラスチック製ペトリ皿に、温める各スパチュラに500 μLの0.5 Mスクロース、50 μLの0.5 Mスクロース、50 μLの0.25 Mスクロースを1滴ずつ溶液ドロップします。M2培地(各100μL)を3滴入れて洗浄します。
- 温暖化プロセス
注:加温プロセスは、室温、例えば実体顕微鏡のベースで20〜22°Cで行われます。- デュワーから密封されたヘラを回収します。LN2 を使用して適切なコンテナに入れます。 図 3 を参照してください。
- ウォーミングプレートを実体顕微鏡に置きます。一度に1つずつ、ステンレス鋼のピンセットでヘラの基部を持ち、手袋をはめた手で識別ロッドを引き出し、次にストローを引き出します。胚を含むプラットフォームを500 μLの0.5 Mショ糖滴にすばやく浸します。
- すべての胚がドロップに落ちたことを確認します。必要に応じて、へらをそっと動かして放出を助けます。胚を引っ張ったガラスキャピラリーにロードし、0.5 Mショ糖溶液の50 μL滴下に入れ、2分間インキュベートします。
- 胚を50 μL滴の0.25 Mショ糖溶液に入れ、さらに2分間インキュベートします。
注:胚を各溶液に入れる前に、使用する溶液をキャピラリーに事前にロードします。 - 最後に、胚をM2培地の異なる滴で3回洗浄して、スクロースを取り除きます。
- 使用前に、各種に適した条件下で胚を少なくとも1時間インキュベートします。
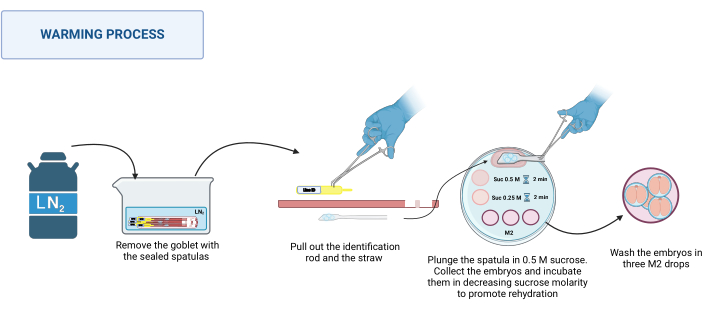
図3:スパチュラMVD温暖化プロセスのスキーム。詳細については、テキストを参照してください。 BioRenderで作成。メイクル、M.(2025)https://BioRender.com/k91k191。この図の拡大版を表示するには、ここをクリックしてください。
結果
当初は、プロピレングリコール溶液、ストロー、および速度制御凍結装置7に基づく従来の緩慢凍結法を使用しました。しかし、ガラス化法がより簡単で費用対効果の高い選択肢である可能性を検討した後、8細胞 in vivo 由来マウス胚と2細胞 in vitro 産生マウス胚13(表1および表2)において、従来の緩慢凍結(SLF)とスパチュラMVDの結果を比較する研究を実施しました。結果は、凍結保存された胚の総数に対する温暖化後にデバイスから回収された胚の数を定義する「回収率」の観点から提示されます。「生存率」とは、デバイスから回収された胚に対する生存可能な胚の数を指します。割球が無傷であれば、胚は生存可能と考えられていた(2細胞胚には2つの割球、8細胞胚には少なくとも4つの割球)14。これらの用語は、デバイスおよびプロセス全体が凍結保存に適しているかどうかを評価するために使用されます。
有意に高い生存率(表1 および 表2)および性交後3.5日での発達率(dpc;例えば、桑実胚および胚盤胞胚、 表1)は、マウス胚のSLF群よりもスパチュラMVDで達成された。どちらの方法も許容できる孵化率に達しましたが、予想通り、対照の新鮮群よりも大幅に低かった(非ガラス化胚; 表 1)。ビトリファイド/加温およびコントロールされた新鮮な2細胞胚をレシピエントの女性に移植したところ、妊娠率(妊娠/全移植された女性)と出生率(全レシピエント女性で生まれた/移植された胚)の両方に違いはないことが明らかになりました。 表2)。これらの結果から、SLF法からガラス固化法への転換に至りました。
| 胚の数 | 2.5 dpcでの生存率(生存可能/デバイスから回収された胚) | 3.5 dpcでの胚発生率(桑実胚盤胞/生存胚) | 5.5 dpcでの孵化率(孵化した胚盤胞/培養胚) | |
| ゆっくり凍結 | 410 | 89.3% (366/410)a | 91.8% (336/366)a | 49.7 % (90/181)a |
| へらMVD | 341 | 92.7 % (316/341)b | 97.2% (307/316)b | 41.0% (68/166)a |
| 新鮮な胚 | 458 | - | 98.7% (452/458)b | 67.8 % (139/205)b |
表1: ガラス化または徐凍結を受けた8細胞マウス胚の生存率とin vitroでの発育率。In vivo 8細胞マウス胚をスパチュラMVDまたは緩徐凍結により凍結保存し、新鮮胚と比較した。新鮮な胚を2.5dpcで雌から採取し、他のグループと同じ条件で培養しました。生存率(生存可能/デバイスから回収された胚)は、温め/融解後に決定されました。生存可能な胚をin vitro培養しました。胚発生率(桑実胚胚/生存胚)と孵化率(孵化/培養胚)は、それぞれ3.5 dpcと5.5 dpcで決定されました。異なる上付き文字は、有意差を示します (P < 0.05)。
| 胚の数 | 回収率(デバイス/凍結保存された胚から回収) | 生存率(生存可能/デバイスから回収された胚) | 妊娠率(妊娠中/転院した女性) | 移植された女性(生まれた/移植された胚)の総数の出生率 | |
| ゆっくり凍結 | 531 | 88.3% (469/531)a | 85.1% (399/469)a | - | - |
| へらMVD | 431 | 84.2% (363/431)a | 94.7% (344/363)b | 53.3 % (8/15)a | 17.8 % (47/264)a |
| 新鮮な胚 | 446 | - | 97.7% (436/446)b | 53.3 % (8/15)a | 20.6% (53/257)a |
表2:ガラス化または緩徐凍結を受けた2細胞マウス胚の回復率と生存率。ビトリファイド/温められた胚と新鮮な胚の生殖結果。in vitroで作製した2細胞胚をSpatula MVDまたはSLFで凍結保存した。回復率(デバイスから回収された胚/凍結保存された胚)と生存率(生存可能/デバイスから回収された胚)は、温暖化または融解後に決定されました。生存可能な温められた新鮮な胚をレシピエントの女性に移植しました(グループあたり15人の女性、女性あたり~17人の胚)。妊娠率(妊娠中/移植された女性)と出生率(生まれた/移植された胚)が決定されました。異なる上付き文字は、有意差を示します (P < 0.05)。
スパチュラMVDは、 in vitro で作製したヒツジの着床前胚のガラス化についても試験され、市販の装置と比較されました6。結果を 表3に示します。胚の品質は、国際胚技術学会(IETS)15が推奨する基準に従って形態学によって評価され、それらの優れたグレード1の胚が各実験グループに割り当てられました。
生存率(温めてからそれぞれ~70%と~16%、温めてから3時間後または24時間後)も、8日目の胚の孵化もガラス化法の影響を受けませんでした。8日目の胚盤胞の割合は、対照群(新鮮胚)と比較して、両方のガラス化技術で低かった(それぞれ~8%対20.5%);P < 0.05)。これらの結果は、 in vitro で作製したヒツジの胚もスパチュラMVDを用いてガラス化できることを示唆しています。さらに、以前の結果は、緩徐凍結、へらMVD、または市販の装置をレシピエントの雌に移植したヒツジの胚を移植することによって補完された16。結果を 表4に示します。胚生存率(30日目の生存胚/移植された胚)、妊娠率(妊娠/移植された雌羊)、妊娠から出生までの胎児喪失(出生時に評価された子羊/30日目に生存可能な胚)、および子羊の生存率(生後1週間の生きた子羊/生まれた子羊)を実験群間で評価しました。
その結果、胚移植後の胚生存率はSLF(26.5%)とスパチュラMVD(22.2%)で同程度であったが、商用デバイス群(52.0%、P < 0.05)の方が高かった。生殖結果(妊娠期間、胎児の減少、出生時体重、および子羊の生存率)は、凍結保存法によって有意に影響を受けませんでした。全体として、スパチュラMVDは、ヒツジの着床前胚のガラス化にも適した方法です。
| 胚の数 | 生存率%(生存可能/凍結保存された胚) | 発生率% (6日目の桑実胚盤胞/切断された胚) | 孵化率%(孵化した胚盤胞/切断された胚) | ||
| 3時間 | 24時間 | ||||
| へらMVD | 165 | 69.6 ± 2.4a | 14.6 ± 3.5A | 11.1 ± 2.1b | 6.4 ± 1.9b |
| 商用デバイス | 165 | 71.3 ± 1.3a | 17.7 ± 4.5A | 12.7 ± 3.2b | 10.2 ± 2.9b |
| 対照群(新鮮胚) | 408 | - | - | 41.3 ± 3.7a | 20.5 ± 4.5A |
表3:スパチュラMVDまたは市販のデバイスによるガラス化を受けたヒツジ胚の生存率とin vitro発育率。in vitroで作製した2-8細胞期の胚(受精後2日目)をSpatula MVDまたは市販のデバイスを使用してガラス化し、その後温めました。生存率(生存率/凍結保存率)は、温暖化後3時間および24時間で分析されました。発生率と孵化率は、6日目に得られた桑実胚と胚盤胞の数、および孵化した胚の数をそれぞれ、切断された(2〜8細胞)胚の数に対して定義しました。同じ列に異なる上付き文字がある場合は、有意な差があることを示します (P < 0.05)。データはSEM±平均として表示されます。
| 胚の生存(30日目の生存可能な胚/移植された胚) | 妊娠率(妊娠中/移管した雌羊) | 胎児の喪失(出生時にアクセスして生まれた子羊/30日目に生存可能な胚) | 妊娠期間(d) | 出生時体重(g) | 子羊の生存率(生後1週間の生きた子羊/生まれた子羊) | |
| へらMVD | 22.2 パーセント a (28/126) | 32.9 %a (25/76) | 4.0 パーセント a (1/25) | 150.7 ± 1.8A | 4102 ± 112.4a | 87.5 %a (21/24) |
| 商用 デバイス | 52.0 %b (91/175) | 66.0 %b (62/94) | 11.0 %a (8/73) | 150.4 ± 1.9a | 3980 ± 221.2a | 83.1 パーセント a (54/65) |
| ゆっくり凍結 | 26.5 %a (36/136) | 38.3 %a (28/73) | 6.7パーセントA (2/30) | 150.4 ± 2.1a | 4319 ± 107.3a | 89.3%a (25/28) |
表4:凍結保存法が移植後の胚生存率、妊娠維持、および子羊の産出に及ぼす影響。in vivoまたはin vitroで産生された胚の胚盤胞から拡大した胚盤胞への桑実体をガラス化/緩徐凍結および加温/融解にかけ、多経産のメリノ同期雌羊に移しました。胚生存率(30日目の生存可能胚/移植された胚)、妊娠率(妊娠中/移植された雌羊)、妊娠から出生までの胎児喪失(出生時にアクセスして生まれた子羊/30日目に生存可能な胚)、妊娠期間(d)、出生体重(g)、および子羊の生存率(生後1週間の生きた子羊/生まれた子羊)を実験群間で比較した。
また、当施設で使用されなくなった遺伝子改変マウス系統をスパチュラMVD法により2細胞胚としてバックアップしました。主に 体外 受精(または自然交配)によって産生された最低300個の2細胞胚を、各マウス系統についてガラス化した。このプロセスの品質管理は、各ラインの2つまたは3つのヘラを温め、胚を偽妊娠した女性レシピエントに移植することによって行われました。異なる遺伝子改変マウス系統の代表的な結果を 表5に示します。平均して、回復率は90.4%、生存率は96.8%でした。妊娠率は80%、出生率は平均31.5%でした。注目すべきは、出生率が12%から45%までの幅広い結果を示したことであり、これは胚の感受性と胚移植の結果に影響を与える可能性のあるさまざまな遺伝子改変によるものと考えられます。一般に、これらの結果は、施設で以前に得られた結果と一致していました。
| マウスライン | ガラス化/温められた 胚の数 | 回復率(デバイス/凍結保存された胚から回収) | 生存率(生存可能/デバイスから回収された胚) | 妊娠率(妊娠中/転院した女性) | 出生率(生まれた/移植された胚の子犬) |
| 1 | 60 | 83.3 % (50/60) | 96.0 % (48/50) | 50 % (1/2) | 19.4 % (7/36) |
| 2 | 35 | 100 % (35/35) | 100 % (35/35) | 100 % (1/1) | 39.1 % (9/23) |
| 3 | 43 | 76.7 % (33/43) | 84.8 % (28/33) | 100 % (1/1) | 38.8 % (7/18) |
| 4 | 41 | 92.6 % (38/41) | 97.3 % (37/38) | 100 % (2/2) | 31.4 % (11/35) |
| 5 | 66 | 98.4 % (65/66) | 100 % (65/65) | 100 % (3/3) | 36.6 % (22/60) |
| 6 | 70 | 94.2 %(66/70) | 95.4 % (63/66) | 33 % (1/3) | 12 % (6/50) |
| 7 | 74 | 87.8 % (65/74) | 100 % (65/65) | 100 % (3/3) | 45 % (27/60) |
| 平均 | 90.4 % (352/389) | 96.8 % (341/352) | 80 % (12/15) | 31.5 % (89/282) |
表5:異なる遺伝子改変マウス系統の2細胞胚で実施された品質管理ガラス化プロセスの代表的な結果。 GMマウス系統は、スパチュラMVD法を用いて2細胞胚(最低300胚)としてバックアップしました。このプロセスの品質管理は、各ラインの2つまたは3つのヘラを温め、胚を偽妊娠した女性レシピエントに移植することによって行われました。温暖化後の回復率(デバイスから回収された胚/凍結保存された胚)と生存率(生存可能/デバイスから回収された胚)を決定しました。生存可能な温められた胚を2細胞期でレシピエント雌に移植した(1株あたり1〜3匹の雌、雌1体あたり~18個の胚)。妊娠率(妊娠中/移植された女性)と出生率(生まれた/移植された胚)が決定されました。
最後に、我々は最近、新鮮でガラス化した温められたマウス受精卵をCRISPR試薬でマイクロインジェクションし、その後、 in vitro で培養するか、偽妊娠した女性に移すという比較研究を行った17。目的は、スパチュラMVDを使用したガラス化受精卵が、B6D2F1/JおよびC57BL/6J受精卵のマイクロインジェクションに適した胚源であるかどうかを評価することでした。回復率および生存率は、2〜8細胞期の胚について得られた以前の結果と同様であった(表6)。全体として、ガラス化温合卵はマイクロインジェクションを生き延び、孵化した胚盤胞に成長するか、生きた仔を産み、CRISPR/Cas9システムによって誘発される突然変異を示しました。しかし、突然変異率は、ガラス化受精卵の方が新しい受精卵よりも有意に低かった。Zygoteクライオバンキングは、オンデマンドでマイクロインジェクションセッションを実施するための代替胚源であり、年間を通じて動物の繁殖と維持を回避し、CRISPR技術における3Rの実装を強化するようです。
| ストレイン接合子 | 凍結保存された受精卵のNº | 回収率(デバイス/凍結保存された胚から回収) | 生存率(生存可能/デバイスから回収された胚) |
| B6D2F1/J | 380 | 97.1 % (369/380) | 90.8 % (335/369) |
| C57BL/6J | 800 | 84.0 % (672/800) | 92.3 % (620/672) |
表6:ビトリファイド温合B6D2F1/JおよびC57BL/6J受精卵の回復率と生存率。 B6D2F1/JおよびC57BL/6Jドナー雌からin vivo産生受精卵を採取し、スパチュラMVDでガラス化し、加温した。回復率(デバイスから回収された胚/凍結保存された胚)と生存率(生存可能/デバイスから回収された胚)は、温暖化後に決定されました。
ディスカッション
スパチュラMVDは、組み立てが簡単で、低コストで、最小容量のガラス固化装置で、高い胚保持能力と最適な液体窒素デュワー占有率を備えています。この方法は、簡単、迅速、堅牢であることが証明されています。平均して、ガラス化胚の高い胚回収率と生存率(~90%)だけでなく、マウスで胚移植を行った場合の良好な生殖結果(~80%の妊娠率と~30%の出生率)も達成しており、これは他の最小体積ガラス化法に匹敵します18,19,20。
スパチュラMVDガラス化法の重要なステップには、(i)スパチュラの準備が含まれます。この手法には、かなりの専門知識が必要です。鉗子で加熱してゲルローダーチップで製造されるプラットフォームは、~1 mm2 で、端部で閉じている必要があります。先端が開いたままの場合、温暖化プロセス中にヘラをショ糖滴に突っ込むときに、温度差により気泡が発生する場合があります。気泡は胚の検索と回復を妨げます。(ii)ガラス化溶液中での胚のインキュベーション。密度が高いため、胚は液滴内で異なる高さに留まります。すべての胚の迅速な吸引が必要です。胚が室温でこれらの溶液に長期間留まると、毒性が予想されます。(iii)へらガラス固化ドロップ。プラットフォーム内のガラス化液滴(胚を含む)の容量は、~0.5〜1.0μLである必要があります。凍結保護剤の量が多いと、胚の生存率に影響します。必要な体積を運ぶことができる胚のサイズよりも少し広い内径のプルドキャピラリーを使用することをお勧めします。さらに、プラットフォーム内の大きな落下は、システムを閉じるときに壁の内側の0.5 mLストローに引っかかる可能性が高くなる可能性があります。(iv)へらのシーリング。0.5mLストローでへらを閉じるときは、特別な注意を払う必要があります。両方の要素を整列させる必要があります。へらの中の胚滴は邪魔されてはいけません。(v)加温中は、ロッド識別子と0.5mLストローの取り外し順序に従ってください。そうしないと、温度差によって識別子が追い出される可能性があります。
この手法には、さまざまな段階でのオペレーターのトレーニングが必要です。主なトラブルシューティングは、へらからの胚の回復である可能性があります。スパチュラを温めたときに回収されるガラス化胚の70〜80%未満の場合、これは(i)ヘラプラットフォームへの胚の負荷が不完全であるか、(ii)システムが閉じたときに胚が0.5mLのストロー内壁に保持されていることが原因である可能性があります。最初の問題を克服するには、胚を含む液滴のローディングを実体顕微鏡下で行い、吸引チューブアセンブリと、胚とキャピラリーに沿った2〜3個の小さな気泡を含む凍結保護剤をロードした引っ張られたキャピラリーを使用して行う必要があります。2つ目の問題については、加温中にプラットフォームに胚が見えない場合は、綿栓を切って0.5mLのストローを開き、M2中の0.5Mショ糖500μLで2回洗浄し(セクション2、ステップ1を参照)、胚回収のために皿に溶液を排出します。
この方法の限界は、主にすでに述べた重要な段階に関連しています。ポイントはヘラの準備だと考えています。良いヘラを実行するにはトレーニングが必要ですが、一度学べば習得できます。培地は自家製であるため、この方法はヒトの生殖クリニックでは使用できません。
スパチュラMVDの主な利点は、商用のデバイスと比較して低コストのデバイスであることです9。さらに、クライオチューブガラス固化8と比較して、液体窒素デュワーのスペースを節約します。 私たちは、さまざまな段階でマウスとヒツジの胚でその機能をテストしました。これは、低速凍結法よりも特に簡単で、速く、経済的で、効果的です。
この方法は、幅広い研究分野で、さまざまな非ヒト哺乳類種の胚をガラス化するために使用できます。
開示事項
著者は、利益相反を宣言しません。
謝辞
スパチュラMVDの開発に貢献してくれたアレホ・メンチャカに感謝します。GSは、バイオテクノロジー大学院プログラム-ファカルタッドデシエンシアス-レプブリカ大学(https://webmasterbiotecnol.wixsite.com/biotec1)(助成金番号:GS 2437 347)から資金提供を受けました。GS、MNM、MC は、FOCEM - Fondo para la Convergencia Estructural del Mercosur (https://focem.mercosur.int/es/) から資金提供を受けました (助成金番号: COF 03/11)。GSとMCは、ウルグアイのSistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovaciónのフェローです。(https://www.anii.org.uy/)。資金提供者(バイオテクノロジー大学院プログラム-シエンシア学部-レプブリカ大学;FOCEM - Fondo para la Convergencia Estructural del Mercosur;Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación, Uruguay)は、研究デザイン、データ収集と分析、出版の決定、または原稿の準備に関与していませんでした。
資料
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter | Sartorius | 16534 | Minisart syringe filter 0.2 µL |
| 0.5 mL straw | Minitube | 13408/0044 | French type medium paillette |
| Aspirator tube assembly | Sigma | A5177 | |
| Bunsen burner | Indulab | 7000134 | |
| Dimethyl sulfoxide | Sigma | D2650 | |
| Ethylene glycol | Sigma | 102466 | |
| Ficoll PM70 | Sigma | F2878 | Density gradient medium |
| Gel-loader tip | Eppendorf | 10411193 | |
| Glass capillary | Marienfeld | 2900000 | Microhaematocrit capillary tube |
| Gloves for LN2 handling | Tempshield | CE0338 | Cryogloves |
| Goblets | Minitube | 16913/1133 | |
| Goggles for LN2 handling | 3M | 40661-00000-10 | Anti-fog, anti-scratch coating |
| Hot plate | Labec | LA-SH-II-5B | Digital model |
| Identification rod | IMV technologies | 6326 | Non steril LG48 mm |
| Insulated styrofoam container | |||
| LN2 storage dewar | Taylor-Wharton | XT21-AI | Cryoscience |
| Long stainless-steel twezeers | Fine Science Tools | 11000-25 | |
| M2 | Sigma | M7167 | |
| PBS | Home-made | Phosphate Buffered saline. Usually 1 L of concentrated 5x buffer is prepared and then diluted to 1x. Recipe: 40 g sodium chloride, 1 g potassium chloride, 7.2 g anhydrous disodium phosphate, 1.2 g monopotassium phosphate. Add distilled water and sterilize by autoclave. | |
| Plastic Petri dish | Falcon | 351029 | Not TC-treated Bacteriological Petri Dish |
| Stereomicroscope | Olympus | SZ2-LGB | |
| Sucrose | Sigma | S1888 | |
| Watchmaker’s #5 forceps | Fine Science Tools | 11254-20 |
参考文献
- Crispo, M., Meikle, M. N., Rülicke, T. Cryopreservation of Valuable Mouse and Rat Lines. Rodent Quality Control: Genes and Bugs. Laboratory Animal Science and Medicine. , Springer. Cham. (2024).
- Lloyd, K., Franklin, C., Lutz, C., Magnuson, T. Reproducibility: use mouse biobanks or lose them. Nature. 522 (7555), 151-153 (2015).
- Hart-Johnson, S., Mankelow, K. Archiving genetically altered animals: a review of cryopreservation and recovery methods for genome-edited animals. Lab Anim. 56 (1), 26-34 (2022).
- Shaw, J. M., Jones, G. M. Terminology associated with vitrification and other cryopreservation procedures for oocytes and embryos. Hum Reprod Update. 9 (6), 583-605 (2003).
- Arav, A. Cryopreservation of oocytes and embryos. Theriogenology. 81 (1), 96-102 (2014).
- dos Santos Neto, P. C., et al. Cryotolerance of Day 2 or Day 6 in vitro produced ovine embryos after vitrification by Cryotop or Spatula methods. Cryobiology. 70 (1), 17-22 (2015).
- Renard, J. P., Babinet, C. High survival of mouse embryos after rapid freezing and thawing inside plastic straws with 1-2 propanediol as cryoprotectant. J Exp Zool. 230 (3), 443-448 (1984).
- Tsang, W. H., Chow, K. L. Mouse embryo cryopreservation utilizing a novel high-capacity vitrification spatula. Biotechniques. 46 (7), 550-552 (2009).
- Kuwayama, M. Highly efficient vitrification for cryopreservation of human oocytes and embryos: the Cryotop method. Theriogenology. 67 (1), 73-80 (2007).
- Nakao, K., Nakagata, N., Katsuki, M. Simple and efficient vitrification procedure for cryopreservation of mouse embryos. Exp Anim. 46 (3), 231-234 (1997).
- National Research Council. Guide for the Care and Use of Laboratory Animals. , National Academies Press. Washington, DC. (1996).
- du Sert, N. P., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biol. 18 (7), e3000410(2020).
- Meikle, M. N., Schlapp, G., Menchaca, A., Crispo, M. Minimum volume Spatula MVD vitrification method improves embryo survival compared to traditional slow freezing, both for in vivo and in vitro produced mice embryos. Cryobiology. 84, 77-81 (2018).
- Momozawa, K., et al. Efficient vitrification of mouse embryos using the Kitasato Vitrification System as a novel vitrification device. Reprod Biol Endocrinol. 15 (1), 29(2017).
- Stringfellow, D. A., Givens, M. D. Manual of the International Embryo Transfer Society: A Procedural Guide and General Information for the use of Embryo Transfer Technology Emphasizing Sanitary Procedures. , International Embryo Transfer Society. (2010).
- Dos Santos-Neto, P. C., Cuadro, F., Barrera, N., Crispo, M., Menchaca, A. Embryo survival and birth rate after minimum volume vitrification or slow freezing of in vivo and in vitro produced ovine embryos. Cryobiology. 78, 8-14 (2017).
- Schlapp, G., Meikle, M. N., Pórfido, J. L., Menchaca, A., Crispo, M. Zygote cryobanking applied to CRISPR/Cas9 microinjection in mice. PLoS One. 19 (7), e0306617(2024).
- Kamoshita, M., et al. Recent advances of oocyte/embryo vitrification in mammals from rodents and large animals. Anim Sci J. 95 (1), e13931(2024).
- Qiu, J., et al. Equilibrium vitrification of mouse embryos using low concentrations of cryoprotectants. Cryobiology. 98, 127-133 (2021).
- Tsang, W. H., Chow, K. L. Cryopreservation of mammalian embryos: Advancement of putting life on hold. Birth Defects Res C Embryo Today. 90 (3), 163-175 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved