Method Article
Espátula Montevidéu Dispositivo para vitrificação de embriões de mamíferos
Neste Artigo
Resumo
Aqui, apresentamos o protocolo Spatula Montevideo para vitrificação de embriões pré-implantacionais de camundongos e ovelhas, consistindo em uma espátula caseira e utilizando soluções caseiras. Os embriões são rapidamente equilibrados em duas soluções crioprotetoras de concentração crescente, carregadas na espátula, imersas em nitrogênio líquido e, finalmente, seladas com um canudo de 0,5 mL.
Resumo
Este estudo descreve um método de vitrificação eficiente e econômico para criopreservação de embriões de camundongos e ovelhas conhecido como Espátula Montevidéu (MVD). Este protocolo utiliza uma espátula caseira como dispositivo de transporte, que é preparada com uma ponta de carregador de gel. Os embriões são rapidamente equilibrados em duas soluções crioprotetoras caseiras de concentração crescente, carregadas na espátula e, em seguida, imersas diretamente em nitrogênio líquido. Aproximadamente 30-40 embriões de camundongos em estágio de pré-implantação podem ser carregados na espátula, que é posteriormente selada com um canudo de 0,5 mL. O uso de espátulas em vez de criotubos, que são freqüentemente usados para armazenar embriões vitrificados, otimiza o espaço nos dewars de nitrogênio líquido. Além disso, o processo de aquecimento requer apenas uma solução caseira de sacarose de concentração decrescente para reidratar os embriões e restaurar sua morfologia. Nosso laboratório tem usado com sucesso a Espátula Montevidéu para embriões pré-implantação de camundongos e ovelhas por mais de 10 anos. A Espátula Montevidéu demonstrou uma taxa média de recuperação (embriões recuperados/vitrificados) de 84% e uma taxa de sobrevivência (embriões viáveis/recuperados) de 97% em embriões de camundongos. A vitrificação de embriões murinos produziu melhores resultados do que o congelamento lento, embora não tenham sido observadas diferenças nos resultados reprodutivos (taxas de gravidez, parto e natalidade). Em embriões de ovelhas, taxas semelhantes de sobrevivência e desenvolvimento embrionário foram alcançadas com a Espátula Montevidéu em comparação com um dispositivo comercial. Embora a taxa de prenhez tenha sido maior para o dispositivo comercial, a taxa de sobrevivência dos cordeiros não foi significativamente diferente entre os dispositivos. O método de vitrificação Spatula Montevideo é uma técnica de criopreservação simples que pode ser usada para armazenar embriões excedentes, fazer backup de linhagens de camundongos geneticamente modificados e modelos de ovelhas e facilitar seu intercâmbio entre pesquisadores em todo o mundo.
Introdução
A eficiência da geração de animais geneticamente modificados (GM) aumentou significativamente devido ao desenvolvimento de métodos baseados em endonuclease, particularmente CRISPR/Cas9. Muitos laboratórios em todo o mundo produzem várias linhagens de camundongos e ratos GM que devem ser criopreservadas para evitar deriva genética e manter a integridade dofenótipo 1 original. Além disso, o arquivamento elimina a necessidade de reprodução constante, o que geralmente resulta em número excessivo de animais. Alguns laboratórios enviam linhagens de camundongos GM como embriões ou espermatozoides criopreservados para repositórios internacionais, facilitando a troca desses modelos e evitando o transporte de animais vivos. Isso garante acessibilidade às linhas sem a geração repetitiva de modelos animais GM idênticos2. Por essas razões, a criopreservação de embriões e espermatozoides é fundamental em qualquer instalação animal GM. Geralmente, a criopreservação de embriões é preferida para armazenar linhagens GM porque os embriões contêm o genoma diplóide completo com modificações e podem ser facilmente recuperados por meio da transferência de embriões.
A vitrificação é um processo de não equilíbrio caracterizado por um desequilíbrio entre a água que entra na célula e a água que forma cristais extracelulares ao seu redor. Este método evita a formação de cristais de gelo intracelulares, distinguindo-o do método de congelamento lento (SLF)3 (ver Figura 1). A alta concentração de crioprotetores e o contato direto com nitrogênio líquido (LN2) permitem um resfriamento ultrarrápido (~40 °C/s), alcançando um estado vítreo das amostras em segundos. Além disso, a vitrificação é mais rápida, fácil e menos dispendiosa do que o congelamento lento4. Requer LN2 mínimo e normalmente emprega equipamentos simples que podem ser comprados comercialmente ou caseiros5 (ver Figura 1).
Além disso, o processo de aquecimento é geralmente rápido e replicável. Deve ser realizada rapidamente para evitar toxicidade crioprotetora e manter o estado vítreo3. Ao congelar embriões, muitos laboratórios consideram a conveniência do dispositivo transportador, sua confiabilidade, robustez, capacidade de retenção e custos.
Preferimos o método de vitrificação de espátula de volume mínimo para criopreservação de rotina de embriões de ovelhas e camundongos, usando o dispositivo Spatula Montevideo (MVD)6. Inicialmente, empregamos o método de congelamento lento7 , mas rapidamente fizemos a transição para a vitrificação. Para criar um dispositivo mais simples e eficiente em termos de espaço para o dewar LN2 , modificamos a espátula caseira de Tsang e Chow (2009)8, que é conectada a um criotubo, para desenvolver a espátula MVD que é selada com um canudo de 0,5 mL (ver Tabela de Materiais). A espátula possui uma ponta de carregador de gel (ver Tabela de Materiais), onde uma plataforma de aproximadamente 1 mm² é formada pela fusão suave da ponta com pinças finas, criando uma placa semelhante a uma pétala para carregar os embriões. Esta plataforma pode acomodar até 40 embriões de camundongos em uma pequena gota de vitrificação. Uma haste de identificação (consulte a Tabela de Materiais) é inserida na extremidade aberta da ponta do carregador de gel.
O objetivo deste método é vitrificar embriões de forma simples, rápida e barata que, além disso, economize espaço no dewar de nitrogênio. Este sistema tem sido usado com sucesso por muitos anos, proporcionando excelentes taxas de sobrevivência de embriões (~ 97%) e resultados reprodutivos, particularmente em embriões de camundongos. Como a Espátula MVD é preparada em laboratório, é um método de baixo custo em comparação com os dispositivos comerciais9. Além disso, economiza espaço no dewar de nitrogênio em comparação com o uso de criotubos 8,10.
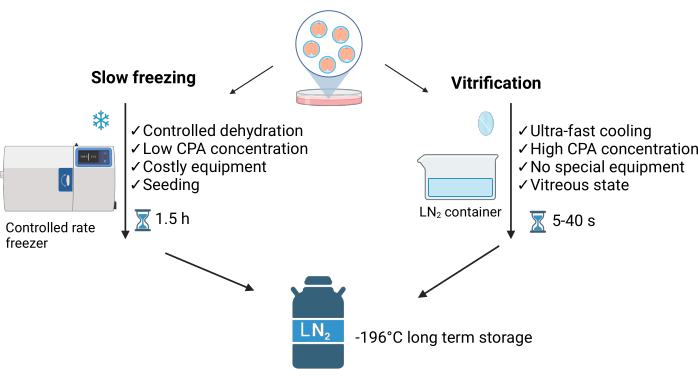
Figura 1: Comparação das duas principais técnicas utilizadas para criopreservação de embriões. Essa figura foi modificada com permissão de Crispo et al.1. Criado em BioRender.com. Clique aqui para ver uma versão maior desta figura.
Protocolo
Os animais utilizados para a obtenção de embriões de camundongos foram alojados e manuseados de acordo com a legislação nacional 18.611 e as diretrizes internacionais de cuidados com os animais11. O protocolo experimental (licença número #007-18) foi oportunamente aprovado pelo Comitê de Cuidados e Uso de Animais do Institut Pasteur de Montevideo (consentimento por escrito). Os protocolos experimentais para ovócitos/embriões de ovinos foram aprovados pelo Comitê Institucional de Cuidados com os Animais Fundación IRAUy (protocolo #001-2017), atendendo às diretrizes ARRIVE12 e foram realizados de acordo com as diretrizes internacionais de cuidados com animais11.
1. Vitrificação (Figura 2)
- Preparação de espátula MVD
- Encurte a ponta do carregador de gel (consulte a Tabela de Materiais) cortando os primeiros 10 mm e o cone da ponta.
NOTA: Isso cria uma ponta mais curta e reta, facilitando a vedação final com o canudo de 0,5 mL (consulte a Tabela de Materiais). - Segure a extremidade da ponta do carregador de gel com a pinça #5 do relojoeiro (consulte a Tabela de Materiais) a aproximadamente 1.0 cm da ponta. Coloque suavemente a ponta na chama de um bico de Bunsen (consulte a Tabela de Materiais) e segure por 8 a 10 s para formar uma plataforma semelhante a uma pétala de aproximadamente 1 mm2.
- Retire da chama e segure firmemente com a pinça por 5 s.
- Usando um estereomicroscópio (consulte a Tabela de Materiais), verifique se a plataforma em forma de pétala (~ 1 mm2) está formada e a borda distal está selada.
NOTA: A plataforma deve ser fechada na extremidade distal para evitar a infiltração de LN2 durante a vitrificação. Certifique-se de que a plataforma esteja limpa e livre de roscas plásticas. Se for muito pequeno ou tiver roscas, apare a ponta e repita o procedimento. - Repita as etapas 1.1.1-1.1.4 para preparar o número necessário de espátulas (1 espátula = até 40 embriões de camundongo).
- Esterilize as espátulas usando raios ultravioleta (UV) ou óxido de etileno e guarde-as em um tubo ou caixa estéril.
- No dia da vitrificação, recupere as espátulas, manuseando-as na extremidade oposta da plataforma. Insira uma haste de identificação (consulte a Tabela de Materiais) em cada espátula e coloque-as na base do estereomicroscópio. Rotule a haste com um marcador permanente ou etiqueta adesiva resistente ao nitrogênio líquido.
NOTA: Evite sempre tocar na plataforma ao manusear as espátulas. O comprimento total do dispositivo completo (espátula + canudo de 0,5 mL + haste de identificação) não deve exceder mais de 1 cm do comprimento da taça.
- Encurte a ponta do carregador de gel (consulte a Tabela de Materiais) cortando os primeiros 10 mm e o cone da ponta.
- Preparação de soluções de vitrificação
- Prepare a solução FS: Dissolva 1,5 g de meio de gradiente de densidade (ver Tabela de Materiais) e 0,85 g de sacarose (ver Tabela de Materiais) em 5 mL de solução salina tamponada com fosfato (PBS; ver Tabela de Materiais). Aqueça em banho-maria fervente até dissolver completamente e, em seguida, esterilize com um filtro de 0,22 μm (consulte a Tabela de Materiais).
NOTA: Esta solução pode ser conservada a 4 °C até 6 meses. - Prepare a solução de pré-vitrificação (PV): No dia da vitrificação, misture 10% de etilenoglicol (ver Tabela de Materiais), 10% de dimetilsulfóxido (ver Tabela de Materiais) e 80% de meio M2 (ver Tabela de Materiais). É necessário um volume total de 100 μL para 5 espátulas.
- Prepare a solução de vitrificação (V): No dia da vitrificação, combine 15% de etilenoglicol, 15% de dimetilsulfóxido, 10% de meio M2 e 60% de solução FS. Um volume total de 100 μL é necessário para 5 espátulas.
- Prepare a solução FS: Dissolva 1,5 g de meio de gradiente de densidade (ver Tabela de Materiais) e 0,85 g de sacarose (ver Tabela de Materiais) em 5 mL de solução salina tamponada com fosfato (PBS; ver Tabela de Materiais). Aqueça em banho-maria fervente até dissolver completamente e, em seguida, esterilize com um filtro de 0,22 μm (consulte a Tabela de Materiais).
- Processo de desidratação e vitrificação de embriões
- Prepare o LN2: Despeje o LN2 em um recipiente adequado (por exemplo, um recipiente de poliestireno isolado de 10 cm x 30 cm x 20 cm) e coloque tantos canudos de 0,5 mL quanto espátulas a serem usadas.
NOTA: Para facilitar a visualização da plataforma da espátula durante a manipulação sob LN2, sugere-se que um recipiente de poliestireno isolado com fundo colorido seja usado para criar um efeito de contraste.
CUIDADO: Use óculos e luvas apropriados (consulte a Tabela de Materiais) ao manusear o LN2. - Prepare as soluções: Em uma placa de Petri de plástico de 100 mm (consulte a Tabela de Materiais), coloque as seguintes gotas: 100 μL de M2, 20 μL de solução PV e 20 μL de solução V para cada espátula.
- Vitrificar embriões: Coloque os embriões a serem vitrificados na gota M2. Manuseie 30-40 embriões de cada vez, incubando-os na gota de solução PV por 30 s e, em seguida, na gota de solução V por mais 30 s em temperatura ambiente (RT).
- Use um capilar de vidro puxado (consulte a Tabela de Materiais) com um conjunto de tubo aspirador (consulte a Tabela de Materiais). Pré-carregue o capilar com pelo menos 1 μL da respectiva solução antes de colocar os embriões.
NOTA: Os embriões estarão em alturas diferentes nas gotas, portanto, ajuste o micrômetro do estereomicroscópio para localizá-los. Recupere embriões de cada gota quando restarem 10 s. Todas as manipulações de embriões devem ser realizadas sob o estereomicroscópio. - Carregar embriões: Aspire os embriões usando uma solução V mínima (por exemplo, ~ 0,1 μL) e coloque-os rapidamente na plataforma da espátula.
- Imersão em LN2: Após carregar os embriões, mergulhe imediatamente a plataforma da espátula em LN2 por 5 s (segurando a espátula com a mão, pela haste). Em seguida, mantendo a espátula em vapores de LN2 , sele-a com um canudo de 0,5 mL usando uma pinça longa de aço inoxidável (consulte a Tabela de Materiais).
NOTA: Remova o LN2 do canudo antes de selar para evitar a expansão durante o aquecimento. Certifique-se de que a espátula e o canudo estejam alinhados corretamente para evitar o contato entre a gota do embrião e a parede do canudo. Por conveniência, as espátulas seladas podem permanecer no recipiente LN2 até que todas as espátulas estejam carregadas com embriões, reabastecendo com LN2 conforme necessário. - Repita o procedimento: Repita as etapas 1.3.3 a 1.3.7 para cada grupo de embriões, usando um novo par de gotas de PV e V.
- Armazenamento: Transfira as espátulas para taças (consulte Tabela de materiais) e, em seguida, para um dewar de armazenamento LN2 (consulte Tabela de materiais).
- Prepare o LN2: Despeje o LN2 em um recipiente adequado (por exemplo, um recipiente de poliestireno isolado de 10 cm x 30 cm x 20 cm) e coloque tantos canudos de 0,5 mL quanto espátulas a serem usadas.

Figura 2: Esquema do processo de vitrificação usando Espátula MVD. Veja o texto para mais detalhes. Criado em BioRender. Meikle, M. (2025) https://BioRender.com/x96y902. Clique aqui para ver uma versão maior desta figura.
2. Aquecimento (Figura 3)
- Preparação da solução
- Prepare uma solução de sacarose 1 M dissolvendo 0,85 g de sacarose em 2,5 mL de meio M2. Esterilizar a solução com um filtro de 0,22 μm.
NOTA: Esta solução pode ser preparada e conservada a 4 °C durante um período máximo de 1 semana. - Preparar soluções de sacarose 0,5 M e 0,25 M diluindo a solução de sacarose 1 M com o volume adequado de meio M2.
- Manter as soluções de sacarose a 37 °C numa placa quente (ver Tabelas de Materiais) até ao início do aquecimento.
- Prepare uma solução de sacarose 1 M dissolvendo 0,85 g de sacarose em 2,5 mL de meio M2. Esterilizar a solução com um filtro de 0,22 μm.
- Preparação da placa de aquecimento
- Em uma placa de Petri de plástico de 100 mm, coloque as seguintes gotas de solução: uma gota de 500 μL de sacarose 0,5 M, uma gota de 50 μL de sacarose 0,5 M e uma gota de 50 μL de sacarose 0,25 M para cada espátula a ser aquecida. Coloque três gotas de meio M2 (100 μL cada) para lavar.
- Processo de aquecimento
NOTA: O processo de aquecimento ocorre em RT, por exemplo, 20-22 °C na base de um estereomicroscópio.- Recupere as espátulas seladas do dewar. Coloque-os em um recipiente apropriado com LN2. Veja a Figura 3.
- Coloque a placa de aquecimento no estereomicroscópio. Um de cada vez, segure a base da espátula com uma pinça de aço inoxidável e, com a mão enluvada, puxe a haste de identificação e depois o canudo. Mergulhe rapidamente a plataforma contendo os embriões na gota de sacarose 0,5 M de 500 μL.
- Certifique-se de que todos os embriões caíram na gota; Se necessário, mova suavemente a espátula para ajudar na sua libertação. Carregue os embriões em um capilar de vidro puxado, coloque-os na gota de 50 μL de solução de sacarose 0,5 M e incube por 2 min.
- Coloque os embriões na gota de 50 μL de solução de sacarose 0,25 M e incube por mais 2 min.
NOTA: Antes de colocar os embriões em cada solução, pré-carregue o capilar com a solução a ser usada. - Por fim, lave os embriões três vezes em diferentes gotas de meio M2 para remover a sacarose.
- Incubar os embriões em condições adequadas para cada espécie durante pelo menos 1 h antes da utilização.
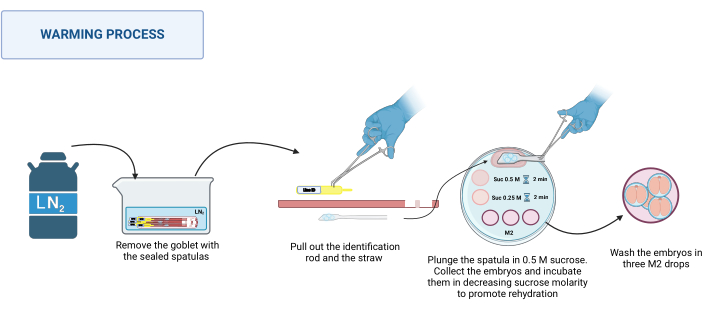
Figura 3: Esquema do processo de aquecimento da Espátula MVD. Veja o texto para mais detalhes. Criado em BioRender. Meikle, M. (2025) https://BioRender.com/k91k191. Clique aqui para ver uma versão maior desta figura.
Resultados
Inicialmente, usamos o método tradicional de congelamento lento baseado em soluções de propilenoglicol, canudos e equipamentos de congelamento de taxa controlada7. No entanto, depois de considerar o método de vitrificação uma opção potencialmente mais fácil e econômica, realizamos um estudo para comparar os resultados do congelamento lento tradicional (SLF) vs. Espátula MVD em embriões de camundongo derivados in vivo de 8 células e 2 células produzidos in vitro 13 (Tabela 1 e Tabela 2). Os resultados são apresentados em termos de "taxa de recuperação", que define o número de embriões recuperados do dispositivo após o aquecimento sobre o número total de embriões criopreservados. "Taxa de sobrevivência" refere-se ao número de embriões viáveis em relação aos embriões recuperados do dispositivo. Os embriões foram considerados viáveis se os blastômeros estivessem intactos (dois blastômeros em embriões de 2 células e pelo menos quatro blastômeros em embriões de 8 células)14. Esses termos são usados para avaliar se o dispositivo e todo o processo são adequados para criopreservação.
Uma taxa de sobrevivência significativamente maior (Tabela 1 e Tabela 2) e taxa de desenvolvimento em 3,5 dias após o coito (dpc; por exemplo, embriões de mórulas e blastocistos, Tabela 1) foram alcançadas para Spatula MVD do que para o grupo SLF em embriões de camundongos. Embora ambos os métodos tenham atingido uma taxa de eclosão aceitável, ela foi significativamente menor do que o grupo controle fresco, como esperado (embriões não vitrificados; Tabela 1). Embriões frescos de 2 células vitrificados/aquecidos e controle foram transferidos para fêmeas receptoras, não revelando diferenças tanto na taxa de gravidez (fêmeas grávidas/total transferidas) quanto na taxa de natalidade (filhotes nascidos/embriões transferidos no total de fêmeas receptoras; Tabela 2). Esses resultados nos levam a mudar do método SLF para a vitrificação.
| Nº de embriões | Taxa de sobrevivência a 2,5 dpc (embriões viáveis/recuperados do dispositivo) | Taxa de desenvolvimento embrionário a 3,5 dpc (mórulas-blastocistos/embriões viáveis) | Taxa de eclosão a 5,5 dpc (blastocistos eclodidos / embriões cultivados) | |
| Congelamento lento | 410 | 89,3 % (366/410)a | 91,8 % (336/366)a | 49,7 % (90/181)a |
| Espátula MVD | 341 | 92,7 % (316/341)b | 97,2 % (307/316)b | 41,0 % (68/166)a |
| Embriões frescos | 458 | - | 98,7 % (452/458)b | 67,8 % (139/205)b |
Tabela 1: Taxas de sobrevivência e desenvolvimento in vitro de embriões murinos de 8 células submetidos a vitrificação ou congelamento lento. Embriões murinos de 8 células in vivo foram criopreservados por Spatula MVD ou congelamento lento e comparados a embriões frescos. Embriões frescos foram coletados de fêmeas a 2,5 dpc e cultivados nas mesmas condições dos outros grupos. A taxa de sobrevivência (embriões viáveis/recuperados do dispositivo) foi determinada após o aquecimento/descongelamento. Embriões viáveis foram cultivados in vitro. A taxa de desenvolvimento embrionário (mórulas-blastocistos/embriões viáveis) e a taxa de eclosão (embriões eclodidos/cultivados) foram determinadas em 3,5 dpc e 5,5 dpc, respectivamente. Diferentes sobrescritos indicam diferenças significativas (P < 0,05).
| Nº de embriões | Taxa de recuperação (recuperada do dispositivo/embriões criopreservados) | Taxa de sobrevivência (embriões viáveis/recuperados do dispositivo) | Taxa de gravidez (mulheres grávidas/transferidas) | Taxa de natalidade no total de fêmeas transferidas (filhotes nascidos/embriões transferidos) | |
| Congelamento lento | 531 | 88,3 % (469/531)a | 85,1 % (399/469)a | - | - |
| Espátula MVD | 431 | 84,2 % (363/431)a | 94,7 % (344/363)b | 53,3 % (8/15)a | 17,8 % (47/264)a |
| Embriões frescos | 446 | - | 97,7 % (436/446)b | 53,3 % (8/15)a | 20,6 % (53/257)a |
Tabela 2: Taxas de recuperação e sobrevivência de embriões murinos de 2 células submetidos a vitrificação ou congelamento lento. Resultados reprodutivos de embriões vitrificados/aquecidos versus embriões frescos.Embriões de 2 células produzidos in vitro foram criopreservados por Spatula MVD ou SLF. A recuperação (recuperada do dispositivo/embriões criopreservados) e a taxa de sobrevivência (embriões viáveis/recuperados do dispositivo) foram determinadas após o aquecimento ou descongelamento. Embriões viáveis aquecidos e frescos foram transferidos para fêmeas receptoras (15 fêmeas por grupo, ~ 17 embriões por fêmea). As taxas de gravidez (fêmeas grávidas/transferidas) e nascimento (filhotes nascidos/embriões transferidos) foram determinadas. Diferentes sobrescritos indicam diferenças significativas (P < 0,05).
A espátula MVD também foi testada para vitrificação de embriões pré-implantação de ovinos produzidos in vitro e comparada com um dispositivo comercial6. Os resultados são apresentados na Tabela 3. A qualidade dos embriões foi avaliada pela morfologia seguindo os critérios recomendados pela International Embryo Technology Society (IETS)15, e os embriões excelentes e bons de Grau 1 foram alocados em cada grupo experimental.
Nem a taxa de sobrevivência (~70% e ~16%, 3 h ou 24 h após o aquecimento, respectivamente) nem a eclosão do embrião no dia 8 foram influenciadas pelo método de vitrificação. A porcentagem de blastocistos no dia 8 foi menor para ambas as técnicas de vitrificação em comparação com o grupo controle (embriões frescos) (~ 8% vs 20,5%, respectivamente; P < 0,05). Esses resultados sugerem que embriões de ovelhas produzidos in vitro também podem ser vitrificados usando a espátula MVD. Além disso, os resultados anteriores foram complementados pela transferência de embriões de ovelhas submetidos a congelamento lento, Spatula MVD ou um dispositivo comercial para fêmeas receptoras16. Os resultados são mostrados na Tabela 4. A taxa de sobrevivência de embriões (embriões viáveis no dia 30/embriões transferidos), taxa de prenhez (ovelhas prenhes/transferidas), perda fetal da gestação ao nascimento (cordeiros nascidos avaliados no nascimento/embriões viáveis no dia 30) e taxa de sobrevivência de cordeiros (cordeiros vivos 1 semana após o nascimento/cordeiros nascidos) foram avaliados entre os grupos experimentais.
Os resultados mostraram que a taxa de sobrevivência do embrião após a transferência de embriões foi semelhante para SLF (26,5%) e Spatula MVD (22,2%), mas foi maior para o grupo de dispositivos comerciais (52,0%, P < 0,05). Os desfechos reprodutivos (duração da gestação, perda fetal, peso ao nascer e taxas de sobrevivência dos cordeiros) não foram significativamente afetados pelo método de criopreservação. No geral, a espátula MVD também é um método adequado para a vitrificação de embriões pré-implantação de ovinos.
| N° de embriões | Taxa de sobrevivência % (embriões viáveis/criopreservados) | Taxa de desenvolvimento % (mórulas-blastocistos no dia 6/embriões clivados) | Taxa de eclosão % (blastocistos eclodidos / embriões clivados) | ||
| 3 h | 24 h | ||||
| Espátula MVD | 165 | 69,6 ± 2,4a | 14,6 ± 3,5A | 11,1 ± 2,1b | 6,4 ± 1,9b |
| Dispositivo comercial | 165 | 71,3 ± 1,3A | 17,7 ± 4,5A | 12,7 ± 3,2b | 10,2 ± 2,9b |
| Grupo controle (embriões frescos) | 408 | - | - | 41,3 ± 3,7A | 20,5 ± 4,5A |
Tabela 3: Taxas de sobrevivência e desenvolvimento in vitro de embriões ovinos submetidos à vitrificação por Spatula MVD ou dispositivo comercial.Embriões em estágio celular produzidos in vitro de 2 a 8 (dia 2 após a fertilização) foram vitrificados usando Spatula MVD ou um dispositivo comercial e depois aquecidos. A taxa de sobrevivência (viável/criopreservada) foi analisada em 3 h e 24 h pós-aquecimento. As taxas de desenvolvimento e eclosão foram definidas como o número de mórulas e blastocistos obtidos no dia 6 e o número de embriões eclodidos, respectivamente, sobre o número de embriões clivados (2-8 células). Sobrescritos diferentes na mesma coluna indicam diferenças significativas (P < 0,05). Os dados são mostrados como Média ± SEM.
| Sobrevivência do embrião (embriões viáveis no dia 30/embriões transferidos) | Taxa de prenhez (ovelhas prenhes/transferidas) | Perda fetal (cordeiros nascidos acessados no nascimento/embriões viáveis no dia 30) | Duração da gestação (d) | Peso ao nascer (g) | Taxa de sobrevivência de cordeiros (cordeiros vivos uma semana após o nascimento/cordeiros nascidos) | |
| Espátula MVD | 22,2% a (28/126) | 32,9% a (25/76) | 4,0% a (1/25) | 150,7 ± 1,8A | 4102 ± 112,4A | 87,5% a (21/24) |
| Dispositivo comercial | 52,0 %b (91/175) | 66,0% b (62/94) | 11.0% a (8/73) | 150,4 ± 1,9A | 3980 ± 221,2A | 83,1% a (54/65) |
| Congelamento lento | 26,5% a (36/136) | 38,3% a (28/73) | 6,7% a (2/30) | 150,4 ± 2,1A | 4319 ± 107,3A | 89,3% a (25/28) |
Tabela 4: Efeito do método de criopreservação na sobrevivência do embrião após a transferência, manutenção da gestação e produção de cordeiros. Mórulas para blastocistos expandidos de embriões produzidos in vivo ou in vitro foram submetidas à vitrificação/congelamento lento e aquecimento/descongelamento e foram transferidas para ovelhas multíparas sincronizadas com Merino. A taxa de sobrevivência embrionária (embriões viáveis no dia 30/embriões transferidos), taxa de prenhez (ovelhas prenhes/transferidas), perda fetal da gestação ao nascimento (cordeiros nascidos acessados no nascimento/embriões viáveis no dia 30), duração da gestação (d), peso ao nascer (g) e taxa de sobrevivência de cordeiros (cordeiros vivos uma semana após o nascimento/cordeiros nascidos) foram comparados entre os grupos experimentais.
Além disso, linhagens de camundongos geneticamente modificados que não estão mais em uso em nossas instalações foram apoiadas como embriões de duas células usando o método Spatula MVD. Um mínimo de 300 embriões bicelulares, produzidos principalmente por fertilização in vitro (ou acasalamento natural), foram vitrificados para cada linhagem de camundongos. O controle de qualidade do processo foi realizado aquecendo duas ou três espátulas de cada linhagem e transferindo os embriões para receptoras pseudográvidas. Os resultados representativos de diferentes linhagens de camundongos geneticamente modificados são mostrados na Tabela 5. Em média, a taxa de recuperação foi de 90,4% e a taxa de sobrevida foi de 96,8%. A taxa de gravidez foi de 80% e a taxa de natalidade foi de 31,5% em média. É importante notar que a taxa de natalidade mostrou uma ampla gama de resultados de 12% a 45%, o que pode ser devido às diferentes modificações genéticas que podem afetar a sensibilidade do embrião e os resultados da transferência de embriões. Em geral, esses resultados foram consistentes com os obtidos anteriormente na instalação.
| Linha do mouse | Nº de embriões vitrificados/aquecidos | Taxa de recuperação (recuperados do dispositivo/embriões criopreservados) | Taxa de sobrevivência (embriões viáveis/recuperados do dispositivo) | Taxa de gravidez (mulheres grávidas/transferidas) | Taxa de natalidade (filhotes nascidos/embriões transferidos) |
| 1 | 60 | 83.3 % (50/60) | 96.0 % (48/50) | 50 % (1/2) | 19.4 % (7/36) |
| 2 | 35 | 100 % (35/35) | 100 % (35/35) | 100 % (1/1) | 39.1 % (9/23) |
| 3 | 43 | 76.7 % (33/43) | 84.8 % (28/33) | 100 % (1/1) | 38.8 % (7/18) |
| 4 | 41 | 92.6 % (38/41) | 97.3 % (37/38) | 100 % (2/2) | 31.4 % (11/35) |
| 5 | 66 | 98.4 % (65/66) | 100 % (65/65) | 100 % (3/3) | 36.6 % (22/60) |
| 6 | 70 | 94.2 %(66/70) | 95.4 % (63/66) | 33 % (1/3) | 12 % (6/50) |
| 7 | 74 | 87.8 % (65/74) | 100 % (65/65) | 100 % (3/3) | 45 % (27/60) |
| Média | 90.4 % (352/389) | 96.8 % (341/352) | 80 % (12/15) | 31.5 % (89/282) |
Tabela 5: Resultados representativos do processo de vitrificação de controle de qualidade realizado em embriões de 2 células de diferentes linhagens de camundongos geneticamente modificados. As linhagens de camundongos GM foram apoiadas como embriões de duas células (mínimo de 300 embriões) usando o método Spatula MVD. O controle de qualidade do processo foi realizado aquecendo duas ou três espátulas de cada linhagem e transferindo os embriões para receptoras pseudográvidas. A recuperação (recuperada do dispositivo/embriões criopreservados) e a taxa de sobrevivência (embriões viáveis/recuperados do dispositivo) foram determinadas após o aquecimento. Embriões aquecidos viáveis foram transferidos no estágio de 2 células para as fêmeas receptoras (1 a 3 fêmeas por linhagem, ~ 18 embriões por fêmea). As taxas de gravidez (fêmeas grávidas/transferidas) e nascimento (filhotes nascidos/embriões transferidos) foram determinadas.
Finalmente, realizamos recentemente um trabalho comparativo no qual zigotos de camundongos frescos e aquecidos por vitrificação foram microinjetados com reagentes CRISPR e, em seguida, cultivados in vitro ou transferidos para fêmeas pseudográvidas17. O objetivo foi avaliar se os zigotos vitrificados - usando Spatula MVD - poderiam ser uma fonte adequada de embriões para microinjeção em zigotos B6D2F1 / J e C57BL / 6J. As taxas de recuperação e sobrevivência foram semelhantes aos resultados anteriores obtidos para embriões de 2-8 em estágio celular (Tabela 6). No geral, os zigotos aquecidos vitrificados sobreviveram à microinjeção, desenvolveram-se em blastocistos eclodidos ou produziram filhotes vivos e demonstraram mutações induzidas pelo sistema CRISPR / Cas9. No entanto, a taxa de mutação foi significativamente menor em zigotos vitrificados do que em novos. O criobanco de zigoto parece ser uma fonte alternativa de embriões para realizar sessões de microinjeção sob demanda, evitando a criação e manutenção de animais durante todo o ano e potencializando a implementação dos 3Rs na tecnologia CRISPR.
| Zigoto de tensão | Nº de zigotos criopreservados | Taxa de recuperação (recuperados do dispositivo/embriões criopreservados) | Taxa de sobrevivência (embriões viáveis/recuperados do dispositivo) |
| B6D2F1/J | 380 | 97.1 % (369/380) | 90.8 % (335/369) |
| C57BL/6J | 800 | 84.0 % (672/800) | 92.3 % (620/672) |
Tabela 6: Taxas de recuperação e sobrevivência de zigotos B6D2F1 / J e C57BL / 6J aquecidos vitrificados. Zigotos produzidos in vivo foram coletados de fêmeas doadoras B6D2F1/J e C57BL/6J, vitrificados por Spatula MVD e aquecidos. As taxas de recuperação (recuperados do dispositivo/embriões criopreservados) e sobrevivência (embriões viáveis/recuperados do dispositivo) foram determinadas após o aquecimento.
Discussão
A Espátula MVD é um dispositivo de vitrificação fácil de montar, de baixo custo e volume mínimo, com alta capacidade de retenção de embriões e ocupação ideal de dewar de nitrogênio líquido. Este método provou ser simples, rápido e robusto. Em média, alcançamos não apenas altas taxas de recuperação e sobrevivência de embriões vitrificados (~ 90%), mas também bons resultados reprodutivos ao realizar a transferência de embriões em camundongos (~ 80% de taxa de gravidez e ~ 30% de taxa de natalidade), que são comparáveis a outros métodos de vitrificação de volume mínimo 18,19,20.
As etapas críticas no método de vitrificação da espátula MVD incluem: (i) Preparação da espátula. Esta técnica requer experiência considerável. A plataforma produzida na ponta do carregador de gel por aquecimento com pinça deve ser de ~ 1 mm2 e deve ser fechada no final. Se a ponta permanecer aberta, bolhas podem se formar ao mergulhar a espátula na gota de sacarose durante o processo de aquecimento devido às diferenças de temperatura. As bolhas interferem na busca e recuperação do embrião. (ii) Incubação de embriões em soluções de vitrificação. Devido à alta densidade, os embriões permanecem em diferentes alturas nas gotas. É necessária uma aspiração rápida de todos os embriões. A toxicidade é esperada se os embriões permanecerem nessas soluções por períodos mais longos à temperatura ambiente. (iii) Gota de vitrificação de espátula. O volume da gota de vitrificação - contendo os embriões - na plataforma deve ser de ~ 0,5-1,0 μL; Volumes maiores de crioprotetor afetam a viabilidade do embrião. Recomendamos o uso de capilares puxados com um diâmetro interno um pouco maior que o tamanho de um embrião, que carregariam o volume necessário. Além disso, quedas maiores na plataforma podem aumentar a possibilidade de ficar preso no canudo de 0,5 mL dentro da parede ao fechar o sistema. (iv) Selagem de espátula. Deve-se ter cuidado especial ao fechar a espátula com o canudo de 0,5 mL; Ambos os elementos devem estar alinhados. As gotas de embriões na espátula não devem ser perturbadas. (v) Durante o aquecimento, siga a ordem de remoção do identificador da haste e do canudo de 0,5 mL. Caso contrário, o identificador pode ser expelido pela diferença de temperatura.
Essa técnica requer treinamento do operador em diferentes estágios. A principal solução de problemas pode ser a recuperação dos embriões da espátula. Se menos de 70-80% dos embriões vitrificados forem recuperados durante o aquecimento da espátula, isso pode ser devido a (i) carregamento incompleto dos embriões na plataforma da espátula ou (ii) embriões retidos na parede interna da palha de 0,5 mL quando o sistema é fechado. Para superar o primeiro problema, o carregamento da gota contendo os embriões deve ser realizado sob o estereomicroscópio usando um conjunto de tubo aspirador e um capilar puxado carregado com o meio crioprotetor contendo os embriões e 2-3 pequenas bolhas de ar ao longo do capilar, o que permite um fluxo correto do líquido. Para a segunda questão, se nenhum embrião for visível na plataforma durante o aquecimento, corte o tampão de algodão para abrir o canudo de 0,5 mL e lave-o duas vezes com 500 μL de sacarose 0,5 M em M2 (ver seção 2, etapa 1), expelindo a solução em um prato para recuperação de embriões.
As limitações do método estão relacionadas principalmente às etapas críticas já mencionadas. Acreditamos que o ponto chave é a preparação da espátula. É preciso treinamento para executar uma boa espátula, mas uma vez aprendida, ela pode ser dominada. Como os meios são caseiros, esse método não pode ser usado em clínicas de reprodução humana.
A principal vantagem da Espátula MVD é que ela é um aparelho de baixo custo em relação aos comerciais9. Além disso, economiza espaço no dewar de nitrogênio líquido em comparação com a vitrificação de criotubo8. Testamos sua funcionalidade em embriões de camundongos e ovelhas em diferentes estágios. É particularmente mais simples, mais rápido, mais econômico e mais eficaz do que o método de congelamento lento.
Este método pode ser usado para vitrificar embriões de diferentes espécies de mamíferos não humanos em uma ampla gama de áreas de pesquisa.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Agradecemos a Alejo Menchaca por sua contribuição para o desenvolvimento da Espátula MVD. GS recebeu financiamento do Programa de Pós-Graduação em Biotecnologia - Facultad de Ciencias - Universidad de la República (https://webmasterbiotecnol.wixsite.com/biotec1) (Processo: GS 2437 347). GS, MNM e MC receberam financiamento do FOCEM - Fondo para la Convergencia Estructural del Mercosul (https://focem.mercosur.int/es/) (Grant Number: COF 03/11). GS e MC são bolsistas do Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación, Uruguai. (https://www.anii.org.uy/). Os financiadores (Programa de Pós-Graduação em Biotecnologia - Facultad de Ciencias -Universidad de la República; FOCEM - Fundo para a Convergência Estrutural do Mercosul; Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación, Uruguai) não tiveram nenhum papel no desenho do estudo, coleta e análise de dados, decisão de publicação ou preparação do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter | Sartorius | 16534 | Minisart syringe filter 0.2 µL |
| 0.5 mL straw | Minitube | 13408/0044 | French type medium paillette |
| Aspirator tube assembly | Sigma | A5177 | |
| Bunsen burner | Indulab | 7000134 | |
| Dimethyl sulfoxide | Sigma | D2650 | |
| Ethylene glycol | Sigma | 102466 | |
| Ficoll PM70 | Sigma | F2878 | Density gradient medium |
| Gel-loader tip | Eppendorf | 10411193 | |
| Glass capillary | Marienfeld | 2900000 | Microhaematocrit capillary tube |
| Gloves for LN2 handling | Tempshield | CE0338 | Cryogloves |
| Goblets | Minitube | 16913/1133 | |
| Goggles for LN2 handling | 3M | 40661-00000-10 | Anti-fog, anti-scratch coating |
| Hot plate | Labec | LA-SH-II-5B | Digital model |
| Identification rod | IMV technologies | 6326 | Non steril LG48 mm |
| Insulated styrofoam container | |||
| LN2 storage dewar | Taylor-Wharton | XT21-AI | Cryoscience |
| Long stainless-steel twezeers | Fine Science Tools | 11000-25 | |
| M2 | Sigma | M7167 | |
| PBS | Home-made | Phosphate Buffered saline. Usually 1 L of concentrated 5x buffer is prepared and then diluted to 1x. Recipe: 40 g sodium chloride, 1 g potassium chloride, 7.2 g anhydrous disodium phosphate, 1.2 g monopotassium phosphate. Add distilled water and sterilize by autoclave. | |
| Plastic Petri dish | Falcon | 351029 | Not TC-treated Bacteriological Petri Dish |
| Stereomicroscope | Olympus | SZ2-LGB | |
| Sucrose | Sigma | S1888 | |
| Watchmaker’s #5 forceps | Fine Science Tools | 11254-20 |
Referências
- Crispo, M., Meikle, M. N., Rülicke, T. Cryopreservation of Valuable Mouse and Rat Lines. Rodent Quality Control: Genes and Bugs. Laboratory Animal Science and Medicine. , Springer. Cham. (2024).
- Lloyd, K., Franklin, C., Lutz, C., Magnuson, T. Reproducibility: use mouse biobanks or lose them. Nature. 522 (7555), 151-153 (2015).
- Hart-Johnson, S., Mankelow, K. Archiving genetically altered animals: a review of cryopreservation and recovery methods for genome-edited animals. Lab Anim. 56 (1), 26-34 (2022).
- Shaw, J. M., Jones, G. M. Terminology associated with vitrification and other cryopreservation procedures for oocytes and embryos. Hum Reprod Update. 9 (6), 583-605 (2003).
- Arav, A. Cryopreservation of oocytes and embryos. Theriogenology. 81 (1), 96-102 (2014).
- dos Santos Neto, P. C., et al. Cryotolerance of Day 2 or Day 6 in vitro produced ovine embryos after vitrification by Cryotop or Spatula methods. Cryobiology. 70 (1), 17-22 (2015).
- Renard, J. P., Babinet, C. High survival of mouse embryos after rapid freezing and thawing inside plastic straws with 1-2 propanediol as cryoprotectant. J Exp Zool. 230 (3), 443-448 (1984).
- Tsang, W. H., Chow, K. L. Mouse embryo cryopreservation utilizing a novel high-capacity vitrification spatula. Biotechniques. 46 (7), 550-552 (2009).
- Kuwayama, M. Highly efficient vitrification for cryopreservation of human oocytes and embryos: the Cryotop method. Theriogenology. 67 (1), 73-80 (2007).
- Nakao, K., Nakagata, N., Katsuki, M. Simple and efficient vitrification procedure for cryopreservation of mouse embryos. Exp Anim. 46 (3), 231-234 (1997).
- National Research Council. Guide for the Care and Use of Laboratory Animals. , National Academies Press. Washington, DC. (1996).
- du Sert, N. P., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biol. 18 (7), e3000410(2020).
- Meikle, M. N., Schlapp, G., Menchaca, A., Crispo, M. Minimum volume Spatula MVD vitrification method improves embryo survival compared to traditional slow freezing, both for in vivo and in vitro produced mice embryos. Cryobiology. 84, 77-81 (2018).
- Momozawa, K., et al. Efficient vitrification of mouse embryos using the Kitasato Vitrification System as a novel vitrification device. Reprod Biol Endocrinol. 15 (1), 29(2017).
- Stringfellow, D. A., Givens, M. D. Manual of the International Embryo Transfer Society: A Procedural Guide and General Information for the use of Embryo Transfer Technology Emphasizing Sanitary Procedures. , International Embryo Transfer Society. (2010).
- Dos Santos-Neto, P. C., Cuadro, F., Barrera, N., Crispo, M., Menchaca, A. Embryo survival and birth rate after minimum volume vitrification or slow freezing of in vivo and in vitro produced ovine embryos. Cryobiology. 78, 8-14 (2017).
- Schlapp, G., Meikle, M. N., Pórfido, J. L., Menchaca, A., Crispo, M. Zygote cryobanking applied to CRISPR/Cas9 microinjection in mice. PLoS One. 19 (7), e0306617(2024).
- Kamoshita, M., et al. Recent advances of oocyte/embryo vitrification in mammals from rodents and large animals. Anim Sci J. 95 (1), e13931(2024).
- Qiu, J., et al. Equilibrium vitrification of mouse embryos using low concentrations of cryoprotectants. Cryobiology. 98, 127-133 (2021).
- Tsang, W. H., Chow, K. L. Cryopreservation of mammalian embryos: Advancement of putting life on hold. Birth Defects Res C Embryo Today. 90 (3), 163-175 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados