Method Article
포유류 배아의 유리화를 위한 주걱 몬테비데오 장치
요약
여기에서는 홈메이드 주걱으로 구성되고 홈메이드 솔루션을 활용하여 마우스와 양의 착상 전 배아를 유리화하기 위한 Spatula Montevideo 프로토콜을 제시합니다. 배아는 농도가 증가하는 두 개의 동결 보호 용액에서 빠르게 평형을 이루고, 주걱에 적재되고, 액체 질소에 담근 다음, 최종적으로 0.5mL 빨대로 밀봉됩니다.
초록
이 연구는 MVD(Spatula Montevideo)로 알려진 마우스 및 양 배아 동결 보존을 위한 효율적이고 비용 효율적인 유리화 방법을 설명합니다. 이 프로토콜은 겔 로더 팁으로 준비된 수제 주걱을 캐리어 장치로 사용합니다. 배아는 농도가 증가하는 두 개의 수제 동결 보호 용액에서 빠르게 평형을 이루고 주걱에 적재된 다음 액체 질소에 직접 담근다. 약 30-40개의 착상 전 단계 마우스 배아를 주걱에 적재할 수 있으며, 이후 0.5mL 빨대로 밀봉합니다. 유리화된 배아를 저장하는 데 자주 사용되는 cryotube 대신 주걱을 사용하면 액체 질소 듀어의 공간을 최적화할 수 있습니다. 또한, 온난화 과정에는 배아를 재수화하고 형태를 복원하기 위해 농도가 감소하는 수제 자당 용액만 필요합니다. 우리 실험실은 10년 이상 동안 쥐와 양의 착상 전 배아를 위해 Spatula Montevideo를 성공적으로 사용해 왔습니다. Spatula Montevideo는 마우스 배아에서 평균 84%의 회수율(회수/유리화 배아)과 97%의 생존율(생존/회수 배아)을 보여주었습니다. 쥐 배아의 유리화(vitrification)는 느린 동결보다 더 나은 결과를 낳았지만, 생식 결과(임신, 출산 및 출산율)에는 차이가 관찰되지 않았습니다. 양 배아의 경우, Spatula Montevideo를 사용하면 상용 장치와 비교하여 유사한 생존 및 배아 발달 속도가 달성되었습니다. 임신율은 상용 기기가 더 높았지만, 어린 양의 생존율은 기기 간에 큰 차이가 없었다. 주걱 몬테비데오 유리화법(Spatula Montevideo vitrification method)은 잉여 배아를 저장하고, 유전자 변형 마우스 계통 및 양 모델을 백업하며, 전 세계 연구자들 간의 교환을 촉진하는 데 사용할 수 있는 간단한 동결 보존 기술입니다.
서문
유전자 변형(GM) 동물 생성의 효율성은 엔도뉴클레아제 기반 방법, 특히 CRISPR/Cas9의 개발로 인해 크게 증가했습니다. 전 세계의 많은 실험실에서 유전자 부동을 방지하고 원래 표현형1의 무결성을 유지하기 위해 냉동 보존해야 하는 다양한 GM 마우스 및 쥐 계통을 생산합니다. 또한 보관을 통해 지속적인 번식의 필요성을 없애주어 종종 과도한 동물 수를 초래합니다. 일부 실험실에서는 GM 마우스 계통을 냉동 보존된 배아 또는 정자로 국제 저장소로 보내 살아있는 동물의 수송을 피하면서 이러한 모델의 교환을 용이하게 합니다. 이를 통해 동일한 GM 동물 모델을 반복적으로 생성하지 않고도 라인에 접근할 수 있습니다2. 이러한 이유로 배아 및 정자 동결 보존은 모든 GM 동물 시설에서 가장 중요합니다. 일반적으로 배아 동결 보존은 배아가 변형된 완전한 이배체 게놈을 포함하고 배아 이식을 통해 쉽게 회수할 수 있기 때문에 GM 계통을 저장하는 데 선호됩니다.
유리화(Vitrification)는 세포로 들어가는 물과 세포 주위에 세포외 결정을 형성하는 물 사이의 불균형을 특징으로 하는 비평형 과정입니다. 이 방법은 세포 내 얼음 결정의 형성을 방지하여 서속 동결 방법(SLF)3과 구별됩니다(그림 1 참조). 고농도의 동결 방지제와 액체 질소(LN2)와의 직접 접촉으로 초고속 냉각(~40°C/s)이 가능하여 몇 초 내에 샘플의 유리체 상태를 달성할 수 있습니다. 또한 유리화는 저속 냉동보다 빠르고 쉬우며 저렴합니다4. 최소한의 LN2가 필요하며 일반적으로 상업적으로 구매하거나 집에서 만들 수 있는 간단한 장비를 사용합니다(그림 1 참조).
또한 온난화 과정은 일반적으로 빠르고 복제 가능합니다. 동결 방지제 독성을 피하고 유리체 상태를 유지하기 위해 신속하게 수행해야 합니다3. 배아를 동결할 때 많은 실험실에서는 운반 장치의 편리함, 신뢰성, 견고성, 보유 용량 및 비용을 고려합니다.
우리는 양과 쥐 배아의 일상적인 동결 보존을 위해 MVD(Spatula Montevideo) 장치6을 사용하여 최소 부피의 주걱 유리화 방법을 선호합니다. 처음에는 서서냉 방법7 을 사용했지만 빠르게 유리화로 전환했습니다. LN2 듀어를 위한 더 간단하고 공간 효율적인 장치를 만들기 위해 Tsang and Chow (2009)8의 수제 주걱을 cryotube에 연결하여 0.5mL 빨대로 밀봉된 주걱 MVD를 개발했습니다( 재료 표 참조). 주걱에는 젤 로더 팁( 재료 표 참조)이 있으며, 여기서 약 1mm²의 플랫폼은 미세한 집게로 팁을 부드럽게 녹여 형성되어 배아를 적재하기 위한 꽃잎 모양의 플레이트를 만듭니다. 이 플랫폼은 작은 유리화 방울에 최대 40개의 마우스 배아를 수용할 수 있습니다. 식별 플러그 로드( 재료 표 참조)는 겔 로더 팁의 열린 끝단에 삽입됩니다.
이 방법의 목적은 간단하고 빠르며 저렴한 방법으로 배아를 유리화하는 것이며, 이를 통해 질소 듀어의 공간을 절약할 수 있습니다. 이 시스템은 수년 동안 성공적으로 사용되어 왔으며 특히 마우스 배아에서 우수한 배아 생존율(~97%)과 생식 결과를 제공합니다. 주걱 MVD는 실험실에서 준비하기 때문에 상용 장치에 비해 저렴한 방법입니다9. 또한, 극저온 튜브 8,10의 사용에 비해 질소 듀어의 공간을 절약합니다.
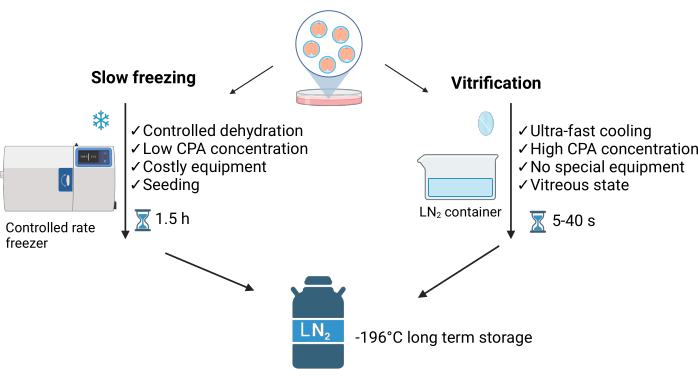
그림 1: 배아 동결 보존에 사용되는 두 가지 주요 기술의 비교. 이 그림은 Crispo et al.1의 허가를 받아 수정되었습니다. BioRender.com 년에 생성되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
쥐 배아를 얻기 위해 사용된 동물은 국내법 18.611 및 국제 동물 관리 지침11에 따라 수용 및 처리되었습니다. 실험 프로토콜(허가 번호 #007-18)은 몬테비데오 파스퇴르 연구소 동물 보호 및 사용 위원회(Institut Pasteur de Montevideo Animal Care and Use Committee)에 의해 적절한 시기에 승인되었습니다(서면 동의서가 제공되었습니다). 양의 난모세포/배아에 대한 실험 프로토콜은 ARRIVE 가이드라인12 을 준수하고 국제 동물 관리 가이드라인11에 따라 수행되었으며, Institutional Animal Care Committee Fundación IRAUy (protocol #001-2017)에 의해 승인되었다.
1. 유리화(그림 2)
- 주걱 MVD 준비
- 처음 10mm와 팁 콘을 잘라 젤 로더 팁( 재료 표 참조)을 줄입니다.
참고: 이렇게 하면 더 짧고 곧은 팁이 생성되어 0.5mL 빨대로 최종 밀봉을 용이하게 합니다( 재료 표 참조). - 팁에서 약 5cm 떨어진 곳에서 워치메이커의 #1.0 집게( 재료 표 참조)로 젤 로더 팁의 끝을 잡습니다. 팁을 분젠 버너( 재료 표 참조)의 화염에 부드럽게 넣고 8-10초 동안 유지하여 약 1mm2의 꽃잎 모양 플랫폼을 형성합니다.
- 불에서 내리고 집게로 5초 동안 단단히 잡습니다.
- 실체 현미경 ( 재료 표 참조)을 사용하여 꽃잎 모양의 플랫폼 (~ 1mm2)이 형성되고 원위 가장자리가 밀봉되어 있는지 확인하십시오.
참고: 플랫폼은 유리화 중 LN2 침투를 방지하기 위해 말단 끝에서 닫아야 합니다. 플랫폼이 깨끗하고 플라스틱 나사산이 없는지 확인하십시오. 너무 작거나 나사산이 있는 경우 팁을 자르고 절차를 반복하십시오. - 1.1.1-1.1.4 단계를 반복하여 필요한 수의 주걱을 준비합니다(주걱 1개 = 최대 40개의 마우스 배아).
- 자외선(UV) 또는 에틸렌 옥사이드를 사용하여 주걱을 살균하고 멸균 튜브 또는 상자에 보관하십시오.
- 유리화 당일에는 주걱을 회수하여 플랫폼의 반대쪽 끝에서 처리합니다. 각 주걱에 식별 막대( 재료 표 참조)를 삽입하고 실체 현미경 베이스에 놓습니다. 막대에 영구 마커 또는 액체 질소 내성 스티커 라벨로 레이블을 지정합니다.
알림: 주걱을 다룰 때는 항상 플랫폼을 만지지 마십시오. 전체 장치(주걱 + 0.5mL 빨대 + 식별 막대)의 총 길이는 잔 길이의 1cm를 초과해서는 안 됩니다.
- 처음 10mm와 팁 콘을 잘라 젤 로더 팁( 재료 표 참조)을 줄입니다.
- 유리화 용액의 준비
- FS 용액을 준비합니다: 1.5g의 밀도 구배 매체( 재료 표 참조)와 0.85g의 자당( 재료 표 참조)을 5mL의 인산염 완충 식염수(PBS, 재료 표 참조)에 용해합니다. 끓는 물에 완전히 녹을 때까지 가열한 다음 0.22μm 필터를 사용하여 멸균합니다( 재료 표 참조).
참고: 이 용액은 최대 6개월 동안 4°C에서 보관할 수 있습니다. - 유리화 전 용액(PV) 준비: 유리화 당일에 10% 에틸렌 글리콜( 재료 표 참조), 10% 디메틸 설폭사이드( 재료 표 참조) 및 80% M2 매체( 재료 표 참조)를 혼합합니다. 5개의 주걱에 대해 총 100μL의 부피가 필요합니다.
- 유리화 용액 준비(V): 유리화 당일에 15% 에틸렌 글리콜, 15% 디메틸 설폭사이드, 10% M2 배지 및 60% FS 용액을 결합합니다. 5개의 주걱에 대해 총 부피 100μL가 필요합니다.
- FS 용액을 준비합니다: 1.5g의 밀도 구배 매체( 재료 표 참조)와 0.85g의 자당( 재료 표 참조)을 5mL의 인산염 완충 식염수(PBS, 재료 표 참조)에 용해합니다. 끓는 물에 완전히 녹을 때까지 가열한 다음 0.22μm 필터를 사용하여 멸균합니다( 재료 표 참조).
- 배아 탈수 및 유리화 과정
- LN2 준비: LN2 를 적절한 용기(예: 10cm x 30cm x 20cm 절연 폴리스티렌 용기)에 붓고 사용할 주걱만큼 0.5mL 빨대를 놓습니다.
참고: LN2 하에서 조작하는 동안 주걱 플랫폼의 시각화를 용이하게 하기 위해 착색된 바닥 절연 폴리스티렌 용기를 사용하여 대비 효과를 생성하는 것이 좋습니다.
주의: LN2를 다룰 때는 적절한 고글과 장갑(재료표 참조)을 착용하십시오. - 용액 준비: 100mm 플라스틱 페트리 접시( 재료 표 참조)에 각 주걱에 대해 100μL의 M2, 20μL의 PV 용액 및 20μL의 V 용액을 떨어뜨립니다.
- 유리화 배아: 유리화할 배아를 M2 드롭에 넣습니다. 한 번에 30-40개의 배아를 처리하고, PV 용액 드롭에서 30초 동안 배양한 다음 실온(RT)에서 30초 동안 V 용액 드롭에서 배양합니다.
- 흡입기 튜브 어셈블리와 함께 인발 유리 모세관( 재료 표 참조)을 사용합니다( 재료 표 참조). 배아를 배치하기 전에 최소 1 μL의 각 용액을 모세관에 미리 로드합니다.
참고: 배아는 방울에서 다른 높이에 있으므로 실체 현미경 마이크로미터를 조정하여 배아의 위치를 파악하십시오. 10초가 남았을 때 각 방울에서 배아를 회수합니다. 모든 배아 조작은 실체현미경 하에서 수행되어야 합니다. - 배아 로드: 최소 V 용액(예: ~ 0.1 μL)을 사용하여 배아를 흡인하고 주걱 플랫폼에 빠르게 놓습니다.
- LN2에 담그기: 배아를 적재한 후 즉시 주걱 플랫폼을 LN2 에 5초 동안 담그십시오(막대를 잡고 손으로 주걱을 잡습니다). 그런 다음 주걱을 LN2 증기로 유지하면서 긴 스테인리스 스틸 핀셋을 사용하여 0.5mL 빨대로 밀봉합니다( 재료 표 참조).
알림: 예열 중 팽창을 방지하기 위해 밀봉하기 전에 빨대에서 LN2 를 제거하십시오. 배아 방울과 빨대 벽 사이의 접촉을 방지하기 위해 주걱과 빨대가 제대로 정렬되었는지 확인하십시오. 편의상 밀봉된 주걱은 모든 주걱에 배아가 적재될 때까지 LN2 용기에 남아 있을 수 있으며 필요에 따라 LN2 로 다시 채워질 수 있습니다. - 절차 반복: 새로운 PV 및 V 방울 쌍을 사용하여 각 배아 그룹에 대해 1.3.3-1.3.7단계를 반복합니다.
- 보관: 주걱을 잔으로 옮긴 다음( 재료 표 참조) LN2 저장 듀어로 옮깁니다( 재료 표 참조).
- LN2 준비: LN2 를 적절한 용기(예: 10cm x 30cm x 20cm 절연 폴리스티렌 용기)에 붓고 사용할 주걱만큼 0.5mL 빨대를 놓습니다.

그림 2: Spatula MVD를 사용한 유리화 공정 계획. 자세한 내용은 텍스트를 참조하십시오. BioRender에서 생성되었습니다. 마이클, M. (2025) https://BioRender.com/x96y902. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 온난화(그림 3)
- 용액 준비
- 2.5mL의 M2 배지에 0.85g의 자당을 용해시키는 1M 자당 용액을 준비합니다. 0.22μm 필터로 용액을 멸균합니다.
참고: 이 용액은 최대 1주일 동안 4°C에서 준비하고 보관할 수 있습니다. - 1M 슈크로스 용액을 적절한 부피의 M2 매체로 희석하여 0.5M 및 0.25M 슈크로스 용액을 준비합니다.
- 온난화가 시작될 때까지 자당 용액을 핫 플레이트( 재료 표 참조)에서 37°C로 유지합니다.
- 2.5mL의 M2 배지에 0.85g의 자당을 용해시키는 1M 자당 용액을 준비합니다. 0.22μm 필터로 용액을 멸균합니다.
- 온난화 플레이트 준비
- 100mm 플라스틱 페트리 접시에 0.5M 자당 500μL 방울, 0.5M 자당 50μL 방울, 0.5M 자당 50μL 방울 및 0.25M 자당 50μL 방울을 가열합니다. M2 배지 3방울(각 100μL)을 떨어뜨려 세척합니다.
- 온난화 과정
참고: 온난화 과정은 실온, 예를 들어 실체현미경 바닥에서 20-22°C와 같이 RT에서 발생합니다.- 듀어에서 봉인된 주걱을 회수하십시오. LN2와 함께 적절한 용기에 넣습니다. 그림 3을 참조하십시오.
- 실체현미경에 온난판을 놓습니다. 한 번에 하나씩 스테인리스 스틸 핀셋으로 주걱 바닥을 잡고 장갑을 낀 손으로 식별 막대를 꺼낸 다음 빨대를 꺼냅니다. 배아가 포함된 플랫폼을 500μL의 0.5M 자당 방울에 빠르게 담그십시오.
- 모든 배아가 낙하 속으로 떨어졌는지 확인하십시오. 필요한 경우 주걱을 부드럽게 움직여 분리를 돕습니다. 배아를 풀드 유리 모세관에 넣고 0.5M 자당 용액의 50μL 방울에 넣고 2분 동안 배양합니다.
- 배아를 0.25M 자당 용액의 50μL 방울에 넣고 2분 더 배양합니다.
참고: 각 용액에 배아를 넣기 전에 사용할 용액을 모세관에 미리 로드합니다. - 마지막으로, 배아를 M2 배지 방울로 세 번 씻어 자당을 제거합니다.
- 사용하기 전에 최소 1시간 동안 각 종에 적합한 조건에서 배아를 배양합니다.
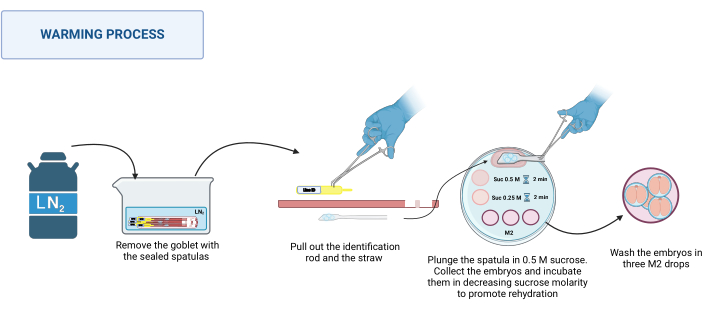
그림 3: 주걱 MVD 가온 과정의 계획. 자세한 내용은 텍스트를 참조하십시오. BioRender에서 생성되었습니다. 마이클, M. (2025) https://BioRender.com/k91k191. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
우리는 처음에 프로필렌 글리콜 용액, 빨대 및 제어 속도 동결 장비를 기반으로 하는 전통적인 서저동결 방법을 사용했습니다7. 그러나 유리화법이 잠재적으로 더 쉽고 비용 효율적인 옵션이라고 생각한 후, 8세포 in vivo 유래 및 2세포 in vitro 생산 마우스 배아에서 기존의 서저냉동(SLF)과 주걱 MVD의 결과를 비교하기 위한 연구를 수행했습니다13(표 1 및 표 2). 결과는 "회수율(recovery rate)"이라는 용어로 제시되며, 이는 동결 보존된 배아의 총 수를 가난한 후 장치에서 회수된 배아의 수를 정의합니다. "생존율"은 장치에서 회수된 배아에 비해 생존 가능한 배아의 수를 나타냅니다. 배아는 할구가 손상되지 않은 경우(2세포 배아에서 2개의 할구와 8세포 배아에서 최소 4개의 할구)에서 생존 가능한 것으로 간주되었습니다14. 이 용어는 장치 및 전체 프로세스가 냉동 보존에 적합한지 여부를 평가하는 데 사용됩니다.
생쥐 배아의 SLF 그룹보다 주걱 MVD에서 성교 후 3.5일째 되는 날의 생존율(표 1 및 표 2)과 발달률(dpc; 예: 모룰라 및 배반포 배아, 표 1)이 유의하게 높았습니다. 두 방법 모두 허용 가능한 부화율에 도달했지만, 예상대로 대조군 신선 그룹보다 현저히 낮았습니다(유리화되지 않은 배아; 표 1). 유리화/가온 및 대조군 신선한 2세포 배아를 수혜 암컷에게 이식한 결과, 임신율(임신/총 이식 암컷)과 출생률(총 수혜 암컷에서 새끼 출생/이식 배아; 표 2). 이러한 결과는 SLF 방법에서 유리화로 전환하도록 이끌었습니다.
| 배아의 Nº | 2.5 dpc에서 생존율(장치에서 생존/회수된 배아) | 3.5 dpc에서 배아 발달률(morulae-blastocysts/viable embryos) | 5.5 dpc에서 부화 속도(부화한 배반포/배양 배아) | |
| 서서히 얼어붙는 | 410 | 89.3 % (366/410)a | 91.8 % (336/366)a | 49.7 % (90/181)a |
| 주걱 MVD | 341 | 92.7 % (316/341)비 | 97.2 % (316분의 307)비 | 41.0 % (68/166)a |
| 신선한 배아 | 458 | - | 98.7 % (452/458)비 | 67.8 % (139/205)비 |
표 1: 유리화(vitrification) 또는 서서히 동결된 8세포 쥐 배아의 생존 및 체외 발달 속도. 생체 내 8세포 쥐 배아를 주걱 MVD 또는 서서히 동결하여 동결 보존하고 신선한 배아와 비교했습니다. 신선한 배아는 2.5 dpc에서 암컷으로부터 수집하여 다른 그룹과 동일한 조건에서 배양했습니다. 생존율(장치에서 생존 가능한/회복된 배아)은 온난화/해동 후에 결정되었습니다. 생존 가능한 배아는 체외 배양되었습니다. 배아 발달 속도(morulae-blastocysts/viable embryos) 및 부화 속도(부화/배양 배아)는 각각 3.5 dpc 및 5.5 dpc로 측정되었습니다. 다른 위 첨자는 유의한 차이를 나타냅니다(P < 0.05).
| 배아의 Nº | 회수율(장치/동결 보존된 배아에서 회수) | 생존율(장치에서 생존 가능한/회복된 배아) | 임신율(임산부/이식 여성) | 총 이식 암컷의 출생률(새끼 출생/이식 배아) | |
| 서서히 얼어붙는 | 531 | 88.3 % (469/531)a | 85.1 % (399/469)a | - | - |
| 주걱 MVD | 431 | 84.2 % (363/431)a | 94.7 % (344/363)비 | 53.3 % (8/15)가 | 17.8 % (47/264)a |
| 신선한 배아 | 446 | - | 97.7 % (436/446)비 | 53.3 % (8/15)가 | 20.6 % (53/257)a |
표 2: 유리화(vitrification) 또는 서서히 동결된 2세포 쥐 배아의 회수율 및 생존율. 유리화/온난화 배아 대 신선 배아의 생식 결과.시험관내에서 생산된 2세포 배아는 주걱 MVD 또는 SLF에 의해 동결 보존되었습니다. 회복(장치/동결 보존된 배아에서 회수) 및 생존율(장치에서 생존/회수된 배아)은 가온 또는 해동 후에 결정되었습니다. 생존 가능한 따뜻하고 신선한 배아를 수혜 암컷(그룹당 15명의 암컷, 암컷당 ~17개의 배아)에게 이식했습니다. 임신(임신/이식된 암컷)과 출산(새끼 출생/이식된 배아) 비율을 측정했습니다. 다른 위 첨자는 유의한 차이를 나타냅니다(P < 0.05).
주걱 MVD는 또한 체외에서 생산된 양 착상 전 배아의 유리화에 대해 테스트되었으며 상용 장치와 비교되었습니다6. 결과는 표 3에 나타나 있습니다. 배아의 질은 IETS(International Embryo Technology Society)15에서 권장하는 기준에 따라 형태학에 의해 평가되었으며, 우수하고 우수한 1등급 배아를 각 실험 그룹에 할당했습니다.
생존율(온난화 후 각각 ~70% 및 ~16%, 3시간 또는 24시간)이나 8일째에 부화하는 배아 모두 유리화법의 영향을 받지 않았습니다. 8일째 되는 날의 배반포의 비율은 두 유리화(vitrification) 기법 모두에서 대조군(신선 배아)에 비해 낮았다(각각 ~8% 대 20.5%; P < 0.05). 이러한 결과는 시험관 에서 생산된 양 배아도 주걱 MVD를 사용하여 유리화할 수 있음을 시사합니다. 또한, 이전 결과는 서서히 동결된 양 배아, 주걱 MVD 또는 상업용 장치를 수혜 암컷에게 이식함으로써 보완되었습니다16. 결과는 표 4에 나타나 있다. 배아 생존율(30일째 생존 배아/이식 배아), 임신율(임신/이식 암양), 임신부터 출생까지의 태아 손실(출생 시 평가된 어린 양/30일째에 생존 가능한 배아), 어린 양 생존율(출생 후 1주일 후 살아있는 어린 양/태어난 어린 양)을 실험 그룹 간에 평가했습니다.
그 결과, 배아 이식 후 배아 생존율은 SLF(26.5%)와 주걱 MVD(22.2%)에서 비슷했지만 상용 의료기기 그룹(52.0%, P < 0.05)에서 더 높았다. 생식 결과(임신 기간, 태아 손실, 출생 체중 및 어린 양 생존율)는 냉동 보존 방법에 의해 크게 영향을 받지 않았습니다. 전반적으로 주걱 MVD는 난소 착상 전 배아의 유리화에 적합한 방법이기도 합니다.
| 배아 N° | 생존율 % (생존 가능/냉동 보존 배아) | 발달률 % (6일째 모낭포/절단된 배아) | 부화율 % (부화한 배반포/절단된 배아) | ||
| 3시간 | 24시간 | ||||
| 주걱 MVD | 165 | 69.6 ± 2.4암페어 | 14.6 ± 3.5암페어 | 11.1 ± 2.1b | 6.4 ± 1.9b |
| 상용 장치 | 165 | 71.3 ± 1.3암페어 | 17.7 ± 4.5암페어 | 12.7 ± 3.2b | 10.2 ± 2.9b |
| 대조군(신선 배아) | 408 | - | - | 41.3 ± 3.7암페어 | 20.5 ± 4.5암페어 |
표 3: Spatula MVD 또는 상용 장치에 의해 유리화(vitrification)를 거친 양 배아의 생존 및 체외 발달 속도.시험관내에서 생산된 2-8개의 세포기 배아(수정 후 2일차)를 주걱 MVD 또는 상용 장치를 사용하여 유리화한 후 가온했습니다. 생존율(생존/동결 보존)은 온난화 후 3시간 및 24시간에 분석되었습니다. 발달 및 부화율은 절단된 (2-8 세포) 배아의 수에 대해 각각 6일째에 얻은 모낭포 및 배반포의 수와 부화한 배아의 수로 정의되었습니다. 같은 열에 있는 다른 위 첨자는 유의한 차이를 나타냅니다(P < 0.05). 데이터는 평균 ± SEM으로 표시됩니다.
| 배아 생존(30일째에 생존 가능한 배아/이식된 배아) | 임신율(임산부/이식 암양) | 태아 손실(출생 시 접근한 출생 어린 양/30일째에 생존 가능한 배아) | 임신 기간 (d) | 출생 체중 (g) | 어린 양 생존율(출생 후 1주일 후 살아있는 새끼 양/태어난 새끼 양) | |
| 주걱 MVD | 22.2 %a (28/126) | 32.9 %ᅡ (25/76) | 4.0 %ᅡ (1/25) | 150.7 ± 1.8암페어 | 4102 ± 112.4ᅡ | 87.5 %a (21/24) |
| 상용 장치 | 52.0 %b (91/175) | 66.0 %b (62/94년) | 11.0 %ᅡ (8/73) | 150.4 ± 1.9ᅡ | 3980 ± 221.2ᅡ | 83.1 %a (54/65) |
| 서서히 얼어붙는 | 26.5 %a (36/136) | 38.3 %a (28/73) | 6.7 %a (2/30) | 150.4 ± 2.1암페어 | 4319 ± 107.3암페어 | 89.3 %ᅡ (25/28) |
표 4: 냉동 보존 방법이 이식 후 배아 생존, 임신 유지 및 어린 양 생산에 미치는 영향. 생체 내 또는 시험관내에서 생산된 배아의 팽창된 배반포에 대한 모룰라를 유리화/서서히 동결 및 가온/해동을 거쳐 다층 메리노 동기화 암양으로 이식하였다. 배아 생존율(30일째 생존 배아/이식된 배아), 임신율(임신/이식된 암양), 임신부터 출생까지의 태아 손실(출생 시 접근한 양/30일째에 생존 가능한 배아), 재태 기간(d), 출생 체중(g) 및 양 생존율(출생 후 1주일 후 살아있는 양/태어난 양)을 실험군에서 비교했습니다.
또한, 본 시설에서 더 이상 사용되지 않는 유전자 변형 마우스 라인은 Spatula MVD 방법을 사용하여 2세포 배아로 백업되었습니다. 주로 시험관 수정(또는 자연 교배)에 의해 생산된 최소 300개의 2세포 배아를 각 마우스 계통에 대해 유리화했습니다. 이 과정의 품질 관리는 각 계통의 2개 또는 3개의 주걱을 데우고 배아를 가성 임신한 여성 수혜자에게 이식하는 방식으로 수행되었습니다. 서로 다른 유전자 변형 마우스 라인의 대표적인 결과가 표 5에 나타나 있습니다. 평균 회복률은 90.4%, 생존율은 96.8%였다. 임신율은 80%였고, 출산율은 평균 31.5%였다. 주목할 점은 출생률이 12%에서 45%까지 다양한 결과를 보였다는 것인데, 이는 배아 민감성과 배아 이식 결과에 영향을 미칠 수 있는 다양한 유전자 변형 때문일 수 있습니다. 일반적으로 이러한 결과는 시설에서 이전에 얻은 결과와 일치했습니다.
| 마우스 라인 | 유리화된/가온된 배아의 수 | 회수율(장치/동결 보존된 배아에서 회수) | 생존율(장치에서 생존 가능한/회복된 배아) | 임신율(임산부/이식 여성) | 출생률(새끼 출생/이식 배아) |
| 1 | 60 | 83.3 % (50/60) | 96.0 % (48/50) | 50 % (1/2) | 19.4 % (7/36) |
| 2 | 35 | 100 % (35/35) | 100 % (35/35) | 100 % (1/1) | 39.1 % (9/23) |
| 3 | 43 | 76.7 % (33/43) | 84.8 % (28/33) | 100 % (1/1) | 38.8 % (7/18) |
| 4 | 41 | 92.6 % (38/41) | 97.3 % (37/38) | 100 % (2/2) | 31.4 % (11/35) |
| 5 | 66 | 98.4 % (65/66) | 100 % (65/65) | 100 % (3/3) | 36.6 % (22/60) |
| 6 | 70 | 94.2 %(66/70) | 95.4 % (63/66) | 33 % (1/3) | 12 % (6/50) |
| 7 | 74 | 87.8 % (65/74) | 100 % (65/65) | 100 % (3/3) | 45 % (27/60) |
| 평균의 | 90.4 % (352/389) | 96.8 % (341/352) | 80 % (12/15) | 31.5 % (89/282) |
표 5: 서로 다른 유전자 변형 마우스 라인의 2-세포 배아에서 수행된 품질 관리 유리화 공정의 대표적인 결과. GM 마우스 라인은 Spatula MVD 방법을 사용하여 2세포 배아(최소 300개 배아)로 백업되었습니다. 이 과정의 품질 관리는 각 계통의 2개 또는 3개의 주걱을 데우고 배아를 가성 임신한 여성 수혜자에게 이식하는 방식으로 수행되었습니다. 회복(장치/동결 보존된 배아에서 회수) 및 생존율(장치에서 생존/회수된 배아)을 가온 후 측정했습니다. 생존 가능한 온난화 배아를 2세포 단계에서 수혜자 암컷(라인당 1-3명의 암컷, 암컷당 ~18개의 배아)으로 이식했습니다. 임신(임신/이식된 암컷)과 출산(새끼 출생/이식된 배아) 비율을 측정했습니다.
마지막으로, 우리는 최근에 신선하고 유리화로 가열된 마우스 접합자에 CRISPR 시약을 미세주입한 다음 체외 배양 또는 가임신한 암컷에게 이식하는 비교 연구를 수행했습니다17. 목표는 주걱 MVD를 사용하는 유리화된 접합자가 B6D2F1/J 및 C57BL/6J 접합체에서 미세주입을 위한 배아의 적절한 공급원이 될 수 있는지 여부를 평가하는 것이었습니다. 회복율 및 생존율은 2-8개의 세포기 배아에 대해 얻은 이전 결과와 유사했습니다(표 6). 전반적으로, 유리화-가열된 접합자는 미세주입에서 살아남았고, 부화한 배반포로 발달하거나 살아있는 새끼를 생산했으며, CRISPR/Cas9 시스템에 의해 유도된 돌연변이를 보여주었습니다. 그러나 돌연변이 비율은 유리화 접합자(vitrified zygote)에서 새로운 접합자보다 현저히 낮았습니다. 접합자 크라이오뱅킹(Zygote cryobanking)은 필요에 따라 미세 주입 세션을 수행할 수 있는 배아의 대체 공급원인 것으로 보이며, 일년 내내 동물의 사육 및 유지 관리를 피하고 CRISPR 기술에서 3R의 구현을 향상시킵니다.
| 스트레인 접합자 | 동결 보존된 접합자의 Nº | 회수율(장치에서 복구/동결 보존된 배아) | 생존율(장치에서 생존 가능한/회복된 배아) |
| B6D2F1/J | 380 | 97.1 % (369/380) | 90.8 % (335/369) |
| C57BL/6J | 800 | 84.0 % (672/800) | 92.3 % (620/672) |
표 6: 유리화-가온 B6D2F1/J 및 C57BL/6J 접합자의 회복 및 생존율. B6D2F1/J 및 C57BL/6J 공여체 암컷으로부터 생체 내에서 생산된 접합자를 수집하고, 주걱 MVD로 유리화하고, 가온하였다. 회복(장치/동결 보존된 배아에서 회수) 및 생존(장치에서 생존/회수된 배아) 비율은 온난화 후 결정되었습니다.
토론
주걱 MVD는 조립이 쉽고 저렴하며 부피가 최소인 유리화 장치로, 배아 보유 용량이 높고 액체 질소 듀어 점유율이 최적입니다. 이 방법은 간단하고 빠르며 강력한 것으로 입증되었습니다. 평균적으로, 유리화 배아의 높은 배아 회수율 및 생존율(~90%)뿐만 아니라 마우스에서 배아 이식을 수행할 때 우수한 생식 결과(~80% 임신율 및 ~30% 출생률)를 달성했으며, 이는 다른 최소 부피 유리화 방법과 비교할 수 있습니다 18,19,20.
주걱 MVD 유리화 방법의 중요한 단계는 다음과 같습니다: (i) 주걱 준비. 이 기술에는 상당한 전문 지식이 필요합니다. 겸자로 가열하여 겔 로더 팁에서 생산된 플랫폼은 ~ 1mm2 가 되어야 하며 끝이 닫혀 있어야 합니다. 팁이 열려 있으면 온도 차이로 인해 가온 과정에서 자당 방울에 주걱을 넣을 때 기포가 형성될 수 있습니다. 거품은 배아 검색과 회복을 방해합니다. (ii) 유리화 용액에서의 배아 배양. 밀도가 높기 때문에 배아는 방울에서 다른 높이에 머무릅니다. 모든 배아의 빠른 흡인이 필요합니다. 배아가 실온에서 더 오랜 기간 동안 이러한 용액에 남아 있는 경우 독성이 예상됩니다. (iii) 주걱 유리화 방울. 플랫폼에서 배아를 포함하는 유리화 방울의 부피는 ~0.5-1.0 μL이어야 합니다. 동결 보호제 부피가 클수록 배아 생존력에 영향을 미칩니다. 필요한 부피를 운반할 수 있는 배아 크기보다 약간 더 넓은 내경을 가진 당긴 모세혈관을 사용하는 것이 좋습니다. 또한 플랫폼을 더 크게 떨어뜨리면 시스템을 닫을 때 벽 내부의 0.5mL 빨대에 끼일 가능성이 높아질 수 있습니다. (iv) 주걱 밀봉. 0.5mL 빨대로 주걱을 닫을 때 특별한 주의를 기울여야 합니다. 두 요소를 모두 정렬해야 합니다. 주걱에 있는 배아 방울은 방해받지 않아야 합니다. (v) 예열 중에는 막대 식별자와 0.5mL 빨대를 제거하는 순서를 따릅니다. 그렇지 않으면 식별자가 온도 차이에 의해 추방될 수 있습니다.
이 기술은 여러 단계에서 작업자 교육이 필요합니다. 주요 문제 해결은 주걱에서 배아를 회수하는 것일 수 있습니다. 주걱을 데울 때 유리화된 배아의 70-80% 미만이 회수되는 경우, 이는 (i) 배아가 주걱 플랫폼에 불완전하게 적재되거나 (ii) 시스템이 닫힐 때 배아가 0.5mL 빨대 내벽에 남아 있기 때문일 수 있습니다. 첫 번째 문제를 극복하기 위해, 배아가 들어 있는 방울의 로딩은 흡인기 튜브 어셈블리와 배아를 포함하는 동결 보호 매체가 로드된 당긴 모세관을 사용하여 실체 현미경 아래에서 수행해야 하며, 이를 통해 액체가 올바르게 흐를 수 있도록 합니다. 두 번째 문제의 경우, 가온 중 플랫폼에서 배아가 보이지 않으면 면 마개를 잘라 0.5mL 빨대를 열고 M2에서 0.5M 자당 500μL로 두 번 세척하여(섹션 2, 1단계 참조) 배아 회수를 위해 접시에 용액을 배출합니다.
이 방법의 한계는 주로 이미 언급한 중요한 단계와 관련이 있습니다. 핵심은 주걱 준비라고 생각합니다. 좋은 주걱을 만들기 위해서는 훈련이 필요하지만, 한 번 배우면 숙달할 수 있습니다. 배지는 수제이기 때문에 이 방법은 인간 생식 클리닉에서 사용할 수 없습니다.
주걱 MVD의 가장 큰 장점은 상용 장치에 비해 저렴한 장치라는 것입니다9. 또한 cryotube vitrification8에 비해 액체 질소 듀어의 공간을 절약합니다. 우리는 여러 단계에서 마우스와 양 배아에 대한 기능을 테스트했습니다. 특히 서속 냉동 방법보다 더 간단하고 빠르며 경제적이며 효과적입니다.
이 방법은 광범위한 연구 분야에서 다양한 비인간 포유류 종의 배아를 유리화하는 데 사용할 수 있습니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
Spatula MVD 개발에 기여한 Alejo Menchaca에게 감사드립니다. GS는 생명공학 대학원 프로그램인 Facultad de Ciencias - Universidad de la República (https://webmasterbiotecnol.wixsite.com/biotec1)로부터 자금을 지원받았습니다(보조금 번호: GS 2437 347). GS, MNM 및 MC는 FOCEM - Fondo para la Convergencia Estructural del Mercosur (https://focem.mercosur.int/es/)로부터 자금을 지원받았습니다(보조금 번호: COF 03/11). GS와 MC는 우루과이의 Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación의 펠로우입니다. (https://www.anii.org.uy/). 자금 제공자 (Biotechnology Postgraduate Program - Facultad de Ciencias -Universidad de la República; FOCEM - Fondo para la Convergencia Estructural del Mercosur; Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación, 우루과이)는 연구 설계, 데이터 수집 및 분석, 출판 결정 또는 원고 준비에 어떠한 역할도 하지 않았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter | Sartorius | 16534 | Minisart syringe filter 0.2 µL |
| 0.5 mL straw | Minitube | 13408/0044 | French type medium paillette |
| Aspirator tube assembly | Sigma | A5177 | |
| Bunsen burner | Indulab | 7000134 | |
| Dimethyl sulfoxide | Sigma | D2650 | |
| Ethylene glycol | Sigma | 102466 | |
| Ficoll PM70 | Sigma | F2878 | Density gradient medium |
| Gel-loader tip | Eppendorf | 10411193 | |
| Glass capillary | Marienfeld | 2900000 | Microhaematocrit capillary tube |
| Gloves for LN2 handling | Tempshield | CE0338 | Cryogloves |
| Goblets | Minitube | 16913/1133 | |
| Goggles for LN2 handling | 3M | 40661-00000-10 | Anti-fog, anti-scratch coating |
| Hot plate | Labec | LA-SH-II-5B | Digital model |
| Identification rod | IMV technologies | 6326 | Non steril LG48 mm |
| Insulated styrofoam container | |||
| LN2 storage dewar | Taylor-Wharton | XT21-AI | Cryoscience |
| Long stainless-steel twezeers | Fine Science Tools | 11000-25 | |
| M2 | Sigma | M7167 | |
| PBS | Home-made | Phosphate Buffered saline. Usually 1 L of concentrated 5x buffer is prepared and then diluted to 1x. Recipe: 40 g sodium chloride, 1 g potassium chloride, 7.2 g anhydrous disodium phosphate, 1.2 g monopotassium phosphate. Add distilled water and sterilize by autoclave. | |
| Plastic Petri dish | Falcon | 351029 | Not TC-treated Bacteriological Petri Dish |
| Stereomicroscope | Olympus | SZ2-LGB | |
| Sucrose | Sigma | S1888 | |
| Watchmaker’s #5 forceps | Fine Science Tools | 11254-20 |
참고문헌
- Crispo, M., Meikle, M. N., Rülicke, T. Cryopreservation of Valuable Mouse and Rat Lines. Rodent Quality Control: Genes and Bugs. Laboratory Animal Science and Medicine. , Springer. Cham. (2024).
- Lloyd, K., Franklin, C., Lutz, C., Magnuson, T. Reproducibility: use mouse biobanks or lose them. Nature. 522 (7555), 151-153 (2015).
- Hart-Johnson, S., Mankelow, K. Archiving genetically altered animals: a review of cryopreservation and recovery methods for genome-edited animals. Lab Anim. 56 (1), 26-34 (2022).
- Shaw, J. M., Jones, G. M. Terminology associated with vitrification and other cryopreservation procedures for oocytes and embryos. Hum Reprod Update. 9 (6), 583-605 (2003).
- Arav, A. Cryopreservation of oocytes and embryos. Theriogenology. 81 (1), 96-102 (2014).
- dos Santos Neto, P. C., et al. Cryotolerance of Day 2 or Day 6 in vitro produced ovine embryos after vitrification by Cryotop or Spatula methods. Cryobiology. 70 (1), 17-22 (2015).
- Renard, J. P., Babinet, C. High survival of mouse embryos after rapid freezing and thawing inside plastic straws with 1-2 propanediol as cryoprotectant. J Exp Zool. 230 (3), 443-448 (1984).
- Tsang, W. H., Chow, K. L. Mouse embryo cryopreservation utilizing a novel high-capacity vitrification spatula. Biotechniques. 46 (7), 550-552 (2009).
- Kuwayama, M. Highly efficient vitrification for cryopreservation of human oocytes and embryos: the Cryotop method. Theriogenology. 67 (1), 73-80 (2007).
- Nakao, K., Nakagata, N., Katsuki, M. Simple and efficient vitrification procedure for cryopreservation of mouse embryos. Exp Anim. 46 (3), 231-234 (1997).
- National Research Council. Guide for the Care and Use of Laboratory Animals. , National Academies Press. Washington, DC. (1996).
- du Sert, N. P., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biol. 18 (7), e3000410(2020).
- Meikle, M. N., Schlapp, G., Menchaca, A., Crispo, M. Minimum volume Spatula MVD vitrification method improves embryo survival compared to traditional slow freezing, both for in vivo and in vitro produced mice embryos. Cryobiology. 84, 77-81 (2018).
- Momozawa, K., et al. Efficient vitrification of mouse embryos using the Kitasato Vitrification System as a novel vitrification device. Reprod Biol Endocrinol. 15 (1), 29(2017).
- Stringfellow, D. A., Givens, M. D. Manual of the International Embryo Transfer Society: A Procedural Guide and General Information for the use of Embryo Transfer Technology Emphasizing Sanitary Procedures. , International Embryo Transfer Society. (2010).
- Dos Santos-Neto, P. C., Cuadro, F., Barrera, N., Crispo, M., Menchaca, A. Embryo survival and birth rate after minimum volume vitrification or slow freezing of in vivo and in vitro produced ovine embryos. Cryobiology. 78, 8-14 (2017).
- Schlapp, G., Meikle, M. N., Pórfido, J. L., Menchaca, A., Crispo, M. Zygote cryobanking applied to CRISPR/Cas9 microinjection in mice. PLoS One. 19 (7), e0306617(2024).
- Kamoshita, M., et al. Recent advances of oocyte/embryo vitrification in mammals from rodents and large animals. Anim Sci J. 95 (1), e13931(2024).
- Qiu, J., et al. Equilibrium vitrification of mouse embryos using low concentrations of cryoprotectants. Cryobiology. 98, 127-133 (2021).
- Tsang, W. H., Chow, K. L. Cryopreservation of mammalian embryos: Advancement of putting life on hold. Birth Defects Res C Embryo Today. 90 (3), 163-175 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유