Method Article
Subkutan apsede cerrahi implantlarda biyofilm oluşumunun kantitatif değerlendirmesi için benzersiz bir fare modeli
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, tek bir fare içinde aynı koşullar altında iki implantın bakterilerle aynı anda inkübasyonunu sağlayan implantla ilgili enfeksiyonların benzersiz bir deneysel modelini tanımlar. Ayrıca, optimize edilmiş karşılaştırmalı analitik yöntemler kullanarak implant yüzeylerinde biyofilm oluşumunun hassas bir şekilde değerlendirilmesine olanak tanır ve biyomalzemelerin antimikrobiyal özelliklerini değerlendirmek için gelişmiş teknikleri gösterir.
Özet
Ortopedik cerrahi prosedürler için antibakteriyel özelliklere sahip yeni bir biyomateryal geliştirmek için, patolojik durumu yakından taklit eden implantla ilgili enfeksiyonların deneysel bir hayvan modelinin oluşturulması çok önemlidir. Ek olarak, malzemeler üzerinde biyofilm oluşumunu değerlendirmek için kontrol numuneleri ile nicel bir karşılaştırma gereklidir. Bununla birlikte, her bireyin tek bir materyal ile implante edilmesini içeren mevcut hayvan modelleri, denekler arasındaki enfeksiyon durumunun heterojenliği nedeniyle tutarsız sonuçlar verebilir. Ayrıca, in vivo malzemeler üzerinde biyofilm oluşumunu doğru bir şekilde ölçmek zor olmaya devam etmektedir ve bulgular güvenilirlikten yoksun olabilir. Bu sorunları ele almak için, bu çalışma, iki implantın tek bir fare içinde kapalı bir ortamda bakterilerle aynı anda inkübasyonunu sağlayan ve kapsüllenmiş bir deri altı apse oluşturan, implantla ilişkili enfeksiyonun benzersiz bir fare modelini göstermiştir. Başlangıçta sırt derisinin altında olgun bir hava kesesi oluşturuldu. İki paslanmaz çelik tel bağlandı ve torbaya yerleştirildi, ardından Staphylococcus aureus'un biyolüminesans bir türü olan Xen 36'nın aşılanması yapıldı. Aşılamadan 14 gün sonra, tellerin etrafında deri altı bir apse oluşmuştu. Biyofilm, her bir telin yüzeyinden tamamen çıkarıldı ve çözünmüş bakteri süspansiyonları, implant üzerinde biyofilm oluşumunu değerlendirmek, koloni oluşturan birimleri belirlemek ve kantitatif polimeraz zincir reaksiyonu analizi yapmak için optimize edilmiş yöntemler kullanılarak doğru bir şekilde ölçüldü. Biyolüminesan bakterilerin lux operonundan yararlanarak, her bir tel üzerindeki biyofilm içindeki bakteri yükünü belirlemek için luxA ve 16S rRNA'nın nispi ekspresyon seviyeleri kullanıldı. Bu optimize edilmiş karşılaştırmalı analitik yaklaşım, tek bir fare modelinde tek tip enfeksiyon koşulları altında iki tel üzerinde biyofilm oluşumunun hassas değerlendirmelerini sağlar ve antibakteriyel özelliklere sahip biyomalzemelerin ilerlemesini kolaylaştırabilir.
Giriş
İmplant ilişkili enfeksiyonlar, cerrahi teknik ve implant tasarımındaki gelişmelere rağmen ortopedik cerrahide yüksek morbidite ve mortalite oranlarına neden olabilmeleri nedeniyle klinik ortamlarda önemli bir sorun olmaya devam etmektedir1. Ameliyathane ortamındaki modern aseptik kontrol standartları ve perioperatif antibiyotik profilaksisi için uygun protokoller sayesinde cerrahi implantlarla ilişkili enfeksiyon insidansı önemli ölçüde azalmış olsa da, primer cerrahide implantla ilişkili enfeksiyonların insidansı %2-5 oranında kalmaktadır2.
İmplant ile ilişkili enfeksiyonların altında yatan birincil mekanizma, implant yüzeylerinde mikroorganizmaları antibiyotiklerden ve bağışıklık sisteminden koruyan ve enfeksiyonun eradike edilmesini zorlaştıran bir biyofilm oluşmasıdır 3,4. Biyofilm oluşumunun ilk aşamasında implant yüzeyine bakteri yapışması çok önemli olduğundan, bakteri yapışmasını ve ardından biyofilm oluşumunu en aza indirmek, implantla ilişkili enfeksiyon riskini azaltmak için önemli bir stratejidir. Çeşitli implant teknolojilerinin antibakteriyel özelliklerine rağmen, bunlar hücre toksisitesi ve alerjiler gibi advers olaylar nedeniyle klinik olarak yaygın olarak kullanılmamaktadır 5,6,7,8. Bu nedenle, implantla ilişkili enfeksiyon riskini azaltmak için güvenliği, etkinliği, stabiliteyi ve dayanıklılığı uyumlu hale getiren antibakteriyel implantlar için hala karşılanmamış bir klinik ihtiyaç vardır. Antibakteriyel özelliklere sahip implantların araştırılması ve geliştirilmesi, bu sorunların üstesinden gelmek için cerrahi teknolojiyi ilerletebilir.
Küçük hayvan modelleri kullanılarak çeşitli biyomalzemelerin antibakteriyel özelliklerinin değerlendirilmesi, daha büyük hayvan modellerine ve klinik çalışmalara geçmeden önce çok önemlidir9. Çok sayıda çalışma, luxABCDE operonu 10,11,12,13,14,15 içeren bir biyolüminesan bakteri kullanılarak implantla ilişkili enfeksiyonların uygulanabilir fare modellerini göstermiştir. Bu modeller, antibakteriyel implantlar veya teknolojiler geliştirmeye yönelik araştırmaları hızlandırırken, bazı sınırlamaları vardır. İlk olarak, fare modellerine yerleştirilen implantlar üzerindeki bakteri yükünü doğrudan ve doğru bir şekilde değerlendirmek için genellikle X-ışınları veya özel görüntüleme sistemleri gibi gelişmiş uzmanlık ve özel ekipman gerekir. İkincisi, toplanan implantlar tipik olarak hayvan başına tek bir enfeksiyon bölgesinde tek bir implantı değerlendirirken, enfeksiyon koşulları ve immünolojik yanıtlar bireyler arasında farklılık gösterebilir ve bu da potansiyel olarak karşılaştırmalı değerlendirmelerin sonuçlarında değişkenliğe yol açabilir. Bu nedenle, çeşitli biyomalzemelerin antibakteriyel etkilerini in vivo olarak karşılaştırırken, bunları tek tip ortamlarda bakterilerle implante etmek ve aşılamak, bu sorunları ele almak için daha faydalıdır. Ek olarak, mevcut metodolojiyi optimize etmek ve hayvan modelinin ve kullanılan bakterilerin özelliklerinden yararlanarak tekrarlanabilirlik ve doğrulukla nicel değerlendirmeler yapmak esastır.
Bu çalışma, karşılaştırmalı bireyler arası ve bireyler arası analitik yöntemler yoluyla tek bir fare modelinde iki implantın yüzeylerinde biyofilm oluşumunu değerlendirmek için hassas ölçümler sağlayan in vivo implantla ilişkili enfeksiyonlar için yeni bir deneysel yaklaşım sunmaktadır. Her bir implant üzerindeki biyofilm, implant üzerindeki biyofilmi görselleştirmek, koloni oluşturan birimlerin (CFU) belirlenmesi ve Staphylococcus aureus, Xen 36'nın biyolüminesans bir suşunun kantitatif polimeraz zincir reaksiyonu (qPCR) analizi için optimize edilmiş yöntemler kullanılarak ölçülebilir. Önceki çalışma, yeni bir metal implantın, bu kapsamlı yaklaşımı kullanarak Staphylococcus aureus'a karşı umut verici in vivo antibakteriyel etkinliğe sahip olduğunu göstermiştir16. Bu metodoloji standart bir laboratuvar ortamında kolayca uygulanabilir ve antibakteriyel biyomalzemelerin geliştirilmesine yönelik araştırmaları hızlandırabilir.
Protokol
Tüm hayvan prosedürleri, California San Francisco Üniversitesi'ndeki (UCSF) Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından onaylanmıştır ve UCSF Çevre Sağlığı ve Güvenliği tarafından yönetilen UCSF Biyogüvenlik Tehlike Programı ile istişare edildikten ve onaylandıktan sonra bir BSL2 tesisinde gerçekleştirilir. Erkek ve dişi C57BL / 6 fareler (12-16 haftalık, 25-50 mg) kullanıldı. Reaktiflerin ve kullanılan ekipmanın ayrıntıları Malzeme Tablosunda listelenmiştir.
1. Bakteri hazırlama
- Patojen olarak biyolüminesan Staphylococcus aureus Xen36 (ATCC49525) kullanın.
NOT: Bu suş, Amerikan Tip Kültür Koleksiyonundan (Manassas, VA) elde edilmiştir ve benzersiz bir şekilde, konağın doğal plazmidine optimize edilmiş ve entegre edilmiş bir luxABCDE operonunu kullanır. Xen36 ayrıca lux operonuna bağlı kanamisin direnç genini kullanır. - Az miktarda donmuş Xen 36 gliserol stoğu ekleyin ve parçaları 200 μg / mL kanamisin içeren 5 mL triptik soya suyu (TSB) ortamına ekleyin.
- Kültürü gece boyunca 37 ° C'de çalkalanan bir inkübatörde (200 rpm) inkübe edin.
- Xen36'yı 200 μg/mL kanamisin içeren TSB agar plakalarına (TSB içinde agar %1.5) sürün ve gece boyunca 37 °C'de inkübe edin.
- Tek Xen36 kolonilerini izole edin ve çalkalama inkübatöründe (200 rpm) 37 ° C'de gece boyunca 200 μg / mL kanamisin içeren 5 mL TSB'de kültürleyin.
- Elde edilen kültürün absorbansını 630 nm'de ölçün.
- Kültürü seyreltin ve 630 nm'deki absorbansa bağlı olarak 1.0 x 108 CFU / mL'lik bir Xen36 kültürü yapın.
NOT: 630 nm'de (bir TSB boşluğuna karşı) 0,5'lik bir absorbans ölçümü, kabaca 1,0 x 108 CFU/ml Xen36'ya eşdeğerdir. - Kültürü seyreltin ve 1.0 x 105 CFU / mL'lik bir Xen36 kültürü yapın.
2. Bağlı implantların hazırlanması
- Her biri 8 mm uzunluğunda ve 0,5 mm çapında, piyasada bulunan cerrahi sınıf paslanmaz çelikten (SUS316L) oluşan çubuk şeklinde iki tel kullanın.
- İki kabloyu, yaklaşık 3 mm uzunluğunda kesilmiş 20 μL'lik bir pipet ucunun her iki ucuna sokarak dikey olarak bağlayın.
NOT: Dikey olarak bağlanmış kabloları 18 G iğnenin ucuna yerleştirin (Şekil 1). Bağlantının kesilmesini önlemek için tellerin pipet ucuyla sıkıca sabitlendiğinden emin olun. - Telleri farelere cerrahi olarak implante etmeden önce otoklavlayın.
3. Olgun bir deri altı kesenin oluşturulması
NOT: Bakteri aşılamasından 7 gün önce hava torbasını aşağıdaki gibi oluşturun:
- Fareyi (C57BL / 6) inhalasyon yoluyla % 2 izofluran ile uyuşturun (kurumsal olarak onaylanmış protokolleri izleyerek).
NOT: Solunum hızını, kas tonusunu, ayak parmağını çimdiklemeyi, kornea refleksini ve mukoza zarının rengini gözlemleyerek uygun anestezi seviyesini değerlendirin. Anestezi altındayken kuruluğu önlemek için gözlere oftalmik merhem kullanın. - Anestezi uygulanmış fareyi cerrahi yatağa aktarın ve farenin dorsal servikal/torasik bölgesini tıraş edin.
- Tüm bölgeyi %70 etanol ve povidon-iyot ile temizleyin ve sterilize edin.
- 10 mL'lik bir şırıngayı steril hava ile doldurun ve prize 27 G'lik bir iğne takın.
- Deri altı dokusu ile fasya arasında boşluk oluşturmak için farenin boynunun tabanını nazikçe sıkıştırın ve kaldırın.
- İğneyi farenin kürek kemiği arasındaki orta çizgiye yerleştirin ve hava kesesini oluşturmak için deri altına 3 mL steril hava enjekte edin (Şekil 2).
NOT: Hava enjekte ederken, havanın sırtın ortasına yayılmasını sağlamak için sırtın her iki tarafını diğer elinizle tutun ve ortada bir kese oluşturun. - Fareyi termal ped ile ısıtılmış bir kafese geri koyun ve anesteziden kurtulana kadar yakından izleyin.
- Boşluğun şişmesini korumak ve her 2 günde bir olgun bir kese oluşturmak için yukarıda anlatıldığı gibi 3 mL steril hava enjekte edin.
NOT: Her şişirmeden önce, iğne ucunun doğru yerleştirildiğini doğrulamak için torbadaki havayı aspire edin. Şırıngayı iğneden dikkatlice çıkarın ve iğne ucunu torbanın içinde bırakın. Torbayı 3 mL steril hava ile yeniden şişirin.
4. Bağlı tellerin implantasyonu ve bakteri aşılaması
- İlk hava enjeksiyonundan 7 gün sonra, fareyi adım 3.1'de anlatıldığı gibi uyuşturun.
NOT: Cerrahi işlem sırasında, farenin nefes aldığını ve anestezi uygulandığını sürekli kontrol edin. Tüm cerrahi prosedür, eğitimli bir cerrah tarafından gerçekleştirildiğinde genellikle 10-15 dakika sürer. Anestezi, fare burnunun yanına oksijenle karıştırılmış% 2 izofluran veren bir tüp yerleştirilerek sürdürülür. - Tüm bölgeyi %70 etanol ve povidon-iyot ile temizleyin ve sterilize edin.
- Ameliyattan hemen önce deri altına bupivakain enjekte edin.
- Torbanın üst kısmında 3 mm'lik orta hat-boyuna bir kesi yapın.
- Bağlı telleri içeren 18 G'lik bir iğneyi delikten torbaya sokun ve 25 G'lık bir spinal iğnenin iç şırıngasını kullanarak telleri dışarı itin (Şekil 3A,B).
- 18 G'lık iğnenin ucunu poşun içinde bırakarak, iç silindiri nazikçe çıkarın ve şırıngayı kullanarak 3 mL 1.0 x 105 CFU/mL Xen36 kültürü enjekte edin (Şekil 3C,D).
- Tüm iğneleri dikkatlice çıkarın, cildi bir yara klipsi kullanarak kapatın ve topikal cilt yapıştırıcısı ile kapatın (Şekil 3E, F).
- Sızıntı olmadığından emin olun, fareyi termal ped ile ısıtılan ayrı kafese geri koyun ve daha önce olduğu gibi izleyin.
5. İmplantların deri altı apseden çıkarılması
- Aşırı dozda izofloran yoluyla ötenaziden sonra, farenin dorsal servikal, torasik ve lomber bölgesini tıraş edin ve tüm bölgeyi% 70 etanol ve povidon-iyot ile temizleyin ve sterilize edin (Şekil 4A).
NOT: Ötenazi, Amerikan Veteriner Hekimler Birliği (AVMA) Hayvanların Ötenazisi Kılavuzuna uygun olarak gerçekleştirilmiştir. - Bel bölgesinde 2 cm'lik bir orta hat kesisi yapın ve cilt altı dokusunu makas kullanarak dikkatlice pul pul dökün.
- İnsizyon ve subkutan diseksiyonu proksimal olarak uzatın ve apseyi çevreleyen yapışık dokuyu ayırın (Şekil 4B - D).
- Tüm subkutan apseyi eksize edin (Şekil 4E).
- Apseyi kesin ve teli apsenin içinden dikkatlice çıkarın (Şekil 4F).
6. İmplant yüzeylerinde oluşan biyofilmin miktarının belirlenmesi
- Kristal menekşe tahlili
- Apseden çıkarılan telleri, 1 mL deiyonize (DI) su içeren 24 oyuklu bir plakanın ayrı kuyucuklarına yerleştirin.
- Tellerin yüzeyinden gevşek bir şekilde yapışan bakterileri gidermek için telleri 1 mL DI su içeren yeni kuyulara aktarın.
- Biyofilmi tellerin üzerine 1 dakika boyunca %100 etanol ile sabitleyin ve kurumasını bekleyin.
- Telleri 1 mL% 0.1 kristal viyole reaktifi içeren yeni kuyucuklara aktarın.
- 15 dakikalık boyamadan sonra, fazla boyayı çıkarmak için telleri iki kez DI suyla nazikçe yıkayın.
- İmplantı 15 dakika boyunca 250 μL% 33 asetik asit içeren 1.5 mL'lik bir mikrosantrifüj tüpüne yerleştirin; İmplant üzerindeki biyofilme yapışan kristal viyoleyi çözündürün, ardından 1 dakika girdaplayın.
- Süspansiyonun 200 μL'sini 96 oyuklu bir plakaya aktarın ve bir mikroplaka okuyucu kullanarak OD630 nm'de absorbansı ölçün. Tüm ölçümler üç nüsha halinde yapılır.
- Koloni oluşturan birimler (CFU) sayımı
- Adım 6.1.2'de açıklandığı gibi tellerin yüzeyinden gevşek bir şekilde yapışan bakterileri çıkarın.
- İmplantı 200 μL 10x tripsin içeren 1.5 mL'lik bir mikrosantrifüj tüpüne yerleştirin ve 37 ° C'de 1 saat inkübe edin.
- 1 dakika boyunca vorteks yapın ve 5 dakika boyunca 100 W'lık bir su banyosunda sonikasyon yapın, ardından biyofilmi süspansiyona ayırmak için 30 saniye boyunca ek girdaplama yapın.
- Seri olarak seyreltilmiş süspansiyonun 10 μL'sini 200 μg / mL kanamisin ile TSB agar plakalarına (% 1.5 içinde agar) aşılayın.
NOT: Bu yordamı her çözüm için üç nüsha halinde gerçekleştirin. - Plakaları 37 °C'de 24 saat inkübe ettikten sonra, plakalardaki kolonileri sayın ve ortalama koloni sayımlarını17 kullanarak orijinal kültürdeki bakteri hücrelerinin sayısını hesaplayın.
NOT: Doğru ölçüm için çok önemli olan tellerden tüm bakterilerin uzaklaştırıldığından emin olmak için, telleri kristal viyole ile boyayın ve süspansiyonu plakalara uyguladıktan sonra gözlemleyin. Ön deneylerde, yukarıdaki mekanik ve kimyasal ayrışmanın kombinasyonu, tüm Xen36 biyofilmlerini geleneksel paslanmaz çelik telin yüzeylerinden başarıyla çıkardı (Şekil 5).
- Kantitatif polimeraz zincir reaksiyonu (qPCR) analizi
- Adım 6.1.2'de açıklandığı gibi tellerin yüzeyinden gevşek bir şekilde yapışan bakterileri çıkarın.
- İmplantı 600 μL TSB içeren 1,5 mL'lik bir mikrotüpe yerleştirin.
- Peletsiz modifiye edilmiş alkali lizis sistemini kullanarak DNA'yı çıkarın16.
NOT: Ayrıştırılmış DNA'nın son hacmi 20 μL'dir. - DNA'yı 1:10 oranında seyreltin ve -20 °C'de saklayın.
- luxA ve 16S rRNA genleri16 için qPCR gerçekleştirin.
NOT: Tüm qPCR reaksiyonları üç kopya halinde gerçekleştirilir. Toplam reaksiyon karışım hacmi 10 μL'dir ve 3 μL DNA şablonu, 5 μl SYBR Green, 1 μL nükleaz içermeyen su ve her bir primerden 0.5 μL içerir. LuxA geni için primerler 5'- GAGCATCATTTCACGGAGTTTG -3' ve 5'- ATAGCGGCAGTTCCTACATTC -3''dür. 16S rRNA geni için primerler 5'- GTGGAGGGTCATTGGAAACT - 3' ve 5'- CACTGGTGTTCCTCCATATCTC - 3'dür. PCR koşulları aşağıdaki gibidir: 94 ° C'de 2 dakika boyunca ilk denatürasyon, ardından 94 ° C'de 15 s'lik 40 döngü, 60 ° C'de 30 s ve 72 ° C'de 30 s ve 72 ° C'de 5 dakika boyunca son uzatma. - Çizim: Üç döngü eşiği (Ct) değerlerinin ortalaması, implant üzerindeki bakteri yükünü tahmin etmek için doğrudan seri olarak seyreltilmiş saf Xen36 kültürlerinden saflaştırılmış DNA ile oluşturulan bir kalibrasyon eğrisine karşı çizilir (Şekil 6).
Sonuçlar
Bu çalışma, önceki çalışmada16 kullanılmış olan implant yüzeylerinde biyofilm oluşumunun optimize edilmiş kantitatif değerlendirmeleri ile implantla ilişkili enfeksiyonun yeni bir fare modelini kullanarak kapsamlı bir yaklaşımın güvenilirliğini değerlendirdi. İki özdeş implant, yüzeylerinde oluşan biyofilmi incelemek için kullanıldı ve her iki implantın da tek bir fare modelinde tek bir deri altı boşluğunda tek tip enfeksiyon koşullarında aynı anda inkübe edilebileceğini doğrulamayı amaçladı. Farelere deri altı kese oluşturma prosedürü uygulandı (Şekil 2) ve 7 gün sonra, bağlı paslanmaz çelik teller olgun keseye implante edildi, ardından Staphylococcus aureus Xen36 ile aşılandı (Şekil 3). Aşılamadan 14 gün sonra, yaklaşık 2 cm uzunluğunda ve 1 cm genişliğinde, poş içinde oluşturulan bağlı telleri içeren kapsüllü bir apse (Şekil 4). Teller apseden alındı ve her bir tel üzerinde oluşan biyofilm kristal viyole boyama, CFU sayımı ve qPCR analizi ile değerlendirildi. Kristal viyole lekeli teller, yüzeylerde tutarlı biyofilm oluşumu gösterdi ve her iki tel arasında gözlemlenebilir bir değişiklik olmadı (Şekil 7A). Karşılaştırmalı bireyler arası ve bireyler arası analitik yöntemlerle biyofilm oluşumunu değerlendirmek için yapılan hassas ölçümler, çözünmüş kristal viyole testinin (Şekil 7B), CFU sayımının (Şekil 7C) ve qPCR analizinin (Şekil 7D) absorbans ölçümlerinin, her iki tel üzerindeki biyofilm içindeki bakteri yükünde istatistiksel olarak anlamlı bir fark göstermediğini göstermiştir. Bu sonuçlar, her iki telin de aynı enfeksiyon koşulları altında tek bir fare modeli içinde tek bir deri altı kese içinde aynı anda inkübe edildiğini göstermiştir.

Şekil 1: Deri altı kese implantasyonu için bağlı tellerin hazırlanması. (A) Birbirine bağlı iki paslanmaz çelik telden (uzunluk: 8 mm, çap: 0,5 mm) oluşan tek bir implantın temsili görüntüsü. (B) 20 μL'lik bir pipet ucunun ucu, iki tel için bir bağlantı görevi görür. (C) Bağlanan teller daha sonra olgun bir deri altı kese içine implantasyon için 18 G'lik bir iğnenin ucuna yerleştirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
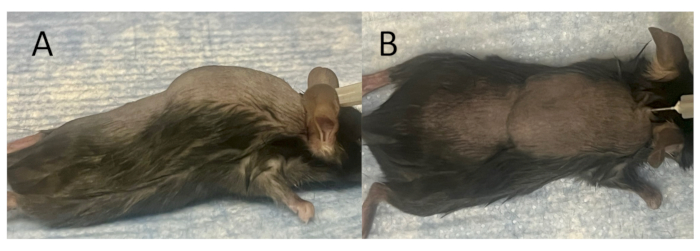
Şekil 2: İmplantasyon ve aşılama için olgun bir deri altı poşun oluşturulması. (A) Yanal görünüm ve (B) hava enjeksiyonundan hemen sonra tamamen oluşmuş bir deri altı kesenin üstten görünümü. Bir fare modelinin arkasında, kürek kemiği arasındaki orta hat boyunca cilde 27 G'lik bir iğne sokularak ve deri altına 3 mL steril hava enjekte edilerek deri altı bir torba oluşturulur. Daha sonra, deri altı bir poşun olgunlaşmasını kolaylaştırmak için 7 gün boyunca her gün 3 mL steril hava uygulanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
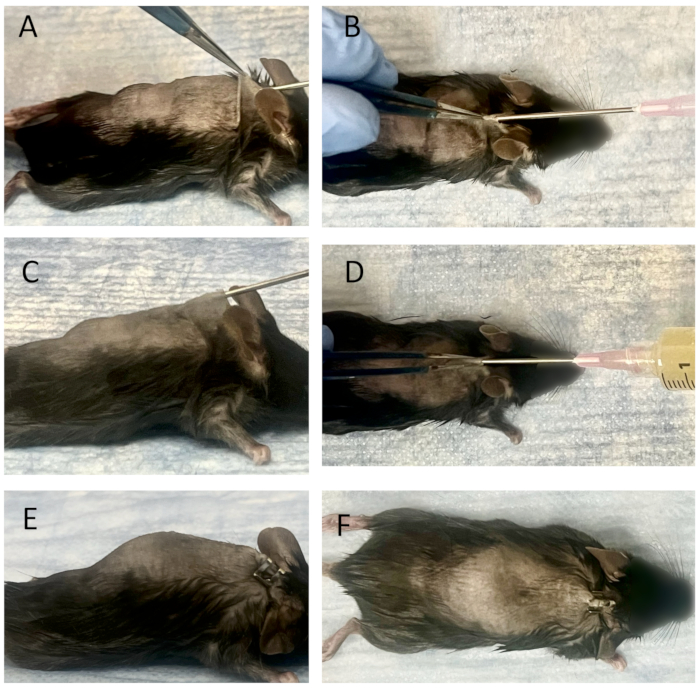
Şekil 3: Bağlı tellerin implantasyonu ve olgun bir deri altı kese içine bakteri aşılaması. (A) Yanal görünüm ve (B) olgun bir deri altı kese içine iğne yerleştirme prosedürünün üstten görünümü. Bağlanan teller 18 G'lik bir iğnenin ucuna yerleştirilir ve telleri dışarı itmek için 25 G'lik bir spinal iğnenin iç şırıngası kullanılır. Deri deliğinden olgun deri altı kese içine yerleştirilirler. Teller daha sonra 25 G'lik bir spinal iğne kullanılarak torbaya yerleştirilir. Yanal görünümden (C) ve üstten görünümden (D) gözlemlendiği gibi kese içine bakteri aşılaması. 18 G iğneye bakteri çözeltisi içeren bir şırınga takıldıktan sonra, 3 mL Xen36 kültürü (1.0 x 105 CFU / ml) torbaya aşılanır. 18 G iğne çıkarıldıktan sonra yerleştirme yeri kapatılır ve ne yanal görünümde (E) ne de üstten görünümde (F) herhangi bir sızıntı tespit edilmez. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
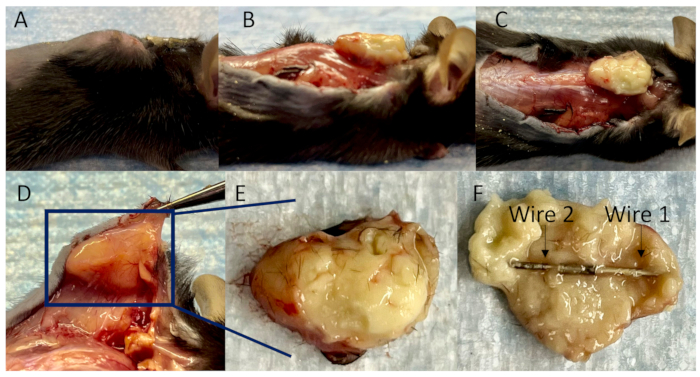
Şekil 4: Deri altı apsede bağlı tellerin toplanması. (A) Aşılamadan 14 gün sonra implantla ilgili enfeksiyonlar için bir fare modelinin yanal görünümü. (B) Lateral görünüm, (C) üstten görünüm ve (D) yapışık dokuları ayırdıktan sonra çevredeki iyi gelişmiş kan damarları ile deri altı apsenin alt görünümü. (E) Deri altı apse tamamen kapsüllenmiştir ve (F) bağlı teller tamamen içine sarılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: CFU değerlendirmesi için teller üzerinde oluşan biyofilmin çıkarılması. (A) Her bir telin yüzeylerinde oluşan biyofilm, in vitro aşılamadan 14 gün sonra sürekli olarak kristal viyole ile boyanır. (B) Lekeli biyofilm, girdap ve sonikasyon ile azalır. (C) Tripsin tedavisi eklenerek tamamen elimine edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
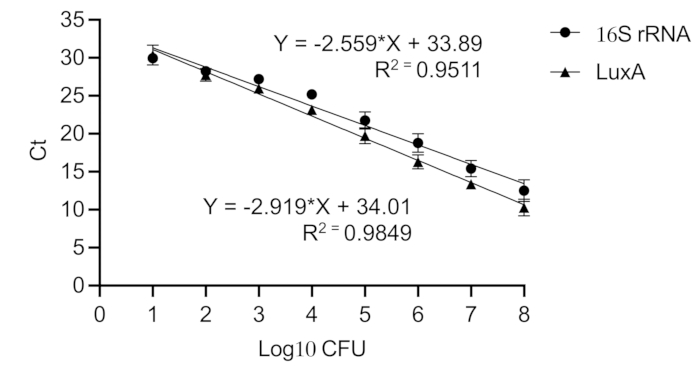
Şekil 6: Staphylococcus aureus'ta 16S rRNA ve luxA genlerinin kalibrasyon eğrisi. Bir kalibrasyon eğrisi, Ct değerlerini CFU'daki eşdeğer bakteri yüküne dönüştürür. Saf Staphylococcus aureus Xen36 kültürünün (10,8 ila 10,1 CFU) seri bir seyreltmesi oluşturulur. 16S rRNA (R2 = 0.951) ve luxA (R2 = 0.985) için doğrusal standart eğrileri gösteren yüksek bir Pearson korelasyon katsayısı elde edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
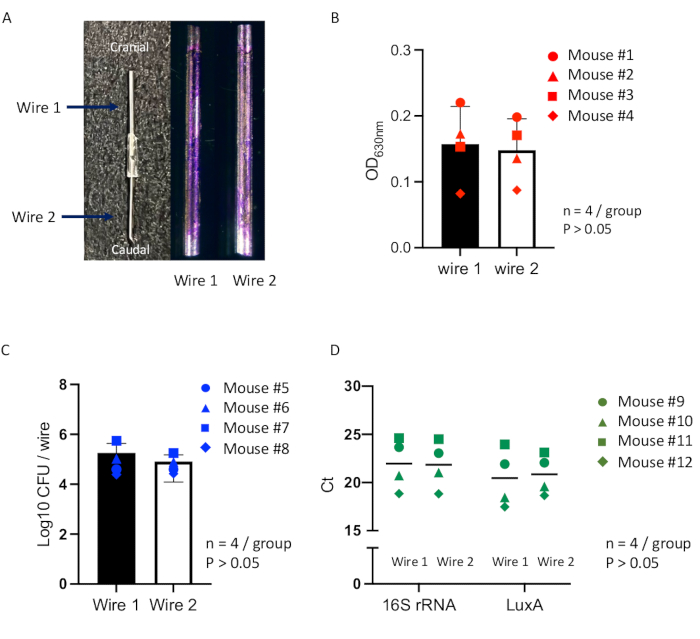
Şekil 7: Bir fare modelinde bağlı teller üzerinde biyofilm oluşumunun kantitatif değerlendirmeleri. (A) Deri altı poşu implantasyonu için birbirine bağlı iki paslanmaz çelik telden (solda) ve aşılamadan 14 gün sonra her bir telin (Tel 1 veya Tel 2) yüzeylerinde oluşan kristal viyole lekeli biyofilmden oluşan tek bir implantın temsili görüntüleri (sağda). Karşılaştırmalı bireyler arası ve bireyler arası analitik yöntemler kullanılarak biyofilmi değerlendirmek için ölçümler, (B) kristal mor lekeli biyofilmin absorbans ölçümü (n = 4; daire noktası Fare #1'i gösterir; üçgen nokta Fare #2'yi gösterir; kare nokta Fare #3'ü gösterir; elmas nokta Fare #4'ü gösterir). (C) CFU sayımı (n = 4; daire noktası Fare #5'i; üçgen nokta Fare #6'yı; kare nokta Fare #7'yi; baklava nokta Fare #8'i gösterir) ve (D) qPCR analizi (n = 4; daire noktası Fare #9'u; üçgen nokta Fare #10'u; kare nokta Fare #11'i; baklava noktası Fare #12'yi gösterir). Kablo grupları arasındaki farklar, tek yönlü bir varyans analizi (ANOVA) kullanılarak değerlendirilir. Tüm veriler ortalama ± standart hata olarak sunulur. İstatistiksel olarak anlamlı değerler p < 0.05 olarak tanımlandı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu çalışma, yeni bir fare modelinden ve implantla ilişkili enfeksiyon için optimize edilmiş analiz tekniklerinden yararlanarak birden fazla implantta biyofilm oluşumunun kesin kantitatif değerlendirmeleri için kapsamlı bir yaklaşım göstermiştir. Aynı denekte aynı enfeksiyon koşulları altında iki implantın inkübe edildiğinden emin olmak için, tekrarlanan hava enjeksiyonları yoluyla tek bir fare içinde olgun bir deri altı kese oluşturuldu. Bu model, fare hareket ederken bile birbirine bağlı iki implantın aynı enfeksiyon koşulları altında inkübe edilebileceği kapalı ve stabil bir ortam sağladı. Staphylococcus aureus ile inokülasyonu takiben, her iki teli de tamamen saran ve klinik implantla ilişkili enfeksiyonların özelliklerine çok benzeyen, yaklaşık 2 cm uzunluğunda, soliter kapsüllü bir subkutan apse gelişti. Her iki tel de apseden çıkarıldı ve biyofilm mekanik ve kimyasal ayrışma kullanılarak her yüzeyden çıkarıldı. Çözünmüş bakteri çözeltisi, her bir tel üzerindeki biyofilm içindeki bakteri yükünü kantitatif olarak analiz etmek için kullanıldı. Kantitatif değerlendirme için iki tip tel grubu arasında birden fazla telin karşılaştırmalı bir bireyler arası ve birey içi analitik analizi yapıldı. Ek olarak, aynı fareye yerleştirilen her iki tel de daha doğru bir değerlendirme için karşılaştırmalı olarak ölçüldü, çünkü aynı anda tek tip bir enfeksiyonla inkübe edildiler. qPCR analizi, kantitatif değerlendirme için 16S rRNA geninin ve bir biyolüminesan Staphylococcus aureus'ta lusiferazı kodlayan lux operonunun nispi ekspresyon seviyelerini kullandı. İki özdeş tel içeren bu çalışma, birkaç farede tel grupları arasında veya tek bir fare içindeki teller arasında biyofilm oluşumunun tüm kantitatif değerlendirmelerinde önemli bir farkla sonuçlanmadı. Bu arada, önceki çalışma, birkaç farede iki farklı tel grubu arasında biyofilm oluşumunun kantitatif değerlendirmelerinde önemli farklılıklar göstermiştir16. Bu nedenle, bu kapsamlı yaklaşım, sonuçların değişkenliğini en aza indirmek için fare modelini ve analitik teknikleri optimize eder ve potansiyel olarak birden fazla biyomalzeme üzerinde biyofilm oluşumunun nicel değerlendirmelerinin doğruluğunu ve tekrarlanabilirliğini artırır.
Biyomalzemelerdeki antimikrobiyal etkinliği değerlendirmek için implantla ilişkili enfeksiyonların birkaç in vivo modeli oluşturulmuştur 9,18,19,20. Bu modellerde, bakteri aşılaması ile birlikte hayvan başına tibia, femur veya omurga sürecine tipik olarak tek bir implant yerleştirilir. Apse, aşılamayı takiben implantın etrafında veya bitişiğinde geliştiğinden, klinik özellikleri yakından taklit ettiğinden, bu modeller implantla ilişkili enfeksiyonun in vivo çalışması için yararlıdır. Bununla birlikte, kantitatif değerlendirmelerden elde edilen sonuçlar, denek başına tek bir implant, kusurlu bir şekilde kapalı bir alana aşılama ve denekler arasındaki bağışıklık tepkileri ve enfeksiyon koşullarındaki değişkenlik nedeniyle tutarsız olabilir. Ek olarak, bu modellerdeki nicel değerlendirmeler sıklıkla özel uzmanlık ve özel ölçüm cihazları gerektirir ve bu da uygulanabilirliklerini sınırlar. Bu fare modelinde implant boyutu sınırlı olsa da, bu sorunlar, tek bir fare içinde aynı enfeksiyon koşulları altında birden fazla implantın bakterilerle aynı anda inkübasyonunu içeren bu kapsamlı metodolojinin özellikleri ile iyileştirilebilir.
Bu yaklaşımdaki en kritik adım, oluşan biyofilmin implanttan uzaklaştırılmasıdır. Biyofilmin kantitatif değerlendirmesi için temsili bir yöntem, bakterilerin biyofilmden ayrılmasını, bir ortamda askıya alınmasını ve ardından kaplamayı gerektiren CFU sayımıdır11. Sonikasyon ve girdap içeren mekanik stres teknikleri, birçok çalışmada biyofilmi ayırmak için yaygın olarak kullanılırken, tüm biyofilmleri implantlardan tamamen çıkarmadaki yeterlilikleri konusunda endişeler vardır. Bu tekniklerin yetersiz olduğu kanıtlanırsa, sonuçların güvenilirliği tehlikeye girebilir. Bu çalışma, mekanik stimülasyonun tek başına biyofilmi tamamen ayıramadığını göstermiştir. Bu nedenle, daha güvenilir bakteri ayrılması elde etmek ve biyofilm21 içindeki canlı bakteri yükünü doğru bir şekilde ölçmek için kimyasal tedavinin tripsin ve mekanik stimülasyon ile entegre edilmesi gereklidir.
qPCR analizi, biyofilm içindeki genel bakteri yükünü değerlendirmek için mikrobiyom çalışmalarında yaygın olarak kullanılır. Bu tahlil, kantitatif değerlendirme için kristal viyole tahlilinden muhtemelen daha doğru bir yöntemdir22. Doğrudan saf bakteri kültürlerinden saflaştırılmış plazmit DNA ile bir kalibrasyon eğrisi oluşturarak, biyofilm içindeki bakteri yükü doğru olabilir. 16S rRNA geninin tüm bakterilerde bulunan ribozomal bir alt birim olduğu göz önüne alındığında, 16S rRNA genini hedefleyen qPCR, bakteri nicelemesi için yaygın olarak kullanılır ve 16S rRNA geninin ekspresyonu, Staphylococcus aureus23,24'ün büyümesi sırasında nispeten stabildir. luxA geni, Staphylococcus aureus Xen 36'nın biyolüminesans bir suşundaki lux operonunun bir bileşenidir. Bu çalışma, luxA geni için qPCR'nin, Xen 36'nın aşılanmasından sonra biyofilm oluşumunu kantitatif olarak değerlendirmek için de etkili olduğunu göstermiştir. Bu nedenle, biyofilm oluşumunun kantitatif değerlendirmesi, bir biyolüminesan bakterinin aşılanması ve lux operonunun gen ekspresyon analizi kullanılarak optimize edilebilir. Bu prosedürün uygulanması nispeten kolaydır, tekrarlanabilir ve araştırmacıların aynı anda birden fazla örneği analiz etmelerini sağlar. Ayrıca, ekonomiktir ve özel ekipman gerektirmez, bu da onu herhangi bir laboratuvar için uygun bir seçim haline getirir.
Bu kapsamlı yaklaşımın bazı sınırlamaları vardır. İlk olarak, bu çalışma öncelikle lokalize ve kapalı bir ortamda implantlar üzerinde biyofilm oluşumunu değerlendirmeyi amaçlamakta, böylece biyomalzemelerin sistemik enfeksiyonlar üzerindeki etkisini değerlendirmeyi yetersiz kılmaktadır. İkincisi, bu fare modelinde iyi gelişmiş bir apse oluşturmak için gereken bakteri yükü, alternatif modellere göre önemli ölçüde daha yüksektir ve bu da biyomalzemelerin biyofilm25'e direncini değerlendirmek için zorlu bir ortam yaratabilir. Bununla birlikte, implantları tamamen çevreleyen bir apse oluşturmak ve aynı bakteriyel enfeksiyon koşulları altında implantları kültürlemek için daha yüksek bir bakteri kültürü dozu gerekliydi. Üçüncüsü, implantlardan biri diğer implantı etkileyebileceğinden bileşikler salgılarsa bu model kullanılamaz. Dördüncüsü, iki implantı bağlamak için kullanılan pipet ucu enfeksiyonun seyrini etkileyebilir, ancak yaygın olarak bulunan bir pipet ucunun kullanılması modelin herhangi bir laboratuvar ortamında uygulanmasını kolaylaştırır.
Sonuç olarak, bu çalışma, implantla ilişkili enfeksiyonun yeni bir fare modelini ve biyofilm oluşumunun kesin kantitatif değerlendirmesi için optimize edilmiş analitik yöntemler sunmaktadır. Bu kapsamlı yaklaşımın, özelliklerinden yararlanarak cerrahi implantlarda karşılaştırmalı biyofilm ölçümü için sonuç ölçümlerinin doğruluğunu, tekrarlanabilirliğini ve çok yönlülüğünü artırması ve böylece antimikrobiyal implantların gelecekteki gelişimine katkıda bulunması beklenmektedir.
Açıklamalar
Yazarlar hiçbir rekabet çıkarı beyan etmezler.
Teşekkürler
Bu araştırma kısmen, Yıkıcı Kas-İskelet Sistemi Yenilikleri Merkezi (IIP-1916629), Komatsuseiki Kosakusho Co., Ltd. ve Rosies Base, LLC adlı bir NSF Endüstri/Üniversite İşbirliği Araştırma Programı tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acetic Acid | THOMAS SCIENTIFIC | 12-16-15-00 | |
| Agilent BioTek 800 TS Absorbance Reader | Agilent | BT800TS | |
| Air-Tite Sterile Hypodermic Needles, Needle Gauge: 18 G | FISHER SCIENTIFIC | 14817151 (CS) | |
| BD Spinal Needles: 25 G | FISHER SCIENTIFIC | 22043805 | |
| Benchtop Incubator Shaker | FISHER SCIENTIFIC | ||
| Branson Ultrasonic Bath, 115 Vac, 60 Hz | FISHER SCIENTIFIC | 2489500 | |
| Branson Ultrasonics 2510R-MTH (Sonicator) | RPI-T48500-500.0 | ||
| Centrifuge sorvall pico | FISHER SCIENTIFIC | ||
| CFX96 Real Time Optics Module qPCR System | BIO-RAD | ||
| Compact Sterilizer, 30L | THOMAS SCIENTIFIC LLC | 22A00N096 (EA/1) | |
| Crystal Violet, 1%, Solution SCI_ED | FISHER SCIENTIFIC | 10114-58-6 | |
| Falcon 24-well cell culture plate | FISHER SCIENTIFIC | 877125 | |
| Falcon 96-well cell culture plate | FISHER SCIENTIFIC | 8771001 | |
| Fisherbrand Digital Vortex Mixer | FISHER SCIENTIFICS | ||
| Kanamycin | THOMAS SCIENTIFIC LLC | 15160054 | |
| Mannitol Salt Agar | FISHER SCIENTIFIC | ||
| Micirobiological Incubator | Thermo Scientific | 51028063H | |
| PBS, Phosphate Buffered Saline | |||
| Staphylococcus aureus ATCC 49525 (Xen36) | Perkin Elmer | 119243 | |
| SYBR Green I Nucleic Acid Gel Stain | FISHER SCIENTIFIC | ||
| Trypsin 10x (2.5%) | FISHER SCIENTIFIC | 15090046 | |
| Tryptic Soy Broth | NETA SCIENTIFIC INC | ||
| Zyppy Plasmid Miniprep Ki | FISHER SCIENTIFIC | 501977785 | pellet-free modified alkaline lysis system |
Referanslar
- Wukich, D. K., Lowery, N. J., McMillen, R. L., Frykberg, R. G. Postoperative infection rates in foot and ankle surgery: a comparison of patients with and without diabetes mellitus. J Bone Joint Surg Am. 92 (2), 287-295 (2010).
- Darouiche, R. O. Treatment of infections associated with surgical implants. N Engl J Med. 350 (14), 1422-1429 (2004).
- Arciola, C. R., Campoccia, D., Montanaro, L. Implant infections: Adhesion, biofilm formation and immune evasion. Nat Rev Microbiol. 16 (7), 397-409 (2018).
- Li, P., Yin, R., Cheng, J., Lin, J. Bacterial biofilm formation on biomaterials and approaches to its treatment and prevention. Int J Mol Sci. 24 (14), ijms241411680(2023).
- Chen, X., Zhou, J., Qian, Y., Zhao, L. Antibacterial coatings on orthopedic implants. Mater Today Bio. 19, 100586(2023).
- Pan, C., Zhou, Z., Yu, X. Coatings as the useful drug delivery system for the prevention of implant-related infections. J Orthop Surg Res. 13 (1), 220(2018).
- Savvidou, O. D., et al. Efficacy of antimicrobial coated orthopedic implants on the prevention of periprosthetic infections: A systematic review and meta-analysis. J Bone Jt Infect. 5 (4), 212-222 (2020).
- Sussman, E. M., Casey, B. J., Dutta, D., Dair, B. J. Different cytotoxicity responses to antimicrobial nanosilver coatings when comparing extract-based and direct-contact assays. J Appl Toxicol. 35 (6), 631-639 (2015).
- Cyphert, E. L., Zhang, N., Learn, G. D., Hernandez, C. J., von Recum, H. A. Recent advances in the evaluation of antimicrobial materials for resolution of orthopedic implant-associated infections in vivo. ACS Infect Dis. 7 (12), 3125-3160 (2021).
- Stavrakis, A. I., et al. Current animal models of postoperative spine infection and potential future advances. Front Med (Lausanne). 2, 34(2015).
- Carli, A. V., et al. Quantification of Peri-implant bacterial load and in vivo biofilm formation in an innovative, clinically representative mouse model of periprosthetic joint infection. J Bone Joint Surg Am. 99 (6), e25(2017).
- Bernthal, N. M., et al. A mouse model of post-arthroplasty Staphylococcus aureus joint infection to evaluate in vivo the efficacy of antimicrobial implant coatings. PLoS One. 5 (9), e12580(2010).
- Kelley, B. V., et al. In vivo mouse model of spinal implant infection. J Vis Exp. (160), e60560(2020).
- Meroni, G., et al. A Journey into animal models of human osteomyelitis: A review. Microorganisms. 10 (6), 10061135(2022).
- Wang, Y., et al. Mouse model of hematogenous implant-related Staphylococcus aureus biofilm infection reveals therapeutic targets. Proc Natl Acad Sci U S A. 114 (26), E5094-E5102 (2017).
- Mitsuhiro Nishizawa, D. H., et al. A novel approach to reducing spinal implant-associated infections. bioRxiv. , (2024).
- Fehlings, M. G., et al. A clinical practice guideline for the management of patients with acute spinal cord injury: Recommendations on the use of methylprednisolone sodium succinate. Global Spine J. 7 (3 Suppl), 203S-211S (2017).
- Dworsky, E. M., et al. Novel in vivo mouse model of implant-related spine infection. J Orthop Res. 35 (1), 193-199 (2017).
- Masters, E. A., et al. Distinct vasculotropic versus osteotropic features of S. agalactiae versus S. aureus implant-associated bone infection in mice. J Orthop Res. 39 (2), 389-401 (2021).
- Sheppard, W. L., et al. Novel in vivo mouse model of shoulder implant infection. J Shoulder Elbow Surg. 29 (7), 1412-1424 (2020).
- Mansouri, M. D., Ramanathan, V., Al-Sharif, A. H., Darouiche, R. O. Efficacy of trypsin in enhancing assessment of bacterial colonization of vascular catheters. J Hosp Infect. 76 (4), 328-331 (2010).
- Wang, X., Howe, S., Deng, F., Zhao, J. Current applications of absolute bacterial quantification in microbiome studies and decision-making regarding different biological questions. Microorganisms. 9 (9), 9091797(2021).
- Lima, A., Franca, A., Muzny, C. A., Taylor, C. M., Cerca, N. DNA extraction leads to bias in bacterial quantification by qPCR. Appl Microbiol Biotechnol. 106 (24), 7993-8006 (2022).
- Eleaume, H., Jabbouri, S. Comparison of two standardization methods in real-time quantitative RT-PCR to follow Staphylococcus aureus genes expression during in vitro growth. J Microbiol Methods. 59 (3), 363-370 (2004).
- Vidlak, D., Kielian, T. Infectious dose dictates the host response during Staphylococcus aureus orthopedic-implant biofilm infection. Infect Immun. 84 (7), 1957-1965 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır