Method Article
מודל עכבר ייחודי להערכה כמותית של היווצרות ביופילם על שתלים כירורגיים במורסה תת עורית
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר מודל ניסיוני ייחודי של זיהומים הקשורים לשתלים המאפשר דגירה בו זמנית של שני שתלים עם חיידקים בתנאים זהים בתוך עכבר בודד. הוא גם מאפשר הערכה מדויקת של היווצרות ביופילם על משטחי השתל באמצעות שיטות אנליטיות השוואתיות אופטימליות, המדגימות טכניקות מתקדמות להערכת התכונות האנטי-מיקרוביאליות של ביו-חומרים.
Abstract
כדי לפתח חומר ביולוגי חדשני בעל תכונות אנטיבקטריאליות להליכים כירורגיים אורטופדיים, יש חשיבות מכרעת להקמת מודל ניסיוני של זיהומים הקשורים לשתלים המחקה מקרוב את המצב הפתולוגי. בנוסף, נדרשת השוואה כמותית עם דגימות בקרה כדי להעריך את היווצרות הביופילם על חומרים. עם זאת, מודלים עכשוויים של בעלי חיים, הכוללים השתלת חומר יחיד לכל פרט, עשויים להניב תוצאות לא עקביות בשל ההטרוגניות של מצב ההדבקה בקרב הנבדקים. יתר על כן, כימות מדויק של היווצרות ביופילם על חומרים in vivo נותר מאתגר, והממצאים עשויים להיות חסרי אמינות. כדי לטפל בבעיות אלה, מחקר זה הדגים מודל עכברי ייחודי של זיהום הקשור לשתלים המאפשר דגירה בו זמנית של שני שתלים עם חיידקים בסביבה סגורה בתוך עכבר יחיד, ויוצרים מורסה תת עורית עטופה. נרתיק אוויר בוגר נוצר בתחילה מתחת לעור הגב. שני חוטי נירוסטה חוברו והוכנסו לתוך השקית, ואחריהם חיסון של Xen 36, זן ביולומינסנט של Staphylococcus aureus. עד 14 יום לאחר החיסון, נוצרה מורסה תת עורית סביב החוטים. הביופילם הוסר לחלוטין מפני השטח של כל חוט, ותרחיפים החיידקים המומסים נמדדו במדויק בשיטות מותאמות להערכת היווצרות ביופילם על השתל, קביעת יחידות יוצרות מושבה וביצוע ניתוח כמותי של תגובת שרשרת פולימראז. על ידי מינוף אופרון הלוקס של חיידקי האור הביולוגי, רמות הביטוי היחסיות של luxA ו-16S rRNA שימשו לקביעת העומס החיידקי בתוך הביופילם על כל חוט. גישה אנליטית השוואתית אופטימלית זו מאפשרת הערכות מדויקות של היווצרות ביופילם על שני חוטים בתנאי זיהום אחידים בתוך מודל עכבר יחיד ועשויה להקל על התקדמות של ביו-חומרים בעלי תכונות אנטיבקטריאליות.
Introduction
זיהומים הקשורים לשתלים נותרו אתגר משמעותי במסגרות קליניות מכיוון שהם עלולים לגרום לשיעורים גבוהים של תחלואה ותמותה בניתוחים אורטופדיים למרות ההתקדמות בטכניקה כירורגית ועיצוב שתלים1. למרות ששכיחות הזיהומים הקשורים לשתלים כירורגיים פחתה משמעותית עקב סטנדרטים מודרניים של בקרה אספטית בסביבת חדר הניתוח ופרוטוקולים מתאימים למניעה אנטיביוטית סביב הניתוח, שכיחות זיהומים הקשורים לשתלים בניתוחים ראשוניים נותרה 2%-5%2.
המנגנון הבסיסי העיקרי של זיהומים הקשורים לשתלים הוא היווצרות ביופילם על משטחי השתל, המגן על מיקרואורגניזמים מפני אנטיביוטיקה ומערכת החיסון, מה שמקשה על מיגור הזיהום 3,4. מכיוון שהיצמדות חיידקים למשטח השתל היא חיונית בשלב הראשון של היווצרות הביופילם, מזעור הידבקות החיידקים והיווצרות הביופילם לאחר מכן היא אסטרטגיה חיונית להפחתת הסיכון לזיהומים הקשורים לשתל. למרות התכונות האנטיבקטריאליות של טכנולוגיות שתלים שונות, אלה לא היו בשימוש קליני נרחב עקב תופעות לוואי, כגון רעילות תאים ואלרגיות 5,6,7,8. לכן, עדיין קיים צורך קליני שלא נענה בשתלים אנטיבקטריאליים המשלבים הרמוניה בין בטיחות, יעילות, יציבות ועמידות כדי להפחית את הסיכון לזיהומים הקשורים לשתלים. מחקר ופיתוח של שתלים בעלי תכונות אנטיבקטריאליות יכולים לקדם טכנולוגיה כירורגית להתגברות על בעיות אלה.
הערכת התכונות האנטיבקטריאליות של ביו-חומרים שונים באמצעות מודלים של בעלי חיים קטנים חיונית לפני שממשיכים למודלים גדולים יותר של בעלי חיים וניסויים קליניים9. מחקרים רבים הראו מודלים עכבריים ישימים של זיהומים הקשורים לשתלים באמצעות חיידק ביולומינסנט המכיל את האופרון luxABCDE 10,11,12,13,14,15. בעוד שמודלים אלה מאיצים את המחקר לפיתוח שתלים או טכנולוגיות אנטיבקטריאליות, יש להם מגבלות מסוימות. ראשית, לעתים קרובות נדרשים מומחיות מתקדמת וציוד מיוחד, כגון צילומי רנטגן או מערכות הדמיה ייעודיות, כדי להעריך את העומס החיידקי על השתלים המונחים במודלים של עכברים באופן ישיר ומדויק. שנית, בעוד שתלים שנאספו בדרך כלל מעריכים שתל בודד באתר זיהום יחיד לכל בעל חיים, תנאי ההדבקה והתגובות החיסוניות עשויים להשתנות בין אנשים, מה שעלול להוביל לשונות בתוצאות של הערכות השוואתיות. לכן, כאשר משווים את ההשפעות האנטיבקטריאליות של ביו-חומרים שונים in vivo, השתלתם וחיסונם בחיידקים בסביבות אחידות מועילה יותר לטיפול בבעיות אלה. בנוסף, חיוני לייעל את המתודולוגיה הנוכחית ולבצע הערכות כמותיות עם יכולת שחזור ודיוק על ידי ניצול המאפיינים של מודל החי והחיידקים המשמשים.
מחקר זה מציג גישה ניסויית חדשה לזיהומים הקשורים לשתלים in vivo המאפשרת מדידות מדויקות להערכת היווצרות הביופילם על פני השטח של שני שתלים בתוך מודל עכבר יחיד באמצעות שיטות אנליטיות השוואתיות בין-אישיות ותוך אינדיבידואליות. ניתן לכמת את הביופילם על כל שתל באמצעות שיטות מותאמות להדמיית הביופילם על השתל, קביעת היחידות היוצרות מושבה (CFU) ותגובת שרשרת פולימראז כמותית (qPCR) של זן ביולומינסנט של סטפילוקוקוס זהוב, Xen 36. המחקר הקודם הראה כי לשתל מתכת חדש יש יעילות אנטיבקטריאלית מבטיחה in vivo נגד סטפילוקוקוס זהוב באמצעות גישה מקיפה זו16. מתודולוגיה זו ניתנת ליישום בקלות במעבדה סטנדרטית ועשויה להאיץ את המחקר לפיתוח ביו-חומרים אנטיבקטריאליים.
Protocol
כל ההליכים בבעלי חיים מאושרים על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) באוניברסיטת קליפורניה בסן פרנסיסקו (UCSF) ומבוצעים במתקן BSL2 לאחר התייעצות ואישור של תוכנית סיכוני הבטיחות הביולוגית של UCSF, המנוהלת על ידי UCSF Environmental Health and Safety. נעשה שימוש בעכברי C57BL/6 זכרים ונקבות (בני 12-16 שבועות, 25-50 מ"ג). פרטי הריאגנטים והציוד המשמש מפורטים בטבלת החומרים.
1. הכנת חיידקים
- השתמש ב-Staphylococcus aureus Xen36 (ATCC49525) כפתוגן.
הערה: זן זה מתקבל מאוסף תרבות הסוג האמריקאי (Manassas, VA) ומשתמש באופן ייחודי באופרון luxABCDE , המותאם ומשולב בפלסמיד המקורי של המארח. Xen36 משתמש גם בגן העמידות לקנמיצין המקושר לאופרון הלוקס . - הוסף כמות קטנה של ציר גליצרול קפוא של Xen 36 והוסף את החתיכות ל -5 מ"ל של מדיום מרק סויה טריפטי (TSB) המכיל 200 מיקרוגרם/מ"ל קנמיצין.
- דגרו את התרבית למשך הלילה בטמפרטורה של 37 מעלות צלזיוס באינקובטור רועד (200 סל"ד).
- פס Xen36 על צלחות אגר TSB (TSB באגר 1.5%) המכילים 200 מיקרוגרם/מ"ל קנמיצין ודגירה למשך הלילה ב-37 מעלות צלזיוס.
- יש לבודד מושבות בודדות של Xen36 ולתרבית ב-5 מ"ל של TSB המכיל 200 מיקרוגרם/מ"ל קנמיצין למשך הלילה ב-37 מעלות צלזיוס באינקובטור רועד (200 סל"ד).
- מדוד את הספיגה של התרבית המתקבלת ב 630 ננומטר.
- יש לדלל את התרבית וליצור תרבית Xen36 של 1.0 x 108 CFU/mL בהתבסס על הספיגה ב-630 ננומטר.
הערה: מדידת ספיגה ב-630 ננומטר (כנגד ריק TSB) של 0.5 שווה בערך ל-1.0 x 108 CFU/ml של Xen36. - מדללים את התרבית ויוצרים תרבית Xen36 של 1.0 x 105 CFU/mL.
2. הכנת שתלים מחוברים
- השתמש בשני חוטים בצורת מוט המורכבים מפלדת אל-חלד בדרגה כירורגית (SUS316L), כל אחד באורך 8 מ"מ ובקוטר 0.5 מ"מ.
- חבר את שני החוטים אנכית על ידי הכנסתם לשני הקצוות של קצה פיפטה של 20 מיקרוליטר שנחתך לאורך של כ-3 מ"מ.
הערה: הכנס את החוטים המחוברים אנכית לקצה מחט ה-18 G (איור 1). ודא שהחוטים מאובטחים היטב על ידי קצה הפיפטה כדי למנוע ניתוק. - חיטוי החוטים לפני השתלתם בניתוח בעכברים.
3. יצירת נרתיק תת עורי בוגר
הערה: 7 ימים לפני חיסון חיידקים, צור את נרתיק האוויר באופן הבא:
- להרדים את העכבר (C57BL/6) עם 2% איזופלורן בשאיפה (בהתאם לפרוטוקולים שאושרו על ידי המוסד).
הערה: העריכו את רמת ההרדמה המתאימה על ידי התבוננות בקצב הנשימה, טונוס השרירים, צביטת הבוהן, רפלקס הקרנית וצבע הריריות. יש להשתמש במשחת עיניים על העיניים למניעת יובש בזמן הרדמה. - העבירו את העכבר המורדם למיטת הניתוח וגלחו את אזור צוואר הרחם/בית החזה הגבי של העכבר.
- ספוג ועיקר את האזור כולו עם 70% אתנול ופובידון יוד.
- מלאו מזרק של 10 מ"ל באוויר סטרילי והצמידו מחט של 27 גרם לשקע.
- צבטו בעדינות והרימו את בסיס צוואר העכבר כדי ליצור מרווח בין הרקמה התת עורית לפאשיה.
- הנח את המחט בקו האמצע בין עצם השכמה של העכבר והזריק 3 מ"ל של אוויר סטרילי תת עורי כדי ליצור את נרתיק האוויר (איור 2).
הערה: בזמן הזרקת אוויר, החזק את שני צידי הגב ביד הנגדית כדי להבטיח שהאוויר יתפשט למרכז הגב, ויוצר נרתיק באמצע. - החזירו את העכבר לכלוב שחומם עם פד תרמי ועקבו אחריו מקרוב עד שיתאושש מההרדמה.
- הזרקו 3 מ"ל אוויר סטרילי כמתואר לעיל כדי לשמור על ניפוח החלל וליצור שקית בוגרת כל יומיים.
הערה: לפני כל ניפוח, שאפו את האוויר מהשקית כדי לאשר את המיקום הנכון של קצה המחט. הסר בזהירות את המזרק מהמחט והשאיר את קצה המחט בשקית. נפחו מחדש את השקית עם 3 מ"ל אוויר סטרילי.
4. השתלת חוטים מחוברים וחיסון חיידקים
- 7 ימים לאחר הזרקת האוויר הראשונה, יש להרדים את העכבר כמתואר בשלב 3.1.
הערה: במהלך ההליך הכירורגי, בדוק כל הזמן שהעכבר נושם ומורדם. ההליך הכירורגי כולו אורך בדרך כלל 10-15 דקות כאשר הוא מבוצע על ידי מנתח מיומן. ההרדמה נשמרת על ידי הנחת צינור המספק 2% איזופלורן מעורבב עם חמצן בסמוך לחוטם העכבר. - ספוג ועיקר את האזור כולו עם 70% אתנול ופובידון יוד.
- יש להזריק בופיבקאין תת עורי ממש לפני הניתוח.
- בצע חתך בקו אמצע-אורך של 3 מ"מ בחלק העליון של השקית.
- הכניסו מחט 18 גרם שמכילה את החוטים המחוברים לתוך השקית דרך החור ודחפו החוצה את החוטים באמצעות מזרק פנימי של מחט עמוד שדרה 25 גרם (איור 3A,B).
- השאר את קצה מחט ה-18 גרם בתוך השקית, הסר בעדינות את הגליל הפנימי והזריק 3 מ"ל של תרבית Xen36 של 1.0 x 105 CFU/mL באמצעות המזרק (איור 3C,D).
- הסירו בזהירות את כל המחטים, סגרו את העור באמצעות קליפס פצע ואטמו עם דבק עור מקומי (איור 3E,F).
- ודא שאין דליפה, החזר את העכבר לכלוב האישי שחומם עם פד תרמי ונטר כמו קודם.
5. הוצאת השתלים מהמורסה התת עורית
- לאחר המתת חסד באמצעות מנת יתר של איזופלואורן, יש לגלח את אזור צוואר הרחם, בית החזה והמותני של העכבר, ולספוג ולעקר את האזור כולו עם 70% אתנול ופובידון יוד (איור 4A).
הערה: המתת החסד בוצעה בהתאם להנחיות האגודה האמריקאית לרפואה וטרינרית (AVMA) להמתת חסד של בעלי חיים. - בצע חתך בקו האמצע של 2 ס"מ באזור המותני וקילף בזהירות את הרקמה התת עורית בעזרת מספריים.
- הרחב את החתך והדיסקציה התת עורית באופן פרוקסימלי והפרד את הרקמה הדביקה המקיפה את המורסה (איור 4B - D).
- כרתו את כל המורסה התת עורית (איור 4E).
- חתכו את המורסה וחלצו בזהירות את החוט מהחלק הפנימי של המורסה (איור 4F).
6. כימות הביופילם שנוצר על משטחי השתל
- בדיקת קריסטל סגול
- הנח את החוטים המופקים מהמורסה לבארות בודדות של צלחת בת 24 בארות המכילה 1 מ"ל מים נטולי יונים (DI).
- העבירו את החוטים לבארות חדשות המכילות 1 מ"ל של מי DI כדי להסיר חיידקים נדבקים באופן רופף מפני השטח של החוטים.
- תקן את הביופילם על החוטים עם 100% אתנול למשך דקה אחת ואפשר להם להתייבש.
- העבירו את החוטים לבארות חדשות המכילות 1 מ"ל של 0.1% מגיב סגול קריסטל.
- לאחר 15 דקות של צביעה, שטפו בעדינות את החוטים פעמיים במי DI כדי להסיר עודפי צבע.
- הנח את השתל בצינור מיקרו-צנטריפוגה בנפח 1.5 מ"ל המכיל 250 מיקרוליטר של 33% חומצה אצטית למשך 15 דקות; יש להמיס את הקריסטל סגול הדבק בביופילם על השתל, ולאחר מכן מערבולת למשך דקה אחת.
- העבירו 200 מיקרוליטר מהמתלה לצלחת של 96 בארות ומדדו את הספיגה ב-OD630 ננומטר באמצעות קורא מיקרו-פלטות. כל המדידה מתבצעת בשלוש עותקים.
- ספירת יחידות יוצרות מושבה (CFU)
- הסר את כל החיידקים הדבקים באופן רופף מעל פני החוטים כמתואר בשלב 6.1.2.
- הנח את השתל בצינור מיקרו-צנטריפוגה של 1.5 מ"ל המכיל 200 מיקרוליטר של טריפסין פי 10 ודגר בטמפרטורה של 37 מעלות צלזיוס למשך שעה.
- מערבולת למשך דקה אחת וסוניקט באמבט מים ב-100 וואט למשך 5 דקות, ולאחר מכן מערבולת נוספת למשך 30 שניות כדי לנתק את הביופילם לתוך המתלה.
- חסנו 10 מיקרוליטר מהתרחיף המדולל סדרתי על לוחות אגר TSB (TSB באגר 1.5%) עם 200 מיקרוגרם/מ"ל קנמיצין.
הערה: בצע הליך זה בשלוש עותקים עבור כל פתרון. - לאחר דגירה של הצלחות בטמפרטורה של 37 מעלות צלזיוס למשך 24 שעות, ספרו את המושבות על הצלחות וחשבו את מספר תאי החיידקים בתרבית המקורית באמצעות ספירת המושבות הממוצעת17.
הערה: כדי להבטיח שכל החיידקים יוסרו מהחוטים, דבר חיוני למדידה מדויקת, יש להכתים את החוטים בסגול קריסטל ולהתבונן בהם לאחר מריחת המתלה על הלוחות. בניסויים הראשוניים, השילוב של הדיסוציאציה המכנית והכימית לעיל הסיר בהצלחה את כל הביופילמים של Xen36 ממשטחי חוט הנירוסטה הקונבנציונלי (איור 5).
- ניתוח תגובת שרשרת פולימראז כמותית (qPCR)
- הסר את כל החיידקים הדבקים באופן רופף מעל פני החוטים כמתואר בשלב 6.1.2.
- הנח את השתל לתוך מיקרו-צינור של 1.5 מ"ל המכיל 600 מיקרוליטר TSB.
- חלץ DNA באמצעות מערכת ליזה אלקליין שונה ללא כדורים16.
הערה: הנפח הסופי של ה-DNA המנומק הוא 20 מיקרוליטר. - יש לדלל את ה-DNA ביחס של 1:10 ולאחסן אותו בטמפרטורה של -20 מעלות צלזיוס.
- בצע qPCR עבור הגנים luxA ו-16S rRNA 16.
הערה: כל תגובות ה-qPCR מבוצעות בשלוש עותקים. נפח תערובת התגובה הכולל הוא 10 מיקרוליטר, המכיל 3 מיקרוליטר של תבנית DNA, 5 מיקרוליטר של SYBR Green, 1 מיקרוליטר של מים נטולי נוקלאז ו-0.5 מיקרוליטר מכל פריימר. פריימרים לגן luxA הם 5'- GAGCATCATTTCACGGAGTTTG -3' ו-5'- ATAGCGGCAGTTCCTACATTC -3'. פריימרים לגן 16S rRNA הם 5'- GTGGAGGGTCATTGGAAACT - 3' ו-5'- CACTGGTGTTCCTCTCCTC - 3'. תנאי ה-PCR הם כדלקמן: דנטורציה ראשונית למשך 2 דקות ב-94 מעלות צלזיוס ואחריה 40 מחזורים של 15 שניות ב-94 מעלות צלזיוס, 30 שניות ב-60 מעלות צלזיוס ו-30 שניות ב-72 מעלות צלזיוס, והארכה סופית ב-72 מעלות צלזיוס למשך 5 דקות. - שרטט את הממוצע של ערכי הסף התלת-מחזורי (Ct) משורטט כנגד עקומת כיול שנוצרה עם DNA מטוהר ישירות מתרביות Xen36 טהורות מדוללות סדרתית כדי להעריך את העומס החיידקי על השתל (איור 6).
תוצאות
מחקר זה העריך את המהימנות של גישה מקיפה המשתמשת במודל עכבר חדשני של זיהום הקשור לשתלים עם הערכות כמותיות אופטימליות של היווצרות ביופילם על משטחי השתל, ששימש במחקר הקודם16. שני השתלים הזהים שימשו לבחינת הביופילם שנוצר על פני השטח שלהם, במטרה לוודא שניתן לדגור את שני השתלים בו זמנית בתנאי זיהום אחידים בתוך חלל תת עורי בודד במודל עכבר יחיד. עכברים עברו הליך יצירת כיס תת-עורי (איור 2), ואחרי 7 ימים, חוטי הנירוסטה המחוברים הושתלו לתוך השקית הבוגרת, ולאחר מכן חיסון עם Staphylococcus aureus Xen36 (איור 3). לאחר 14 יום לאחר החיסון, מורסה עטופה באורך של כ-2 ס"מ ורוחב של 1 ס"מ, המכילה את החוטים המחוברים שנוצרו בכיס (איור 4). החוטים נאספו מהמורסה, והביופילם שנוצר על כל חוט הוערך על ידי צביעה סגולה קריסטלית, ספירת CFU וניתוח qPCR. החוטים המוכתמים בסגול קריסטל הראו היווצרות ביופילם עקבית על פני השטח, ללא שינויים נראים לעין בין שני החוטים (איור 7A). המדידות המדויקות להערכת היווצרות הביופילם באמצעות שיטות אנליטיות השוואתיות בין-אישיות ותוך אינדיבידואליות הצביעו על כך שמדידות הספיגה של בדיקת סגול גבישי מומס (איור 7B), ספירת CFU (איור 7C) וניתוח qPCR (איור 7D) לא הראו הבדלים מובהקים סטטיסטית בעומס החיידקים בתוך הביופילם בשני החוטים. תוצאות אלה הצביעו על כך ששני החוטים הודגרו בו זמנית בתנאי זיהום זהים בכיס תת עורי בודד בתוך מודל עכבר יחיד.

איור 1: הכנת חוטים מחוברים להשתלת כיס תת עורי. (A) תמונה מייצגת של שתל בודד המורכב משני חוטי נירוסטה מחוברים (אורך: 8 מ"מ, קוטר: 0.5 מ"מ). (B) קצה של קצה פיפטה של 20 מיקרוליטר משמש כחיבור לשני החוטים. (C) החוטים המחוברים מוחדרים לאחר מכן לקצה מחט 18G להשתלה לתוך כיס תת עורי בוגר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
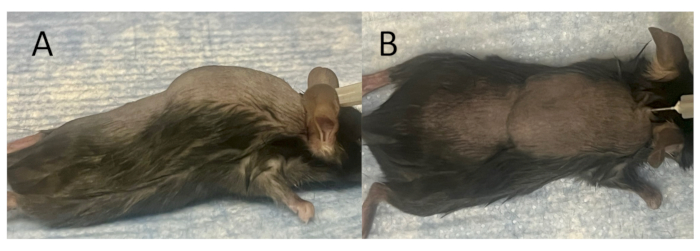
איור 2: יצירת כיס תת עורי בוגר להשתלה וחיסון. (A) המבט לרוחב, ו-(B) המבט העליון של כיס תת עורי שנוצר במלואו מיד לאחר הזרקת אוויר. כיס תת עורי נוצר בגב דגם עכבר על ידי החדרת מחט 27 גרם לעור לאורך קו האמצע בין עצם השכמה והזרקת 3 מ"ל אוויר סטרילי תת עורית. לאחר מכן, 3 מ"ל של אוויר סטרילי ניתנים כל יומיים למשך 7 ימים כדי להקל על הבשלת כיס תת עורי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
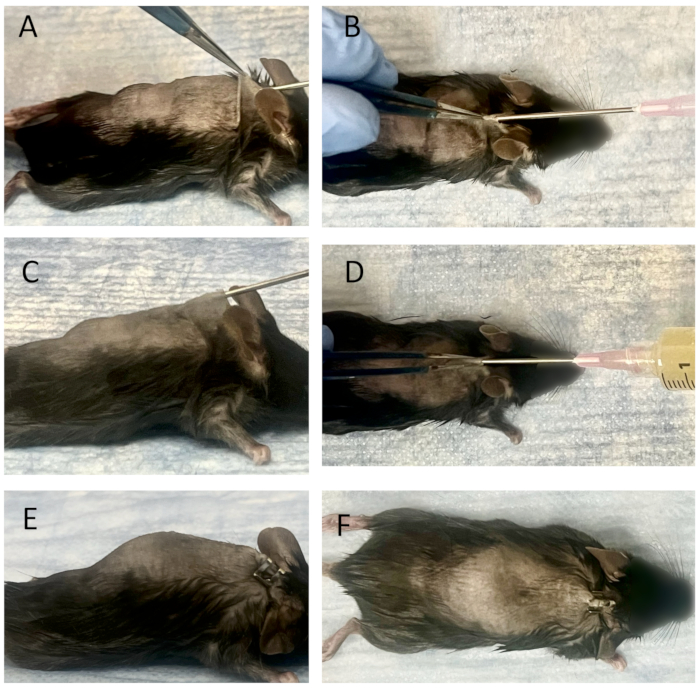
איור 3: השתלת חוטים מחוברים וחיסון חיידקים לתוך כיס תת עורי בוגר. (A) המבט לרוחב, ו-(B) המבט העליון של הליך החדרת המחט לתוך כיס תת עורי בוגר. החוטים המחוברים מונחים בקצה מחט 18 G, ומזרק פנימי של מחט עמוד שדרה 25G משמש לדחיפת החוטים. הם מוחדרים לתוך השקית התת עורית הבוגרת דרך חור העור. לאחר מכן החוטים מוכנסים לתוך השקית באמצעות מחט עמוד שדרה 25 גרם. חיסון חיידקים לתוך השקית כפי שנצפה מהמבט הצדדי (C) ומהמבט העליון (D). לאחר חיבור מזרק המכיל תמיסה חיידקית למחט 18 גרם, 3 מ"ל של תרבית Xen36 (1.0 x 105 CFU/ml) מחוסנים לתוך השקית. אתר ההחדרה נסגר לאחר הסרת מחט ה-18 G, ללא דליפה מהמבט הצדדי (E) או מהמבט העליון (F). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
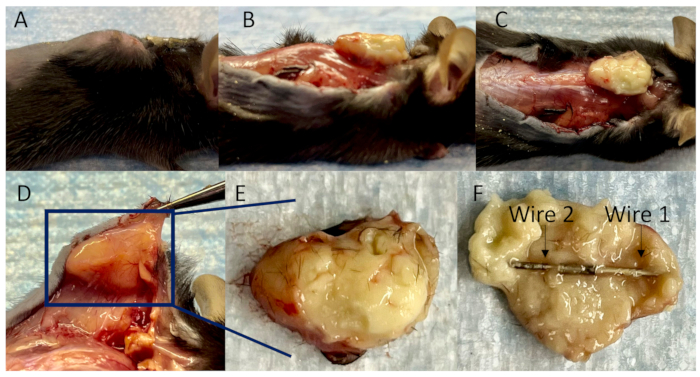
איור 4: אוסף חוטים מחוברים במורסה תת עורית. (A) מבט רוחבי של מודל עכבר לזיהומים שקשורים לשתלים ב-14 יום לאחר החיסון. (B) המבט לרוחב, (C) המבט העליון, ו-(D) המבט התחתון של המורסה התת-עורית עם כלי הדם המפותחים שמסביב לאחר הפרדת הרקמות הדביקות. (E) המורסה התת-עורית עטופה כולה, ו-(F) החוטים המחוברים עטופים במלואם בתוכה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: הסרת ביופילם שנוצר על חוטים לצורך הערכת CFU. (A) הביופילם שנוצר על פני השטח של כל חוט מוכתם באופן עקבי בסגול קריסטל 14 יום לאחר החיסון במבחנה. (B) הביופילם המוכתם מצטמצם על-ידי מערבולת וסוניקציה. (C) הוא מסולק לחלוטין על ידי הוספת טיפול בטריפסין. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
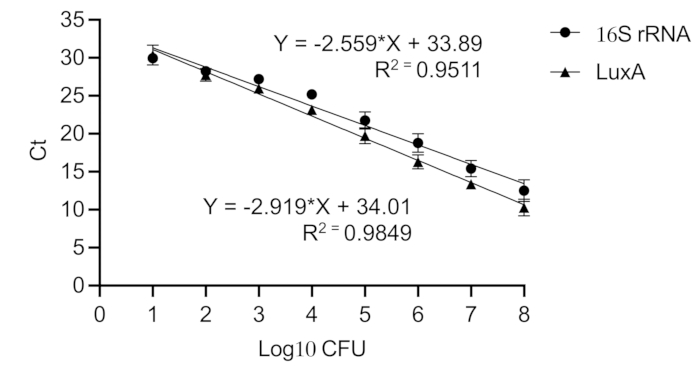
איור 6: עקומת כיול של גנים 16S rRNA ו-luxA ב-Staphylococcus aureus. עקומת כיול ממירה ערכי Ct לעומס החיידקים המקביל ב-CFU. נוצר דילול סדרתי של תרבית Staphylococcus aureus Xen36 טהורה (108 עד10 1 CFU). מקדם מתאם פירסון גבוה מתקבל עבור 16S rRNA (R2 = 0.951) ו-luxA (R2 = 0.985), המציין עקומות סטנדרטיות ליניאריות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
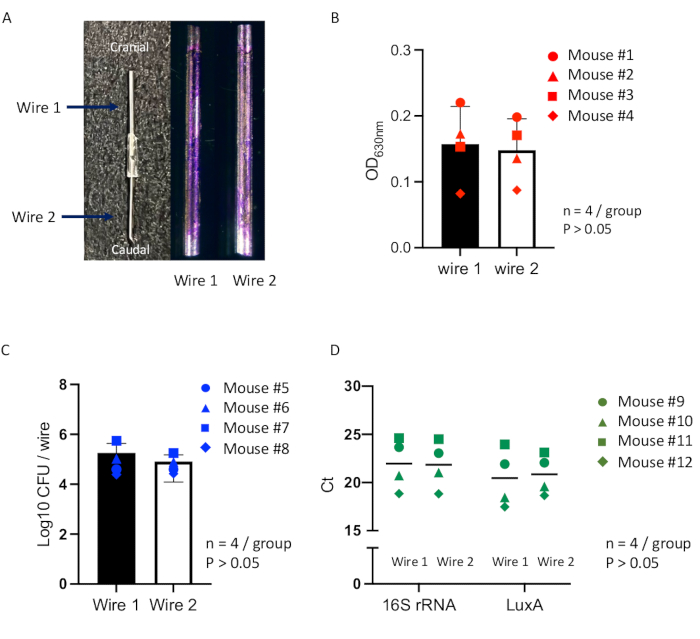
איור 7: הערכות כמותיות של היווצרות ביופילם על חוטים מחוברים בתוך מודל עכבר. (A) תמונות מייצגות של שתל יחיד המורכב משני חוטי נירוסטה מחוברים עבור השתלת השקית התת-עורית (משמאל) וביופילם בצבע סגול קריסטל שנוצר על פני השטח של כל חוט (חוט 1 או חוט 2) לאחר 14 יום לאחר החיסון (מימין). מדידות להערכת הביופילם באמצעות שיטות אנליטיות השוואתיות בין-אישיות ותוך אינדיבידואליות מבוצעות עבור כל חוט בתוך מודל עכבר (סה"כ n = 12), כולל (B) מדידת הספיגה של ביופילם מוכתם בסגול גבישי (n = 4; נקודת עיגול מציינת עכבר #1; נקודת משולש מציינת עכבר #2; נקודה מרובעת מציינת עכבר #3; נקודת יהלום מציינת עכבר #4). (C) ספירת CFU (n = 4; נקודת עיגול מציינת עכבר #5; נקודת משולש מציינת עכבר #6; נקודה מרובעת מציינת עכבר #7; נקודת יהלום מציינת עכבר #8), ו-(D) ניתוח qPCR (n = 4; נקודת עיגול מציינת עכבר #9; נקודת משולש מציינת עכבר #10; נקודה מרובעת מציינת עכבר #11; נקודת יהלום מציינת עכבר #12). ההבדלים בין קבוצות החוטים מוערכים באמצעות ניתוח שונות חד כיווני (ANOVA). כל הנתונים מוצגים כממוצע ± שגיאת תקן. ערכים מובהקים סטטיסטית הוגדרו כ-p < 0.05. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
מחקר זה הדגים גישה מקיפה להערכות כמותיות מדויקות של היווצרות ביופילם על שתלים מרובים על ידי מינוף מודל עכבר חדש וטכניקות ניתוח אופטימליות לזיהום הקשור לשתלים. כדי להבטיח ששני שתלים הודגרו בתנאי זיהום זהים באותו נבדק, נוצר כיס תת עורי בוגר בתוך עכבר בודד באמצעות הזרקות אוויר חוזרות ונשנות. מודל זה סיפק סביבה סגורה ויציבה שבה ניתן היה לדגור שני שתלים מחוברים בתנאי זיהום זהים, גם כאשר העכבר זז. לאחר החיסון בסטפילוקוקוס זהוב, התפתחה מורסה תת עורית בודדת, באורך של כ-2 ס"מ, הסוגרת את שני החוטים במלואם ודומה מאוד למאפיינים של זיהומים קליניים הקשורים לשתלים. שני החוטים חולצו מהמורסה, והביופילם הוסר מכל משטח באמצעות דיסוציאציה מכנית וכימית. תמיסת החיידקים המומסת שימשה לניתוח כמותי של העומס החיידקי בתוך הביופילם על כל חוט. ניתוח אנליטי השוואתי בין-אישי ותוך אישי של מספר חוטים נערך בין שני סוגי קבוצות החוטים להערכה כמותית. בנוסף, שני החוטים שהוצבו בתוך אותו עכבר נמדדו באופן השוואתי להערכה מדויקת יותר מכיוון שהם הודגרו בו זמנית עם זיהום אחיד. ניתוח ה-qPCR השתמש ברמות הביטוי היחסיות של הגן 16S rRNA ואופרון הלוקס, המקודד לוציפראז בסטפילוקוקוס זהוב ביולוגי, להערכה כמותית. מחקר זה שכלל שני חוטים זהים לא הביא להבדלים משמעותיים בכל ההערכות הכמותיות של היווצרות ביופילם בין קבוצות החוטים במספר עכברים או בין חוטים בתוך עכבר יחיד. בינתיים, המחקר הקודם הראה הבדלים משמעותיים בהערכות כמותיות של היווצרות ביופילם בין שתי קבוצות חוטים נפרדות בכמה עכברים16. לכן, גישה מקיפה זו מייעלת את מודל העכבר ואת הטכניקות האנליטיות כדי למזער את השונות של התוצאות, מה שעשוי לשפר את הדיוק והשחזור של הערכות כמותיות של היווצרות ביופילם על ביו-חומרים מרובים.
מספר מודלים in vivo של זיהומים הקשורים לשתלים הוקמו כדי להעריך את היעילות האנטי-מיקרוביאלית בביו-חומרים 9,18,19,20. במודלים אלה, שתל בודד ממוקם בדרך כלל בתהליך השוקה, עצם הירך או עמוד השדרה לכל בעל חיים, יחד עם חיסון חיידקים. מכיוון שהמורסה מתפתחת סביב השתל או בסמוך אליו לאחר החיסון, תוך חיקוי הדוק של המאפיינים הקליניים, מודלים אלה מועילים למחקר in vivo של זיהום הקשור לשתל. עם זאת, התוצאות מההערכות הכמותיות עשויות להיות לא עקביות עקב שתל בודד לכל נבדק, החיסון לחלל סגור בצורה לא מושלמת, ושונות בתגובות החיסוניות ובמצבי זיהום בין הנבדקים. בנוסף, ההערכות הכמותיות במודלים אלה דורשות לעתים קרובות מומחיות מיוחדת ומנגנון מדידה ספציפי, מה שמגביל את יישומם. למרות שגודל השתל מוגבל במודל עכבר זה, ניתן לשפר את הבעיות הללו על ידי התכונות של מתודולוגיה מקיפה זו, הכוללת דגירה בו זמנית של שתלים מרובים עם חיידקים בתנאי זיהום זהים בתוך עכבר יחיד.
השלב הקריטי ביותר בגישה זו הוא הסרת הביופילם שנוצר מהשתל. שיטה מייצגת להערכה כמותית של ביופילם היא ספירת CFU, הדורשת ניתוק של חיידקים מהביופילם, השעייתם במדיום וציפוי לאחר מכן11. בעוד שטכניקות מאמץ מכניות הכוללות סוניקציה ומערבולת משמשות בדרך כלל לניתוק ביופילם במחקרים רבים, ישנם חששות לגבי הספיקות שלהן בהסרה מוחלטת של כל הביופילם מהשתלים. אם טכניקות אלה יתבררו כלא מספיקות, אמינות התוצאות עלולה להיפגע. מחקר זה הראה שגירוי מכני לבדו לא יכול לנתק את הביופילם לחלוטין. לכן, שילוב טיפול כימי עם טריפסין וגירוי מכני הכרחי כדי להשיג ניתוק חיידקים אמין יותר ולכמת במדויק את העומס החיידקי החי בתוך הביופילם21.
ניתוח ה-qPCR משמש בדרך כלל במחקרי מיקרוביום כדי להעריך את העומס החיידקי הכולל בתוך הביופילם. בדיקה זו היא ככל הנראה שיטה מדויקת יותר להערכה כמותית מאשר בדיקת סגול גביש22. על ידי יצירת עקומת כיול עם DNA פלסמיד מטוהר ישירות מתרביות חיידקים טהורות, העומס החיידקי בתוך הביופילם יכול להיות מדויק. בהתחשב בכך שהגן 16S rRNA הוא תת-יחידה ריבוזומלית הקיימת בכל החיידקים, qPCR המכוון לגן 16S rRNA נמצא בשימוש נרחב לכימות חיידקים, והביטוי של הגן 16S rRNA יציב יחסית במהלך הצמיחה של Staphylococcus aureus 23,24. הגן luxA הוא מרכיב של אופרון לוקס בזן ביולומינסנט של Staphylococcus aureus Xen 36. מחקר זה הראה כי qPCR עבור הגן luxA יעיל גם להערכה כמותית של היווצרות ביופילם לאחר חיסון Xen 36. לפיכך, ניתן לייעל את ההערכה הכמותית של היווצרות ביופילם על ידי חיסון חיידק ביולומינסנט ושימוש בניתוח ביטוי גנים של אופרון הלוקס. הליך זה קל יחסית ליישום, ניתן לשחזור ומאפשר לחוקרים לנתח מספר דגימות בו זמנית. יתר על כן, הוא חסכוני ואינו דורש ציוד מיוחד, מה שהופך אותו לבחירה ריאלית עבור כל מעבדה.
לגישה מקיפה זו יש כמה מגבלות. ראשית, מחקר זה נועד בעיקר להעריך את היווצרות הביופילם על שתלים בסביבה מקומית וסגורה, ובכך להפוך אותו לבלתי מספיק כדי להעריך את ההשפעה של ביו-חומרים על זיהומים מערכתיים. שנית, העומס החיידקי הנדרש ליצירת מורסה מפותחת היטב במודל עכבר זה גבוה משמעותית מאשר במודלים חלופיים, מה שעשוי ליצור סביבה מאתגרת להערכת העמידות של ביו-חומרים לביופילם25. עם זאת, כדי ליצור מורסה המקיפה לחלוטין את השתלים ושתלים בתנאי זיהום חיידקי זהים, נדרש מינון גבוה יותר של תרבית חיידקים. שלישית, לא ניתן להשתמש במודל זה אם אחד השתלים משחרר תרכובות, מכיוון שהן עלולות להשפיע על השתל השני. רביעית, קצה הפיפטה המשמש לחיבור שני השתלים עשוי להשפיע על מהלך הזיהום, אם כי שימוש בקצה פיפטה זמין בדרך כלל הופך את המודל לקל ליישום בכל סביבת מעבדה.
לסיכום, מחקר זה מציג מודל עכבר חדש של זיהום הקשור לשתלים ושיטות אנליטיות אופטימליות להערכה כמותית מדויקת של היווצרות ביופילם. גישה מקיפה זו צפויה לשפר את הדיוק, השחזור והרבגוניות של מדדי התוצאה לכימות השוואתי של ביופילם על שתלים כירורגיים על ידי ניצול תכונותיו, ובכך לתרום לפיתוח עתידי של שתלים אנטי-מיקרוביאליים.
Disclosures
המחברים מצהירים שאין ניגודי אינטרסים.
Acknowledgements
מחקר זה מומן בחלקו על ידי תוכנית מחקר שיתופית של התעשייה והאוניברסיטה של NSF הנקראת המרכז לחידושים משבשים של שרירים ושלד (IIP-1916629), Komatsuseiki Kosakusho Co., Ltd., ו-Rosies Base, LLC.
Materials
| Name | Company | Catalog Number | Comments |
| Acetic Acid | THOMAS SCIENTIFIC | 12-16-15-00 | |
| Agilent BioTek 800 TS Absorbance Reader | Agilent | BT800TS | |
| Air-Tite Sterile Hypodermic Needles, Needle Gauge: 18 G | FISHER SCIENTIFIC | 14817151 (CS) | |
| BD Spinal Needles: 25 G | FISHER SCIENTIFIC | 22043805 | |
| Benchtop Incubator Shaker | FISHER SCIENTIFIC | ||
| Branson Ultrasonic Bath, 115 Vac, 60 Hz | FISHER SCIENTIFIC | 2489500 | |
| Branson Ultrasonics 2510R-MTH (Sonicator) | RPI-T48500-500.0 | ||
| Centrifuge sorvall pico | FISHER SCIENTIFIC | ||
| CFX96 Real Time Optics Module qPCR System | BIO-RAD | ||
| Compact Sterilizer, 30L | THOMAS SCIENTIFIC LLC | 22A00N096 (EA/1) | |
| Crystal Violet, 1%, Solution SCI_ED | FISHER SCIENTIFIC | 10114-58-6 | |
| Falcon 24-well cell culture plate | FISHER SCIENTIFIC | 877125 | |
| Falcon 96-well cell culture plate | FISHER SCIENTIFIC | 8771001 | |
| Fisherbrand Digital Vortex Mixer | FISHER SCIENTIFICS | ||
| Kanamycin | THOMAS SCIENTIFIC LLC | 15160054 | |
| Mannitol Salt Agar | FISHER SCIENTIFIC | ||
| Micirobiological Incubator | Thermo Scientific | 51028063H | |
| PBS, Phosphate Buffered Saline | |||
| Staphylococcus aureus ATCC 49525 (Xen36) | Perkin Elmer | 119243 | |
| SYBR Green I Nucleic Acid Gel Stain | FISHER SCIENTIFIC | ||
| Trypsin 10x (2.5%) | FISHER SCIENTIFIC | 15090046 | |
| Tryptic Soy Broth | NETA SCIENTIFIC INC | ||
| Zyppy Plasmid Miniprep Ki | FISHER SCIENTIFIC | 501977785 | pellet-free modified alkaline lysis system |
References
- Wukich, D. K., Lowery, N. J., McMillen, R. L., Frykberg, R. G. Postoperative infection rates in foot and ankle surgery: a comparison of patients with and without diabetes mellitus. J Bone Joint Surg Am. 92 (2), 287-295 (2010).
- Darouiche, R. O. Treatment of infections associated with surgical implants. N Engl J Med. 350 (14), 1422-1429 (2004).
- Arciola, C. R., Campoccia, D., Montanaro, L. Implant infections: Adhesion, biofilm formation and immune evasion. Nat Rev Microbiol. 16 (7), 397-409 (2018).
- Li, P., Yin, R., Cheng, J., Lin, J. Bacterial biofilm formation on biomaterials and approaches to its treatment and prevention. Int J Mol Sci. 24 (14), ijms241411680(2023).
- Chen, X., Zhou, J., Qian, Y., Zhao, L. Antibacterial coatings on orthopedic implants. Mater Today Bio. 19, 100586(2023).
- Pan, C., Zhou, Z., Yu, X. Coatings as the useful drug delivery system for the prevention of implant-related infections. J Orthop Surg Res. 13 (1), 220(2018).
- Savvidou, O. D., et al. Efficacy of antimicrobial coated orthopedic implants on the prevention of periprosthetic infections: A systematic review and meta-analysis. J Bone Jt Infect. 5 (4), 212-222 (2020).
- Sussman, E. M., Casey, B. J., Dutta, D., Dair, B. J. Different cytotoxicity responses to antimicrobial nanosilver coatings when comparing extract-based and direct-contact assays. J Appl Toxicol. 35 (6), 631-639 (2015).
- Cyphert, E. L., Zhang, N., Learn, G. D., Hernandez, C. J., von Recum, H. A. Recent advances in the evaluation of antimicrobial materials for resolution of orthopedic implant-associated infections in vivo. ACS Infect Dis. 7 (12), 3125-3160 (2021).
- Stavrakis, A. I., et al. Current animal models of postoperative spine infection and potential future advances. Front Med (Lausanne). 2, 34(2015).
- Carli, A. V., et al. Quantification of Peri-implant bacterial load and in vivo biofilm formation in an innovative, clinically representative mouse model of periprosthetic joint infection. J Bone Joint Surg Am. 99 (6), e25(2017).
- Bernthal, N. M., et al. A mouse model of post-arthroplasty Staphylococcus aureus joint infection to evaluate in vivo the efficacy of antimicrobial implant coatings. PLoS One. 5 (9), e12580(2010).
- Kelley, B. V., et al. In vivo mouse model of spinal implant infection. J Vis Exp. (160), e60560(2020).
- Meroni, G., et al. A Journey into animal models of human osteomyelitis: A review. Microorganisms. 10 (6), 10061135(2022).
- Wang, Y., et al. Mouse model of hematogenous implant-related Staphylococcus aureus biofilm infection reveals therapeutic targets. Proc Natl Acad Sci U S A. 114 (26), E5094-E5102 (2017).
- Mitsuhiro Nishizawa, D. H., et al. A novel approach to reducing spinal implant-associated infections. bioRxiv. , (2024).
- Fehlings, M. G., et al. A clinical practice guideline for the management of patients with acute spinal cord injury: Recommendations on the use of methylprednisolone sodium succinate. Global Spine J. 7 (3 Suppl), 203S-211S (2017).
- Dworsky, E. M., et al. Novel in vivo mouse model of implant-related spine infection. J Orthop Res. 35 (1), 193-199 (2017).
- Masters, E. A., et al. Distinct vasculotropic versus osteotropic features of S. agalactiae versus S. aureus implant-associated bone infection in mice. J Orthop Res. 39 (2), 389-401 (2021).
- Sheppard, W. L., et al. Novel in vivo mouse model of shoulder implant infection. J Shoulder Elbow Surg. 29 (7), 1412-1424 (2020).
- Mansouri, M. D., Ramanathan, V., Al-Sharif, A. H., Darouiche, R. O. Efficacy of trypsin in enhancing assessment of bacterial colonization of vascular catheters. J Hosp Infect. 76 (4), 328-331 (2010).
- Wang, X., Howe, S., Deng, F., Zhao, J. Current applications of absolute bacterial quantification in microbiome studies and decision-making regarding different biological questions. Microorganisms. 9 (9), 9091797(2021).
- Lima, A., Franca, A., Muzny, C. A., Taylor, C. M., Cerca, N. DNA extraction leads to bias in bacterial quantification by qPCR. Appl Microbiol Biotechnol. 106 (24), 7993-8006 (2022).
- Eleaume, H., Jabbouri, S. Comparison of two standardization methods in real-time quantitative RT-PCR to follow Staphylococcus aureus genes expression during in vitro growth. J Microbiol Methods. 59 (3), 363-370 (2004).
- Vidlak, D., Kielian, T. Infectious dose dictates the host response during Staphylococcus aureus orthopedic-implant biofilm infection. Infect Immun. 84 (7), 1957-1965 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved