Method Article
一种独特的小鼠模型,用于定量评估皮下脓肿手术植入物上生物膜的形成
* 这些作者具有相同的贡献
摘要
该协议描述了一种独特的植入物相关感染实验模型,该模型能够在同一条件下在一只小鼠中同时孵育两个植入物与细菌。它还允许使用优化的比较分析方法精确评估植入物表面的生物膜形成,展示了评估生物材料抗菌特性的先进技术。
摘要
为了开发一种用于骨科外科手术的具有抗菌特性的新型生物材料,建立与病理状态紧密相关的植入物相关感染的实验动物模型至关重要。此外,需要与对照样品进行定量比较,以评估材料上生物膜的形成。然而,由于受试者之间感染状态的异质性,目前的动物模型涉及为每个个体植入单一材料,可能会产生不一致的结果。此外,准确量化 体内 材料上生物膜的形成仍然具有挑战性,并且研究结果可能缺乏可靠性。为了解决这些问题,本研究展示了一种独特的植入物相关感染小鼠模型,该模型能够在一只小鼠的封闭环境中同时将两个植入物与细菌一起孵育,形成一个有包膜的皮下脓肿。一个成熟的气囊最初是在背部皮肤下形成的。将两根不锈钢丝连接并放入袋子中,然后接种 Xen 36,一种金黄色葡萄球 菌的生物发光菌株。接种后 14 天,钢丝周围已形成皮下脓肿。从每根导线的表面完全去除生物膜,并使用优化的方法准确测量溶解的细菌悬浮液,以评估植入物上的生物膜形成,确定菌落形成单位,并进行定量聚合酶链反应分析。通过利用生物发光细菌的 lux 纵子,使用 luxA 和 16S rRNA 的相对表达水平来确定每条线上生物膜内的细菌载量。这种优化的比较分析方法能够在单个小鼠模型内均匀感染条件下精确评估两条线上生物膜的形成,并可能促进具有抗菌特性的生物材料的发展。
引言
植入物相关感染在临床环境中仍然是一个重大挑战,因为尽管手术技术和植入物设计取得了进步,但它们仍可能导致骨科手术的高发病率和死亡率1。尽管由于手术室环境中无菌控制的现代标准和适当的围手术期抗生素预防方案,与外科植入物相关的感染发生率已显着降低,但初次手术中植入物相关感染的发生率仍为 2%-5%2。
植入物相关感染的主要潜在机制是在植入物表面形成生物膜,保护微生物免受抗生素和免疫系统的侵害,使感染难以根除 3,4。由于细菌粘附在植入物表面的生物膜形成第一阶段至关重要,因此最大限度地减少细菌粘附和随后的生物膜形成是降低植入物相关感染风险的重要策略。尽管各种植入技术具有抗菌特性,但由于细胞毒性和过敏等不良事件,这些技术尚未在临床上得到广泛使用 5,6,7,8。因此,对于协调安全性、有效性、稳定性和耐用性以降低植入物相关感染风险的抗菌植入物,仍然存在未满足的临床需求。具有抗菌特性的植入物的研发可以推动外科技术克服这些问题。
在进行大型动物模型和临床试验之前,使用小动物模型评估各种生物材料的抗菌性能至关重要9。大量研究表明,使用生物发光细菌的植入物相关感染的小鼠模型适用,该细菌包含 luxABCDE 纵子10、11、12、13、14、15。虽然这些模型加速了抗菌植入物或技术开发的研究,但它们有一定的局限性。首先,通常需要先进的专业知识和专用设备,例如 X 射线或专用成像系统,以直接准确地评估放置在小鼠模型中的植入物上的细菌负荷。其次,虽然收集的植入物通常会在每只动物的单个感染部位评估单独的植入物,但感染状况和免疫反应可能因个体而异,这可能导致比较评估结果的差异。因此,在比较各种生物材料 在体内的抗菌效果时,在均匀的环境中植入细菌并接种它们更有利于解决这些问题。此外,必须优化当前方法,并通过利用动物模型和所用细菌的特性进行具有可重复性和准确性的定量评估。
本研究提出了一种用于体内植入物相关感染的新型实验方法,该方法能够通过比较个体内和个内分析方法进行精确测量以评估单个小鼠模型中两个植入物表面的生物膜形成。可以使用优化的方法对每个植入物上的生物膜进行定量,以可视化植入物上的生物膜,确定金黄色葡萄球菌 Xen 36 生物发光菌株的菌落形成单位 (CFU) 和定量聚合酶链反应 (qPCR) 分析。先前的研究表明,使用这种综合方法,一种新型金属植入物对金黄色葡萄球菌具有有希望的体内抗菌功效16。这种方法可以在标准实验室环境中轻松实施,并可能加速开发抗菌生物材料的研究。
研究方案
所有动物程序均已获得加州大学旧金山分校 (UCSF) 机构动物护理和使用委员会 (IACUC) 的批准,并在与 UCSF 环境健康与安全管理的 UCSF 生物安全危害计划协商并获得批准后,在 BSL2 设施中进行。使用雄性和雌性 C57BL/6 小鼠 (12-16 周龄,25-50 mg)。材料表中列出了试剂和所用设备的详细信息。
1. 菌种制备
- 使用生物发光的 金黄色葡萄球菌 Xen36 (ATCC49525) 作为病原体。
注:该菌株购自美国典型培养物保藏中心(弗吉尼亚州马纳萨斯),独特地利用了 luxABCDE 纵子,该纵子经过优化并整合到宿主的天然质粒中。Xen36 还使用与 lux 纵子相关的卡那霉素抗性基因。 - 加入少量 Xen 36 冷冻甘油原液,并将这些块加入 5 mL 含有 200 μg/mL 卡那霉素的胰蛋白酶大豆肉汤 (TSB) 培养基中。
- 将培养物在 37 °C 下在振荡培养箱 (200 rpm) 中孵育过夜。
- 将 Xen36 划线到含有 200 μg/mL 卡那霉素的 TSB 琼脂平板(琼脂中的 1.5% 中的 TSB)上,并在 37 °C 下孵育过夜。
- 分离 Xen36 的单个菌落,并在 5 mL 含有 200 μg/mL 卡那霉素的 TSB 中培养,在 37 °C 下在振荡培养箱 (200 rpm) 中过夜。
- 测量所得培养物在 630 nm 处的吸光度。
- 稀释培养物,并根据 630 nm 处的吸光度制备 1.0 x 108 CFU/mL 的 Xen36 培养物。
注:在 630 nm(相对于 TSB 空白)处测量的吸光度为 0.5 大致相当于 1.0 x 108 CFU/ml 的 Xen36。 - 稀释培养物并制备 1.0 x 105 CFU/mL 的 Xen36 培养物。
2. 连接植入物的准备
- 使用两根由市售手术级不锈钢 (SUS316L) 制成的棒状线,每根线长 8 mm,直径 0.5 mm。
- 将两根导线插入切割成约 3 mm 长度的 20 μL 移液器吸头的两端,垂直连接两根导线。
注意: 将垂直连接的电线插入 18 G 针的尖端(图 1)。确保移液器吸头牢固固定导线,以防止断开连接。 - 在手术将电线植入小鼠之前,先对电线进行高压灭菌。
3. 形成成熟的皮下袋
注意:细菌接种前 7 天,按如下方式创建气袋:
- 通过吸入用 2% 异氟醚麻醉小鼠 (C57BL/6)(遵循机构批准的方案)。
注意:通过观察呼吸频率、肌张力、脚趾捏、角膜反射和粘膜颜色来评估适当的麻醉水平。在眼睛上使用眼药膏以防止麻醉时干燥。 - 将麻醉的小鼠转移到手术床上,剃掉小鼠的背侧宫颈/胸部区域。
- 用 70% 乙醇和聚维酮碘擦拭并消毒整个区域。
- 用无菌空气填充 10 mL 注射器,并将 27 G 针头连接到出口。
- 轻轻捏住并抬高小鼠颈部的根部,以在皮下组织和筋膜之间创造空间。
- 将针头放入小鼠肩胛骨之间的中线,皮下注射 3 mL 无菌空气以形成气袋(图 2)。
注意: 注入空气时,用另一只手按住背部的两侧,以确保空气扩散到背部中心,在中间形成一个袋子。 - 将鼠标放回用导热垫加热的笼子中并密切监测,直到它从麻醉中恢复过来。
- 如上所述注入 3 mL 无菌空气以维持腔体的充气并每 2 天创建一个成熟的袋子。
注意: 每次充气前,从造口袋中吸出空气,以确认针尖的正确位置。小心地从针头上取下注射器,将针尖留在袋中。用 3 mL 无菌空气重新充气小袋。
4. 连接导线的植入和细菌接种
- 第一次空气注射后 7 天,按照步骤 3.1 中的说明麻醉小鼠。
注意:在手术过程中,不断检查鼠标是否呼吸并已麻醉。如果由训练有素的外科医生进行,整个外科手术通常需要 10-15 分钟。通过在小鼠鼻子附近放置一根输送 2% 异氟醚与氧气混合的管子来维持麻醉。 - 用 70% 乙醇和聚维酮碘擦拭并消毒整个区域。
- 手术前皮下注射布比卡因。
- 在造口袋顶部做一个 3 mm 的中线纵向切口。
- 将包含连接电线的 18 G 针头通过孔插入袋子中,然后使用 25 G 脊髓针的内注射器推出电线(图 3A、B)。
- 将 18 G 针头的尖端留在袋子内,轻轻取下内筒,并使用注射器注射 3 mL 的 1.0 x 105 CFU/mL Xen36 培养物(图 3C、D)。
- 小心地取下所有针头,使用伤口夹闭合皮肤,并用局部皮肤粘合剂密封(图 3E、F)。
- 确保没有泄漏,将鼠标放回用导热垫加热的单个笼子中,然后像以前一样进行监控。
5. 从皮下脓肿中取出植入物
- 通过过量的异氟烷实施安乐死后,剃掉小鼠的颈椎、胸部和腰椎区域,并用 70% 乙醇和聚维酮碘擦拭和消毒整个区域(图 4A)。
注意:安乐死是根据美国兽医协会 (AVMA) 动物安乐死指南进行的。 - 在腰部区域做一个 2 厘米的中线切口,然后用剪刀小心地去除皮下组织。
- 向近端扩展切口和皮下解剖,并分离脓肿周围的粘附组织(图 4B - D)。
- 切除整个皮下脓肿(图 4E)。
- 切开脓肿并小心地从脓肿内部提取金属丝(图 4F)。
6. 定量种植体表面形成的生物膜
- 结晶紫测定
- 将从脓肿中提取的导线放入含有 1 mL 去离子 (DI) 水的 24 孔板的各个孔中。
- 将电线转移到含有 1 mL 去离子水的新井中,以去除电线表面任何松散粘附的细菌。
- 用 100% 乙醇将生物膜固定在电线上 1 分钟,然后让它们干燥。
- 将导线转移到含有 1 mL 0.1% 结晶紫试剂的新孔中。
- 染色 15 分钟后,用去离子水轻轻清洗电线两次,以去除多余的染料。
- 将植入物放入含有 250 μL 33% 乙酸的 1.5 mL 微量离心管中 15 分钟;溶解粘附在植入物上生物膜上的结晶紫,然后涡旋 1 分钟。
- 将 200 μL 悬浮液转移到 96 孔板中,并使用酶标仪测量 OD630 nm 处的吸光度。所有测量一式三份进行。
- 菌落形成单位 (CFU) 计数
- 按照步骤 6.1.2 中的说明从电线表面清除任何松散粘附的细菌。
- 将植入物放入含有 200 μL 10x 胰蛋白酶的 1.5 mL 微量离心管中,并在 37 °C 下孵育 1 小时。
- 涡旋 1 分钟,然后在 100 W 的水浴中超声处理 5 分钟,然后进一步涡旋 30 秒以将生物膜分离到悬浮液中。
- 将 10 μL 连续稀释的悬浮液接种到 TSB 琼脂平板(琼脂中的 1.5% 中的 TSB)上,加入 200 μg/mL 卡那霉素。
注意:对于每个解决方案,请一式三份执行此过程。 - 将板在37°C孵育24小时后,计数板上的菌落,并使用平均菌落计数17计算原始培养物中细菌细胞的数量。
注意:为确保去除电线上的所有细菌,这对于准确测量至关重要,请用结晶紫染色电线,并在将悬浮液涂在板上后观察它们。在初步实验中,上述机械和化学解离的结合成功地从传统不锈钢丝的表面去除了所有 Xen36 生物膜(图 5)。
- 定量聚合酶链反应 (qPCR) 分析
- 按照步骤 6.1.2 中的说明从电线表面清除任何松散粘附的细菌。
- 将植入物放入含有 600 μL TSB 的 1.5 mL 微管中。
- 使用无沉淀改良的碱性裂解系统提取 DNA16。
注:洗脱的 DNA 的最终体积为 20 μL。 - 以 1:10 的比例稀释 DNA 并将其储存在 -20 °C。
- 对 luxA 和 16S rRNA 基因16 进行 qPCR。
注:所有 qPCR 反应一式三份进行。总反应混合物体积为 10 μL,含有 3 μL DNA 模板、5 μL SYBR Green、1 μL 无核酸酶水和 0.5 μL 每种引物。luxA 基因的引物是 5'- GAGCATCATTTCACGGAGTTTG -3' 和 5'- ATAGCGGCAGTTCCTACATTC -3'。16S rRNA 基因的引物是 5'- GTGGAGGGTCATTGGAAACT - 3' 和 5'- CACTGGTGTTCCTCCATATCTC - 3'。PCR条件如下:在94°C下初始变性2分钟,然后在94°C下15秒,60°C下30秒,72°C下30秒40个循环,最后在72°C下延伸5分钟。 - 将三个循环阈值 (Ct) 值的平均值与直接从连续稀释的纯 Xen36 培养物中纯化的 DNA 生成的校准曲线作图,以估计植入物上的细菌载量(图 6)。
结果
本研究评估了一种综合方法的可靠性,该方法使用一种新的植入物相关感染小鼠模型,并对植入物表面生物膜的形成进行优化定量评估,该方法已在之前的研究中使用16。两个相同的植入物用于检查在其表面形成的生物膜,旨在验证两个植入物可以在单个小鼠模型中的单独皮下空间内在均匀的感染条件下同时孵育。小鼠接受皮下造袋程序(图 2),7 天后,将连接的不锈钢丝植入成熟的造袋中,然后接种 金黄色葡萄球菌 Xen36(图 3)。到接种后 14 天,长约 2 厘米、宽约 1 厘米的包膜脓肿,包含在造口袋中形成的连接线(图4)。从脓肿中取出金属丝,并通过结晶紫染色、CFU 计数和 qPCR 分析评估每根金属丝上形成的生物膜。结晶紫染色的导线在表面上显示出一致的生物膜形成,两根导线之间没有可观察到的变化(图 7A)。通过比较个体内分析方法评估生物膜形成的精确测量表明,溶解结晶紫测定(图 7B)、CFU 计数(图 7C)和 qPCR 分析(图 7D)的吸光度测量显示生物膜内的细菌载量在两条线上没有统计学上的显着差异。这些结果表明,在单个小鼠模型内的单个皮下袋中,在相同的感染条件下同时孵育两条导线。

图 1:用于皮下造口袋植入术的连接导线的准备。 (A) 由两根连接的不锈钢丝(长度:8 毫米,直径:0.5 毫米)组成的单个植入物的代表性图像。(B) 20 μL 移液器吸头的尖端用作两根导线的连接。(C) 随后将连接的导线插入 18 G 针头的尖端,以植入成熟的皮下袋。 请单击此处查看此图的较大版本。
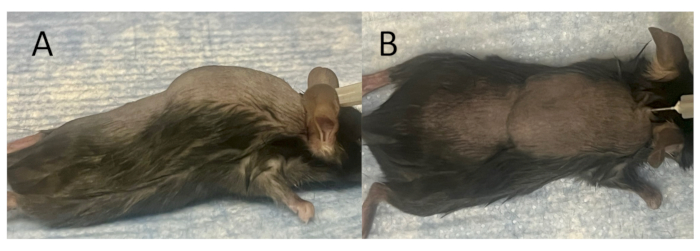
图 2:创建用于植入和接种的成熟皮下袋。 (A) 侧视图,以及 (B) 空气注射后完全形成的皮下袋的俯视图。通过将 27 G 针头沿肩胛骨之间的中线插入皮肤并皮下注射 3 mL 无菌空气,在小鼠模型的背面形成皮下袋。此后,每隔一天施用 3 mL 无菌空气,持续 7 天,以促进皮下袋的成熟。 请单击此处查看此图的较大版本。
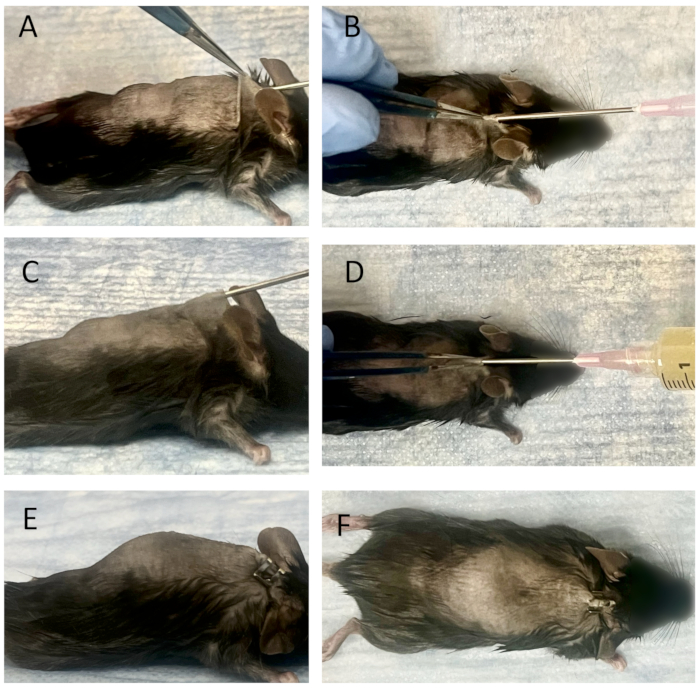
图 3:将连接的电线和细菌接种物植入成熟的皮下袋中。 (A) 侧视图,以及 (B) 将针头插入成熟皮下袋的俯视图。将连接的电线放入 18 G 针头的尖端,并使用 25 G 脊髓针的内注射器推出电线。它们通过皮肤孔插入成熟的皮下袋中。随后使用 25 G 脊髓针将电线放入袋中。从侧视图 (C) 和顶视图 (D) 观察到的细菌接种到造袋中。将含有细菌溶液的注射器连接到 18 G 针头后,将 3 mL Xen36 培养物 (1.0 x 105 CFU/ml) 接种到袋子中。取出 18 G 针头后,插入部位闭合,从侧视图 (E) 或俯视图 (F) 均未检测到泄漏。 请单击此处查看此图的较大版本。
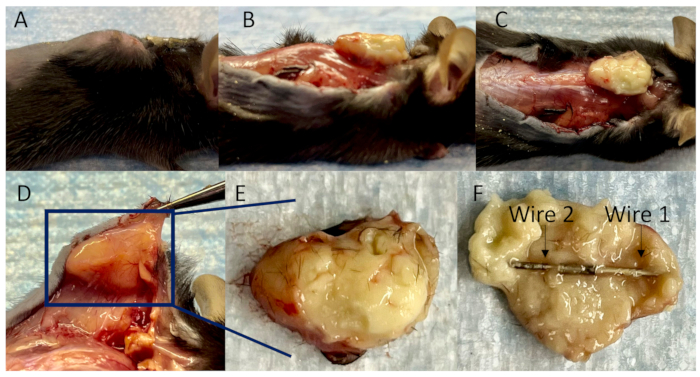
图 4:皮下脓肿中连接导线的集合。 (A) 接种后 14 天植入物相关感染的小鼠模型的侧视图。(B) 分离粘附组织后皮下脓肿的侧视图,(C) 俯视图和 (D) 皮下脓肿周围发育良好的血管的底视图。(E) 皮下脓肿完全包裹,(F) 连接的导线完全包裹在其中。 请单击此处查看此图的较大版本。

图 5:去除在导线上形成的生物膜以进行 CFU 评估。 (A) 在 体外接种后 14 天,在每根导线表面形成的生物膜始终被结晶紫染色。(B) 染色的生物膜通过涡旋和超声处理而减少。(C) 添加胰蛋白酶处理可完全消除。 请单击此处查看此图的较大版本。
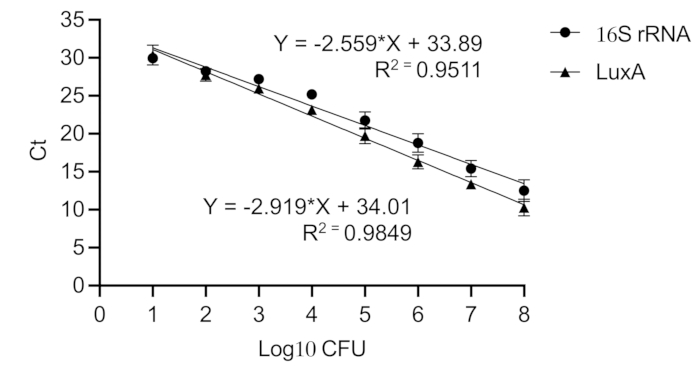
图 6:金黄色葡萄球菌中 16S rRNA 和 luxA 基因的校准曲线。校准曲线将 Ct 值转换为 CFU 中的等效细菌载量。制备纯金黄色葡萄球菌 Xen36 培养物(108 至 101 CFU)的连续稀释液。16S rRNA (R2 = 0.951) 和 luxA (R2 = 0.985) 获得高 Pearson 相关系数,表明线性标准曲线。请单击此处查看此图的较大版本。
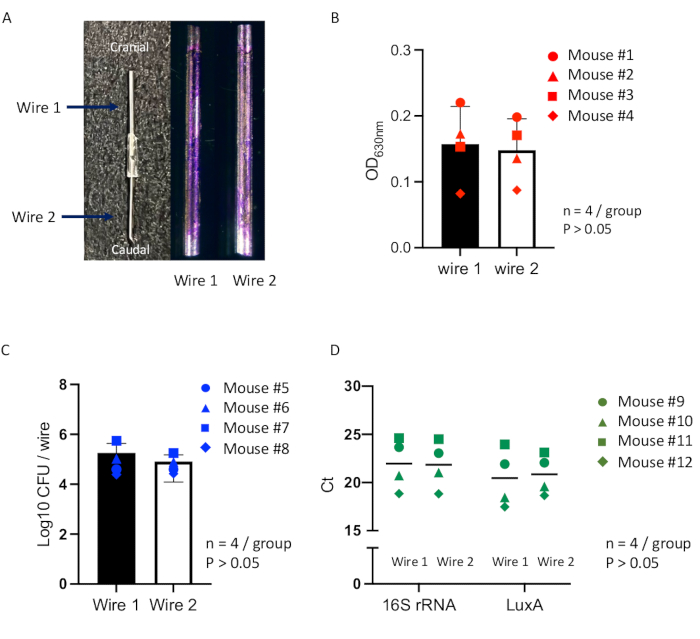
图 7:小鼠模型中连接导线上生物膜形成的定量评估。 (A) 单个植入物的代表性图像,由两根连接的不锈钢丝组成,用于皮下袋植入术(左)和接种后 14 天在每根线(1 号线或 2 号线)表面形成的结晶紫染色生物膜(右)。使用比较个体内分析方法对小鼠模型中的每条线进行测量以评估生物膜(总计 n = 12),包括 (B) 结晶紫染色生物膜的吸光度测量(n = 4;圆点表示小鼠 #1;三角形点表示小鼠 #2;方点表示小鼠 #3;菱形点表示小鼠 #4)。(C) CFU 计数(n = 4;圆点表示小鼠 #5;三角形点表示小鼠 #6;方点表示小鼠 #7;菱形点表示小鼠 #8)和 (D) qPCR 分析(n = 4;圆点表示小鼠 #9;三角形点表示小鼠 #10;方点表示小鼠 #11;菱形点表示小鼠 #12)。使用单因素方差分析 (ANOVA) 评估线组之间的差异。所有数据均以平均值±标准误差表示。具有统计学意义的值定义为 p < 0.05。请单击此处查看此图的较大版本。
讨论
本研究展示了一种通过利用新型小鼠模型和优化的种植体相关感染分析技术,对多个植入物上生物膜形成进行精确定量评估的综合方法。为了确保在同一受试者的相同感染条件下孵育两个植入物,通过重复空气注射在单个小鼠内创建一个成熟的皮下袋。该模型提供了一个封闭而稳定的环境,即使在小鼠移动时,也可以在相同的感染条件下孵育两个相连的植入物。接种 金黄色葡萄球菌后,形成一个孤立的包膜皮下脓肿,长约 2 cm,完全包裹着两条金属丝,与临床植入物相关感染的特征非常相似。从脓肿中提取两根线,并使用机械和化学解离从每个表面去除生物膜。溶解的细菌溶液用于定量分析每根导线上生物膜内的细菌载量。在两种类型的导线组之间对多根导线进行个体间和个体内的比较分析,以进行定量评估。此外,放置在同一只小鼠中的两条电线都经过比较测量,以便更准确地评估,因为它们同时与均匀感染一起孵育。qPCR 分析使用 16S rRNA 基因和勒克斯纵子的相对表达水平,后者在生物发光金 黄色葡萄球菌中编码荧光素酶,用于定量评估。这项涉及两条相同电线的研究导致几只小鼠的电线组之间或一只小鼠内的电线之间生物膜形成的所有定量评估没有显着差异。同时,先前的研究表明,在几只小鼠中,两个不同的线组之间生物膜形成的定量评估存在显着差异16。因此,这种全面的方法优化了小鼠模型和分析技术,以最大限度地减少结果的可变性,从而有可能提高多种生物材料上生物膜形成定量评估的准确性和可重复性。
已经建立了几种植入物相关感染的体内模型来评估生物材料中的抗菌效果 9,18,19,20。在这些模型中,通常将单个植入物与细菌接种一起放置在每只动物的胫骨、股骨或脊柱突中。由于脓肿在接种后在种植体周围或附近发展,与临床特征非常相似,因此这些模型有助于种植体相关感染的体内研究。然而,由于每个受试者只有一个植入物、接种到不完美的封闭空间以及受试者之间免疫反应和感染状况的差异,定量评估的结果可能不一致。此外,这些模型中的定量评估通常需要专业知识和特定的测量设备,这限制了它们的适用性。尽管这种小鼠模型的植入物大小有限,但这些问题可以通过这种综合方法的属性来改善,该方法涉及在一只小鼠中相同感染条件下同时孵育多个植入物与细菌。
这种方法中最关键的步骤是从植入物中去除形成的生物膜。生物膜定量评估的代表性方法是 CFU 计数,它需要将细菌从生物膜中分离出来,将它们悬浮在培养基中,然后进行电镀11。虽然在许多研究中,涉及超声处理和涡旋的机械应力技术通常用于分离生物膜,但人们担心它们是否足以从植入物中完全去除所有生物膜。如果这些技术被证明是不够的,结果的可靠性可能会受到影响。这项研究表明,单独的机械刺激不能完全分离生物膜。因此,将化学处理与胰蛋白酶和机械刺激相结合是必要的,以实现更可靠的细菌分离并准确量化生物膜内的活细菌载量21。
qPCR 分析通常用于微生物组研究,以评估生物膜内的整体细菌载量。该测定法可能比结晶紫测定法22 更准确的定量评估方法。通过使用直接从纯细菌培养物中纯化的质粒 DNA 创建校准曲线,生物膜内的细菌载量可以准确。鉴于 16S rRNA 基因是存在于所有细菌中的核糖体亚基,靶向 16S rRNA 基因的 qPCR 被广泛用于细菌定量,并且 16S rRNA 基因的表达在金黄色葡萄球菌生长过程中相对稳定 23,24。luxA 基因是金黄色葡萄球菌 Xen 36 生物发光菌株中 lux纵子的一个组成部分。本研究表明,luxA 基因的 qPCR 也可用于定量评估接种 Xen 36 后生物膜的形成。因此,可以通过接种生物发光细菌并使用 lux纵子的基因表达分析来优化生物膜形成的定量评估。该程序相对容易实施、可重复,并使研究人员能够同时分析多个样品。此外,它经济实惠,不需要特殊设备,是任何实验室的可行选择。
这种全面的方法有一些局限性。首先,本研究主要旨在评估局部和封闭环境中植入物上生物膜的形成,因此不足以评估生物材料对全身感染的影响。其次,在该小鼠模型中形成发达脓肿所需的细菌负荷远高于替代模型,这可能为评估生物材料对生物膜的抵抗力25 创造一个具有挑战性的环境。然而,为了在相同的细菌感染条件下形成完全围绕植入物的脓肿并培养植入物,需要更高剂量的细菌培养。第三,如果其中一个植入物释放化合物,则不能使用此模型,因为它们可能会影响另一个植入物。第四,用于连接两个植入物的移液器吸头可能会影响感染过程,尽管使用常用的移液器吸头可以使该模型在任何实验室环境中轻松实施。
总之,本研究提出了一种新的植入物相关感染小鼠模型和用于精确定量评估生物膜形成的优化分析方法。这种全面的方法有望通过利用其属性来提高外科植入物比较生物膜定量结果测量的准确性、可重复性和多功能性,从而为抗菌植入物的未来发展做出贡献。
披露声明
作者声明没有利益冲突。
致谢
这项研究部分由名为 Center for Disruptive Musculoskeletal Innovations (IIP-1916629)、Komatsuseiki Kosakusho Co., Ltd. 和 Rosies Base, LLC 的 NSF 产学/大学合作研究计划资助。
材料
| Name | Company | Catalog Number | Comments |
| Acetic Acid | THOMAS SCIENTIFIC | 12-16-15-00 | |
| Agilent BioTek 800 TS Absorbance Reader | Agilent | BT800TS | |
| Air-Tite Sterile Hypodermic Needles, Needle Gauge: 18 G | FISHER SCIENTIFIC | 14817151 (CS) | |
| BD Spinal Needles: 25 G | FISHER SCIENTIFIC | 22043805 | |
| Benchtop Incubator Shaker | FISHER SCIENTIFIC | ||
| Branson Ultrasonic Bath, 115 Vac, 60 Hz | FISHER SCIENTIFIC | 2489500 | |
| Branson Ultrasonics 2510R-MTH (Sonicator) | RPI-T48500-500.0 | ||
| Centrifuge sorvall pico | FISHER SCIENTIFIC | ||
| CFX96 Real Time Optics Module qPCR System | BIO-RAD | ||
| Compact Sterilizer, 30L | THOMAS SCIENTIFIC LLC | 22A00N096 (EA/1) | |
| Crystal Violet, 1%, Solution SCI_ED | FISHER SCIENTIFIC | 10114-58-6 | |
| Falcon 24-well cell culture plate | FISHER SCIENTIFIC | 877125 | |
| Falcon 96-well cell culture plate | FISHER SCIENTIFIC | 8771001 | |
| Fisherbrand Digital Vortex Mixer | FISHER SCIENTIFICS | ||
| Kanamycin | THOMAS SCIENTIFIC LLC | 15160054 | |
| Mannitol Salt Agar | FISHER SCIENTIFIC | ||
| Micirobiological Incubator | Thermo Scientific | 51028063H | |
| PBS, Phosphate Buffered Saline | |||
| Staphylococcus aureus ATCC 49525 (Xen36) | Perkin Elmer | 119243 | |
| SYBR Green I Nucleic Acid Gel Stain | FISHER SCIENTIFIC | ||
| Trypsin 10x (2.5%) | FISHER SCIENTIFIC | 15090046 | |
| Tryptic Soy Broth | NETA SCIENTIFIC INC | ||
| Zyppy Plasmid Miniprep Ki | FISHER SCIENTIFIC | 501977785 | pellet-free modified alkaline lysis system |
参考文献
- Wukich, D. K., Lowery, N. J., McMillen, R. L., Frykberg, R. G. Postoperative infection rates in foot and ankle surgery: a comparison of patients with and without diabetes mellitus. J Bone Joint Surg Am. 92 (2), 287-295 (2010).
- Darouiche, R. O. Treatment of infections associated with surgical implants. N Engl J Med. 350 (14), 1422-1429 (2004).
- Arciola, C. R., Campoccia, D., Montanaro, L. Implant infections: Adhesion, biofilm formation and immune evasion. Nat Rev Microbiol. 16 (7), 397-409 (2018).
- Li, P., Yin, R., Cheng, J., Lin, J. Bacterial biofilm formation on biomaterials and approaches to its treatment and prevention. Int J Mol Sci. 24 (14), ijms241411680(2023).
- Chen, X., Zhou, J., Qian, Y., Zhao, L. Antibacterial coatings on orthopedic implants. Mater Today Bio. 19, 100586(2023).
- Pan, C., Zhou, Z., Yu, X. Coatings as the useful drug delivery system for the prevention of implant-related infections. J Orthop Surg Res. 13 (1), 220(2018).
- Savvidou, O. D., et al. Efficacy of antimicrobial coated orthopedic implants on the prevention of periprosthetic infections: A systematic review and meta-analysis. J Bone Jt Infect. 5 (4), 212-222 (2020).
- Sussman, E. M., Casey, B. J., Dutta, D., Dair, B. J. Different cytotoxicity responses to antimicrobial nanosilver coatings when comparing extract-based and direct-contact assays. J Appl Toxicol. 35 (6), 631-639 (2015).
- Cyphert, E. L., Zhang, N., Learn, G. D., Hernandez, C. J., von Recum, H. A. Recent advances in the evaluation of antimicrobial materials for resolution of orthopedic implant-associated infections in vivo. ACS Infect Dis. 7 (12), 3125-3160 (2021).
- Stavrakis, A. I., et al. Current animal models of postoperative spine infection and potential future advances. Front Med (Lausanne). 2, 34(2015).
- Carli, A. V., et al. Quantification of Peri-implant bacterial load and in vivo biofilm formation in an innovative, clinically representative mouse model of periprosthetic joint infection. J Bone Joint Surg Am. 99 (6), e25(2017).
- Bernthal, N. M., et al. A mouse model of post-arthroplasty Staphylococcus aureus joint infection to evaluate in vivo the efficacy of antimicrobial implant coatings. PLoS One. 5 (9), e12580(2010).
- Kelley, B. V., et al. In vivo mouse model of spinal implant infection. J Vis Exp. (160), e60560(2020).
- Meroni, G., et al. A Journey into animal models of human osteomyelitis: A review. Microorganisms. 10 (6), 10061135(2022).
- Wang, Y., et al. Mouse model of hematogenous implant-related Staphylococcus aureus biofilm infection reveals therapeutic targets. Proc Natl Acad Sci U S A. 114 (26), E5094-E5102 (2017).
- Mitsuhiro Nishizawa, D. H., et al. A novel approach to reducing spinal implant-associated infections. bioRxiv. , (2024).
- Fehlings, M. G., et al. A clinical practice guideline for the management of patients with acute spinal cord injury: Recommendations on the use of methylprednisolone sodium succinate. Global Spine J. 7 (3 Suppl), 203S-211S (2017).
- Dworsky, E. M., et al. Novel in vivo mouse model of implant-related spine infection. J Orthop Res. 35 (1), 193-199 (2017).
- Masters, E. A., et al. Distinct vasculotropic versus osteotropic features of S. agalactiae versus S. aureus implant-associated bone infection in mice. J Orthop Res. 39 (2), 389-401 (2021).
- Sheppard, W. L., et al. Novel in vivo mouse model of shoulder implant infection. J Shoulder Elbow Surg. 29 (7), 1412-1424 (2020).
- Mansouri, M. D., Ramanathan, V., Al-Sharif, A. H., Darouiche, R. O. Efficacy of trypsin in enhancing assessment of bacterial colonization of vascular catheters. J Hosp Infect. 76 (4), 328-331 (2010).
- Wang, X., Howe, S., Deng, F., Zhao, J. Current applications of absolute bacterial quantification in microbiome studies and decision-making regarding different biological questions. Microorganisms. 9 (9), 9091797(2021).
- Lima, A., Franca, A., Muzny, C. A., Taylor, C. M., Cerca, N. DNA extraction leads to bias in bacterial quantification by qPCR. Appl Microbiol Biotechnol. 106 (24), 7993-8006 (2022).
- Eleaume, H., Jabbouri, S. Comparison of two standardization methods in real-time quantitative RT-PCR to follow Staphylococcus aureus genes expression during in vitro growth. J Microbiol Methods. 59 (3), 363-370 (2004).
- Vidlak, D., Kielian, T. Infectious dose dictates the host response during Staphylococcus aureus orthopedic-implant biofilm infection. Infect Immun. 84 (7), 1957-1965 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。