Method Article
皮下膿瘍の外科用インプラントにおけるバイオフィルム形成の定量的評価のためのユニークなマウスモデル
* これらの著者は同等に貢献しました
要約
このプロトコルは、1匹のマウス内で同じ条件下で2つのインプラントと細菌を同時にインキュベートすることを可能にする、インプラント関連感染症のユニークな実験モデルを記述しています。また、最適化された比較分析法を使用してインプラント表面のバイオフィルム形成を正確に評価し、バイオマテリアルの抗菌特性を評価するための高度な技術を実証します。
要約
整形外科手術用の抗菌性を有する新規生体材料を開発するためには、病態を忠実に模倣したインプラント関連感染症の実験動物モデルを確立することが重要です。さらに、材料上のバイオフィルム形成を評価するためには、対照サンプルとの定量的な比較が必要です。しかし、現在の動物モデルでは、各個体に単一の材料を移植するため、被験者間の感染状態の不均一性により、結果に一貫性がない可能性があります。さらに、in vivoで材料上のバイオフィルム形成を正確に定量することは依然として困難であり、その結果の信頼性に欠ける可能性があります。これらの問題に対処するために、本研究では、1匹のマウス内の密閉された環境で2つのインプラントと細菌を同時にインキュベートし、カプセル化された皮下膿瘍を形成することができる、インプラント関連感染症のユニークなマウスモデルを示しました。成熟したエアポーチは、最初に背中の皮膚の下に作成されました。2本のステンレス鋼線を接続してポーチに入れ、続いて黄色ブドウ球菌の生物発光株であるXen 36を接種しました。接種後14日で、ワイヤーの周囲に皮下膿瘍が形成されました。バイオフィルムは各ワイヤーの表面から完全に除去され、溶解した細菌懸濁液は、インプラント上のバイオフィルム形成の評価、コロニー形成ユニットの決定、および定量的ポリメラーゼ連鎖反応分析の実施に最適な方法を使用して正確に測定されました。生物発光細菌のルクスオペロンを活用することにより、luxAおよび16S rRNAの相対的な発現レベルを使用して、各ワイヤー上のバイオフィルム内の細菌負荷を決定しました。この最適化された比較分析アプローチにより、1つのマウスモデル内の均一な感染条件下で2本のワイヤー上のバイオフィルム形成を正確に評価することができ、抗菌特性を持つバイオマテリアルの進歩を促進する可能性があります。
概要
インプラント関連の感染症は、外科技術やインプラント設計の進歩にもかかわらず、整形外科手術で高い罹患率と死亡率を引き起こす可能性があるため、臨床現場では依然として大きな課題となっています1。手術室環境での無菌管理の最新の基準と周術期の抗生物質予防のための適切なプロトコルにより、外科インプラントに関連する感染症の発生率は大幅に減少しましたが、一次手術におけるインプラント関連感染症の発生率は 2%-5%2 のままです。
インプラント関連感染症の主な根本的なメカニズムは、インプラント表面にバイオフィルムが形成され、微生物を抗生物質や免疫系から保護し、感染の根絶を困難にすることです3,4。バイオフィルム形成の最初の段階では、インプラント表面への細菌の付着が重要であるため、細菌の付着とその後のバイオフィルム形成を最小限に抑えることは、インプラント関連の感染リスクを減らすための重要な戦略です。さまざまなインプラント技術の抗菌特性にもかかわらず、これらは細胞毒性やアレルギーなどの有害事象のために臨床的に広く使用されていません5,6,7,8。そのため、安全性、有効性、安定性、耐久性を調和させ、インプラント関連感染症のリスクを低減する抗菌インプラントに対する臨床ニーズはまだ満たされていません。抗菌性を有するインプラントの研究開発は、これらの問題を克服するための外科技術を進歩させる可能性があります。
小動物モデルを用いて様々な生体材料の抗菌特性を評価することは、大型動物モデルや臨床試験に進む前に不可欠である9。多くの研究により、luxABCDEオペロン10,11,12,13,14,15を含む生物発光細菌を使用したインプラント関連感染症の適切なマウスモデルが示されています。これらのモデルは、抗菌インプラントや技術の開発に向けた研究を加速させる一方で、一定の限界があります。まず、マウスモデルに埋入されたインプラントにかかる細菌負荷を直接かつ正確に評価するためには、高度な専門知識とX線や専用のイメージングシステムなどの特殊な機器が必要になることがよくあります。第二に、採取されたインプラントは通常、動物1匹につき1つの感染部位で単独のインプラントを評価しますが、感染状態や免疫学的反応は個人によって異なる場合があり、比較評価の結果にばらつきが生じる可能性があります。したがって、生体内でさまざまな生体材料の抗菌効果を比較すると、均一な環境で細菌を移植および接種する方が、これらの問題に対処するために有益です。また、現在の方法論を最適化し、動物モデルや使用する細菌の特性を活かして、再現性と精度で定量的な評価を行うことも重要です。
この研究は、in vivoインプラント関連感染症の新しい実験的アプローチを提示し、1つのマウスモデル内の2つのインプラントの表面上のバイオフィルム形成を、個人間および個人内の分析方法の比較を通じて正確に測定することを可能にします。各インプラント上のバイオフィルムは、インプラント上のバイオフィルムを視覚化するための最適化された方法を使用して定量化でき、コロニー形成単位(CFU)の決定、および黄色ブドウ球菌(Xen 36)の生物発光株の定量的ポリメラーゼ連鎖反応(qPCR)分析を行うことができます。以前の研究では、この包括的なアプローチを使用して、新しい金属インプラントが黄色ブドウ球菌に対して有望なin vivo抗菌効果を持っていることが示されました16。この方法論は、標準的な実験室環境で簡単に導入でき、抗菌バイオマテリアルの開発研究を加速させる可能性があります。
プロトコル
すべての動物処置は、カリフォルニア大学サンフランシスコ校(UCSF)の動物管理・使用委員会(IACUC)によって承認されており、UCSF環境衛生安全局が管理するUCSFバイオセーフティハザードプログラムとの協議と承認を経て、BSL2施設で実施されます。雌雄のC57BL/6マウス(12-16週齢、25-50mg)を用いた。試薬や使用した機器の詳細は、資料表に記載されています。
1.バクテリアの準備
- 病原体として生物発光 性黄色ブドウ球菌 Xen36(ATCC49525)を使用します。
注:この株は、American Type Culture Collection(バージニア州マナサス)から入手し、ホストのネイティブプラスミドに最適化されて統合された luxABCDE オペロンを独自に利用しています。Xen36は、 ルクス オペロンに結合したカナマイシン耐性遺伝子も利用しています。 - Xen 36の凍結グリセロールストックを少量加え、200 μg / mLのカナマイシンを含む5 mLのトリプシン大豆ブロス(TSB)培地に加えます。.
- 培養物を振盪インキュベーター(200 rpm)で37°Cで一晩インキュベートします。
- 200 μg/mLのカナマイシンを含むTSB寒天プレート(TSB寒天中1.5%)にXen36をストリークし、37°Cで一晩インキュベートします。
- Xen36の単一コロニーを分離し、200 μg/mLのカナマイシンを含む5 mLのTSBで、振とうインキュベーター(200 rpm)で37°Cで一晩培養します。
- 得られた培養物の630nmでの吸光度を測定します。
- 培養物を希釈し、630 nmの吸光度に基づいて1.0 x 108 CFU / mLのXen36培養物を作ります。
注:630 nm(TSBブランクに対して)の0.5の吸光度測定値は、Xen36の1.0 x 108 CFU / mlとほぼ同等です。 - 培養物を希釈し、Xen36培養物を1.0 x 105 CFU / mLにします。
2. 連結インプラントの作製
- 長さ8mm、直径0.5mmの市販の外科用ステンレス鋼(SUS316L)で構成された2本の棒状ワイヤーを使用します。
- 約3 mmの長さにカットした20 μLピペットチップの両端に2本のワイヤーを挿入して、2本のワイヤーを垂直に接続します。
注意: 垂直に接続されたワイヤを18G針の先端に挿入します(図1)。断線を防ぐために、ワイヤーがピペットチップでしっかりと固定されていることを確認してください。 - ワイヤーをマウスに外科的に移植する前に、ワイヤーをオートクレーブします。
3. 成熟した皮下パウチの作製
注意: 細菌接種の7日前に、次のようにエアポーチを作成します。
- マウス (C57BL/6) を 2% イソフルランで吸入 して 麻酔します (施設で承認されたプロトコルに従います)。
注:呼吸数、筋肉の緊張、つま先のつま先つまみ、角膜反射、および粘膜の色を観察して、麻酔の適切なレベルを評価します。麻酔下での乾燥を防ぐために、目に眼科用軟膏を使用してください。. - 麻酔をかけたマウスを手術床に移し、マウスの背側頸部/胸部を剃ります。
- 70%エタノールとポビドンヨードで全領域を綿棒で拭き取り、滅菌します。
- 10mLシリンジに滅菌空気を入れ、27Gの針を出口に取り付けます。
- マウスの首の付け根をそっとつまんで持ち上げ、皮下組織と筋膜の間にスペースを作ります。
- マウスの肩甲骨の間の正中線に針を置き、3 mLの滅菌空気を皮下に注入してエアポーチを作成します(図2)。
注意: 空気を注入するときは、反対側の手で背中の両側を押し下げて、空気が背中の中央に広がり、中央にポーチが作成されるようにします。 - マウスをサーマルパッドで温めたケージに戻し、麻酔から回復するまで注意深く監視します。
- 上記のように3mLの滅菌空気を注入して、キャビティの膨張を維持し、2日ごとに成熟したポーチを作成します。
注意: 各膨張の前に、ポーチから空気を吸引して、針先が適切に配置されていることを確認します。注射器を針から慎重に取り外し、針先をポーチに残します。ポーチを3mLの滅菌空気で再膨らませます。.
4. 接続したワイヤーの埋め込みと細菌接種
- 最初の空気注入から7日後、ステップ3.1の説明に従ってマウスに麻酔をかけます。
注:外科的処置中は、マウスが呼吸していて麻酔されていることを常に確認してください。訓練を受けた外科医が行う場合、外科的処置全体は通常10〜15分かかります。麻酔は、マウスの鼻に隣接して酸素と混合された2%イソフルランを送達するチューブを配置することによって維持されます。 - 70%エタノールとポビドンヨードで全領域を綿棒で拭き取り、滅菌します。
- 手術の直前にブピバカインを皮下注射します。
- ポーチの上部に3mmの正中線-縦方向に切開します。
- 接続されたワイヤーを含む18G針を穴からポーチに挿入し、25G脊椎針の内側のシリンジを使用してワイヤーを押し出します(図3A、B)。
- 18 G 針の先端をポーチ内に残し、インナーシリンダーを静かに取り外し、シリンジを使用して 1.0 x 105 CFU/mL Xen36 培養液を 3 mL 注入します(図 3C、D)。
- すべての針を慎重に取り外し、傷口クリップを使用して皮膚を閉じ、局所皮膚接着剤で密封します(図3E、F)。.
- 漏れがないことを確認し、マウスをサーマルパッドで温めた個々のケージに戻し、以前と同じように監視します。
5. 皮下膿瘍からのインプラントの抜出
- イソフルオランの過剰投与 による 安楽死後、マウスの背側頸部、胸部、および腰部を剃り、70%エタノールとポビドンヨードで全領域を綿棒で拭いて滅菌します(図4A)。
注:安楽死は、動物の安楽死に関する米国獣医師会(AVMA)のガイドラインに従って実施されました。 - 腰部に正中線を2cm切開し、ハサミで皮下組織を丁寧に剥離します。
- 切開部と皮下解剖部を近位に伸ばし、膿瘍を囲む付着組織を分離します(図4B-D)。
- 皮下膿瘍全体を切除します(図4E)。
- 膿瘍を切断し、膿瘍の内側からワイヤーを慎重に引き出します(図4F)。
6. インプラント表面に形成されたバイオフィルムの定量化
- クリスタルバイオレットアッセイ
- 膿瘍から抽出したワイヤーを、1 mL の脱イオン (DI) 水を含む 24 ウェルプレートの個々のウェルに入れます。
- 1 mLのDI水を含む新しいウェルにワイヤーを移し、ワイヤーの表面から緩く付着したバクテリアを取り除きます。
- バイオフィルムを100%エタノールでワイヤーに1分間固定し、乾燥させます。
- 0.1%クリスタルバイオレット試薬1 mLを含む新しいウェルにワイヤーを移します。
- 染色後15分後、ワイヤーをDI水で2回やさしく洗浄し、余分な染料を取り除きます。
- インプラントを250μLの33%酢酸を含む1.5mLの微量遠心チューブに15分間入れます。インプラント上のバイオフィルムに付着したクリスタルバイオレットを可溶化し、続いて1分間ボルテックスします。
- 200 μLの懸濁液を96ウェルプレートに移し、マイクロプレートリーダーを使用してOD630 nm での吸光度を測定します。すべての測定はトリプリケートで行われます。
- コロニー形成単位(CFU)カウント
- 手順6.1.2で説明されているように、ワイヤーの表面から緩く付着したバクテリアを取り除きます。
- 200 μLの10xトリプシンが入った1.5 mLの微量遠心チューブにインプラントを入れ、37°Cで1時間インキュベートします。
- 1分間ボルテックスし、100Wの水浴中で5分間超音波処理した後、さらに30秒間ボルテックスしてバイオフィルムを懸濁液に剥離します。
- TSB寒天プレート(寒天中のTSB1.5%)に、段階希釈した懸濁液10μLに200μg/mLのカナマイシンを接種します。
注: この手順は、ソリューションごとに 3 回に分けて実行します。 - プレートを37°Cで24時間インキュベートした後、プレート上のコロニーをカウントし、平均コロニーカウント17を使用して元の培養物中の細菌細胞の数を計算します。
注:正確な測定に重要なワイヤーからすべての細菌が除去されるようにするには、ワイヤーをクリスタルバイオレットで染色し、懸濁液をプレートに適用した後でそれらを観察します。予備実験では、上記の機械的解離と化学的解離の組み合わせにより、従来のステンレス鋼線の表面からXen36バイオフィルムをすべて除去することに成功しました(図5)。
- 定量的ポリメラーゼ連鎖反応(qPCR)解析
- 手順6.1.2で説明されているように、ワイヤーの表面から緩く付着したバクテリアを取り除きます。
- インプラントを600μLのTSBを含む1.5mLマイクロチューブに入れます。
- ペレットフリーの改変アルカリ溶解システムを使用してDNAを抽出します16。
注:溶出されたDNAの最終容量は20μLです。 - DNAを1:10に希釈し、-20°Cで保存します。
- luxAおよび16S rRNA遺伝子16のqPCRを実行します。
注:すべてのqPCR反応はトリプリケートで行われます。反応ミックスの総容量は10 μLで、DNAテンプレート3 μL、SYBR Green5 μL、ヌクレアーゼフリー水1 μL、各プライマー0.5 μLが含まれています。luxA遺伝子のプライマーは、5'- GAGCATCATTTCACGGAGTTTG -3'および5'- ATAGCGGCAGTTCCTACATTC -3'です。16S rRNA遺伝子のプライマーは、5'- GTGGAGGGTCATTGGAAACT - 3'および5'- CACTGGTGTTCCTCCATATCTC - 3'です。PCR条件は、94°Cで2分間の初期変性を行い、その後94°Cで15秒、60°Cで30秒、72°Cで30秒のサイクルを40サイクル行い、最後に72°Cで5分間延長します。 - 3サイクル閾値(Ct)の平均を、段階希釈した純粋なXen36培養物から直接精製したDNAで生成された検量線に対してプロットし、インプラントへの細菌負荷を推定します(図6)。
結果
この研究では、インプラント関連感染症の新しいマウスモデルを使用した包括的なアプローチの信頼性を評価し、インプラント表面のバイオフィルム形成の最適化された定量的評価を行いました16。2つの同一のインプラントを使用して、表面に形成されたバイオフィルムを調べ、1つのマウスモデルの孤立した皮下空間内で、両方のインプラントが均一な感染条件で同時にインキュベートできることを確認することを目的としています。マウスに皮下パウチ作製法(図2)を行い、7日後に連結したステンレスワイヤーを成熟パウチに埋め込んだ後、 黄色ブドウ球菌 Xen36を接種しました(図3)。接種後14日で、長さ約2cm、幅約1cmのカプセル化された膿瘍が、ポーチ内に形成された接続されたワイヤーを含んでいます(図4)。ワイヤーは膿瘍から採取され、各ワイヤーに形成されたバイオフィルムは、クリスタルバイオレット染色、CFUカウント、およびqPCR分析によって評価されました。クリスタルバイオレット染色されたワイヤーは、表面に一貫したバイオフィルム形成を示し、両方のワイヤー間に観察可能な変化は見られませんでした(図7A)。個体間および個体内の分析方法を比較してバイオフィルム形成を評価するための正確な測定では、溶存結晶バイオレットアッセイ(図7B)、CFUカウント(図7C)、およびqPCR分析(図7D)の吸光度測定では、両方のワイヤーのバイオフィルム内の細菌負荷に統計的に有意な差がないことが示されました。これらの結果は、両方のワイヤーが、単一のマウスモデル内の孤立した皮下ポーチで、同じ感染条件下で同時にインキュベートされたことを示唆しています。

図1:皮下パウチ埋込用接続ワイヤーの作製 (A)2本のステンレスワイヤー(長さ8mm、直径0.5mm)を連結した1本のインプラントの代表画像。(B)20μLピペットチップのチップは、2本のワイヤーの接続として機能します。(C)接続されたワイヤーは、その後、成熟した皮下ポーチに移植するために18G針の先端に挿入されます。 この図の拡大版を表示するには、ここをクリックしてください。
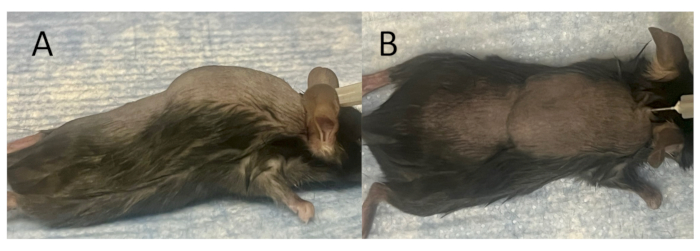
図2:移植・接種用の成熟した皮下パウチの作製(A)側面図、(B)エアインジェクション直後の完全に形成された皮下パウチの上面図。マウスモデルの背部に、肩甲骨間の正中線に沿って皮膚に27Gの針を挿入し、3mLの滅菌空気を皮下に注入することにより、皮下嚢を作成します。その後、皮下パウチの成熟を促進するために、3 mLの滅菌空気を隔日で7日間投与します。.この図の拡大版を表示するには、ここをクリックしてください。
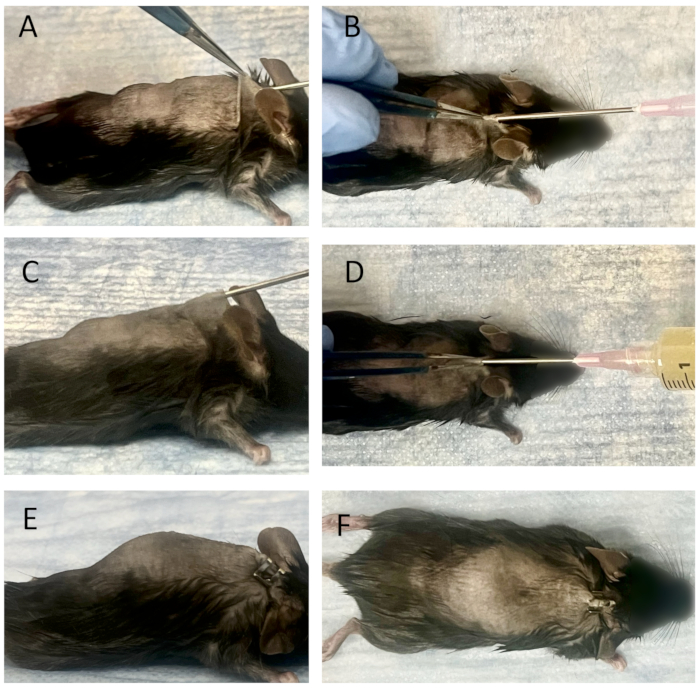
図3:成熟した皮下ポーチへの接続されたワイヤーの埋め込みと細菌接種(A)側面図、(B)成熟した皮下ポーチへの針挿入手順の上面図。接続されたワイヤーを18G針の先端にセットし、25Gの脊椎針の内側のシリンジを使用してワイヤーを押し出します。それらは、皮膚の穴を通して成熟した皮下ポーチに挿入されます。その後、ワイヤーは25Gの脊椎針を使用してポーチに入れられます。側面図(C)と上面図(D)から観察したポーチへの細菌接種。18G針に細菌溶液入りシリンジを装着後、3mLのXen36培養液(1.0×105CFU/ml)をパウチに接種します。18G針を抜いた後、挿入部位は閉じられ、側面図(E)または上面図(F)のいずれからも漏れは検出されません。この図の拡大版を表示するには、ここをクリックしてください。
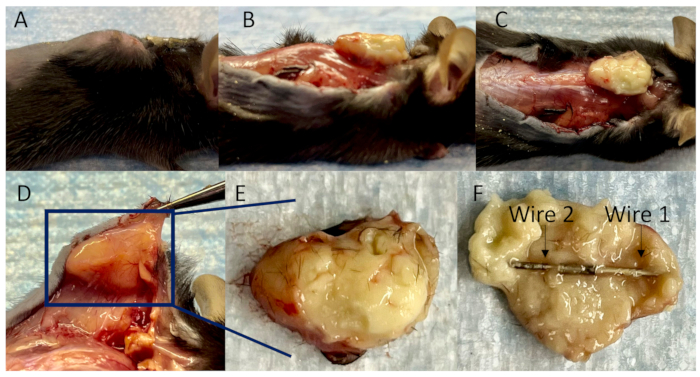
図4:皮下膿瘍内の接続されたワイヤーの集まり。 (A)接種後14日目のインプラント関連感染症のマウスモデルの側面図。(B)接着組織を分離した後の周囲のよく発達した血管を有する皮下膿瘍の側面図、(C)上面図、(D)下図。(E)皮下膿瘍は完全にカプセル化されており、(F)接続されたワイヤーは完全にその中に包まれています。 この図の拡大版を表示するには、ここをクリックしてください。

図5:CFU評価のためのワイヤー上に形成されたバイオフィルムの除去 (A)各ワイヤーの表面に形成されたバイオフィルムは、 in vitroでの接種後14日目に一貫してクリスタルバイオレットで染色されます。(B)染色されたバイオフィルムは、ボルテックスと超音波処理によって減少します。(C)トリプシン処理を追加することで完全に排除されます。 この図の拡大版を表示するには、ここをクリックしてください。
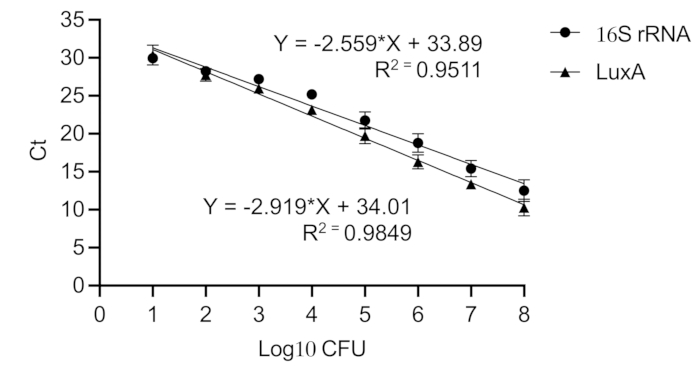
図6:黄色ブドウ球菌の16S rRNAおよびluxA遺伝子の検量線。検量線は、Ct値をCFUの等価細菌負荷に変換します。純粋な黄色ブドウ球菌Xen36培養物(10、8〜10、1 CFU)の段階希釈液を作成します。16S rRNA(R2 = 0.951)とluxA(R2 = 0.985)では高いピアソン相関係数が得られ、線形の標準曲線を示しています。この図の拡大版を表示するには、ここをクリックしてください。
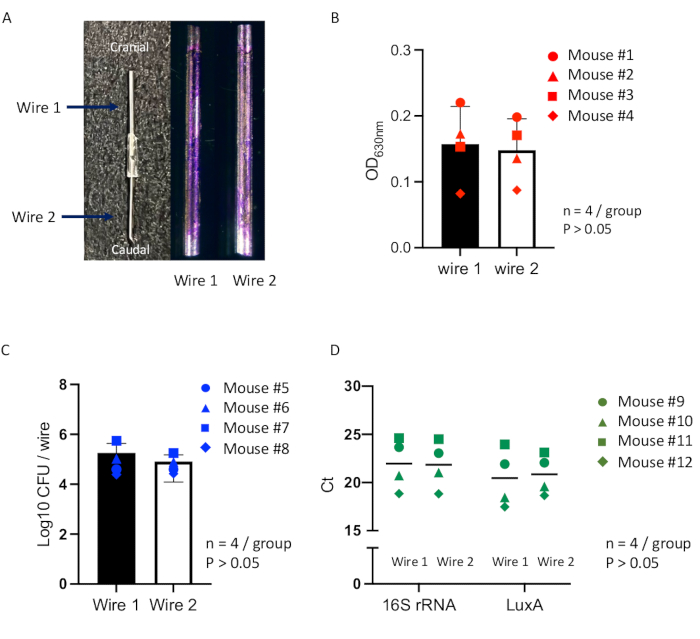
図7:マウスモデル内の接続されたワイヤー上のバイオフィルム形成の定量的評価 (A)皮下パウチ移植用の2本のステンレス鋼ワイヤーで構成された単一のインプラント(左)と、接種後14日目に各ワイヤー(Wire 1またはWire 2)の表面に形成された結晶紫色染色バイオフィルム(右)の代表的な画像。マウスモデル内の各ワイヤー(合計n=12)について、(B)結晶紫色に染色されたバイオフィルムの吸光度測定(n = 4、円の点はマウス#1、三角の点はマウス#2、四角の点はマウス#3、菱点はマウス#4)を含む、マウスモデル内の各ワイヤーについて、個体間および個体内の比較分析法を用いてバイオフィルムを評価するための測定を行います。(C)CFUカウント(n = 4、円の点はマウス#5、三角の点はマウス#6、四角の点はマウス#7、ひし形の点はマウス#8)、(D)qPCR解析(n = 4、円の点はマウス#9、三角の点はマウス#10、四角の点はマウス#11、菱形の点はマウス#12)。ワイヤ グループ間の差は、一元配置分散分析 (ANOVA) を使用して評価されます。すべてのデータは、平均誤差±標準誤差として表示されます。統計的に有意な値は 、p < 0.05と定義されました。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
この研究では、新しいマウスモデルとインプラント関連感染症の最適化された解析技術を活用することにより、複数のインプラント上のバイオフィルム形成の正確な定量的評価のための包括的なアプローチを実証しました。2つのインプラントを同じ被験者の同じ感染条件下でインキュベートするために、空気注入を繰り返して1匹のマウス内に成熟した皮下パウチを作成しました。このモデルは、マウスが動いても、2つの接続されたインプラントを同じ感染条件下でインキュベートできる、閉鎖的で安定した環境を提供しました。 黄色ブドウ球菌の接種後、長さ約2cmの孤立したカプセル化された皮下膿瘍が発生し、両方のワイヤーを完全に囲み、臨床インプラント関連感染症の特徴によく似ていました。両方のワイヤーを膿瘍から抽出し、バイオフィルムを機械的および化学的解離を使用して各表面から除去しました。溶解した細菌溶液を利用して、各ワイヤーのバイオフィルム内の細菌負荷を定量的に分析しました。定量的評価のために、2種類のワイヤーグループ間で複数のワイヤーの個人間および個人内の比較分析分析を実施しました。さらに、同じマウス内に配置した両方のワイヤーは、均一な感染と同時にインキュベートされたため、より正確な評価のために比較測定されました。qPCR解析では、16S rRNA遺伝子と、生物発光 黄色ブドウ球菌のルシフェラーゼをコードするルクスオペロンの相対発現レベルを定量的評価に使用しました。2本の同一のワイヤーを用いたこの研究では、数匹のマウスのワイヤー群間、または1匹のマウス内のワイヤー間のバイオフィルム形成に関するすべての定量的評価において、有意差は認められませんでした。一方、先行研究では、数匹のマウスにおいて、2つの異なるワイヤーグループ間でバイオフィルム形成の定量的評価に有意差が認められた16。したがって、この包括的なアプローチにより、マウスモデルと分析技術が最適化され、結果のばらつきが最小限に抑えられ、複数のバイオマテリアルでのバイオフィルム形成の定量的評価の精度と再現性が向上する可能性があります。
インプラント関連感染症のいくつかのin vivoモデルは、生体材料9,18,19,20の抗菌効果を評価するために確立されています。これらのモデルでは、通常、1つのインプラントが動物ごとに脛骨、大腿骨、または脊椎の突起に埋め込まれ、細菌の接種も行われます。膿瘍は接種後にインプラントの周囲またはインプラントに隣接して発生し、臨床的特徴を密接に模倣しているため、これらのモデルはインプラント関連感染症のin vivo研究に役立ちます。ただし、定量的評価の結果は、被験者ごとに 1 つのインプラント、不完全に囲まれた空間への接種、および被験者間の免疫応答と感染状態のばらつきにより、一貫性がない場合があります。さらに、これらのモデルでの定量的評価には、専門的な専門知識と特定の測定装置が必要になることが多く、その適用性は限られています。このマウスモデルではインプラントのサイズは限られていますが、これらの問題は、1匹のマウス内で同じ感染条件下で複数のインプラントと細菌を同時にインキュベートするこの包括的な方法論の特性によって改善できます。
このアプローチで最も重要なステップは、形成されたバイオフィルムをインプラントから除去することです。バイオフィルムの定量的評価の代表的な方法はCFU計数であり、バイオフィルムからの細菌の剥離、培地中のそれらの懸濁液、およびその後のプレーティング11が必要である。超音波処理およびボルテックスを含む機械的ストレス技術は、多くの研究でバイオフィルムを剥離するために一般的に使用されていますが、インプラントからすべてのバイオフィルムを完全に除去するのに十分であることについて懸念があります。これらの手法が不十分であることが判明した場合、結果の信頼性が損なわれる可能性があります。この研究は、機械的刺激だけではバイオフィルムを完全に剥離できないことを示しました。したがって、トリプシンと機械的刺激による化学処理の統合は、より信頼性の高い細菌の剥離を達成し、バイオフィルム21内の生きた細菌負荷を正確に定量化するために必要である。
qPCR解析は、バイオフィルム内の全体的な細菌負荷を評価するために、マイクロバイオーム研究で一般的に使用されます。このアッセイは、クリスタルバイオレットアッセイ22よりも定量的評価のためのより正確な方法である可能性が高い。純粋な細菌培養物から直接精製したプラスミドDNAで検量線を作成することにより、バイオフィルム内の細菌負荷を正確に測定できます。16S rRNA遺伝子がすべての細菌に存在するリボソームサブユニットであることを考えると、16S rRNA遺伝子を標的とするqPCRは細菌の定量に広く利用されており、16S rRNA遺伝子の発現は黄色ブドウ球菌の増殖中に比較的安定しています23,24。luxA遺伝子は、黄色ブドウ球菌Xen 36の生物発光株のルクスオペロンの成分です。本研究により、luxA遺伝子のqPCRは、Xen 36の接種後のバイオフィルム形成を定量的に評価するのにも有効であることが示されました。したがって、バイオルミネッセンス細菌を接種し、ルクスオペロンの遺伝子発現解析を使用することで、バイオフィルム形成の定量的評価を最適化できます。この手順は比較的簡単に実装でき、再現性があり、研究者は複数のサンプルを同時に分析できます。さらに、経済的で特別な機器を必要としないため、あらゆる研究室で実現可能な選択肢となっています。
この包括的なアプローチには、いくつかの制限があります。まず、この研究は主に、局所的で閉鎖された環境でインプラント上のバイオフィルム形成を評価することを目的としており、それにより、全身感染症に対する生体材料の影響を評価するには不十分です。第二に、このマウスモデルでよく発達した膿瘍を形成するために必要な細菌負荷は、他のモデルよりもかなり高く、バイオフィルム25に対する生体材料の耐性を評価するための困難な環境を作り出す可能性があります。しかし、インプラントを完全に取り囲む膿瘍を形成し、インプラントを同一の細菌感染条件下で培養するためには、より高用量の細菌培養が必要でした。第三に、インプラントの1つが化合物を放出する場合、他のインプラントに影響を与える可能性があるため、このモデルは使用できません。第四に、2つのインプラントを接続するために使用されるピペットチップは、感染の経過に影響を与える可能性がありますが、一般的に入手可能なピペットチップを使用すると、このモデルはどの実験室環境でも簡単に実装できます。
結論として、この研究は、インプラント関連感染の新しいマウスモデルと、バイオフィルム形成の正確な定量的評価のための最適化された分析方法を提示します。この包括的なアプローチにより、外科用インプラントの比較バイオフィルム定量のためのアウトカム指標の精度、再現性、汎用性が、その特性を活用することで、抗菌インプラントの将来の発展に貢献することが期待されます。
開示事項
著者は、競合する利益を宣言しません。
謝辞
本研究の一部は、NSF産学連携研究プログラム「Center for Disruptive Musculoskeletal Innovations(IIP-1916629)」、株式会社小松精機製作所、合同会社Rosies Baseから資金提供を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Acetic Acid | THOMAS SCIENTIFIC | 12-16-15-00 | |
| Agilent BioTek 800 TS Absorbance Reader | Agilent | BT800TS | |
| Air-Tite Sterile Hypodermic Needles, Needle Gauge: 18 G | FISHER SCIENTIFIC | 14817151 (CS) | |
| BD Spinal Needles: 25 G | FISHER SCIENTIFIC | 22043805 | |
| Benchtop Incubator Shaker | FISHER SCIENTIFIC | ||
| Branson Ultrasonic Bath, 115 Vac, 60 Hz | FISHER SCIENTIFIC | 2489500 | |
| Branson Ultrasonics 2510R-MTH (Sonicator) | RPI-T48500-500.0 | ||
| Centrifuge sorvall pico | FISHER SCIENTIFIC | ||
| CFX96 Real Time Optics Module qPCR System | BIO-RAD | ||
| Compact Sterilizer, 30L | THOMAS SCIENTIFIC LLC | 22A00N096 (EA/1) | |
| Crystal Violet, 1%, Solution SCI_ED | FISHER SCIENTIFIC | 10114-58-6 | |
| Falcon 24-well cell culture plate | FISHER SCIENTIFIC | 877125 | |
| Falcon 96-well cell culture plate | FISHER SCIENTIFIC | 8771001 | |
| Fisherbrand Digital Vortex Mixer | FISHER SCIENTIFICS | ||
| Kanamycin | THOMAS SCIENTIFIC LLC | 15160054 | |
| Mannitol Salt Agar | FISHER SCIENTIFIC | ||
| Micirobiological Incubator | Thermo Scientific | 51028063H | |
| PBS, Phosphate Buffered Saline | |||
| Staphylococcus aureus ATCC 49525 (Xen36) | Perkin Elmer | 119243 | |
| SYBR Green I Nucleic Acid Gel Stain | FISHER SCIENTIFIC | ||
| Trypsin 10x (2.5%) | FISHER SCIENTIFIC | 15090046 | |
| Tryptic Soy Broth | NETA SCIENTIFIC INC | ||
| Zyppy Plasmid Miniprep Ki | FISHER SCIENTIFIC | 501977785 | pellet-free modified alkaline lysis system |
参考文献
- Wukich, D. K., Lowery, N. J., McMillen, R. L., Frykberg, R. G. Postoperative infection rates in foot and ankle surgery: a comparison of patients with and without diabetes mellitus. J Bone Joint Surg Am. 92 (2), 287-295 (2010).
- Darouiche, R. O. Treatment of infections associated with surgical implants. N Engl J Med. 350 (14), 1422-1429 (2004).
- Arciola, C. R., Campoccia, D., Montanaro, L. Implant infections: Adhesion, biofilm formation and immune evasion. Nat Rev Microbiol. 16 (7), 397-409 (2018).
- Li, P., Yin, R., Cheng, J., Lin, J. Bacterial biofilm formation on biomaterials and approaches to its treatment and prevention. Int J Mol Sci. 24 (14), ijms241411680(2023).
- Chen, X., Zhou, J., Qian, Y., Zhao, L. Antibacterial coatings on orthopedic implants. Mater Today Bio. 19, 100586(2023).
- Pan, C., Zhou, Z., Yu, X. Coatings as the useful drug delivery system for the prevention of implant-related infections. J Orthop Surg Res. 13 (1), 220(2018).
- Savvidou, O. D., et al. Efficacy of antimicrobial coated orthopedic implants on the prevention of periprosthetic infections: A systematic review and meta-analysis. J Bone Jt Infect. 5 (4), 212-222 (2020).
- Sussman, E. M., Casey, B. J., Dutta, D., Dair, B. J. Different cytotoxicity responses to antimicrobial nanosilver coatings when comparing extract-based and direct-contact assays. J Appl Toxicol. 35 (6), 631-639 (2015).
- Cyphert, E. L., Zhang, N., Learn, G. D., Hernandez, C. J., von Recum, H. A. Recent advances in the evaluation of antimicrobial materials for resolution of orthopedic implant-associated infections in vivo. ACS Infect Dis. 7 (12), 3125-3160 (2021).
- Stavrakis, A. I., et al. Current animal models of postoperative spine infection and potential future advances. Front Med (Lausanne). 2, 34(2015).
- Carli, A. V., et al. Quantification of Peri-implant bacterial load and in vivo biofilm formation in an innovative, clinically representative mouse model of periprosthetic joint infection. J Bone Joint Surg Am. 99 (6), e25(2017).
- Bernthal, N. M., et al. A mouse model of post-arthroplasty Staphylococcus aureus joint infection to evaluate in vivo the efficacy of antimicrobial implant coatings. PLoS One. 5 (9), e12580(2010).
- Kelley, B. V., et al. In vivo mouse model of spinal implant infection. J Vis Exp. (160), e60560(2020).
- Meroni, G., et al. A Journey into animal models of human osteomyelitis: A review. Microorganisms. 10 (6), 10061135(2022).
- Wang, Y., et al. Mouse model of hematogenous implant-related Staphylococcus aureus biofilm infection reveals therapeutic targets. Proc Natl Acad Sci U S A. 114 (26), E5094-E5102 (2017).
- Mitsuhiro Nishizawa, D. H., et al. A novel approach to reducing spinal implant-associated infections. bioRxiv. , (2024).
- Fehlings, M. G., et al. A clinical practice guideline for the management of patients with acute spinal cord injury: Recommendations on the use of methylprednisolone sodium succinate. Global Spine J. 7 (3 Suppl), 203S-211S (2017).
- Dworsky, E. M., et al. Novel in vivo mouse model of implant-related spine infection. J Orthop Res. 35 (1), 193-199 (2017).
- Masters, E. A., et al. Distinct vasculotropic versus osteotropic features of S. agalactiae versus S. aureus implant-associated bone infection in mice. J Orthop Res. 39 (2), 389-401 (2021).
- Sheppard, W. L., et al. Novel in vivo mouse model of shoulder implant infection. J Shoulder Elbow Surg. 29 (7), 1412-1424 (2020).
- Mansouri, M. D., Ramanathan, V., Al-Sharif, A. H., Darouiche, R. O. Efficacy of trypsin in enhancing assessment of bacterial colonization of vascular catheters. J Hosp Infect. 76 (4), 328-331 (2010).
- Wang, X., Howe, S., Deng, F., Zhao, J. Current applications of absolute bacterial quantification in microbiome studies and decision-making regarding different biological questions. Microorganisms. 9 (9), 9091797(2021).
- Lima, A., Franca, A., Muzny, C. A., Taylor, C. M., Cerca, N. DNA extraction leads to bias in bacterial quantification by qPCR. Appl Microbiol Biotechnol. 106 (24), 7993-8006 (2022).
- Eleaume, H., Jabbouri, S. Comparison of two standardization methods in real-time quantitative RT-PCR to follow Staphylococcus aureus genes expression during in vitro growth. J Microbiol Methods. 59 (3), 363-370 (2004).
- Vidlak, D., Kielian, T. Infectious dose dictates the host response during Staphylococcus aureus orthopedic-implant biofilm infection. Infect Immun. 84 (7), 1957-1965 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved