Method Article
Un modelo de ratón único para la evaluación cuantitativa de la formación de biopelículas en implantes quirúrgicos en abscesos subcutáneos
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe un modelo experimental único de infecciones relacionadas con implantes que permite la incubación simultánea de dos implantes con bacterias en condiciones idénticas dentro de un solo ratón. También permite una evaluación precisa de la formación de biopelículas en las superficies de los implantes utilizando métodos analíticos comparativos optimizados, demostrando técnicas avanzadas para evaluar las propiedades antimicrobianas de los biomateriales.
Resumen
Para desarrollar un nuevo biomaterial con propiedades antibacterianas para procedimientos quirúrgicos ortopédicos, es crucial establecer un modelo animal experimental de infecciones relacionadas con implantes que imite de cerca el estado patológico. Además, se requiere una comparación cuantitativa con muestras de control para evaluar la formación de biopelículas en los materiales. Sin embargo, los modelos animales actuales, que implican implantar a cada individuo con un solo material, pueden producir resultados inconsistentes debido a la heterogeneidad del estado de infección entre los sujetos. Además, cuantificar con precisión la formación de biopelículas en materiales in vivo sigue siendo un desafío, y los hallazgos pueden carecer de fiabilidad. Para abordar estos problemas, este estudio demostró un modelo de ratón único de infección relacionada con implantes que permite la incubación simultánea de dos implantes con bacterias en un entorno cerrado dentro de un solo ratón, formando un absceso subcutáneo encapsulado. Inicialmente se creó una bolsa de aire madura debajo de la piel de la espalda. Se conectaron dos cables de acero inoxidable y se colocaron en la bolsa, seguido de la inoculación de Xen 36, una cepa bioluminiscente de Staphylococcus aureus. A los 14 días de la inoculación, se había formado un absceso subcutáneo alrededor de los alambres. La biopelícula se eliminó por completo de la superficie de cada alambre y las suspensiones bacterianas disueltas se midieron con precisión utilizando métodos optimizados para evaluar la formación de biopelícula en el implante, determinar las unidades formadoras de colonias y realizar análisis cuantitativos de la reacción en cadena de la polimerasa. Aprovechando el operón lux de las bacterias bioluminiscentes, se utilizaron los niveles de expresión relativa de luxA y 16S rRNA para determinar la carga bacteriana dentro de la biopelícula en cada cable. Este enfoque analítico comparativo optimizado permite evaluaciones precisas de la formación de biopelículas en dos cables en condiciones de infección uniformes dentro de un solo modelo de ratón y puede facilitar el avance de biomateriales con propiedades antibacterianas.
Introducción
Las infecciones relacionadas con implantes siguen siendo un desafío importante en los entornos clínicos porque pueden causar altas tasas de morbilidad y mortalidad en cirugía ortopédica a pesar de los avances en la técnica quirúrgica y el diseño de implantes1. Aunque la incidencia de infecciones asociadas con implantes quirúrgicos ha disminuido significativamente debido a los estándares modernos de control aséptico en el entorno del quirófano y a los protocolos adecuados para la profilaxis antibiótica perioperatoria, la incidencia de infecciones relacionadas con los implantes en la cirugía primaria sigue siendo del 2%-5%2.
El principal mecanismo subyacente de las infecciones relacionadas con los implantes es la formación de una biopelícula en las superficies del implante, que protege a los microorganismos de los antibióticos y del sistema inmunitario, lo que dificulta la erradicación de la infección 3,4. Dado que la adhesión bacteriana a la superficie del implante es crucial durante la primera etapa de la formación de la biopelícula, minimizar la adhesión bacteriana y la posterior formación de la biopelícula es una estrategia esencial para reducir el riesgo de infecciones relacionadas con el implante. A pesar de las propiedades antibacterianas de varias tecnologías de implantes, estas no han sido ampliamente utilizadas clínicamente debido a eventos adversos, como toxicidad celular y alergias 5,6,7,8. Por lo tanto, todavía existe una necesidad clínica insatisfecha de implantes antibacterianos que armonicen la seguridad, la eficacia, la estabilidad y la durabilidad para reducir el riesgo de infecciones relacionadas con los implantes. La investigación y el desarrollo de implantes con propiedades antibacterianas podrían hacer avanzar la tecnología quirúrgica para superar estos problemas.
La evaluación de las propiedades antibacterianas de diversos biomateriales utilizando modelos animales pequeños es esencial antes de proceder a modelos animales más grandes y ensayos clínicos9. Numerosos estudios han demostrado modelos de ratón aplicables de infecciones relacionadas con implantes utilizando una bacteria bioluminiscente, que contiene el operón luxABCDE 10,11,12,13,14,15. Si bien estos modelos aceleran la investigación para desarrollar implantes o tecnologías antibacterianas, tienen ciertas limitaciones. En primer lugar, a menudo se requieren conocimientos avanzados y equipos especializados, como rayos X o sistemas de imagen dedicados, para evaluar la carga bacteriana en los implantes colocados en modelos de ratón de forma directa y precisa. En segundo lugar, si bien los implantes recolectados generalmente evalúan un implante solitario en un solo sitio de infección por animal, las condiciones de infección y las respuestas inmunológicas pueden variar entre individuos, lo que puede conducir a variabilidad en los resultados de las evaluaciones comparativas. Por lo tanto, al comparar los efectos antibacterianos de varios biomateriales in vivo, es más beneficioso implantarlos e inocularlos con bacterias en entornos uniformes para abordar estos problemas. Además, es fundamental optimizar la metodología actual y realizar evaluaciones cuantitativas con reproducibilidad y precisión aprovechando las características del modelo animal y las bacterias utilizadas.
Este estudio presenta un nuevo enfoque experimental para infecciones relacionadas con implantes in vivo que permite mediciones precisas para evaluar la formación de biopelículas en las superficies de dos implantes dentro de un solo modelo de ratón a través de métodos analíticos comparativos inter e intraindividuales. La biopelícula de cada implante se puede cuantificar utilizando métodos optimizados para visualizar la biopelícula en el implante, determinar las unidades formadoras de colonias (UFC) y el análisis cuantitativo de la reacción en cadena de la polimerasa (qPCR) de una cepa bioluminiscente de Staphylococcus aureus, Xen 36. El estudio previo demostró que un nuevo implante metálico posee una prometedora eficacia antibacteriana in vivo contra Staphylococcus aureus utilizando este enfoque integral16. Esta metodología se puede implementar fácilmente en un entorno de laboratorio estándar y puede acelerar la investigación en el desarrollo de biomateriales antibacterianos.
Protocolo
Todos los procedimientos con animales son aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de California en San Francisco (UCSF) y se realizan en una instalación BSL2 después de consultar y aprobar el Programa de Riesgos de Bioseguridad de la UCSF, administrado por el Departamento de Salud y Seguridad Ambiental de la UCSF. Se utilizaron ratones machos y hembras C57BL/6 (12-16 semanas de edad, 25-50 mg). Los detalles de los reactivos y el equipo utilizado se enumeran en la Tabla de Materiales.
1. Preparación de bacterias
- Utilice el Staphylococcus aureus Xen36 (ATCC49525) bioluminiscente como patógeno.
NOTA: Esta cepa se obtiene de la American Type Culture Collection (Manassas, VA) y utiliza de manera única un operón luxABCDE , que está optimizado e integrado en el plásmido nativo del huésped. Xen36 también utiliza el gen de resistencia a la kanamicina vinculado al operón lux . - Añadir una pequeña cantidad de caldo de glicerol congelado de Xen 36 y añadir los trozos a 5 mL de caldo de soja tríptico (TSB) medio que contenga 200 μg/mL de kanamicina.
- Incubar el cultivo durante la noche a 37 °C en una incubadora agitadora (200 rpm).
- Estrelle Xen36 en placas de agar TSB (TSB en agar 1,5%) que contengan 200 μg/mL de kanamicina e incube durante la noche a 37 °C.
- Aislar colonias individuales de Xen36 y cultivar en 5 mL de TSB que contengan 200 μg/mL de kanamicina durante la noche a 37 °C en una incubadora agitadora (200 rpm).
- Mida la absorbancia del cultivo resultante a 630 nm.
- Diluir el cultivo y hacer un cultivo Xen36 de 1,0 x 108 UFC/mL basado en la absorbancia a 630 nm.
NOTA: Una medición de absorbancia a 630 nm (frente a un blanco TSB) de 0,5 equivale aproximadamente a 1,0 x 108 UFC/ml de Xen36. - Diluya el cultivo y haga un cultivo Xen36 de 1,0 x 105 UFC/mL.
2. Preparación de implantes conectados
- Utilice dos alambres en forma de varilla compuestos de acero inoxidable (SUS316L de grado quirúrgico disponible en el mercado, cada uno de 8 mm de largo y 0,5 mm de diámetro.
- Conecte los dos cables verticalmente insertándolos en ambos extremos de una punta de pipeta de 20 μL cortada a una longitud de aproximadamente 3 mm.
NOTA: Inserte los cables conectados verticalmente en la punta de la aguja de 18 G (Figura 1). Asegúrese de que los cables estén firmemente asegurados por la punta de la pipeta para evitar la desconexión. - Esterilizar los cables en autoclave antes de implantarlos quirúrgicamente en los ratones.
3. Creación de una bolsa subcutánea madura
NOTA: 7 días antes de la inoculación bacteriana, cree la bolsa de aire de la siguiente manera:
- Anestesiar al ratón (C57BL/6) con isoflurano al 2% por vía inhalatoria (siguiendo protocolos aprobados institucionalmente).
NOTA: Evalúe el nivel adecuado de anestesia observando la frecuencia respiratoria, el tono muscular, el pellizco de los dedos de los pies, el reflejo corneal y el color de las membranas mucosas. Use ungüento oftálmico en los ojos para prevenir la sequedad mientras está bajo anestesia. - Transfiera el ratón anestesiado a la cama quirúrgica y afeite la región dorsal cervical/torácica del ratón.
- Frotar y esterilizar toda la región con etanol al 70% y povidona yodada.
- Llene una jeringa de 10 ml con aire estéril y coloque una aguja de 27 g en la salida.
- Pellizca y eleva suavemente la base del cuello del ratón para crear espacio entre el tejido subcutáneo y la fascia.
- Coloque la aguja en la línea media entre las escápulas del ratón e inyecte 3 mL de aire estéril por vía subcutánea para crear la bolsa de aire (Figura 2).
NOTA: Mientras inyecta aire, sostenga ambos lados de la espalda con la mano opuesta para asegurarse de que el aire se extienda al centro de la espalda, creando una bolsa en el medio. - Regrese el ratón a una jaula calentada con una almohadilla térmica y vigílelo de cerca hasta que se haya recuperado de la anestesia.
- Inyecte 3 mL de aire estéril como se describió anteriormente para mantener el inflado de la cavidad y crear una bolsa madura cada 2 días.
NOTA: Antes de cada inflado, aspire el aire de la bolsa para confirmar la colocación correcta de la punta de la aguja. Retire con cuidado la jeringa de la aguja, dejando la punta de la aguja en la bolsa. Vuelva a inflar la bolsa con 3 ml de aire estéril.
4. Implantación de cables conectados e inoculación bacteriana
- 7 días después de la primera inyección de aire, anestesiar el ratón como se describe en el paso 3.1.
NOTA: Durante el procedimiento quirúrgico, verifique constantemente que el ratón esté respirando y esté anestesiado. Todo el procedimiento quirúrgico suele durar entre 10 y 15 minutos cuando lo realiza un cirujano capacitado. La anestesia se mantiene mediante la colocación de un tubo que administra isoflurano al 2% mezclado con oxígeno adyacente al hocico del ratón. - Frotar y esterilizar toda la región con etanol al 70% y povidona yodada.
- Inyecte bupivacaína por vía subcutánea justo antes de la cirugía.
- Haga una incisión longitudinal en la línea media de 3 mm en la parte superior de la bolsa.
- Inserte una aguja de 18 G que contiene los cables conectados en la bolsa a través del orificio y empuje los cables con una jeringa interna de una aguja espinal de 25 G (Figura 3A, B).
- Dejando la punta de la aguja de 18 G dentro de la bolsa, retire suavemente el cilindro interior e inyecte 3 mL de cultivo Xen36 de 1,0 x 105 UFC/mL con la jeringa (Figura 3C, D).
- Retire con cuidado todas las agujas, cierre la piel con una pinza para heridas y selle con adhesivo cutáneo tópico (Figura 3E, F).
- Asegúrese de que no haya fugas, devuelva el mouse a la jaula individual calentada con una almohadilla térmica y monitoree como antes.
5. Extracción de los implantes del absceso subcutáneo
- Después de la eutanasia por sobredosis de isofluorano, afeitar la región dorsal cervical, torácica y lumbar del ratón, e hisopar y esterilizar toda la región con etanol al 70% y povidona yodada (Figura 4A).
NOTA: La eutanasia se llevó a cabo de acuerdo con las Directrices de la Asociación Americana de Medicina Veterinaria (AVMA) para la eutanasia de animales. - Realice una incisión de 2 cm en la línea media de la región lumbar y exfolie cuidadosamente el tejido subcutáneo con unas tijeras.
- Extienda la incisión y la disección subcutánea proximalmente y separe el tejido adherente que rodea el absceso (Figura 4B - D).
- Extirpar todo el absceso subcutáneo (Figura 4E).
- Corte el absceso y extraiga con cuidado el alambre del interior del absceso (Figura 4F).
6. Cuantificación del biofilm formado en las superficies del implante
- Ensayo de cristal violeta
- Coloque los alambres extraídos del absceso en pocillos individuales de una placa de 24 pocillos que contenga 1 mL de agua desionizada (DI).
- Transfiera los cables a pozos nuevos que contengan 1 mL de agua desionizada para eliminar cualquier bacteria poco adherida de la superficie de los cables.
- Fije el biofilm en los cables con etanol al 100% durante 1 minuto y déjelos secar.
- Transfiera los alambres a nuevos pocillos que contengan 1 mL de reactivo violeta cristalino al 0,1%.
- Después de 15 minutos de manchas, lave suavemente los hilos dos veces con agua desionizada para eliminar el exceso de tinte.
- Colocar el implante en un tubo de microcentrífuga de 1,5 mL que contenga 250 μL de ácido acético al 33% durante 15 min; Solubilizar el cristal violeta adherido a la biopelícula del implante, seguido de un vórtice durante 1 min.
- Transfiera 200 μL de la suspensión a una placa de 96 pocillos y mida la absorbancia a630 nm de diámetro exterior utilizando un lector de microplacas. Todas las mediciones se realizan por triplicado.
- Recuento de unidades formadoras de colonias (UFC)
- Retire cualquier bacteria poco adherida de la superficie de los cables como se describe en el paso 6.1.2.
- Colocar el implante en un tubo de microcentrífuga de 1,5 mL que contenga 200 μL de tripsina 10x e incubar a 37 °C durante 1 h.
- Vórtice durante 1 min y sonicate en un baño de agua a 100 W durante 5 min, seguido de un vórtice adicional durante 30 s para separar la biopelícula en la suspensión.
- Inocular 10 μL de la suspensión diluida en serie en las placas de agar TSB (TSB en agar 1,5%) con 200 μg/mL de kanamicina.
NOTA: Realice este procedimiento por triplicado para cada solución. - Después de incubar las placas a 37 °C durante 24 h, cuente las colonias en las placas y calcule el número de células bacterianas en el cultivo original utilizando el recuento medio de colonias17.
NOTA: Para asegurarse de que se eliminen todas las bacterias de los cables, lo cual es crucial para una medición precisa, tiña los cables con violeta cristalino y obsérvalos después de aplicar la suspensión a las placas. En los experimentos preliminares, la combinación de la disociación mecánica y química anterior eliminó con éxito todas las biopelículas de Xen36 de las superficies del alambre de acero inoxidable convencional (Figura 5).
- Análisis cuantitativo de la reacción en cadena de la polimerasa (qPCR)
- Retire cualquier bacteria poco adherida de la superficie de los cables como se describe en el paso 6.1.2.
- Coloque el implante en un microtubo de 1,5 mL que contenga 600 μL de TSB.
- Extraiga el ADN utilizando el sistema de lisis alcalina modificada sin pellets16.
NOTA: El volumen final de ADN eluido es de 20 μL. - Diluir el ADN 1:10 y almacenarlo a -20 °C.
- Realice qPCR para los genes luxA y 16S rRNA 16.
NOTA: Todas las reacciones de qPCR se realizan por triplicado. El volumen total de la mezcla de reacción es de 10 μL, que contiene 3 μL de plantilla de ADN, 5 μl de SYBR Green, 1 μL de agua libre de nucleasas y 0,5 μL de cada cebador. Los cebadores para el gen luxA son 5'- GAGCATCATTTCACGGAGTGTG -3' y 5'- ATAGCGGCAGTTCCTACATTC -3'. Los cebadores para el gen 16S rRNA son 5'- GTGGAGGGTCATTGGAAACT - 3' y 5'- CACTGGTTCCTCCATATCTC - 3'. Las condiciones de PCR son las siguientes: desnaturalización inicial durante 2 min a 94 °C seguida de 40 ciclos de 15 s a 94 °C, 30 s a 60 °C y 30 s a 72 °C, y una extensión final a 72 °C durante 5 min. - La media de los valores de umbral (Ct) de tres ciclos se compara con una curva de calibración generada con ADN purificado directamente a partir de cultivos puros de Xen36 diluidos en serie para estimar la carga bacteriana en el implante (Figura 6).
Resultados
Este estudio evaluó la fiabilidad de un enfoque integral que utiliza un nuevo modelo de ratón de infección relacionada con implantes con evaluaciones cuantitativas optimizadas de la formación de biopelículas en las superficies de los implantes, que se ha utilizado en el estudio anterior16. Los dos implantes idénticos se utilizaron para examinar la biopelícula formada en sus superficies, con el objetivo de verificar que ambos implantes podían incubarse simultáneamente en condiciones de infección uniformes dentro de un espacio subcutáneo solitario en un solo modelo de ratón. Los ratones se sometieron a un procedimiento de creación de bolsa subcutánea (Figura 2) y, después de 7 días, los alambres de acero inoxidable conectados se implantaron en la bolsa madura, seguido de la inoculación con Staphylococcus aureus Xen36 (Figura 3). A los 14 días después de la inoculación, se formó en la bolsa un absceso encapsulado de aproximadamente 2 cm de largo y 1 cm de ancho, que contiene los cables conectados (Figura 4). Los alambres se recolectaron del absceso y la biopelícula formada en cada alambre se evaluó mediante tinción de violeta cristalino, recuento de UFC y análisis de qPCR. Los alambres teñidos con violeta cristalino mostraron una formación consistente de biopelícula en las superficies, sin cambios observables entre ambos alambres (Figura 7A). Las mediciones precisas para evaluar la formación de biopelícula a través de métodos analíticos comparativos inter e intraindividuales indicaron que las mediciones de absorbancia del ensayo de violeta cristalino disuelto (Figura 7B), el recuento de UFC (Figura 7C) y el análisis de qPCR (Figura 7D) no mostraron diferencias estadísticamente significativas en la carga bacteriana dentro de la biopelícula en ambos cables. Estos resultados sugirieron que ambos alambres se incubaron simultáneamente en condiciones de infección idénticas en una bolsa subcutánea solitaria dentro de un solo modelo de ratón.

Figura 1: Preparación de los cables conectados para el implante de la bolsa subcutánea. (A) Una imagen representativa de un solo implante que consta de dos alambres de acero inoxidable conectados (longitud: 8 mm, diámetro: 0,5 mm). (B) Una punta de pipeta de 20 μL sirve de conexión para los dos cables. (C) Los cables conectados se insertan posteriormente en la punta de una aguja de 18 G para su implantación en una bolsa subcutánea madura. Haga clic aquí para ver una versión más grande de esta figura.
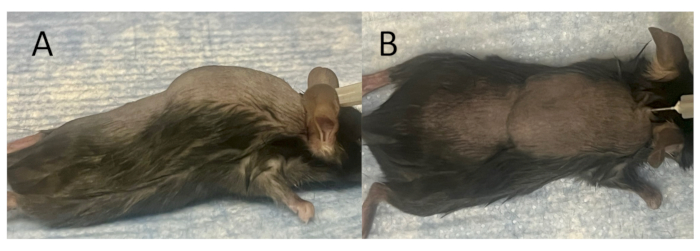
Figura 2: Creación de una bolsa subcutánea madura para la implantación e inoculación. (A) La vista lateral, y (B) la vista superior de una bolsa subcutánea completamente formada justo después de la inyección de aire. Se crea una bolsa subcutánea en la parte posterior de un modelo de ratón insertando una aguja de 27 G en la piel a lo largo de la línea media entre las escápulas e inyectando 3 ml de aire estéril por vía subcutánea. A partir de entonces, se administran 3 mL de aire estéril cada dos días durante 7 días para facilitar la maduración de una bolsa subcutánea. Haga clic aquí para ver una versión más grande de esta figura.
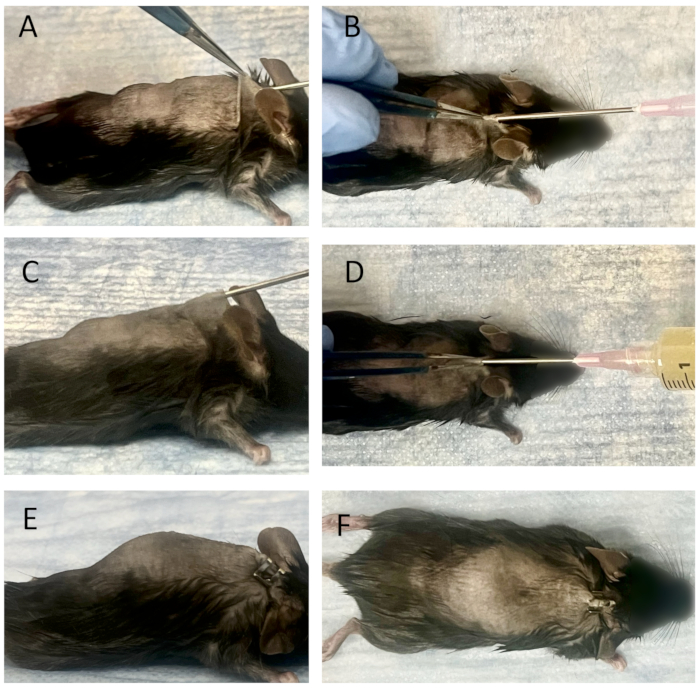
Figura 3: Implantación de cables conectados e inoculación bacteriana en una bolsa subcutánea madura. (A) La vista lateral, y (B) la vista superior del procedimiento de inserción de la aguja en una bolsa subcutánea madura. Los cables conectados se colocan en la punta de una aguja de 18 G y se utiliza una jeringa interna de una aguja espinal de 25 G para empujar los cables. Se insertan en la bolsa subcutánea madura a través del orificio de la piel. A continuación, los alambres se colocan en la bolsa con una aguja espinal de 25 G. Inoculación bacteriana en la bolsa observada desde la vista lateral (C) y la vista superior (D). Después de colocar una jeringa que contiene solución bacteriana en la aguja de 18 G, se inoculan 3 mL de cultivo de Xen36 (1,0 x 105 UFC/ml) en la bolsa. El sitio de inserción se cierra después de retirar la aguja de 18 G, sin que se detecten fugas ni en la vista lateral (E) ni en la vista superior (F). Haga clic aquí para ver una versión más grande de esta figura.
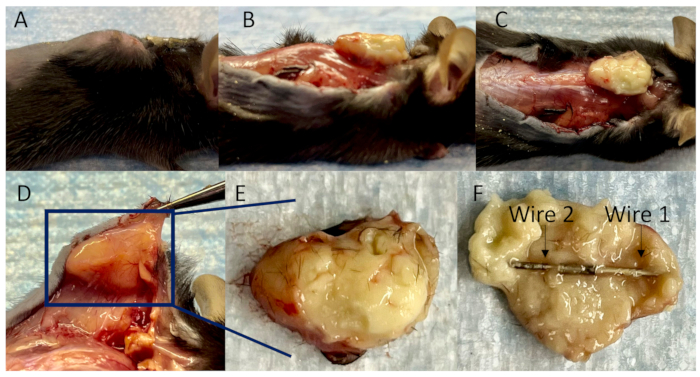
Figura 4: Colección de cables conectados en un absceso subcutáneo. (A) Una vista lateral de un modelo de ratón para infecciones relacionadas con implantes a los 14 días después de la inoculación. (B) La vista lateral, (C) la vista superior y (D) la vista inferior del absceso subcutáneo con los vasos sanguíneos circundantes bien desarrollados después de separar los tejidos adherentes. (E) El absceso subcutáneo está completamente encapsulado, y (F) los cables conectados están completamente envueltos dentro de él. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Eliminación de la biopelícula formada en los alambres para la evaluación de UFC. (A) La biopelícula formada en las superficies de cada alambre se tiñe consistentemente con violeta cristalino a los 14 días después de la inoculación in vitro. (B) La biopelícula teñida se ve disminuida por el vórtice y la sonicación. (C) Se elimina por completo mediante la adición de tratamiento con tripsina. Haga clic aquí para ver una versión más grande de esta figura.
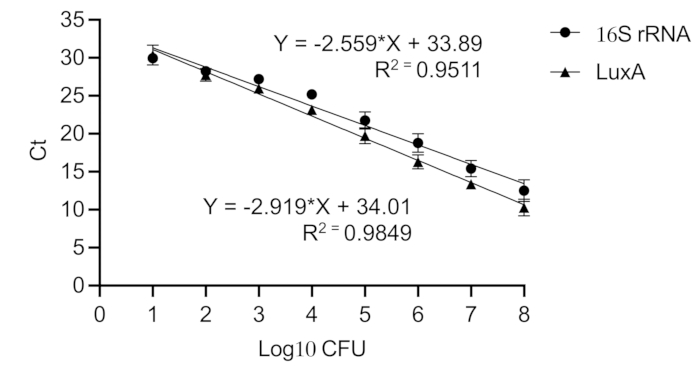
Figura 6: Curva de calibración de los genes 16S rRNA y luxA en Staphylococcus aureus. Una curva de calibración convierte los valores de Ct en la carga bacteriana equivalente en UFC. Se crea una dilución seriada de cultivo puro de Staphylococcus aureus Xen36 (108 a 101 UFC). Se obtiene un alto coeficiente de correlación de Pearson para el ARNr 16S (R2 = 0,951) y luxA (R2 = 0,985), lo que indica curvas estándar lineales. Haga clic aquí para ver una versión más grande de esta figura.
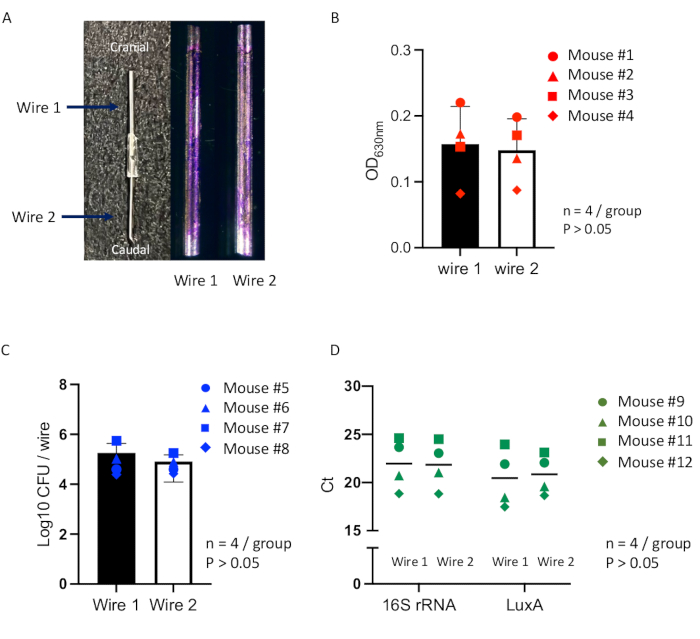
Figura 7: Evaluaciones cuantitativas de la formación de biopelículas en cables conectados dentro de un modelo de ratón. (A) Imágenes representativas de un solo implante que consta de dos alambres de acero inoxidable conectados para la implantación de la bolsa subcutánea (izquierda) y biopelícula teñida de violeta cristalino formada en las superficies de cada alambre (Alambre 1 o Alambre 2) a los 14 días después de la inoculación (derecha). Las mediciones para evaluar la biopelícula utilizando métodos analíticos comparativos inter e intraindividuales se realizan para cada cable dentro de un modelo de ratón (n total = 12), incluyendo (B) la medición de la absorbancia de la biopelícula teñida con violeta cristalino (n = 4; el punto circular indica el ratón #1; el punto del triángulo indica el ratón #2; el punto cuadrado indica el ratón #3; el punto de diamante indica el ratón #4). (C) Conteo de UFC (n = 4; el punto circular indica el ratón #5; el punto triangular indica el ratón #6; el punto cuadrado indica el ratón #7; el punto de diamante indica el ratón #8), y (D) análisis de qPCR (n = 4; el punto circular indica el ratón #9; el punto triangular indica el ratón #10; el punto cuadrado indica el ratón #11; el punto de diamante indica el ratón #12). Las diferencias entre los grupos de alambres se evalúan mediante un análisis de varianza unidireccional (ANOVA). Todos los datos se presentan como error medio ± estándar. Los valores estadísticamente significativos se definieron como p < 0,05. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este estudio demostró un enfoque integral para evaluaciones cuantitativas precisas de la formación de biopelículas en múltiples implantes mediante el aprovechamiento de un nuevo modelo de ratón y técnicas de análisis optimizadas para la infección relacionada con implantes. Para garantizar que dos implantes se incubaran en condiciones de infección idénticas en el mismo sujeto, se creó una bolsa subcutánea madura dentro de un solo ratón mediante inyecciones de aire repetidas. Este modelo proporcionó un entorno cerrado y estable en el que dos implantes conectados podían incubarse en condiciones de infección idénticas, incluso mientras el ratón se movía. Después de la inoculación con Staphylococcus aureus, se desarrolló un absceso subcutáneo encapsulado solitario, de aproximadamente 2 cm de longitud, que encerraba completamente ambos alambres y se asemejaba mucho a las características de las infecciones clínicas relacionadas con implantes. Ambos alambres se extrajeron del absceso y la biopelícula se eliminó de cada superficie mediante disociación mecánica y química. La solución bacteriana disuelta se utilizó para analizar cuantitativamente la carga bacteriana dentro de la biopelícula en cada cable. Se llevó a cabo un análisis analítico comparativo inter e intraindividual de múltiples hilos entre los dos tipos de grupos de hilos para su evaluación cuantitativa. Además, ambos cables colocados dentro del mismo ratón se midieron comparativamente para una evaluación más precisa porque se incubaron simultáneamente con una infección uniforme. El análisis de qPCR utilizó los niveles relativos de expresión del gen 16S rRNA y el operón lux, que codifica la luciferasa en un Staphylococcus aureus bioluminiscente, para la evaluación cuantitativa. Este estudio, que involucró dos alambres idénticos, no resultó en diferencias significativas en todas las evaluaciones cuantitativas de la formación de biopelículas entre los grupos de alambres en varios ratones o entre alambres dentro de un solo ratón. Mientras tanto, el estudio previo mostró diferencias significativas en las evaluaciones cuantitativas de la formación de biopelículas entre dos grupos de alambre distintos en varios ratones16. Por lo tanto, este enfoque integral optimiza el modelo de ratón y las técnicas analíticas para minimizar la variabilidad de los resultados, lo que podría mejorar la precisión y la reproducibilidad de las evaluaciones cuantitativas de la formación de biopelículas en múltiples biomateriales.
Se han establecido varios modelos in vivo de infecciones relacionadas con implantes para evaluar la eficacia antimicrobiana en biomateriales 9,18,19,20. En estos modelos, normalmente se coloca un solo implante en la tibia, el fémur o la apófisis espinal por animal, junto con la inoculación bacteriana. Dado que el absceso se desarrolla alrededor o adyacente al implante después de la inoculación, imitando de cerca las características clínicas, estos modelos son útiles para el estudio in vivo de la infección relacionada con el implante. Sin embargo, los resultados de las evaluaciones cuantitativas pueden ser inconsistentes debido a un solo implante por sujeto, la inoculación en un espacio imperfectamente cerrado y la variabilidad en las respuestas inmunitarias y las condiciones de infección entre los sujetos. Además, las evaluaciones cuantitativas de estos modelos suelen requerir conocimientos especializados y aparatos de medición específicos, lo que limita su aplicabilidad. Aunque el tamaño del implante es limitado en este modelo de ratón, estos problemas pueden mejorarse gracias a los atributos de esta metodología integral, que implica la incubación simultánea de múltiples implantes con bacterias en condiciones de infección idénticas dentro de un solo ratón.
El paso más crítico en este enfoque es la eliminación de la biopelícula formada del implante. Un método representativo para la evaluación cuantitativa de la biopelícula es el recuento de UFC, que requiere el desprendimiento de las bacterias de la biopelícula, su suspensión en un medio y la posterior colocación de placas11. Aunque en muchos estudios se suelen utilizar técnicas de estrés mecánico que implican sonicación y vórtice para separar el biofilm, existen preocupaciones sobre su suficiencia para eliminar completamente todo el biofilm de los implantes. Si estas técnicas resultan insuficientes, la fiabilidad de los resultados puede verse comprometida. Este estudio demostró que la estimulación mecánica por sí sola no podía separar completamente la biopelícula. Por lo tanto, es necesario integrar el tratamiento químico con tripsina y la estimulación mecánica para lograr un desprendimiento bacteriano más confiable y cuantificar con precisión la carga bacteriana viva dentro del biofilm21.
El análisis de qPCR se usa comúnmente en estudios de microbioma para evaluar la carga bacteriana general dentro de la biopelícula. Este ensayo es probablemente un método más preciso para la evaluación cuantitativa que el ensayo de cristal violeta22. Al crear una curva de calibración con ADN plasmídico purificado directamente a partir de cultivos bacterianos puros, la carga bacteriana dentro de la biopelícula puede ser precisa. Dado que el gen 16S rRNA es una subunidad ribosómica presente en todas las bacterias, la qPCR dirigida al gen 16S rRNA se utiliza ampliamente para la cuantificación bacteriana, y la expresión del gen 16S rRNA es relativamente estable durante el crecimiento de Staphylococcus aureus 23,24. El gen luxA es un componente del operón lux en una cepa bioluminiscente de Staphylococcus aureus Xen 36. Este estudio demostró que la qPCR para el gen luxA también es efectiva para evaluar cuantitativamente la formación de biopelículas después de la inoculación de Xen 36. Por lo tanto, la evaluación cuantitativa de la formación de biopelículas se puede optimizar mediante la inoculación de una bacteria bioluminiscente y el uso del análisis de expresión génica del operón lux. Este procedimiento es relativamente fácil de implementar, reproducible y permite a los investigadores analizar varias muestras simultáneamente. Además, es económico y no requiere ningún equipo especial, por lo que es una opción factible para cualquier laboratorio.
Este enfoque integral tiene algunas limitaciones. En primer lugar, este estudio tiene como objetivo principal evaluar la formación de biopelículas en implantes en un entorno localizado y cerrado, lo que lo hace insuficiente para evaluar el impacto de los biomateriales en las infecciones sistémicas. En segundo lugar, la carga bacteriana necesaria para formar un absceso bien desarrollado en este modelo de ratón es considerablemente mayor que en los modelos alternativos, lo que puede crear un entorno desafiante para evaluar la resistencia de los biomateriales a la biopelícula25. Sin embargo, para formar un absceso que rodeara completamente los implantes y cultivar los implantes en condiciones idénticas de infección bacteriana, se requirió una dosis más alta de cultivo de bacterias. En tercer lugar, este modelo no se puede utilizar si uno de los implantes libera compuestos, ya que pueden afectar al otro implante. En cuarto lugar, la punta de pipeta utilizada para conectar los dos implantes puede influir en el curso de la infección, aunque el uso de una punta de pipeta comúnmente disponible hace que el modelo sea fácil de implementar en cualquier entorno de laboratorio.
En conclusión, este estudio presenta un nuevo modelo de ratón de infección relacionada con implantes y métodos analíticos optimizados para una evaluación cuantitativa precisa de la formación de biopelículas. Se espera que este enfoque integral mejore la precisión, la reproducibilidad y la versatilidad de las medidas de resultados para la cuantificación comparativa de biopelículas en implantes quirúrgicos mediante la explotación de sus atributos, contribuyendo así al desarrollo futuro de implantes antimicrobianos.
Divulgaciones
Los autores declaran no tener intereses contrapuestos.
Agradecimientos
Esta investigación fue parcialmente financiada por un Programa de Investigación Cooperativa Industrial/Universitaria de NSF llamado Centro de Innovaciones Musculoesqueléticas Disruptivas (IIP-1916629), Komatsuseiki Kosakusho Co., Ltd., y Rosies Base, LLC.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetic Acid | THOMAS SCIENTIFIC | 12-16-15-00 | |
| Agilent BioTek 800 TS Absorbance Reader | Agilent | BT800TS | |
| Air-Tite Sterile Hypodermic Needles, Needle Gauge: 18 G | FISHER SCIENTIFIC | 14817151 (CS) | |
| BD Spinal Needles: 25 G | FISHER SCIENTIFIC | 22043805 | |
| Benchtop Incubator Shaker | FISHER SCIENTIFIC | ||
| Branson Ultrasonic Bath, 115 Vac, 60 Hz | FISHER SCIENTIFIC | 2489500 | |
| Branson Ultrasonics 2510R-MTH (Sonicator) | RPI-T48500-500.0 | ||
| Centrifuge sorvall pico | FISHER SCIENTIFIC | ||
| CFX96 Real Time Optics Module qPCR System | BIO-RAD | ||
| Compact Sterilizer, 30L | THOMAS SCIENTIFIC LLC | 22A00N096 (EA/1) | |
| Crystal Violet, 1%, Solution SCI_ED | FISHER SCIENTIFIC | 10114-58-6 | |
| Falcon 24-well cell culture plate | FISHER SCIENTIFIC | 877125 | |
| Falcon 96-well cell culture plate | FISHER SCIENTIFIC | 8771001 | |
| Fisherbrand Digital Vortex Mixer | FISHER SCIENTIFICS | ||
| Kanamycin | THOMAS SCIENTIFIC LLC | 15160054 | |
| Mannitol Salt Agar | FISHER SCIENTIFIC | ||
| Micirobiological Incubator | Thermo Scientific | 51028063H | |
| PBS, Phosphate Buffered Saline | |||
| Staphylococcus aureus ATCC 49525 (Xen36) | Perkin Elmer | 119243 | |
| SYBR Green I Nucleic Acid Gel Stain | FISHER SCIENTIFIC | ||
| Trypsin 10x (2.5%) | FISHER SCIENTIFIC | 15090046 | |
| Tryptic Soy Broth | NETA SCIENTIFIC INC | ||
| Zyppy Plasmid Miniprep Ki | FISHER SCIENTIFIC | 501977785 | pellet-free modified alkaline lysis system |
Referencias
- Wukich, D. K., Lowery, N. J., McMillen, R. L., Frykberg, R. G. Postoperative infection rates in foot and ankle surgery: a comparison of patients with and without diabetes mellitus. J Bone Joint Surg Am. 92 (2), 287-295 (2010).
- Darouiche, R. O. Treatment of infections associated with surgical implants. N Engl J Med. 350 (14), 1422-1429 (2004).
- Arciola, C. R., Campoccia, D., Montanaro, L. Implant infections: Adhesion, biofilm formation and immune evasion. Nat Rev Microbiol. 16 (7), 397-409 (2018).
- Li, P., Yin, R., Cheng, J., Lin, J. Bacterial biofilm formation on biomaterials and approaches to its treatment and prevention. Int J Mol Sci. 24 (14), ijms241411680(2023).
- Chen, X., Zhou, J., Qian, Y., Zhao, L. Antibacterial coatings on orthopedic implants. Mater Today Bio. 19, 100586(2023).
- Pan, C., Zhou, Z., Yu, X. Coatings as the useful drug delivery system for the prevention of implant-related infections. J Orthop Surg Res. 13 (1), 220(2018).
- Savvidou, O. D., et al. Efficacy of antimicrobial coated orthopedic implants on the prevention of periprosthetic infections: A systematic review and meta-analysis. J Bone Jt Infect. 5 (4), 212-222 (2020).
- Sussman, E. M., Casey, B. J., Dutta, D., Dair, B. J. Different cytotoxicity responses to antimicrobial nanosilver coatings when comparing extract-based and direct-contact assays. J Appl Toxicol. 35 (6), 631-639 (2015).
- Cyphert, E. L., Zhang, N., Learn, G. D., Hernandez, C. J., von Recum, H. A. Recent advances in the evaluation of antimicrobial materials for resolution of orthopedic implant-associated infections in vivo. ACS Infect Dis. 7 (12), 3125-3160 (2021).
- Stavrakis, A. I., et al. Current animal models of postoperative spine infection and potential future advances. Front Med (Lausanne). 2, 34(2015).
- Carli, A. V., et al. Quantification of Peri-implant bacterial load and in vivo biofilm formation in an innovative, clinically representative mouse model of periprosthetic joint infection. J Bone Joint Surg Am. 99 (6), e25(2017).
- Bernthal, N. M., et al. A mouse model of post-arthroplasty Staphylococcus aureus joint infection to evaluate in vivo the efficacy of antimicrobial implant coatings. PLoS One. 5 (9), e12580(2010).
- Kelley, B. V., et al. In vivo mouse model of spinal implant infection. J Vis Exp. (160), e60560(2020).
- Meroni, G., et al. A Journey into animal models of human osteomyelitis: A review. Microorganisms. 10 (6), 10061135(2022).
- Wang, Y., et al. Mouse model of hematogenous implant-related Staphylococcus aureus biofilm infection reveals therapeutic targets. Proc Natl Acad Sci U S A. 114 (26), E5094-E5102 (2017).
- Mitsuhiro Nishizawa, D. H., et al. A novel approach to reducing spinal implant-associated infections. bioRxiv. , (2024).
- Fehlings, M. G., et al. A clinical practice guideline for the management of patients with acute spinal cord injury: Recommendations on the use of methylprednisolone sodium succinate. Global Spine J. 7 (3 Suppl), 203S-211S (2017).
- Dworsky, E. M., et al. Novel in vivo mouse model of implant-related spine infection. J Orthop Res. 35 (1), 193-199 (2017).
- Masters, E. A., et al. Distinct vasculotropic versus osteotropic features of S. agalactiae versus S. aureus implant-associated bone infection in mice. J Orthop Res. 39 (2), 389-401 (2021).
- Sheppard, W. L., et al. Novel in vivo mouse model of shoulder implant infection. J Shoulder Elbow Surg. 29 (7), 1412-1424 (2020).
- Mansouri, M. D., Ramanathan, V., Al-Sharif, A. H., Darouiche, R. O. Efficacy of trypsin in enhancing assessment of bacterial colonization of vascular catheters. J Hosp Infect. 76 (4), 328-331 (2010).
- Wang, X., Howe, S., Deng, F., Zhao, J. Current applications of absolute bacterial quantification in microbiome studies and decision-making regarding different biological questions. Microorganisms. 9 (9), 9091797(2021).
- Lima, A., Franca, A., Muzny, C. A., Taylor, C. M., Cerca, N. DNA extraction leads to bias in bacterial quantification by qPCR. Appl Microbiol Biotechnol. 106 (24), 7993-8006 (2022).
- Eleaume, H., Jabbouri, S. Comparison of two standardization methods in real-time quantitative RT-PCR to follow Staphylococcus aureus genes expression during in vitro growth. J Microbiol Methods. 59 (3), 363-370 (2004).
- Vidlak, D., Kielian, T. Infectious dose dictates the host response during Staphylococcus aureus orthopedic-implant biofilm infection. Infect Immun. 84 (7), 1957-1965 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados