Method Article
Влияние шиконина на сигнальный путь HIF-1α/VEGF у мышей с острым повреждением легких, вызванным сепсисом
В этой статье
Резюме
Протокол направлен на оценку эффективности шиконина в облегчении острого повреждения легких, вызванного сепсисом у мышей. Нацеливаясь на путь HIF-1α/VEGF, исследование изучает, как различные дозы шиконина влияют на показатели выживаемости, патологию легких и экспрессию маркеров воспаления, подчеркивая его потенциальные терапевтические преимущества.
Аннотация
Сепсис часто вызывает острое повреждение легких (ОПЛ), осложнение с высокой смертностью. Путь HIF-1α/VEGF играет ключевую роль в развитии сепсиса, а шиконин, природное соединение с противовоспалительными свойствами, может облегчить повреждение легких, воздействуя на этот путь. Мыши Balb/c были случайным образом разделены на четыре группы: фиктивная группа, модельная группа, группа лечения низкими дозами и группа лечения высокими дозами. В симуляционной группе была выполнена лапаротомия без лигирования слепой кишки и пункции (CLP), в то время как модельной группе была выполнена операция CLP для индуцирования острого повреждения легких, связанного с сепсисом. После моделирования группы лечения с низкими и высокими дозами получали шиконин через зонд в дозах 12,5 мг/кг и 50 мг/кг соответственно один раз в сутки в течение 14 дней. Проводился мониторинг 7-дневной выживаемости мышей. Для оценки патологии легочной ткани использовали окрашивание гематоксилином и эозином (HE), измеряли массовое соотношение легких: влажное/сухое (W/D), а также проводили вестерн-блоттинг для выявления экспрессии HIF-1α, VEGF, TNF-α и IL-6 в легочной ткани. Шиконин значительно улучшил выживаемость септических мышей, при этом наибольший эффект наблюдался в группе с высокими дозами (p < 0,05). По сравнению с модельной группой, соотношение W/D в легких и повреждение тканей в группах, получавших шиконин, были значительно снижены дозозависимым образом. Кроме того, шиконин значительно снижал экспрессию HIF-1α, VEGF, TNF-α и IL-6, причем в группе высоких доз наблюдалось наиболее выраженное снижение (p < 0,05). Шиконин облегчает острое повреждение легких у мышей-септиков, потенциально подавляя экспрессию HIF-1α и снижая выработку связанных с ним воспалительных факторов.
Введение
Сепсис — это тяжелая системная воспалительная реакция, вызванная инфекцией. 1 Это часто приводит к полиорганной дисфункции и может стать опасным для жизни по мере прогрессирования заболевания. 2 Несмотря на использование таких методов лечения, как искусственная вентиляция легких и поддерживающая терапия, показатели смертности от сепсис-ассоциированного ОПЛ остаются высокими, достигая 30-40%3. Эти методы лечения в основном направлены на устранение симптомов, а не на основные причины, что ограничивает их общую эффективность. Таким образом, выявление новых терапевтических подходов, направленных на устранение причин повреждения легких, может значительно улучшить результаты лечения сепсиса у пациентов.
Недавние исследования определили индуцируемый гипоксией фактор-1α (HIF-1α) в качестве важнейшего регулятора в прогрессировании сепсис-индуцированного ALI 4,5. HIF-1α накапливается в легочной ткани во время сепсиса, стимулируя экспрессию нижестоящих генов, которые усугубляют воспаление и повреждение тканей6. Этот процесс значительно способствует усугублению поражения легких. Таким образом, нацеливание на сигнальный путь HIF-1α предлагает многообещающий подход к смягчению воспалительных и гипоксических реакций, наблюдаемых при сепсис-индуцированном ОПЛ.
В поисках более эффективных методов лечения традиционная китайская медицина (ТКМ) предоставила ценные знания 7,8. Шиконин — соединение антрахинона, извлеченное из Lithospermum erythrorhizon7. Он обладает выраженнымпротивовоспалительным 9, антибактериальным10 и противоопухолевым эффектами11. Шиконин может облегчить повреждение легких, вызванное липополисахаридом (ЛПС), что указывает на его потенциальную терапевтическую роль при заболеваниях легких12. В то же время некоторые исследования также показали, что шиконин может облегчить окислительное повреждение, вызванное сепсисом, регулируя мононуклеарную макрофагальную систему, уравновешивая провоспалительные и противовоспалительные реакции. Тем не менее, механизмы, лежащие в основе защитных эффектов шиконина при ОПЛ, вызванном сепсисом, до конца не изучены. Это представляет собой критический пробел в современных исследованиях.
В этом исследовании мы стремимся изучить защитные эффекты шиконина в мышиной модели сепсис-индуцированного ОПЛ с использованием лигирования и пункции слепой кишки (CLP). Технология CLP играет важную роль в исследованиях сепсиса, поскольку она может моделировать сложные системные воспалительные реакции и полиорганную дисфункцию, что делает ее подходящей для оценки эффективности новых стратегий лечения. Технология CLP относительно более клинически актуальна по сравнению с традиционными методами введения ЛПС: она моделирует системную воспалительную реакцию, вызванную транслокацией микробиоты кишечника, которая ближе к патологическому процессу клинического сепсиса. Его можно градуировать и контролировать: регулируя длину лигирования и размер перфорации, можно контролировать тяжесть заболевания, и он подходит для всего исследования сепсиса. Кроме того, он может моделировать аналогичные динамические изменения в полиорганной дисфункции и цитокиновом ответе. Исследуя роль шиконина в модуляции сигнального пути HIF-1α/VEGF, мы надеемся получить представление о новых терапевтических стратегиях, которые воздействуют на основные механизмы повреждения легких, связанного с сепсисом, потенциально улучшая клинические исходы.
протокол
Протокол получил одобрение Центра экспериментальных животных Медицинского университета Вэньчжоу. В данном исследовании использовались самцы мышей C57Bl/6 (в возрасте 5–6 месяцев; 20–25 г). Подробная информация об основных реагентах и используемом оборудовании приведена в Таблице материалов.
1. Подготовка мышиной модели для лечения сепсиса
- Домашние мыши при постоянной температуре 25 °C, влажности 50% и 12-часовом цикле свет/темнота.
- После 7-дневного периода акклиматизации случайным образом разделите мышей на четыре группы: группа Шама, модельная группа, группа с низкой дозой лечения и группа с высокой дозой лечения, по 20 мышей в каждой группе.
- Основываясь на ссылках из предыдущего исследования13, лечите группу с низкими дозами с концентрацией пурпурина 12,5 мг/кг в течение 14 дней, а группу с высокими дозами с концентрацией 50 мг/кг в течение 14 дней. В группе фиктивной хирургии выполните лапаротомию, вытяжение слепой кишки, уменьшение и закрытие без лигирования или пункции, а также лечение той же дозой физиологического раствора в течение 14 дней. Экспериментальные этапы для группы сепсиса следующие.
- После ночного голодания (вода была разрешена) обезболивайте мышей пентобарбиталом натрия (40-80 мг/кг) в стерильных условиях на протяжении всего процесса. Нанесите ветеринарную мазь на глаза, чтобы предотвратить сухость во время анестезии.
- Проверьте правильность обезболивания как замедление частоты дыхания, снижение мышечного напряжения и отсутствие явной реакции на стресс при легком зажиме нижних конечностей кровоостанавливающими щипцами.
- Провести дезинфекцию 75% этанолом, 3х. Сделайте продольный разрез около 1 см в среднем-левом положении брюшка мыши и разрежьте кожу, фасцию и мышцы слоями, чтобы обнажить брюшную полость.
- С помощью офтальмологических щипцов с тупым концом в обеих руках аккуратно исследуйте брюшную полость, найдите и освободите слепую кишку мыши, а также перевязайте ее на расстоянии около 1 см от конца слепой кишки.
- С помощью иглы 21G проколите и перевязайте конец слепой кишки, осторожно выдавите небольшое количество содержимого кишечника из места прокола с помощью офтальмологических щипцов с тупым наконечником, а затем извлеките его в слепую кишку.
- Проводят подкожную инфузионную терапию 1 мл 0,9% раствора натрия хлорида. Не оставляйте животное без присмотра до тех пор, пока оно не придет в сознание, достаточное для поддержания лежачего положения на грудине. Отметим, что животное, перенесшее операцию, не возвращается в компанию других животных до полного выздоровления.
- После 7 дней моделирования CLP введите чрезмерную анестезию для эвтаназии.
ПРИМЕЧАНИЕ: В связи с возможным раздражающим действием пурпурина на кожу, дыхательные пути и пищеварительный тракт, а также его высокой токсичностью для водных организмов, загрязнением окружающей среды, используйте средства индивидуальной защиты во время эксперимента.
2. Оценка животных моделей
- Наблюдение за выживанием мышей
- Выполняйте работу с животными так, как описано выше. Запишите уровень смертности в течение 1 недели после моделирования для статистического анализа. Некоторые мыши умирают без сепсиса до эвтаназии, в то время как мыши модели CLP имеют определенный уровень смертности (табл. 1).
- Измерение соотношения влажного и сухого веса легких
- Через 24 ч моделирования снова обезболите мышей в соответствии с шагами 1.4-1.5.
- Сделайте продольный разрез примерно на 1 см с левой стороны средней линии ключицы мыши и удалите кожу, фасцию и мышечные слои, чтобы обнажить грудную полость с помощью хирургических ножниц и щипцов.
- Удалите левое легкое и слейте поверхностную жидкость. Измерьте влажный вес, а затем высушите его в духовке при температуре 80 °C в течение 72 ч до постоянного веса, чтобы получить сухой вес.
- Рассчитайте содержание воды в легких следующим образом:
Содержание воды в легких = (Сырой вес - Сухой вес) / Сырой вес x 100%.
- Гистопатологическое сравнение тканей легких
- В указанные моменты времени соберите левое легкое, как описано выше в шаге 2.2. Зафиксируйте легкое в 10% нейтральном формальдегиде, погрузите его в парафин и разрежьте на толщину 5 мкм.
- Депарафинизируйте легкое в ксилоле, 2 раза, в течение 5-10 минут каждый раз. Выполняйте последовательную регидратацию этанола со значениями 100%, 95%, 85% и 75% в течение 3 минут на каждый градиент. Замочить в дистиллированной воде на 2 минуты.
- Окрашивайте примерно 100 мл раствора гематоксилина в течение 10 минут, затем смойте дистиллированной водой, чтобы удалить плавающий цвет.
- Добавьте около 70 мл раствора для дифференцировки и замочите на 30 секунд. Затем замочите в водопроводной воде 2 раза, каждый раз на 3-5 минут.
- Добавьте примерно 100 мл раствора красителя эозина по каплям в течение 2 минут. Вылейте излишки раствора красителя и быстро обезвоживайтесь, как описано ниже.
- Выполните обезвоживание, прозрачность и герметизацию, как описано ниже.
- Замочите образцы в градиентном этаноле: 75%, 85%, 95% и 100% этаноле (I) на 2-3 с каждый. Замочите в 100% этаноле (II) на 1 минуту и замочите в ксилоле 2 раза на 1 минуту каждый раз. С помощью соломинки или пипетки капните нейтральную камедь на поверхность срезов ткани и распределите ее максимально равномерно, чтобы избежать образования пузырьков. Запечатайте и наблюдайте под микроскопом при 400-кратном увеличении.
- Выберите 10 случайных полей для каждого участка легкого. Попросите патологоанатома оценить патологические изменения, такие как альвеолярный отек, кровоизлияние и инфильтрация нейтрофилов, от 0 (норма) до 4 (серьезное повреждение). Используйте общий балл для оценки.
- Вестерн-блоттинг
- Извлеките ядерные белки из легочной ткани в соответствии с инструкциями набора для экстракции ядерных белков и измерьте концентрацию белка методом BCA в соответствии с инструкциями производителя.
- Подготовьте образцы с загрузкой белка 50 мкг белка на образец. Приготовьте SDS-PAGE разделительный гель (10%) и укладывающий гель (3%). Проведите электрофорез при напряжении 80 В в течение 45 минут, затем перенесите белок на мембрану PVDF при напряжении 110 В в течение 60 минут после того, как образцы попадут в разделительный гель.
- Перенесите белки на мембрану и заблокируйте на 60 минут. Инкубируют с первичными антителами (см. Таблицу материалов, 1:1000) в течение ночи при 4 °C, а затем инкубируют вторичными антителами (см. Таблицу материалов, 1:1000) при 37 °C в течение 2 ч.
- Промойте мембрану TBST и используйте ECL для визуализации. В темном помещении добавьте подготовленные реагенты на мембрану из ПВДФ и проведите встряхивание и флуоресцентную визуализацию. Реагенты ECL взаимодействуют с биомолекулами на мембране, вызывая сильные хемилюминесцентные реакции, которые регистрируются приборами флуоресцентной визуализации.
- Проанализируйте значение оттенков серого для белковых полос с помощью системы анализа изображений Метод количественной оценки полос (подробную информацию о системе, используемой для анализа денситометрии полос, см. в разделе Изображение NIH).
- Статистический анализ
- Используйте SPSS 26.0 для статистического анализа. Используйте однофакторный ANOVA для сравнения средних значений нескольких групп и тесты LSD-t для парных сравнений. Рассмотрим p-значение < 0,05 как статистически значимое.
Результаты
Чтобы оценить терапевтический потенциал шиконина, мы сначала оценили его влияние на выживаемость у септических мышей в течение 7-дневного периода. Лечение шиконином улучшало показатели выживаемости дозозависимым образом (Рисунок 1).
Учитывая широко распространенность повреждения легких при сепсисе, мы также оценили отек легких у мышей. Отек легких оценивали путем измерения соотношения влажной и сухой массы легких (W/D). Отношение W/D было значительно повышено в модельной группе по сравнению с фиктивной группой (p < 0,05). Лечение Шиконином смягчало этот эффект дозозависимым образом. В группе с высокой дозой наблюдалось более существенное снижение отека легких, чем в группе с низкой дозой (p < 0,05) (рис. 2).
Для дальнейшей валидации защитного действия шиконина на легочную ткань был проведен гистопатологический анализ. В фиктивной группе наблюдалась нормальная структура легких, в то время как в модельной группе CLP наблюдалось заметное повреждение тканей, включая обширный отек, кровоизлияние и воспалительную инфильтрацию клеток. В соответствии со сниженным соотношением W/D, лечение шиконином облегчало эти патологические изменения дозозависимым образом. У мышей в группе высоких доз наблюдалось значительно меньше гистопатологических отклонений по сравнению с модельной группой CLP, и их показатели патологии были заметно ниже, чем в группе с низкой дозой (p < 0,05; Рисунок 3).
Поскольку и воспаление, и гипоксия являются основными факторами повреждения легких, вызванного сепсисом, мы дополнительно изучили уровни экспрессии ключевых белков, участвующих в этих путях. Вестерн-блоттинг показал, что в модельной группе CLP наблюдался значительно повышенный уровень TNF-αand, IL-6 и VEGF, что указывает на воспалительную реакцию (рис. 4). Кроме того, HIF-1α и VEGF были высоко экспрессированы в модельной группе, что подтверждает повышенную гипоксию (рис. 5). Лечение шиконином значительно снижало экспрессию этих белков дозозависимым образом, при этом в группе с высокой дозой наблюдалось большее подавление HIF-1α, VEGF, TNF-α и IL-6 по сравнению с группой с низкой дозой (p < 0,05; Рисунок 4 и Рисунок 5). Эти молекулярные результаты еще раз подтверждают защитную роль шиконина, подчеркивая его способность модулировать как гипоксию, так и воспаление у септических мышей.
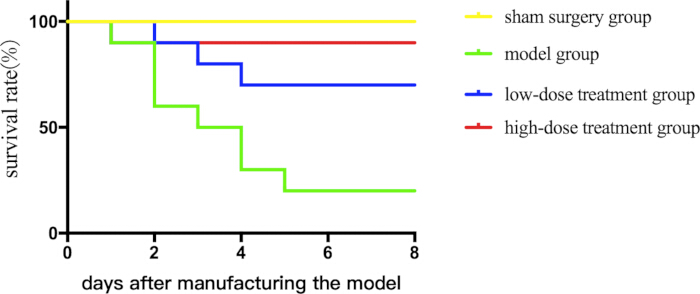
Рисунок 1: Сравнение показателей выживаемости между различными группами септических мышей. Мышей объединяли в группы и подвергали их CLP наряду с медикаментозным лечением, а также строили кривые выживаемости, чтобы зафиксировать их статус выживаемости. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
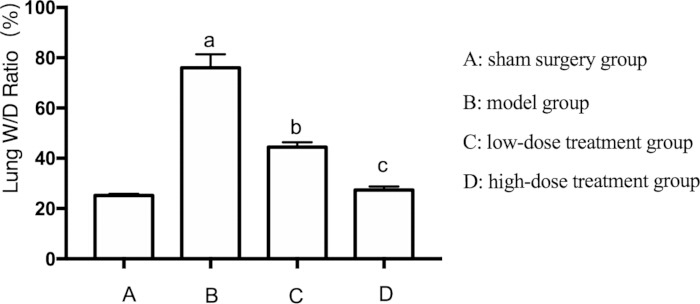
Рисунок 2: Влияние шиконина на соотношение W/D в легких у септических мышей. Мышей объединяли в группы и подвергали воздействию CLP вместе с медикаментозным лечением в течение 24 ч, после чего регистрировали соотношение W/D в легких. AP < 0,05 по сравнению с группой Sham, BP < 0,05 по сравнению с группой сепсиса, а CP < 0,05 по сравнению с группой лечения с низкими дозами. Полосы погрешностей показывают стандартное отклонение, односторонний ANOVA использовался для сравнения средних значений нескольких групп, а тест LSD-t использовался для парного сравнения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
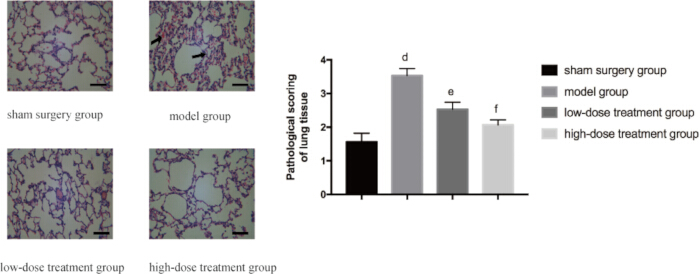
Рисунок 3: Микроскопические изменения патологии легочной ткани в разных группах. Мышей объединяли в группы и подвергали КЛП с медикаментозной обработкой в течение 24 ч. Затем легочную ткань собирали для окрашивания HE. На левой панели отображаются репрезентативные изображения с 400-кратным увеличением (масштабная линейка = 100 мкм). Обширный отек, кровотечение и воспалительная инфильтрация клеток могут наблюдаться в модельной группе, как показано стрелкой. На правой панели представлены соответствующие гистопатологические оценки. По сравнению с фиктивной группой разница была достоверной (p 0,05). Полосы погрешностей показывают стандартное отклонение, односторонний ANOVA использовался для сравнения средних значений нескольких групп, а тест LSD-t использовался для парного сравнения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
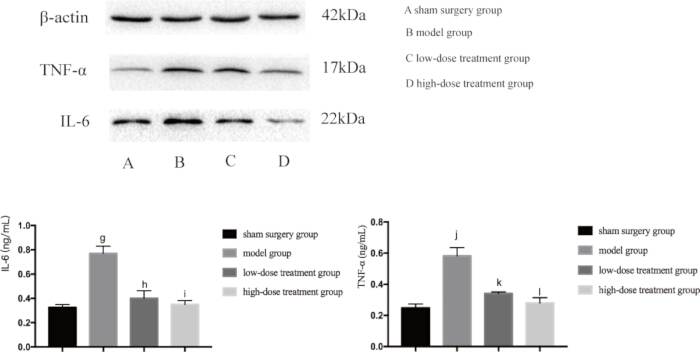
Рисунок 4: Уровни экспрессии белков TNF-α и IL-6 в легочной ткани мышей. Мышей группировали и подвергали ХЛП одновременно с лечением препаратом в течение 24 ч, после чего в легочной ткани была обнаружена экспрессия указанных белков. По сравнению с фиктивной группой экспрессия TNF-α в модельной группе была достоверно повышена (gp < 0,05). По сравнению с модельной группой, экспрессия TNF-α в группе лечения низкими дозами была достоверно снижена (hp < 0,05). По сравнению с группой, получавшей низкие дозы, экспрессия ФНО-α в группе высокодозного лечения снизилась, но разница не была статистически значимой (ip > 0,05). Кроме того, по сравнению с фиктивной группой достоверно увеличилась экспрессия IL-6 в модельной группе (jp < 0,05). По сравнению с модельной группой экспрессия IL-6 в группе лечения низкими дозами была достоверно снижена (kp < 0,05). По сравнению с группой, получавшей низкие дозы, экспрессия IL-6 в группе лечения высокими дозами снижалась, но разница не была статистически значимой (lp > 0,05). Полосы погрешностей показывают стандартное отклонение, односторонний ANOVA использовался для сравнения средних значений нескольких групп, а тест LSD-t использовался для парного сравнения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
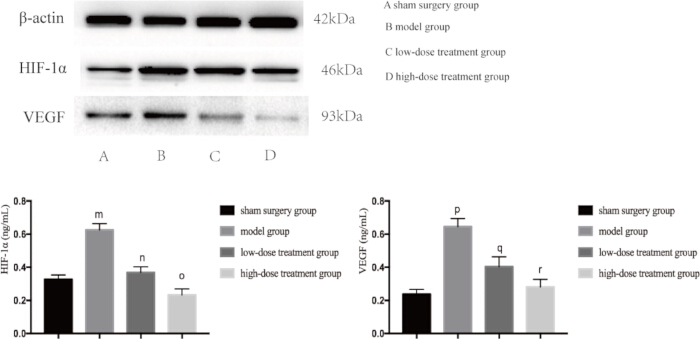
Рисунок 5: Уровни экспрессии белков HIF-1α и VEGF в легочной ткани мышей. Мышей группировали и подвергали ХЛП одновременно с лечением препаратом в течение 24 ч, после чего в легочной ткани была обнаружена экспрессия указанных белков. По сравнению с фиктивной группой экспрессия HIF-1α в модельной группе была достоверно увеличена (mp < 0,05). По сравнению с модельной группой, экспрессия HIF-1α в группе лечения низкими дозами была достоверно снижена (np < 0,05). По сравнению с группой, получавшей низкие дозы, экспрессия HIF-1α в группе лечения высокими дозами снижалась, но разница не была статистически значимой (op > 0,05). Кроме того, по сравнению с фиктивной группой экспрессия VEGF в модельной группе была достоверно увеличена (pp < 0,05). По сравнению с модельной группой, экспрессия VEGF в группе лечения низкими дозами была достоверно снижена (qp < 0,05). По сравнению с группой, получавшей низкие дозы, экспрессия VEGF в группе лечения высокими дозами снижалась, но разница не была статистически значимой (rp > 0,05). Полосы погрешностей показывают стандартное отклонение, односторонний ANOVA использовался для сравнения средних значений нескольких групп, а тест LSD-t использовался для парного сравнения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Дни недели | Фиктивная группа | Модельная группа | Группа лечения с низкими дозами | группа высокодозной терапии |
| 0 | 20 | 20 | 20 | 20 |
| 1 | 20 | 20 | 20 | 20 |
| 2 | 20 | 18 | 20 | 18 |
| 3 | 20 | 12 | 18 | 18 |
| 4 | 20 | 10 | 16 | 18 |
| 5 | 20 | 6 | 14 | 18 |
| 6 | 20 | 4 | 14 | 18 |
| 7 | 20 | 4 | 14 | 18 |
Таблица 1: Выживаемость мышей.
Обсуждение
Будучи моделью золотого стандарта для исследований сепсиса, модель CLP является ключевым шагом в этом эксперименте, потому что CLP имитирует сложность сепсиса человека лучше, чем многие другие модели. Сепсис-ассоциированный ОПЛ остается критической клинической проблемой из-за его высокой смертности и ограниченной эффективности современных методов лечения14,15. Наше исследование впервые демонстрирует, что шиконин значительно улучшает выживаемость у септических мышей, модулируя как HIF-1α, так и воспалительные реакции путем создания модели CLP.
Смертность, вызванная CLP, зависит от нескольких технических параметров, таких как размер иглы, длина перевязанной слепой кишки и количество проколов слепой кишки. Если игла слишком тонкая или количество игл недостаточно, это не вызовет реакцию системного сепсиса. Если игла слишком толстая или количество использованных игл слишком много, мыши склонны к смерти и не могут продолжить следующий эксперимент. Таким образом, путем неоднократных технических модификаций и устранения неполадок мы пришли к выводу, что мы проводили лигирование на расстоянии примерно 1 см от конца слепой кишки. Мы использовали иглу 21G для прокола и перевязки конца слепой кишки и осторожно выдавили небольшое количество содержимого кишечника из места прокола с помощью офтальмологических щипцов с тупым наконечником, прежде чем снова ввести его обратно в слепую кишку. В течение 6-часового послеоперационного периода CLP наблюдайте, проявляются ли у мышей симптомы сепсиса, такие как вялость, медленные движения, эрегированные волосы, выделения из глаз и диарея. Наблюдения указывают на дозозависимую выживаемость, наблюдаемую в группе высоких доз шиконина, что согласуется с предыдущими исследованиями терапевтического потенциала ТКМв лечении сепсиса. Шиконин с высокой вероятностью может служить ценным дополнением или альтернативой современным методам лечения сепсис-индуцированного ОПЛ 5,17.
Как мы уже упоминали ранее, эта модель может предоставить реальную платформу для моделирования патологического механизма сепсиса18. Потому что он может моделировать ключевые особенности сепсиса человека, включая множественные бактериальные инфекции, динамические иммунные реакции, полиорганную дисфункцию и многое другое. Кроме того, модель CLP может оптимизировать валидацию и совершенствование существующих методов лечения, таких как проверка эффективности антибиотиков, иммуномодуляторов и адъювантной терапии (таких как витамин С и гидрокортизон), помогая оптимизировать дозировку и время введения. Модель также имеет большое значение для выявления биологической основы существующих клинических проблем, проблем антибиотикорезистентности, стандартизации клинических трансляционных исследований, искусственного интеллекта, анализа больших данных и других аспектов.
Будущие применения этой технологии включают в себя следующие аспекты. Во-первых, это исследования и разработка новых лекарственных препаратов и валидация стратегий лечения, что потенциально может стимулировать развитие гистон-терапии в будущем. Во-вторых, углубленный анализ иммунных механизмов и реакций хозяина, например, помощь в разработке иммуномодулирующих терапий, таких как применение ингибиторов сигнального пути PD-1/PD-L119. В-третьих, интеграция мультиомики и искусственного интеллекта, такая как объединение данных, генерируемых моделями CLP, может быть использована для построения прогностических моделей сепсиса в будущем с помощью машинного обучения. В-четвертых, изучение микробиома и инфекционного контроля. В будущем эта модель может быть использована для изучения возможности новых стратегий борьбы с инфекциями, таких как трансплантация фекальной микробиоты и фаготерапия.
Несмотря на то, что модель CLP является хорошо зарекомендовавшим себя методом индуцирования сепсиса, она может не полностью воспроизводить сложность сепсиса человека, что ограничивает возможность обобщения наших результатов. Будущие исследования должны включать в себя большие размеры выборки и изучать эффекты шиконина в различных моделях сепсиса, чтобы подтвердить эти результаты. Более того, более глубокое изучение задействованных молекулярных механизмов, включая потенциальные взаимодействия с другими сигнальными путями, будет иметь решающее значение для понимания полного терапевтического потенциала шиконина.
В заключение, наше исследование определяет шиконин как перспективного кандидата для лечения сепсис-индуцированного ОПЛ с помощью мышиной модели CLP. Воздействуя как на гипоксические, так и на воспалительные пути, шиконин обладает потенциалом для улучшения клинических исходов у пациентов с сепсисом. Эта работа не только дает новое представление о механизмах повреждения легких, связанного с сепсисом, но и подчеркивает потенциальную роль традиционной китайской медицины в современных терапевтических стратегиях.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих интересов.
Благодарности
Исследование было поддержано Научно-техническим проектом Вэньчжоу (Y2020976).
Материалы
| Name | Company | Catalog Number | Comments |
| H&E stain kit staining kit | Solaibao Technology | G1120HE | |
| Low-temperature centrifuge | Sigma | 3K15 | |
| Microplate Reader | Bio-Rad | Model 680 | |
| rabbit monoclonal VEGF-receptor1 antibody | Abcam | ab238632 | |
| rabbit polyclonal HIF-1α antibody | Abcam | ab51608 | |
| SDS-PAGE electrophoresis system | Bio-Rad | MINI Protean2 | |
| Shikonin | MedChemExpress | HY-N0822 |
Ссылки
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены