Method Article
Auswirkungen von Shikonin auf den HIF-1α/VEGF-Signalweg bei Mäusen mit akuter Lungenschädigung durch Sepsis
In diesem Artikel
Zusammenfassung
Das Protokoll zielt darauf ab, die Wirksamkeit von Shikonin bei der Linderung akuter Lungenschäden, die durch Sepsis bei Mäusen verursacht werden, zu bewerten. Durch die Ausrichtung auf den HIF-1α/VEGF-Signalweg untersucht die Studie, wie unterschiedliche Dosen von Shikonin die Überlebensraten, die Lungenpathologie und die Expression von Entzündungsmarkern beeinflussen, und unterstreicht den potenziellen therapeutischen Nutzen.
Zusammenfassung
Sepsis verursacht häufig eine akute Lungenschädigung (ALI), eine Komplikation mit hoher Mortalität. Der HIF-1α/VEGF-Signalweg spielt eine Schlüsselrolle bei der Sepsis, und Shikonin, eine natürliche Verbindung mit entzündungshemmenden Eigenschaften, kann Lungenschäden lindern, indem es auf diesen Signalweg abzielt. Balb/c-Mäuse wurden nach dem Zufallsprinzip in vier Gruppen eingeteilt: Scheingruppe, Modellgruppe, niedrig dosierte Behandlungsgruppe und hochdosierte Behandlungsgruppe. Die Scheingruppe erzog sich einer Laparotomie ohne Zäkalligatur und -punktion (CLP), während die Modellgruppe sich einer CLP unterzog, um eine Sepsis-bedingte akute Lungenschädigung zu induzieren. Nach der Modellierung erhielten die niedrig und hoch dosierten Behandlungsgruppen Shikonin durch Sonde in Dosen von 12,5 mg/kg bzw. 50 mg/kg einmal täglich für 14 Tage. Die 7-Tage-Überlebensrate der Mäuse wurde überwacht. Hämatoxylin- und Eosin (HE)-Färbung wurde verwendet, um die Pathologie des Lungengewebes zu beurteilen, das Verhältnis von Feucht/Trocken (W/D) der Lunge wurde gemessen und ein Western Blot durchgeführt, um die Expression von HIF-1α, VEGF, TNF-α und IL-6 im Lungengewebe nachzuweisen. Shikonin verbesserte die Überlebensrate septischer Mäuse signifikant, wobei der größte Effekt in der Hochdosisgruppe beobachtet wurde (p < 0,05). Im Vergleich zur Modellgruppe waren das Lungen-W/D-Verhältnis und die Gewebeschädigung in den mit Shikonin behandelten Gruppen dosisabhängig signifikant reduziert. Darüber hinaus regulierte Shikonin die Expression von HIF-1α, VEGF, TNF-α und IL-6 signifikant herunter, wobei die Hochdosisgruppe die ausgeprägteste Reduktion aufwies (p < 0,05). Shikonin lindert akute Lungenschäden bei septischen Mäusen, möglicherweise durch Hemmung der Expression von HIF-1α und Verringerung der Produktion verwandter Entzündungsfaktoren.
Einleitung
Sepsis ist eine schwere systemische Entzündungsreaktion, die durch eine Infektion ausgelöst wird. 1 Sie führt oft zu Funktionsstörungen mehrerer Organe und kann mit fortschreitender Erkrankung lebensbedrohlich werden. 2 Trotz des Einsatzes von Therapien wie maschineller Beatmung und unterstützender Pflege sind die Sterblichkeitsraten für Sepsis-assoziierte ALI mit 30 % bis 40 % nach wie vor hoch3. Diese Behandlungen befassen sich hauptsächlich mit den Symptomen und nicht mit den zugrunde liegenden Ursachen, was ihre Gesamtwirksamkeit einschränkt. Daher könnte die Identifizierung neuer Therapieansätze, die auf die Ursachen von Lungenverletzungen abzielen, die Behandlungsergebnisse bei Sepsis erheblich verbessern.
Neuere Studien haben den Hypoxie-induzierbaren Faktor-1α (HIF-1α) als kritischen Regulator bei der Progression der Sepsis-induzierten ALIidentifiziert 4,5. HIF-1α reichert sich während der Sepsis im Lungengewebe an und treibt die Expression nachgeschalteter Gene voran, die Entzündungen und Gewebeschäden verschlimmern6. Dieser Prozess trägt wesentlich zur Verschlechterung der Lungenschädigung bei. Daher bietet die Ausrichtung auf den HIF-1α-Signalweg einen vielversprechenden Ansatz zur Abschwächung der inflammatorischen und hypoxischen Reaktionen, die bei Sepsis-induzierter ALI beobachtet werden.
Auf der Suche nach wirksameren Behandlungen hat die Traditionelle Chinesische Medizin (TCM) wertvolle Erkenntnisse geliefert 7,8. Shikonin ist eine Anthrachinonverbindung, die aus Lithospermum erythrorhizon7 gewonnen wird. Es zeigt bemerkenswerte entzündungshemmende9, antibakterielle10 und antitumorale Wirkungen11. Shikonin kann Lungenschäden, die durch Lipopolysaccharid (LPS) induziert werden, lindern, was auf seine potenzielle therapeutische Rolle bei Lungenerkrankungen hindeutet12. Gleichzeitig haben einige Studien auch vorgeschlagen, dass Shikonin oxidative Schäden, die durch Sepsis verursacht werden, lindern kann, indem es das mononukleäre Makrophagensystem reguliert und entzündungsfördernde und entzündungshemmende Reaktionen ausgleicht. Die Mechanismen, die hinter der schützenden Wirkung von Shikonin bei Sepsis-induzierter ALI stehen, sind jedoch nicht vollständig verstanden. Dies stellt eine kritische Lücke in der aktuellen Forschung dar.
In dieser Studie wollen wir die protektive Wirkung von Shikonin in einem Mausmodell der Sepsis-induzierten ALI mittels Cecal-Ligation und -Punktion (CLP) untersuchen. Die CLP-Technologie spielt eine wichtige Rolle in der Sepsisforschung, da sie komplexe systemische Entzündungsreaktionen und Multiorgandysfunktionen simulieren kann und sich daher für die Bewertung der Wirksamkeit neuartiger Behandlungsstrategien eignet. Die CLP-Technologie ist im Vergleich zu herkömmlichen LPS-Injektionsmethoden klinisch relevanter: Sie simuliert die systemische Entzündungsreaktion, die durch die Translokation der Darmmikrobiota verursacht wird, was dem pathologischen Prozess der klinischen Sepsis näher kommt. Sie kann abgestuft und kontrolliert werden: Durch die Anpassung der Ligaturlänge und der Perforationsgröße kann die Schwere der Erkrankung kontrolliert werden, und sie eignet sich für die gesamte Untersuchung der Sepsis. Darüber hinaus kann es ähnliche dynamische Veränderungen der Multiorgandysfunktion und der Zytokinreaktion simulieren. Durch die Untersuchung der Rolle von Shikonin bei der Modulation des HIF-1α/VEGF-Signalwegs hoffen wir, Einblicke in neue therapeutische Strategien zu gewinnen, die die zugrunde liegenden Mechanismen der Sepsis-bedingten Lungenschädigung angehen und möglicherweise die klinischen Ergebnisse verbessern.
Protokoll
Das Protokoll erhielt die Genehmigung des Versuchstierzentrums der Wenzhou Medical University. In der aktuellen Studie wurden männliche C57Bl/6-Mäuse (5-6 Monate alt; 20-25 g) verwendet. Die Einzelheiten zu den wichtigsten Reagenzien und den verwendeten Geräten sind in der Materialtabelle aufgeführt.
1. Vorbereitung des Sepsis-Mausmodells
- Beherbergen Sie Mäuse bei einer konstanten Temperatur von 25 °C, 50 % Luftfeuchtigkeit und einem 12-stündigen Hell-Dunkel-Zyklus.
- Nach einer 7-tägigen Akklimatisierungsphase teilen Sie die Mäuse nach dem Zufallsprinzip in vier Gruppen ein: Scheingruppe, Modellgruppe, Niedrigdosis-Behandlungsgruppe und Hochdosis-Behandlungsgruppe mit 20 Mäusen in jeder Gruppe.
- Basierend auf Referenzen aus einer früheren Studie13 ist die niedrig dosierte Gruppe mit einer Konzentration von 12,5 mg/kg Purpurin für 14 Tage und die hochdosierte Gruppe mit einer Konzentration von 50 mg/kg für 14 Tage zu behandeln. Für die Scheinchirurgie-Gruppe führen Sie eine Laparotomie, Zäkaltraktion, -reduktion und -verschluss ohne Ligatur oder Punktion durch und behandeln Sie 14 Tage lang mit der gleichen Dosis physiologischer Kochsalzlösung. Die experimentellen Schritte für die Sepsis-Gruppe sind wie folgt.
- Nach dem Fasten über Nacht (Wasser war erlaubt) betäuben Sie die Mäuse während des gesamten Prozesses unter sterilen Bedingungen mit Natrium-Pentobarbital (40-80 mg/kg). Tragen Sie Tierarztsalbe auf die Augen auf, um Trockenheit unter Narkose zu verhindern.
- Überprüfen Sie die richtige Anästhesie, da die Atemfrequenz verlangsamt wird, die Muskelspannung abnimmt und keine offensichtliche Stressreaktion auftritt, wenn die unteren Gliedmaßen leicht mit einer hämostatischen Pinzette abgeklemmt werden.
- Desinfizieren Sie mit 75% Ethanol, 3x. Machen Sie einen Längsschnitt von etwa 1 cm in der mittleren linken Position des Mausbauchs und schneiden Sie die Haut, Faszien und Muskeln in Schichten auf, um die Bauchhöhle freizulegen.
- Erkunden Sie mit einer stumpfen Augenzange in beiden Händen vorsichtig die Bauchhöhle, lokalisieren und befreien Sie den Blinddarm der Maus und ligieren Sie ihn in einem Abstand von etwa 1 cm vom Ende des Blinddarms.
- Verwenden Sie eine 21-G-Nadel, um das Ende des Blinddarms zu punktieren und zu ligieren, drücken Sie vorsichtig eine kleine Menge Darminhalt mit einer stumpfen Augenzange aus der Einstichstelle heraus und holen Sie ihn dann in den Blinddarm zurück.
- Führen Sie eine subkutane Flüssigkeitsreanimation mit 1 ml 0,9%iger Natriumchloridlösung durch. Lassen Sie das Tier nicht unbeaufsichtigt, bis es wieder genügend Bewusstsein erlangt hat, um das Brustbein aufrecht zu erhalten. Wir weisen darauf hin, dass das Tier, das operiert wurde, erst dann wieder in die Gesellschaft anderer Tiere zurückkehrt, wenn es sich vollständig erholt hat.
- Verabreichen Sie nach 7 Tagen CLP-Modellierung eine übermäßige Anästhesie zur Euthanasie.
HINWEIS: Aufgrund der möglichen reizenden Wirkungen von Purpurin auf die Haut, die Atemwege und den Verdauungstrakt sowie seiner hohen Toxizität für Wasserorganismen und Umweltverschmutzung ist während des Experiments ein persönlicher Schutz zu verwenden.
2. Bewertung von Tiermodellen
- Beobachtung des Überlebens von Mäusen
- Führen Sie den Umgang mit den Tieren wie oben beschrieben durch. Erfassen Sie die Sterblichkeitsrate innerhalb von 1 Woche nach der Modellierung für die statistische Analyse. Einige Mäuse sterben ohne Sepsis vor der Euthanasie, während CLP-Modellmäuse eine gewisse Sterblichkeitsrate aufweisen (Tabelle 1).
- Messung des Nass-Trocken-Gewichtsverhältnisses der Lunge
- Nach 24 Stunden Modellierung betäuben Sie die Mäuse erneut gemäß den Schritten 1.4-1.5.
- Machen Sie einen Längsschnitt von ca. 1 cm auf der linken Seite der Schlüsselbeinmittellinie der Maus und entfernen Sie die Haut-, Faszien- und Muskelschichten, um die Brusthöhle mit einer chirurgischen Schere und Pinzette freizulegen.
- Entfernen Sie die linke Lunge und lassen Sie die Oberflächenflüssigkeit ab. Messen Sie das Nassgewicht und trocknen Sie es dann 72 h lang in einem 80 °C Ofen auf ein konstantes Gewicht, um das Trockengewicht zu erhalten.
- Berechnen Sie den Lungenwassergehalt als:
Lungenwassergehalt = (Nassgewicht - Trockengewicht) / Nassgewicht x 100%.
- Histopathologischer Vergleich von Lungengeweben
- Zu bestimmten Zeitpunkten die linke Lunge wie oben in Schritt 2.2 beschrieben entnehmen. Fixieren Sie die Lunge in 10 % neutralem Formaldehyd, betten Sie sie in Paraffin ein und schneiden Sie sie in einer Dicke von 5 μm.
- Entwachse die Lunge in Xylol, 2x, jedes Mal für 5-10 Minuten. Führen Sie eine serielle Ethanol-Rehydrierung mit 100 %, 95 %, 85 % und 75 % für 3 Minuten pro Gradient durch. In destilliertem Wasser 2 Min. einweichen.
- Färben Sie 10 Minuten lang mit ca. 100 ml Hämatoxylinlösung und spülen Sie es dann mit destilliertem Wasser ab, um schwimmende Farbe zu entfernen.
- Etwa 70 mL der Differenzierungslösung zugeben und 30 s einweichen. Dann 2x in Leitungswasser einweichen, jeweils für 3-5 Minuten.
- Fügen Sie ca. 100 ml Eosin-Farbstofflösung tropfenweise für 2 Minuten hinzu. Gießen Sie überschüssige Färbelösung aus und trocknen Sie schnell wie unten beschrieben.
- Führen Sie die Auslagerung, Transparenz und Versiegelung wie unten beschrieben durch.
- Die Proben werden in Gradienten-Ethanol eingeweicht: 75 %, 85 %, 95 % und 100 % Ethanol (I) für jeweils 2-3 s. 1 min in 100% Ethanol (II) einweichen und jeweils 2x 1 Minute in Xylol einweichen. Träufeln Sie mit einem Strohhalm oder einer Pipette neutralen Kaugummi auf die Oberfläche der Gewebescheiben und verteilen Sie ihn so gleichmäßig wie möglich, um die Bildung von Blasen zu vermeiden. Versiegeln und unter dem Mikroskop bei 400x betrachten.
- Wählen Sie 10 zufällige Felder pro Lungenabschnitt aus. Bitten Sie einen Pathologen, pathologische Veränderungen wie Alveolarödeme, Blutungen und Neutrophileninfiltration von 0 (normal) bis 4 (schwere Schädigung) zu bewerten. Verwenden Sie die Gesamtpunktzahl für die Auswertung.
- Western-Blotting
- Extrahieren Sie Kernproteine aus Lungengewebe gemäß den Anweisungen des Kernprotein-Extraktionskits und messen Sie die Proteinkonzentration mit der BCA-Methode gemäß den Anweisungen des Herstellers.
- Bereiten Sie proteinbeladene Proben mit 50 μg beladenem Protein pro Probe vor. Bereiten Sie das Trenngel (10%) und das Stapelgel (3%) SDS-PAGE vor. Führen Sie eine Elektrophorese bei 80 V für 45 min durch und übertragen Sie das Protein dann 60 Minuten lang bei 110 V auf die PVDF-Membran, nachdem die Proben in das Trenngel gelangt sind.
- Übertragen Sie die Proteine auf eine Membran und blockieren Sie sie für 60 Minuten. Inkubation mit Primärantikörpern (siehe Materialtabelle, 1:1000) über Nacht bei 4 °C, gefolgt von Sekundärantikörpern (siehe Materialtabelle, 1:1000) Inkubation bei 37 °C für 2 h.
- Waschen Sie die Membran mit TBST und verwenden Sie ECL zur Visualisierung. Geben Sie die vorbereiteten Reagenzien in einem dunklen Raum auf eine PVDF-Membran und führen Sie eine Schüttel- und Fluoreszenzbildgebung durch. ECL-Reagenzien interagieren mit Biomolekülen auf der Membran und erzeugen starke Chemilumineszenzreaktionen, die von Fluoreszenzbildgebungsinstrumenten aufgezeichnet werden.
- Analysieren Sie den Grauwert von Proteinbanden mit einem Bildanalysesystem, der Bandenquantifizierungsmethode (detaillierte Informationen zu dem System, das für die Analyse der Bandendichtemessung verwendet wird, finden Sie unter NIH-Bild).
- Statistische Analyse
- Verwenden Sie SPSS 26.0 für statistische Analysen. Verwenden Sie die unidirektionale ANOVA, um die Mittelwerte mehrerer Gruppen zu vergleichen, und LSD-t-Tests für paarweise Vergleiche. Betrachten Sie einen p-Wert < 0,05 als statistisch signifikant.
Ergebnisse
Um das therapeutische Potenzial von Shikonin zu bewerten, untersuchten wir zunächst seine Wirkung auf das Überleben bei septischen Mäusen über einen Zeitraum von 7 Tagen. Die Behandlung mit Shikonin verbesserte die Überlebensraten dosisabhängig (Abbildung 1).
Angesichts des weit verbreiteten Auftretens von Lungenschäden bei Sepsis untersuchten wir auch Lungenödeme bei Mäusen. Das Lungenödem wurde durch Messung des Verhältnisses von Nass- zu Trockengewicht (W/D) der Lunge bewertet. Das W/D-Verhältnis war in der Modellgruppe im Vergleich zur Scheingruppe signifikant erhöht (p < 0,05). Die Behandlung mit Shikonin milderte diesen Effekt dosisabhängig ab. Die Hochdosisgruppe zeigte eine deutlichere Verringerung des Lungenödems als die Niedrigdosisgruppe (p < 0,05) (Abbildung 2).
Um die schützende Wirkung von Shikonin auf das Lungengewebe weiter zu validieren, wurde eine histopathologische Analyse durchgeführt. Die Scheingruppe zeigte eine normale Lungenstruktur, während die CLP-Modellgruppe deutliche Gewebeschäden aufwies, einschließlich ausgedehnter Ödeme, Blutungen und infiltrierender Zellinfiltration. In Übereinstimmung mit dem reduzierten W/D-Verhältnis linderte die Shikonin-Behandlung diese pathologischen Veränderungen dosisabhängig. Mäuse in der Hochdosisgruppe wiesen im Vergleich zur CLP-Modellgruppe signifikant weniger histopathologische Anomalien auf, und ihre pathologischen Werte waren deutlich niedriger als die in der Niedrigdosisgruppe (p < 0,05; Abbildung 3).
Da sowohl Entzündungen als auch Hypoxie Haupttreiber für Sepsis-induzierte Lungenschäden sind, untersuchten wir als nächstes die Expressionsniveaus von Schlüsselproteinen, die an diesen Signalwegen beteiligt sind. Die Western-Blot-Analyse zeigte, dass die CLP-Modellgruppe signifikant erhöhte Spiegel von TNF-αand, IL-6 und VEGF aufwies, was auf eine Entzündungsreaktion hindeutet (Abbildung 4). Zusätzlich wurden HIF-1α und VEGF in der Modellgruppe stark exprimiert, was die erhöhte Hypoxie bestätigt (Abbildung 5). Die Behandlung mit Shikonin reduzierte die Expression dieser Proteine dosisabhängig signifikant, wobei die Hochdosisgruppe eine stärkere Suppression von HIF-1α, VEGF, TNF-α und IL-6 im Vergleich zur Niedrigdosisgruppe zeigte (p < 0,05; Abbildung 4 und Abbildung 5). Diese molekularen Befunde unterstützen die schützende Rolle von Shikonin und unterstreichen seine Fähigkeit, sowohl Hypoxie als auch Entzündungen bei septischen Mäusen zu modulieren.
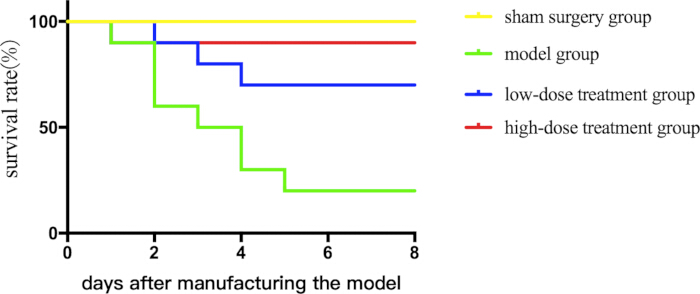
Abbildung 1: Vergleich der Überlebensraten zwischen verschiedenen Gruppen septischer Mäuse. Die Mäuse wurden gruppiert und zusammen mit einer medikamentösen Behandlung einer CLP-Behandlung unterzogen, und es wurden Überlebenskurven erstellt, um ihren Überlebensstatus aufzuzeichnen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
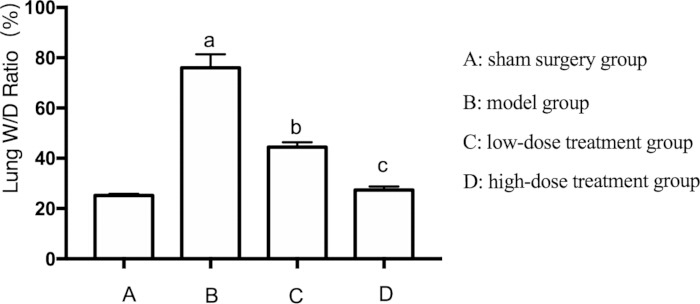
Abbildung 2: Auswirkungen von Shikonin auf das W/D-Verhältnis der Lunge bei septischen Mäusen. Die Mäuse wurden gruppiert und 24 Stunden lang einer CLP-Behandlung zusammen mit einer medikamentösen Behandlung unterzogen, wonach das W/D-Verhältnis der Lunge aufgezeichnet wurde. AP < 0,05 im Vergleich zur Scheingruppe, BP < 0,05 im Vergleich zur Sepsis-Gruppe und CP < 0,05 im Vergleich zur Niedrigdosis-Behandlungsgruppe. Die Fehlerbalken zeigen die Standardabweichung, die unidirektionale ANOVA wurde verwendet, um die Mittelwerte mehrerer Gruppen zu vergleichen, und der LSD-t-Test wurde für den paarweisen Vergleich verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
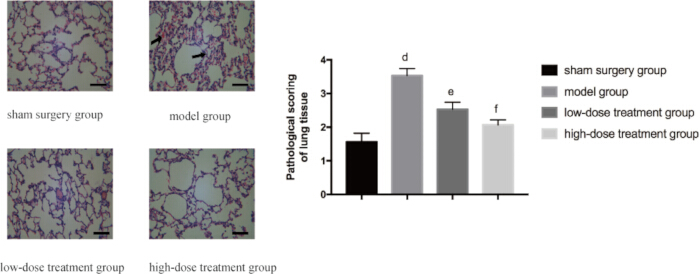
Abbildung 3: Mikroskopische Veränderungen in der Pathologie des Lungengewebes in verschiedenen Gruppen. Die Mäuse wurden in Gruppen eingeteilt und 24 Stunden lang einer CLP-Behandlung mit medikamentöser Behandlung unterzogen. Anschließend wurde Lungengewebe für die HE-Färbung entnommen. Im linken Bereich werden repräsentative Bilder mit 400-facher Vergrößerung (Maßstabsleiste = 100 μm) angezeigt. Ausgedehnte Ödeme, Blutungen und infiltrierende Zellen sind in der Modellgruppe zu sehen, wie durch den Pfeil angedeutet. Das rechte Feld zeigt die entsprechenden histopathologischen Scores. Im Vergleich zur Scheingruppe war der Unterschied signifikant (p 0,05). Die Fehlerbalken zeigen die Standardabweichung, die unidirektionale ANOVA wurde verwendet, um die Mittelwerte mehrerer Gruppen zu vergleichen, und der LSD-t-Test wurde für den paarweisen Vergleich verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
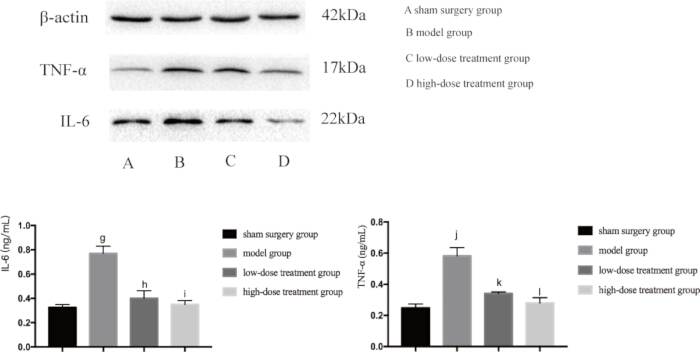
Abbildung 4: Proteinexpressionsniveaus von TNF-α und IL-6 im Lungengewebe von Mäusen. Die Mäuse wurden in Gruppen eingeteilt und 24 Stunden lang einer CLP-Behandlung unterzogen, wonach die Expression der angegebenen Proteine im Lungengewebe nachgewiesen wurde. Im Vergleich zur Scheingruppe war die Expression von TNF-α in der Modellgruppe signifikant erhöht (gp < 0,05). Im Vergleich zur Modellgruppe war die Expression von TNF-α in der niedrig dosierten Behandlungsgruppe signifikant verringert (hp < 0,05). Im Vergleich zur niedrig dosierten Behandlungsgruppe nahm die Expression von TNF-α in der hochdosierten Behandlungsgruppe ab, aber der Unterschied war statistisch nicht signifikant (ip > 0,05). Darüber hinaus stieg die Expression von IL-6 in der Modellgruppe im Vergleich zur Scheingruppe signifikant an (jp < 0,05). Im Vergleich zur Modellgruppe war die Expression von IL-6 in der niedrig dosierten Behandlungsgruppe signifikant verringert (kp < 0,05). Im Vergleich zur niedrig dosierten Behandlungsgruppe nahm die Expression von IL-6 in der hochdosierten Behandlungsgruppe ab, aber der Unterschied war statistisch nicht signifikant (lp > 0,05). Die Fehlerbalken zeigen die Standardabweichung, die unidirektionale ANOVA wurde verwendet, um die Mittelwerte mehrerer Gruppen zu vergleichen, und der LSD-t-Test wurde für den paarweisen Vergleich verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
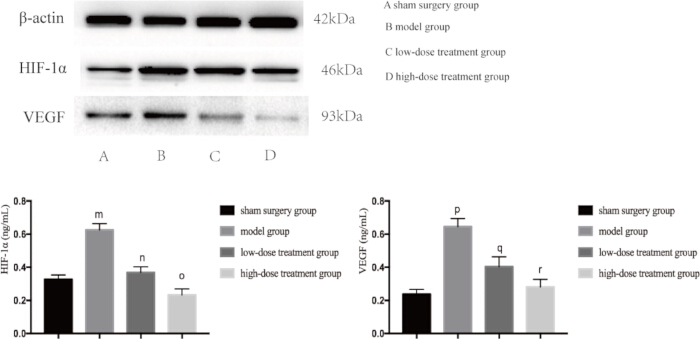
Abbildung 5: Proteinexpressionsniveaus von HIF-1α und VEGF im Lungengewebe von Mäusen. Die Mäuse wurden in Gruppen eingeteilt und 24 Stunden lang einer CLP-Behandlung unterzogen, wonach die Expression der angegebenen Proteine im Lungengewebe nachgewiesen wurde. Im Vergleich zur Scheingruppe war die Expression von HIF-1α in der Modellgruppe signifikant erhöht (mp < 0,05). Im Vergleich zur Modellgruppe war die Expression von HIF-1α in der niedrig dosierten Behandlungsgruppe signifikant verringert (np < 0,05). Im Vergleich zur niedrig dosierten Behandlungsgruppe nahm die Expression von HIF-1α in der hochdosierten Behandlungsgruppe ab, aber der Unterschied war statistisch nicht signifikant (op > 0,05). Darüber hinaus war die Expression von VEGF in der Modellgruppe im Vergleich zur Scheingruppe signifikant erhöht (pp < 0,05). Im Vergleich zur Modellgruppe war die Expression von VEGF in der niedrig dosierten Behandlungsgruppe signifikant verringert (qp < 0,05). Im Vergleich zur niedrig dosierten Behandlungsgruppe nahm die Expression von VEGF in der hochdosierten Behandlungsgruppe ab, aber der Unterschied war statistisch nicht signifikant (rp> 0,05). Die Fehlerbalken zeigen die Standardabweichung, die unidirektionale ANOVA wurde verwendet, um die Mittelwerte mehrerer Gruppen zu vergleichen, und der LSD-t-Test wurde für den paarweisen Vergleich verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Tage | Schein-Gruppe | Modellgruppe | Niedrig dosierte Behandlungsgruppe | Hochdosis-Behandlungsgruppe |
| 0 | 20 | 20 | 20 | 20 |
| 1 | 20 | 20 | 20 | 20 |
| 2 | 20 | 18 | 20 | 18 |
| 3 | 20 | 12 | 18 | 18 |
| 4 | 20 | 10 | 16 | 18 |
| 5 | 20 | 6 | 14 | 18 |
| 6 | 20 | 4 | 14 | 18 |
| 7 | 20 | 4 | 14 | 18 |
Tabelle 1: Überlebensrate von Mäusen.
Diskussion
Als Goldstandardmodell für die Sepsisforschung ist das CLP-Modell ein wichtiger Schritt in diesem Experiment, da CLP die Komplexität der menschlichen Sepsis besser nachahmt als viele andere Modelle. Die Sepsis-assoziierte ALI bleibt aufgrund ihrer hohen Mortalitätsraten und der begrenzten Wirksamkeit der derzeitigen Behandlungen eine kritische klinische Herausforderung14,15. Unsere Studie zeigt zum ersten Mal, dass Shikonin das Überleben bei septischen Mäusen signifikant verbessert, indem es sowohl HIF-1α als auch Entzündungsreaktionen moduliert, indem es ein CLP-Modell erstellt.
Die CLP-induzierte Mortalität hängt von mehreren technischen Parametern ab, wie z. B. der Nadelgröße, der Länge des ligierten Blinddarms und der Anzahl der Blinddarmpunktionen. Wenn die Nadel zu dünn ist oder die Anzahl der Nadeln nicht ausreicht, verursacht sie keine systemische Sepsisreaktion. Wenn die Nadel zu dick ist oder die Nadel zu oft verwendet wird, sind Mäuse anfällig für den Tod und können mit dem nächsten Experiment nicht fortfahren. Daher sind wir durch wiederholte technische Modifikationen und Fehlerbehebungen zu dem Schluss gekommen, dass wir die Ligatur in einem Abstand von ca. 1 cm vom Ende des Blindfußes durchgeführt haben. Wir verwendeten eine 21G-Nadel, um das Ende des Blinddarms zu punktieren und zu ligieren, und drückten vorsichtig eine kleine Menge Darminhalt mit einer stumpfen Pinzette aus der Einstichstelle heraus, bevor wir ihn wieder in den Blinddarm einführten. Beobachten Sie während der 6-stündigen postoperativen Phase der CLP-Erkrankung, ob die Mäuse Symptome einer Sepsis wie Lethargie, langsame Bewegungen, aufrechtes Haar, Augensekrete und Durchfall aufweisen. Die Beobachtungen deuten auf einen dosisabhängigen Überlebensvorteil hin, der in der hochdosierten Shikonin-Gruppe beobachtet wurde, was mit früheren Forschungen zum therapeutischen Potenzial der TCM bei der Sepsis-Behandlung übereinstimmt16. Shikonin ist sehr wahrscheinlich eine wertvolle Ergänzung oder Alternative zu den derzeitigen Therapien für Sepsis-induzierte ALI 5,17.
Wie bereits erwähnt, kann dieses Modell eine reale Simulationsplattform für den pathologischen Mechanismus der Sepsis18 bieten. Weil es Schlüsselmerkmale der menschlichen Sepsis simulieren kann, darunter multiple bakterielle Infektionen, dynamische Immunreaktionen, Funktionsstörungen mehrerer Organe und mehr. Darüber hinaus kann das CLP-Modell die Validierung und Verbesserung bestehender Behandlungsmethoden optimieren, wie z. B. die Überprüfung der Wirksamkeit von Antibiotika, Immunmodulatoren und adjuvanten Therapien (wie Vitamin C und Hydrocortison), was zur Optimierung der Dosierung und des Zeitpunkts der Verabreichung beiträgt. Das Modell ist auch von großer Bedeutung für die Aufdeckung der biologischen Grundlagen bestehender klinischer Herausforderungen, Antibiotikaresistenzprobleme, die Standardisierung der klinischen translationalen Forschung, künstliche Intelligenz, Big-Data-Analyse und andere Aspekte.
Zu den zukünftigen Anwendungen dieser Technologie gehören folgende Aspekte. Erstens, die Erforschung und Entwicklung neuer Medikamente und die Validierung von Behandlungsstrategien, wie z. B. die Entwicklung von Histontherapien in der Zukunft. Zweitens eine eingehende Analyse der Immunmechanismen und Wirtsreaktionen, wie z. B. die Unterstützung bei der Entwicklung immunmodulatorischer Therapien, wie z. B. die Anwendung von PD-1/PD-L1-Signalweg-Inhibitoren19. Drittens kann die Integration von Multi-Omics und künstlicher Intelligenz, wie z. B. die Kombination von Daten, die von CLP-Modellen generiert werden, genutzt werden, um durch maschinelles Lernen in Zukunft Vorhersagemodelle für Sepsis zu konstruieren. Viertens, Erforschung des Mikrobioms und der Infektionskontrolle. In Zukunft kann dieses Modell verwendet werden, um die Machbarkeit neuartiger Anti-Infektionsstrategien wie die fäkale Mikrobiota-Transplantation und die Phagentherapie zu untersuchen.
Obwohl das CLP-Modell eine gut etablierte Methode zur Induktion von Sepsis ist, kann es die Komplexität der menschlichen Sepsis nicht vollständig replizieren, was die Verallgemeinerbarkeit unserer Ergebnisse einschränkt. Zukünftige Studien sollten größere Stichprobengrößen einbeziehen und die Auswirkungen von Shikonin in verschiedenen Sepsismodellen untersuchen, um diese Ergebnisse zu validieren. Darüber hinaus wird eine tiefere Erforschung der beteiligten molekularen Mechanismen, einschließlich möglicher Wechselwirkungen mit anderen Signalwegen, entscheidend sein, um das volle therapeutische Potenzial von Shikonin zu verstehen.
Zusammenfassend lässt sich sagen, dass unsere Studie Shikonin als vielversprechenden Kandidaten für die Behandlung von Sepsis-induzierter ALI durch ein CLP-Mausmodell identifiziert. Indem es sowohl auf hypoxische als auch auf Entzündungswege abzielt, hat Shikonin das Potenzial, die klinischen Ergebnisse für Sepsis-Patienten zu verbessern. Diese Arbeit liefert nicht nur neue Einblicke in die Mechanismen der Sepsis-bedingten Lungenschädigung, sondern unterstreicht auch die potenzielle Rolle der traditionellen chinesischen Medizin in modernen Therapiestrategien.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden Interessen haben.
Danksagungen
Die Studie wurde vom Wenzhou Science and Technology Project (Y2020976) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| H&E stain kit staining kit | Solaibao Technology | G1120HE | |
| Low-temperature centrifuge | Sigma | 3K15 | |
| Microplate Reader | Bio-Rad | Model 680 | |
| rabbit monoclonal VEGF-receptor1 antibody | Abcam | ab238632 | |
| rabbit polyclonal HIF-1α antibody | Abcam | ab51608 | |
| SDS-PAGE electrophoresis system | Bio-Rad | MINI Protean2 | |
| Shikonin | MedChemExpress | HY-N0822 |
Referenzen
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten