Method Article
敗血症による急性肺損傷マウスにおけるHIF-1α/VEGFシグナル伝達経路に対するシコニンの影響
要約
このプロトコルは、マウスの敗血症による急性肺損傷の緩和におけるシコニンの有効性を評価することを目的としています。HIF-1α/VEGF経路を標的とすることにより、この研究では、さまざまな用量のシコニンが生存率、肺の病理、および炎症マーカーの発現にどのように影響するかを調査し、その潜在的な治療上の利点を強調しています。
要約
敗血症は、死亡率の高い合併症である急性肺損傷(ALI)を引き起こすことがよくあります。HIF-1α/VEGF経路は敗血症において重要な役割を果たしており、抗炎症作用を持つ天然化合物であるシコニンは、この経路を標的とすることで肺の損傷を緩和する可能性があります。Balb/cマウスは、偽群、モデル群、低用量治療群、高用量治療群の4つのグループにランダムに分けられました。偽グループは盲腸結紮穿刺(CLP)を伴わない開腹術を受け、モデルグループは敗血症関連の急性肺損傷を誘発するためにCLPを受けました。モデリング後、低用量および高用量の治療群は、それぞれ12.5 mg / kgおよび50 mg / kgの用量で1日1回14日間強制経口投与されました。マウスの7日間生存率をモニターした。ヘマトキシリンとエオシン(HE)染色を使用して肺組織の病理を評価し、肺のウェット/ドライ(W / D)重量比を測定し、ウェスタンブロットを実施して、肺組織におけるHIF-1α、VEGF、TNF-α、およびIL-6の発現を検出しました。シコニンは敗血症性マウスの生存率を有意に改善し、高用量群で最大の効果が観察されました(p < 0.05)。モデル群と比較して、シコニン治療群の肺W/D比と組織損傷は、用量依存的に有意に減少した。さらに、シコニンはHIF-1α、VEGF、TNF-α、およびIL-6の発現を有意に低下させ、高用量群で最も顕著な減少を示しました(p < 0.05)。シコニンは、HIF-1αの発現を阻害し、関連する炎症因子の産生を減少させることにより、敗血症性マウスの急性肺損傷を緩和する可能性がある。
概要
敗血症は、感染によって引き起こされる重度の全身性炎症反応です。1 それはしばしば多臓器機能障害を引き起こし、状態が進行するにつれて生命を脅かす可能性があります。2 人工呼吸器や支持療法などの治療法を使用しているにもかかわらず、敗血症関連ALIの死亡率は依然として高く、30%〜40%に達しています3。これらの治療法は、根本的な原因ではなく主に症状に対処するため、全体的な効果は限られています。したがって、肺損傷の原因を標的とする新しい治療アプローチを特定することで、敗血症の患者の転帰を大幅に改善できる可能性があります。
最近の研究では、敗血症誘発性ALIの進行における重要な調節因子として、低酸素誘導性因子-1α(HIF-1α)が特定されています4,5。HIF-1αは敗血症時に肺組織に蓄積し、炎症や組織損傷を悪化させる下流の遺伝子の発現を促進します6。このプロセスは、肺損傷の悪化に大きく寄与します。したがって、HIF-1αシグナル伝達経路を標的とすることは、敗血症誘発性ALIに見られる炎症反応および低酸素反応を緩和するための有望なアプローチを提供します。
より効果的な治療法を模索する中で、伝統的な中国医学(TCM)は貴重な洞察を提供してきました7,8。シコニンは、Lithospermum erythrorhizon7から抽出されたアントラキノン化合物です。顕著な抗炎症作用9、抗菌作用10、抗腫瘍作用11を示します。シコニンは、リポ多糖(LPS)によって引き起こされる肺の損傷を緩和することができ、肺の状態におけるその潜在的な治療的役割を示唆しています12。同時に、いくつかの研究では、シコニンが単核マクロファージシステムを調節し、炎症誘発性反応と抗炎症反応のバランスをとることにより、敗血症によって引き起こされる酸化的損傷を緩和する可能性があることも提案されています。しかし、敗血症誘発性ALIにおけるシコニンの保護効果の背後にあるメカニズムは完全には理解されていません。これは、現在の研究における重大なギャップを表しています。
本研究では、盲腸結穿刺穿刺(CLP)を用いた敗血症誘発性ALIのマウスモデルにおけるシコニンの保護効果の検討を目指します。CLP技術は、複雑な全身性炎症反応や多臓器機能障害をシミュレートできるため、敗血症研究において重要な役割を果たしており、新しい治療戦略の有効性を評価するのに適しています。CLP技術は、従来のLPS注射法と比較して比較的臨床的に関連性が高く、腸内細菌叢の転座によって引き起こされる全身性炎症反応をシミュレートし、臨床敗血症の病理学的プロセスに近いものです。結紮の長さと穿孔サイズを調整することで、疾患の重症度を制御することができ、敗血症の研究全体に適しています。さらに、多臓器機能障害とサイトカイン応答における同様の動的変化をシミュレートできます。HIF-1α/VEGFシグナル伝達経路の調節におけるシコニンの役割を調査することにより、敗血症関連肺損傷の根本的なメカニズムに対処する新しい治療戦略への洞察を提供し、臨床転帰を改善する可能性を秘めています。
プロトコル
このプロトコルは、温州医科大学実験動物センターから承認を得ました。本研究では、雄のC57Bl/6マウス(生後5-6ヶ月;20-25g)を用いた。主な試薬や使用した機器の詳細は、 材料表に記載されています。
1. 敗血症マウスモデル作製
- 25°Cの一定温度、50%の湿度、および12時間の明暗サイクル下でのハツカネズミ。
- 7日間の順応期間の後、マウスを偽群、モデル群、低用量治療群、高用量治療群の4つのグループにランダムに分け、各グループに20匹のマウスを配置します。
- 以前の研究13 からの参照に基づいて、低用量群を 12.5 mg/kg のプルプリン濃度で 14 日間治療し、高用量群を 50 mg/kg の濃度で 14 日間治療します。偽手術群では、結紮や穿刺を伴わずに開腹術、盲腸牽引、整復、閉鎖を行い、同用量の生理食塩水で14日間治療します。敗血症群の実験手順は以下の通りです。
- 一晩絶食した後(水が許可されました)、プロセス全体を通して無菌条件下でペントバルビタールナトリウム(40-80 mg / kg)でマウスに麻酔をかけます。.麻酔下での乾燥を防ぐために、目に獣医軟膏を塗ります。
- 止血鉗子で下肢を軽く締めると、呼吸数が遅くなり、筋肉の緊張が減少し、明らかなストレス反応が見られないため、適切な麻酔がかかることを確認してください。
- 75%エタノール、3xで消毒を行います。マウス腹部の中央左位置に縦1cm程度の切開を行い、皮膚、筋膜、筋肉を層状に切り開いて腹腔を露出させます。
- 先端が鈍い眼科用鉗子を両手で使用して、腹腔内を静かに探索し、マウスの盲腸を見つけて解放し、盲腸の端から約1cmの距離で結紮します。
- 21Gの針を使用して盲腸の端を穿刺して結紮し、先端が鈍い眼科用鉗子を使用して穿刺部位から少量の腸の内容物を静かに絞り出し、それを盲腸に回収します。
- 1mLの0.9%塩化ナトリウム溶液で皮下液蘇生を行います。動物が胸骨の横臥を維持するのに十分な意識を取り戻すまで、動物を放置しないでください。手術を受けた動物は、完全に回復するまで他の動物の会社に戻されないことに注意してください。
- CLPモデリングの7日後、安楽死のために過度の麻酔を投与します。
注:皮膚、気道、消化管に対するプルプリンの刺激作用の可能性があり、水生生物に対する高い毒性、環境汚染のため、実験中は個人用保護具を使用してください。
2. 動物モデルの評価
- マウス生存観察
- 上記のように動物の取り扱いを行います。モデリング後1週間以内の死亡率を記録し、統計解析に活用します。一部のマウスは安楽死前に敗血症なしで死亡しますが、CLPモデルマウスは一定の死亡率を持っています(表1)。
- 肺の湿式対乾燥重量比の測定
- モデリングの24時間後、ステップ1.4-1.5に従ってマウスを再度麻酔します。
- マウスの鎖骨正中線の左側に縦方向に約1cmの切開を行い、手術用ハサミや鉗子などで皮膚、筋膜、筋肉層を切除して胸腔を露出させます。
- 左肺を切除し、表面の液体を排出します。湿重量を測定し、80°Cのオーブンで72時間一定の重量まで乾燥させて乾燥重量を求めます。
- 肺水分量を次のように計算します。
肺水分量=(湿重量-乾燥重量)/湿重量x100%。
- 肺組織の病理組織学的比較
- 指定された時点で、上記のステップ2.2で説明したように左肺を採取します。肺を10%中性ホルムアルデヒドで固定し、パラフィンに埋め込んで、厚さ5μmで切片化します。
- キシレンで肺を2回、毎回5〜10分間脱ろうします。100%、95%、85%、および75%で、グラジエントごとに3分間、一連のエタノール再水和を行います。蒸留水に2分間浸します。
- 約100mLのヘマトキシリン溶液で10分間染色し、蒸留水ですすいで浮遊色を取り除きます。
- 分化液を約70mL加え、30秒間浸漬します。次に、水道水に2回、毎回3〜5分間浸します。
- 約100 mLのエオシン色素溶液を滴下して2分間加えます。余分な色素溶液を注ぎ、以下に説明するように迅速に脱水します。
- 脱水、透明化、密封を下記の通り行ってください。
- グラジエントエタノールにサンプルを浸します:75%、85%、95%、および100%エタノール(I)をそれぞれ2〜3秒間。100%エタノール(II)に1分間浸漬し、キシレンに2回1分間ずつ浸します。ストローまたはスポイトを使用して、ティッシュスライスの表面に中性ガムを滴下し、気泡の形成を避けるためにできるだけ均等に広げます。400倍の顕微鏡で密封し、観察します。
- 肺切片ごとに 10 個のランダム フィールドを選択します。病理医に依頼して、肺胞浮腫、出血、好中球浸潤などの病理学的変化を0(正常)から4(重度の損傷)にスコアリングしてもらいます。合計スコアを使用して評価します。
- ウェスタンブロッティング
- 核タンパク質抽出キットの指示に従って肺組織から核タンパク質を抽出し、製造元の指示に従ってBCA法を使用してタンパク質濃度を測定します。
- サンプルあたり50 μgのタンパク質をロードして、タンパク質ローディングサンプルを調製します。SDS-PAGE分離ゲル(10%)とスタッキングゲル(3%)を調製します。80 V で 45 分間電気泳動を行い、サンプルが分離ゲルに入った後、タンパク質を 110 V で 60 分間 PVDF メンブレンに移します。
- タンパク質をメンブレンに移し、60分間ブロックします。一次抗体( 材料表、1:1000参照)と4°Cで一晩インキュベートし、続いて二次抗体( 材料表1 :1000参照)と37°Cで2時間インキュベートします。
- TBSTでメンブレンを洗浄し、ECLを使用して視覚化します。暗室で、調製した試薬をPVDFメンブレンに添加し、振とうおよび蛍光イメージングを行います。ECL試薬は、メンブレン上の生体分子と相互作用して強力な化学発光反応を引き起こし、蛍光イメージング装置によって記録されます。
- 画像解析システムであるBand Quantification Methodを使用して、タンパク質バンドのグレースケール値を解析します(バンドデンシトメトリーの解析に使用されるシステムの詳細については、NIH画像を参照してください)。
- 統計分析
- 統計分析にはSPSS 26.0を使用します。一元配置分散分析(ANOVA)を使用して複数のグループの平均を比較し、LSD-t検定を使用してペアワイズ比較を行います。0.05 < p 値を統計的に有意であると考えます。
結果
シコニンの治療可能性を評価するために、まず、敗血症性マウスの生存に対するシコニンの効果を7日間にわたって評価しました。シコニンによる治療は、用量依存的に生存率を改善しました(図1)。
敗血症における肺損傷の広範な発生を考慮して、マウスの肺水腫も評価しました。肺水腫は、肺の湿潤重量と乾燥重量(W / D)の比率を測定することによって評価されました。モデル群のW/D比は、偽群と比較して有意に上昇しました(p < 0.05)。シコニン治療は、用量依存的にこの影響を軽減しました。.高用量群は、低用量群よりも肺水腫の大幅な減少を示しました(p < 0.05)(図2)。
肺組織に対するシコニンの保護効果をさらに検証するために、病理組織学的分析が行われました。偽のグループは正常な肺の構造を示しましたが、CLPモデルグループは、広範な浮腫、出血、炎症性細胞浸潤などの顕著な組織損傷を示しました。W/D比の低下と一致して、シコニン治療はこれらの病理学的変化を用量依存的に緩和しました。.高用量群のマウスは、CLPモデル群と比較して組織病理学的異常が有意に少なく、その病理スコアは低用量群のマウスよりも著しく低かった(p < 0.05; 図3)。
炎症と低酸素症の両方が敗血症誘発性肺損傷の主要な要因であるため、次に、これらの経路に関与する主要なタンパク質の発現レベルを調べました。ウェスタンブロット解析により、CLPモデル群ではTNF-αand、IL-6、およびVEGFのレベルが有意に上昇しており、炎症反応を示していることが明らかになりました(図4)。また、モデル群ではHIF-1αとVEGFが高発現しており、低酸素症の増加が確認されました(図5)。シコニン治療は、これらのタンパク質の発現を用量依存的に有意に減少させ、高用量群は低用量群と比較してHIF-1α、VEGF、TNF-α、およびIL-6の抑制が大きかった(p < 0.05; 図 4 と 図 5)。これらの分子的知見は、シコニンの保護的役割をさらに支持し、敗血症性マウスにおけるシコニンが低酸素症と炎症の両方を調節する能力を強調しています。
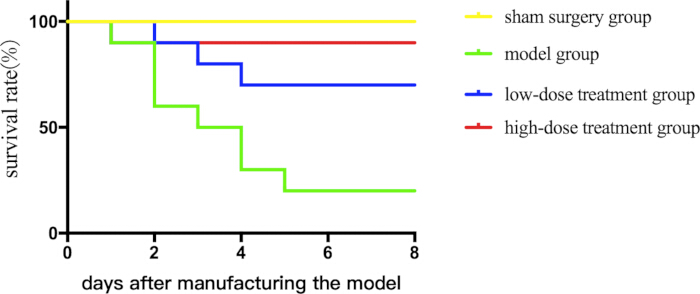
図1:敗血症性マウスの異なるグループ間の生存率の比較。 マウスをグループ化し、薬物治療とともにCLPを投与し、生存曲線をプロットして生存状態を記録しました。 この図の拡大版を表示するには、ここをクリックしてください。
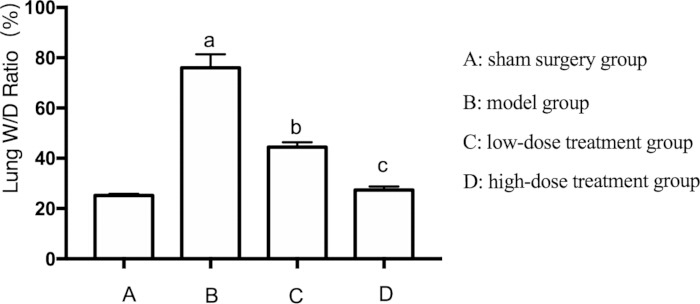
図2:敗血症性マウスの肺W/D比に対するシコニンの影響。 マウスをグループ化し、CLPと薬物治療を24時間行った後、肺のW / D比を記録しました。 AP < SHAM群と比較して0.05、 BP <敗血症群と比較して0.05、 CP <低用量治療群と比較して0.05でした。エラーバーは標準偏差を示し、一元配置ANOVAは複数のグループの平均値を比較するために使用され、LSD-t検定はペアワイズ比較に使用されました。 この図の拡大版を表示するには、ここをクリックしてください。
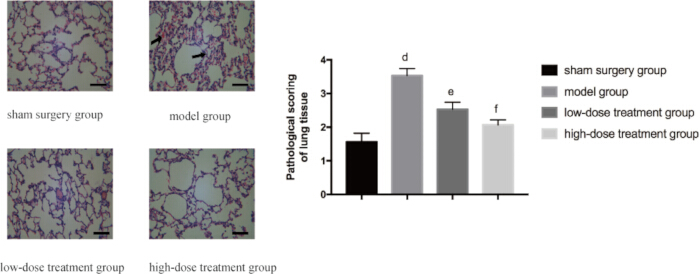
図3:グループ間の肺組織病理学の微視的変化。 マウスをグループ化し、CLPに24時間薬物治療を加えました。その後、HE染色のために肺組織を採取しました。左パネルには、400倍の倍率(スケールバー=100μm)で代表的な画像が表示されます。矢印で示されているように、広範囲にわたる浮腫、出血、および炎症性細胞の浸潤がモデルグループで見られます。右側のパネルには、対応する病理組織学的スコアが表示されます。偽群と比較して、差は有意であった(p 0.05)。エラーバーは標準偏差を示し、一元配置ANOVAは複数のグループの平均値を比較するために使用され、LSD-t検定はペアワイズ比較に使用されました。 この図の拡大版を表示するには、ここをクリックしてください。
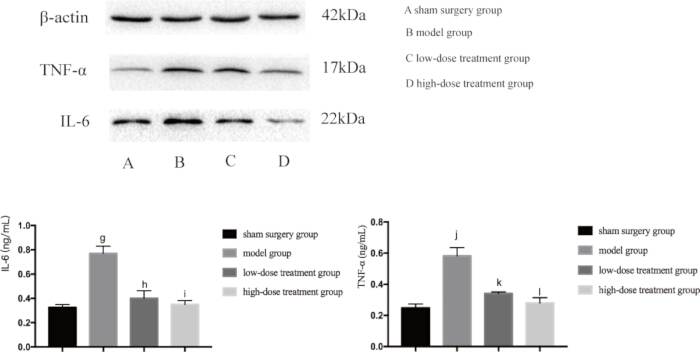
図4:マウスの肺組織におけるTNF-αおよびIL-6のタンパク質発現レベル。 マウスをグループ化し、CLPと薬物治療を24時間行った後、示されたタンパク質の発現が肺組織で検出されました。偽群と比較して、モデル群でのTNF-αの発現は有意に増加しました(gp < 0.05)。モデル群と比較して、低用量治療群におけるTNF-αの発現は有意に減少しました(hp < 0.05)。低用量投与群と比較して、高用量投与群のTNF-αの発現は減少したが、その差は統計的に有意ではなかった(ip > 0.05)。また、シャム群と比較して、モデル群におけるIL-6の発現は有意に増加しました(jp < 0.05)。モデル群と比較して、低用量治療群におけるIL-6の発現は有意に減少しました(kp < 0.05)。低用量投与群と比較して、高用量投与群のIL-6の発現は減少しましたが、その差は統計的に有意ではありませんでした(lp > 0.05)。エラーバーは標準偏差を示し、一元配置ANOVAは複数のグループの平均値を比較するために使用され、LSD-t検定はペアワイズ比較に使用されました。 この図の拡大版を表示するには、ここをクリックしてください。
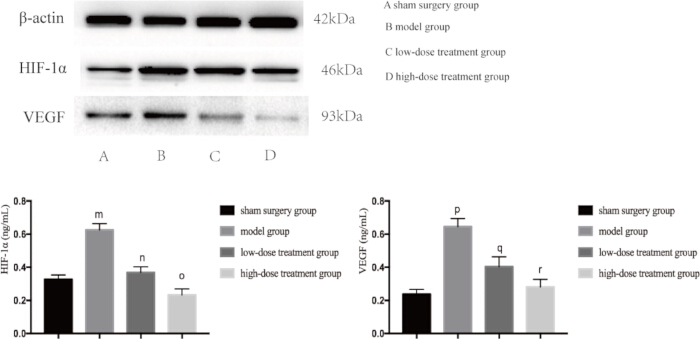
図5:マウスの肺組織におけるHIF-1αおよびVEGFのタンパク質発現レベル。 マウスをグループ化し、CLPと薬物治療を24時間行った後、示されたタンパク質の発現が肺組織で検出されました。偽群と比較して、モデル群におけるHIF-1αの発現は有意に増加しました(mp< 0.05)。モデル群と比較して、低用量治療群におけるHIF-1αの発現は有意に減少しました(np < 0.05)。低用量投与群と比較して、高用量投与群におけるHIF-1αの発現は減少したが、その差は統計的に有意ではなかった(op > 0.05)。また、シャム群と比較して、モデル群におけるVEGFの発現は有意に増加した(pp < 0.05)。モデル群と比較して、低用量治療群におけるVEGFの発現は有意に減少しました(qp < 0.05)。低用量投与群と比較して、高用量投与群におけるVEGFの発現は減少したが、その差は統計学的に有意ではなかった(rp > 0.05)。エラーバーは標準偏差を示し、一元配置ANOVAは複数のグループの平均値を比較するために使用され、LSD-t検定はペアワイズ比較に使用されました。 この図の拡大版を表示するには、ここをクリックしてください。
| 日 | シャムグループ | モデルグループ | 低用量治療群 | 高用量治療群 |
| 0 | 20 | 20 | 20 | 20 |
| 1 | 20 | 20 | 20 | 20 |
| 2 | 20 | 18 | 20 | 18 |
| 3 | 20 | 12 | 18 | 18 |
| 4 | 20 | 10 | 16 | 18 |
| 5 | 20 | 6 | 14 | 18 |
| 6 | 20 | 4 | 14 | 18 |
| 7 | 20 | 4 | 14 | 18 |
表1:マウスの生存率。
ディスカッション
敗血症研究のゴールドスタンダードモデルであるCLPモデルは、CLPが他の多くのモデルよりもヒト敗血症の複雑さをよりよく模倣しているため、この実験の重要なステップです。敗血症関連ALIは、その高い死亡率と現在の治療法の有効性が限られているため、依然として重要な臨床的課題です14,15。私たちの研究は、シコニンがCLPモデルを作成することによりHIF-1αと炎症反応の両方を調節することにより、敗血症性マウスの生存率を大幅に改善することを初めて示しています。
CLPによる死亡率は、針のサイズ、結紮された盲腸の長さ、盲腸穿刺の数など、いくつかの技術的パラメータに依存します。針が細すぎたり、針の数が足りなかったりしても、全身性敗血症反応は起こりません。針が太すぎたり、針の使用回数が多すぎたりすると、マウスは死にやすく、次の実験に進むことができません。そこで、技術的な修正やトラブル対応を繰り返した結果、盲腸の端から約1cmの距離で結紮を行ったという結論に至りました。21Gの針を使用して盲腸の端を穿刺して結紮し、先端が鈍い眼科用鉗子を使用して穿刺部位から少量の腸の内容物を静かに絞り出してから、盲腸に再導入しました。CLPの術後6時間の間に、マウスが無気力、動きの鈍化、直立した毛、眼の分泌物、下痢などの敗血症の症状を示すかどうかを観察します。この観察結果は、高用量シコニン群で観察された用量依存的な生存利益を示しており、これは敗血症管理におけるTCMの治療可能性に関する以前の研究と一致しています16。シコニンは、敗血症誘発性ALI5,17に対する現在の治療法の貴重な補助剤または代替薬として役立つ可能性が非常に高いです。
前述したように、このモデルは敗血症18の病理学的メカニズムの実際のシミュレーションプラットフォームを提供できます。それは、複数の細菌感染、動的免疫応答、多臓器機能障害など、ヒト敗血症の主要な特徴をシミュレートできるからです。さらに、CLPモデルは、抗生物質、免疫調節剤、補助療法(ビタミンCやヒドロコルチゾンなど)の有効性の検証など、既存の治療法の検証と改善を最適化することができ、投与量と投与タイミングの最適化に役立ちます。このモデルは、既存の臨床課題、抗生物質耐性の問題、臨床トランスレーショナルリサーチの標準化、人工知能、ビッグデータ分析などの側面の生物学的基盤を明らかにする上でも非常に重要です。
この技術の将来の応用には、以下の側面が含まれます。まず、新薬の研究開発と治療戦略の検証、例えば将来のヒストン治療法の開発を促進する可能性などです。第二に、免疫調節療法の開発を支援するなど、免疫メカニズムと宿主応答の詳細な分析、例えばPD-1/PD-L1シグナル伝達経路阻害剤の適用など19。第3に、CLPモデルで生成されたデータを組み合わせるなど、マルチオミクスと人工知能の統合により、機械学習による将来の敗血症の予測モデルを構築することができます。第四に、マイクロバイオームと感染制御の探求。将来的には、このモデルを使用して、糞便微生物叢移植やファージ療法などの新しい抗感染戦略の実現可能性を探る可能性があります。
CLPモデルは敗血症を誘発するための確立された方法ですが、ヒトの敗血症の複雑さを完全に再現するわけではないため、私たちの発見の一般化可能性が制限される可能性があります。今後の研究では、より大きなサンプルサイズを含め、これらの知見を検証するために、さまざまな敗血症モデルにおけるシコニンの影響を調査する必要があります。さらに、他のシグナル伝達経路との潜在的な相互作用を含む、関与する分子メカニズムのより深い調査は、シコニンの完全な治療可能性を理解するために重要です。
結論として、私たちの研究は、CLPマウスモデルを通じて敗血症誘発性ALIの治療のための有望な候補としてシコニンを特定しました。シコニンは、低酸素経路と炎症経路の両方を標的とすることにより、敗血症患者の臨床転帰を改善する可能性があります。この研究は、敗血症関連の肺損傷のメカニズムに関する新たな洞察を提供するだけでなく、現代の治療戦略における伝統的な漢方薬の潜在的な役割も浮き彫りにしています。
開示事項
著者は、競合する利益がないことを宣言します。
謝辞
この研究は、温州科学技術プロジェクト(Y2020976)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| H&E stain kit staining kit | Solaibao Technology | G1120HE | |
| Low-temperature centrifuge | Sigma | 3K15 | |
| Microplate Reader | Bio-Rad | Model 680 | |
| rabbit monoclonal VEGF-receptor1 antibody | Abcam | ab238632 | |
| rabbit polyclonal HIF-1α antibody | Abcam | ab51608 | |
| SDS-PAGE electrophoresis system | Bio-Rad | MINI Protean2 | |
| Shikonin | MedChemExpress | HY-N0822 |
参考文献
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved