Method Article
패혈증으로 인한 급성 폐 손상이 있는 마우스의 HIF-1α/VEGF 신호 경로에 대한 Shikonin의 효과
요약
이 프로토콜은 생쥐의 패혈증으로 인한 급성 폐 손상을 완화하는 데 시코닌의 효과를 평가하는 것을 목표로 합니다. 이 연구는 HIF-1α/VEGF 경로를 표적으로 삼아 다양한 용량의 시코닌이 생존율, 폐 병리학 및 염증 마커의 발현에 어떤 영향을 미치는지 조사하여 잠재적인 치료 이점을 강조합니다.
초록
패혈증은 종종 사망률이 높은 합병증인 급성 폐 손상(ALI)을 유발합니다. HIF-1α/VEGF 경로는 패혈증에서 중요한 역할을 하며, 항염증 특성을 가진 천연 화합물인 시코닌은 이 경로를 표적으로 하여 폐 손상을 완화할 수 있습니다. Balb/c 마우스는 무작위로 가짜 그룹, 모델 그룹, 저용량 치료 그룹 및 고용량 치료 그룹의 4개 그룹으로 나뉘었습니다. 가짜 그룹은 세칼 결찰 및 천자(CLP) 없이 개복술을 받았고, 모델 그룹은 패혈증 관련 급성 폐 손상을 유발하기 위해 CLP를 받았습니다. 모델링 후, 저용량 및 고용량 치료군은 14일 동안 1일 1회 각각 12.5mg/kg 및 50mg/kg의 용량으로 시코닌을 가스로 투여했습니다. 생쥐의 7일 생존율을 모니터링했습니다. 폐 조직 병리를 평가하기 위해 Hematoxylin 및 eosin(HE) 염색을 사용하고, 폐 습식/건식(W/D) 중량 비율을 측정하고, 폐 조직에서 HIF-1α, VEGF, TNF-α 및 IL-6의 발현을 감지하기 위해 웨스턴 블롯을 수행했습니다. Shikonin은 패혈성 마우스의 생존율을 유의하게 향상시켰으며, 고용량 그룹에서 가장 큰 효과가 관찰되었습니다(p < 0.05). 모델 그룹과 비교했을 때, 시코닌 투여군의 폐 W/D 비율과 조직 손상은 용량 의존적 방식으로 유의하게 감소했다. 또한, 시코닌은 HIF-1α, VEGF, TNF-α 및 IL-6의 발현을 현저히 하향 조절했으며, 고용량 투여군이 가장 뚜렷한 감소를 보였다(p < 0.05). Shikonin은 잠재적으로 HIF-1α의 발현을 억제하고 관련 염증 인자의 생성을 감소시킴으로써 패혈성 마우스의 급성 폐 손상을 완화합니다.
서문
패혈증은 감염에 의해 유발되는 심각한 전신 염증 반응입니다. 1 종종 다발성 장기 기능 장애로 이어지며 상태가 진행됨에 따라 생명을 위협할 수 있습니다. 2 기계 환기 및 지지 치료와 같은 치료법의 사용에도 불구하고 패혈증 관련 ALI의 사망률은 여전히 30%-40%3에 달할 정도로 높습니다. 이러한 치료법은 주로 근본적인 원인보다는 증상을 해결하여 전반적인 효과를 제한합니다. 따라서 폐 손상의 원인을 표적으로 하는 새로운 치료법을 식별하면 패혈증 환자의 결과를 크게 개선할 수 있습니다.
최근 연구에서는 저산소증 유발 인자-1α(HIF-1α)가 패혈증 유발 ALI 4,5의 진행에 중요한 조절인자로 확인되었습니다. HIF-1α는 패혈증 중 폐 조직에 축적되어 염증과 조직 손상을 악화시키는 다운스트림 유전자의 발현을 촉진합니다6. 이 과정은 폐 손상의 악화에 크게 기여합니다. 따라서 HIF-1α 신호 전달 경로를 표적으로 하는 것은 패혈증 유발 ALI에서 나타나는 염증 및 저산소 반응을 완화하기 위한 유망한 접근 방식을 제공합니다.
보다 효과적인 치료법을 찾는 과정에서 중국 전통 의학(Traditional Chinese medicine, TCM)은 귀중한 통찰력을 제공했습니다 7,8. 시코닌(Shikonin)은 Lithospermum erythrorhizon7에서 추출한 안트라퀴논 화합물입니다. 항염증 효과 9, 항균효과 10, 항종양 효과 11 가 눈에 띈다. 시코닌은 지질다당류(LPS)에 의해 유발된 폐 손상을 완화할 수 있으며, 이는 폐 질환에서 잠재적인 치료 역할을 시사한다12. 동시에 일부 연구에서는 시코닌이 단핵 대식세포 시스템을 조절하고 전염증 반응과 항염증 반응의 균형을 유지함으로써 패혈증으로 인한 산화 손상을 완화할 수 있다고 제안했습니다. 그러나 패혈증 유발 ALI에서 시코닌의 보호 효과 뒤에 숨은 메커니즘은 완전히 이해되지 않았습니다. 이것은 현재 연구에서 중요한 격차를 나타냅니다.
이 연구에서는 세칼 결찰 및 천자(CLP)를 사용하여 패혈증 유발 ALI의 마우스 모델에서 시코닌의 보호 효과를 탐구하는 것을 목표로 합니다. CLP 기술은 복잡한 전신 염증 반응 및 다기관 기능 장애를 시뮬레이션할 수 있기 때문에 패혈증 연구에서 중요한 역할을 하며, 새로운 치료 전략의 효과를 평가하는 데 적합합니다. CLP 기술은 기존 LPS 주입 방법에 비해 상대적으로 임상적으로 관련성이 높습니다: 임상 패혈증의 병리학적 과정에 더 가까운 장내 미생물 전좌로 인한 전신 염증 반응을 시뮬레이션합니다. 등급을 매기고 조절할 수 있습니다: 결찰 길이와 천공 크기를 조정함으로써 질병의 중증도를 조절할 수 있으며 패혈증에 대한 전체 연구에 적합합니다. 또한 다중 장기 기능 장애 및 사이토카인 반응에서 유사한 동적 변화를 시뮬레이션할 수 있습니다. HIF-1α/VEGF 신호 전달 경로를 조절하는 시코닌의 역할을 조사함으로써 패혈증 관련 폐 손상의 기저 메커니즘을 다루는 새로운 치료 전략에 대한 통찰력을 제공하여 잠재적으로 임상 결과를 개선할 수 있기를 희망합니다.
프로토콜
이 프로토콜은 원저우 의과대학 실험동물센터(Wenzhou Medical University Experimental Animal Center)의 승인을 받았다. 본 연구에서는 수컷 C57Bl/6 마우스(5-6개월, 20-25g)를 사용하였다. 주요 시약과 사용된 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다.
1. 패혈증 마우스 모델의 준비
- 25°C의 일정한 온도, 50% 습도, 12시간의 라이트/다크 사이클에서 자란 집쥐.
- 7일의 순응 기간 후, 마우스를 무작위로 4개 그룹(Sham 그룹, 모델 그룹, 저용량 치료 그룹, 고용량 치료 그룹)으로 나누고 각 그룹에 20마리의 마우스를 배치합니다.
- 이전 연구의 참고 문헌에 기초하여13, 저용량 그룹은 14일 동안 12.5mg/kg 농도의 푸르푸린을, 50mg/kg 농도의 고용량 그룹은 14일 동안 치료한다. 가짜 수술 그룹의 경우 결찰이나 천자 없이 개복술, 두골 견인, 축소 및 봉합을 시행하고 14일 동안 동일한 용량의 생리식염수로 치료합니다. 패혈증 그룹에 대한 실험 단계는 다음과 같습니다.
- 하룻밤 금식 후(물은 허용됨) 공정 전반에 걸쳐 멸균 상태에서 펜토바르비탈나트륨(40-80mg/kg)으로 마우스를 마취합니다. 마취 상태에서 건조를 방지하기 위해 수의사 연고를 눈에 바르십시오.
- 호흡 속도가 느려지고, 근육 긴장이 감소하며, 지혈 겸자로 하지를 가볍게 조일 때 뚜렷한 스트레스 반응이 없는지 여부에 따라 적절한 마취를 확인하십시오.
- 75% 에탄올, 3x로 소독을 수행합니다. 마우스 복부의 좌측 중간 위치에서 약 1cm의 세로로 절개하고 피부, 근막, 근육을 겹겹이 절개하여 복강을 노출시킵니다.
- 끝이 뭉툭한 안과 겸자를 양손에 사용하여 복강을 부드럽게 탐색하고 쥐의 맹장을 찾아 풀어낸 다음 맹장 끝에서 약 1cm 떨어진 곳에서 접합합니다.
- 21G 바늘을 사용하여 맹장 끝을 뚫고 접합한 다음 끝이 뭉툭한 안과 겸자를 사용하여 천자 부위에서 소량의 장 내용물을 부드럽게 짜낸 다음 맹장으로 회수합니다.
- 0.9% 염화나트륨 용액 1mL로 피하액 소생술을 수행합니다. 흉골 누운 자세를 유지할 수 있을 만큼 충분한 의식을 회복할 때까지 동물을 방치하지 마십시오. 우리는 수술을 받은 동물이 완전히 회복될 때까지 다른 동물과 함께 돌려보내지 않는다는 점에 유의합니다.
- CLP 모델링 7일 후, 안락사를 위해 과도한 마취를 시행합니다.
참고: 푸르푸린이 피부, 호흡기 및 소화관에 자극을 줄 수 있는 영향과 수생 생물에 대한 높은 독성, 환경 오염으로 인해 실험 중 개인 보호 장치를 사용하십시오.
2. 동물모델 평가
- 생쥐 생존 관찰
- 위에서 설명한 대로 동물 취급을 수행합니다. 통계 분석을 위해 모델링한 후 1주일 이내에 사망률을 기록합니다. 일부 마우스는 안락사 전에 패혈증 없이 사망하는 반면, CLP 모델 마우스는 특정 사망률을 가지고 있습니다(표 1).
- Lung wet-to-dry 중량 비율 측정
- 모델링 24시간 후 1.4-1.5단계에 따라 마우스를 다시 마취합니다.
- 마우스의 쇄골 정중선 왼쪽을 약 1cm 정도 세로로 절개하고 피부, 근막, 근육층을 제거하여 수술용 가위와 집게로 흉강을 노출시킵니다.
- 왼쪽 폐를 제거하고 표면 액체를 배출합니다. 젖은 무게를 측정 한 다음 80 ° C 오븐에서 72 시간 동안 일정한 무게로 건조하여 건조 무게를 얻습니다.
- 폐 수분 함량을 다음과 같이 계산합니다.
폐 수분 함량 = (젖은 중량 - 건조 중량) / 젖은 중량 x 100%.
- 폐 조직의 조직병리학적 비교
- 지정된 시점에서, 위의 2.2단계에서 설명한 대로 왼쪽 폐를 채취합니다. 폐를 10% 중성 포름알데히드로 고정하고 파라핀에 삽입한 다음 5μm 두께로 절단합니다.
- 매번 5-10분 동안 자일렌 2배로 폐를 디왁스합니다. 그래디언트당 3분 동안 100%, 95%, 85% 및 75%로 시리즈 에탄올 재수화를 수행합니다. 증류수에 2분 동안 담그십시오.
- 약 100mL의 헤마톡실린 용액으로 10분 동안 염색한 다음 증류수로 헹구어 떠다니는 색을 제거합니다.
- 약 70mL의 분화 용액을 넣고 30초 동안 담가둡니다. 그런 다음 3-5분 동안 매번 2회 수돗물에 담가둡니다.
- 약 100mL의 에오신 염료 용액을 2분 동안 적가합니다. 여분의 염료 용액을 붓고 아래 설명된 대로 빠르게 탈수합니다.
- 아래 설명된 대로 탈수, 투명도 및 밀봉을 수행합니다.
- 샘플을 그래디언트 에탄올: 75%, 85%, 95% 및 100% 에탄올(I)에 각각 2-3초 동안 담그십시오. 100% 에탄올(II)에 1분 동안 담그고 자일렌 2x에 1분 동안 담그십시오. 빨대나 스포이드를 사용하여 조직 조각 표면에 중성 껌을 떨어뜨리고 거품이 생기지 않도록 가능한 한 골고루 펴 바릅니다. 밀봉하고 400x에서 현미경으로 관찰하십시오.
- 폐 절편당 10개의 임의 필드를 선택합니다. 병리학자에게 폐포 부종, 출혈 및 호중구 침윤과 같은 병리학적 변화를 0(정상)에서 4(심각한 손상)까지 점수를 매기도록 요청하십시오. 평가에 총점을 사용합니다.
- 웨스턴 블로팅
- 핵 단백질 추출 키트 지침에 따라 폐 조직에서 핵 단백질을 추출하고 제조업체의 지침에 따라 BCA 방법을 사용하여 단백질 농도를 측정합니다.
- 샘플당 50μg의 단백질이 로드된 단백질 로딩 샘플을 준비합니다. SDS-PAGE 분리 젤(10%)과 스태킹 젤(3%)을 준비합니다. 80V에서 45분 동안 전기영동을 수행한 다음 샘플이 분리 겔에 들어간 후 60분 동안 110V에서 PVDF 멤브레인으로 단백질을 이동합니다.
- 단백질을 멤브레인으로 옮기고 60분 동안 차단합니다. 1차 항체( Table of Materials, 1:1000 참조)로 4°C에서 하룻밤 동안 배양한 후, 2차 항체( Table of Materials, 1:1000 참조)를 37°C에서 2시간 동안 배양합니다.
- TBST로 멤브레인을 세척하고 시각화를 위해 ECL을 사용합니다. 어두운 방에서 준비된 시약을 PVDF 멤브레인에 넣고 진탕 및 형광 이미징을 수행합니다. ECL 시약은 멤브레인의 생체 분자와 상호 작용하여 강력한 화학발광 반응을 일으키며, 이는 형광 이미징 기기에 의해 기록됩니다.
- 이미지 분석 시스템인 Band Quantification Method를 사용하여 단백질 밴드의 그레이스케일 값을 분석합니다(밴드 밀도 측정에 사용되는 시스템에 대한 자세한 내용은 NIH 이미지 참조).
- 통계 분석
- 통계 분석에 SPSS 26.0을 사용합니다. 일원분산분석(One-Way ANOVA)을 사용하여 여러 그룹의 평균을 비교하고, LSD-t 검정을 사용하여 쌍별 비교를 수행할 수 있습니다. p-값 < 0.05를 통계적으로 유의한 것으로 간주합니다.
결과
시코닌의 치료 가능성을 평가하기 위해 먼저 7일 동안 패혈성 마우스의 생존에 미치는 영향을 평가했습니다. 시코닌을 사용한 치료는 용량 의존적 방식으로 생존율을 향상시켰다(그림 1).
패혈증으로 인한 폐 손상의 광범위한 발생을 감안하여, 우리는 또한 쥐의 폐부종을 평가했다. 폐부종은 폐 습식 중량 대 건식 중량(W/D) 비율을 측정하여 평가했습니다. W/D 비율은 가짜 그룹에 비해 모델 그룹에서 유의하게 높았습니다(p < 0.05). 시코닌 치료는 용량 의존적 방식으로 이러한 효과를 완화했다. 고용량 투여군은 저선량 투여군보다 폐부종이 더 현저하게 감소한 것으로 나타났다(p < 0.05)(그림 2).
폐 조직에 대한 시코닌의 보호 효과를 추가로 검증하기 위해 조직병리학적 분석을 수행했습니다. 가짜 그룹은 정상적인 폐 구조를 보인 반면, CLP 모델 그룹은 광범위한 부종, 출혈 및 염증성 세포 침투를 포함한 현저한 조직 손상을 보였습니다. 감소된 W/D 비율과 일치하게, 시코닌 치료는 용량 의존적 방식으로 이러한 병리학적 변화를 완화시켰다. 고용량 그룹의 마우스는 CLP 모델 그룹에 비해 조직병리학적 이상이 유의하게 적었으며, 병리학적 점수는 저용량 그룹의 마우스보다 현저히 낮았다(p < 0.05; 그림 3).
염증과 저산소증은 모두 패혈증으로 인한 폐 손상의 주요 원인이기 때문에 다음으로 이러한 경로에 관여하는 주요 단백질의 발현 수준을 조사했습니다. 웨스턴 블롯 분석은 CLP 모델 그룹이 TNF-αand, IL-6 및 VEGF 수치가 현저히 증가하여 염증 반응을 나타내는 것으로 나타났습니다(그림 4). 또한, HIF-1α 및 VEGF는 모델 그룹에서 높게 발현되어 저산소증 증가를 확인했습니다(그림 5). 시코닌 치료는 용량 의존적 방식으로 이러한 단백질의 발현을 유의하게 감소시켰으며, 고용량 투여군은 저용량 투여군에 비해 HIF-1α, VEGF, TNF-α 및 IL-6의 더 큰 억제를 보였다(p < 0.05; 그림 4 및 그림 5). 이러한 분자 발견은 시코닌의 보호 역할을 더욱 뒷받침하며, 패혈성 마우스에서 저산소증과 염증을 모두 조절하는 능력을 강조합니다.
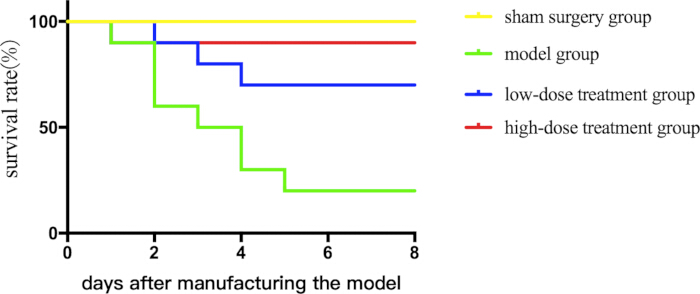
그림 1: 서로 다른 패혈성 마우스 그룹 간의 생존율 비교. 마우스를 그룹화하여 약물 치료와 함께 CLP를 실시하고 생존 상태를 기록하기 위해 생존 곡선을 표시했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
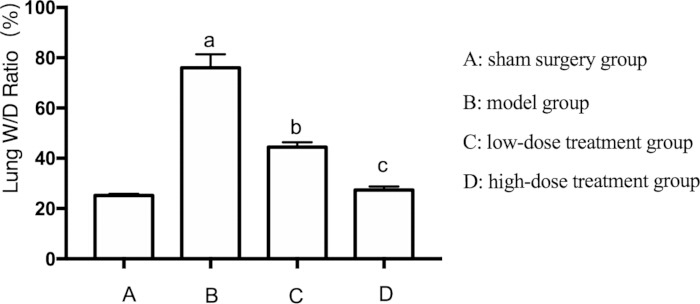
그림 2: 패혈성 마우스의 폐 W/D 비율에 대한 Shikonin의 효과. 마우스를 그룹화하여 24시간 동안 약물 치료와 함께 CLP를 투여한 후 폐 W/D 비율을 기록했습니다. AP < 가짜 투여군에 비해 0.05, BP < 패혈증 투여군에 비해 0.05, CP < 저용량 치료 군에 비해 0.05였다. 오차 막대는 표준 편차를 나타내고, 일원 ANOVA는 여러 그룹의 평균값을 비교하는 데 사용되었으며, LSD-t 검정은 쌍별 비교를 위해 사용되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
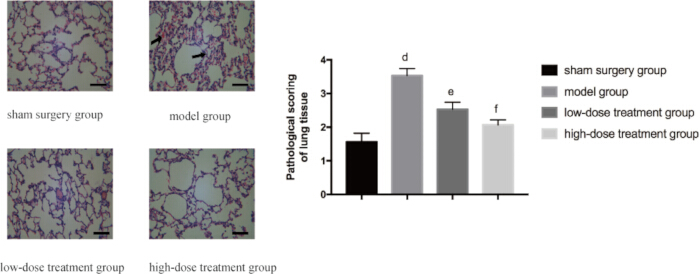
그림 3: 그룹 간 폐 조직 병리학의 미시적 변화. 마우스를 그룹화하여 24시간 동안 약물 치료와 함께 CLP를 투여했습니다. 그런 다음 HE 염색을 위해 폐 조직을 적출했습니다. 왼쪽 패널에는 400배 배율(스케일 바 = 100μm)로 대표 이미지가 표시됩니다. 광범위한 부종, 출혈 및 염증성 세포 침투는 화살표로 표시된 것처럼 모델 그룹에서 볼 수 있습니다. 오른쪽 패널은 해당 조직병리학적 점수를 나타냅니다. 가짜 그룹과 비교했을 때, 그 차이는 유의했다(p 0.05). 오차 막대는 표준 편차를 나타내고, 일원 ANOVA는 여러 그룹의 평균값을 비교하는 데 사용되었으며, LSD-t 검정은 쌍별 비교를 위해 사용되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
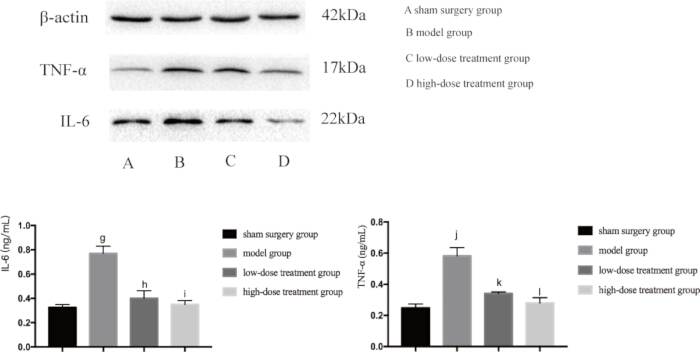
그림 4: 생쥐의 폐 조직에서 TNF-α 및 IL-6의 단백질 발현 수준. 마우스를 그룹화하여 24시간 동안 약물 치료와 함께 CLP를 투여한 후 지시된 단백질의 발현을 폐 조직에서 검출했습니다. 가짜 그룹과 비교했을 때, 모델 그룹에서 TNF-α의 발현은 유의하게 증가하였다(gp < 0.05). 모델군과 비교했을 때, 저용량 치료군에서 TNF-α의 발현은 유의하게 감소했다(hp < 0.05). 저용량 치료군에 비해 고용량 치료군에서 TNF-α의 발현은 감소했으나 그 차이는 통계적으로 유의하지 않았다(ip > 0.05). 또한, 모조군에 비해 모델군에서 IL-6의 발현이 유의하게 증가했다(jp < 0.05). 모델군과 비교했을 때, 저용량 치료군에서 IL-6의 발현은 유의하게 감소했다(kp < 0.05). 저용량 치료군과 비교했을 때, 고용량 치료군에서 IL-6의 발현은 감소하였으나, 그 차이는 통계적으로 유의하지 않았다(lp > 0.05). 오차 막대는 표준 편차를 나타내고, 일원 ANOVA는 여러 그룹의 평균값을 비교하는 데 사용되었으며, LSD-t 검정은 쌍별 비교를 위해 사용되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
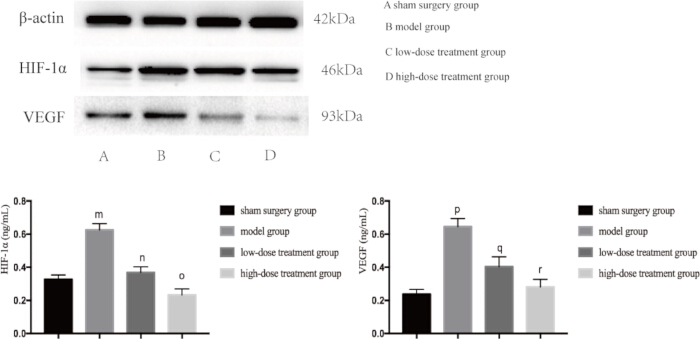
그림 5: 생쥐의 폐 조직에서 HIF-1α 및 VEGF의 단백질 발현 수준. 마우스를 그룹화하여 24시간 동안 약물 치료와 함께 CLP를 투여한 후 지시된 단백질의 발현을 폐 조직에서 검출했습니다. 모조군과 비교했을 때, 모델군에서 HIF-1α의 발현은 유의하게 증가하였다(mp< 0.05). 모델군과 비교했을 때, 저용량 치료군에서 HIF-1α의 발현은 유의하게 감소했다(np< 0.05). 저용량 치료군과 비교했을 때, 고용량 치료군에서 HIF-1α의 발현은 감소하였으나, 그 차이는 통계적으로 유의하지 않았다(op > 0.05). 또한, 가짜군과 비교하여, 모델군에서의 VEGF의 발현이 유의하게 증가하였다(p< 0.05). 모델군과 비교했을 때, 저용량 치료군에서 VEGF의 발현은 유의하게 감소하였다(qp < 0.05). 저용량 치료군과 비교했을 때, 고용량 치료군에서 VEGF의 발현은 감소하였으나, 그 차이는 통계적으로 유의하지 않았다(rp > 0.05). 오차 막대는 표준 편차를 나타내고, 일원 ANOVA는 여러 그룹의 평균값을 비교하는 데 사용되었으며, LSD-t 검정은 쌍별 비교를 위해 사용되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 일 | 가짜 그룹 | 모델 그룹 | 저용량 치료군 | 고용량 치료군 |
| 0 | 20 | 20 | 20 | 20 |
| 1 | 20 | 20 | 20 | 20 |
| 2 | 20 | 18 | 20 | 18 |
| 3 | 20 | 12 | 18 | 18 |
| 4 | 20 | 10 | 16 | 18 |
| 5 | 20 | 6 | 14 | 18 |
| 6 | 20 | 4 | 14 | 18 |
| 7 | 20 | 4 | 14 | 18 |
표 1: 생쥐의 생존율.
토론
패혈증 연구를 위한 황금 표준 모델인 CLP 모델은 CLP가 다른 많은 모델보다 인간 패혈증의 복잡성을 더 잘 모방하기 때문에 이 실험의 핵심 단계입니다. 패혈증 관련 ALI는 높은 사망률과 현재 치료법의 제한된 효과로 인해 중요한 임상적 과제로 남아 있습니다14,15. 본 연구는 시코닌이 CLP 모델을 만들어 HIF-1α와 염증 반응을 모두 조절함으로써 패혈성 마우스의 생존율을 크게 향상시킨다는 것을 처음으로 입증했습니다.
CLP로 인한 폐사는 바늘 크기, 결찰된 맹장의 길이, 두골 천자 수와 같은 몇 가지 기술적 매개변수에 따라 달라집니다. 바늘이 너무 가늘거나 바늘 수가 충분하지 않으면 전신 패혈증 반응을 일으키지 않습니다. 바늘이 너무 두껍거나 바늘 사용 횟수가 너무 많으면 쥐가 죽기 쉬워 다음 실험을 진행할 수 없습니다. 따라서 반복적인 기술적 수정과 문제 해결을 통해 맹장 끝에서 약 1cm 떨어진 곳에서 결찰을 수행했다는 결론을 내렸습니다. 우리는 21G 바늘을 사용하여 맹장 끝을 뚫고 결찰하고, 끝이 뭉툭한 안과 겸자를 사용하여 천자 부위에서 소량의 장 내용물을 부드럽게 짜낸 후 맹장에 다시 넣었습니다. CLP 수술 후 6시간 동안 생쥐가 무기력, 느린 움직임, 직립 모발, 눈 분비물 및 설사와 같은 패혈증 증상을 보이는지 관찰합니다. 이러한 관찰 결과는 고용량 시코닌 투여군에서 관찰된 용량 의존적 생존 혜택을 나타내며, 이는 패혈증 관리에서 TCM의 치료 가능성에 대한 이전 연구와 일치한다16. Shikonin은 패혈증 유발 ALI 5,17에 대한 현재 치료법의 귀중한 보조 또는 대안으로 작용할 가능성이 높습니다.
앞서 언급했듯이 이 모델은 패혈증18의 병리학적 메커니즘에 대한 실제 시뮬레이션 플랫폼을 제공할 수 있습니다. 여러 박테리아 감염, 동적 면역 반응, 여러 장기 기능 장애 등을 포함한 인간 패혈증의 주요 특징을 시뮬레이션할 수 있기 때문입니다. 또한 CLP 모델은 항생제, 면역조절제 및 보조 요법(예: 비타민 C 및 하이드로코르티손)의 효능 검증과 같은 기존 치료 방법의 검증 및 개선을 최적화하여 용량 및 투여 시기를 최적화하는 데 도움이 될 수 있습니다. 이 모델은 또한 기존 임상 문제, 항생제 내성 문제, 임상 중개 연구의 표준화, 인공 지능, 빅 데이터 분석 및 기타 측면의 생물학적 기초를 밝히는 데 매우 중요합니다.
이 기술의 향후 응용 분야에는 다음과 같은 측면이 포함됩니다. 첫째, 신약의 연구 개발과 치료 전략의 검증, 예를 들어 미래에 히스톤 요법의 개발을 잠재적으로 주도하는 것과 같습니다. 둘째, PD-1/PD-L1 신호전달 경로 억제제의 적용과 같은 면역조절 요법 개발 지원과 같은 면역 기전 및 숙주 반응에 대한 심층 분석19. 셋째, CLP 모델에서 생성된 데이터를 결합하는 것과 같은 다중 오믹스와 인공 지능의 통합은 기계 학습을 통해 향후 패혈증에 대한 예측 모델을 구축하는 데 사용할 수 있습니다. 넷째, 마이크로바이옴 및 감염 통제에 대한 탐구. 앞으로 이 모델은 분변 미생물군 이식 및 파지 요법과 같은 새로운 감염 방지 전략의 타당성을 탐구하는 데 사용될 수 있습니다.
CLP 모델은 패혈증을 유발하기 위한 잘 정립된 방법이지만, 인간 패혈증의 복잡성을 완전히 재현하지 못할 수 있어 본 연구 결과의 일반화 가능성을 제한할 수 있습니다. 향후 연구에서는 더 큰 표본 크기를 포함하고 이러한 결과를 검증하기 위해 다양한 패혈증 모델에서 시코닌의 효과를 조사해야 합니다. 또한, 다른 신호 경로와의 잠재적인 상호 작용을 포함하여 관련된 분자 메커니즘에 대한 심층적인 탐구는 시코닌의 완전한 치료 잠재력을 이해하는 데 중요할 것입니다.
결론적으로, 본 연구는 시코닌을 CLP 마우스 모델을 통한 패혈증 유발 ALI 치료의 유망한 후보로 식별합니다. 저산소 경로와 염증 경로를 모두 표적으로 삼음으로써, 시코닌은 패혈증 환자의 임상 결과를 개선할 수 있는 잠재력을 가지고 있습니다. 이 연구는 패혈증 관련 폐 손상의 메커니즘에 대한 새로운 통찰력을 제공할 뿐만 아니라 현대 치료 전략에서 전통 한의학의 잠재적 역할을 강조합니다.
공개
저자들은 자신들이 서로 상충하는 이해관계가 없다고 선언한다.
감사의 말
이 연구는 원저우 과학기술프로젝트(Wenzhou Science and Technology Project, Y2020976)의 지원을 받았다.
자료
| Name | Company | Catalog Number | Comments |
| H&E stain kit staining kit | Solaibao Technology | G1120HE | |
| Low-temperature centrifuge | Sigma | 3K15 | |
| Microplate Reader | Bio-Rad | Model 680 | |
| rabbit monoclonal VEGF-receptor1 antibody | Abcam | ab238632 | |
| rabbit polyclonal HIF-1α antibody | Abcam | ab51608 | |
| SDS-PAGE electrophoresis system | Bio-Rad | MINI Protean2 | |
| Shikonin | MedChemExpress | HY-N0822 |
참고문헌
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유