Method Article
Efectos de la shikonina en la vía de señalización HIF-1α/VEGF en ratones con lesión pulmonar aguda causada por sepsis
En este artículo
Resumen
El protocolo tiene como objetivo evaluar la eficacia de la shikonina en el alivio de la lesión pulmonar aguda causada por la sepsis en ratones. Al dirigirse a la vía HIF-1α/VEGF, el estudio investiga cómo las diferentes dosis de shikonina influyen en las tasas de supervivencia, la patología pulmonar y la expresión de marcadores inflamatorios, destacando sus posibles beneficios terapéuticos.
Resumen
La sepsis a menudo causa lesión pulmonar aguda (ALI), una complicación de alta mortalidad. La vía HIF-1α/VEGF desempeña un papel clave en la sepsis, y la shikonin, un compuesto natural con propiedades antiinflamatorias, puede aliviar la lesión pulmonar al dirigirse a esta vía. Los ratones Balb/c se dividieron aleatoriamente en cuatro grupos: grupo simulado, grupo modelo, grupo de tratamiento de dosis baja y grupo de tratamiento de dosis alta. El grupo simulado se sometió a laparotomía sin ligadura y punción cecal (CLP), mientras que el grupo modelo se sometió a CLP para inducir lesión pulmonar aguda relacionada con la sepsis. Después del modelado, los grupos de tratamiento de dosis baja y dosis alta recibieron shikonina por sonda nasogástrica en dosis de 12,5 mg/kg y 50 mg/kg, respectivamente, una vez al día durante 14 días. Se monitorizó la tasa de supervivencia a 7 días de los ratones. Se utilizó la tinción con hematoxilina y eosina (HE) para evaluar la patología del tejido pulmonar, se midió la relación de peso húmedo/seco (W/D) del pulmón y se realizó un Western blot para detectar la expresión de HIF-1α, VEGF, TNF-α e IL-6 en el tejido pulmonar. La shikonina mejoró significativamente la tasa de supervivencia de los ratones sépticos, con el mayor efecto observado en el grupo de dosis alta (p < 0,05). En comparación con el grupo modelo, la relación W/D pulmonar y el daño tisular en los grupos tratados con shikonin se redujeron significativamente de manera dependiente de la dosis. Además, la shikonina disminuyó significativamente la expresión de HIF-1α, VEGF, TNF-α e IL-6, y el grupo de dosis alta mostró la reducción más pronunciada (p < 0,05). La shikonina alivia la lesión pulmonar aguda en ratones sépticos, potencialmente al inhibir la expresión de HIF-1α y reducir la producción de factores inflamatorios relacionados.
Introducción
La sepsis es una respuesta inflamatoria sistémica grave desencadenada por una infección. 1 A menudo conduce a la disfunción de múltiples órganos y puede llegar a ser potencialmente mortal a medida que la afección progresa. 2 A pesar del uso de terapias como la ventilación mecánica y los cuidados de apoyo, las tasas de mortalidad por IAL asociada a la sepsis siguen siendo altas, alcanzando el 30%-40%3. Estos tratamientos abordan principalmente los síntomas en lugar de las causas subyacentes, lo que limita su eficacia general. Por lo tanto, la identificación de nuevos enfoques terapéuticos que se dirijan a las causas de la lesión pulmonar podría mejorar significativamente los resultados de los pacientes en la sepsis.
Estudios recientes han identificado el factor 1α inducible por hipoxia (HIF-1α) como un regulador crítico en la progresión de la ALI inducida por sepsis 4,5. El HIF-1α se acumula en el tejido pulmonar durante la sepsis, impulsando la expresión de genes posteriores que exacerban la inflamación y el daño tisular6. Este proceso contribuye significativamente al empeoramiento de la lesión pulmonar. Por lo tanto, dirigirse a la vía de señalización HIF-1α ofrece un enfoque prometedor para mitigar las respuestas inflamatorias e hipóxicas observadas en la ALA inducida por sepsis.
En la búsqueda de tratamientos más efectivos, la Medicina Tradicional China (MTC) ha proporcionado valiosos conocimientos 7,8. La shikonina es un compuesto de antraquinona extraído de Lithospermum erythrorhizon7. Presenta notables efectos antiinflamatorios9, antibacterianos10 y antitumorales11. La shikonina puede aliviar la lesión pulmonar inducida por el lipopolisacárido (LPS), lo que sugiere su potencial papel terapéutico en las afecciones pulmonares12. Al mismo tiempo, algunos estudios también han propuesto que la shikonina puede aliviar el daño oxidativo causado por la sepsis al regular el sistema de macrófagos mononucleares, equilibrando las respuestas proinflamatorias y antiinflamatorias. Sin embargo, los mecanismos detrás de los efectos protectores de shikonin en la ALI inducida por sepsis no se comprenden completamente. Esto representa una brecha crítica en la investigación actual.
En este estudio, nuestro objetivo es explorar los efectos protectores de la shikonina en un modelo murino de ALI inducida por sepsis mediante ligadura y punción cecal (CLP). La tecnología CLP desempeña un papel importante en la investigación de la sepsis, ya que puede simular respuestas inflamatorias sistémicas complejas y disfunción multiorgánica, lo que la hace adecuada para evaluar la eficacia de nuevas estrategias de tratamiento. La tecnología CLP es relativamente más relevante desde el punto de vista clínico en comparación con los métodos tradicionales de inyección de LPS: simula la respuesta inflamatoria sistémica causada por la translocación de la microbiota intestinal, que está más cerca del proceso patológico de la sepsis clínica. Se puede graduar y controlar: ajustando la longitud de la ligadura y el tamaño de la perforación, se puede controlar la gravedad de la enfermedad y es adecuado para todo el estudio de la sepsis. Además, puede simular cambios dinámicos similares en la disfunción multiorgánica y la respuesta a las citocinas. Al investigar el papel de la shikonina en la modulación de la vía de señalización HIF-1α/VEGF, esperamos proporcionar información sobre nuevas estrategias terapéuticas que aborden los mecanismos subyacentes de la lesión pulmonar relacionada con la sepsis, lo que podría mejorar los resultados clínicos.
Protocolo
El protocolo obtuvo la aprobación del Centro de Animales Experimentales de la Universidad Médica de Wenzhou. En el presente estudio se utilizaron ratones machos C57Bl/6 (5-6 meses de edad; 20-25 g). Los detalles de los reactivos principales y el equipo utilizado se enumeran en la Tabla de Materiales.
1. Preparación del modelo de ratón de sepsis
- Los ratones domésticos se encuentran a una temperatura constante de 25 °C, 50% de humedad y un ciclo de luz/oscuridad de 12 h.
- Después de un período de aclimatación de 7 días, divida aleatoriamente los ratones en cuatro grupos: grupo simulado, grupo modelo, grupo de tratamiento de dosis baja y grupo de tratamiento de dosis alta, con 20 ratones en cada grupo.
- Sobre la base de las referencias de un estudio previo13, tratar el grupo de dosis baja con una concentración de 12,5 mg/kg de purpurina durante 14 días, y el grupo de dosis alta con una concentración de 50 mg/kg durante 14 días. Para el grupo de cirugía simulada, realizar laparotomía, tracción cecal, reducción y cierre sin ligadura ni punción, y tratar con la misma dosis de solución salina fisiológica durante 14 días. Los pasos experimentales para el grupo de sepsis son los siguientes.
- Después del ayuno nocturno (se permitió el uso de agua), anestesiar a los ratones con pentobarbital sódico (40-80 mg/kg) en condiciones estériles durante todo el proceso. Aplique ungüento veterinario en los ojos para prevenir la sequedad mientras está bajo anestesia.
- Verifique la anestesia adecuada, ya que disminuye la frecuencia respiratoria, disminuye la tensión muscular y no hay una respuesta de estrés obvia al sujetar ligeramente las extremidades inferiores con pinzas hemostáticas.
- Realizar la desinfección con etanol al 75%, 3x. Haga una incisión longitudinal de aproximadamente 1 cm en la posición media izquierda del abdomen del ratón y corte la piel, la fascia y los músculos en capas para exponer la cavidad abdominal.
- Con pinzas oftálmicas de punta roma en ambas manos, explore suavemente la cavidad abdominal, localice y libere el ciego del ratón y líguelo a una distancia de aproximadamente 1 cm del extremo del ciego.
- Use una aguja de 21G para perforar y ligar el extremo del ciego, exprima suavemente una pequeña cantidad de contenido intestinal del sitio de la punción con pinzas oftálmicas de punta roma y luego retírela en el ciego.
- Realizar la reanimación subcutánea con líquidos con 1 mL de solución de cloruro sódico al 0,9%. No deje al animal desatendido hasta que haya recuperado la conciencia suficiente para mantener la decúbito esternal. Observamos que el animal que ha sido sometido a una cirugía no se devuelve a la compañía de otros animales hasta que se recupera por completo.
- Después de 7 días de modelado CLP, administrar anestesia excesiva para la eutanasia.
NOTA: Debido a los posibles efectos irritantes de la purpurina en la piel, el tracto respiratorio y el tracto digestivo, así como su alta toxicidad para los organismos acuáticos, la contaminación ambiental, use protección personal durante el experimento.
2. Evaluación de modelos animales
- Observación de la supervivencia de los ratones
- Realice el manejo de animales como se describe anteriormente. Registre la tasa de mortalidad dentro de 1 semana después del modelado para el análisis estadístico. Algunos ratones mueren sin sepsis antes de la eutanasia, mientras que los ratones modelo CLP tienen una cierta tasa de mortalidad (Tabla 1).
- Medición de la relación entre el peso húmedo y seco de los pulmones
- Después de 24 h de modelado, anestesiar a los ratones nuevamente según los pasos 1.4-1.5.
- Haga una incisión longitudinal de aproximadamente 1 cm en el lado izquierdo de la línea media de la clavícula del ratón y retire la piel, la fascia y las capas musculares para exponer la cavidad torácica con tijeras quirúrgicas y pinzas.
- Retire el pulmón izquierdo y drene el líquido de la superficie. Mida el peso húmedo y luego séquelo en un horno a 80 °C durante 72 h a un peso constante para obtener el peso seco.
- Calcule el contenido de agua pulmonar como:
Contenido de agua pulmonar = (Peso húmedo - Peso seco) / Peso húmedo x 100%.
- Comparación histopatológica de los tejidos pulmonares
- En los puntos de tiempo especificados, recoja el pulmón izquierdo como se describe anteriormente en el paso 2.2. Fije el pulmón en formaldehído neutro al 10%, insértelo en parafina y córtelo en secciones de 5 μm de grosor.
- Desparafinar el pulmón en xileno, 2 veces, durante 5-10 minutos cada vez. Realice la rehidratación de etanol en serie con 100%, 95%, 85% y 75%, durante 3 minutos por gradiente. Remojar en agua destilada durante 2 min.
- Manchar con aproximadamente 100 ml de solución de hematoxilina durante 10 minutos, luego enjuagar con agua destilada para eliminar cualquier color flotante.
- Añadir unos 70 ml de la solución de diferenciación y remojar durante 30 s. Luego, sumérjalo en agua del grifo 2 veces, cada vez durante 3-5 minutos.
- Agregue aproximadamente 100 mL de solución de colorante de eosina gota a gota durante 2 minutos. Vierta el exceso de solución de tinte y deshidrate rápidamente como se describe a continuación.
- Realice la deshidratación, la transparencia y el sellado como se describe a continuación.
- Remoje las muestras en etanol de gradiente: 75%, 85%, 95% y 100% de etanol (I) durante 2-3 s cada una. Remoje en etanol (II) al 100% durante 1 minuto y remoje en xileno 2 veces durante 1 minuto cada vez. Con una pajita o un gotero, gotee goma neutra sobre la superficie de las rodajas de papel y extiéndala uniformemente tanto como sea posible para evitar la formación de burbujas. Selle y observe bajo un microscopio a 400x.
- Seleccione 10 campos aleatorios por sección pulmonar. Pídale a un patólogo que califique los cambios patológicos, como el edema alveolar, la hemorragia y la infiltración de neutrófilos, de 0 (normal) a 4 (daño grave). Utilice la puntuación total para la evaluación.
- Western blot
- Extraiga las proteínas nucleares del tejido pulmonar de acuerdo con las instrucciones del kit de extracción de proteínas nucleares y mida la concentración de proteínas utilizando el método BCA según las instrucciones del fabricante.
- Prepare muestras de carga de proteínas con 50 μg de proteína cargada por muestra. Prepare el gel separador SDS-PAGE (10%) y el gel apilador (3%). Realice la electroforesis a 80 V durante 45 min, luego transfiera la proteína a la membrana de PVDF a 110 V durante 60 min después de que las muestras hayan ingresado al gel de separación.
- Transfiera las proteínas a una membrana y bloquee durante 60 min. Incubar con anticuerpos primarios (ver Tabla de Materiales, 1:1000) durante la noche a 4 °C, seguido de una incubación de anticuerpos secundarios (ver Tabla de Materiales, 1:1000) a 37 °C durante 2 h.
- Lave la membrana con TBST y use ECL para la visualización. En una habitación oscura, agregue los reactivos preparados a una membrana de PVDF y realice imágenes de agitación y fluorescencia. Los reactivos ECL interactúan con las biomoléculas de la membrana, produciendo fuertes reacciones de quimioluminiscencia, que son registradas por instrumentos de imágenes de fluorescencia.
- Analice el valor en escala de grises de las bandas de proteínas utilizando un sistema de análisis de imágenes, el Método de cuantificación de bandas (para obtener información detallada sobre el sistema utilizado para analizar la densitometría de bandas, consulte Imagen de los NIH).
- Análisis estadístico
- Utilice SPSS 26.0 para el análisis estadístico. Utilice el ANOVA de un factor para comparar las medias de múltiples grupos y las pruebas de LSD-t para comparaciones por pares. Considere un valor p < 0,05 como estadísticamente significativo.
Resultados
Para evaluar el potencial terapéutico de shikonin, primero evaluamos su efecto sobre la supervivencia en ratones sépticos durante un período de 7 días. El tratamiento con shikonina mejoró las tasas de supervivencia de forma dosis-dependiente (Figura 1).
Dada la presencia generalizada de lesiones pulmonares en la sepsis, también evaluamos el edema pulmonar en ratones. El edema pulmonar se evaluó midiendo la relación entre el peso húmedo y seco (P/D) del pulmón. La relación W/D fue significativamente elevada en el grupo modelo en comparación con el grupo simulado (p < 0,05). El tratamiento con shikonin mitigó este efecto de forma dependiente de la dosis. El grupo de dosis alta mostró una reducción más sustancial del edema pulmonar que el grupo de dosis baja (p < 0,05) (Figura 2).
Para validar aún más el efecto protector de la shikonina sobre el tejido pulmonar, se realizó un análisis histopatológico. El grupo simulado mostró una estructura pulmonar normal, mientras que el grupo modelo CLP mostró un marcado daño tisular, incluyendo edema extenso, hemorragia e infiltración de células inflamatorias. De acuerdo con la reducción de la relación P/D, el tratamiento con shikonina alivió estos cambios patológicos de una manera dependiente de la dosis. Los ratones en el grupo de dosis alta mostraron significativamente menos anormalidades histopatológicas en comparación con el grupo del modelo CLP, y sus puntuaciones de patología fueron notablemente más bajas que las del grupo de dosis baja (p < 0,05; Figura 3).
Dado que tanto la inflamación como la hipoxia son los principales impulsores de la lesión pulmonar inducida por la sepsis, a continuación examinamos los niveles de expresión de proteínas clave involucradas en estas vías. El análisis de Western blot reveló que el grupo modelo CLP tenía niveles significativamente elevados de TNF-αand, IL-6 y VEGF, lo que indica una respuesta inflamatoria (Figura 4). Además, el HIF-1α y el VEGF se expresaron en gran medida en el grupo modelo, lo que confirma el aumento de la hipoxia (Figura 5). El tratamiento con shikonina redujo significativamente la expresión de estas proteínas de manera dependiente de la dosis, y el grupo de dosis alta mostró una mayor supresión de HIF-1α, VEGF, TNF-α e IL-6 en comparación con el grupo de dosis baja (p < 0,05; Figura 4 y Figura 5). Estos hallazgos moleculares respaldan aún más el papel protector de la shikonin, destacando su capacidad para modular tanto la hipoxia como la inflamación en ratones sépticos.
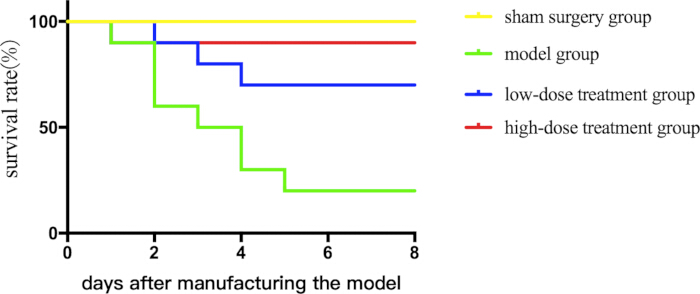
Figura 1: Comparación de las tasas de supervivencia entre diferentes grupos de ratones sépticos. Los ratones fueron agrupados y sometidos a CLP junto con el tratamiento farmacológico, y se trazaron curvas de supervivencia para registrar su estado de supervivencia. Haga clic aquí para ver una versión más grande de esta figura.
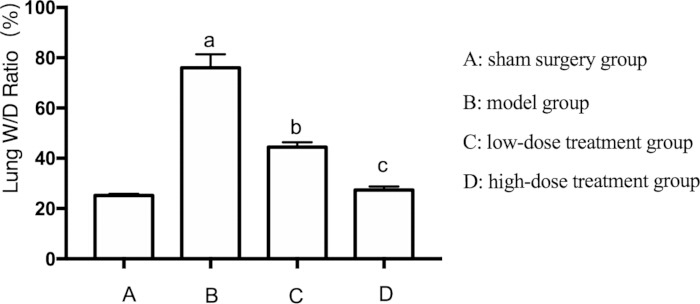
Figura 2: Efectos de Shikonin en la relación W/D pulmonar en ratones sépticos. Los ratones fueron agrupados y sometidos a CLP junto con tratamiento farmacológico durante 24 h, después de lo cual se registró la relación P/D pulmonar. AP < 0,05 en comparación con el grupo simulado, BP < 0,05 en comparación con el grupo de sepsis y CP < 0,05 en comparación con el grupo de tratamiento con dosis bajas. Las barras de error muestran la desviación estándar, se utilizó el ANOVA de un factor para comparar los valores medios de varios grupos y la prueba LSD-t para la comparación por pares. Haga clic aquí para ver una versión más grande de esta figura.
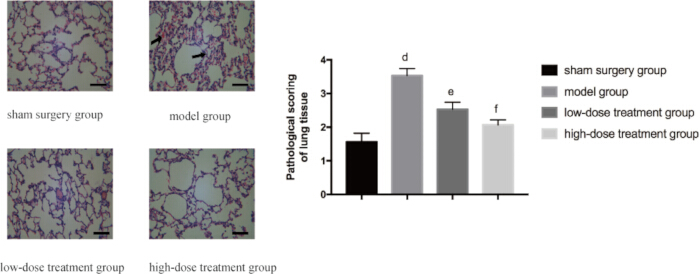
Figura 3: Cambios microscópicos en la patología del tejido pulmonar en todos los grupos. Los ratones fueron agrupados y sometidos a CLP con tratamiento farmacológico durante 24 h. A continuación, se extrajo tejido pulmonar para la tinción de HE. El panel izquierdo muestra imágenes representativas con un aumento de 400x (barra de escala = 100 μm). Se puede observar edema generalizado, sangrado e infiltración de células inflamatorias en el grupo modelo, como lo indica la flecha. En el panel derecho se presentan las puntuaciones histopatológicas correspondientes. En comparación con el grupo simulado, la diferencia fue significativa (p 0,05). Las barras de error muestran la desviación estándar, se utilizó el ANOVA de un factor para comparar los valores medios de varios grupos y la prueba LSD-t para la comparación por pares. Haga clic aquí para ver una versión más grande de esta figura.
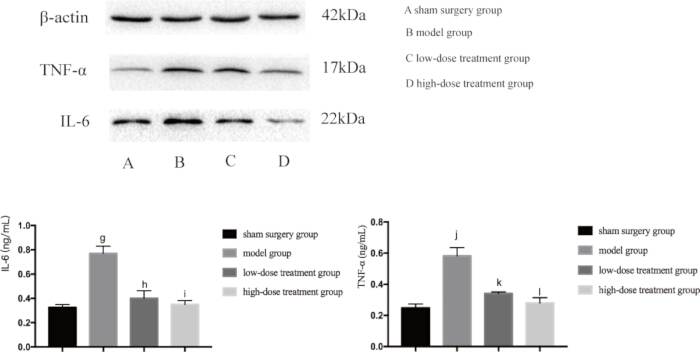
Figura 4: Niveles de expresión proteica de TNF-α e IL-6 en tejido pulmonar de ratones. Los ratones fueron agrupados y sometidos a CLP junto con tratamiento farmacológico durante 24 h, tras lo cual se detectó la expresión de las proteínas indicadas en el tejido pulmonar. En comparación con el grupo simulado, la expresión de TNF-α en el grupo modelo aumentó significativamente (gp < 0,05). En comparación con el grupo modelo, la expresión de TNF-α en el grupo de tratamiento con dosis bajas disminuyó significativamente (hp < 0,05). En comparación con el grupo de tratamiento con dosis bajas, la expresión de TNF-α en el grupo de tratamiento con dosis altas disminuyó, pero la diferencia no fue estadísticamente significativa (ip > 0,05). Además, en comparación con el grupo simulado, la expresión de IL-6 en el grupo modelo aumentó significativamente (jp < 0,05). En comparación con el grupo modelo, la expresión de IL-6 en el grupo de tratamiento con dosis bajas disminuyó significativamente (kp < 0,05). En comparación con el grupo de tratamiento con dosis bajas, la expresión de IL-6 en el grupo de tratamiento con dosis altas disminuyó, pero la diferencia no fue estadísticamente significativa (p> 0,05). Las barras de error muestran la desviación estándar, se utilizó el ANOVA de un factor para comparar los valores medios de varios grupos y la prueba LSD-t para la comparación por pares. Haga clic aquí para ver una versión más grande de esta figura.
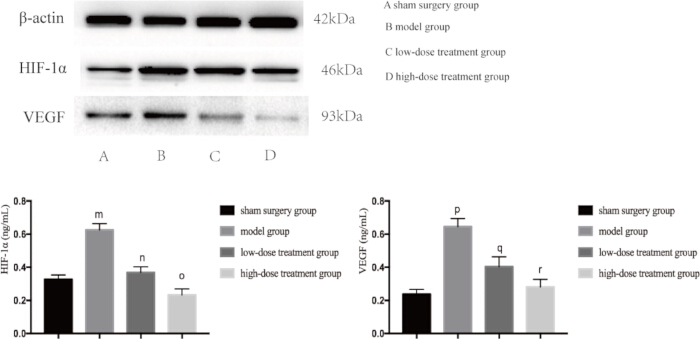
Figura 5: Niveles de expresión proteica de HIF-1α y VEGF en tejido pulmonar de ratones. Los ratones fueron agrupados y sometidos a CLP junto con tratamiento farmacológico durante 24 h, tras lo cual se detectó la expresión de las proteínas indicadas en el tejido pulmonar. En comparación con el grupo simulado, la expresión de HIF-1α en el grupo modelo aumentó significativamente (mp < 0,05). En comparación con el grupo modelo, la expresión de HIF-1α en el grupo de tratamiento con dosis bajas disminuyó significativamente (np < 0,05). En comparación con el grupo de tratamiento con dosis bajas, la expresión de HIF-1α en el grupo de tratamiento con dosis altas disminuyó, pero la diferencia no fue estadísticamente significativa (op > 0,05). Además, en comparación con el grupo simulado, la expresión de VEGF en el grupo modelo aumentó significativamente (pp < 0,05). En comparación con el grupo modelo, la expresión de VEGF en el grupo de tratamiento con dosis bajas disminuyó significativamente (qp < 0,05). En comparación con el grupo de tratamiento con dosis bajas, la expresión de VEGF en el grupo con tratamiento con dosis altas disminuyó, pero la diferencia no fue estadísticamente significativa (rp > 0,05). Las barras de error muestran la desviación estándar, se utilizó el ANOVA de un factor para comparar los valores medios de varios grupos y la prueba LSD-t para la comparación por pares. Haga clic aquí para ver una versión más grande de esta figura.
| Días | Grupo falso | Grupo de modelos | Grupo de tratamiento de dosis baja | Grupo de tratamiento de dosis alta |
| 0 | 20 | 20 | 20 | 20 |
| 1 | 20 | 20 | 20 | 20 |
| 2 | 20 | 18 | 20 | 18 |
| 3 | 20 | 12 | 18 | 18 |
| 4 | 20 | 10 | 16 | 18 |
| 5 | 20 | 6 | 14 | 18 |
| 6 | 20 | 4 | 14 | 18 |
| 7 | 20 | 4 | 14 | 18 |
Tabla 1: Tasa de supervivencia de ratones.
Discusión
Como modelo de referencia para la investigación de la sepsis, el modelo CLP es un paso clave en este experimento porque el CLP imita la complejidad de la sepsis humana mejor que muchos otros modelos. La ALI asociada a la sepsis sigue siendo un desafío clínico crítico debido a sus altas tasas de mortalidad y a la limitada efectividad de los tratamientos actuales14,15. Nuestro estudio demuestra, por primera vez, que la shikonina mejora significativamente la supervivencia en ratones sépticos al modular tanto el HIF-1α como las respuestas inflamatorias mediante la creación de un modelo CLP.
La mortalidad inducida por CLP depende de varios parámetros técnicos, como el tamaño de la aguja, la longitud del ciego ligado y el número de punciones cecales. Si la aguja es demasiado delgada o el número de agujas no es suficiente, no causará una reacción sistémica de sepsis. Si la aguja es demasiado gruesa o el número de veces que se usa la aguja es demasiado, los ratones son propensos a la muerte y no pueden continuar con el siguiente experimento. Por lo tanto, a través de repetidas modificaciones técnicas y resolución de problemas, hemos concluido que realizamos la ligadura a una distancia de aproximadamente 1 cm del extremo del ciego. Utilizamos una aguja de 21G para pinchar y ligar el extremo del ciego, y exprimimos suavemente una pequeña cantidad de contenido intestinal del sitio de la punción con pinzas oftálmicas de punta roma antes de volver a introducirlo en el ciego. Durante las 6 h postoperatorias de CLP, observe si los ratones presentan síntomas de sepsis como letargo, lentitud de movimientos, pelo erguido, secreciones oculares y diarrea. Las observaciones indican un beneficio de supervivencia dependiente de la dosis observado en el grupo de shiconina en dosis altas, lo que es consistente con investigaciones previas sobre el potencial terapéutico de la MTC en el tratamiento de la sepsis16. Es muy probable que la shikonina sirva como un valioso complemento o alternativa a las terapias actuales para la ALI inducida por sepsis 5,17.
Como mencionamos anteriormente, este modelo puede proporcionar una plataforma real de simulación del mecanismo patológico de la sepsis18. Porque puede simular características clave de la sepsis humana, incluidas múltiples infecciones bacterianas, respuestas inmunitarias dinámicas, disfunción de múltiples órganos y más. Además, el modelo CLP puede optimizar la validación y mejora de los métodos de tratamiento existentes, como la verificación de la eficacia de antibióticos, inmunomoduladores y terapias adyuvantes (como la vitamina C y la hidrocortisona), lo que ayuda a optimizar la dosis y el momento de administración. El modelo también es de gran importancia para revelar las bases biológicas de los desafíos clínicos existentes, los problemas de resistencia a los antibióticos, la estandarización de la investigación clínica traslacional, la inteligencia artificial, el análisis de big data y otros aspectos.
Las aplicaciones futuras de esta tecnología incluyen los siguientes aspectos. En primer lugar, la investigación y el desarrollo de nuevos fármacos y la validación de estrategias de tratamiento, como el posible impulso del desarrollo de terapias con histonas en el futuro. En segundo lugar, un análisis en profundidad de los mecanismos inmunitarios y las respuestas del huésped, como la ayuda en el desarrollo de terapias inmunomoduladoras, como la aplicación de inhibidores de la vía de señalización PD-1/PD-L119. En tercer lugar, la integración de la multiómica y la inteligencia artificial, como la combinación de datos generados por los modelos CLP, puede utilizarse para construir modelos predictivos de sepsis en el futuro a través del aprendizaje automático. En cuarto lugar, la exploración del microbioma y el control de infecciones. En el futuro, este modelo podría utilizarse para explorar la viabilidad de nuevas estrategias antiinfecciosas, como el trasplante de microbiota fecal y la terapia con fagos.
Aunque el modelo CLP es un método bien establecido para inducir sepsis, es posible que no reproduzca completamente la complejidad de la sepsis humana, lo que limita la generalización de nuestros hallazgos. Los estudios futuros deben incluir tamaños de muestra más grandes y explorar los efectos de la shiconina en diferentes modelos de sepsis para validar estos hallazgos. Además, una exploración más profunda de los mecanismos moleculares involucrados, incluidas las posibles interacciones con otras vías de señalización, será crucial para comprender todo el potencial terapéutico de la shikonin.
En conclusión, nuestro estudio identifica a la shiconina como un candidato prometedor para el tratamiento de la ALI inducida por sepsis a través de un modelo de ratón CLP. Al dirigirse tanto a las vías hipóxicas como a las inflamatorias, la shikonina tiene el potencial de mejorar los resultados clínicos de los pacientes con sepsis. Este trabajo no solo proporciona nuevos conocimientos sobre los mecanismos de la lesión pulmonar relacionada con la sepsis, sino que también destaca el papel potencial de la medicina tradicional china en las estrategias terapéuticas modernas.
Divulgaciones
Los autores declaran que no tienen intereses contrapuestos.
Agradecimientos
El estudio contó con el apoyo del Proyecto de Ciencia y Tecnología de Wenzhou (Y2020976).
Materiales
| Name | Company | Catalog Number | Comments |
| H&E stain kit staining kit | Solaibao Technology | G1120HE | |
| Low-temperature centrifuge | Sigma | 3K15 | |
| Microplate Reader | Bio-Rad | Model 680 | |
| rabbit monoclonal VEGF-receptor1 antibody | Abcam | ab238632 | |
| rabbit polyclonal HIF-1α antibody | Abcam | ab51608 | |
| SDS-PAGE electrophoresis system | Bio-Rad | MINI Protean2 | |
| Shikonin | MedChemExpress | HY-N0822 |
Referencias
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados