Method Article
Малоинвазивная анатомическая резекция VIII сегмента печени на основе портальной территории для лечения гепатоцеллюлярной карциномы
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этом исследовании подробно описаны методы лапароскопической сегментэктомии S8, подчеркивающие переход от частичной к анатомической резекции под руководством навигации по портальной ножке. Улучшенное 3D-понимание анатомии, отточенные минимально инвазивные навыки и владение интраоперационным ультразвуком повысили точность и безопасность процедур, сократив осложнения и оптимизировав результаты хирургической хирургии печени с помощью систематизированных протоколов анатомической резекции.
Аннотация
Гепатэктомия является основным методом лечения гепатоцеллюлярной карциномы (ГЦК) и подразделяется на анатомическую гепатэктомию и неанатомическую гепатэктомию в зависимости от объема резекции. Анатомическая гепатэктомия использует сегмент или подсегмент печени портальной территории (ПТ) в качестве основной анатомической единицы, систематически резецируя опухолевую ПТ и полностью удаляя систему Глиссона, которая снабжает и разграничивает эту область для повышения онкологической эффективности. Неанатомическая гепатэктомия следует принципу радикальной онкологической резекции, акцентируя внимание на удалении ткани печени на расстоянии более 1 см от края опухоли. С популяризацией концепций прецизионной хирургии минимально инвазивная анатомическая гепатэктомия на основе ПТ получила широкое применение. Тем не менее, минимально инвазивная резекция сегмента S8 печени по-прежнему считается одной из самых сложных резекций печени. Мы успешно выполнили анатомическую резекцию сегмента портальной территории S8 печени с использованием интраоперационного ультразвука, флуоресцентной лапароскопии и методов мембранной диссекции Ланнека, достигнув хороших краткосрочных клинических результатов.
Введение
Гепатоцеллюлярная карцинома, широко известная как рак печени, является одной из самых распространенных злокачественных опухолей в Китае. В 2022 году в Китае было зарегистрировано 367 700 новых случаев рака печени, что делает его четвертым по величине по заболеваемости; Число смертей достигло 316 500, что делает его второй по значимостипричиной смертности от рака1. Гепатэктомия предоставляет одну из лучших возможностей для долгосрочной выживаемости у пациентов с ГЦК2. Резекция печени может быть классифицирована на анатомическую резекцию печени (АР) и неанатомическую резекцию печени (НАР) в зависимости от объема резекции. АР включает в себя полную резекцию анатомически независимых сегментов печени или комбинированных сегментов вместе с паренхимой печени в пределах опухоленесущих ветвей воротной вены для достижения лучших онкологических результатов и предотвращения осложнений от остаточной ишемии или застойных участков. Преимущество АР выражается в тщательности иссечения опухоли и полном сохранении притока и оттока печеночных протоков оставшейся печени3. С другой стороны, НАР, также известная как нерегулярная резекция печени, относится к резекции ткани печени на расстоянии более 1 см от края опухоли на основе принципов онкологической радикальной резекции. Этот хирургический метод не строго придерживается анатомической сегментации печени, а подбирается в соответствии с расположением и размером опухоли, направленный на сохранение как можно большего количества нормальной ткани печени при обеспечении безопасного края для иссечения опухоли.
С развитием концепций точной хирургии и более глубоким пониманием анатомии печени, теория и практика анатомической резекции печени на основе портальной территории (PT-AR) получили признание и первоначальное продвижение впоследние годы. PT-AR включает в себя предоперационную трехмерную реконструкцию и анализ бассейна для определения опухолевой портальной территории (PT) и соответствующего планирования операции. Интраоперационно сегменты или подсегменты печени в бассейне используются в качестве основных анатомических единиц, при этом основным методом является навигация по флуоресцентному окрашиванию индоцианином зеленого (ICG), дополненная экспозицией репрезентативных межсегментарных печеночных вен (IHV). Затем печень рассекается по физиологическим трещинам для достижения полной резекции опухоленесущего портального бассейна при обеспечении целостности и функциональной сохранности будущего остатка печени (FLR). Наложенная интраоперационная пункция под ультразвуковым контролем для портального положительного окрашивания или ретроградного окрашивания после перевязки целевой ножки печени является фундаментальным техническим требованием для достижения PT-AR.
Лапароскопическая резекция печени известна своим минимально инвазивным подходом и превосходными результатами восстановления по сравнению с традиционной открытой хирургией. Однако сложность резекции разных сегментов печени варьируется. Расположение сегмента VIII печени глубоко в верхней части брюшной полости, рядом с печеночными венами и нижней полой веной, наряду с проблемой прямого доступа к глиссонной ножке сегмента VIII, делает лапароскопическую анатомическую резекцию печени особенно сложной для этого сегмента 5,6,7,8,9.
В данном исследовании показана портальная венозная регионарная анатомическая резекция сегмента печени S8 по поводу гепатоцеллюлярной карциномы. Наша цель состоит в том, чтобы подробно описать технику и ключевые этапы этой операции, включая технику лапароскопической пункции под ультразвуковым контролем и технику диссекции ножки печени на основе мембраны Lannaec. Делясь этим протоколом, мы надеемся предоставить доказательства, подтверждающие целесообразность и безопасность лапароскопической портальной венозной анатомической анатомической резекции печени при лечении гепатоцеллюлярной карциномы S8, что в конечном итоге улучшит результаты лечения пациентов.
протокол
Исследование, включающее лапароскопическую анатомическую резекцию печени для сегмента 8 (LALR-S8), придерживалось стандартных этических норм. Он получил одобрение Комитета по этике Шэньчжэньской народной больницы (LL-KY-2020462). Кроме того, от каждого пациента было получено информированное письменное согласие, гарантирующее, что исследование соответствует нормам и требованиям медицинской этики.
1. Отбор пациентов
- Используйте следующие критерии включения:
- Проводите LALR-S8 у пациентов с доброкачественными или злокачественными опухолями печени и убедитесь, что они проходят стандартные сердечно-легочные обследования, анализы крови и биохимические оценки; Убедитесь, что у них нет противопоказаний для хирургического вмешательства или анестезии.
- Выполнение предоперационной визуализации, включая КТ-ангиографию брюшной полости, трехмерную реконструкцию печени и сосудистой системы, усиленную МРТ, а также расчет остаточных и стандартных объемов печени.
- Используйте следующие критерии исключения: пациенты с функцией печени классифицируются как класс С по шкале Пью-Чайлда; тем, кто плохо переносит общий наркоз; пациенты с внутрипеченочными или внепеченочными метастазами; те, кто перенес открытую операцию; и пациенты, перенесшие сегментарную резекцию или другие комбинированные хирургические методы лечения.
2. Предоперационная подготовка, хирургическая позиция и анестезия
- Предоперационная подготовка
- Анамнез и физикальное обследование: Оцените функцию печени, профиль свертываемости крови, тест на клиренс ICG и общее состояние здоровья.
- Визуализация: Получите подробную предоперационную визуализацию (например, усиленная КТ брюшной полости, МРТ и трехмерная реконструкция печени и сосудистой системы) для определения анатомии сегмента 8 печени и ее сосудистой сети (Рисунок 1)
- Натощак: Убедитесь, что пациент придерживается инструкций натощак, как правило, начиная с полуночи за день до операции.
- Лекарства: При необходимости назначайте профилактические антибиотики и анализируйте любые лекарства, которые могут повлиять на кровотечение или функцию печени.
- Информированное согласие и обучение: Объясните лапароскопическую процедуру, включая ее методы, риски и преимущества, и получите информированное согласие.
- Хирургическое положение
- Положение лежа на спине: Расположите пациента на операционном столе в положении лежа на спине.
- Обратное положение по Тренделенбургу: слегка наклоните операционный стол, чтобы облегчить контакт и доступ к печени.
ПРИМЕЧАНИЕ: Такое положение помогает перемещать печень вверх и подальше от верхней части живота. - Стабилизация: Закрепите пациента на операционном столе, чтобы предотвратить движение во время процедуры.
- Анестезия
- Общая анестезия: Введите общую анестезию, чтобы пациент оставался без сознания и чувствовал себя комфортно на протяжении всей операции.
- Индукция и поддержание: Используйте для интубации внутривенные индукционные агенты (например, пропофол) и миорелаксанты (например, сукцинилхолин). Поддерживайте анестезию ингаляционными препаратами (например, севофлураном) и дополнительными анальгетиками (например, фентанилом). Отрегулируйте глубину анестезии, чтобы обеспечить адекватную анестезию и безопасность пациента.
- Мониторинг: Непрерывно контролируйте частоту сердечных сокращений, артериальное давление, насыщение крови кислородом и уровень углекислого газа в конце выдоха.
3. Хирургические техники
- После внутривенной ингаляционной анестезии пациента расположить в левом боковом положении на 30° с поднятием головы и разведением ног. Для резекции печени используйте пятипортовый доступ, при этом инсуффляционное давление поддерживается на уровне 11-13 мм рт.ст., центральное венозное давление на уровне 3-5 смH2O, а также применяется маневр Прингла для 10-15 минут окклюзии с последующим 5-минутным расслаблением.
- Сделайте вертикальный разрез на 2 см ниже правого края пупка, и последовательно раскройте слои брюшной стенки, чтобы получить доступ к животу. Ввести троакар 12 мм для установления пневмоперитонеума, затем ввести лапароскоп в брюшную полость.
- Разместите пять троакаров следующим образом: один 12-миллиметровый троакар в надбарабанной области для наблюдения; один троакар 5 мм у правой передней подмышечной линии; один троакар 12 мм ниже правой медиальной ключицы; один троакар 5 мм горизонтально на 2 см ниже мечевидного отростка; и один троакар диаметром 12 мм на 2 см выше пупка (рис. 2).
ПРИМЕЧАНИЕ: Общие хирургические инструменты, используемые при резекции печени, включают интраоперационное лапароскопическое ультразвуковое исследование, гармонический скальпель и биполярные устройства для свертывания. - Используйте интраоперационное лапароскопическое ультразвуковое исследование (LUS) для контроля пункции, с ICG для положительного окрашивания анатомической резекции сегмента печени S8:
- Рассечение окружающих связок и идентификация P8: Рассеките окружающие связки правой доли печени и используйте зонд LUS для определения ветви воротной вены сегмента 8 (P8), при необходимости регулируя положение прокола и угол иглы.
- Введение ультразвукового датчика и положительное окрашивание с помощью ICG: Введите лапароскопический ультразвуковой датчик BK через порт троакара 12 мм. Проколите P8 иглой для чрескожной чреспеченочной холангиографии (ЧТХ) с массой 21 G под контролем LUS. Введите 5-10 мл 1,25% ICG через иглу для окрашивания сегмента VIII, обеспечивая отсутствие ретроградного потока в соседние сегменты (Рисунок 3)
- Отрицательное окрашивание анатомической резекции сегмента печени S8 прикорневым доступом:
- Диссекция ножки печени S8: Обнажить правую переднюю часть ворот печени на основе мембраны Ланнека между воротами VI и воротами V10. Затем рассеките вдоль вентральной стороны правой передней ножки печени и по направлению к стороне головы слева, чтобы обнажить ножку печени S8; Мобилизуйте и поднимите эту ножку.
- Гемостаз и негативное окрашивание: После рассечения ворот пальцев наложите сосудистый зажим для гемостаза ножки печени S8 (Рисунок 4) и подтвердите, что ишемическая линия сегмента S8 включает опухоль. Введите 5-10 мл 1,25% ИКГ через периферическую вену. Ищите сегмент VIII, который будет очерчен флуоресценцией через 5 минут (рис. 5).
- Резекция печени под контролем флуоресцентного интерфейса: контролируйте флуоресценцию, чтобы подтвердить, что окрашенный участок покрывает опухоль. Сделайте разрезы вдоль границы раздела между флуоресцентными и нефлуоресцентными участками с помощью ультразвукового скальпеля или CUSA, сохраняя при этом межсегментарные печеночные вены (рис. 6).
ПРИМЕЧАНИЕ: Таким образом, как опухоль, так и сегмент или подсегмент печени PT могут быть полностью резецированы. - Гемостаз и осмотр: Достижение гемостаза с помощью электрокаутеризации или наложения швов после резекции поражения. Осмотрите место резекции, чтобы убедиться в отсутствии остаточного кровотечения или утечки желчи. На поперечном разрезе обратите внимание на межсегментарные жилки и конец сегмента P8 (рис. 7).
Результаты
В период с января 2022 года по декабрь 2023 года гепатэктомия сегмента S8 была выполнена в общей сложности 17 пациентам. Из них семь случаев включали неанатомические резекции, шесть случаев были анатомическими резекциями через печеночный паренхиматозный доступ, и четыре случая были анатомическими резекциями портальной территории. Не было существенных различий в предоперационных показателях по шкале Чайлд-Пью, размере опухоли и функции печеночного резерва среди групп. Время хирургического вмешательства в группе анатомической резекции ПТ было больше, чем в группах анатомической резекции и анатомической резекции с паренхиматозным доступом в печени, в первую очередь из-за относительно сложной портальной пункции или рассечения соответствующих сегментов печени, что потребовало больше времени. Не было существенных различий в интраоперационной кровопотере между группами, но пиковый уровень АЛТ после операции был ниже в группе анатомической резекции портальной территории по сравнению с двумя другими группами, вероятно, потому, что в этой группе было меньше остаточной нефункциональной ткани печени. Все хирургические края превышали 1 см, при этом в группе анатомической резекции ПТ края были больше, чем в двух других группах. Ни в коем случае не произошло утечки желчи, и не было внеплановых повторных операций. Односторонний анализ ANOVA был использован для данных подсчета, а тест ранговой суммы был использован для данных измерений. Конкретные результаты подробно описаны в таблице 1.
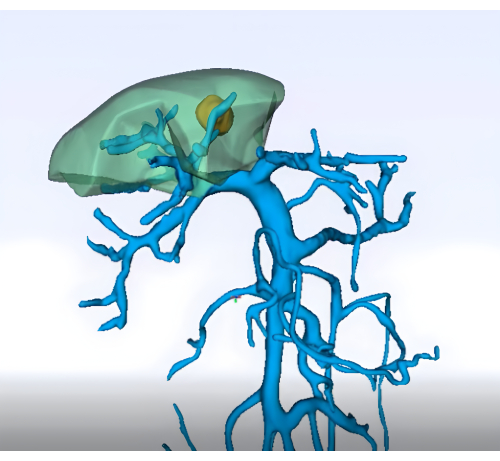
Рисунок 1: Предоперационный анализ территории воротной вены с использованием технологии трехмерной реконструкции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
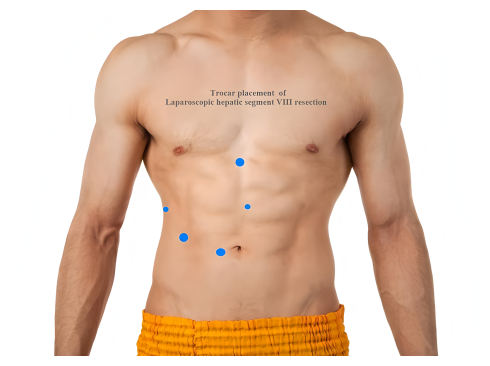
Рисунок 2: Размещение троакара при лапароскопической резекции VIII сегмента печени. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
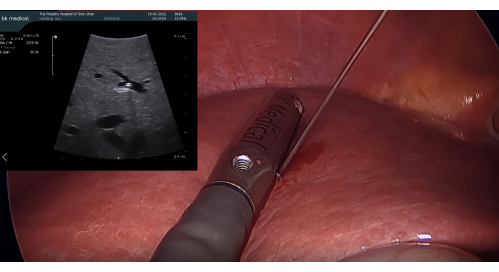
Рисунок 3: Пункция P8 иглой PTC 21 G под контролем лапароскопического ультразвукового зонда. Сокращение: PTC = чрескожная чреспеченочная холангиография. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
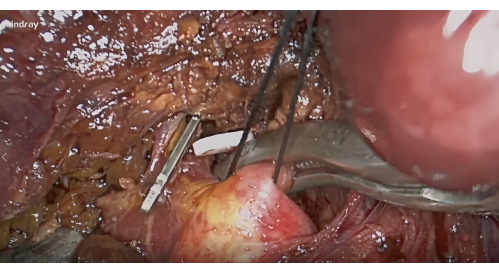
Рисунок 4: Рассечение печеночных ножок сегмента VIII вдоль мембраны Ланнека и блокада сосудистым зажимом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Разметка линии резекции после негативного окрашивания. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
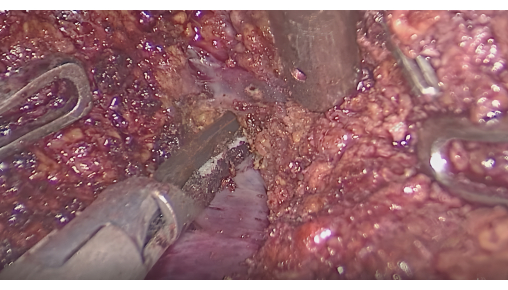
Рисунок 6: Рассечение паренхимы печени между межсегментарными венами. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
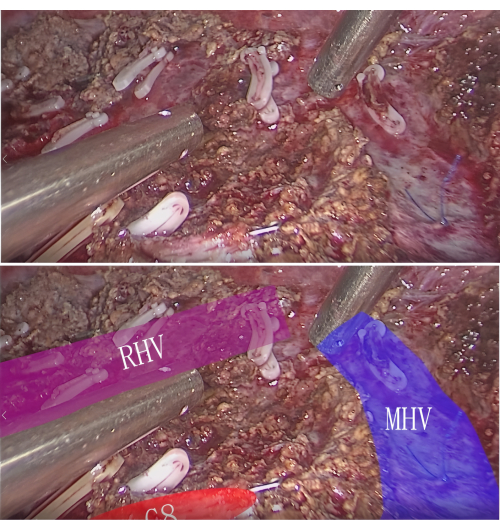
Рисунок 7: Межсегментарная вена и культя P8 в секции резекции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Неанатомическая резекция (n=7) | Анатомические резекции через паренхиматозный доступ (n=6) | анатомическая резекция портальной венозной территории (n=4) | Значение F /χ2 | p-значение | |
| Оценка по шкале Чайлд-Пью перед операцией | 5,4±0,8 | 5,2±0,4 | 5,3±0,5 | 0.306 | 0.741 |
| Размер опухоли (см) | 3.4±1.5 | 3,1±0,8 | 2,8±0,6 | 0.454 | 0.644 |
| Предоперационная ИКГ 15 мин Коэффициент удержания (%) | - | - | - | 0.195 | 0.907 |
| Время работы (мин) | 189±52 | 201±36 гг. | 268±51 | 3.826 | 0.047 |
| Кровопотеря (мл) | 228±135 | 175±52 | 170±24 | 0.716 | 0.506 |
| Минимальный хирургический край (см) | 1,3±0,5 | 1,7±0,3 | 2,0±0,4 | 3.972 | 0.043 |
| Пиковая послеоперационная АЛТ (ЕД/л) | No 328±109 | 219±45 | 152±38 | 7.045 | 0.008 |
| Уровень билирубина в послеоперационные сутки 5 суток (мкмоль/л) | 17.2±8.2 | 18.1±4.2 | 14.7±4.3 | 0.389 | 0.685 |
| Время послеоперационной выписки (сут) | 7.5±1.3 | 6,7±0,8 | 6.3±1.0 | 2.279 | 0.139 |
| Послеоперационное подтекание желчи | 0 | 0 | 0 | - | - |
| Незапланированная повторная операция | 0 | 0 | 0 | - | - |
Таблица 1: Сравнение клинических данных между различными группами.
Обсуждение
Резекция сегмента S8 печени, особенно анатомическая резекция, остается серьезной проблемой11. Теоретическая основа анатомической гепатэктомии на основе портальной ножки еще не получила широкого признания в хирургическом сообществе печени. Следовательно, гепатобилиарные хирурги продолжают собирать надежные клинические данные для объективной оценки терапевтической ценности анатомической резекции печени. Последние достижения в области анатомической реконцептуализации печеночной анатомии, особенно в отношении капсулы Лаэннека и шестисекторной теории, теоретически позволили точно идентифицировать и препарировать отдельные печеночные ножки, соответствующие определенным сегментам или подсегментам. Интеграция флуоресцентной лапароскопии и лапароскопической ультрасонографии еще больше облегчила реализацию лапароскопической анатомической гепатэктомии, позволив в режиме реального времени визуализировать территориальные границы перфузии и интраоперационную навигацию. Согласно Токийской конференции экспертов по консенсусу 2021года12, анатомическая резекция определяется как полное удаление участков печени, связанных с определенными территориями воротной вены, очерченными третичными ветвями воротной вены. Анатомическая резекция печени характеризуется полным иссечением анатомически независимых сегментов печени, подсегментов или объединенных сегментов печени11,13. По сравнению с неанатомической резекцией печени, при анатомической резекции одновременно удаляются соответствующие сегменты печени, связанные с территорией соответствующей ветви воротной вены, что теоретически снижает риск диссеминации опухоли через портальный венозный кровоток в пораженном сегменте печени и минимизирует послеоперационные осложнения. Следовательно, в настоящее время он считается предпочтительным хирургическим подходом при раке печени14.
Межсегментарная или сегментарная плоскости печени определяются границами территорий воротной вены. Печеночные вены, пересекающие эти плоскости, называются межсегментарными венами, которые служат важными ориентирами во время резекции печени, обеспечивая точную идентификацию путем непрерывного воздействия в плоскости разреза15. Этот метод требует опыта в ультразвуковой визуализации печени, умелого использования LUS и техник пункции, которые требуют обучения. Основываясь на нашем опыте, мы считаем, что умелое применение интраоперационного ультразвука имеет решающее значение для повышения успешности операции и безопасности пациента. Хирурги всех уровней должны начать с ознакомления с распознаванием и интерпретацией ультразвуковых изображений с помощью рутинных чрескожных ультразвуковых вмешательств, овладев базовыми операционными навыками. Впоследствии они должны перейти к применению ультразвука в открытых операциях, научившись использовать ультразвук для управления резекцией печени и оценки опухолей печени. Этот этап обучения углубит понимание хирургами интраоперационных анатомических структур. В конечном счете, практикующие врачи должны стремиться к освоению использования интраоперационного ультразвука в лапароскопических процедурах для достижения большей точности, особенно в ситуациях с ограниченной визуализацией. Благодаря этому постепенному процессу обучения и практики хирурги станут экспертами в использовании ультразвуковых технологий в сложных операциях, что значительно повысит безопасность и эффективность.
Метод LALR-S8 направлен на эффективное определение местоположения сосудистого кровоснабжения сегмента S8 и определение межсегментарной плоскости. Makuuchi et al. были первыми, кто предложил метод нацеливания на воротную вену под ультразвуковым контролем с последующей инъекцией красителя для уточнения перфузии опухолевого сегмента3. В 2008 году Aoki et al. впервые применили технологию флуоресцентной визуализации для локализации сегментов во время операций на печени16. В настоящее время метод флуоресцентного контроля ICG в рамках LUS стал стандартным методом повышения точности лапароскопических анатомических резекций печени17. Этот подход не только позволяет избежать видимости ишемических линий только на поверхности печени, но и позволяет в режиме реального времени визуализировать четкие флуоресцентные линии демаркации в межсегментарной плоскости. Глиссонеанский подход с флуоресцентным окрашиванием ICG позволяет проводить анатомическую резекцию печени, максимально сохраняя функциональную остаточную ткань печени и сводя к минимуму интраоперационные кровотечения.
Макуучи предположил, что анатомическая резекция печени для сегмента S8 должна включать четыре этапа: (1) маркировка границ сегмента печени на поверхности с помощью методов окрашивания или окклюзии кровотока; (2) выполнение резекции паренхимы печени под контролем ультразвука с использованием опорной вены этого сегмента печени в качестве границы; (3) достижение полного обнажения значительных вен на поверхности разреза печени; (4) лигирование системы Глиссона вблизи корня печеночного сегмента3. Ветви воротной жилки сегмента S8 в основном состоят из вентральной и дорсальной ветвей. Дорсальная ветвь сегмента S8 обычно разветвляется вблизи корня правой передней воротной вены, в то время как ветвь воротной вены сегмента S5 разветвляется на его конечной стороне, что требует отдельного прокола для вентральной и дорсальной ветвей. Между дорсальной ветвью сегмента S8 и правой передней воротной веной проходит заметная ветвь среднепеченочной вены (V8), отвечающая за венозный отток из S8. После тотальной резекции сегмента S8 на поверхности разреза можно увидеть среднюю печеночную вену, правую печеночную вену и нижнюю полую вену.
С января 2022 года по декабрь 2023 года сегментэктомия печени S8 выполнена 17 пациентам. Все пациенты выздоровели и были выписаны без каких-либо серьезных осложнений. Наш опыт в хирургии печени подчеркивает интеграцию теоретических знаний и практических навыков, особенно в детальном изучении внутрипеченочной анатомии, рекомендуя практику вскрытия с использованием трупной печени. Кроме того, мы подчеркиваем важность овладения лапароскопическими техниками посредством симуляционного обучения и участия в минимально инвазивных процедурах. Знакомство с различными эндоскопическими инструментами, такими как гармонические скальпели и интраоперационный ультразвук, имеет решающее значение. Кроме того, использование обучения на месте и хирургических разборов полетов для понимания теории и методов анатомической резекции печени имеет важное значение с акцентом на постепенное усложнение процедур и, в конечном итоге, на достижение упрощения. Не менее важны умелое применение интраоперационного ультразвука, тесное сотрудничество в рамках хирургической бригады и тщательный самоанализ эффективности хирургического вмешательства. Жизненно важен эффективный интраоперационный механизм спасения, обеспечивающий своевременный переход к открытой хирургии, когда это необходимо, и обеспечивающий поддержку со стороны старших хирургов для повышения успеха процедуры.
Исходя из нашего опыта, у нас есть следующие выводы: (1) Освойте 3D сегментарную анатомию с помощью трупной тренировки с акцентом на микродиссекцию глиссонеевой ножки. (2) Совершенствование лапароскопических навыков с помощью минимально инвазивных упражнений на основе моделирования для повышения точности инструмента. (3) Оптимизируйте энергетические устройства (ультразвуковой скальпель/флуоресценция CUSA/ICG) для безопасной паренхиматозной транссекции. (4) Внедрить мультимодальное обучение, сочетающее анализ видео и разбор случаев для оптимизации стратегии дополненной реальности. (5) Усиление командной синергии с помощью контроля CVP под руководством анестезиолога и квалифицированной хирургической помощи. (6) Разработать протоколы спасения, определяющие пороги открытой конверсии и пути эскалации старших хирургов.
Тем не менее, это исследование имеет некоторые ограничения, так как включает в себя всего несколько случаев. Кроме того, исследование является ретроспективным, и отбор пациентов ограничен. Необходимы более точно спланированные проспективные исследования для дальнейшего сравнения преимуществ и недостатков различных минимально инвазивных методов резекции печени. Мы поделимся своим опытом оперативно после получения более достоверных данных.
Раскрытие информации
Авторы не имеют конфликта интересов или финансовых связей, которые можно было бы раскрыть.
Благодарности
Эта работа была поддержана грантами проекта Фонда фундаментальных и прикладных фундаментальных исследований провинции Гуандун (No 2023A1515220114); Крупный проект по науке и технике Шэньчжэньской муниципальной комиссии по науке и технологическим инновациям (No KJZD20230923114120038), Шэньчжэньский фонд строительства ключевых медицинских дисциплин (No SZXK015); а также проект строительства ключевых клинических специальностей провинции Гуандун и национальный проект строительства ключевых клинических специальностей.
Материалы
| Name | Company | Catalog Number | Comments |
| Bipolar electric coagulation forceps | Mindray | Seal 7 | For blood vessel coagulation and division |
| Fluorescence Endoscopic camera system | Mindray | R1 | An endoscopic camera system with 4K fluorescence imaging |
| Intraoperative Ultrasonic imaging system | ALOKA | UST-5418 | With the four-directional flexible linear array ultrasonic laparoscopic transducer, the intraoperative ultrasound support ultrasonic elastography, contrast ultrasound, and magnetic navigation guided puncture |
| Intraoperative Ultrasonic imaging system | Mindray | LAP13-4Cs | Four-directional flexible linear array ultrasonic laparoscopic transducer which supports support ultrasonic elastography and contrast ultrasound |
| SPSS 20.0 | statistical analysis software | ||
| Ultrasonic scalpel | Johnson & Johnson | ETHICON GEN11 | For blood vessel coagulation and division |
Ссылки
- Zheng, R. S., et al. Cancer incidence and mortality in China, 2022. Chinese Journal of Oncology. 46 (3), 221-231 (2024).
- Qin, S. Primary liver cancer diagnosis and treatment Expert Panel of the Chinese Ministry of Health Guidelines on the diagnosis and treatment of primary liver cancer (2011 edition). Chin Clin Oncol. 1 (1), 10(2012).
- Makuuchi, M., Hasegawa, H., Yamazaki, S. Ultrasonically guided subsegmentectomy. Surg Gynecol Obstet. 161 (4), 346-350 (1985).
- Wang, X., Cao, J., Li, J. Anatomic liver resection based on portal territory with margin priority for hepatocellular carcinoma. JAMA Surg. 159 (6), 710-711 (2024).
- Urade, T., et al. Laparoscopic anatomical liver resection using indocyanine green fluorescence imaging. Asian J Surg. 43 (1), 362-368 (2020).
- Fuks, D., Aldrighetti, L., Jiao, L. R., Wakabayashi, G., Limongelli, P. Laparoscopic management of hepatocellular carcinoma: A critical reappraisal. Surg Laparosc Endosc Percutan Tech. 27 (4), 203-205 (2017).
- Morimoto, M., et al. Minimally invasive anatomic liver resection: Results of a survey of world experts. J Hepatobiliary Pancreat Sci. 29 (1), 33-40 (2022).
- Goh, E. L., Chidambaram, S., Ma, S. Laparoscopic vs open hepatectomy for hepatocellular carcinoma in patients with cirrhosis: A meta-analysis of the long-term survival outcomes. Int J Surg. 50, 35-42 (2018).
- Ban, D., et al. A novel difficulty scoring system for laparoscopic liver resection. J Hepatobiliary Pancreat Sci. 21 (10), 745-753 (2014).
- Sugioka, A., Kato, Y., Tanahashi, Y. Systematic extrahepatic Glissonean pedicle isolation for anatomical liver resection based on Laennec's capsule: proposal of a novel comprehensive surgical anatomy of the liver. J Hepatobiliary Pancreat Sci. 24 (1), 17-23 (2017).
- Xie, Q., Gao, F. A commentary on 'approaches of laparoscopic anatomical liver resection of segment 8 for hepatocellular carcinoma: a retrospective cohort study of short-term results at multiple centers in China'. Int J Surg. 111 (1), 1646-1647 (2023).
- Ciria, R., et al. Study group of Precision Anatomy for Minimally Invasive Hepato-Biliary-Pancreatic surgery (PAM-HBP surgery). A snapshot of the 2020 conception of anatomic liver resections and their applicability on minimally invasive liver surgery. A preparatory survey for the Expert Consensus Meeting on Precision Anatomy for Minimally Invasive HBP Surgery. J Hepatobiliary Pancreat Sci. 29 (1), 41-50 (2022).
- Morimoto, M., et al. and Study group of Precision Anatomy for Minimally Invasive Hepato-Biliary-Pancreatic surgery (PAM-HBP surgery). Glissonean approach for hepatic inflow control in minimally invasive anatomic liver resection: A systematic review. J Hepatobiliary Pancreat Sci. 29 (1), 51-65 (2022).
- Fuks, D., Aldrighetti, L., Jiao, L. R., Wakabayashi, G., Limongelli, P. Laparoscopic management of hepatocellular carcinoma: A critical reappraisal. Surg Laparosc Endosc Percutan Tech. 27 (4), 203-205 (2017).
- Monden, K., et al. Landmarks and techniques to perform minimally invasive liver surgery: A systematic review with a focus on hepatic outflow. J Hepatobiliary Pancreat Sci. 29 (1), 66-81 (2022).
- Kang, L. -M., Zhang, F. -W., Yu, F. -K., Xu, L. Pay attention to the application of indocyanine green fluorescence imaging technology in laparoscopic liver cancer resection. World J Clin Cases. 12 (23), 5288-5293 (2024).
- Cassinotti, E., et al. European Association for Endoscopic Surgery (EAES) consensus on Indocyanine Green (ICG) fluorescence-guided surgery. Surg Endosc. 37 (3), 1629-1648 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены