Method Article
Resección anatómica mínimamente invasiva del segmento VIII hepático basada en el territorio portal para tratar el carcinoma hepatocelular
* Estos autores han contribuido por igual
En este artículo
Resumen
En este estudio se detallan las técnicas de segmentectomía laparoscópica S8, haciendo hincapié en la transición de la resección parcial a la anatómica guiada por la navegación del pedículo portal. La comprensión anatómica 3D mejorada, las habilidades mínimamente invasivas refinadas y el dominio de la ecografía intraoperatoria mejoraron la precisión y la seguridad del procedimiento, reduciendo las complicaciones y optimizando los resultados quirúrgicos hepáticos a través de protocolos de resección anatómica sistematizados.
Resumen
La hepatectomía es el tratamiento primario para el carcinoma hepatocelular (CHC) y se clasifica en hepatectomía anatómica y hepatectomía no anatómica según la extensión de la resección. La hepatectomía anatómica utiliza el segmento o subsegmento hepático del territorio portal (TP) como unidad anatómica básica, resecando sistemáticamente el TP portador de tumor y eliminando completamente el sistema de Glisson que irriga y delimita esta área para mejorar la eficacia oncológica. La hepatectomía no anatómica sigue el principio de la resección oncológica radical, haciendo hincapié en la extirpación del tejido hepático a más de 1 cm del margen tumoral. Con la popularización de los conceptos de cirugía de precisión, se ha aplicado ampliamente la hepatectomía anatómica mínimamente invasiva basada en fisioterapia. Sin embargo, la resección mínimamente invasiva del segmento S8 del hígado todavía se considera una de las resecciones hepáticas más desafiantes. Realizamos con éxito una resección anatómica del segmento S8 del territorio portal del hígado mediante ecografía intraoperatoria, laparoscopia fluorescente y disección de membrana de Lannaec, logrando buenos resultados clínicos a corto plazo.
Introducción
El carcinoma hepatocelular, comúnmente conocido como cáncer de hígado, es uno de los tumores malignos más comunes en China. En 2022, hubo 367.700 nuevos casos de cáncer de hígado en China, lo que lo convierte en el cuarto más alto en términos de incidencia; El número de muertes alcanzó las 316.500, lo que la convierte en la segunda causa de muerte relacionada con el cáncer1. La hepatectomía proporciona una de las mejores oportunidades de supervivencia a largo plazo en los pacientes con CHC2. La resección hepática se puede clasificar en resección hepática anatómica (AR) y resección hepática no anatómica (NAR) según la extensión de la resección. La RA implica la resección completa de segmentos hepáticos anatómicamente independientes o segmentos combinados, junto con el parénquima hepático dentro de las ramas de la vena porta portadoras de tumores, para lograr mejores resultados oncológicos y evitar complicaciones de áreas isquémicas o congestionadas residuales. La ventaja de la RA se refleja en la minuciosidad de la extirpación tumoral y en la preservación completa de los conductos hepáticos de entrada y salida del hígado remanente3. Por otro lado, la NAR, también conocida como resección hepática irregular, se refiere a la resección del tejido hepático a más de 1 cm del margen tumoral basada en los principios de la resección radical oncológica. Este método quirúrgico no se adhiere estrictamente a la segmentación anatómica del hígado, sino que se adapta de acuerdo con la ubicación y el tamaño del tumor, con el objetivo de preservar la mayor cantidad posible de tejido hepático normal y garantizar un margen seguro para la extirpación del tumor.
Con el avance de los conceptos de cirugía de precisión y una comprensión más profunda de la anatomía del hígado, la teoría y la práctica de la resección anatómica hepática basada en el territorio portal (PT-AR) han ganado reconocimiento y promoción inicial en los últimos años4. La PT-AR implica la reconstrucción tridimensional preoperatoria y el análisis de la cuenca para identificar el territorio portal (TP) portador del tumor y planificar la cirugía en consecuencia. Intraoperatoriamente, los segmentos o subsegmentos hepáticos dentro de la cuenca se utilizan como unidades anatómicas básicas, siendo la navegación con tinción fluorescente con verde de indocianina (ICG) el método principal, complementado con la exposición de venas hepáticas intersegmentarias (IHV) representativas. A continuación, se disecciona el hígado a lo largo de las fisuras fisiológicas para lograr la resección completa de la cuenca porta tumoral, al tiempo que se garantiza la integridad y la preservación funcional del futuro remanente hepático (FLR). La punción guiada por ultrasonido intraoperatoria superpuesta para la tinción portal positiva o retrógrada después de la ligadura del pedículo hepático diana es un requisito técnico fundamental para lograr la PT-AR.
La resección hepática laparoscópica es reconocida por su enfoque mínimamente invasivo y sus resultados de recuperación superiores en comparación con la cirugía abierta tradicional. Sin embargo, la complejidad de la resección de diferentes segmentos hepáticos varía. La localización del segmento VIII del hígado en la parte superior del abdomen, cerca de las venas hepáticas y la vena cava inferior, junto con el desafío de acceder directamente al pedículo glissoniano del segmento VIII, hace que la resección anatómica laparoscópica del hígado sea particularmente desafiante para este segmento 5,6,7,8,9.
Este estudio demuestra la resección anatómica regional venosa portal del segmento hepático S8 para el carcinoma hepatocelular. Nuestro objetivo es detallar la técnica y los pasos clave de esta cirugía, incluyendo la técnica de punción laparoscópica guiada por ecografía y la técnica de disección pedicular, hepática basada en la membrana de Lannaec. Al compartir este protocolo, esperamos proporcionar evidencia que respalde la viabilidad y seguridad de la resección hepática regional regional venosa portal laparoscópica en el tratamiento del carcinoma hepatocelular S8, mejorando en última instancia los resultados del tratamiento del paciente.
Protocolo
El estudio de resección anatómica hepática laparoscópica para el segmento 8 (LALR-S8) se ha adherido a las prácticas éticas estándar. Recibió la aprobación del Comité de Ética del Hospital Popular de Shenzhen (LL-KY-2020462). Además, se obtuvo el consentimiento informado por escrito de cada paciente, asegurando que la investigación cumple con las normas y requisitos de ética médica.
1. Selección de pacientes
- Utilice los siguientes criterios de inclusión:
- Realizar LALR-S8 en pacientes con tumores hepáticos benignos o malignos y asegurarse de que se sometan a evaluaciones cardiopulmonares, análisis de sangre y evaluaciones bioquímicas estándar; Asegúrese de que no tengan contraindicaciones para la cirugía o la anestesia.
- Realizar imágenes preoperatorias, incluida la angiografía por tomografía computarizada abdominal, la reconstrucción tridimensional del hígado y la vasculatura, y la resonancia magnética mejorada, así como cálculos de los volúmenes hepáticos residuales y estándar.
- Utilice los siguientes criterios de exclusión: pacientes con función hepática clasificada como Clase C de Pugh-Child; los que no pueden tolerar la anestesia general; pacientes con metástasis intrahepáticas o extrahepáticas; los que se han sometido a una cirugía abierta; y pacientes que han recibido resecciones segmentarias u otros tratamientos quirúrgicos combinados.
2. Preparación preoperatoria, posición quirúrgica y anestesia
- Preparación preoperatoria
- Anamnología y examen físico: evalúe la función hepática, el perfil de coagulación, la prueba de depuración de ICG y el estado de salud general.
- Diagnóstico por imágenes: Obtener imágenes preoperatorias detalladas (p. ej., tomografía computarizada abdominal mejorada, resonancia magnética y reconstrucción tridimensional del hígado y la vasculatura) para delinear la anatomía del segmento 8 del hígado y su vasculatura (Figura 1)
- Ayuno: Asegúrese de que el paciente se adhiera a las instrucciones de ayuno, generalmente a partir de la medianoche del día anterior a la cirugía.
- Medicamentos: Administre antibióticos profilácticos si es necesario y revise cualquier medicamento que pueda afectar el sangrado o la función hepática.
- Consentimiento informado y educación: Explique el procedimiento laparoscópico, incluidos sus métodos, riesgos y beneficios, y obtenga el consentimiento informado.
- Posición quirúrgica
- Posición supina: Coloque al paciente en la mesa de operaciones en posición supina.
- Posición de Trendelenburg inversa: Incline ligeramente la mesa de operaciones para facilitar la exposición y el acceso al hígado.
NOTA: Esta posición ayuda a mover el hígado hacia arriba y lejos de la parte superior del abdomen. - Estabilización: Asegure al paciente a la mesa de operaciones para evitar que se mueva durante el procedimiento.
- Anestesia
- Anestesia general: Administre anestesia general para garantizar que el paciente permanezca inconsciente y cómodo durante toda la cirugía.
- Inducción y mantenimiento: Use agentes de inducción intravenosa (por ejemplo, propofol) y relajantes musculares (por ejemplo, succinilcolina) para la intubación. Mantenga la anestesia con agentes inhalados (por ejemplo, sevoflurano) y analgésicos complementarios (por ejemplo, fentanilo). Ajuste la profundidad de la anestesia para garantizar una anestesia adecuada y la seguridad del paciente.
- Monitoreo: Controle continuamente la frecuencia cardíaca, la presión arterial, la saturación de oxígeno en sangre y los niveles de dióxido de carbono al final de la espiración.
3. Técnicas quirúrgicas
- Después de la anestesia inhalatoria intravenosa, coloque al paciente en una posición de decúbito lateral izquierdo de 30° con la cabeza elevada y las piernas separadas. Utilice un abordaje de cinco puertos para la resección hepática, con una presión de insuflación mantenida en 11-13 mmHg, presión venosa central en 3-5 cmH2O, y la maniobra de Pringle aplicada durante 10-15 min de oclusión seguida de una liberación de 5 min.
- Realice una incisión vertical 2 cm por debajo del borde derecho del ombligo y abra las capas de la pared abdominal secuencialmente para acceder al abdomen. Inserte un trocar de 12 mm para establecer el neumoperitoneo, luego introduzca el laparoscopio en la cavidad abdominal.
- Coloque cinco trócares de la siguiente manera: un trócar de 12 mm en la región suprumbilical para su observación; un trocar de 5 mm en la línea axilar anterior derecha; un trócar de 12 mm por debajo de la clavícula medial derecha; un trocar de 5 mm horizontalmente 2 cm por debajo de la apófisis xifoides; y un trocar de 12 mm a 2 cm por encima del ombligo (Figura 2).
NOTA: Los instrumentos quirúrgicos comunes utilizados en la resección hepática incluyen ultrasonido laparoscópico intraoperatorio, bisturí armónico y dispositivos de coagulación bipolar. - Utilice la ecografía laparoscópica intraoperatoria (LUS) para guiar la punción, con ICG para la tinción positiva de la resección anatómica del segmento hepático S8:
- Disección de los ligamentos circundantes e identificación de P8: Diseccione los ligamentos circundantes del lóbulo hepático derecho y utilice la sonda LUS para identificar la rama de la vena porta para el segmento 8 (P8), ajustando la posición de punción y el ángulo de la aguja según sea necesario.
- Inserción de la sonda de ultrasonido y tinción positiva con ICG: Inserte la sonda de ultrasonido laparoscópica BK a través del puerto de trocar de 12 mm. Punción del P8 con una aguja de colangiografía transhepática percutánea (CTP) de 21 G guiada por el LUS. Inyecte 5-10 mL de ICG al 1,25% a través de la aguja para teñir el segmento VIII, asegurándose de que no haya flujo retrógrado en los segmentos adyacentes (Figura 3)
- Tinción negativa de la resección anatómica del segmento hepático S8 por vía hiliare:
- Disección del pedículo hepático S8: exponer el hilio hepático anterior derecho basado en la membrana de Lannaec entre la puerta VI y la puerta V10. Luego, diseccionar a lo largo del lado ventral del pedículo hepático anterior derecho y hacia el lado cefálico a la izquierda para exponer el pedículo hepático S8; movilizar y levantar este pedículo.
- Hemostasia y tinción negativa: Tras la disección del hilio, aplicar pinza vascular para la hemostasia del pedículo hepático S8 (Figura 4) y confirmar la línea isquémica del segmento S8 para incluir el tumor. Inyectar 5-10 mL de ICG al 1,25% a través de la vena periférica. Busque el segmento VIII que será delineado por la fluorescencia después de 5 min (Figura 5).
- Resección hepática guiada por interfaz fluorescente: controle la fluorescencia para confirmar que el área teñida cubre el tumor. Realice incisiones a lo largo de la interfaz entre las áreas fluorescentes y no fluorescentes utilizando un bisturí ultrasónico o CUSA, mientras se preservan las venas hepáticas intersegmentarias (Figura 6).
NOTA: Tanto el tumor como el segmento o subsegmento hepático del TP se pueden resecar completamente de esta manera. - Hemostasia e inspección: Lograr la hemostasia mediante electrocauterización o sutura después de la resección de la lesión. Inspeccione el sitio de la resección para confirmar que no haya sangrado residual ni fugas de bilis. En la sección transversal, observe las venas intersegmentarias y el extremo del segmento P8 (Figura 7).
Resultados
Entre enero de 2022 y diciembre de 2023, un total de 17 pacientes se sometieron a hepatectomía del segmento S8. De estos, siete casos involucraron resecciones no anatómicas, seis casos fueron resecciones anatómicas por abordaje del parénquima hepático y cuatro casos fueron resecciones anatómicas del territorio portal. No hubo diferencias significativas en las puntuaciones de Child-Pugh preoperatorias, el tamaño del tumor y la función de reserva hepática entre los grupos. El tiempo quirúrgico para el grupo de resección anatómica con TP fue más largo que para los grupos de resección no anatómica y resección anatómica con abordaje del parénquima hepático, principalmente debido a la punción portal relativamente difícil o la disección de los segmentos hepáticos correspondientes, que requirió más tiempo. No hubo diferencias significativas en la pérdida de sangre intraoperatoria entre los grupos, pero el nivel máximo de ALT después de la operación fue menor en el grupo de resección anatómica del territorio portal en comparación con los otros dos grupos, probablemente porque este grupo tenía menos tejido hepático residual no funcional. Todos los márgenes quirúrgicos superaron 1 cm, y el grupo de resección anatómica con TP tuvo márgenes más grandes que los otros dos grupos. En ningún caso, se produjo ninguna fuga de bilis y no hubo reintervenciones no planificadas. Se empleó el análisis de ANOVA de un factor para los datos de recuento, y se utilizó la prueba de suma de rangos para los datos de medición. Los resultados específicos se detallan en la Tabla 1.
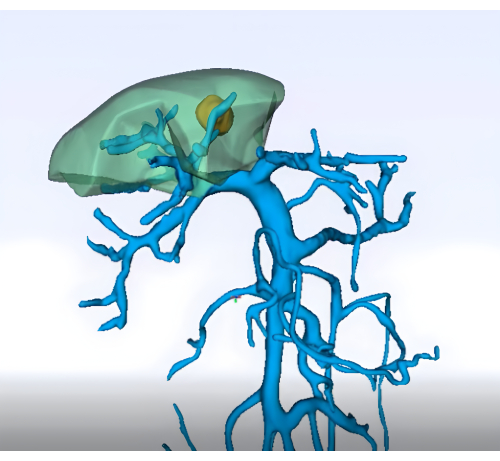
Figura 1: Análisis preoperatorio del territorio de la vena porta mediante tecnología de reconstrucción tridimensional. Haga clic aquí para ver una versión más grande de esta figura.
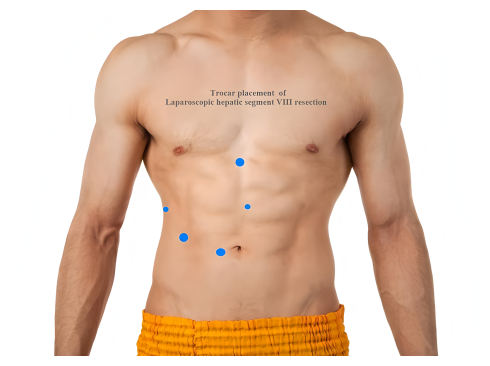
Figura 2: Colocación del trócar en la resección laparoscópica del segmento VIII hepático. Haga clic aquí para ver una versión más grande de esta figura.
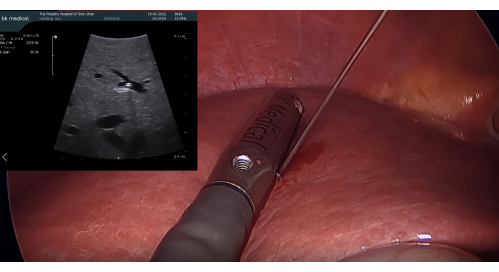
Figura 3: Punción de P8 con una aguja PTC de 21 G guiada por la sonda de ecografía laparoscópica. Abreviatura: PTC = colangiografía transhepática percutánea. Haga clic aquí para ver una versión más grande de esta figura.
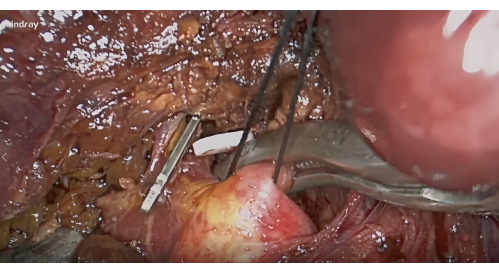
Figura 4: Disección de los pedículos hepáticos del segmento VIII a lo largo de la membrana de Lannaec y bloqueo con pinza vascular. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Marcando la línea de resección después de la tinción negativa. Haga clic aquí para ver una versión más grande de esta figura.
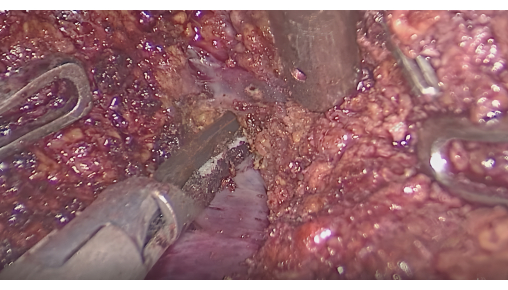
Figura 6: Disección del parénquima hepático entre venas intersegmentarias. Haga clic aquí para ver una versión más grande de esta figura.
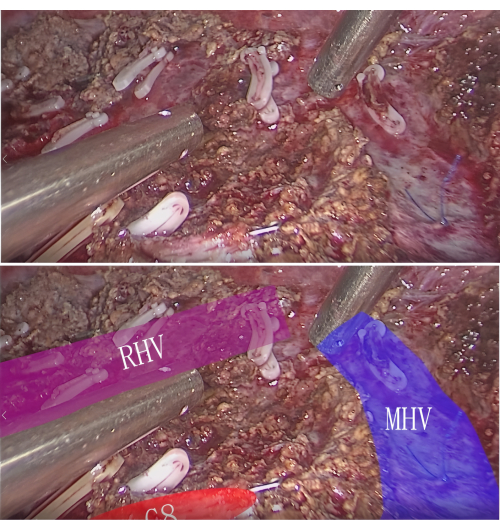
Figura 7: Vena intersegmentaria y el muñón P8 en la sección de resección. Haga clic aquí para ver una versión más grande de esta figura.
| Resección no anatómica (n=7) | Resecciones anatómicas mediante abordaje parenquimatoso (n=6) | Resección anatómica basada en el territorio venoso portal (n=4) | Valor F /χ2 | Valor p | |
| Puntuación preoperatoria de Child-Pugh | 5,4±0,8 | 5,2±0,4 | 5,3±0,5 | 0.306 | 0.741 |
| Tamaño del tumor (cm) | 3.4±1.5 | 3.1±0.8 | 2.8±0.6 | 0.454 | 0.644 |
| Tasa de retención de ICG preoperatorio a 15 min (%) | - | - | - | 0.195 | 0.907 |
| Tiempo de funcionamiento (min) | 189±52 | 201±36 | 268±51 | 3.826 | 0.047 |
| Pérdida de sangre (mL) | 228±135 | 175±52 | 170±24 | 0.716 | 0.506 |
| Margen quirúrgico mínimo (cm) | 1.3±0.5 | 1,7±0,3 | 2.0±0.4 | 3.972 | 0.043 |
| Pico de ALT postoperatorio (U/L) | 328±109 | 219±45 | 152±38 | 7.045 | 0.008 |
| Niveles de bilirrubina en el día 5 postoperatorio (μmol/L) | 17.2±8.2 | 18.1±4.2 | 14.7±4.3 | 0.389 | 0.685 |
| Tiempo de alta postoperatoria (días) | 7.5±1.3 | 6,7±0,8 | 6.3±1.0 | 2.279 | 0.139 |
| Fuga de bilis postoperatoria | 0 | 0 | 0 | - | - |
| Reoperación no planificada | 0 | 0 | 0 | - | - |
Tabla 1: Comparación de datos clínicos entre diferentes grupos.
Discusión
La resección del segmento S8 del hígado, en particular la resección anatómica, sigue siendo un desafío importante11. La base teórica de la hepatectomía anatómica basada en el pedículo portal aún no ha obtenido una aceptación generalizada dentro de la comunidad quirúrgica hepática. En consecuencia, los cirujanos hepatobiliares continúan buscando evidencia clínica sólida para evaluar objetivamente el valor terapéutico de la resección anatómica del hígado. Los avances recientes en la reconceptualización de la anatomía hepática, particularmente con respecto a la cápsula de Laennec y la teoría de los seis sectores, han permitido teóricamente la identificación y disección precisas de pedículos hepáticos individuales correspondientes a segmentos o subsegmentos específicos. La integración de la laparoscopia fluorescente y la ecografía laparoscópica ha facilitado aún más la realización de la hepatectomía anatómica laparoscópica, permitiendo la visualización en tiempo real de los límites de perfusión territorial y la navegación intraoperatoria. Según la conferencia de consenso de expertos de Tokio de 202112, la resección anatómica se define como la extirpación completa de porciones hepáticas asociadas con territorios específicos de la vena porta, delineadas por ramas terciarias de la vena porta. La resección anatómica del hígado se caracteriza por la extirpación completa de segmentos, subsegmentos o segmentos combinados del hígado anatómicamente independientes11,13. En comparación con la resección hepática no anatómica, la resección anatómica extirpa simultáneamente los segmentos hepáticos correspondientes asociados con el territorio de la rama de la vena porta relevante, lo que teóricamente reduce el riesgo de diseminación tumoral a través del flujo sanguíneo venoso portal en el segmento hepático afectado y minimiza las complicaciones posoperatorias. En consecuencia, actualmente se considera el abordaje quirúrgico preferido para el cáncer de hígado14.
Los planos intersegmentarios o segmentarios del hígado están determinados por los límites de los territorios de la vena porta. Las venas hepáticas que atraviesan estos planos se denominan venas intersegmentarias, que sirven como puntos de referencia importantes durante la resección hepática, lo que permite una identificación precisa a través de la exposición continua en el plano de corte15. Este método requiere experiencia en imágenes de ultrasonido hepático, uso competente de LUS y técnicas de punción, que requieren una curva de aprendizaje. Basándonos en nuestra experiencia, la aplicación experta de la ecografía intraoperatoria es crucial para mejorar las tasas de éxito quirúrgico y la seguridad del paciente. Los cirujanos de todos los niveles deben comenzar por familiarizarse con el reconocimiento y la interpretación de imágenes de ultrasonido a través de intervenciones de ultrasonido percutáneo de rutina, dominando las habilidades operativas básicas. Posteriormente, deben progresar a la aplicación de la ecografía en cirugías abiertas, aprendiendo a utilizar la ecografía para guiar las resecciones hepáticas y evaluar los tumores hepáticos. Esta fase de formación reforzará la comprensión de los cirujanos sobre las estructuras anatómicas intraoperatorias. En última instancia, los profesionales deben tratar de dominar el uso de la ecografía intraoperatoria en los procedimientos laparoscópicos para lograr una mayor precisión, especialmente en situaciones con visualización limitada. A través de este proceso gradual de aprendizaje y práctica, los cirujanos se convertirán en expertos en el empleo de la tecnología de ultrasonido en cirugías complejas, mejorando significativamente tanto la seguridad como la eficacia.
La técnica LALR-S8 tiene como objetivo localizar eficazmente el suministro vascular al segmento S8 y definir el plano intersegmentario. Makuuchi et al. fueron los primeros en proponer un método para dirigirse a la vena porta bajo la guía ecográfica, seguido de la inyección de colorante para clarificar la perfusión del segmento tumoral3. En 2008, Aoki et al. fueron pioneros en la aplicación de la tecnología de imágenes de fluorescencia para la localización de segmentos durante la cirugía hepática16. En la actualidad, el método guiado por fluorescencia ICG bajo LUS se ha convertido en una técnica estándar para mejorar la precisión de las resecciones hepáticas anatómicas laparoscópicas17. Este enfoque no solo aborda la limitación de las líneas isquémicas que solo son visibles en la superficie del hígado, sino que también proporciona una visualización en tiempo real de líneas de demarcación fluorescentes claras en el plano intersegmentario. El enfoque glissoniano con tinción de fluorescencia ICG permite la resección anatómica del hígado al tiempo que maximiza la preservación del tejido hepático residual funcional y minimiza el sangrado intraoperatorio.
Makuuchi propuso que la resección anatómica del hígado para el segmento S8 debería incluir cuatro pasos: (1) marcar los límites del segmento hepático en la superficie utilizando técnicas de tinción u oclusión de flujo sanguíneo; (2) realizar una resección del parénquima hepático guiada por ecografía, utilizando la vena emblemática de ese segmento hepático como límite; (3) lograr la exposición completa de venas significativas en la superficie de corte del hígado; (4) ligar el sistema de Glisson cerca de la raíz del segmento hepático3. Las ramas de la vena porta para el segmento S8 consisten principalmente en las ramas ventral y dorsal. La rama dorsal del segmento S8 generalmente se bifurca cerca de la raíz de la vena porta anterior derecha, mientras que la rama de la vena porta del segmento S5 se bifurca en su lado terminal, lo que requiere tinción de punción separada para las ramas ventral y dorsal. Hay una rama prominente de la vena hepática media (V8) que corre entre la rama dorsal del segmento S8 y la vena porta anterior derecha, responsable del drenaje venoso de S8. Después de la resección total del segmento S8, se pueden ver la vena hepática media, la vena hepática derecha y la vena cava inferior en la superficie cortada.
De enero de 2022 a diciembre de 2023, un total de 17 pacientes se sometieron a segmentectomía hepática S8. Todos los pacientes se recuperaron y fueron dados de alta sin mayores complicaciones. Nuestra experiencia en cirugía hepática enfatiza la integración de conocimientos teóricos y habilidades prácticas, particularmente en el aprendizaje detallado de la anatomía intrahepática, recomendando la práctica de disección con hígados cadavéricos. Además, destacamos la importancia de dominar las técnicas laparoscópicas a través de la formación en simulación y la participación en procedimientos mínimamente invasivos. La familiaridad con diversos instrumentos endoscópicos, como los bisturíes armónicos y la ecografía intraoperatoria, es crucial. Además, es esencial aprovechar la capacitación in situ y los informes quirúrgicos para comprender la teoría y las técnicas de la resección anatómica del hígado, con un enfoque en el aumento gradual de la complejidad del procedimiento y, en última instancia, lograr la simplificación. La aplicación competente de la ecografía intraoperatoria, la estrecha colaboración dentro del equipo quirúrgico y la autoevaluación exhaustiva del rendimiento quirúrgico son igualmente críticas. Es vital contar con un mecanismo de rescate intraoperatorio eficaz, que garantice la conversión oportuna a cirugía abierta cuando sea necesario y asegure el apoyo de los cirujanos superiores para mejorar el éxito del procedimiento.
A partir de nuestra experiencia, tenemos las siguientes percepciones: (1) Dominar la anatomía segmentaria en 3D mediante formación cadavérica centrada en la microdisección del pedículo glissoniano. (2) Perfeccione las habilidades laparoscópicas a través de simulacros mínimamente invasivos basados en simulación para la precisión del instrumento. (3) Optimizar los dispositivos de energía (bisturí ultrasónico / CASO SA / Fluorescencia ICG) para una transección parenquimatosa segura. (4) Implementar el aprendizaje multimodal, combinando análisis de video y sesiones informativas de casos para la optimización de la estrategia de RA. (5) Mejorar la sinergia del equipo con el control de la CVP gestionado por el anestesiólogo y la asistencia quirúrgica competente. (6) Establecer protocolos de rescate que definan los umbrales de conversión abiertos y las vías de escalamiento del cirujano senior.
Sin embargo, este estudio tiene algunas limitaciones, ya que involucra solo unos pocos casos. Además, el estudio es retrospectivo y la selección de pacientes es limitada. Se necesitan estudios prospectivos diseñados con mayor precisión para comparar mejor las ventajas y desventajas de las diferentes técnicas de resección hepática mínimamente invasivas. Compartiremos nuestras experiencias con prontitud una vez que obtengamos datos más confiables.
Divulgaciones
Los autores no tienen conflictos de intereses ni vínculos financieros que revelar.
Agradecimientos
Este trabajo fue apoyado por subvenciones del Proyecto del Fondo Provincial de Investigación Básica y Básica Aplicada de Guangdong (No. 2023A1515220114); el Proyecto Principal de Ciencia y Tecnología de la Comisión Municipal de Innovación Científica y Tecnológica de Shenzhen, (No.KJZD20230923114120038), Fondo de Construcción de Disciplina Médica Clave de Shenzhen (No.SZXK015); y el Proyecto de Construcción de Especialidades Clínicas Clave Provinciales y Nacionales de Guangdong y el Proyecto de Construcción de Especialidades Clínicas Clave Nacionales.
Materiales
| Name | Company | Catalog Number | Comments |
| Bipolar electric coagulation forceps | Mindray | Seal 7 | For blood vessel coagulation and division |
| Fluorescence Endoscopic camera system | Mindray | R1 | An endoscopic camera system with 4K fluorescence imaging |
| Intraoperative Ultrasonic imaging system | ALOKA | UST-5418 | With the four-directional flexible linear array ultrasonic laparoscopic transducer, the intraoperative ultrasound support ultrasonic elastography, contrast ultrasound, and magnetic navigation guided puncture |
| Intraoperative Ultrasonic imaging system | Mindray | LAP13-4Cs | Four-directional flexible linear array ultrasonic laparoscopic transducer which supports support ultrasonic elastography and contrast ultrasound |
| SPSS 20.0 | statistical analysis software | ||
| Ultrasonic scalpel | Johnson & Johnson | ETHICON GEN11 | For blood vessel coagulation and division |
Referencias
- Zheng, R. S., et al. Cancer incidence and mortality in China, 2022. Chinese Journal of Oncology. 46 (3), 221-231 (2024).
- Qin, S. Primary liver cancer diagnosis and treatment Expert Panel of the Chinese Ministry of Health Guidelines on the diagnosis and treatment of primary liver cancer (2011 edition). Chin Clin Oncol. 1 (1), 10(2012).
- Makuuchi, M., Hasegawa, H., Yamazaki, S. Ultrasonically guided subsegmentectomy. Surg Gynecol Obstet. 161 (4), 346-350 (1985).
- Wang, X., Cao, J., Li, J. Anatomic liver resection based on portal territory with margin priority for hepatocellular carcinoma. JAMA Surg. 159 (6), 710-711 (2024).
- Urade, T., et al. Laparoscopic anatomical liver resection using indocyanine green fluorescence imaging. Asian J Surg. 43 (1), 362-368 (2020).
- Fuks, D., Aldrighetti, L., Jiao, L. R., Wakabayashi, G., Limongelli, P. Laparoscopic management of hepatocellular carcinoma: A critical reappraisal. Surg Laparosc Endosc Percutan Tech. 27 (4), 203-205 (2017).
- Morimoto, M., et al. Minimally invasive anatomic liver resection: Results of a survey of world experts. J Hepatobiliary Pancreat Sci. 29 (1), 33-40 (2022).
- Goh, E. L., Chidambaram, S., Ma, S. Laparoscopic vs open hepatectomy for hepatocellular carcinoma in patients with cirrhosis: A meta-analysis of the long-term survival outcomes. Int J Surg. 50, 35-42 (2018).
- Ban, D., et al. A novel difficulty scoring system for laparoscopic liver resection. J Hepatobiliary Pancreat Sci. 21 (10), 745-753 (2014).
- Sugioka, A., Kato, Y., Tanahashi, Y. Systematic extrahepatic Glissonean pedicle isolation for anatomical liver resection based on Laennec's capsule: proposal of a novel comprehensive surgical anatomy of the liver. J Hepatobiliary Pancreat Sci. 24 (1), 17-23 (2017).
- Xie, Q., Gao, F. A commentary on 'approaches of laparoscopic anatomical liver resection of segment 8 for hepatocellular carcinoma: a retrospective cohort study of short-term results at multiple centers in China'. Int J Surg. 111 (1), 1646-1647 (2023).
- Ciria, R., et al. Study group of Precision Anatomy for Minimally Invasive Hepato-Biliary-Pancreatic surgery (PAM-HBP surgery). A snapshot of the 2020 conception of anatomic liver resections and their applicability on minimally invasive liver surgery. A preparatory survey for the Expert Consensus Meeting on Precision Anatomy for Minimally Invasive HBP Surgery. J Hepatobiliary Pancreat Sci. 29 (1), 41-50 (2022).
- Morimoto, M., et al. and Study group of Precision Anatomy for Minimally Invasive Hepato-Biliary-Pancreatic surgery (PAM-HBP surgery). Glissonean approach for hepatic inflow control in minimally invasive anatomic liver resection: A systematic review. J Hepatobiliary Pancreat Sci. 29 (1), 51-65 (2022).
- Fuks, D., Aldrighetti, L., Jiao, L. R., Wakabayashi, G., Limongelli, P. Laparoscopic management of hepatocellular carcinoma: A critical reappraisal. Surg Laparosc Endosc Percutan Tech. 27 (4), 203-205 (2017).
- Monden, K., et al. Landmarks and techniques to perform minimally invasive liver surgery: A systematic review with a focus on hepatic outflow. J Hepatobiliary Pancreat Sci. 29 (1), 66-81 (2022).
- Kang, L. -M., Zhang, F. -W., Yu, F. -K., Xu, L. Pay attention to the application of indocyanine green fluorescence imaging technology in laparoscopic liver cancer resection. World J Clin Cases. 12 (23), 5288-5293 (2024).
- Cassinotti, E., et al. European Association for Endoscopic Surgery (EAES) consensus on Indocyanine Green (ICG) fluorescence-guided surgery. Surg Endosc. 37 (3), 1629-1648 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados