Method Article
Résection anatomique mini-invasive du segment VIII du foie basée sur le territoire porte pour traiter le carcinome hépatocellulaire
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cette étude détaille les techniques de segmentectomie laparoscopique S8, en mettant l’accent sur la transition de la résection partielle à la résection anatomique guidée par la navigation du pédicule porte. Une meilleure compréhension anatomique 3D, des compétences mini-invasives raffinées et la maîtrise de l’échographie peropératoire ont amélioré la précision et la sécurité des procédures, réduisant les complications tout en optimisant les résultats de la chirurgie hépatique grâce à des protocoles de résection anatomique systématisés.
Résumé
L’hépatectomie est le traitement principal du carcinome hépatocellulaire (CHC) et est classée en hépatectomie anatomique et hépatectomie non anatomique en fonction de l’étendue de la résection. L’hépatectomie anatomique utilise le segment ou le sous-segment du foie du territoire porte (TP) comme unité anatomique de base, réséquant systématiquement le PT porteur de la tumeur et supprimant complètement le système Glisson qui alimente et délimite cette zone pour améliorer l’efficacité oncologique. L’hépatectomie non anatomique suit le principe de la résection oncologique radicale, en mettant l’accent sur l’ablation du tissu hépatique à plus de 1 cm de la marge tumorale. Avec la popularisation des concepts de chirurgie de précision, l’hépatectomie anatomique mini-invasive basée sur les PT a été largement appliquée. Cependant, la résection mini-invasive du segment S8 du foie reste considérée comme l’une des résections hépatiques les plus difficiles. Nous avons réalisé avec succès une résection anatomique du segment du territoire porte S8 du foie à l’aide d’échographies peropératoires, de laparoscopies fluorescentes et de techniques de dissection membranaire de Lannaec, obtenant de bons résultats cliniques à court terme.
Introduction
Le carcinome hépatocellulaire, communément appelé cancer du foie, est l’une des tumeurs malignes les plus courantes en Chine. En 2022, il y a eu 367 700 nouveaux cas de cancer du foie en Chine, ce qui en fait le quatrième plus élevé en termes d’incidence ; Le nombre de décès a atteint 316 500, ce qui en fait la deuxième cause de décès liés au cancer1. L’hépatectomie offre l’une des meilleures opportunités de survie à long terme chez les patients atteints de CHC2. La résection hépatique peut être classée en résection hépatique anatomique (RA) et résection hépatique non anatomique (NAR) en fonction de l’étendue de la résection. L’AR implique la résection complète de segments hépatiques anatomiquement indépendants ou de segments combinés, ainsi que du parenchyme hépatique dans les branches de la veine porte porteuse de la tumeur, afin d’obtenir de meilleurs résultats oncologiques et d’éviter les complications dues aux zones ischémiques résiduelles ou congestionnées. L’avantage de l’AR se reflète dans la minutie de l’excision tumorale et la préservation complète des canaux hépatiques d’entrée et de sortie du foie restant3. D’autre part, la NAR, également connue sous le nom de résection hépatique irrégulière, fait référence à la résection du tissu hépatique à plus de 1 cm de la marge tumorale basée sur les principes de la résection radicale oncologique. Cette méthode chirurgicale n’adhère pas strictement à la segmentation anatomique du foie, mais est adaptée en fonction de l’emplacement et de la taille de la tumeur, visant à préserver autant de tissu hépatique normal que possible tout en assurant une marge de sécurité pour l’excision de la tumeur.
Avec l’avancement des concepts de chirurgie de précision et une compréhension plus approfondie de l’anatomie du foie, la théorie et la pratique de la résection anatomique du foie basée sur le territoire porte (PT-AR) ont gagné en reconnaissance et en promotion initiale au cours des dernières années4. La PT-AR implique une reconstruction tridimensionnelle préopératoire et une analyse du bassin pour identifier le territoire porte porteur de la tumeur (TP) et planifier la chirurgie en conséquence. En peropératoire, les segments ou sous-segments hépatiques du bassin sont utilisés comme unités anatomiques de base, la navigation par coloration par fluorescence au vert d’indocyanine (ICG) étant la méthode principale, complétée par l’exposition des veines hépatiques intersegmentaires représentatives (IHV). Le foie est ensuite disséqué le long de fissures physiologiques pour réaliser une résection complète du bassin porte porteur de la tumeur tout en assurant l’intégrité et la préservation fonctionnelle du futur résidu hépatique (FLR). La ponction peropératoire superposée guidée par échographie pour la coloration porte positive ou la coloration rétrograde après ligature du pédicule hépatique cible est une exigence technique fondamentale pour la réalisation de la PT-AR.
La résection hépatique laparoscopique est reconnue pour son approche peu invasive et ses résultats de récupération supérieurs par rapport à la chirurgie ouverte traditionnelle. Cependant, la complexité de la résection des différents segments hépatiques varie. L’emplacement du segment VIII du foie profondément dans la partie supérieure de l’abdomen, près des veines hépatiques et de la veine cave inférieure, ainsi que le défi d’accéder directement au pédicule glissonéen du segment VIII, rendent la résection hépatique anatomique laparoscopique particulièrement difficile pour ce segment5, 6, 7, 8, 9.
Cette étude met en évidence la résection anatomique régionale veineuse porte du segment hépatique S8 pour le carcinome hépatocellulaire. Notre objectif est de détailler la technique et les étapes clés de cette chirurgie, y compris la technique de ponction guidée par échographie laparoscopique et la technique de dissection hépatique pédiculaire basée sur la membrane de Lannaec. En partageant ce protocole, nous espérons fournir des preuves à l’appui de la faisabilité et de l’innocuité de la résection hépatique anatomique régionale veineuse porte laparoscopique dans le traitement du carcinome hépatocellulaire S8, améliorant ainsi les résultats du traitement des patients.
Protocole
L’étude portant sur la résection anatomique du foie par laparoscopie pour le segment 8 (LALR-S8) a respecté les pratiques éthiques standard. Il a reçu l’approbation du Comité d’éthique de l’Hôpital populaire de Shenzhen (LL-KY-2020462). De plus, un consentement écrit éclairé a été obtenu de chaque patient, garantissant que la recherche est conforme aux normes et exigences de l’éthique médicale.
1. Sélection des patients
- Utilisez les critères d’inclusion suivants :
- Effectuer LALR-S8 sur des patients atteints de tumeurs hépatiques bénignes ou malignes et s’assurer qu’ils subissent des évaluations cardiopulmonaires standard, des tests sanguins et des évaluations biochimiques ; Assurez-vous qu’ils n’ont pas de contre-indications à la chirurgie ou à l’anesthésie.
- Effectuer l’imagerie préopératoire, y compris l’angiographie par tomodensitométrie abdominale, la reconstruction tridimensionnelle du foie et du système vasculaire, l’IRM améliorée, ainsi que les calculs des volumes hépatiques résiduels et standard.
- Utilisez les critères d’exclusion suivants : patients dont la fonction hépatique est classée dans la classe C de Pugh-Child ; ceux qui ne peuvent pas tolérer l’anesthésie générale ; patients présentant des métastases intrahépatiques ou extrahépatiques ; ceux qui ont subi une chirurgie ouverte ; et les patients qui ont reçu des résections segmentaires ou d’autres traitements chirurgicaux combinés.
2. Préparation préopératoire, position chirurgicale et anesthésie
- Préparation préopératoire
- Anamnèse et examen physique : Évaluer la fonction hépatique, le profil de coagulation, le test de clairance de l’ICG et l’état de santé général.
- Imagerie : Obtenir une imagerie préopératoire détaillée (p. ex., TDM abdominale améliorée, IRM et reconstruction tridimensionnelle du foie et du système vasculaire) pour délimiter l’anatomie du segment 8 du foie et son système vasculaire (figure 1)
- Jeûne : Assurez-vous que le patient respecte les instructions de jeûne, généralement à partir de minuit la veille de la chirurgie.
- Médicaments : Administrez des antibiotiques prophylactiques si nécessaire et passez en revue tous les médicaments qui pourraient avoir un impact sur les saignements ou la fonction hépatique.
- Consentement éclairé et éducation : Expliquez la procédure laparoscopique, y compris ses méthodes, ses risques et ses avantages, et obtenez un consentement éclairé.
- Position chirurgicale
- Position couchée : Positionnez le patient sur la table d’opération en position couchée.
- Position de Trendelenburg inversée : Inclinez légèrement la table d’opération pour faciliter l’exposition et l’accès au foie.
REMARQUE : Cette position aide à déplacer le foie vers le haut et loin de la partie supérieure de l’abdomen. - Stabilisation : Fixez le patient à la table d’opération pour l’empêcher de bouger pendant la procédure.
- Anesthésie
- Anesthésie générale : Administrer une anesthésie générale pour s’assurer que le patient reste inconscient et confortable tout au long de la chirurgie.
- Induction et entretien : Utiliser des agents d’induction intraveineuse (par exemple, le propofol) et des relaxants musculaires (par exemple, la succinylcholine) pour l’intubation. Maintenez l’anesthésie avec des agents inhalés (par exemple, le sévoflurane) et des analgésiques supplémentaires (par exemple, le fentanyl). Ajustez la profondeur de l’anesthésie pour assurer une anesthésie adéquate et la sécurité du patient.
- Surveillance : Surveillez en permanence la fréquence cardiaque, la pression artérielle, la saturation en oxygène du sang et les niveaux de dioxyde de carbone en fin d’expiration.
3. Techniques chirurgicales
- Après une anesthésie par inhalation intraveineuse, positionnez le patient dans une position de décubitus latéral gauche à 30°, avec élévation de la tête et jambes séparées. Utilisez une approche à cinq voies pour la résection hépatique, avec une pression d’insufflation maintenue à 11-13 mmHg, une pression veineuse centrale à 3-5 cmH2O, et la manœuvre de Pringle appliquée pendant 10-15 min d’occlusion suivie d’un relâchement de 5 min.
- Faites une incision verticale à 2 cm sous le bord droit de l’ombilic et ouvrez les couches de la paroi abdominale séquentiellement pour accéder à l’abdomen. Insérez un trocart de 12 mm pour établir le pneumopéritoine, puis introduisez le laparoscope dans la cavité abdominale.
- Placez cinq trocarts comme suit : un trocart de 12 mm dans la région suprumbilicale pour l’observation ; un trocart de 5 mm à la ligne axillaire antérieure droite ; un trocart de 12 mm sous la clavicule médiale droite ; un trocart de 5 mm horizontalement à 2 cm au-dessous de l’apophyse xiphoïde ; et un trocart de 12 mm à 2 cm au-dessus de l’ombilic (figure 2).
REMARQUE : Les instruments chirurgicaux couramment utilisés dans la résection du foie comprennent l’échographie laparoscopique peropératoire, le scalpel harmonique et les appareils de coagulation bipolaire. - Utilisez l’échographie laparoscopique peropératoire (LUS) pour guider la ponction, avec l’ICG pour une coloration positive de la résection anatomique du segment hépatique S8 :
- Dissection des ligaments environnants et identification de P8 : Disséquez les ligaments environnants du lobe hépatique droit et utilisez la sonde LUS pour identifier la branche de la veine porte du segment 8 (P8), en ajustant la position de ponction et l’angle de l’aiguille si nécessaire.
- Insertion de la sonde à ultrasons et coloration positive avec ICG : Insérez la sonde à ultrasons laparoscopique BK par l’orifice du trocart de 12 mm. Perforez le P8 avec une aiguille de cholangiographie transhépatique percutanée (CTP) de 21 G guidée par le LUS. Injecter 5 à 10 mL d’ICG à 1,25 % à travers l’aiguille pour colorer le segment VIII, en veillant à ce qu’il n’y ait pas d’écoulement rétrograde dans les segments adjacents (figure 3)
- Coloration négative de la résection anatomique du segment hépatique S8 par l’approche hilaire :
- Dissection du pédicule hépatique S8 : Exposer le hile hépatique antérieur droit à l’aide de la membrane de Lannaec entre la porte VI et la porte V10. Ensuite, disséquez le long de la face ventrale du pédicule hépatique antérieur droit et vers le côté céphalique à gauche pour exposer le pédicule hépatique S8 ; Mobiliser et soulever ce pédicule.
- Hémostase et coloration négative : Après dissection du hile, appliquez une pince vasculaire pour l’hémostase du pédicule hépatique S8 (Figure 4) et confirmez que la ligne ischémique du segment S8 inclut la tumeur. Injecter 5 à 10 ml d’ICG à 1,25 % par la veine périphérique. Recherchez le segment VIII qui sera délimité par la fluorescence après 5 min (Figure 5).
- Résection hépatique guidée par interface fluorescente : Surveiller la fluorescence pour confirmer que la zone colorée recouvre la tumeur. Faites des incisions le long de l’interface entre les zones fluorescentes et non fluorescentes à l’aide d’un scalpel à ultrasons ou d’un CUSA, tout en préservant les veines hépatiques intersegmentaires (Figure 6).
REMARQUE : La tumeur et le segment ou sous-segment hépatique PT peuvent être complètement réséqués de cette manière. - Hémostase et inspection : Réaliser l’hémostase par électrocautérisation ou suture après résection de la lésion. Inspectez le site de résection pour confirmer qu’il n’y a pas de saignement résiduel ou de fuite de bile. Sur la coupe, observez les nervures intersegmentaires et l’extrémité du segment P8 (Figure 7).
Résultats
Entre janvier 2022 et décembre 2023, un total de 17 patients ont subi une hépatectomie du segment S8. Parmi ceux-ci, sept cas impliquaient des résections non anatomiques, six cas étaient des résections anatomiques par voie parenchymateuse hépatique et quatre cas étaient des résections anatomiques du territoire porte. Il n’y avait pas de différences significatives dans les scores préopératoires de Child-Pugh, la taille de la tumeur et la fonction de la réserve hépatique entre les groupes. Le temps chirurgical pour le groupe de résection anatomique par TP était plus long que celui des groupes de résection anatomique non anatomique et de résection anatomique par voie parenchymateuse hépatique, principalement en raison de la ponction porte ou de la dissection relativement difficile des segments hépatiques correspondants, qui nécessitait plus de temps. Il n’y avait pas de différences significatives dans la perte de sang peropératoire entre les groupes, mais le taux maximal d’ALT postopératoire était plus faible dans le groupe de résection anatomique du territoire porte par rapport aux deux autres groupes, probablement parce que ce groupe avait moins de tissu hépatique non fonctionnel résiduel. Toutes les marges chirurgicales dépassaient 1 cm, le groupe de résection anatomique par PT ayant des marges plus grandes que les deux autres groupes. Il n’y a eu aucune fuite de bile dans tous les cas, et il n’y a pas eu de réopérations imprévues. L’analyse ANOVA à un facteur a été utilisée pour les données de comptage, et le test de somme de rang a été utilisé pour les données de mesure. Les résultats spécifiques sont détaillés dans le tableau 1.
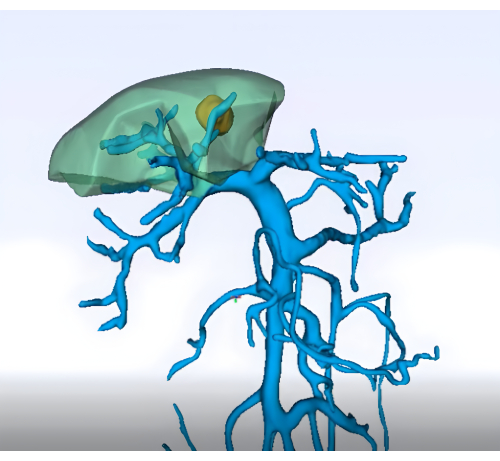
Figure 1 : Analyse préopératoire du territoire de la veine porte à l’aide d’une technologie de reconstruction tridimensionnelle.Veuillez cliquer ici pour voir une version agrandie de cette figure.
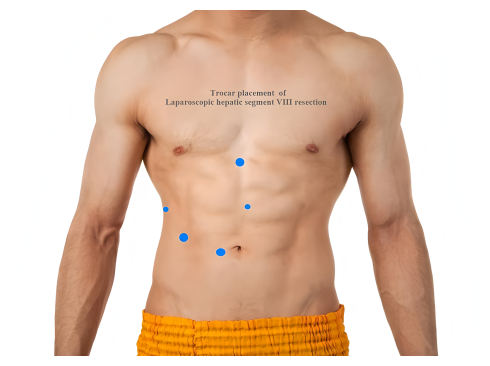
Figure 2 : Placement du trocart de la résection laparoscopique du segment hépatique VIII. Veuillez cliquer ici pour voir une version agrandie de cette figure.
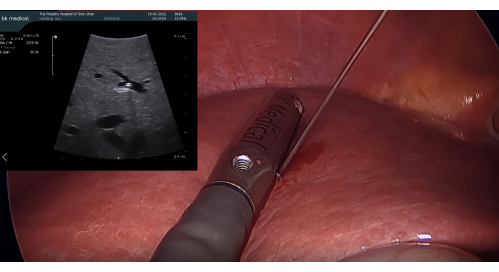
Figure 3 : Ponction de P8 avec une aiguille PTC de 21 G guidée par la sonde à ultrasons laparoscopique. Abréviation : PTC = cholangiographie transhépatique percutanée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
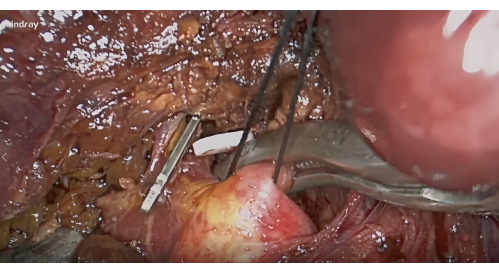
Figure 4 : Dissection des pédicules hépatiques du segment VIII le long de la membrane de Lannaec et blocage par clamp vasculaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Marquage de la ligne de résection après une coloration négative. Veuillez cliquer ici pour voir une version agrandie de cette figure.
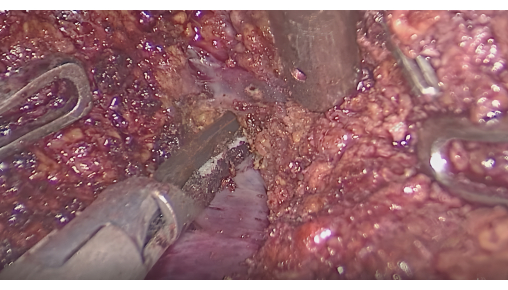
Figure 6 : Dissection du parenchyme hépatique entre les veines intersegmentaires. Veuillez cliquer ici pour voir une version agrandie de cette figure.
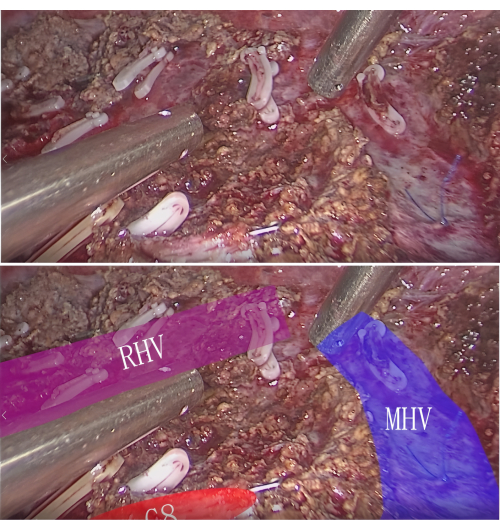
Figure 7 : La veine intersegmentaire et le moignon P8 dans la coupe de résection. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Résection non anatomique (n = 7) | Résections anatomiques par voie parenchymateuse (n=6) | Résection anatomique basée sur le territoire veineux porte (n = 4) | Valeur F/χ2 | Valeur p | |
| Score de Child-Pugh préopératoire | 5.4±0.8 | 5.2±0.4 | 5,3±0,5 | 0.306 | 0.741 |
| Taille de la tumeur (cm) | 3.4±1.5 | 3.1±0.8 | 2,8±0,6 | 0.454 | 0.644 |
| Taux de rétention préopératoire ICG 15 min ( %) | - | - | - | 0.195 | 0.907 |
| Temps de fonctionnement (min) | 189±52 | 201±36 | 268±51 | 3.826 | 0.047 |
| Perte de sang (mL) | 228±135 | 175±52 | 170±24 | 0.716 | 0.506 |
| Marge chirurgicale minimale (cm) | 1,3±0,5 | 1,7±0,3 | 2,0±0,4 | 3.972 | 0.043 |
| Pic postopératoire ALT (U/L) | 328±109 | 219±45 | 152±38 | 7.045 | 0.008 |
| 5e jour postopératoire taux de bilirubine (μmol/L) | 17.2±8.2 | 18.1±4.2 | 14.7±4.3 | 0.389 | 0.685 |
| Temps de sortie postopératoire (jours) | 7.5±1.3 | 6,7±0,8 | 6.3±1.0 | 2.279 | 0.139 |
| Fuite biliaire postopératoire | 0 | 0 | 0 | - | - |
| Réopération non planifiée | 0 | 0 | 0 | - | - |
Tableau 1 : Comparaison des données cliniques entre différents groupes.
Discussion
La résection du segment S8 du foie, en particulier la résection anatomique, reste un défi important11. La base théorique de l’hépatectomie anatomique basée sur le pédicule porte n’a pas encore été largement acceptée par la communauté chirurgicale hépatique. Par conséquent, les chirurgiens hépatobiliaires continuent de rechercher des preuves cliniques solides pour évaluer objectivement la valeur thérapeutique de la résection hépatique anatomique. Les progrès récents dans la reconceptualisation de l’anatomie hépatique, en particulier en ce qui concerne la capsule de Laennec et la théorie des six secteurs, ont théoriquement permis l’identification et la dissection précises de pédicules hépatiques individuels correspondant à des segments ou sous-segments spécifiques. L’intégration de la laparoscopie fluorescente et de l’échographie laparoscopique a encore facilité la réalisation de l’hépatectomie anatomique laparoscopique, permettant la visualisation en temps réel des limites de perfusion territoriale et la navigation peropératoire. Selon la conférence de consensus d’experts de Tokyo de 202112, la résection anatomique est définie comme l’ablation complète de parties hépatiques associées à des territoires spécifiques de la veine porte, délimités par des branches tertiaires de la veine porte. La résection hépatique anatomique se caractérise par l’excision complète de segments, de sous-segments ou de segments combinés du foie anatomiquement indépendants11,13. Par rapport à la résection hépatique non anatomique, la résection anatomique enlève simultanément les segments hépatiques correspondants associés au territoire de la branche de la veine porte concernée, réduisant théoriquement le risque de dissémination de la tumeur par le flux sanguin veineux porte dans le segment hépatique affecté et minimisant les complications postopératoires. Par conséquent, il est actuellement considéré comme l’approche chirurgicale privilégiée pour le cancer du foie14.
Les plans intersegmentaires ou segmentaires du foie sont déterminés par les limites des territoires de la veine porte. Les veines hépatiques traversant ces plans sont appelées veines intersegmentaires, qui servent de points de repère importants lors de la résection du foie, permettant une identification précise grâce à une exposition continue au plan de coupe15. Cette méthode nécessite une expertise en imagerie par échographie hépatique, une utilisation compétente de LUS et des techniques de ponction, qui nécessitent une courbe d’apprentissage. D’après notre expérience, l’application qualifiée de l’échographie peropératoire est cruciale pour améliorer les taux de réussite chirurgicale et la sécurité des patients. Les chirurgiens de tous les niveaux doivent commencer par se familiariser avec la reconnaissance et l’interprétation de l’imagerie échographique par le biais d’interventions échographiques percutanées de routine, en maîtrisant les compétences opérationnelles de base. Par la suite, ils devraient progresser vers l’application de l’échographie dans les chirurgies ouvertes, en apprenant à utiliser les ultrasons pour guider les résections hépatiques et évaluer les tumeurs hépatiques. Cette phase de formation renforcera la compréhension des structures anatomiques peropératoires par les chirurgiens. En fin de compte, les praticiens devraient viser à maîtriser l’utilisation de l’échographie peropératoire dans les procédures laparoscopique afin d’obtenir une plus grande précision, en particulier dans les situations où la visualisation est limitée. Grâce à ce processus d’apprentissage et de pratique progressif, les chirurgiens deviendront aptes à utiliser la technologie des ultrasons dans des chirurgies complexes, améliorant ainsi considérablement l’innocuité et l’efficacité.
La technique LALR-S8 vise à localiser efficacement l’approvisionnement vasculaire pour segmenter S8 et définir le plan intersegmentaire. Makuuchi et al. ont été les premiers à proposer une méthode de ciblage de la veine porte sous guidage échographique, suivie d’une injection de colorant pour clarifier la perfusion du segmenttumoral 3. En 2008, Aoki et al. ont été les pionniers de l’application de la technologie d’imagerie par fluorescence pour la localisation de segments lors d’une chirurgie hépatique16. À l’heure actuelle, la méthode guidée par fluorescence ICG sous LUS est devenue une technique standard pour améliorer la précision des résections hépatiques anatomiques laparoscopique17. Cette approche permet non seulement de résoudre la limitation des lignes ischémiques visibles uniquement à la surface du foie, mais aussi de visualiser en temps réel des lignes de démarcation fluorescentes claires sur le plan intersegmentaire. L’approche glissonienne avec coloration par fluorescence ICG permet une résection anatomique du foie tout en maximisant la préservation du tissu hépatique résiduel fonctionnel et en minimisant les saignements peropératoires.
Makuuchi a proposé que la résection anatomique du foie pour le segment S8 comprenne quatre étapes : (1) marquer les limites du segment hépatique à la surface à l’aide de techniques de coloration ou d’occlusion du flux sanguin ; (2) effectuer une résection du parenchyme hépatique guidée par échographie, en utilisant la veine de repère de ce segment hépatique comme limite ; (3) l’exposition complète des veines importantes à la surface du foie coupé ; (4) ligature du système Glisson près de la racine du segmenthépatique 3. Les branches de la veine porte du segment S8 sont principalement constituées des branches ventrale et dorsale. La branche dorsale du segment S8 bifurque généralement près de la racine de la veine porte antérieure droite, tandis que la branche de la veine porte du segment S5 bifurque sur son côté terminal, nécessitant une coloration par ponction distincte pour les branches ventrale et dorsale. Il existe une branche proéminente de la veine hépatique moyenne (V8) entre la branche dorsale du segment S8 et la veine porte antérieure droite, responsable du drainage veineux de S8. Après la résection totale du segment S8, la veine hépatique moyenne, la veine hépatique droite et la veine cave inférieure peuvent être observées à la surface de la coupe.
De janvier 2022 à décembre 2023, un total de 17 patients ont subi une segmentectomie hépatique S8. Tous les patients se sont rétablis et sont sortis sans complications majeures. Notre expérience en chirurgie hépatique met l’accent sur l’intégration des connaissances théoriques et des compétences pratiques, en particulier dans l’apprentissage détaillé de l’anatomie intrahépatique, préconisant la pratique de la dissection à l’aide de foies cadavériques. De plus, nous soulignons l’importance de maîtriser les techniques laparoscopique par le biais de formations par simulation et de la participation à des procédures mini-invasives. La connaissance des différents instruments endoscopiques, tels que les scalpels harmoniques et les ultrasons peropératoires, est cruciale. De plus, il est essentiel de tirer parti de la formation sur site et des débriefings chirurgicaux pour comprendre la théorie et les techniques de la résection anatomique du foie, en mettant l’accent sur l’augmentation progressive de la complexité de la procédure et, en fin de compte, sur la simplification. L’application efficace de l’échographie peropératoire, une collaboration étroite au sein de l’équipe chirurgicale et une auto-évaluation approfondie des performances chirurgicales sont tout aussi essentielles. Un mécanisme de sauvetage peropératoire efficace est essentiel, assurant une conversion rapide en chirurgie ouverte si nécessaire et le soutien de chirurgiens chevronnés pour améliorer le succès de la procédure.
D’après notre expérience, nous avons les connaissances suivantes : (1) Maîtriser l’anatomie segmentaire 3D via un entraînement cadavérique axé sur la microdissection pédiculaire glissonéenne. (2) Affiner les compétences laparoscopique grâce à des exercices mini-invasifs basés sur la simulation pour la précision des instruments. (3) Optimiser les dispositifs d’énergie (scalpel à ultrasons/fluorescence CUSA/ICG) pour une transsection parenchymateuse sûre. (4) Mettre en œuvre l’apprentissage multimodal, combinant l’analyse vidéo et les débriefings de cas pour l’optimisation de la stratégie AR. (5) Améliorer la synergie d’équipe grâce à un contrôle CVP géré par un anesthésiste et à une assistance chirurgicale compétente. (6) Établir des protocoles de sauvetage définissant des seuils de conversion ouverts et des voies d’escalade pour les chirurgiens seniors.
Cependant, cette étude présente certaines limites, car elle ne porte que sur quelques cas. De plus, l’étude est rétrospective et la sélection des patients est limitée. Des études prospectives plus précises sont nécessaires pour comparer davantage les avantages et les inconvénients des différentes techniques de résection hépatique mini-invasives. Nous partagerons nos expériences rapidement dès que nous aurons obtenu des données plus fiables.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts ou lien financier à divulguer.
Remerciements
Ce travail a été soutenu par des subventions du Projet du Fonds provincial de recherche fondamentale et appliquée du Guangdong (n° 2023A1515220114) ; le grand projet scientifique et technologique de la Commission municipale d’innovation scientifique et technologique de Shenzhen (n° KJZD20230923114120038), le Fonds de construction de la discipline médicale clé de Shenzhen (n° SZXK015) ; et le projet provincial et national de construction de spécialités cliniques clés du Guangdong et le projet national de construction de spécialités cliniques clés.
matériels
| Name | Company | Catalog Number | Comments |
| Bipolar electric coagulation forceps | Mindray | Seal 7 | For blood vessel coagulation and division |
| Fluorescence Endoscopic camera system | Mindray | R1 | An endoscopic camera system with 4K fluorescence imaging |
| Intraoperative Ultrasonic imaging system | ALOKA | UST-5418 | With the four-directional flexible linear array ultrasonic laparoscopic transducer, the intraoperative ultrasound support ultrasonic elastography, contrast ultrasound, and magnetic navigation guided puncture |
| Intraoperative Ultrasonic imaging system | Mindray | LAP13-4Cs | Four-directional flexible linear array ultrasonic laparoscopic transducer which supports support ultrasonic elastography and contrast ultrasound |
| SPSS 20.0 | statistical analysis software | ||
| Ultrasonic scalpel | Johnson & Johnson | ETHICON GEN11 | For blood vessel coagulation and division |
Références
- Zheng, R. S., et al. Cancer incidence and mortality in China, 2022. Chinese Journal of Oncology. 46 (3), 221-231 (2024).
- Qin, S. Primary liver cancer diagnosis and treatment Expert Panel of the Chinese Ministry of Health Guidelines on the diagnosis and treatment of primary liver cancer (2011 edition). Chin Clin Oncol. 1 (1), 10(2012).
- Makuuchi, M., Hasegawa, H., Yamazaki, S. Ultrasonically guided subsegmentectomy. Surg Gynecol Obstet. 161 (4), 346-350 (1985).
- Wang, X., Cao, J., Li, J. Anatomic liver resection based on portal territory with margin priority for hepatocellular carcinoma. JAMA Surg. 159 (6), 710-711 (2024).
- Urade, T., et al. Laparoscopic anatomical liver resection using indocyanine green fluorescence imaging. Asian J Surg. 43 (1), 362-368 (2020).
- Fuks, D., Aldrighetti, L., Jiao, L. R., Wakabayashi, G., Limongelli, P. Laparoscopic management of hepatocellular carcinoma: A critical reappraisal. Surg Laparosc Endosc Percutan Tech. 27 (4), 203-205 (2017).
- Morimoto, M., et al. Minimally invasive anatomic liver resection: Results of a survey of world experts. J Hepatobiliary Pancreat Sci. 29 (1), 33-40 (2022).
- Goh, E. L., Chidambaram, S., Ma, S. Laparoscopic vs open hepatectomy for hepatocellular carcinoma in patients with cirrhosis: A meta-analysis of the long-term survival outcomes. Int J Surg. 50, 35-42 (2018).
- Ban, D., et al. A novel difficulty scoring system for laparoscopic liver resection. J Hepatobiliary Pancreat Sci. 21 (10), 745-753 (2014).
- Sugioka, A., Kato, Y., Tanahashi, Y. Systematic extrahepatic Glissonean pedicle isolation for anatomical liver resection based on Laennec's capsule: proposal of a novel comprehensive surgical anatomy of the liver. J Hepatobiliary Pancreat Sci. 24 (1), 17-23 (2017).
- Xie, Q., Gao, F. A commentary on 'approaches of laparoscopic anatomical liver resection of segment 8 for hepatocellular carcinoma: a retrospective cohort study of short-term results at multiple centers in China'. Int J Surg. 111 (1), 1646-1647 (2023).
- Ciria, R., et al. Study group of Precision Anatomy for Minimally Invasive Hepato-Biliary-Pancreatic surgery (PAM-HBP surgery). A snapshot of the 2020 conception of anatomic liver resections and their applicability on minimally invasive liver surgery. A preparatory survey for the Expert Consensus Meeting on Precision Anatomy for Minimally Invasive HBP Surgery. J Hepatobiliary Pancreat Sci. 29 (1), 41-50 (2022).
- Morimoto, M., et al. and Study group of Precision Anatomy for Minimally Invasive Hepato-Biliary-Pancreatic surgery (PAM-HBP surgery). Glissonean approach for hepatic inflow control in minimally invasive anatomic liver resection: A systematic review. J Hepatobiliary Pancreat Sci. 29 (1), 51-65 (2022).
- Fuks, D., Aldrighetti, L., Jiao, L. R., Wakabayashi, G., Limongelli, P. Laparoscopic management of hepatocellular carcinoma: A critical reappraisal. Surg Laparosc Endosc Percutan Tech. 27 (4), 203-205 (2017).
- Monden, K., et al. Landmarks and techniques to perform minimally invasive liver surgery: A systematic review with a focus on hepatic outflow. J Hepatobiliary Pancreat Sci. 29 (1), 66-81 (2022).
- Kang, L. -M., Zhang, F. -W., Yu, F. -K., Xu, L. Pay attention to the application of indocyanine green fluorescence imaging technology in laparoscopic liver cancer resection. World J Clin Cases. 12 (23), 5288-5293 (2024).
- Cassinotti, E., et al. European Association for Endoscopic Surgery (EAES) consensus on Indocyanine Green (ICG) fluorescence-guided surgery. Surg Endosc. 37 (3), 1629-1648 (2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon