Method Article
Minimalinvasive anatomische Resektion des Lebersegments VIII auf Basis eines Portalgebiets zur Behandlung des hepatozellulären Karzinoms
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Diese Studie beschreibt laparoskopische S8-Segmentektomietechniken und betont den Übergang von der partiellen zur anatomischen Resektion, die durch portale Pedikelnavigation gesteuert wird. Ein verbessertes anatomisches 3D-Verständnis, verfeinerte minimal-invasive Fähigkeiten und die Beherrschung des intraoperativen Ultraschalls verbesserten die Präzision und Sicherheit des Verfahrens, reduzierten Komplikationen und optimierten gleichzeitig die chirurgischen Ergebnisse in der Leber durch systematisierte anatomische Resektionsprotokolle.
Zusammenfassung
Die Hepatektomie ist die primäre Behandlung des hepatozellulären Karzinoms (HCC) und wird je nach Ausmaß der Resektion in anatomische Hepatektomie und nicht-anatomische Hepatektomie eingeteilt. Bei der anatomischen Hepatektomie wird das Lebersegment oder -untersegment des Pfortaders (PT) als anatomische Grundeinheit verwendet, wobei die tumortragende PT systematisch reseziert und das Glisson-System, das diesen Bereich versorgt und abgrenzt, vollständig entfernt wird, um die onkologische Wirksamkeit zu verbessern. Die nicht-anatomische Hepatektomie folgt dem Prinzip der radikalen onkologischen Resektion, wobei der Schwerpunkt auf der Entfernung von Lebergewebe in einem Abstand von mehr als 1 cm vom Tumorrand liegt. Mit der Popularisierung von Konzepten der Präzisionschirurgie wurde die minimalinvasive anatomische Hepatektomie auf der Grundlage von PTs in großem Umfang angewendet. Die minimalinvasive Resektion des Segments S8 der Leber gilt jedoch nach wie vor als eine der anspruchsvollsten Leberresektionen. Wir führten erfolgreich eine anatomische Resektion des portalen Territoriums Segment S8 der Leber mittels intraoperativem Ultraschall, Fluoreszenz-Laparoskopie und Lannaec-Membrandissektion durch und erzielten gute kurzfristige klinische Ergebnisse.
Einleitung
Das hepatozelluläre Karzinom, allgemein bekannt als Leberkrebs, ist eine der häufigsten bösartigen Tumoren in China. Im Jahr 2022 gab es in China 367.700 neue Fälle von Leberkrebs und damit die vierthöchste Inzidenz; Die Zahl der Todesfälle erreichte 316.500 und ist damit die zweithäufigste krebsbedingte Todesursache1. Die Hepatektomie bietet eine der besten Möglichkeiten für ein langfristiges Überleben bei Patienten mit HCC2. Die Leberresektion kann je nach Ausmaß der Resektion in eine anatomische Leberresektion (AR) und eine nicht-anatomische Leberresektion (NAR) eingeteilt werden. Bei der AR handelt es sich um die vollständige Resektion von anatomisch unabhängigen Lebersegmenten oder kombinierten Segmenten zusammen mit dem Leberparenchym innerhalb der tumortragenden Pfortaderäste, um bessere onkologische Ergebnisse zu erzielen und Komplikationen durch verbleibende ischämische oder verstopfte Bereiche zu vermeiden. Der Vorteil der AR spiegelt sich in der Gründlichkeit der Tumorexzision und dem vollständigen Erhalt der Zu- und Abflussgänge der Leber wider3. Auf der anderen Seite bezieht sich die NAR, auch als irreguläre Leberresektion bekannt, auf die Resektion von Lebergewebe mehr als 1 cm vom Tumorrand entfernt, basierend auf den Prinzipien der onkologischen radikalen Resektion. Diese Operationsmethode hält sich nicht strikt an die anatomische Segmentierung der Leber, sondern wird auf die Lage und Größe des Tumors zugeschnitten, mit dem Ziel, so viel normales Lebergewebe wie möglich zu erhalten und gleichzeitig einen sicheren Spielraum für die Tumorentfernung zu gewährleisten.
Mit der Weiterentwicklung von Konzepten der Präzisionschirurgie und einem tieferen Verständnis der Anatomie der Leber haben Theorie und Praxis der anatomischen Leberresektion auf der Grundlage des Portalterritoriums (PT-AR) in den letzten Jahren Anerkennung und erste Förderung erfahren4. PT-AR umfasst eine präoperative dreidimensionale Rekonstruktion und Beckenanalyse, um das tumortragende Portalgebiet (PT) zu identifizieren und die Operation entsprechend zu planen. Intraoperativ werden Lebersegmente oder Untersegmente innerhalb des Beckens als grundlegende anatomische Einheiten verwendet, wobei die Navigation mit Indocyaningrün (ICG)-Fluoreszenzfärbung die primäre Methode ist, ergänzt durch die Freilegung repräsentativer intersegmentaler Lebervenen (IHVs). Die Leber wird dann entlang physiologischer Fissuren präpariert, um eine vollständige Resektion des tumortragenden Pfortaderbeckens zu erreichen und gleichzeitig die Integrität und Funktionserhaltung des zukünftigen Leberrests (FLR) zu gewährleisten. Die überlagerte intraoperative ultraschallgesteuerte Punktion für die portale positive Färbung oder retrograde Färbung nach Ligatur des hepatischen Zielpedikels ist eine grundlegende technische Voraussetzung für das Erreichen der PT-AR.
Die laparoskopische Leberresektion ist bekannt für ihren minimal-invasiven Ansatz und ihre überlegenen Genesungsergebnisse im Vergleich zur herkömmlichen offenen Chirurgie. Die Komplexität der Resektion verschiedener Lebersegmente ist jedoch unterschiedlich. Die Lage des Segments VIII der Leber tief im Oberbauch, in der Nähe der Lebervenen und der unteren Hohlvene, zusammen mit der Herausforderung, direkt auf den Glissone-Stiel des Segments VIII zuzugreifen, macht die laparoskopische anatomische Leberresektion für dieses Segmentbesonders schwierig 5,6,7,8,9.
Diese Studie zeigt die portalvenöse regionalanatomische Resektion des Lebersegments S8 beim hepatozellulären Karzinom. Unser Ziel ist es, die Technik und die wichtigsten Schritte dieser Operation zu beschreiben, einschließlich der laparoskopischen, ultraschallgesteuerten Punktionstechnik und der Leberpedikeldissektion auf der Grundlage der Lannaec-Membran. Durch die Weitergabe dieses Protokolls hoffen wir, Beweise für die Machbarkeit und Sicherheit der laparoskopischen portalvenösen regionalen anatomischen Leberresektion bei der Behandlung des hepatozellulären S8-Karzinoms zu liefern und letztendlich die Behandlungsergebnisse der Patienten zu verbessern.
Protokoll
Die Studie mit laparoskopischer anatomischer Leberresektion für Segment 8 (LALR-S8) hat sich an die ethischen Standardpraktiken gehalten. Es erhielt die Genehmigung der Ethikkommission des Shenzhen People's Hospital (LL-KY-2020462). Darüber hinaus wurde von jedem Patienten eine schriftliche Einverständniserklärung eingeholt, um sicherzustellen, dass die Forschung den medizinischen Ethiknormen und -anforderungen entspricht.
1. Auswahl des Patienten
- Verwenden Sie die folgenden Einschlusskriterien:
- Führen Sie LALR-S8 bei Patienten mit gutartigen oder bösartigen Lebertumoren durch und stellen Sie sicher, dass sie sich standardmäßigen kardiopulmonalen Untersuchungen, Bluttests und biochemischen Untersuchungen unterziehen; Stellen Sie sicher, dass sie keine Kontraindikationen für eine Operation oder Anästhesie haben.
- Durchführung präoperativer Bildgebung, einschließlich CT-Angiographie des Abdomens, dreidimensionaler Rekonstruktion der Leber und des Gefäßsystems und erweiterter MRT sowie Berechnungen des Rest- und Standardlebervolumens.
- Verwenden Sie die folgenden Ausschlusskriterien: Patienten mit Leberfunktion, die als Pugh-Child-Klasse C eingestuft sind; diejenigen, die eine Vollnarkose nicht vertragen; Patienten mit intrahepatischen oder extrahepatischen Metastasen; diejenigen, die sich einer offenen Operation unterzogen haben; und Patienten, die segmentale Resektionen oder andere kombinierte chirurgische Behandlungen erhalten haben.
2. Präoperative Vorbereitung, chirurgische Position und Anästhesie
- Präoperative Vorbereitung
- Anamnese und körperliche Untersuchung: Beurteilung der Leberfunktion, des Gerinnungsprofils, des ICG-Clearance-Tests und des allgemeinen Gesundheitszustands.
- Bildgebung: Erhalten Sie eine detaillierte präoperative Bildgebung (z. B. verbesserte abdominale CT, MRT und dreidimensionale Rekonstruktion der Leber und des Gefäßsystems), um die Anatomie des Segments 8 der Leber und ihres Gefäßsystems abzugrenzen (Abbildung 1)
- Fasten: Stellen Sie sicher, dass sich der Patient an die Fastenanweisungen hält, in der Regel ab Mitternacht am Tag vor der Operation.
- Medikamente: Verabreichen Sie bei Bedarf prophylaktische Antibiotika und überprüfen Sie alle Medikamente, die sich auf Blutungen oder Leberfunktion auswirken können.
- Einwilligungserklärung und Aufklärung: Erklären Sie das laparoskopische Verfahren, einschließlich seiner Methoden, Risiken und Vorteile, und holen Sie die Einwilligungserklärung ein.
- Chirurgische Position
- Rückenlage: Positionieren Sie den Patienten in Rückenlage auf dem Operationstisch.
- Umgekehrte Trendelenburg-Position: Kippen Sie den Operationstisch leicht, um die Belichtung und den Zugang zur Leber zu erleichtern.
HINWEIS: Diese Position hilft, die Leber nach oben und vom Oberbauch weg zu bewegen. - Stabilisierung: Sichern Sie den Patienten auf dem Operationstisch, um Bewegungen während des Eingriffs zu verhindern.
- Anästhesie
- Vollnarkose: Verabreichen Sie eine Vollnarkose, um sicherzustellen, dass der Patient während der gesamten Operation bewusstlos bleibt und sich wohl fühlt.
- Induktion und Erhaltung: Verwenden Sie zur Intubation intravenöse Induktionsmittel (z. B. Propofol) und Muskelrelaxantien (z. B. Succinylcholin). Halten Sie die Anästhesie mit inhalativen Mitteln (z. B. Sevofluran) und ergänzenden Analgetika (z. B. Fentanyl) aufrecht. Passen Sie die Anästhesietiefe an, um eine angemessene Anästhesie und Patientensicherheit zu gewährleisten.
- Überwachung: Überwachen Sie kontinuierlich Herzfrequenz, Blutdruck, Blutsauerstoffsättigung und Kohlendioxidspiegel am Ende der Tidalzeit.
3. Chirurgische Techniken
- Nach der intravenösen Inhalationsanästhesie wird der Patient in einer 30° linken lateralen Dekubitusposition mit Kopferhöhung und getrennten Beinen positioniert. Verwenden Sie für die Leberresektion einen Fünf-Port-Ansatz mit einem Insufflationsdruck von 11-13 mmHg, einem zentralvenösen Druck von 3-5 cmH2O und dem Pringle-Manöver für 10-15 Minuten Okklusion, gefolgt von einer 5-minütigen Freisetzung.
- Machen Sie einen vertikalen Schnitt 2 cm unterhalb des rechten Nabelrandes und öffnen Sie die Bauchwandschichten nacheinander, um Zugang zum Bauch zu erhalten. Führen Sie einen 12-mm-Trokar ein, um ein Pneumoperitoneum zu etablieren, und führen Sie dann das Laparoskop in die Bauchhöhle ein.
- Platzieren Sie fünf Trokare wie folgt: einen 12-mm-Trokar zur Beobachtung in den Suprumbilikalbereich; ein 5-mm-Trokar an der rechten vorderen Achsellinie; ein 12-mm-Trokar unterhalb des rechten medialen Schlüsselbeins; ein 5-mm-Trokar horizontal 2 cm unterhalb des Xiphoid-Processus; und ein 12-mm-Trokar 2 cm über dem Nabel (Abbildung 2).
HINWEIS: Zu den gängigen chirurgischen Instrumenten, die bei der Leberresektion verwendet werden, gehören intraoperativer laparoskopischer Ultraschall, harmonisches Skalpell und bipolare Gerinnungsgeräte. - Intraoperativer laparoskopischer Ultraschall (LUS) zur Steuerung der Punktion verwenden, mit ICG zur positiven Färbung der anatomischen Resektion des Lebersegments S8:
- Dissektion der umgebenden Bänder und Identifizierung von P8: Präparieren Sie die umgebenden Bänder des rechten Leberlappens und identifizieren Sie mit der LUS-Sonde den Pfortaderast für Segment 8 (P8), wobei Sie die Punktionsposition und den Nadelwinkel nach Bedarf anpassen.
- Einführen der Ultraschallsonde und positive Färbung mit ICG: Führen Sie die laparoskopische Ultraschallsonde BK durch den 12-mm-Trokaranschluss ein. Punktion des P8 mit einer 21 G perkutanen transhepatischen Cholangiographie (PTC) Nadel unter Führung des LUS. Injizieren Sie 5-10 ml 1,25 % ICG durch die Nadel, um Segment VIII zu färben, wobei sichergestellt wird, dass kein retrograder Fluss in benachbarte Segmente erfolgt (Abbildung 3)
- Negative Färbung der anatomischen Resektion des Lebersegments S8 über den hilären Zugang:
- Dissektion des Leberstiels S8: Freilegung des rechten vorderen Leberhilums in Anlehnung an die Lannaec-Membran zwischen Tor VI und Tor V10. Präparieren Sie dann entlang der ventralen Seite des rechten vorderen Leberstiels und zur Kopfseite auf der linken Seite, um den Leberstiel S8 freizulegen. Mobilisieren und heben Sie diesen Pedikel.
- Blutstillung und Negativfärbung: Nach der Hilumdissektion wird eine Gefäßklemme zur Blutstillung des Leberstiels S8 angelegt (Abbildung 4) und die ischämische Linie des Segments S8 wird bestätigt, um den Tumor einzuschließen. Injizieren Sie 5-10 ml 1,25 % ICG durch die periphere Vene. Suchen Sie nach Segment VIII, das nach 5 min durch die Fluoreszenz abgegrenzt wird (Abbildung 5).
- Leberresektion mit fluoreszierender Grenzfläche: Überwachen Sie die Fluoreszenz, um zu bestätigen, dass der gefärbte Bereich den Tumor bedeckt. Nehmen Sie Schnitte entlang der Grenzfläche zwischen fluoreszierenden und nicht fluoreszierenden Bereichen mit einem Ultraschallskalpell oder CUSA vor, wobei die intersegmentalen Lebervenen erhalten bleiben (Abbildung 6).
HINWEIS: Sowohl der Tumor als auch das PT-Lebersegment oder -Untersegment können auf diese Weise vollständig reseziert werden. - Blutstillung und Inspektion: Erreichen Sie die Blutstillung durch Elektrokauterisation oder Nähen nach einer Läsionsresektion. Untersuchen Sie die Resektionsstelle, um sicherzustellen, dass keine Restblutungen oder Gallenleckagen vorhanden sind. Im Querschnitt sind die intersegmentalen Venen und das Ende des P8-Segments zu beobachten (Abbildung 7).
Ergebnisse
Zwischen Januar 2022 und Dezember 2023 wurden insgesamt 17 Patienten einer Hepatektomie des Segments S8 unterzogen. Davon handelte es sich in sieben Fällen um nicht-anatomische Resektionen, in sechs Fällen um anatomische Resektionen über den hepatischen parenchymalen Zugang und in vier Fällen um anatomische Resektionen des Portalterritoriums. Es gab keine signifikanten Unterschiede in den präoperativen Child-Pugh-Scores, der Tumorgröße und der Leberreservefunktion zwischen den Gruppen. Die Operationszeit für die PT-Gruppe mit anatomischer Resektion war länger als die für die anatomischen Resektionsgruppen mit nicht-anatomischer Resektion und hepatischem parenchymalem Zugang, was vor allem auf die relativ schwierige Portalpunktion oder Dissektion der entsprechenden Lebersegmente zurückzuführen ist, die mehr Zeit erforderte. Es gab keine signifikanten Unterschiede im intraoperativen Blutverlust zwischen den Gruppen, aber der postoperative Spitzen-ALT-Spiegel war in der anatomischen Resektionsgruppe des Pfortadergebiets niedriger als in den beiden anderen Gruppen, wahrscheinlich weil diese Gruppe weniger verbleibendes nicht-funktionelles Lebergewebe aufwies. Alle chirurgischen Ränder überstiegen 1 cm, wobei die PT-Gruppe der anatomischen Resektion größere Ränder aufwies als die beiden anderen Gruppen. In jedem Fall trat kein Gallenaustritt auf, und es gab keine ungeplanten Reoperationen. Für Zähldaten wurde eine unidirektionale ANOVA-Analyse eingesetzt, für Messdaten wurde der Rang-Summen-Test verwendet. Spezifische Ergebnisse sind in Tabelle 1 aufgeführt.
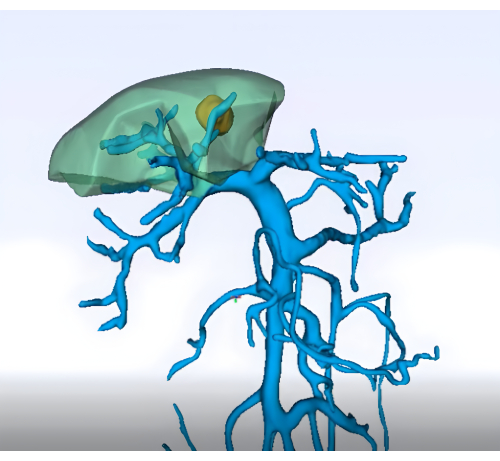
Abbildung 1: Präoperative Analyse des Pfortaderterritoriums mittels dreidimensionaler Rekonstruktionstechnik. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
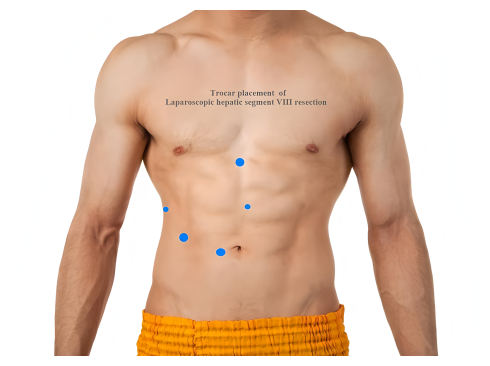
Abbildung 2: Trokarplatzierung einer laparoskopischen Lebersegment-VIII-Resektion. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
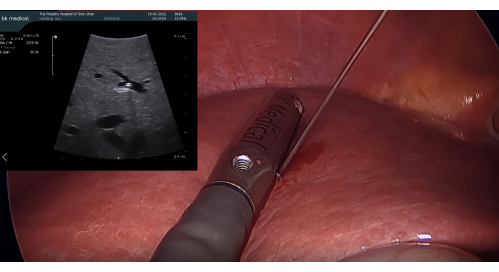
Abbildung 3: Punktion von P8 mit einer 21 G PTC-Nadel, geführt von der laparoskopischen Ultraschallsonde. Abkürzung: PTC = perkutane transhepatische Cholangiographie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
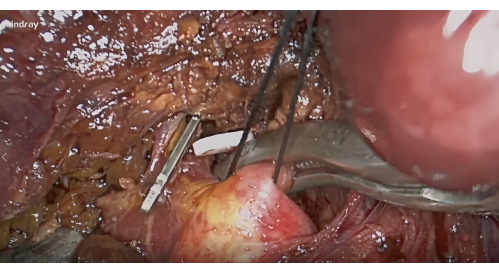
Abbildung 4: Dissektion der Leberstiele des Segments VIII entlang der Lannaec-Membran und Blockade mit Gefäßklemme. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Markierung der Resektionslinie nach der Negativfärbung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
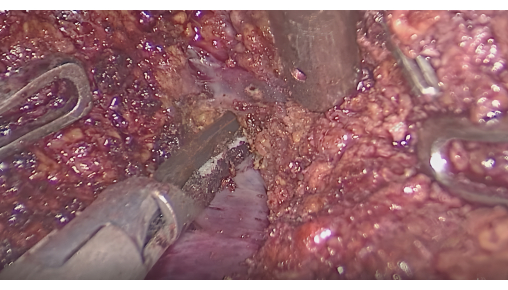
Abbildung 6: Dissektion des Leberparenchyms zwischen den intersegmentalen Venen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
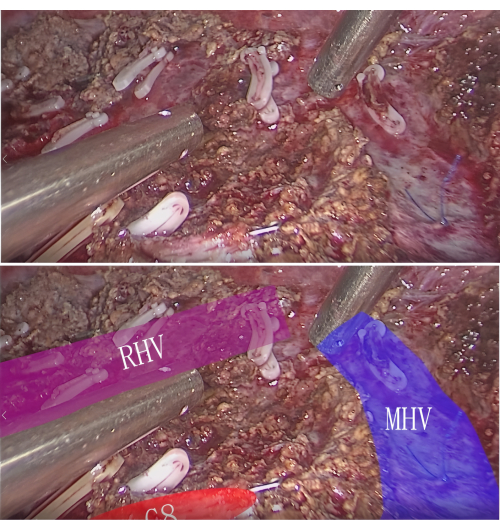
Abbildung 7: Intersegmentale Vena und der P8-Stumpf im Resektionsbereich. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| nicht-anatomische Resektion (n=7) | anatomische Resektionen durch einen parenchymalen Zugang (n=6) | portalvenöse territoriale anatomische Resektion (n=4) | F-Wert /χ2 | p-Wert | |
| Präoperativer Child-Pugh-Score | 5,4±0,8 kg | 5,2±0,4 kg | 5,3±0,5 kg | 0.306 | 0.741 |
| Tumorgröße (cm) | 3,4±1,5 | 3.1±0.8 | 2,8±0,6 kg | 0.454 | 0.644 |
| Präoperativer ICG 15 min Retentionsrate (%) | - | - | - | 0.195 | 0.907 |
| Betriebszeit (min) | Tel.: 189±52 | 201±36 kg | Tel.: 268±51 | 3.826 | 0.047 |
| Blutverlust (ml) | Tel.: 228±135 | 175±52 kg | 170±24 Uhr | 0.716 | 0.506 |
| Minimaler chirurgischer Spielraum (cm) | 1,3±0,5 | 1,7±0,3 kg | 2,0±0,4 | 3.972 | 0.043 |
| Maximale postoperative ALT (U/L) | Tel.: 328±109 | Tel.: 219±45 | Tel.: 152±38 | 7.045 | 0.008 |
| Bilirubinspiegel an postoperativem Tag 5 (μmol/L) | 17.2±8.2 | 18.1±4.2 | 14.7±4.3 | 0.389 | 0.685 |
| Postoperative Entlassungszeit (Tage) | 7,5±1,3 | 6,7±0,8 kg | 6,3±1,0 | 2.279 | 0.139 |
| Postoperativer Gallenverlust | 0 | 0 | 0 | - | - |
| Ungeplante Wiederholung | 0 | 0 | 0 | - | - |
Tabelle 1: Vergleich der klinischen Daten zwischen verschiedenen Gruppen.
Diskussion
Die Resektion des Segments S8 der Leber, insbesondere die anatomische Resektion, stellt nach wie vor eine große Herausforderungdar 11. Die theoretische Grundlage der portalpedikelbasierten anatomischen Hepatektomie muss sich in der Leberchirurgie noch durchsetzen. Folglich verfolgen hepatobiliäre Chirurgen weiterhin robuste klinische Evidenz, um den therapeutischen Wert der anatomischen Leberresektion objektiv zu bewerten. Jüngste Fortschritte in der hepatischen anatomischen Rekonzeptualisierung, insbesondere in Bezug auf die Laennec-Kapsel und die Sechs-Sektoren-Theorie, haben theoretisch die präzise Identifizierung und Dissektion einzelner Leberstiele ermöglicht, die bestimmten Segmenten oder Untersegmenten entsprechen. Die Integration von Fluoreszenz-Laparoskopie und laparoskopischer Sonographie hat die Durchführung der laparoskopischen anatomischen Hepatektomie weiter erleichtert und ermöglicht die Echtzeit-Visualisierung der territorialen Perfusionsgrenzen und die intraoperative Navigation. Laut der Tokioter Expertenkonsensuskonferenz von 202112 ist die anatomische Resektion definiert als die vollständige Entfernung von Leberanteilen, die mit bestimmten Pfortadergebieten verbunden sind, die durch tertiäre Pfortaderäste abgegrenzt sind. Die anatomische Leberresektion ist gekennzeichnet durch die vollständige Exzision von anatomisch unabhängigen Lebersegmenten, Untersegmenten oder kombinierten Segmenten11,13. Im Vergleich zur nicht-anatomischen Leberresektion werden bei der anatomischen Resektion gleichzeitig die entsprechenden Lebersegmente entfernt, die mit dem relevanten Pfortaderastgebiet assoziiert sind, wodurch theoretisch das Risiko einer Tumorausbreitung durch portalvenösen Blutfluss im betroffenen Lebersegment reduziert und postoperative Komplikationen minimiert werden. Daher gilt sie derzeit als der bevorzugte chirurgische Ansatz bei Leberkrebs14.
Die intersegmentale oder segmentale Ebene der Leber wird durch die Grenzen der Pfortaderterritorien bestimmt. Die Lebervenen, die diese Ebenen durchqueren, werden als intersegmentale Venen bezeichnet, die als wichtige Orientierungspunkte während der Leberresektion dienen und eine genaue Identifizierung durch kontinuierliche Exposition in der Schnittebene15 ermöglichen. Diese Methode erfordert Fachwissen in der Leberultraschallbildgebung, den kompetenten Umgang mit LUS und Punktionstechniken, die eine Lernkurve erfordern. Basierend auf unserer Erfahrung ist die kompetente Anwendung von intraoperativem Ultraschall entscheidend für die Steigerung des chirurgischen Erfolgs und der Patientensicherheit. Chirurgen auf allen Ebenen sollten sich zunächst mit der Erkennung und Interpretation von Ultraschallbildern durch routinemäßige perkutane Ultraschalleingriffe vertraut machen und grundlegende operative Fähigkeiten beherrschen. Anschließend sollten sie zur Anwendung von Ultraschall in offenen Operationen übergehen und lernen, wie sie Ultraschall zur Steuerung von Leberresektionen und zur Beurteilung von Lebertumoren einsetzen können. In dieser Phase der Ausbildung wird das Verständnis der Chirurgen für die intraoperativen anatomischen Strukturen gestärkt. Letztendlich sollten Ärzte darauf abzielen, den Einsatz von intraoperativem Ultraschall bei laparoskopischen Eingriffen zu beherrschen, um eine höhere Präzision zu erreichen, insbesondere in Situationen mit eingeschränkter Visualisierung. Durch diesen schrittweisen Lern- und Übungsprozess werden Chirurgen versiert im Einsatz von Ultraschalltechnologie bei komplexen Operationen, was sowohl die Sicherheit als auch die Wirksamkeit erheblich verbessert.
Die LALR-S8-Technik zielt darauf ab, die Gefäßversorgung des Segments S8 effektiv zu lokalisieren und die intersegmentale Ebene zu definieren. Makuuchi et al. waren die ersten, die eine Methode vorschlugen, mit der die Pfortader unter Ultraschallkontrolle angegriffen werden kann, gefolgt von einer Farbstoffinjektion zur Klärung der Perfusion des Tumorsegments3. Im Jahr 2008 leisteten Aoki et al. Pionierarbeit bei der Anwendung der Fluoreszenzbildgebungstechnologie zur Segmentlokalisierung während der Leberchirurgie16. Derzeit ist die fluoreszenzgesteuerte ICG-Methode unter LUS zu einer Standardtechnik geworden, um die Genauigkeit laparoskopischer anatomischer Leberresektionen zu verbessern17. Dieser Ansatz adressiert nicht nur die Einschränkung, dass ischämische Linien nur auf der Leberoberfläche sichtbar sind, sondern ermöglicht auch die Echtzeit-Visualisierung klarer fluoreszierender Demarkationslinien auf der intersegmentalen Ebene. Der Glissone-Ansatz mit ICG-Fluoreszenzfärbung ermöglicht eine anatomische Leberresektion bei gleichzeitiger Maximierung des Erhalts des funktionellen Leberrestgewebes und der Minimierung intraoperativer Blutungen.
Makuuchi schlug vor, dass die anatomische Leberresektion für Segment S8 vier Schritte umfassen sollte: (1) Markieren der Lebersegmentgrenzen auf der Oberfläche mit Färbe- oder Blutflussverschlusstechniken; (2) Durchführung einer mittels Ultraschall geführten Leberparenchymresektion unter Verwendung der Orientierungsvene dieses Lebersegments als Grenze; (3) Erreichen einer vollständigen Freilegung signifikanter Venen an der Schnittfläche der Leber; (4) Liligation des Glisson-Systems in der Nähe der Wurzel des Lebersegments3. Die Pfortaderäste für das Segment S8 bestehen im Wesentlichen aus dem ventralen und dorsalen Ast. Der dorsale Ast des Segments S8 gabelt sich typischerweise in der Nähe der Wurzel der rechten vorderen Pfortader, während sich der Pfortaderast des Segments S5 an seiner terminalen Seite gabelt, was eine separate Punktionsfärbung für den ventralen und dorsalen Ast erforderlich macht. Zwischen dem dorsalen Ast des Segments S8 und der rechten vorderen Pfortadervene verläuft ein markanter Ast der Vena hepatica (V8), der für den venösen Abfluss von S8 verantwortlich ist. Nach der totalen Resektion des Segments S8 sind an der Schnittfläche die mittlere Lebervene, die rechte Lebervene und die untere Hohlvene zu sehen.
Von Januar 2022 bis Dezember 2023 wurden insgesamt 17 Patienten einer Leber-S8-Segmentektomie unterzogen. Alle Patienten erholten sich und wurden ohne größere Komplikationen entlassen. Unsere Erfahrung in der Leberchirurgie legt Wert auf die Integration von theoretischem Wissen und praktischen Fertigkeiten, insbesondere im detaillierten Erlernen der intrahepatischen Anatomie, und empfiehlt die Dissektionspraxis mit Leichenlebern. Darüber hinaus betonen wir, wie wichtig es ist, laparoskopische Techniken durch Simulationstraining und die Teilnahme an minimalinvasiven Verfahren zu beherrschen. Die Vertrautheit mit verschiedenen endoskopischen Instrumenten, wie z. B. harmonischen Skalpellen und intraoperativem Ultraschall, ist von entscheidender Bedeutung. Darüber hinaus ist es wichtig, Vor-Ort-Schulungen und chirurgische Nachbesprechungen zu nutzen, um die Theorie und die Techniken der anatomischen Leberresektion zu verstehen, wobei der Schwerpunkt auf der schrittweisen Erhöhung der Verfahrenskomplexität und letztendlich der Vereinfachung liegt. Ebenso wichtig sind die kompetente Anwendung des intraoperativen Ultraschalls, die enge Zusammenarbeit innerhalb des Operationsteams und eine gründliche Selbstkontrolle der chirurgischen Leistung. Ein effektiver intraoperativer Rettungsmechanismus ist von entscheidender Bedeutung, um bei Bedarf eine rechtzeitige Umstellung auf offene Chirurgie zu gewährleisten und die Unterstützung durch leitende Chirurgen zu sichern, um den Erfolg des Eingriffs zu verbessern.
Aus unserer Erfahrung haben wir folgende Erkenntnisse: (1) Meistern Sie die 3D-Segmentanatomie durch Leichentraining mit Schwerpunkt auf der Glissone-Pedikel-Mikrodissektion. (2) Verfeinern Sie Ihre laparoskopischen Fähigkeiten durch simulationsbasierte, minimal-invasive Bohrer für die Präzision der Instrumente. (3) Optimieren Sie die Energiegeräte (Ultraschallskalpell/CUSA/ICG-Fluoreszenz) für eine sichere Parenchymtranssektion. (4) Implementierung von multimodalem Lernen, das Videoanalyse und Fallnachbesprechungen zur Optimierung der AR-Strategie kombiniert. (5) Verbessern Sie die Teamsynergie durch anästhesistisch geführte CVP-Kontrolle und kompetente chirurgische Unterstützung. (6) Erstellung von Rettungsprotokollen, in denen offene Konversionsschwellen und Eskalationswege für leitende Chirurgen definiert sind.
Diese Studie hat jedoch einige Einschränkungen, da sie nur wenige Fälle umfasst. Darüber hinaus ist die Studie retrospektiv und die Auswahl der Patienten ist begrenzt. Um die Vor- und Nachteile verschiedener minimal-invasiver Leberresektionstechniken weiter vergleichen zu können, bedarf es präziser konzipierter prospektiver Studien. Wir werden unsere Erfahrungen umgehend teilen, sobald wir zuverlässigere Daten erhalten.
Offenlegungen
Die Autoren haben keine Interessenkonflikte oder finanziellen Verbindungen offenzulegen.
Danksagungen
Diese Arbeit wurde durch Zuschüsse aus dem Projekt des Guangdong Provincial Basic and Applied Basic Research Fund (Nr. 2023A1515220114) unterstützt; das Wissenschafts- und Technologie-Großprojekt der Shenzhen Municipal Science and Technology Innovation Commission (Nr. KJZD20230923114120038), Shenzhen Key Medical Discipline Construction Fund (Nr. SZXK015); und das Bauprojekt für das klinische Spezialprojekt der Provinz Guangdong und des National Key Clinical Specialty sowie des Bauprojekts für das klinische Spezialprojekt des National Key.
Materialien
| Name | Company | Catalog Number | Comments |
| Bipolar electric coagulation forceps | Mindray | Seal 7 | For blood vessel coagulation and division |
| Fluorescence Endoscopic camera system | Mindray | R1 | An endoscopic camera system with 4K fluorescence imaging |
| Intraoperative Ultrasonic imaging system | ALOKA | UST-5418 | With the four-directional flexible linear array ultrasonic laparoscopic transducer, the intraoperative ultrasound support ultrasonic elastography, contrast ultrasound, and magnetic navigation guided puncture |
| Intraoperative Ultrasonic imaging system | Mindray | LAP13-4Cs | Four-directional flexible linear array ultrasonic laparoscopic transducer which supports support ultrasonic elastography and contrast ultrasound |
| SPSS 20.0 | statistical analysis software | ||
| Ultrasonic scalpel | Johnson & Johnson | ETHICON GEN11 | For blood vessel coagulation and division |
Referenzen
- Zheng, R. S., et al. Cancer incidence and mortality in China, 2022. Chinese Journal of Oncology. 46 (3), 221-231 (2024).
- Qin, S. Primary liver cancer diagnosis and treatment Expert Panel of the Chinese Ministry of Health Guidelines on the diagnosis and treatment of primary liver cancer (2011 edition). Chin Clin Oncol. 1 (1), 10(2012).
- Makuuchi, M., Hasegawa, H., Yamazaki, S. Ultrasonically guided subsegmentectomy. Surg Gynecol Obstet. 161 (4), 346-350 (1985).
- Wang, X., Cao, J., Li, J. Anatomic liver resection based on portal territory with margin priority for hepatocellular carcinoma. JAMA Surg. 159 (6), 710-711 (2024).
- Urade, T., et al. Laparoscopic anatomical liver resection using indocyanine green fluorescence imaging. Asian J Surg. 43 (1), 362-368 (2020).
- Fuks, D., Aldrighetti, L., Jiao, L. R., Wakabayashi, G., Limongelli, P. Laparoscopic management of hepatocellular carcinoma: A critical reappraisal. Surg Laparosc Endosc Percutan Tech. 27 (4), 203-205 (2017).
- Morimoto, M., et al. Minimally invasive anatomic liver resection: Results of a survey of world experts. J Hepatobiliary Pancreat Sci. 29 (1), 33-40 (2022).
- Goh, E. L., Chidambaram, S., Ma, S. Laparoscopic vs open hepatectomy for hepatocellular carcinoma in patients with cirrhosis: A meta-analysis of the long-term survival outcomes. Int J Surg. 50, 35-42 (2018).
- Ban, D., et al. A novel difficulty scoring system for laparoscopic liver resection. J Hepatobiliary Pancreat Sci. 21 (10), 745-753 (2014).
- Sugioka, A., Kato, Y., Tanahashi, Y. Systematic extrahepatic Glissonean pedicle isolation for anatomical liver resection based on Laennec's capsule: proposal of a novel comprehensive surgical anatomy of the liver. J Hepatobiliary Pancreat Sci. 24 (1), 17-23 (2017).
- Xie, Q., Gao, F. A commentary on 'approaches of laparoscopic anatomical liver resection of segment 8 for hepatocellular carcinoma: a retrospective cohort study of short-term results at multiple centers in China'. Int J Surg. 111 (1), 1646-1647 (2023).
- Ciria, R., et al. Study group of Precision Anatomy for Minimally Invasive Hepato-Biliary-Pancreatic surgery (PAM-HBP surgery). A snapshot of the 2020 conception of anatomic liver resections and their applicability on minimally invasive liver surgery. A preparatory survey for the Expert Consensus Meeting on Precision Anatomy for Minimally Invasive HBP Surgery. J Hepatobiliary Pancreat Sci. 29 (1), 41-50 (2022).
- Morimoto, M., et al. and Study group of Precision Anatomy for Minimally Invasive Hepato-Biliary-Pancreatic surgery (PAM-HBP surgery). Glissonean approach for hepatic inflow control in minimally invasive anatomic liver resection: A systematic review. J Hepatobiliary Pancreat Sci. 29 (1), 51-65 (2022).
- Fuks, D., Aldrighetti, L., Jiao, L. R., Wakabayashi, G., Limongelli, P. Laparoscopic management of hepatocellular carcinoma: A critical reappraisal. Surg Laparosc Endosc Percutan Tech. 27 (4), 203-205 (2017).
- Monden, K., et al. Landmarks and techniques to perform minimally invasive liver surgery: A systematic review with a focus on hepatic outflow. J Hepatobiliary Pancreat Sci. 29 (1), 66-81 (2022).
- Kang, L. -M., Zhang, F. -W., Yu, F. -K., Xu, L. Pay attention to the application of indocyanine green fluorescence imaging technology in laparoscopic liver cancer resection. World J Clin Cases. 12 (23), 5288-5293 (2024).
- Cassinotti, E., et al. European Association for Endoscopic Surgery (EAES) consensus on Indocyanine Green (ICG) fluorescence-guided surgery. Surg Endosc. 37 (3), 1629-1648 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten