Method Article
Ressecção Anatômica Minimamente Invasiva do Segmento VIII do Fígado com Base no Território Portal para Tratamento de Carcinoma Hepatocelular
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este estudo detalha as técnicas de segmentectomia laparoscópica S8, enfatizando a transição da ressecção parcial para a anatômica guiada pela navegação do pedículo portal. A compreensão anatômica 3D aprimorada, as habilidades minimamente invasivas refinadas e o domínio do ultrassom intraoperatório melhoraram a precisão e a segurança do procedimento, reduzindo as complicações e otimizando os resultados cirúrgicos hepáticos por meio de protocolos de ressecção anatômica sistematizados.
Resumo
A hepatectomia é o tratamento primário para o carcinoma hepatocelular (CHC) e é categorizada em hepatectomia anatômica e hepatectomia não anatômica com base na extensão da ressecção. A hepatectomia anatômica utiliza o segmento ou subsegmento hepático do território portal (TP) como unidade anatômica básica, ressecando sistematicamente o TP portador do tumor e removendo completamente o sistema de Glisson que supre e demarca essa área para aumentar a eficácia oncológica. A hepatectomia não anatômica segue o princípio da ressecção oncológica radical, enfatizando a remoção do tecido hepático a mais de 1 cm de distância da margem do tumor. Com a popularização dos conceitos de cirurgia de precisão, a hepatectomia anatômica minimamente invasiva baseada em TPs tem sido amplamente aplicada. No entanto, a ressecção minimamente invasiva do segmento S8 do fígado ainda é considerada uma das ressecções hepáticas mais desafiadoras. Realizamos com sucesso uma ressecção anatômica do segmento do território portal S8 do fígado usando técnicas de ultrassom intraoperatório, laparoscopia fluorescente e dissecção da membrana de Lannaec, obtendo bons resultados clínicos em curto prazo.
Introdução
O carcinoma hepatocelular, comumente conhecido como câncer de fígado, é um dos tumores malignos mais comuns na China. Em 2022, houve 367.700 novos casos de câncer de fígado na China, tornando-se o quarto maior em termos de incidência; O número de óbitos chegou a 316.500, tornando-se a segunda principal causa de mortes relacionadas ao câncer1. A hepatectomia oferece uma das melhores oportunidades de sobrevida em longo prazo em pacientes com CHC2. A ressecção hepática pode ser classificada em ressecção hepática anatômica (RA) e ressecção hepática não anatômica (NAR) com base na extensão da ressecção. A RA envolve a ressecção completa de segmentos hepáticos anatomicamente independentes ou segmentos combinados, juntamente com o parênquima hepático dentro dos ramos da veia porta portadores do tumor, para obter melhores resultados oncológicos e evitar complicações de áreas isquêmicas residuais ou congestionadas. A vantagem da RA se reflete na meticulosidade da excisão do tumor e na preservação completa dos ductos hepáticos de entrada e saída do fígado remanescente3. Por outro lado, a NAR, também conhecida como ressecção hepática irregular, refere-se à ressecção do tecido hepático a mais de 1 cm da margem do tumor com base nos princípios da ressecção radical oncológica. Esse método cirúrgico não adere estritamente à segmentação anatômica do fígado, mas é adaptado de acordo com a localização e o tamanho do tumor, com o objetivo de preservar o máximo possível de tecido hepático normal, garantindo uma margem segura para a excisão do tumor.
Com o avanço dos conceitos de cirurgia de precisão e uma compreensão mais profunda da anatomia do fígado, a teoria e a prática da ressecção anatômica hepática baseada no território portal (PT-AR) ganharam reconhecimento e promoção inicial nos últimos anos4. O PT-AR envolve reconstrução tridimensional pré-operatória e análise de bacias para identificar o território portal (TP) portador do tumor e planejar a cirurgia de acordo. No intraoperatório, segmentos ou subsegmentos hepáticos dentro da bacia são usados como unidades anatômicas básicas, sendo a navegação de coloração por fluorescência verde de indocianina (ICG) o método primário, complementada pela exposição de veias hepáticas intersegmentares (IHVs) representativas. O fígado é então dissecado ao longo de fissuras fisiológicas para obter a ressecção completa da bacia portal portadora do tumor, garantindo a integridade e a preservação funcional do futuro remanescente hepático (FLR). A punção guiada por ultrassom intraoperatório sobreposta para coloração portal positiva ou coloração retrógrada após ligadura do pedículo hepático alvo é um requisito técnico fundamental para a obtenção do TP-AR.
A ressecção hepática laparoscópica é reconhecida por sua abordagem minimamente invasiva e resultados de recuperação superiores quando comparada à cirurgia aberta tradicional. No entanto, a complexidade da ressecção de diferentes segmentos hepáticos varia. A localização do segmento VIII do fígado profundamente no abdome superior, próximo às veias hepáticas e veia cava inferior, juntamente com o desafio de acessar diretamente o pedículo glissoneano do segmento VIII, torna a ressecção anatômica laparoscópica do fígado particularmente desafiadora para esse segmento 5,6,7,8,9.
Este estudo demonstra a ressecção anatômica regional da veia portal do segmento hepático S8 para carcinoma hepatocelular. Nosso objetivo é detalhar a técnica e as principais etapas desta cirurgia, incluindo a técnica de punção guiada por ultrassom laparoscópico e a técnica de dissecção do pedículo hepático baseada na membrana de Lannaec. Ao compartilhar este protocolo, esperamos fornecer evidências que apoiem a viabilidade e a segurança da ressecção anatômica regional do fígado venoso portal laparoscópico no tratamento do carcinoma hepatocelular S8, melhorando os resultados do tratamento do paciente.
Protocolo
O estudo envolvendo ressecção anatômica laparoscópica do fígado para o Segmento 8 (LALR-S8) aderiu às práticas éticas padrão. Recebeu aprovação do Comitê de Ética do Hospital Popular de Shenzhen (LL-KY-2020462). Além disso, o consentimento informado por escrito foi obtido de cada paciente, garantindo que a pesquisa esteja em conformidade com as normas e requisitos de ética médica.
1. Seleção de pacientes
- Use os seguintes critérios de inclusão:
- Realizar LALR-S8 em pacientes com tumores hepáticos benignos ou malignos e garantir que eles sejam submetidos a avaliações cardiopulmonares padrão, exames de sangue e avaliações bioquímicas; Certifique-se de que eles não tenham contra-indicações para cirurgia ou anestesia.
- Realize imagens pré-operatórias, incluindo angiografia por TC abdominal, reconstrução tridimensional do fígado e vasculatura e ressonância magnética aprimorada, bem como cálculos de volumes residuais e padrão do fígado.
- Utilizar os seguintes critérios de exclusão: pacientes com função hepática classificados como Pugh-Child Classe C; aqueles que não toleram anestesia geral; pacientes com metástases intra-hepáticas ou extra-hepáticas; aqueles que foram submetidos a cirurgia aberta; e pacientes que receberam ressecções segmentares ou outros tratamentos cirúrgicos combinados.
2. Preparo pré-operatório, posição cirúrgica e anestesia
- Preparo pré-operatório
- História e exame físico: Avalie a função hepática, o perfil de coagulação, o teste de depuração do ICG e o estado geral de saúde.
- Imagem: Obtenha imagens pré-operatórias detalhadas (por exemplo, TC abdominal aprimorada, ressonância magnética e reconstrução tridimensional do fígado e vasculatura) para delinear a anatomia do segmento 8 do fígado e sua vasculatura (Figura 1)
- Jejum: Certifique-se de que o paciente siga as instruções de jejum, geralmente a partir da meia-noite do dia anterior à cirurgia.
- Medicamentos: Administre antibióticos profiláticos, se necessário, e revise quaisquer medicamentos que possam afetar o sangramento ou a função hepática.
- Consentimento informado e educação: Explique o procedimento laparoscópico, incluindo seus métodos, riscos e benefícios, e obtenha o consentimento informado.
- Posição cirúrgica
- Posição supina: Posicione o paciente na mesa de operação na posição supina.
- Posição de Trendelenburg reversa: Incline levemente a mesa de operação para facilitar a exposição e o acesso ao fígado.
NOTA: Esta posição ajuda a mover o fígado para cima e para longe da parte superior do abdômen. - Estabilização: Prenda o paciente à mesa de operação para evitar movimentos durante o procedimento.
- Anestesia
- Anestesia geral: Administre anestesia geral para garantir que o paciente permaneça inconsciente e confortável durante toda a cirurgia.
- Indução e manutenção: Use agentes de indução intravenosa (por exemplo, propofol) e relaxantes musculares (por exemplo, succinilcolina) para intubação. Mantenha a anestesia com agentes inalatórios (por exemplo, sevoflurano) e analgésicos suplementares (por exemplo, fentanil). Ajuste a profundidade da anestesia para garantir a anestesia adequada e a segurança do paciente.
- Monitoramento: Monitore continuamente a frequência cardíaca, pressão arterial, saturação de oxigênio no sangue e níveis de dióxido de carbono expirado.
3. Técnicas cirúrgicas
- Após a anestesia inalatória intravenosa, posicione o paciente em decúbito lateral esquerdo de 30° com a elevação da cabeça e as pernas separadas. Use uma abordagem de cinco portas para ressecção hepática, com uma pressão de insuflação mantida em 11-13 mmHg, pressão venosa central em 3-5 cmH2O, e a manobra de Pringle aplicada por 10-15 min de oclusão seguida por uma liberação de 5 min.
- Faça uma incisão vertical 2 cm abaixo da borda direita do umbigo e abra as camadas da parede abdominal sequencialmente para acessar o abdômen. Insira um trocarte de 12 mm para estabelecer o pneumoperitônio e, em seguida, introduza o laparoscópio na cavidade abdominal.
- Coloque cinco trocartes da seguinte forma: um trocarte de 12 mm na região sucumbilical para observação; um trocarte de 5 mm na linha axilar anterior direita; um trocarte de 12 mm abaixo da clavícula medial direita; um trocarte de 5 mm horizontalmente 2 cm abaixo do apêndice xifóide; e um trocarte de 12 mm 2 cm acima do umbigo (Figura 2).
NOTA: Os instrumentos cirúrgicos comuns usados na ressecção hepática incluem ultrassom laparoscópico intraoperatório, bisturi harmônico e dispositivos de coagulação bipolar. - Use ultrassom laparoscópico intraoperatório (LUS) para guiar a punção, com ICG para coloração positiva da ressecção anatômica do segmento hepático S8:
- Dissecção dos ligamentos circundantes e identificação de P8: Dissecar os ligamentos circundantes do lobo hepático direito e usar a sonda LUS para identificar o ramo da veia porta para o segmento 8 (P8), ajustando a posição da punção e o ângulo da agulha conforme necessário.
- Inserção da sonda de ultrassom e coloração positiva com ICG: Insira a sonda de ultrassom laparoscópica BK através da porta do trocarte de 12 mm. Perfure o P8 com uma agulha de colangiografia trans-hepática percutânea (PTC) de 21 G guiada pelo LUS. Injete 5-10 mL de ICG a 1,25% através da agulha para corar o segmento VIII, garantindo que não haja fluxo retrógrado para segmentos adjacentes (Figura 3)
- Coloração negativa da ressecção anatômica do segmento hepático S8 por meio da abordagem hilar:
- Dissecção do pedículo hepático S8: Expor o hilo hepático anterior direito com base na membrana de Lannaec entre a porta VI e a porta V10. Em seguida, dissecar ao longo do lado ventral do pedículo hepático anterior direito e em direção ao lado cefálico à esquerda para expor o pedículo hepático S8; mobilize e levante esse pedículo.
- Hemostasia e coloração negativa: Após a dissecção do hilo, aplicar pinça vascular para hemostasia do pedículo hepático S8 (Figura 4) e confirmar a linha isquêmica do segmento S8 para incluir o tumor. Injete 5-10 mL de ICG a 1,25% através da veia periférica. Procure o segmento VIII que será delineado pela fluorescência após 5 min (Figura 5).
- Ressecção hepática guiada por interface fluorescente: Monitore a fluorescência para confirmar que a área corada cobre o tumor. Faça incisões ao longo da interface entre as áreas fluorescentes e não fluorescentes usando bisturi ultrassônico ou CUSA, preservando as veias hepáticas intersegmentares (Figura 6).
NOTA: Tanto o tumor quanto o segmento ou subsegmento hepático do TP podem ser ressecados completamente dessa maneira. - Hemostasia e inspeção: Obter hemostasia por eletrocautério ou sutura após a ressecção da lesão. Inspecione o local da ressecção para confirmar se não há sangramento residual ou vazamento de bile. Na seção transversal, observe as veias intersegmentares e a extremidade do segmento P8 (Figura 7).
Resultados
Entre janeiro de 2022 e dezembro de 2023, um total de 17 pacientes foram submetidos à hepatectomia do segmento S8. Destes, sete casos envolveram ressecções não anatômicas, seis casos foram ressecções anatômicas por via do parênquima hepático e quatro casos foram ressecções anatômicas do território portal. Não houve diferenças significativas nos escores pré-operatórios de Child-Pugh, tamanho do tumor e função de reserva hepática entre os grupos. O tempo cirúrgico para o grupo de ressecção anatômica TP foi maior do que para os grupos de ressecção anatômica não anatômica e ressecção anatômica por via parenquimatosa hepática, principalmente devido à punção portal relativamente desafiadora ou dissecção dos segmentos hepáticos correspondentes, que exigiu mais tempo. Não houve diferenças significativas na perda sanguínea intraoperatória entre os grupos, mas o nível máximo de ALT no pós-operatório foi menor no grupo de ressecção anatômica do território portal em comparação com os outros dois grupos, provavelmente porque esse grupo tinha menos tecido hepático residual não funcional. Todas as margens cirúrgicas excederam 1 cm, sendo que o grupo de ressecção anatômica TP apresentou margens maiores do que os outros dois grupos. Nenhum vazamento de bile ocorreu em nenhum caso, e não houve reoperações não planejadas. A análise ANOVA de uma via foi empregada para os dados de contagem e o teste de soma de postos foi utilizado para os dados de medição. Os resultados específicos estão detalhados na Tabela 1.
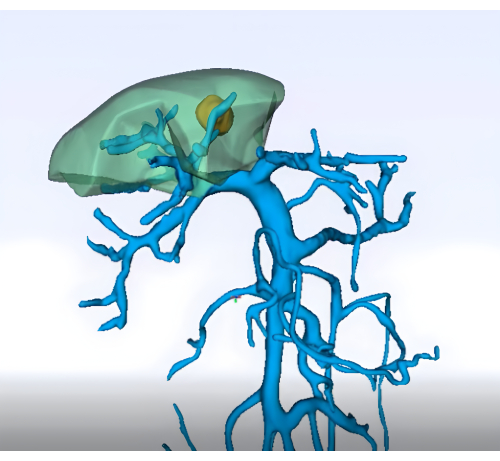
Figura 1: Análise pré-operatória do território da veia porta com tecnologia de reconstrução tridimensional. Clique aqui para ver uma versão maior desta figura.
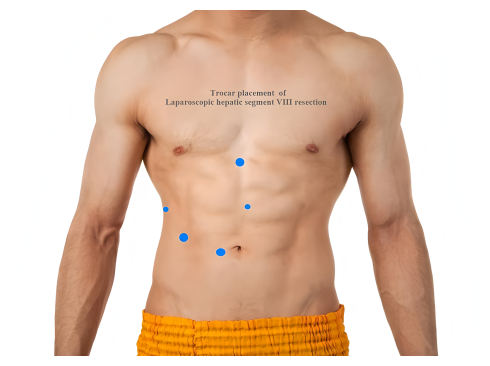
Figura 2: Colocação do trocarte de ressecção laparoscópica do segmento VIII hepático. Clique aqui para ver uma versão maior desta figura.
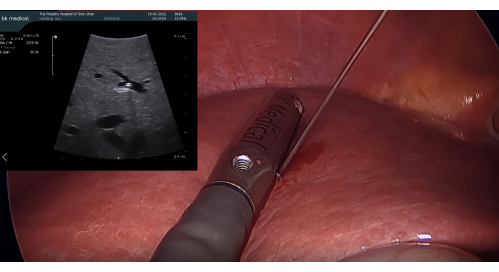
Figura 3: Punção de P8 com agulha PTC 21 G guiada pela sonda de ultrassom laparoscópica. Abreviatura: PTC = colangiografia trans-hepática percutânea. Clique aqui para ver uma versão maior desta figura.
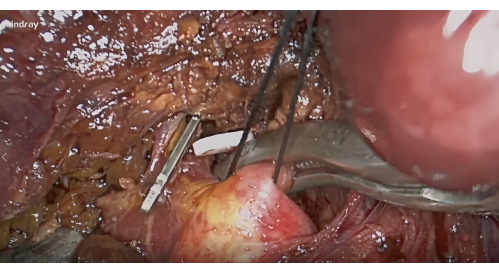
Figura 4: Dissecção dos pedículos hepáticos do segmento VIII ao longo da membrana de Lannaec e bloqueio com pinça vascular. Clique aqui para ver uma versão maior desta figura.

Figura 5: Marcação da linha de ressecção após coloração negativa. Clique aqui para ver uma versão maior desta figura.
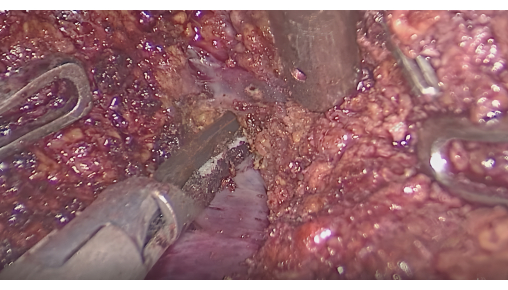
Figura 6: Dissecção do parênquima hepático entre veias intersegmentares. Clique aqui para ver uma versão maior desta figura.
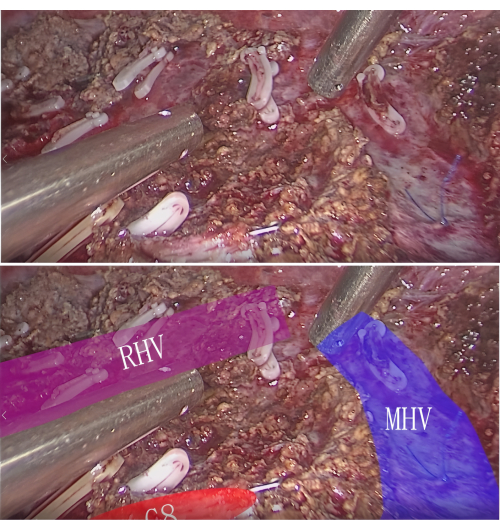
Figura 7: Veia intersegmentar e coto P8 na seção de ressecção. Clique aqui para ver uma versão maior desta figura.
| ressecção não anatômica (n=7) | ressecções anatômicas por via parenquimatosa (n=6) | ressecção anatômica baseada no território da veia portal (n=4) | Valor F /χ2 | Valor de p | |
| Escore pré-operatório de Child-Pugh | 5.4±0.8 | 5.2±0.4 | 5.3±0.5 | 0.306 | 0.741 |
| Tamanho do tumor (cm) | 3,4±1,5 | 3.1±0.8 | 2,8±0,6 | 0.454 | 0.644 |
| ICG pré-operatório 15 min taxa de retenção (%) | - | - | - | 0.195 | 0.907 |
| Tempo operatório (min) | 189±52 | 201±36 | 268±51 | 3.826 | 0.047 |
| Perda de sangue (mL) | 228±135 | 175±52 | 170±24 | 0.716 | 0.506 |
| Margem cirúrgica mínima (cm) | 1,3±0,5 | 1,7±0,3 | 2.0±0.4 | 3.972 | 0.043 |
| Pico de ALT pós-operatória (U/L) | 328±109 | 219±45 | 152±38 | 7.045 | 0.008 |
| Níveis de bilirrubina no 5º dia pós-operatório (μmol/L) | 17.2±8.2 | 18.1±4.2 | 14.7±4.3 | 0.389 | 0.685 |
| Tempo de alta pós-operatória (dias) | 7.5±1.3 | 6,7±0,8 | 6.3±1.0 | 2.279 | 0.139 |
| Vazamento biliar pós-operatório | 0 | 0 | 0 | - | - |
| Reoperação não planejada | 0 | 0 | 0 | - | - |
Tabela 1: Comparação dos dados clínicos entre os diferentes grupos.
Discussão
A ressecção do segmento S8 do fígado, particularmente a ressecção anatômica, continua sendo um desafio significativo11. A base teórica da hepatectomia anatômica baseada em pedículo portal ainda não ganhou ampla aceitação na comunidade cirúrgica hepática. Consequentemente, os cirurgiões hepatobiliares continuam a buscar evidências clínicas robustas para avaliar objetivamente o valor terapêutico da ressecção anatômica do fígado. Avanços recentes na reconceituação anatômica hepática, particularmente em relação à cápsula de Laennec e à teoria dos seis setores, permitiram teoricamente a identificação e dissecção precisas de pedículos hepáticos individuais correspondentes a segmentos ou subsegmentos específicos. A integração da laparoscopia fluorescente e da ultrassonografia laparoscópica facilitou ainda mais a realização da hepatectomia anatômica laparoscópica, permitindo a visualização em tempo real dos limites territoriais de perfusão e a navegação intraoperatória. De acordo com a conferência de consenso de especialistas de Tóquio de 202112, a ressecção anatômica é definida como a remoção completa de porções hepáticas associadas a territórios específicos da veia porta, delineados por ramos terciários da veia porta. A ressecção anatômica do fígado é caracterizada pela excisão completa de segmentos, subsegmentos ou segmentos combinados do fígado anatomicamente independentes 11,13. Em comparação com a ressecção hepática não anatômica, a ressecção anatômica remove simultaneamente os segmentos hepáticos correspondentes associados ao território de ramo da veia porta relevante, teoricamente reduzindo o risco de disseminação do tumor através do fluxo sanguíneo venoso portal no segmento hepático afetado e minimizando as complicações pós-operatórias. Consequentemente, atualmente é considerada a abordagem cirúrgica preferida para o câncer de fígado14.
Os planos intersegmentares ou segmentares do fígado são determinados pelos limites dos territórios da veia porta. As veias hepáticas que atravessam esses planos são chamadas de veias intersegmentares, que servem como marcos importantes durante a ressecção hepática, permitindo a identificação precisa por meio da exposição contínua no plano de corte15. Este método requer experiência em imagens de ultrassom hepático, uso proficiente de LUS e técnicas de punção, que exigem uma curva de aprendizado. Com base em nossa experiência, a aplicação qualificada do ultrassom intraoperatório é crucial para aumentar as taxas de sucesso cirúrgico e a segurança do paciente. Os cirurgiões em todos os níveis devem começar se familiarizando com o reconhecimento e interpretação de imagens de ultrassom por meio de intervenções de ultrassom percutâneas de rotina, dominando as habilidades operacionais básicas. Posteriormente, eles devem progredir para a aplicação do ultrassom em cirurgias abertas, aprendendo a utilizar o ultrassom para guiar ressecções hepáticas e avaliar tumores hepáticos. Esta fase do treinamento reforçará a compreensão dos cirurgiões sobre as estruturas anatômicas intraoperatórias. Em última análise, os profissionais devem ter como objetivo dominar o uso do ultrassom intraoperatório em procedimentos laparoscópicos para obter maior precisão, especialmente em situações com visualização limitada. Por meio desse processo gradual de aprendizado e prática, os cirurgiões se tornarão adeptos do emprego da tecnologia de ultrassom em cirurgias complexas, aumentando significativamente a segurança e a eficácia.
A técnica LALR-S8 visa localizar efetivamente o suprimento vascular para o segmento S8 e definir o plano intersegmentar. Makuuchi e col. foram os primeiros a propor um método para direcionar a veia porta sob orientação de ultrassom, seguido de injeção de corante para esclarecer a perfusão do segmentotumoral 3. Em 2008, Aoki et al. foram pioneiros na aplicação da tecnologia de imagem de fluorescência para localização de segmentos durante cirurgia hepática16. Atualmente, o método guiado por fluorescência ICG sob LUS tornou-se uma técnica padrão para aumentar a precisão das ressecções anatômicas laparoscópicasdo fígado 17. Essa abordagem não apenas aborda a limitação das linhas isquêmicas serem visíveis apenas na superfície do fígado, mas também fornece visualização em tempo real de linhas de demarcação fluorescentes claras no plano intersegmentar. A abordagem glissoneana com coloração de fluorescência ICG permite a ressecção anatômica do fígado, maximizando a preservação do tecido hepático residual funcional e minimizando o sangramento intraoperatório.
Makuuchi propôs que a ressecção anatômica do fígado para o segmento S8 deveria incluir quatro etapas: (1) marcar os limites do segmento hepático na superfície usando técnicas de coloração ou oclusão do fluxo sanguíneo; (2) realização de ressecção do parênquima hepático guiada por ultrassonografia, utilizando como limite a veia de referência desse segmento hepático; (3) alcançar a exposição total de veias significativas na superfície de corte do fígado; (4) ligando o sistema de Glisson próximo à raiz do segmento hepático3. Os ramos da veia porta para o segmento S8 consistem principalmente nos ramos ventral e dorsal. O ramo dorsal do segmento S8 normalmente se bifurca perto da raiz da veia porta anterior direita, enquanto o ramo da veia porta do segmento S5 se bifurca em seu lado terminal, necessitando de coloração de punção separada para os ramos ventral e dorsal. Há um ramo proeminente da veia hepática média (V8) correndo entre o ramo dorsal do segmento S8 e a veia porta anterior direita, responsável pela drenagem venosa de S8. Após a ressecção total do segmento S8, a veia hepática média, a veia hepática direita e a veia cava inferior podem ser vistas na superfície de corte.
De janeiro de 2022 a dezembro de 2023, um total de 17 pacientes foram submetidos à segmentectomia hepática S8. Todos os pacientes se recuperaram e receberam alta sem maiores complicações. Nossa experiência em cirurgia hepática enfatiza a integração de conhecimentos teóricos e habilidades práticas, particularmente no aprendizado detalhado da anatomia intra-hepática, recomendando a prática de dissecção usando fígados cadavéricos. Além disso, enfatizamos a importância de dominar as técnicas laparoscópicas por meio de treinamento de simulação e participação em procedimentos minimamente invasivos. A familiaridade com vários instrumentos endoscópicos, como bisturis harmônicos e ultrassom intraoperatório, é crucial. Além disso, é essencial aproveitar o treinamento no local e os debriefings cirúrgicos para entender a teoria e as técnicas de ressecção anatômica do fígado, com foco no aumento gradual da complexidade do procedimento e, finalmente, na simplificação. A aplicação proficiente de ultrassom intraoperatório, a estreita colaboração dentro da equipe cirúrgica e a auto-revisão completa do desempenho cirúrgico são igualmente críticas. Um mecanismo de resgate intraoperatório eficaz é vital, garantindo a conversão oportuna para cirurgia aberta quando necessário e garantindo o apoio de cirurgiões seniores para aumentar o sucesso do procedimento.
De nossa experiência, temos os seguintes insights: (1) Domine a anatomia segmentar 3D por meio de treinamento cadavérico com foco na microdissecção pedicular glissoneana. (2) Refinar as habilidades laparoscópicas por meio de exercícios minimamente invasivos baseados em simulação para precisão do instrumento. (3) Otimize os dispositivos de energia (bisturi ultrassônico / fluorescência CUSA / ICG) para transecção parenquimatosa segura. (4) Implementar o Aprendizado Multimodal, combinando análise de vídeo e debriefings de casos para otimização da estratégia de AR. (5) Melhorar a sinergia da equipe com controle de PVC gerenciado por anestesiologista e assistência cirúrgica proficiente. (6) Estabelecer protocolos de resgate que definam limiares de conversão abertos e caminhos de escalonamento de cirurgiões seniores.
No entanto, este estudo apresenta algumas limitações, pois envolve apenas alguns casos. Além disso, o estudo é retrospectivo e a seleção de pacientes é limitada. Estudos prospectivos mais precisamente desenhados são necessários para comparar ainda mais as vantagens e desvantagens de diferentes técnicas de ressecção hepática minimamente invasiva. Compartilharemos nossas experiências prontamente após a obtenção de dados mais confiáveis.
Divulgações
Os autores não têm conflitos de interesse ou vínculos financeiros a divulgar.
Agradecimentos
Este trabalho foi apoiado por doações do Projeto do Fundo de Pesquisa Básica e Aplicada da Província de Guangdong (nº 2023A1515220114); o Projeto Principal de Ciência e Tecnologia da Comissão Municipal de Inovação em Ciência e Tecnologia de Shenzhen (Nº KJZD20230923114120038), Fundo de Construção de Disciplina Médica Chave de Shenzhen (Nº SZXK015); e Projeto de Construção de Especialidade Clínica Chave Provincial e Nacional de Guangdong e Projeto de Construção de Especialidade Clínica Chave Nacional.
Materiais
| Name | Company | Catalog Number | Comments |
| Bipolar electric coagulation forceps | Mindray | Seal 7 | For blood vessel coagulation and division |
| Fluorescence Endoscopic camera system | Mindray | R1 | An endoscopic camera system with 4K fluorescence imaging |
| Intraoperative Ultrasonic imaging system | ALOKA | UST-5418 | With the four-directional flexible linear array ultrasonic laparoscopic transducer, the intraoperative ultrasound support ultrasonic elastography, contrast ultrasound, and magnetic navigation guided puncture |
| Intraoperative Ultrasonic imaging system | Mindray | LAP13-4Cs | Four-directional flexible linear array ultrasonic laparoscopic transducer which supports support ultrasonic elastography and contrast ultrasound |
| SPSS 20.0 | statistical analysis software | ||
| Ultrasonic scalpel | Johnson & Johnson | ETHICON GEN11 | For blood vessel coagulation and division |
Referências
- Zheng, R. S., et al. Cancer incidence and mortality in China, 2022. Chinese Journal of Oncology. 46 (3), 221-231 (2024).
- Qin, S. Primary liver cancer diagnosis and treatment Expert Panel of the Chinese Ministry of Health Guidelines on the diagnosis and treatment of primary liver cancer (2011 edition). Chin Clin Oncol. 1 (1), 10(2012).
- Makuuchi, M., Hasegawa, H., Yamazaki, S. Ultrasonically guided subsegmentectomy. Surg Gynecol Obstet. 161 (4), 346-350 (1985).
- Wang, X., Cao, J., Li, J. Anatomic liver resection based on portal territory with margin priority for hepatocellular carcinoma. JAMA Surg. 159 (6), 710-711 (2024).
- Urade, T., et al. Laparoscopic anatomical liver resection using indocyanine green fluorescence imaging. Asian J Surg. 43 (1), 362-368 (2020).
- Fuks, D., Aldrighetti, L., Jiao, L. R., Wakabayashi, G., Limongelli, P. Laparoscopic management of hepatocellular carcinoma: A critical reappraisal. Surg Laparosc Endosc Percutan Tech. 27 (4), 203-205 (2017).
- Morimoto, M., et al. Minimally invasive anatomic liver resection: Results of a survey of world experts. J Hepatobiliary Pancreat Sci. 29 (1), 33-40 (2022).
- Goh, E. L., Chidambaram, S., Ma, S. Laparoscopic vs open hepatectomy for hepatocellular carcinoma in patients with cirrhosis: A meta-analysis of the long-term survival outcomes. Int J Surg. 50, 35-42 (2018).
- Ban, D., et al. A novel difficulty scoring system for laparoscopic liver resection. J Hepatobiliary Pancreat Sci. 21 (10), 745-753 (2014).
- Sugioka, A., Kato, Y., Tanahashi, Y. Systematic extrahepatic Glissonean pedicle isolation for anatomical liver resection based on Laennec's capsule: proposal of a novel comprehensive surgical anatomy of the liver. J Hepatobiliary Pancreat Sci. 24 (1), 17-23 (2017).
- Xie, Q., Gao, F. A commentary on 'approaches of laparoscopic anatomical liver resection of segment 8 for hepatocellular carcinoma: a retrospective cohort study of short-term results at multiple centers in China'. Int J Surg. 111 (1), 1646-1647 (2023).
- Ciria, R., et al. Study group of Precision Anatomy for Minimally Invasive Hepato-Biliary-Pancreatic surgery (PAM-HBP surgery). A snapshot of the 2020 conception of anatomic liver resections and their applicability on minimally invasive liver surgery. A preparatory survey for the Expert Consensus Meeting on Precision Anatomy for Minimally Invasive HBP Surgery. J Hepatobiliary Pancreat Sci. 29 (1), 41-50 (2022).
- Morimoto, M., et al. and Study group of Precision Anatomy for Minimally Invasive Hepato-Biliary-Pancreatic surgery (PAM-HBP surgery). Glissonean approach for hepatic inflow control in minimally invasive anatomic liver resection: A systematic review. J Hepatobiliary Pancreat Sci. 29 (1), 51-65 (2022).
- Fuks, D., Aldrighetti, L., Jiao, L. R., Wakabayashi, G., Limongelli, P. Laparoscopic management of hepatocellular carcinoma: A critical reappraisal. Surg Laparosc Endosc Percutan Tech. 27 (4), 203-205 (2017).
- Monden, K., et al. Landmarks and techniques to perform minimally invasive liver surgery: A systematic review with a focus on hepatic outflow. J Hepatobiliary Pancreat Sci. 29 (1), 66-81 (2022).
- Kang, L. -M., Zhang, F. -W., Yu, F. -K., Xu, L. Pay attention to the application of indocyanine green fluorescence imaging technology in laparoscopic liver cancer resection. World J Clin Cases. 12 (23), 5288-5293 (2024).
- Cassinotti, E., et al. European Association for Endoscopic Surgery (EAES) consensus on Indocyanine Green (ICG) fluorescence-guided surgery. Surg Endosc. 37 (3), 1629-1648 (2023).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados