Method Article
Farmacologia de Rede e Validação dos Mecanismos Antidepressivos de Qiangzhifang em um Modelo de Rato de Depressão Induzida por Estresse de Contenção Crônica
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este estudo avaliou a eficácia antidepressiva de Qiangzhifang em um modelo de rato de depressão induzida por estresse de contenção crônica e elucidou seu efeito regulatório nas vias HIF-1 e JAK-STAT por farmacologia de rede e análise de docking molecular.
Resumo
A depressão é um transtorno psiquiátrico complexo que apresenta desafios significativos de tratamento. Qiangzhifang (QZF), um composto usado na medicina tradicional chinesa, demonstra potencial eficácia clínica no tratamento da depressão. No entanto, os mecanismos de ação e os ingredientes ativos do QZF não foram totalmente elucidados. O objetivo principal deste estudo foi elucidar os ingredientes ativos eficazes e os potenciais mecanismos moleculares do QZF para o alívio da depressão, integrando previsões de farmacologia de rede com validações experimentais.
Adotamos um modelo de estresse crônico de contenção (CRS) em ratos e realizamos testes comportamentais como o teste de campo aberto (OFT), teste de preferência por sacarose (SPT) e teste de nado forçado (FST) para avaliar os efeitos terapêuticos do QZF na depressão. Em relação aos parâmetros comportamentais, o grupo QZF apresentou massa corporal, razão de preferência por sacarose e tempo de residência na zona central significativamente maiores em comparação com o grupo modelo (P < 0,01, P < 0,01, P < 0,01) e um tempo de imobilização significativamente reduzido no teste de nado forçado (P < 0,001). Estudos de farmacologia de rede e docking molecular sugerem que o QZF pode ter efeitos antidepressivos modulando as vias HIF-1 e JAK-STAT, com genes-alvo importantes, incluindo AKT1, IL-6, MTOR e TP53, implicados em inflamação, neuroproteção e apoptose. Em conclusão, este estudo oferece novos insights sobre a modernização e o desenvolvimento de compostos da medicina chinesa para o tratamento abrangente da depressão.
Introdução
A depressão, um desafio generalizado de saúde global, é caracterizada por um humor deprimido persistente, interesse e prazer reduzidos e deficiências cognitivas e neurológicas1. Conforme relatado pela Organização Mundial da Saúde, a depressão afeta aproximadamente 380 milhões de pessoas em todo o mundo, e esse número deve aumentar2. Como um transtorno mental complexo e multifatorial, a depressão afeta a qualidade de vida dos pacientes e representa um ônus econômico e médico considerável para a sociedade, caracterizado por altas taxas de incidência, recorrência e incapacidade3.
A etiologia da depressão é complexa, com os mecanismos precisos ainda não totalmente compreendidos. À medida que a pesquisa neste campo progride, fatores como neuroinflamação, estresse oxidativo e apoptose têm atraído atenção significativa. Estudos indicam que pacientes com depressão apresentam níveis elevados de citocinas pró-inflamatórias como TNF e interleucina-1β em comparação com indivíduos saudáveis, e uma maior prevalência de depressão é observada naqueles com condições inflamatórias4. No estresse oxidativo, as espécies reativas de oxigênio (ROS) são produzidas em excesso em resposta a estímulos nocivos, sobrecarregando as defesas antioxidantes do corpo e levando a um desequilíbrio entre os sistemas oxidativo e antioxidante, causando danos aos tecidos. O estresse oxidativo elevado na depressão pode aumentar a peroxidação lipídica e exacerbar os danos aos genes e proteínas celulares, impactando a função neuronal e contribuindo para a degeneração neuronal, apoptose e plasticidade prejudicada5. Além disso, as alterações observadas nas apresentações clínicas, marcadores bioquímicos e estruturas cerebrais em pacientes com depressão estão ligadas à apoptose. Estudos de imagem revelam redução do volume hipocampal e atrofia em pacientes com depressão, com a apoptose neuronal potencialmente desempenhando um papel fundamental nessas alterações6.
Atualmente, o tratamento medicamentoso é a principal abordagem para o manejo da depressão, sendo os inibidores seletivos da recaptação da serotonina (ISRSs) e os inibidores da recaptação da norepinefrina (NRIs) frequentemente empregados na prática clínica7. No entanto, esses medicamentos são acompanhados por efeitos adversos significativos. Além dos sintomas do sistema nervoso central, como dor de cabeça e insônia, a maioria dos antidepressivos também costuma apresentar efeitos colaterais gastrointestinais, incluindo náuseas e diarreia 8,9. Alguns antidepressivos também podem causar disfunção sexual10, o que afeta gravemente os resultados do tratamento e reduz a adesão à medicação entre pacientes com depressão11. Além disso, a eficácia desses medicamentos é limitada para alguns pacientes. Estudos metabolômicos recentes indicaram que diferenças individuais na microbiota intestinal podem influenciar a eficácia do medicamento12. Portanto, o desenvolvimento de tratamentos mais seguros e eficazes continua sendo um foco crítico na pesquisa da depressão.
As formulações da medicina tradicional chinesa (MTC) demonstraram um potencial significativo no tratamento da depressão, atribuído aos seus efeitos sinérgicos envolvendo múltiplos componentes, alvos e vias13. A MTC postula que o qi Yang vigoroso é essencial para manter a vitalidade do corpo. Portanto, o professor Yuanqing Ding, aproveitando os princípios únicos do diagnóstico e tratamento da MTC e a extensa experiência clínica, propôs que "yang yu shen tui" é a patogênese fundamental da depressão. Com base nesse conceito, ele desenvolveu o Qiangzhifang (QZF) para abordar especificamente essa patogênese14. A aplicação clínica do QZF no tratamento da depressão demonstrou eficácia significativa, com uma taxa efetiva total de 71,43%15. O QZF é composto por vários materiais medicinais tradicionais chineses, incluindo Ramulus cinnamomi (gui zhi, GZ), Polygala tenuifolia (yuan zhi, YZ), Alpinia oxyphylla miq (yi zhi ren, YZR), Paeonia lactiflora (bai shao, BS), Fritillariae cirrhosae bulbus (chuan bei mu, CBM), Panax ginseng (ren shen, RS), Rhodiola rosea L (hong jing tian, HJT) e alcaçuz (gan cao, GC) (Arquivo Suplementar 1). Estudos demonstraram que Polygala tenuifolia é rica em saponinas e exibe efeitos neuroprotetores16. Da mesma forma, o par de ervas Ramulus Cinnamomi-Paeonia lactiflora demonstra eficácia potencial no alívio da dor e da depressão17. Além disso, as saponinas totais do ginseng podem reduzir os níveis de citocinas pró-inflamatórias do hipocampo, melhorar o comportamento depressivo e atenuar os danos ao nervo hipocampal em ratos18. O alcaçuz contém principalmente triterpenóides e flavonóides. Os flavonóides totais (LF) do alcaçuz podem desempenhar um papel antidepressivo, melhorando o comportamento depressivo, modulando a via de sinalização BDNF / TrkB e aumentando a plasticidade sináptica19. No entanto, os mecanismos específicos subjacentes aos efeitos antidepressivos do QZF permanecem obscuros, limitando assim sua aplicação generalizada.
Portanto, nosso estudo visa estabelecer um modelo de RSC em ratos com depressão, demonstrar o efeito terapêutico do QZF na depressão em ratos por meio de experimentos comportamentais e avaliar sistematicamente o mecanismo antidepressivo do QZF usando farmacologia de rede e tecnologia de docking molecular20. Ao esclarecer os componentes ativos e os alvos potenciais do QZF, os principais alvos da depressão podem ser localizados com precisão. Acreditamos que, ao explorar profundamente o mecanismo de ação do QZF, podemos não apenas fornecer opções de tratamento mais seguras e eficazes para pacientes com depressão, mas também fornecer uma base científica para a aplicação da MTC no tratamento da depressão.
Protocolo
Todos os protocolos experimentais foram aprovados pelo Comitê de Ética em Experimentos Animais da Universidade de Medicina Tradicional Chinesa de Shandong (número de aprovação: YYLW2023000327) e obedeceram ao Guia para o Cuidado e Uso de Animais de Laboratório emitido pelos Institutos Nacionais de Saúde. Neste experimento, foram utilizados 40 ratos Wistar machos, saudáveis, grau FPS, com peso corporal médio de (140 ± 10) g (Figura 1). Consulte a Tabela de Materiais para obter uma lista de todos os materiais, equipamentos e software usados neste protocolo.
1. Modelo de depressão de rato
- Alojamento e agrupamento de animais
- Entre na sala de criação com os animais e numere-os usando um instrumento de marcação de cauda.
- Aloje os ratos individualmente em gaiolas, mantendo uma temperatura de 21 ± 2 °C e um ciclo claro/escuro de 12 h/12 h.
- Aclimatar os ratos em laboratório por 7 dias, proporcionando acesso ad libitum a comida e água enquanto os manuseia diariamente para adaptação.
- Após o período de aclimatação, medir o peso corporal e realizar os testes de preferência de sacarose (SPT) e testes de campo aberto (OFT).
- Com base nos dados experimentais, divida os ratos em quatro grupos, garantindo que cada grupo seja composto por 10 ratos: o grupo controle (CON), o grupo modelo (CRS), o grupo QZF e o grupo fluoxetina (F).
- Estabelecimento de um modelo de rato de Estresse de Contenção Crônica (CRS)
- Construa o dispositivo de retenção de ratos. Selecione um tubo de plástico transparente com diâmetro e comprimento adequados ao tamanho21 do rato, permitindo que o rato fique de pé e vire para dentro, evitando a fuga. Use um furador elétrico de ferro de solda para criar furos nas laterais do tubo de plástico e na tampa para garantir a circulação de ar adequada.
- Coloque suavemente os ratos nos dispositivos de contenção (exceto os do Grupo C) 1 h após a administração intragástrica diária do medicamento, garantindo que estejam em uma posição confortável.
- Prive todos os grupos de ratos de comida e água durante o período de contenção. Após o término do período de contenção, forneça-lhes comida e água suficientes uniformemente. Fixe a duração diária da contenção em 6 h (das 9:30 h às 15:30 h) e mantenha-a por 28 dias consecutivos.
2. Intervenção medicamentosa
- Administrar via gavagem: 1 mL de solução/100 g de peso corporal, fluoxetina (2,7 mg·kg-1·dia-1) e QZF (2 g·kg-1·dia-1)22. Forneça aos Grupos C e SRC solução salina normal equivalente para controle de variável única.
NOTA: A administração diária do medicamento foi realizada às 08:00 h, iniciando-se de forma síncrona com o estabelecimento do modelo e persistindo durante todo o período de modelagem de 28 dias.
3. Teste de preferência de sacarose (SPT)
- Prive os ratos de comida e água por 24 horas antes do início do experimento.
- Preparar uma solução aquosa de sacarose a 1% e encher a solução e a água pura nos bebedouros dos animais experimentais para pesagem. Meça o consumo de água pura e água de sacarose pesando as garrafas antes e depois do experimento.
- Coloque uma garrafa de solução de sacarose e uma garrafa de água pura na entrada de água de cada tampa da gaiola de rato, uma à esquerda e outra à direita, para livre acesso à bebida. Para evitar que os ratos favoreçam um lado para a ingestão de água, troque as posições das garrafas de água à esquerda e à direita após 30 minutos do experimento.
- Após 1 h do experimento, remova todas as garrafas de água, pese-as prontamente e registre o consumo de solução de sacarose e água pura. Calcule a taxa semanal de preferência por sacarose usando a fórmula:
Valor de preferência de sacarose =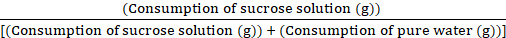 × 100%
× 100%
4. Medição do peso corporal
- Pesar os ratos semanalmente após a entrada no laboratório e definir o horário fixo para a pesagem às 7:00 da manhã. Estabeleça este esquema para facilitar a observação das mudanças de peso corporal.
5. Ensaio em campo aberto (OFT)
- Antes do início do experimento, aclimatar os ratos à sala comportamental por 1 h e ajustar a iluminação na caixa de campo aberto para garantir uma distribuição uniforme. Confirme se os ratos estão claramente visíveis no software de rastreamento.
- Utilize o sistema de rastreamento e análise de vídeo para dividir a superfície inferior da caixa de campo aberto (50 cm x 50 cm x 50 cm) em nove grades quadradas de área igual. Designe as oito grades adjacentes às paredes como a área periférica e a grade central como a área central.
- Coloque o rato na área central da caixa de campo aberto. Grave o movimento do rato por 5 minutos usando o sistema de rastreamento de vídeo.
- Depois de testar cada rato, limpe a câmara com etanol a 75% para remover o odor residual e evitar interferência no comportamento do próximo rato. Insira a distância total (mm) das atividades em campo aberto e o número de entradas na grade central nos registros OFT.
6. Teste de nado forçado (FST)
NOTA: O experimento de nado forçado com ratos compreende um pré-experimento e um experimento formal. Realizar o pré-experimento 24 h antes do experimento formal, seguindo o mesmo procedimento, com o rato nadando por 15 min.
- Transporte os animais experimentais para a sala comportamental pelo menos 30 minutos antes do experimento para permitir que eles se aclimatem ao ambiente.
- Prepare um cilindro cilíndrico transparente de água de plexiglass (50 cm de altura e 20 cm de diâmetro) e encha-o com água a 23-25 °C. Ajuste a profundidade da água com base no peso do animal, garantindo que a cauda do animal permaneça a uma certa distância do fundo do cilindro.
- Coloque lentamente os ratos no cilindro de água e fique quieto durante todo o experimento. Ative a câmera e o sistema de aquisição de sinal. Observe e registre a duração da imobilidade flutuante dentro de 300 s. Retire imediatamente os ratos da água e seque-os no final do experimento.
- Após cada sessão, substitua a água para evitar qualquer influência no próximo rato.
7. Predição farmacológica em rede
- Coleção de compostos QZF e alvos putativos
- Acesse o banco de dados de Farmacologia de Sistemas de Medicina Tradicional Chinesa (TCMSP) (https://old.tcmsp-e.com/)23, o banco de dados HERB24 e o banco de dados TCMID (https://www.bidd.group/TCMID/). Use os oito nomes TCM em QZF, incluindo GZ, YZ, YZR, BS, CBM, RS, HJT e ZGC, como palavras-chave para pesquisar compostos ativos e alvos das ervas. Colete alvos do TCMSP e da previsão de alvo suíço (http://www.swisstargetprediction.ch/). Defina o valor do filtro como Probabilidade* > 0.
NOTA: Normalmente, os ingredientes foram incluídos como ingredientes ativos com base em suas características farmacocinéticas: biodisponibilidade oral (OB) ≥ 30% e características semelhantes a medicamentos (DL) ≥ 0,1825.
- Acesse o banco de dados de Farmacologia de Sistemas de Medicina Tradicional Chinesa (TCMSP) (https://old.tcmsp-e.com/)23, o banco de dados HERB24 e o banco de dados TCMID (https://www.bidd.group/TCMID/). Use os oito nomes TCM em QZF, incluindo GZ, YZ, YZR, BS, CBM, RS, HJT e ZGC, como palavras-chave para pesquisar compostos ativos e alvos das ervas. Colete alvos do TCMSP e da previsão de alvo suíço (http://www.swisstargetprediction.ch/). Defina o valor do filtro como Probabilidade* > 0.
- Previsão de alvos de doenças
- Pesquise a palavra-chave "depressão" no banco de dados GeneCards (https://www.genecards.org/), obtenha alvos genéticos associados à depressão, baixe a planilha eletrônica de alvos de doenças, filtre os escores genéticos superiores ao valor médio e compile uma lista de alvos de depressão26.
- Rede de drogas-componente-doença-alvo
- Crie uma nova planilha e preencha-a com alvos relacionados à depressão e alvos de medicamentos na mesma coluna. Clique em Iniciar na barra de menu | Formatação condicional | Regras de Células de Destaque | Valores duplicados. Selecione um formato (por exemplo, "Preenchimento Vermelho Claro") na caixa de diálogo que aparece27, clique em OK para exibir os resultados.
- Inicie o software de análise de rede e importe o arquivo da planilha clicando em Arquivo na barra de menu | Importação | Rede. Otimize a aparência da rede ajustando o tamanho e a cor dos nós no painel Estilo localizado no painel de controle esquerdo. Execute a análise de topologia de rede clicando em Ferramentas na barra de menus | Analise a Rede27.
- Rede de interação proteína-proteína (PPI)
- Acesse a ferramenta Jvenn (https://jvenn.toulouse.inrae.fr/app/example.html), carregue os alvos compostos e os alvos da doença separadamente, plote os Genes Sobrepostos (OGE) entre os alvos presumidos compostos e os alvos da doença. Clique nos números da imagem e copie-os para uma planilha e baixe a imagem do diagrama de Venn.
- Acesse o banco de dados STRING (https://stringdb.org/)28 e insira os OGEs da planilha no banco de dados. Especificamente, cole a lista de alvos sobrepostos de anti-depressão QZF na caixa de diálogo Lista de nomes . Selecione Homo sapiens na seção Organismos e clique em PESQUISAR | CONTINUAR. Selecione a opção Exportações na barra de título e baixe a tabela de resumo da rede PPI nos formatos PNG e TSV29.
- Triagem de proteínas centrais
- Inicie o software de análise de rede (https://cytoscape.org/). Em seguida, na barra de menu, clique em Arquivo | Importação | Rede | File para importar o arquivo de formato TSV gerado na etapa30 anterior.
- Selecione Analisar rede na barra de menus e clique no botão Analisar . Em seguida, visualize os resultados da análise e entenda as características estruturais gerais da rede, como o número de nós, o número de bordas e o grau médio.
- Aplicativos selecionados | Gerenciador de aplicativos na barra de menus. Procure MCODE, instale o plug-in e execute o plug-in para obter o destino do hub. Em seguida, procure por CytoNCA, instale o plug-in e concentre-se nos três valores de parâmetro de Grau, Centralidade de proximidade (CC) e Centralidade de intermediação (BC). De acordo com os valores desses parâmetros, rastreie os nós com maior grau, CC e BC, que geralmente são considerados proteínas centrais31.
- Análise de enriquecimento da Ontologia Gênica (GO) e da Enciclopédia de Genes e Genomas de Kyoto (KEGG)
- Abra a plataforma de bioinformática (https://www.omicshare.com/). Clique no menu Ferramentas , encontre a ferramenta de conversão de genes de identificação e clique nela. Em seguida, clique no botão de upload de arquivo , selecione a etapa gerada no núcleo dos genes-alvo e baixe a lista de IDs de arquivo convertida.
- No menu Ferramentas , clique na ferramenta Análise de enriquecimento KEGG dinâmico . Carregue a lista de ID do gene. Na opção Espécie , selecione Homo sapiens e clique no botão Enviar .
- No menu Ferramentas, clique na ferramenta Análise de enriquecimento GO dinâmico | Opção de gene | Opção de upload de arquivo. Selecione a lista de ID do gene e, na opção Espécie, selecione Homo sapiens. Selecione o tipo de GO para análise, incluindo Processo Biológico, Função Molecular e Componente Celular.
- Para os resultados da análise de enriquecimento KEGG e GO, defina o limite de filtragem como p < 0,05. Organize as contagens em ordem decrescente.
8. Verificação de encaixe molecular
- Visite o site do PubChem (https://pubchem.ncbi.nlm.nih.gov/). Digite os compostos alvo na barra de pesquisa. Clique na Estrutura 2D e faça o download.
- Abra o banco de dados PDB (https://www.Rcsb.org/). Selecione a estrutura cristalina com alta resolução e contendo o ligante original. Faça download do arquivo PDB.
- Para otimizar a estrutura da proteína, abra o software de visualização molecular. Carregue o arquivo PDB baixado. Remova as moléculas de água e salve o arquivo PDB otimizado.
- Abra o software de encaixe molecular e importe o arquivo PDB otimizado. No AutoDockTools, clique em Editar | Excluir Água para excluir moléculas de água. Clique em Editar | Adicionar hidrogênios | Adicione para adicionar átomos de hidrogênio à proteína e ao ligante29.
- No AutoDockTools, defina a barra receptora como receptor.pdbqt e a barra de ligante como ligand.pdbqt. Abra o arquivo pdbqt. file para visualizar os locais de ligação da proteína e do ligante e definir o tamanho e a posição da caixa de encaixe para garantir que ela possa envolver completamente a proteína receptora e o composto ligante. No AutoDockTools, clique em Grid | Defina a caixa de grade para definir as coordenadas e dimensões centrais da caixa e usar valores padrão para encaixe molecular. Os quadros de encaixe serão classificados automaticamente em ordem decrescente de energias de ligação.
- Abra o arquivo de resultados e registre o valor ideal da energia de ligação. Energias de ligação mais baixas indicam ligação mais estável. Use o software de visualização molecular para carregar o arquivo de resultados. Ajuste a visualização e a cor para exibir claramente a interação ligante-receptor.
9. Análise estatística
- Realize análises estatísticas no software de análise e visualização de dados científicos e represente todos os dados como a média ± SEM. Use ANOVA bidirecional de medidas repetidas para comparações entre grupos antes e depois da administração do medicamento. Empregue ANOVA unidirecional para comparações entre mais de dois grupos.
- Considere o valor de P < 0,05 como estatisticamente significativo.
Resultados
Resultados de testes comportamentais no modelo de depressão de ratos induzida por RSC
Resultados do teste de preferência de sacarose
No início do estudo, não houve diferença no coeficiente de preferência por sacarose entre os grupos (P > 0,05). Após 28 dias de intervenção, o coeficiente de preferência pela sacarose do grupo RSC foi significativamente menor do que o do grupo CON (P < 0,05), enquanto os grupos F e QZF apresentaram coeficientes significativamente maiores em comparação com o grupo RSC (ambos P < 0,01). Os resultados indicaram que ratos estressados exibiram sintomas anedônicos típicos, que foram aliviados pelo tratamento com F e QZF (Figura 2A).
Resultados do peso corporal
Antes da indução da RSC, não foram observadas diferenças significativas entre os grupos (P > 0,05). Após 4 semanas de estresse, a taxa de crescimento do peso corporal do grupo CRS foi significativamente menor do que a do grupo CON (P < 0,01), enquanto os grupos F e QZF exibiram taxas de crescimento significativamente mais altas do que o grupo M (P < 0,001, P < 0,01). Esses achados indicam que o estresse interrompeu o metabolismo fisiológico normal em ratos, com os grupos F e QZF mostrando melhorias e correções significativas em seus perfis metabólicos anormais (Figura 2B).
Resultados do teste de campo aberto
Após 28 dias de intervenção, não houve diferença significativa na distância total do teste em campo aberto entre os quatro grupos (P > 0,05) (Figura 2D). Em comparação com o grupo CON, o tempo gasto na área central do grupo CRS foi significativamente reduzido (P < 0,01). Em comparação com o grupo RSC, o tempo gasto na área central dos grupos F e QZF foi significativamente aumentado (ambos P < 0,01). Não houve diferença significativa entre os grupos de tratamento (P > 0,05) (Figura 2C,E).
Resultados do teste de nado forçado
Após 28 dias de intervenção, o grupo RSC exibiu um tempo de imobilidade significativamente aumentado em comparação com o grupo CON (P < 0,0001). Em comparação com o grupo RSC, os grupos F e QZF apresentaram tempos de imobilidade significativamente reduzidos (P < 0,05, P < 0,001) (Figura 2F).
Predição de farmacologia de rede
Segmentar redes com pressupostos compostos
Para construir a rede de alvos hipotéticos compostos QZF, primeiro selecionamos 1.020 alvos hipotéticos de QZF, que foram coletados e visualizados como alvos compostos pelo software de análise de rede. A rede apresentou 1.184 nós e 8.728 arestas (Figura 3)32.
QZF e triagem de alvos de depressão
Um total de 17.947 alvos relacionados à depressão foram recuperados do banco de dados GeneCards, exibindo uma pontuação média de relevância de 1,105. Alvos com Pontuação de Relevância superior a 1,105 (n = 5.048) foram posteriormente selecionados para posterior análise dos dados. Um diagrama de Venn foi construído com 1.020 alvos do QZF para obter 612 alvos comuns (OGEs) (Figura 4A). Os 612 alvos comuns foram importados para o banco de dados STRING para análise, e a rede PPI continha 607 nós e 14.375 arestas (Figura 4B), e os OGEs foram importados para o software de análise de rede para obter a rede de interação.
Triagem de genes-alvo principais
A análise do módulo usando o plug-in MCODE identificou o módulo de cluster com a pontuação mais alta, que teve uma pontuação MCODE de 54,1902931. Identificamos 64 alvos-chave no módulo do hub de cluster que são críticos para os efeitos antidepressivos do QZF (Figura 4C). Usando o plug-in CytoNCA, selecionamos nós altamente conectados com base em três métricas de centralidade: Centralidade de Grau (DC), Centralidade de Proximidade (CC) e Centralidade de Intermediação (BC). Especificamente, a centralidade de grau mede o número de conexões diretas que um nó tem dentro da rede. A centralidade de proximidade quantifica o recíproco do comprimento médio do caminho mais curto entre um nó e todos os outros nós, indicando a eficiência com que um nó pode acessar outros. A centralidade de intermediação avalia a frequência com que um nó aparece nos caminhos mais curtos entre todos os pares de nós, refletindo seu papel mediador. Com base nessas métricas, construímos a rede principal e identificamos os 10 principais nós mais conectados: BCL2, AKT1, IL6, BCL2L1, MTOR, CASP3, TP53, STAT3, NFKB1 e HIF1A (Figura 4D). Após a filtragem de dados, realizamos uma análise de enriquecimento funcional nesses 10 genes-alvo principais para elucidar ainda mais suas funções biológicas.
Análise de enriquecimento GO
A análise de enriquecimento do GO rendeu um total de 2.783 itens anotados, com 2.385 exibindo significância estatística. Essa análise influenciou predominantemente as categorias de processo biológico (PB), função molecular (MF) e componente celular (CC). Especificamente, a categoria GO-BP englobou 2.450 itens, dos quais 1.926 foram considerados estatisticamente significativos. A categoria função molecular (GO-MF) identificou 184 itens, sendo que 117 apresentaram significância estatística. A categoria componente celular (GO-CC) revelou 149 itens, sendo que, destes, 59 foram estatisticamente significativos (Figura 5).
Análise de enriquecimento KEGG
A análise de enriquecimento da via KEGG identificou um total de 156 vias associadas aos 10 alvos principais, com 119 dessas vias demonstrando significância estatística. Os números ilustram as 20 principais vias com as maiores pontuações de enriquecimento (Figura 6). A remoção de algumas doenças associadas deixou duas vias de sinalização, as vias de sinalização HIF-1 e JAK-STAT, que foram previstas como vias-chave para QZF e depressão.
Principais redes de vias-alvo para QZF e Depressão
Para elucidar a relação mecanicista entre QZF e seus efeitos na depressão, desenvolvemos uma rede de interação TCM-composto-alvo-via (Figura 7). Utilizando software de análise de rede, visualizamos a via de sinalização com o valor p mais significativo junto com seus alvos associados. O gráfico de rede resultante compreendia 93 nós e 218 bordas. Além disso, geramos um diagrama de Sankey para representar genes-chave e seus compostos ativos correspondentes, focando especificamente nas vias de sinalização centrais HIF-1 e JAK-STAT (Figura 8).
Acoplamento molecular
A análise de docking molecular foi adotada para comprovar a especificidade do alvo do composto. Essa técnica avalia a afinidade de ligação entre um ligante e seu alvo proteico, onde magnitudes mais baixas de energia de ligação indicam uma interação mais forte e maior proximidade do ligante ao seu local de ligação33. Os resultados revelaram que as energias de ligação foram de -8,7 kcal/mol para HIF1A e Glycyrrhiza flavonol A, -8,5 kcal/mol para STAT3 e Ginsenoside rh2, -7,6 Kcal/mmol para BCL2 e Isolicoflavonol, -6,8 Kcal/mol para MTOR e Licochalcone B, -6,7 Kcal/mol para AKT1 e Kaempferol e -5,2 Kcal/mol para IL6 e ácido linolênico.
No geral, os resultados do docking molecular demonstraram que os compostos exibiram uma forte afinidade de ligação para seus alvos. A energia de ligação de cada proteína é visualizada da seguinte forma: o padrão de desenho animado branco representa o receptor de proteína, o azul é o ligante de molécula pequena, a linha pontilhada amarela indica a ligação de hidrogênio formada entre o ligante e o receptor, o verde representa o local de ligação da ligação de hidrogênio entre o receptor de proteína e o ligante de molécula pequena, e os números significam as distâncias de ligação de hidrogênio, o que implica que a ligação entre o ligante e o receptor é altamente estável (Figura 9)34.
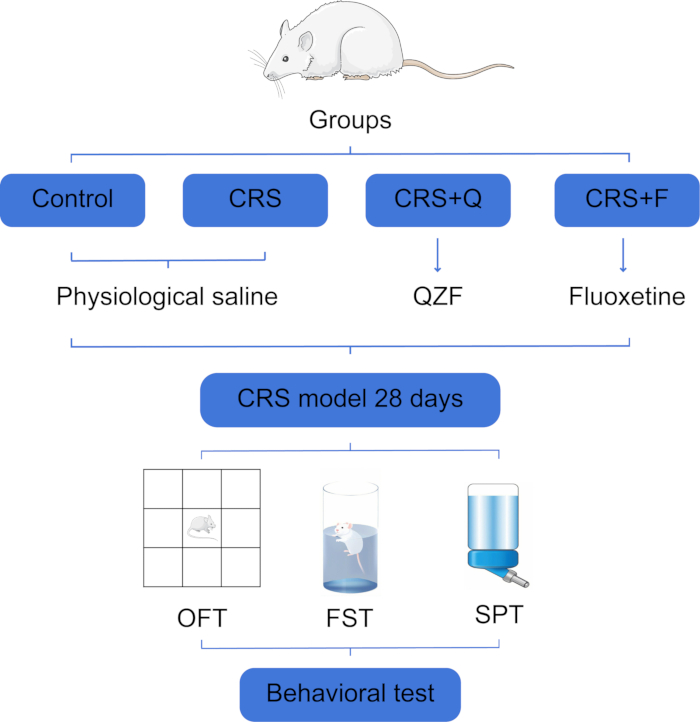
Figura 1: Fluxograma de agrupamento e testes comportamentais para ratos experimentais. Abreviaturas: CRS = estresse crônico de contenção; QZF (Q) = qiangzhifang; F = fluoxetina; OFT = ensaio em campo aberto; FST = teste de nado forçado; SPT = teste de preferência de sacarose. Clique aqui para ver uma versão maior desta figura.

Figura 2: Efeitos do QZF no modelo de depressão de rato induzido por RSC. (A) Nível de consumo de sacarose (%) no dia 0 e no dia 28. (B) Peso corporal (g) no dia 0 e no dia 28. (C) Gráfico das trajetórias dos ratos no teste de campo aberto na semana 4. (D) Distância total em campo aberto nos dias 0 e 28. (E) A duração da permanência na área central do OFT em cada grupo na semana 4. ** P < 0,01 indica uma diferença significativa entre os grupos F e QZF em comparação com o grupo RSC. (F) O tempo de imobilidade do FST (%) em cada grupo na semana 4. * P < 0,01 indica uma diferença significativa entre o grupo F em comparação com o grupo RSC. P < 0,001 indica que o grupo QZF apresentou diferenças significativas em comparação com o grupo RSC. Abreviaturas: CRS = estresse crônico de contenção; QZF = qiangzhifang. Clique aqui para ver uma versão maior desta figura.
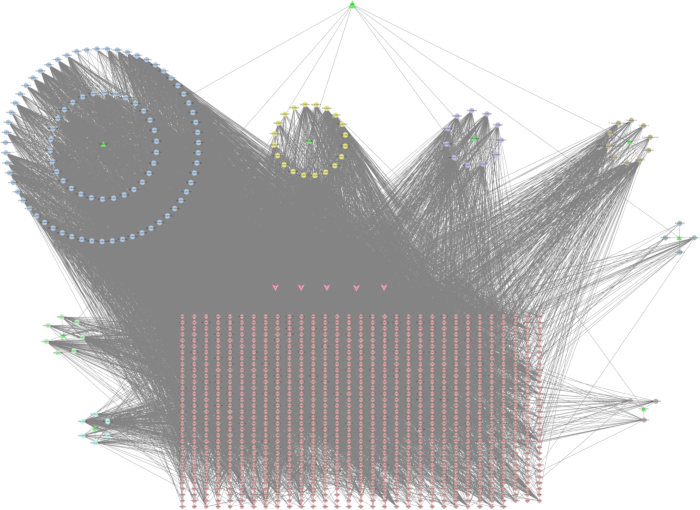
Figura 3: Rede QZF-Compound-Target. Os triângulos verdes denotam os medicamentos tradicionais chineses em QZF; os círculos denotam os componentes dos medicamentos tradicionais chineses; os losangos denotam os alvos. As setas rosa indicam os constituintes comuns de vários medicamentos fitoterápicos chineses. A (MOL000211) refere-se a Bai shao e Zhi gan cao; B (MOL000358) está associado a Bai shao, Chuan bei mu, Gu zhi e Ren shen; C (MOL000359) se conecta com Bai shao, Chuan bei mu e Gui zhi; D (MOL000422) refere-se a Bai shao, Zhi gan cao e Ren shen; E (MOL000492) é relevante para Bai shao e Gu zhi. Clique aqui para ver uma versão maior desta figura.
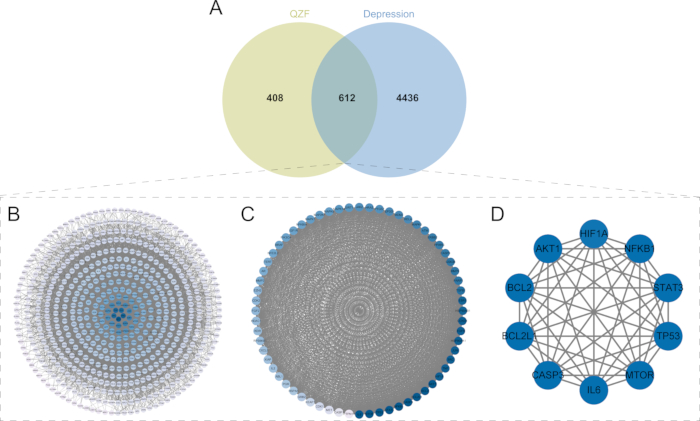
Figura 4: Identificação de alvos de interseção e triagem dos alvos principais. (A) Diagrama de Venn dos alvos comuns de QZF e depressão. Os círculos verdes claros representam as proteínas-alvo dos ingredientes ativos no QZF; Os círculos azuis denotam proteínas associadas à depressão. As áreas sobrepostas, onde as duas cores se cruzam, ilustram as proteínas compartilhadas, totalizando 612. (B) Rede PPI de QZF e depressão. (C) Análise MCODE. (D) Os 10 principais alvos principais. Abreviaturas: QZF = qiangzhifang; PPI = interação proteína-proteína. Clique aqui para ver uma versão maior desta figura.

Figura 5: Histograma para a análise de enriquecimento GO de alvos comuns. As barras verdes representam processos biológicos; as barras vermelhas representam funções moleculares; As barras azuis representam componentes celulares. A altura de cada barra reflete a contagem de genes associada ao termo GO correspondente. Abreviatura: GO = Ontologia do Gene. Clique aqui para ver uma versão maior desta figura.

Figura 6: Vias de enriquecimento KEGG dos alvos terapêuticos do QZF na depressão. (A) Gráfico de barras dos 20 principais caminhos, classificados por valor-P. (B) Gráfico de bolhas das 20 principais vias: o tamanho do ponto indica o número do gene; a intensidade da cor reflete a significância do valor P. (C) Anotação funcional das vias KEGG. Abreviatura: KEGG = Enciclopédia de Genes e Genomas de Kyoto. Clique aqui para ver uma versão maior desta figura.
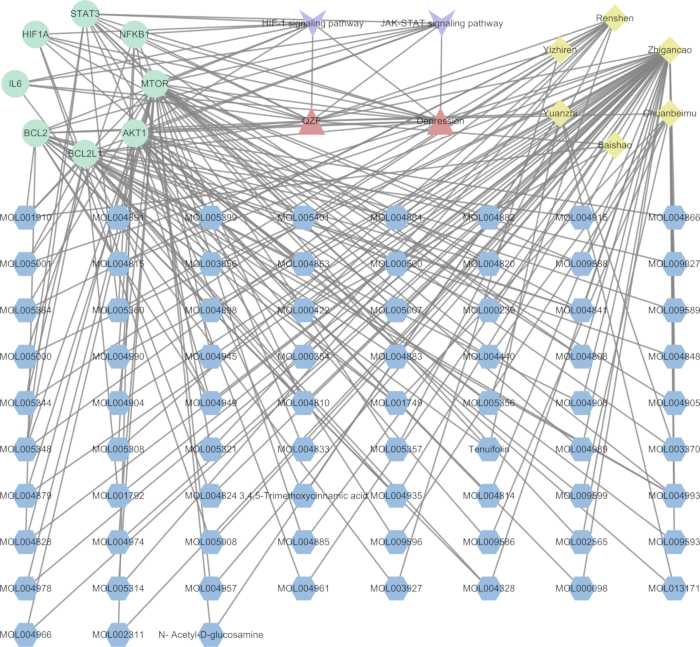
Figura 7: Rede de interação da via TCM-composto-alvo. Vermelho denota QZF e depressão, roxo designa vias de sinalização, verde destaca proteínas da via central, amarelo identifica medicamentos tradicionais chineses dentro de QZF e azul especifica compostos fitoterápicos constituintes. Clique aqui para ver uma versão maior desta figura.
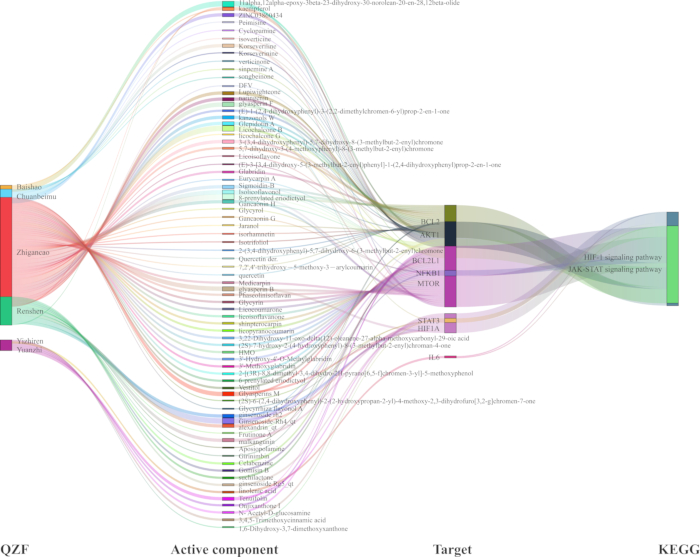
Figura 8: Diagrama de Sankey da via alvo do composto TCM para o efeito antidepressivo do QZF com base nas vias de sinalização HIF-1 e JAK-STAT. Abreviaturas: QZF = qiangzhifang; MTC = Medicina Tradicional Chinesa; HIF-1 = fator induzível por hipóxia-1; JAK-STAT = Transdutores de sinal de quinase ativados por Janus e ativadores de transcrição. Clique aqui para ver uma versão maior desta figura.
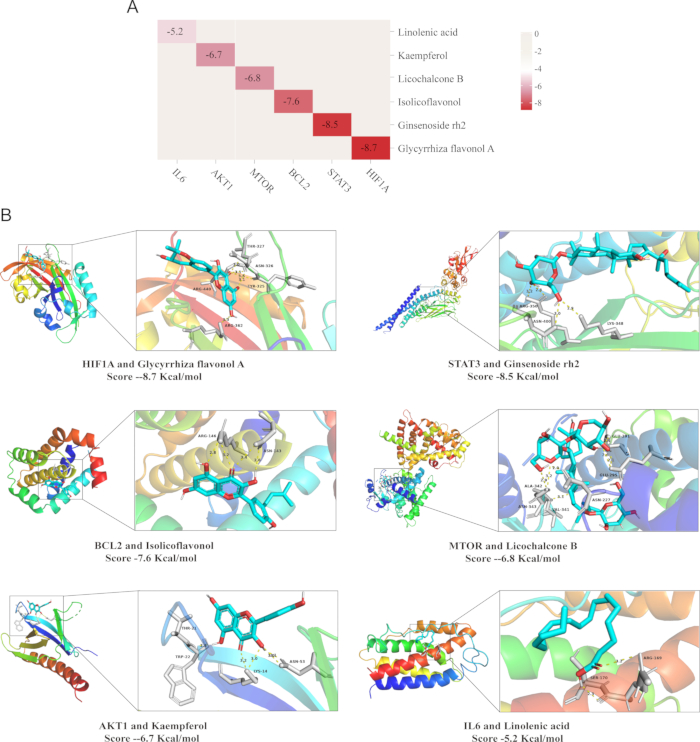
Figura 9: Resultados da validação do docking molecular. (A) Mapa de calor da energia de ligação (kcal/mol) entre componentes representativos de QZF e moléculas de proteína-alvo (B) Visualização da situação de encaixe. Abreviatura: QZF = qiangzhifang. Clique aqui para ver uma versão maior desta figura.
Arquivo Suplementar 1: Preparação de grânulos de medicina tradicional chinesa QZF. Abreviatura: QZF = qiangzhifang. Clique aqui para baixar este arquivo.
Discussão
A RSC é um método amplamente utilizado para estabelecer modelos animais de depressão. Esse modelo mimetiza o estresse psicológico crônico encontrado na vida humana e induz comportamentos semelhantes à depressão em ratos35. Neste estudo, o tubo de contenção de ratos foi construído em plástico transparente, garantindo a segurança do animal e permitindo uma observação clara durante o experimento. O tubo transparente media aproximadamente 18 cm de comprimento e 6 cm de diâmetro e apresentava vários orifícios de ventilação, cada um com 1 cm de diâmetro, distribuídos uniformemente nas laterais e na tampa para fornecer fluxo de ar suficiente para os ratos. Os ratos estressados exibiram sintomas depressivos, como letargia e olhos vidrados, juntamente com mudanças comportamentais características da depressão. Especificamente, essas mudanças incluíram diminuição da atividade motora no OFT, tempo de imobilidade prolongado no FST e redução do consumo de sacarose no SPT. Essas manifestações comportamentais se assemelham muito à bradicinesia, anedonia e perda de interesse observadas em pacientes com depressão clínica.
No contexto do estudo dos complexos mecanismos patológicos da depressão, a combinação de farmacologia de rede e tecnologia de docking molecular fornece uma estratégia inovadora para analisar os mecanismos moleculares dos compostos da medicina tradicional chinesa no tratamento da depressão. Este estudo identificou HIF1A, STAT3, BCL2, MTOR, AKT1 e IL6 como os principais alvos do QZF no tratamento da depressão. Esses alvos foram enriquecidos principalmente nas vias de sinalização HIF-1 e JAK-STAT. Essas duas vias de sinalização desempenham um papel central nos principais processos patológicos da depressão, como neuroinflamação, estresse oxidativo e apoptose.
A via de sinalização HIF-1, servindo como mecanismo regulador central para o metabolismo celular do oxigênio, desempenha um papel crucial em vários processos fisiológicos, incluindo neuroproteção, respostas ao estresse antioxidante e angiogênese36. Pesquisas indicam que o tecido cerebral de indivíduos com depressão exibe um microambiente hipóxico pronunciado e lesão por estresse oxidativo, que estão intimamente associados à ativação de respostas neuroinflamatórias e ao desequilíbrio de neurotransmissores37. A pesquisa de Semenza demonstra que, em condições hipóxicas, o HIF-1α regula positivamente os genes associados ao metabolismo do oxigênio e aos mecanismos de defesa antioxidante, incluindo o fator de crescimento endotelial vascular (VEGF), a eritropoietina (EPO) e os genes mitocondriais. Consequentemente, isso melhora a função mitocondrial, promove a formação de microvasos cerebrais, aumenta o fornecimento de oxigênio ao tecido cerebral e reduz o acúmulo de espécies reativas de oxigênio (ROS)38.
Outros estudos experimentais demonstram que a deficiência de HIF-1α aumenta acentuadamente a suscetibilidade neuronal ao estresse oxidativo, desencadeando assim a ativação anormal da via de sinalização apoptótica39. Isso leva a um aumento significativo na apoptose neuronal e declínio cognitivo progressivo. Em contraste, a superexpressão de HIF-1α específica do neurônio em modelos de camundongos transgênicos aumenta significativamente a sobrevivência neuronal e a densidade sináptica40. Essas descobertas não apenas comprovam o papel crítico do HIF-1α no mecanismo de defesa antioxidante, mas também destacam seu potencial significado terapêutico no aprimoramento da função cerebral por meio da promoção da plasticidade neural, remodelação e otimização da arquitetura sináptica. Além disso, a via de sinalização HIF-1 antagoniza a via de transdução de sinal NF-κB, levando a uma redução na produção das citocinas inflamatórias IL-6 e TNF-α, supressão da neuroinflamação e exibição de potenciais efeitos neuroprotetores e antidepressivos41.
Notavelmente, o flavonol A da glicirriza, um dos componentes ativos do QZF, foi confirmado como exibindo propriedades antioxidantes e anti-inflamatórias. Neste estudo, os dados de docking molecular revelam que a liquiritigenina A exibe uma alta afinidade de ligação à proteína HIF-1α, atingindo -8,7 kcal / mol. Este achado indica fortemente que o flavonol A da glicirriza pode atingir diretamente o HIF-1α, modulando sua estabilidade proteica ou atividade transcricional. Consequentemente, regula a expressão de genes envolvidos no metabolismo do oxigênio e na defesa antioxidante dentro da via de sinalização do HIF-1, aumentando assim a sobrevivência neuronal em condições hipóxicas e aliviando os danos neurais associados à depressão.
A via de sinalização JAK-STAT serve como o hub central para a transdução de sinal de citocinas e desempenha um papel fundamental em vários processos biológicos, incluindo regulação da inflamação, modulação da resposta imune e sobrevivência neuronal42,43. Pesquisas extensas demonstraram que a patogênese da depressão está intrinsecamente ligada à desregulação da via de sinalização JAK-STAT44. Uma meta-análise realizada por Dowlati e col. revelou que, em comparação com controles saudáveis, os níveis séricos de citocinas pró-inflamatórias, como IL-6 e TNF-α, foram significativamente aumentados em pacientes com depressão e positivamente correlacionados com a gravidade dos sintomas depressivos45. Especificamente, esses fatores pró-inflamatórios são capazes de ativar a via JAK-STAT, provocando assim uma resposta inflamatória. Esse processo não apenas induz danos diretos aos neurônios e células gliais, mas também compromete a estrutura e a função sináptica, exacerbando as deficiências cognitivas e emocionais nos pacientes46.
Além disso, a ativação excessiva da via JAK-STAT está fortemente associada à apoptose neuronal. A fosforilação sustentada de STAT3 regula positivamente a expressão de genes pró-apoptóticos, incluindo membros da família Caspase, resultando em perda neuronal. Além disso, a ativação aberrante dessa via prejudica a neurogênese na região do hipocampo e diminui a plasticidade sináptica, exacerbando os déficits neurofuncionais47. Neste estudo, o ginsenosídeo Rh2, um importante componente ativo do QZF, exibiu afinidade de ligação significativa com a proteína STAT3 na análise de docking molecular. Com base nesses achados, o ginsenosídeo Rh2 pode efetivamente aliviar as respostas neuroinflamatórias, inibindo especificamente a ativação do STAT3 e, assim, reduzindo a produção e liberação de citocinas pró-inflamatórias48.
Além das duas principais vias de sinalização, HIF-1 e JAK-STAT, este estudo identificou as interações sinérgicas entre outros componentes ativos e alvos durante a ação antidepressiva do QZF. A BCL2, uma proteína antiapoptótica canônica, desempenha um papel essencial na manutenção da sobrevivência celular e na supressão das vias de sinalização apoptótica49. No QZF, o isolicoflavonol exibe propriedades antioxidantes e antiapoptóticas, direcionando e ativando especificamente a proteína BCL2, inibindo efetivamente a apoptose neuronal, protegendo os neurônios e melhorando as alterações neuropatológicas associadas à depressão. Além disso, a via de sinalização aberrante do MTOR em pacientes com depressão está fortemente associada à disfunção neuronal50. Estudos demonstraram que o Licochalcone B promove o crescimento e a sobrevivência neuronal, aumenta a plasticidade sináptica e a conectividade funcional modulando a via de sinalização MTOR51, exercendo assim um efeito antidepressivo. Além disso, o flavonóide natural kaempferol, caracterizado por suas potentes atividades antioxidantes e anti-inflamatórias, ativa especificamente a via de sinalização AKT1. Por meio da regulação de várias moléculas-chave a jusante, ele não apenas promove a sobrevivência neuronal, mas também acelera a recuperação funcional, fornecendo assim suporte adicional ao alvo molecular para os efeitos antidepressivos do QZF.
Em resumo, este estudo utilizou farmacologia de rede e docking molecular para prever as vias terapêuticas, alvos centrais e componentes ativos eficazes do QZF no tratamento da depressão. O efeito antidepressivo do QZF foi validado em um modelo de depressão em ratos, sugerindo que ele pode exercer seus efeitos antidepressivos modulando várias vias de sinalização, incluindo HIF-1 e JAK-STAT, e visando processos patológicos importantes, como neuroinflamação, estresse oxidativo e apoptose. Essa descoberta não apenas aprofunda nossa compreensão dos mecanismos patológicos subjacentes à depressão, mas também fornece uma base teórica e novos alvos terapêuticos para a aplicação de fórmulas da medicina tradicional chinesa no tratamento da depressão. No entanto, este estudo tem algumas limitações. Os mecanismos sinérgicos de múltiplos componentes no QZF ainda não foram totalmente elucidados, e os processos metabólicos e interações desses componentes in vivo requerem mais investigações. Pesquisas futuras podem integrar experimentos in vitro e in vivo com tecnologias avançadas, como cromatografia líquida, sequenciamento de alto rendimento e integração multiômica para identificar de forma abrangente e precisa os principais alvos e vias associados aos efeitos antidepressivos do QZF, verificando e expandindo as previsões feitas por meio da farmacologia da rede.
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
A pesquisa foi apoiada pela Fundação Nacional de Ciências Naturais da China (82374311), pela Administração Estatal de Medicina Tradicional Chinesa, Teoria Básica de Alto Nível da Medicina Tradicional Chinesa (MTC), Projeto de Construção de Disciplinas-Chave da Medicina Tradicional Chinesa (zyyzdxk-2023118), pelo Projeto Nacional de Construção de Estúdios de Especialistas em Medicina Tradicional Chinesa (Carta Nacional de Educação em Medicina Chinesa nº 75) e pela Fundação de Ciências Naturais da Província de Shandong (ZR2022LZY016). Os grânulos QZF foram preparados pelo Departamento de Produtos Farmacêuticos, Hospital Afiliado da Universidade de Medicina Tradicional Chinesa de Shandong.
Materiais
| Name | Company | Catalog Number | Comments |
| Animal behavior analysis system | Shanghai Xinsoft Information Technology Co., LTD | XR-SuperMaze | |
| AutoDockTools | The Scripps Research Institute | ||
| Cytoscape software | Cytoscape Consortium | version 3.7.2 | |
| Electric soldering iron hole puncher | Nanjing Naiwei Technology Co., Ltd. | ||
| Fluoxetine | Lilly Suzhou Pharmaceutical Co., LTD | ||
| Open field experimental system | Shanghai Xinsoft Information Technology Co., LTD | XR-XZ301 | |
| PyMol | Schrödinger | ||
| Qiangzhifang | Affiliated Hospital of Shandong University of Traditional Chinese Medicine, Jinan, China | ||
| Transparent plastic tube | Nantong Baiyang Plastic Products Co., Ltd. |
Referências
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados