Method Article
Pharmacologie en réseau et validation des mécanismes antidépresseurs de Qiangzhifang dans un modèle de dépression induite par le stress chronique chez le rat
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cette étude a évalué l’efficacité antidépressive de Qiangzhifang dans un modèle de rat de dépression chronique induite par le stress de contention et a élucidé son effet régulateur sur les voies HIF-1 et JAK-STAT par pharmacologie de réseau et analyse d’amarrage moléculaire.
Résumé
La dépression est un trouble psychiatrique complexe qui pose d’importants défis en matière de traitement. Le Qiangzhifang (QZF), un composé utilisé dans la médecine traditionnelle chinoise, démontre une efficacité clinique potentielle dans le traitement de la dépression. Cependant, les mécanismes d’action et les principes actifs de QZF n’ont pas été entièrement élucidés. L’objectif principal de cette étude était d’élucider les ingrédients actifs efficaces et les mécanismes moléculaires potentiels de la QZF pour le soulagement de la dépression en intégrant les prédictions pharmacologiques en réseau aux validations expérimentales.
Nous avons adopté un modèle de rat de stress chronique (CRS) et effectué des tests comportementaux tels que le test en champ ouvert (OFT), le test de préférence de saccharose (SPT) et le test de nage forcée (FST) pour évaluer les effets thérapeutiques du QZF sur la dépression. En ce qui concerne les paramètres comportementaux, le groupe QZF a montré une masse corporelle significativement plus élevée, un rapport de préférence de saccharose et un temps de séjour dans la zone centrale par rapport au groupe modèle (P < 0,01, P < 0,01, P < 0,01), et un temps d’immobilisation significativement réduit dans le test de nage forcée (P < 0,001). Les études de pharmacologie et d’amarrage moléculaire suggèrent que QZF peut avoir des effets antidépresseurs en modulant les voies HIF-1 et JAK-STAT, avec des gènes cibles clés tels que AKT1, IL-6, MTOR et TP53, impliqués dans l’inflammation, la neuroprotection et l’apoptose. En conclusion, cette étude offre de nouvelles perspectives sur la modernisation et le développement des composés de la médecine chinoise pour le traitement complet de la dépression.
Introduction
La dépression, un problème de santé mondial omniprésent, se caractérise par une mauvaise humeur persistante, une diminution de l’intérêt et du plaisir, ainsi que des troubles cognitifs et neurologiques1. Comme l’indique l’Organisation mondiale de la santé, la dépression touche environ 380 millions de personnes dans le monde, et ce chiffre devrait augmenter de2. En tant que trouble mental complexe et multifactoriel, la dépression affecte la qualité de vie des patients et représente un fardeau économique et médical considérable pour la société, caractérisée par une incidence, des taux de récidive etdes taux d’incapacité élevés3.
L’étiologie de la dépression est complexe, les mécanismes précis n’étant pas encore entièrement compris. Au fur et à mesure que la recherche dans ce domaine progresse, des facteurs tels que la neuroinflammation, le stress oxydatif et l’apoptose ont suscité une attention considérable. Des études indiquent que les patients souffrant de dépression présentent des niveaux élevés de cytokines pro-inflammatoires comme le TNF et l’interleukine-1β par rapport aux individus en bonne santé, et une prévalence plus élevée de dépression est observée chez les personnes atteintes d’affections inflammatoires4. Dans le stress oxydatif, les espèces réactives de l’oxygène (ROS) sont surproduites en réponse à des stimuli nocifs, submergeant les défenses antioxydantes de l’organisme et entraînant un déséquilibre entre les systèmes oxydatifs et antioxydants, causant ainsi des lésions tissulaires. Un stress oxydatif élevé dans la dépression peut améliorer la peroxydation lipidique et exacerber les dommages aux gènes et aux protéines cellulaires, affectant la fonction neuronale et contribuant à la dégénérescence neuronale, à l’apoptose et à l’altération de la plasticité5. De plus, les altérations observées dans les présentations cliniques, les marqueurs biochimiques et les structures cérébrales chez les patients souffrant de dépression sont liées à l’apoptose. Des études d’imagerie révèlent une réduction du volume de l’hippocampe et une atrophie chez les patients souffrant de dépression, l’apoptose neuronale jouant potentiellement un rôle central dans ces changements6.
À l’heure actuelle, le traitement médicamenteux est la principale approche pour gérer la dépression, les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) et les inhibiteurs de la recapture de la noradrénaline (INR) étant fréquemment utilisés dans la pratique clinique7. Cependant, ces médicaments s’accompagnent d’effets indésirables importants. En plus des symptômes du système nerveux central comme les maux de tête et l’insomnie, la plupart des antidépresseurs présentent également des effets secondaires gastro-intestinaux, notamment des nausées et de la diarrhée 8,9. Certains antidépresseurs peuvent également provoquer un dysfonctionnement sexuel10, ce qui a un impact sévère sur les résultats du traitement et réduit l’observance thérapeutique chez les patients souffrant de dépression11. De plus, l’efficacité de ces médicaments est limitée pour certains patients. Des études métabolomiques récentes ont indiqué que des différences individuelles dans le microbiote intestinal peuvent influencer l’efficacité des médicaments12. Par conséquent, le développement de traitements plus sûrs et plus efficaces reste un objectif essentiel dans la recherche sur la dépression.
Les formulations de la médecine traditionnelle chinoise (MTC) ont démontré un potentiel significatif dans le traitement de la dépression, attribué à leurs effets synergiques impliquant de multiples composants, cibles et voies13. La MTC postule qu’un qi Yang vigoureux est essentiel au maintien de la vitalité du corps. Par conséquent, le professeur Yuanqing Ding, s’appuyant sur les principes uniques du diagnostic et du traitement de la MTC et sur une vaste expérience clinique, a proposé que « yang yu shen tui » est la pathogenèse fondamentale de la dépression. Sur la base de ce concept, il a développé Qiangzhifang (QZF) pour s’attaquer spécifiquement à cette pathogenèse14. L’application clinique du QZF dans le traitement de la dépression a démontré une efficacité significative, avec un taux d’efficacité total de 71,43 %15. QZF est composé de diverses matières médicinales traditionnelles chinoises, notamment Ramulus cinnamomi (gui zhi, GZ), Polygala tenuifolia (yuan zhi, YZ), Alpinia oxyphylla miq (yi zhi ren, YZR), Paeonia lactiflora (bai shao, BS), Fritillariae cirrhosae bulbus (chuan bei mu, CBM), Panax ginseng (ren shen, RS), Rhodiola rosea L (hong jing tian, HJT) et réglisse (gan cao, GC) (Dossier supplémentaire 1). Des études ont montré que Polygala tenuifolia est riche en saponines et présente des effets neuroprotecteurs16. De même, la paire d’herbes Ramulus Cinnamomi-Paeonia lactiflora démontre une efficacité potentielle dans le soulagement de la douleur et de la dépression17. De plus, les saponines totales du ginseng peuvent réduire les niveaux de cytokines pro-inflammatoires de l’hippocampe, améliorer le comportement dépressif et atténuer les lésions nerveuses de l’hippocampe chez les rats18. La réglisse contient principalement des triterpénoïdes et des flavonoïdes. Les flavonoïdes totaux (LF) de la réglisse peuvent jouer un rôle antidépresseur en améliorant le comportement dépressif, en modulant la voie de signalisation BDNF/TrkB et en améliorant la plasticité synaptique19. Cependant, les mécanismes spécifiques sous-jacents aux effets antidépresseurs de la QZF restent flous, limitant ainsi son application à grande échelle.
Par conséquent, notre étude vise à établir un modèle de dépression CRS chez le rat, à démontrer l’effet thérapeutique de QZF sur la dépression chez le rat par le biais d’expériences comportementales et à évaluer systématiquement le mécanisme antidépresseur de QZF à l’aide de la pharmacologie en réseau et de la technologie d’amarrage moléculaire20. En clarifiant les composants actifs et les cibles potentielles de la QZF, les cibles principales de la dépression peuvent être localisées avec précision. Nous pensons qu’en explorant en profondeur le mécanisme d’action de la QZF, nous pouvons non seulement fournir des options de traitement plus sûres et plus efficaces aux patients souffrant de dépression, mais également fournir une base scientifique pour l’application de la MTC dans le traitement de la dépression.
Protocole
Tous les protocoles expérimentaux ont été approuvés par le Comité d’éthique de l’expérimentation animale de l’Université de médecine traditionnelle chinoise du Shandong (numéro d’approbation : YYLW2023000327) et sont conformes au Guide pour le soin et l’utilisation des animaux de laboratoire publié par les National Institutes of Health. Dans cette expérience, nous avons utilisé 40 rats Wistar mâles sains, de grade SPF, avec un poids corporel moyen de (140 ± 10) g (Figure 1). Consultez la table des matériaux pour une liste de tous les matériaux, équipements et logiciels utilisés dans ce protocole.
1. Modèle de dépression chez le rat
- Hébergement et regroupement des animaux
- Entrez dans la salle d’élevage avec les animaux et numérotez-les à l’aide d’un instrument de marquage de la queue.
- Hébergez les rats individuellement dans des cages, en maintenant une température de 21 ± 2 °C et un cycle lumière/obscurité de 12 h/12 h.
- Acclimater les rats en laboratoire pendant 7 jours, en leur donnant un accès ad libitum à la nourriture et à l’eau tout en les manipulant quotidiennement pour s’adapter.
- Après la période d’acclimatation, mesurez le poids corporel et effectuez les tests de préférence de saccharose (SPT) et les tests en plein champ (OFT).
- Sur la base des données expérimentales, divisez les rats en quatre groupes, en vous assurant que chaque groupe se compose de 10 rats : le groupe témoin (CON), le groupe modèle (CRS), le groupe QZF et le groupe fluoxétine (F).
- Mise en place d’un modèle de rat de stress chronique par contention (CRS)
- Construisez le dispositif de retenue des rats. Choisissez un tube en plastique transparent d’un diamètre et d’une longueur adaptés à la taille21 du rat, permettant au rat de se tenir debout et de se retourner à l’intérieur tout en l’empêchant de s’échapper. Utilisez une perforatrice électrique pour créer des trous sur les côtés du tube en plastique et sur le couvercle afin d’assurer une bonne circulation de l’air.
- Placez délicatement les rats dans les dispositifs de contention (sauf ceux du groupe C) 1 h après l’administration intragastrique quotidienne du médicament, en vous assurant qu’ils sont dans une position confortable.
- Priver tous les groupes de rats de nourriture et d’eau pendant la période de contention. Une fois la période de contention terminée, donnez-leur suffisamment de nourriture et d’eau uniformément. Fixer la durée quotidienne de contention à 6 h (de 9:30 h à 15:30 h) et la maintenir pendant 28 jours consécutifs.
2. Intervention en matière de toxicomanie
- Administrer par gavage : 1 mL de solution/100 g de poids corporel, de la fluoxétine (2,7 mg·kg-1·jour-1) et du QZF (2 g·kg-1·jour-1)22. Fournir aux groupes C et CRS une solution saline normale équivalente pour un contrôle à une seule variable.
REMARQUE : L’administration quotidienne du médicament a été effectuée à 08h00, commençant en même temps que l’établissement du modèle et se poursuivant tout au long de la période de modélisation de 28 jours.
3. Test de préférence au saccharose (SPT)
- Priver les rats de nourriture et d’eau pendant 24 heures avant le début de l’expérience.
- Préparez une solution aqueuse de saccharose à 1 % et versez la solution et l’eau pure dans les bouteilles des animaux de laboratoire pour la pesée. Mesurez la consommation d’eau pure et d’eau saccharose en pesant les bouteilles avant et après l’expérience.
- Placez une bouteille de solution de saccharose et une bouteille d’eau pure à la prise d’eau de chaque couvercle de cage à rats, une à gauche et une à droite, pour un accès libre à l’eau. Pour éviter que les rats ne privilégient un côté pour la consommation d’eau, inversez les positions des bouteilles d’eau à gauche et à droite après 30 minutes après le début de l’expérience.
- Après 1 h de l’expérience, retirez toutes les bouteilles d’eau, pesez-les rapidement et notez la consommation de solution de saccharose et d’eau pure. Calculez le rapport hebdomadaire de préférence pour le saccharose à l’aide de la formule suivante :
Valeur de préférence du saccharose =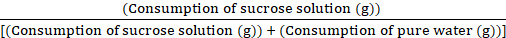 × 100 %
× 100 %
4. Mesure du poids corporel
- Pesez les rats chaque semaine à leur entrée dans le laboratoire et fixez l’heure fixée pour la pesée à 7h00. Établissez cet horaire pour faciliter l’observation des changements de poids corporel.
5. Test en champ ouvert (OFT)
- Avant le début de l’expérience, acclimatez les rats à la salle comportementale pendant 1 h et ajustez l’éclairage dans la boîte à champ ouvert pour assurer une distribution uniforme. Vérifiez que les rats sont clairement visibles dans le logiciel de suivi.
- Utilisez le système de suivi et d’analyse vidéo pour diviser la surface inférieure de la boîte à champ ouvert (50 cm x 50 cm x 50 cm) en neuf grilles carrées de surface égale. Désignez les huit grilles adjacentes aux murs comme la zone périphérique et la grille centrale comme la zone centrale.
- Placez le rat dans la zone centrale de la boîte à champ ouvert. Enregistrez les mouvements du rat pendant 5 minutes à l’aide du système de suivi vidéo.
- Après avoir testé chaque rat, nettoyez la chambre avec de l’éthanol à 75 % pour éliminer les odeurs résiduelles et éviter d’interférer avec le comportement du rat suivant. Entrez la distance totale (mm) des activités en plein champ et le nombre d’entrées dans la grille centrale dans les enregistrements OFT.
6. Test de nage forcée (FST)
REMARQUE : L’expérience de nage forcée chez le rat comprend une pré-expérience et une expérience formelle. Effectuez la pré-expérience 24 h avant l’expérience formelle, en suivant la même procédure, avec le rat nageant pendant 15 min.
- Transportez les animaux expérimentaux dans la salle comportementale au moins 30 minutes avant l’expérience pour leur permettre de s’acclimater à l’environnement.
- Préparez un cylindre d’eau cylindrique en plexiglas transparent (50 cm de haut, 20 cm de diamètre) et remplissez-le d’eau à 23-25 °C. Ajustez la profondeur de l’eau en fonction du poids de l’animal, en vous assurant que la queue de l’animal reste à une certaine distance du bas du cylindre.
- Placez lentement les rats dans le cylindre d’eau et restez silencieux tout au long de l’expérience. Activez la caméra et le système d’acquisition du signal. Observez et enregistrez la durée de l’immobilité flottante dans les 300 s. Retirez immédiatement les rats de l’eau et séchez-les à la fin de l’expérience.
- Après chaque séance, remplacez l’eau pour éviter toute influence sur le rat suivant.
7. Prédiction pharmacologique en réseau
- Collection de composés QZF et de cibles présumées
- Accédez à la base de données (https://old.tcmsp-e.com/)23, à la base de données HERB24 et à la base de données https://www.bidd.group/TCMID/ TCMID. Utilisez les huit noms TCM de QZF, y compris GZ, YZ, YZR, BS, CBM, RS, HJT et ZGC, comme mots-clés pour rechercher des composés actifs et des cibles des herbes. Collectez des objectifs du TCMSP et de la prédiction suisse des objectifs (http://www.swisstargetprediction.ch/). Définissez la valeur du filtre sur Probabilité* > 0.
REMARQUE : En règle générale, les ingrédients ont été inclus comme ingrédients actifs en fonction de leurs caractéristiques pharmacocinétiques : biodisponibilité orale (OB) ≥ 30 % et caractéristiques similaires au médicament (DL) ≥ 0,1825.
- Accédez à la base de données (https://old.tcmsp-e.com/)23, à la base de données HERB24 et à la base de données https://www.bidd.group/TCMID/ TCMID. Utilisez les huit noms TCM de QZF, y compris GZ, YZ, YZR, BS, CBM, RS, HJT et ZGC, comme mots-clés pour rechercher des composés actifs et des cibles des herbes. Collectez des objectifs du TCMSP et de la prédiction suisse des objectifs (http://www.swisstargetprediction.ch/). Définissez la valeur du filtre sur Probabilité* > 0.
- Prédiction des cibles de la maladie
- Recherchez le mot-clé « dépression » dans la base de données GeneCards (https://www.genecards.org/), obtenez les cibles génétiques associées à la dépression, téléchargez la feuille de calcul électronique des cibles de la maladie, filtrez les scores génétiques supérieurs à la valeur moyenne et compilez une liste de cibles de dépression26.
- Réseau médicament-composant-maladie-cible
- Créez une nouvelle feuille de calcul et remplissez-la avec des cibles liées à la dépression et des cibles médicamenteuses dans la même colonne. Cliquez sur Démarrer dans la barre de menu | Mise en forme conditionnelle | Règles de mise en surbrillance des cellules | Valeurs dupliquées. Sélectionnez un format (par exemple, « Remplissage rouge clair ») dans la boîte de dialogue qui s’affiche27, cliquez sur OK pour afficher les résultats.
- Lancez le logiciel d’analyse de réseau et importez le fichier tableur en cliquant sur Fichier dans la barre de menu | Importation | Réseau. Optimisez l’apparence du réseau en ajustant la taille et la couleur des nœuds dans le panneau Style situé dans le panneau de configuration de gauche. Effectuez une analyse de la topologie du réseau en cliquant sur Outils dans la barre de menu | Analyser le réseau27.
- Réseau d’interaction protéine-protéine (IPP)
- Accédez à l’outil Jvenn (https://jvenn.toulouse.inrae.fr/app/example.html), téléchargez les cibles composées et les cibles de maladie séparément, tracez les gènes de chevauchement (OGE) entre les cibles présumées composées et les cibles de maladie. Cliquez sur les chiffres de l’image et copiez-les dans une feuille de calcul et téléchargez l’image du diagramme de Venn.
- Accédez à la base de données STRING (https://stringdb.org/)28 et entrez les OGE de la feuille de calcul dans la base de données. Plus précisément, collez la liste de cibles qui se chevauchent l’anti-dépression QZF dans la boîte de dialogue Liste de noms . Sélectionnez Homo sapiens dans la section Organismes et cliquez sur RECHERCHER | CONTINUER. Sélectionnez l’option Exportations dans la barre de titre et téléchargez le tableau récapitulatif du réseau PPI aux formats PNG et TSV29.
- Criblage des protéines de base
- Démarrez le logiciel d’analyse de réseau (https://cytoscape.org/). Ensuite, dans la barre de menu, cliquez sur Fichier | Importation | Réseau | Fichier pour importer le fichier au format TSV généré à l’étapeprécédente 30.
- Sélectionnez Analyser le réseau dans la barre de menus et cliquez sur le bouton Analyser . Ensuite, affichez les résultats de l’analyse et comprenez les caractéristiques structurelles globales du réseau, telles que le nombre de nœuds, le nombre d’arêtes et le degré moyen.
- Sélectionnez Applications | Gestionnaire d’applications dans la barre de menus. Recherchez MCODE, installez le plug-in et exécutez-le pour obtenir la cible du hub. Ensuite, recherchez CytoNCA, installez le plug-in et concentrez-vous sur les trois valeurs de paramètre Degree, Centrality Closeness (CC) et Betweenness centrality (BC). Selon les valeurs de ces paramètres, criblez les nœuds avec des degrés supérieurs, CC et BC, qui sont généralement considérés comme des protéines centrales31.
- Analyse de l’enrichissement de l’ontologie génétique (GO) et de l’Encyclopédie de Kyoto des gènes et des génomes (KEGG)
- Ouvrez la plateforme bioinformatique (https://www.omicshare.com/). Cliquez sur le menu Outils , trouvez l’outil de conversion de gènes ID et cliquez dessus. Ensuite, cliquez sur le bouton de téléchargement du fichier , sélectionnez l’étape générée au cœur des gènes cibles et téléchargez la liste des ID de fichier convertis.
- Dans le menu Outils , cliquez sur l’outil Analyse d’enrichissement dynamique KEGG . Téléchargez la liste d’identification du gène. Dans l’option Espèce , sélectionnez Homo sapiens et cliquez sur le bouton Soumettre .
- Dans le menu Outils, cliquez sur l’outil Analyse d’enrichissement dynamique GO | Option génétique | Option de téléchargement de fichier. Sélectionnez la liste d’identification du gène et dans l’option Espèce, sélectionnez Homo sapiens. Sélectionnez le type de GO pour l’analyse, y compris le processus biologique, la fonction moléculaire et le composant cellulaire.
- Pour les résultats de l’analyse d’enrichissement KEGG et GO, définissez le seuil de filtrage sur p < 0,05. Organisez les comptes par ordre décroissant.
8. Vérification de l’amarrage moléculaire
- Visitez le site Web de PubChem (https://pubchem.ncbi.nlm.nih.gov/). Entrez les composés cibles dans la barre de recherche. Cliquez sur la structure 2D et téléchargez-la.
- Ouvrez la base de données PDB (https://www.Rcsb.org/). Sélectionnez la structure cristalline à haute résolution et contenant le ligand d’origine. Téléchargez le fichier PDB.
- Pour optimiser la structure des protéines, ouvrez le logiciel de visualisation moléculaire. Chargez le fichier PDB téléchargé. Supprimez les molécules d’eau et enregistrez le fichier PDB optimisé.
- Ouvrez le logiciel d’amarrage moléculaire et importez le fichier PDB optimisé. Dans AutoDockTools, cliquez sur Modifier | Supprimer l’eau pour supprimer les molécules d’eau. Cliquez sur Modifier | Ajouter des hydrogènes | Ajouter pour ajouter des atomes d’hydrogène à la protéine et au ligand29.
- Dans AutoDockTools, définissez la barre réceptrice sur receptor.pdbqt et la barre de ligand sur ligand.pdbqt. Ouvrez le pdbqt. pour afficher les sites de liaison de la protéine et du ligand et définissez la taille et la position de la boîte d’amarrage pour vous assurer qu’elle peut enfermer complètement la protéine réceptrice et le composé du ligand. Dans AutoDockTools, cliquez sur Grille | Définissez la boîte de grille pour définir les coordonnées centrales et les dimensions de la boîte et utilisez les valeurs par défaut pour l’ancrage moléculaire. Les cadres d’amarrage seront automatiquement triés par ordre décroissant d’énergies de liaison.
- Ouvrez le fichier de résultats et enregistrez la valeur optimale de l’énergie de liaison. Des énergies de liaison plus faibles indiquent une liaison plus stable. Utilisez le logiciel de visualisation moléculaire pour charger le fichier de résultat. Ajustez la vue et la couleur pour afficher clairement l’interaction ligand-récepteur.
9. Analyse statistique
- Effectuer une analyse statistique dans le logiciel d’analyse et de visualisation des données scientifiques et représenter toutes les données sous forme ± moyenne SEM. Utiliser l’ANOVA à deux facteurs à mesures répétées pour les comparaisons entre les groupes avant et après l’administration du médicament. Utiliser l’ANOVA à un facteur pour les comparaisons entre plus de deux groupes.
- Prenons la valeur de P < 0,05 comme statistiquement significative.
Résultats
Résultats d’un test comportemental dans le modèle de dépression chez le rat induit par le CRS
Résultats du test de préférence pour le saccharose
Au départ, il n’y avait pas de différence dans le coefficient de préférence du saccharose entre les groupes (P > 0,05). Après 28 jours d’intervention, le coefficient de préférence du saccharose du groupe CRS était significativement inférieur à celui du groupe CON (P < 0,05), tandis que les groupes F et QZF présentaient des coefficients significativement plus élevés par rapport au groupe CRS ( P < 0,01). Les résultats ont indiqué que les rats stressés présentaient des symptômes anhédoniques typiques, qui ont été atténués par un traitement par F et QZF (Figure 2A).
Résultats du poids corporel
Avant l’induction du CRS, aucune différence significative n’a été observée entre les groupes (P > 0,05). Après 4 semaines de stress, le taux de croissance du poids corporel du groupe CRS était significativement inférieur à celui du groupe CON (P < 0,01), tandis que les groupes F et QZF présentaient des taux de croissance significativement plus élevés que le groupe M (P < 0,001, P < 0,01). Ces résultats indiquent que le stress a perturbé le métabolisme physiologique normal chez les rats, les groupes F et QZF montrant des améliorations et des corrections significatives de leurs profils métaboliques anormaux (Figure 2B).
Résultats des tests en plein champ
Après 28 jours d’intervention, il n’y avait pas de différence significative dans la distance totale de l’essai en plein champ entre les quatre groupes (P > 0,05) (figure 2D). Par rapport à l’ACN de groupe, le temps passé dans la zone centrale du SCR de groupe était significativement réduit (P < 0,01). Par rapport au groupe CRS, le temps passé dans la zone centrale des groupes F et QZF a été significativement augmenté (P < 0,01). Il n’y avait pas de différence significative entre les groupes de traitement (P > 0,05) (figures 2C et E).
Résultats du test de natation forcée
Après 28 jours d’intervention, le groupe CRS a montré une augmentation significative du temps d’immobilité par rapport au groupe CON (P < 0,0001). Par rapport au groupe CRS, les groupes F et QZF ont montré des temps d’immobilité significativement réduits (P < 0,05, P < 0,001) (Figure 2F).
Prédiction pharmacologique en réseau
Réseaux cibles avec des hypothèses composites
Pour construire le réseau de cibles QZF-compound-hypothetical, nous avons d’abord passé au crible 1 020 cibles hypothétiques de QZF, qui ont été collectées et visualisées comme des cibles composées par le logiciel d’analyse de réseau. Le réseau présentait 1 184 nœuds et 8 728 arêtes (Figure 3)32.
QZF et dépistage cible de la dépression
Au total, 17 947 cibles liées à la dépression ont été extraites de la base de données GeneCards, avec un score de pertinence moyen de 1,105. Les cibles ayant un score de pertinence supérieur à 1,105 (n = 5 048) ont ensuite été sélectionnées pour une analyse plus approfondie des données. Un diagramme de Venn a été construit avec 1 020 cibles de QZF pour obtenir 612 cibles communes (OGE) (Figure 4A). Les 612 cibles communes ont été importées dans la base de données STRING pour analyse, et le réseau PPI contenait 607 nœuds et 14 375 arêtes (Figure 4B), et les OGE ont été importés dans le logiciel d’analyse de réseau pour obtenir le réseau d’interaction.
Criblage des gènes cibles de base
L’analyse du module à l’aide du plug-in MCODE a identifié le module de cluster avec le score le plus élevé, qui avait un score MCODE de 54,1902931. Nous avons identifié 64 cibles clés dans le module de hub de cluster qui sont essentielles pour les effets antidépresseurs de QZF (Figure 4C). À l’aide du plug-in CytoNCA, nous avons recherché des nœuds hautement connectés sur la base de trois mesures de centralité : Centralité de degré (DC), Centralité de proximité (CC) et Centralité d’intermédiarité (BC). Plus précisément, la centralité de degré mesure le nombre de connexions directes qu’un nœud a au sein du réseau. La centralité de proximité quantifie l’inverse de la longueur moyenne du chemin le plus court entre un nœud et tous les autres nœuds, indiquant l’efficacité avec laquelle un nœud peut accéder à d’autres. La centralité d’intermédiarité évalue la fréquence à laquelle un nœud apparaît dans les chemins les plus courts entre toutes les paires de nœuds, reflétant son rôle de médiation. Sur la base de ces mesures, nous avons construit le réseau central et identifié les 10 nœuds les plus connectés : BCL2, AKT1, IL6, BCL2L1, MTOR, CASP3, TP53, STAT3, NFKB1 et HIF1A (Figure 4D). Suite au filtrage des données, nous avons effectué une analyse d’enrichissement fonctionnel sur ces 10 gènes cibles clés afin d’élucider davantage leurs fonctions biologiques.
Analyse de l’enrichissement GO
L’analyse de l’enrichissement du GO a donné un total de 2 783 éléments annotés, dont 2 385 présentent une signification statistique. Cette analyse a principalement influencé les catégories de processus biologiques (BP), de fonction moléculaire (MF) et de composants cellulaires (CC). Plus précisément, la catégorie GO-BP englobait 2 450 éléments, dont 1 926 ont été jugés statistiquement significatifs. La catégorie de la fonction moléculaire (GO-MF) a identifié 184 éléments, dont 117 présentant une signification statistique. La catégorie des composantes cellulaires (GO-CC) a révélé 149 éléments, dont 59 étaient statistiquement significatifs (figure 5).
Analyse de l’enrichissement de KEGG
L’analyse de l’enrichissement de la voie KEGG a identifié un total de 156 voies associées aux 10 cibles clés, dont 119 démontrant une signification statistique. Les figures illustrent les 20 principales voies d’enrichissement ayant les scores d’enrichissement les plus élevés (figure 6). L’élimination de certaines maladies associées a laissé deux voies de signalisation, les voies de signalisation HIF-1 et JAK-STAT, qui ont été prédites comme étant des voies clés pour la QZF et la dépression.
Principaux réseaux de voies cibles pour la QZF et la dépression
Pour élucider la relation mécaniste entre la QZF et ses effets sur la dépression, nous avons développé un réseau d’interaction pivot TCM-composé-cible-voie (Figure 7). À l’aide d’un logiciel d’analyse de réseau, nous avons visualisé la voie de signalisation avec la valeur p la plus significative ainsi que ses cibles associées. Le graphe de réseau résultant comprenait 93 nœuds et 218 arêtes. De plus, nous avons généré un diagramme de Sankey pour représenter les gènes clés et leurs composés actifs correspondants, en nous concentrant spécifiquement sur les voies de signalisation centrales HIF-1 et JAK-STAT (Figure 8).
Amarrage moléculaire
L’analyse d’amarrage moléculaire a été adoptée pour étayer la spécificité cible du composé. Cette technique évalue l’affinité de liaison entre un ligand et sa cible protéique, où des amplitudes plus faibles de l’énergie de liaison indiquent une interaction plus forte et une plus grande proximité du ligand avec son site de liaison33. Les résultats ont révélé que les énergies de liaison étaient de -8,7 kcal/mol pour HIF1A et Glycyrrhiza flavonol A, -8,5 kcal/mol pour STAT3 et Ginsenoside rh2, -7,6 Kcal/mmol pour BCL2 et Isolicoflavonol, -6,8 Kcal/mol pour MTOR et Licochalcone B, -6,7 Kcal/mol pour AKT1 et Kaempférol, et -5,2 Kcal/mol pour IL6 et l’acide linolénique.
Dans l’ensemble, les résultats de l’amarrage moléculaire ont démontré que les composés présentaient une forte affinité de liaison pour leurs cibles. L’énergie de liaison de chaque protéine est visualisée comme suit : le motif en bande dessinée blanche représente le récepteur de la protéine, le bleu est le ligand de la petite molécule, la ligne pointillée jaune indique la liaison hydrogène formée entre le ligand et le récepteur, la verte représente le site d’attache de la liaison hydrogène entre le récepteur de la protéine et le ligand de la petite molécule, et les chiffres signifient les distances de liaison hydrogène, ce qui implique que la liaison entre le ligand et le récepteur est très stable (Figure 9)34.
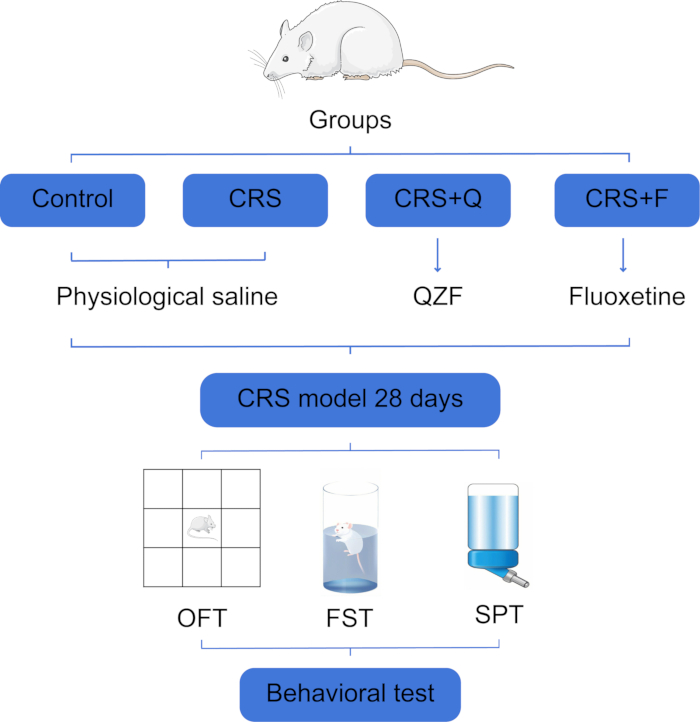
Figure 1 : Organigramme des tests de regroupement et de comportement sur des rats expérimentaux. Abréviations : SRC = stress chronique lié à la contention ; QZF (Q) = qiangzhifang ; F = fluoxétine ; OFT = essai en champ ouvert ; FST = test de nage forcée ; SPT = test de préférence pour le saccharose. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Effets de QZF sur le modèle de dépression chez le rat induit par le CRS. (A) Niveau de consommation de saccharose ( %) au jour 0 et au jour 28. (B) Poids corporel (g) au jour 0 et au jour 28. (C) Tracé des trajectoires des rats dans l’essai en plein champ à la semaine 4. (D) Distance totale en champ libre les jours 0 et 28. (E) La durée du séjour dans la zone centrale de l’OFT dans chaque groupe à la semaine 4. ** P < 0,01 indique une différence significative entre les groupes F et QZF par rapport au groupe CRS. (F) Le temps d’immobilité du TSF ( %) dans chaque groupe à la semaine 4. * P < 0,01 indique une différence significative entre le groupe F et le groupe CRS. P < 0,001 indique que le groupe QZF a montré des différences significatives par rapport au groupe CRS. Abréviations : SRC = stress chronique lié à la contention ; QZF = qiangzhifang. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 3 : Réseau QZF-Compound-Target. Les triangles verts désignent les médecines traditionnelles chinoises en QZF ; les cercles désignent les composants des médecines traditionnelles chinoises ; Les losanges désignent les cibles. Les flèches roses indiquent les constituants communs de plusieurs plantes médicinales chinoises. A (MOL000211) se rapporte à Bai shao et Zhi gan cao ; B (MOL000358) est associé à Bai shao, Chuan bei mu, Gu zhi et Ren shen ; C (MOL000359) se connecte avec Bai shao, Chuan bei mu et Gui zhi ; D (MOL000422) se rapporte à Bai shao, Zhi gan cao et Ren shen ; E (MOL000492) est pertinent pour Bai shao et Gu zhi. Veuillez cliquer ici pour voir une version agrandie de cette figure.
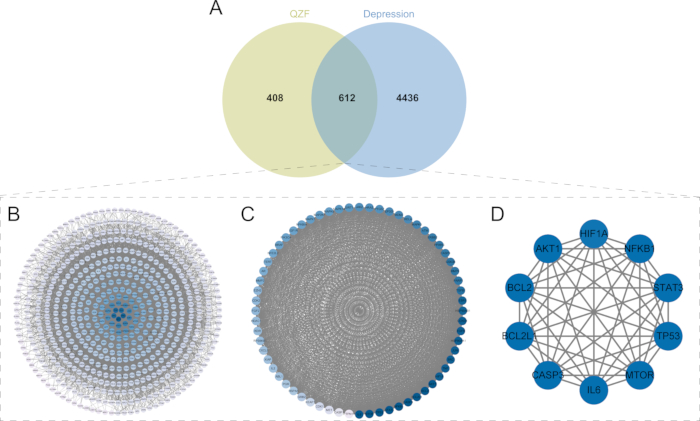
Figure 4 : Identification des cibles d’intersection et criblage des cibles principales. (A) Diagramme de Venn des cibles courantes de QZF et de dépression. Les cercles vert clair représentent les protéines cibles des ingrédients actifs du QZF ; Les cercles bleus désignent les protéines associées à la dépression. Les zones qui se chevauchent, où les deux couleurs se croisent, illustrent les protéines partagées, au total 612. (B) Réseau IPP de QZF et dépression. (C) Analyse MCODE. (D) Les 10 principales cibles. Abréviations : QZF = qiangzhifang ; IPP = interaction protéine-protéine. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Histogramme pour l’analyse de l’enrichissement des cibles courantes par GO. Les barres vertes représentent les processus biologiques ; les barres rouges représentent les fonctions moléculaires ; Les barres bleues représentent les composants cellulaires. La hauteur de chaque barre reflète le nombre de gènes associés au terme GO correspondant. Abréviation : GO = Gene Ontology. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Voies d’enrichissement KEGG des cibles thérapeutiques de QZF dans la dépression. (A) Graphique à barres des 20 principales voies, classées par valeur P. (B) Graphique à bulles des 20 principales voies : la taille des points indique le numéro du gène ; l’intensité des couleurs reflète la signification de la valeur P. (C) Annotation fonctionnelle des voies KEGG. Abréviation : KEGG = Encyclopédie des gènes et des génomes de Kyoto. Veuillez cliquer ici pour voir une version agrandie de cette figure.
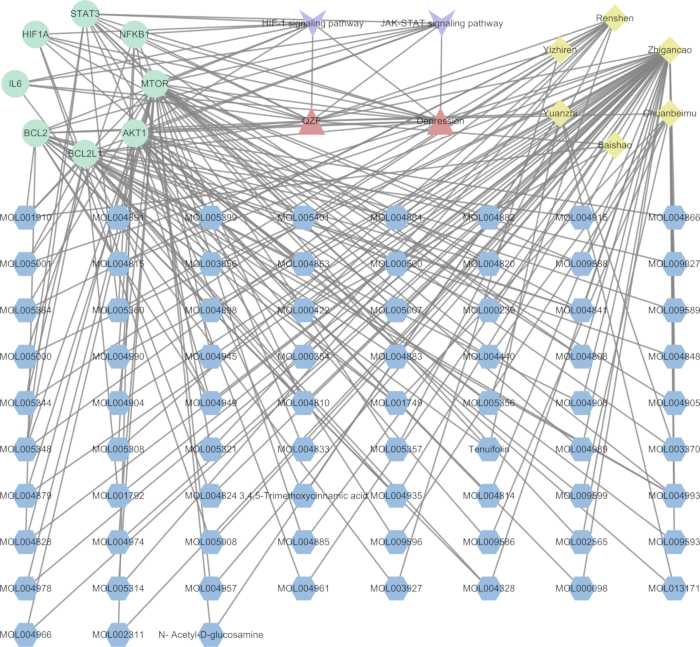
Figure 7 : Réseau d’interaction TCM-compound-target-pathway. Le rouge indique la QZF et la dépression, le violet les voies de signalisation, le vert met en évidence les protéines de la voie centrale, le jaune identifie les médecines traditionnelles chinoises dans la QZF et le bleu spécifie les composés constitutifs à base de plantes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
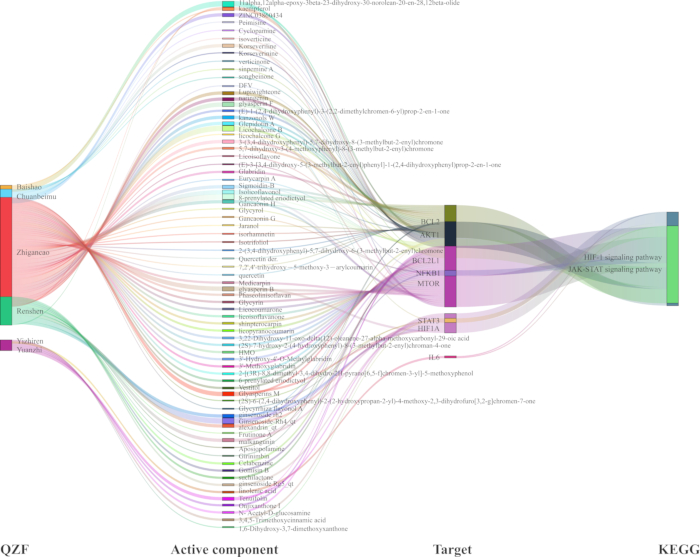
Figure 8 : Diagramme de Sankey de la voie TCM-compound-target-way pour l’effet antidépresseur de QZF basé sur les voies de signalisation HIF-1 et JAK-STAT. Abréviations : QZF = qiangzhifang ; MTC = Médecine traditionnelle chinoise ; HIF-1 = facteur 1 induit par l’hypoxie ; JAK-STAT = Traducteurs de signaux kinases activés par Janus et activateurs de transcription. Veuillez cliquer ici pour voir une version agrandie de cette figure.
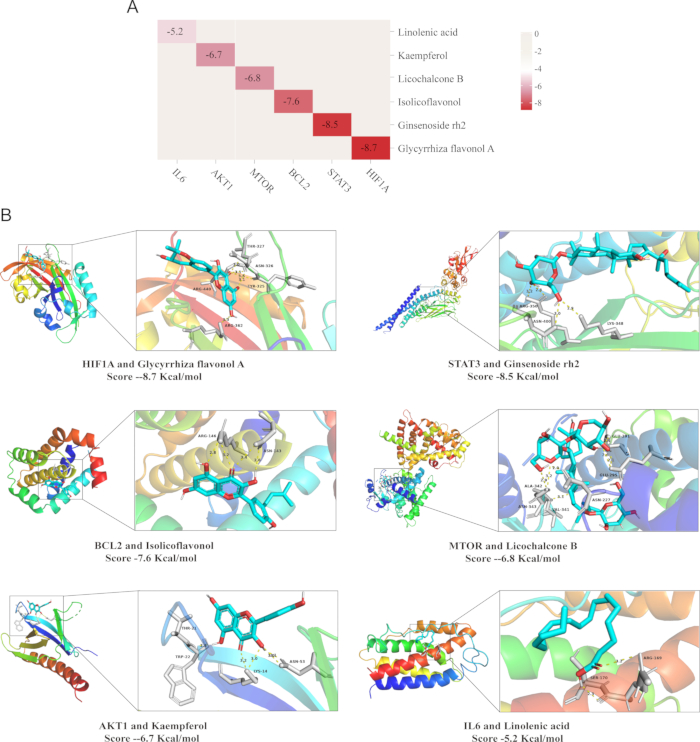
Figure 9 : Résultats de la validation de l’amarrage moléculaire. (A) Carte thermique de l’énergie de liaison (kcal/mol) entre les composants représentatifs de QZF et les molécules protéiques cibles (B) Visualisation de la situation d’amarrage. Abréviation : QZF = qiangzhifang. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Dossier supplémentaire 1 : Préparation des granules de médecine traditionnelle chinoise QZF. Abréviation : QZF = qiangzhifang. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Le CRS est une méthode largement utilisée pour établir des modèles animaux de dépression. Ce modèle imite le stress psychologique chronique rencontré dans la vie humaine et induit des comportements de type dépression chez les rats35. Dans cette étude, le tube de retenue pour rats a été fabriqué à partir de plastique transparent, assurant la sécurité des animaux tout en permettant une observation claire pendant l’expérience. Le tube transparent mesurait environ 18 cm de long et 6 cm de diamètre et comportait plusieurs trous de ventilation, chacun d’un diamètre de 1 cm, uniformément répartis le long des côtés et du couvercle pour fournir une circulation d’air suffisante aux rats. Les rats stressés présentaient des symptômes dépressifs tels que la léthargie et les yeux vitreux, ainsi que des changements de comportement caractéristiques de la dépression. Plus précisément, ces changements comprenaient une diminution de l’activité motrice dans l’OFT, un temps d’immobilité prolongé dans le FST et une réduction de la consommation de saccharose dans le SPT. Ces manifestations comportementales ressemblent beaucoup à la bradykinésie, à l’anhédonie et à la perte d’intérêt observées chez les patients atteints de dépression clinique.
Dans le contexte de l’étude des mécanismes pathologiques complexes de la dépression, la combinaison de la pharmacologie en réseau et de la technologie d’amarrage moléculaire fournit une stratégie innovante pour analyser les mécanismes moléculaires des composés de la médecine traditionnelle chinoise dans le traitement de la dépression. Cette étude a identifié HIF1A, STAT3, BCL2, MTOR, AKT1 et IL6 comme les principales cibles de QZF dans le traitement de la dépression. Ces cibles ont été principalement enrichies dans les voies de signalisation HIF-1 et JAK-STAT. Ces deux voies de signalisation jouent un rôle central dans les processus pathologiques clés de la dépression, tels que la neuroinflammation, le stress oxydatif et l’apoptose.
La voie de signalisation HIF-1, qui sert de mécanisme de régulation central du métabolisme cellulaire de l’oxygène, joue un rôle crucial dans divers processus physiologiques, notamment la neuroprotection, les réponses au stress antioxydant et l’angiogenèse36. La recherche indique que le tissu cérébral des personnes souffrant de dépression présente un microenvironnement hypoxique prononcé et des lésions de stress oxydatif, qui sont étroitement associés à l’activation des réponses neuro-inflammatoires et au déséquilibre des neurotransmetteurs37. Les recherches de Semenza démontrent que dans des conditions hypoxiques, HIF-1α régule à la hausse les gènes associés au métabolisme de l’oxygène et aux mécanismes de défense antioxydants, y compris le facteur de croissance de l’endothélium vasculaire (VEGF), l’érythropoïétine (EPO) et les gènes mitochondriaux. Par conséquent, cela améliore la fonction mitochondriale, favorise la formation de microvaisseaux cérébraux, augmente l’apport d’oxygène aux tissus cérébraux et réduit l’accumulation d’espèces réactives de l’oxygène (ROS)38.
D’autres études expérimentales démontrent que le déficit en HIF-1α augmente considérablement la susceptibilité neuronale au stress oxydatif, déclenchant ainsi une activation anormale de la voie de signalisation apoptotique39. Cela conduit à une augmentation significative de l’apoptose neuronale et à un déclin cognitif progressif. En revanche, la surexpression de HIF-1α spécifique aux neurones dans les modèles de souris transgéniques augmente considérablement la survie neuronale et la densité synaptique40. Ces résultats confirment non seulement le rôle critique de HIF-1α dans le mécanisme de défense antioxydant, mais soulignent également son importance thérapeutique potentielle dans l’amélioration de la fonction cérébrale par la promotion de la plasticité neuronale, le remodelage et l’optimisation de l’architecture synaptique. De plus, la voie de signalisation HIF-1 antagonise la voie de transduction du signal NF-κB, entraînant une réduction de la production de cytokines inflammatoires IL-6 et TNF-α, la suppression de la neuroinflammation et la démonstration d’effets neuroprotecteurs et antidépresseurs potentiels41.
Notamment, il a été confirmé que le flavonol A de Glycyrrhiza, l’un des composants actifs de QZF, présente des propriétés antioxydantes et anti-inflammatoires. Dans cette étude, les données d’amarrage moléculaire révèlent que la liquiritigénine A présente une affinité de liaison élevée à la protéine HIF-1α, atteignant -8,7 kcal/mol. Cette découverte indique fortement que le flavonol A de Glycyrrhiza peut cibler directement HIF-1α, modulant sa stabilité protéique ou son activité transcriptionnelle. Par conséquent, il régule l’expression des gènes impliqués dans le métabolisme de l’oxygène et la défense antioxydante dans la voie de signalisation HIF-1, améliorant ainsi la survie neuronale dans des conditions hypoxiques et atténuant les lésions neuronales associées à la dépression.
La voie de signalisation JAK-STAT sert de plaque tournante centrale pour la transduction du signal des cytokines et joue un rôle central dans divers processus biologiques, notamment la régulation de l’inflammation, la modulation de la réponse immunitaire et la survie neuronale42,43. Des recherches approfondies ont démontré que la pathogenèse de la dépression est intimement liée à la dérégulation de la voie de signalisation JAK-STAT44. Une méta-analyse réalisée par Dowlati et al. a révélé que, par rapport aux témoins sains, les taux sériques de cytokines pro-inflammatoires telles que l’IL-6 et le TNF-α étaient significativement augmentés chez les patients souffrant de dépression et positivement corrélés à la gravité des symptômes dépressifs45. Plus précisément, ces facteurs pro-inflammatoires sont capables d’activer la voie JAK-STAT, provoquant ainsi une réponse inflammatoire. Ce processus induit non seulement des dommages directs aux neurones et aux cellules gliales, mais compromet également la structure et la fonction synaptiques, exacerbant finalement les troubles cognitifs et émotionnels chez les patients46.
De plus, l’activation excessive de la voie JAK-STAT est fortement associée à l’apoptose neuronale. La phosphorylation soutenue de STAT3 régule à la hausse l’expression des gènes pro-apoptotiques, y compris les membres de la famille des caspases, ce qui entraîne finalement une perte neuronale. De plus, l’activation aberrante de cette voie altère la neurogenèse dans la région de l’hippocampe et diminue la plasticité synaptique, exacerbant ainsi les déficits neurofonctionnels47. Dans cette étude, le ginsénoside Rh2, un composant actif important de QZF, a montré une affinité de liaison significative avec la protéine STAT3 dans l’analyse d’amarrage moléculaire. Sur la base de ces résultats, le ginsénoside Rh2 peut atténuer efficacement les réponses neuroinflammatoires en inhibant spécifiquement l’activation de STAT3 et en réduisant ainsi la production et la libération de cytokines pro-inflammatoires48.
En plus des deux voies de signalisation principales, HIF-1 et JAK-STAT, cette étude a identifié les interactions synergiques entre d’autres composants actifs et cibles pendant l’action antidépressive de QZF. BCL2, une protéine canonique anti-apoptotique, joue un rôle essentiel dans le maintien de la survie cellulaire et la suppression des voies de signalisation apoptotiques49. Dans QZF, l’isolicoflavonol présente des propriétés antioxydantes et anti-apoptotiques en ciblant et en activant spécifiquement la protéine BCL2, inhibant ainsi efficacement l’apoptose neuronale, protégeant les neurones et améliorant les altérations neuropathologiques associées à la dépression. De plus, la voie de signalisation aberrante MTOR chez les patients souffrant de dépression est fortement associée à un dysfonctionnement neuronal50. Des études ont démontré que la licochalcone B favorise la croissance et la survie neuronales, améliore la plasticité synaptique et la connectivité fonctionnelle en modulant la voie de signalisation MTOR51, exerçant ainsi un effet antidépresseur. De plus, le flavonoïde naturel kaempférol, caractérisé par ses puissantes activités antioxydantes et anti-inflammatoires, active spécifiquement la voie de signalisation AKT1. Grâce à la régulation de plusieurs molécules clés en aval, il favorise non seulement la survie neuronale, mais accélère également la récupération fonctionnelle, fournissant ainsi un soutien moléculaire supplémentaire pour les effets antidépresseurs de QZF.
En résumé, cette étude a utilisé la pharmacologie de réseau et l’amarrage moléculaire pour prédire les voies thérapeutiques, les cibles principales et les composants actifs efficaces de QZF dans le traitement de la dépression. L’effet antidépresseur de QZF a été validé dans un modèle de dépression chez le rat, suggérant qu’il pourrait exercer ses effets antidépresseurs en modulant plusieurs voies de signalisation, y compris HIF-1 et JAK-STAT, et en ciblant des processus pathologiques clés tels que la neuroinflammation, le stress oxydatif et l’apoptose. Cette découverte permet non seulement d’approfondir notre compréhension des mécanismes pathologiques sous-jacents à la dépression, mais aussi de fournir une base théorique et de nouvelles cibles thérapeutiques pour l’application des formules de la médecine traditionnelle chinoise dans le traitement de la dépression. Cependant, cette étude présente certaines limites. Les mécanismes synergiques de plusieurs composants de QZF restent à élucider entièrement, et les processus métaboliques et les interactions de ces composants in vivo nécessitent des recherches plus approfondies. Les recherches futures pourraient intégrer des expériences in vitro et in vivo avec des technologies avancées telles que la chromatographie liquide, le séquençage à haut débit et l’intégration multi-omique afin d’identifier de manière exhaustive et précise les cibles et les voies clés associées aux effets antidépresseurs de la QZF, vérifiant et élargissant ainsi les prédictions faites par la pharmacologie en réseau.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
La recherche a été soutenue par la Fondation nationale des sciences naturelles de Chine (82374311), le projet de construction de la théorie de base de la médecine traditionnelle chinoise (MTC) de haut niveau de l’Administration d’État de la médecine traditionnelle chinoise (MTC) (zyyzdxk-2023118), le projet de construction du studio des experts nationaux en médecine traditionnelle chinoise (Lettre nationale d’éducation en médecine chinoise n° 75) et la Fondation des sciences naturelles de la province du Shandong (ZR2022LZY016). Les granules QZF ont été préparés par le Département des produits pharmaceutiques de l’hôpital affilié de l’Université de médecine traditionnelle chinoise du Shandong.
matériels
| Name | Company | Catalog Number | Comments |
| Animal behavior analysis system | Shanghai Xinsoft Information Technology Co., LTD | XR-SuperMaze | |
| AutoDockTools | The Scripps Research Institute | ||
| Cytoscape software | Cytoscape Consortium | version 3.7.2 | |
| Electric soldering iron hole puncher | Nanjing Naiwei Technology Co., Ltd. | ||
| Fluoxetine | Lilly Suzhou Pharmaceutical Co., LTD | ||
| Open field experimental system | Shanghai Xinsoft Information Technology Co., LTD | XR-XZ301 | |
| PyMol | Schrödinger | ||
| Qiangzhifang | Affiliated Hospital of Shandong University of Traditional Chinese Medicine, Jinan, China | ||
| Transparent plastic tube | Nantong Baiyang Plastic Products Co., Ltd. |
Références
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon