Method Article
돼지의 마취 중 반복적인 피질 기록을 위한 만성 두개골 창 기술
요약
이 연구는 돼지 모델에서 반복되는 만성 피질 기록에 대한 확장 가능하고 신뢰할 수 있으며 재현 가능한 방법을 제시합니다. 이 방법은 통증 연구 및 신경 질환 진단을 포함한 다양한 신경 과학 분야에 응용되고 있습니다.
초록
대뇌피질 기록은 뇌-컴퓨터 인터페이스 및 질병 진단을 포함한 다양한 응용 분야에 정보를 제공하기 위해 뉴런 신호를 추출하는 데 필수적입니다. 각 응용 분야는 녹음 기술에 대한 특정 요구 사항을 제시하며, 장기 녹음을 위해 침습적 솔루션이 선택되는 경우가 많습니다. 그러나 침습적 기록 방법은 장치 고장 및 조직 부작용으로 인해 장기적인 신호 품질을 손상시키는 데 어려움을 겪고 있습니다.
만성 피질 기록의 신뢰성과 품질을 개선하는 동시에 장치 고장 및 조직 반응과 관련된 위험을 최소화하기 위해 우리는 두개골 창 기술을 개발했습니다. 이 프로토콜에서는 어린 재래종 돼지에 두개골 창을 이식하고 접근하는 방법을 보고하며, 이는 경막에 임시 전기 피질 검사(ECoG) 어레이 배치를 용이하게 합니다. 또한 두개골 창 기술을 사용하여 피질 신호를 기록하는 방법에 대해 설명합니다. 두개골 창 접근은 여러 번 반복될 수 있지만 회복과 조직 치유를 촉진하기 위해 임플란트와 접근 수술 사이에 최소 2주가 권장됩니다.
두개골 창 접근법은 일반적인 전극 고장 모드와 조직 반응을 성공적으로 최소화하여 시간이 지남에 따라 안정적이고 신뢰할 수 있는 피질 기록을 생성했습니다. 우리는 예로 1차 체성 감각 피질의 사건 관련 전위(ERP)를 기록했습니다. 이 방법은 매우 신뢰할 수 있는 기록을 제공했으며, 이를 통해 ERP에 대한 개입(고주파 자극)의 효과를 평가할 수도 있었습니다. 심각한 장치 고장이 없고 사용된 전극 수(전극 2개, 녹음 세션 43개, 동물 16마리)가 감소한 것은 연구 경제성이 개선되었음을 시사합니다. 전극 삽입을 위해서는 경미한 수술이 필요하지만, 이 방법은 감염 위험 감소 및 동물 복지 개선과 같은 이점을 제공합니다.
이 연구는 통증 연구 및 신경 질환 진단을 포함한 다양한 신경 과학 분야에서 잠재적으로 응용될 수 있는 만성 피질 기록에 대한 확장 가능하고 신뢰할 수 있으며 재현 가능한 방법을 제시합니다. 미래의 적응은 다른 종과 피질 내 기록 및 이미징 기술과 같은 기록 양식으로 사용을 확대 할 수 있습니다.
서문
일반적으로 대뇌피질 기록의 목적은 뇌의 뉴런 신호에서 정보를 추출하는 것입니다. 이 정보는 외부 장치 제어, 통신, 질병 진단 또는 재활 등 다양한 방식으로 사용될 수 있습니다 1,2,3,4. 각 응용 프로그램에는 필요한 정보 내용 및 공간 해상도와 허용 가능한 것으로 간주되는 침입성의 양에 대한 고유한 요구 사항이 있습니다. 따라서 1929년 뇌파의 발견 이후 다양한 침입성과 공간 해상도를 가진 기록 솔루션이 개발되었습니다5.
일반적으로 이들은 뇌파 검사(EEG), 전기 피질 검사(ECoG) 및 피질 내 기록으로 나눌 수 있습니다. EEG는 전체 뇌에서 신경 진동 및 이벤트 관련 전위(ERP)를 캡처하는 비침습적 기록 방법입니다. 그러나 이 활동의 출처를 정의할 수 있는 능력은 낮은 공간 해상도로 인해 제한됩니다. ECoG는 전극을 경막하 또는 경막하로 배치하는 보다 침습적인 방법으로, 일반적으로 피질의 더 작은 부분을 덮습니다. 공간 해상도가 더 높으며 ERP를 기록하고 LFP(Local Field Potentials)를 표면화할 수 있습니다. 따라서 뇌 활동의 원인을 보다 정확하게 국소화할 수 있으며, 이는 예를 들어 국소 간질의 원인을 식별하는 데 도움이 됩니다. 피질내 기록은 가장 침습적인 기록 방법이며 뇌 표면 또는 내부 깊숙한 곳에 위치한 개별 뉴런의 스파이크 활동과 전극 주변의 뉴런 부피에서 LFP를 기록할 수 있습니다. 이러한 신호는 매우 높은 공간 해상도와 정보 내용을 갖지만 제한된 뉴런 하위 집합(채널당 1-10개의 뉴런)에 의해 생성됩니다6.
장기간(수개월-년) 동안 뇌에서 정보를 추출하려면 수집된 신호가 전체 기간 동안 동일한 정보를 계속 나타낼 수 있도록 인터페이스가 안정적이고 신뢰할 수 있어야 합니다. EEG 기록은 잦은 전극 교체가 필요하므로 신뢰성이 매우 낮음에서 매우 높음까지 다양합니다 7,8,9,10. 따라서 ECoG 및 피질 내 방법은 종종 장시간 녹음을 위해 선택됩니다. 그러나 이러한 방법 모두 기록 전극과 조직의 상태가 시간이 지남에 따라 안정적으로 유지되어야 합니다. 전극은 일반적으로 동일한 위치에 유지되지만 전극-조직 인터페이스는 조직 반응 또는 전극 고장 모드 11,12,13,14로 인해 변경될 수 있습니다. 조직 반응에는 신경 세포 사멸, 출혈, 생체 오염, 이물질 반응, 신경교증, 캡슐화, 감염, 수막염 및 수막 돌출이 포함됩니다15. 이러한 반응은 전극12,13의 기록 능력을 손상시킵니다. 일반적인 전극 고장 모드는 절연 부품의 박리 또는 누출, 전극 표면 코팅 박리 또는 균열, 와이어 손상 및 전극 전위11,12입니다.
전극 고장 모드를 극복하기 위해 우리는 조직 반응과 관련된 많은 문제, 즉 신경 세포 사멸, 이물질 반응, 신경교증, 캡슐화 및 수막 압출과 관련된 많은 문제를 해결하는 임시 전극 배치 솔루션의 실행 가능성을 고려했습니다. 또한, 신뢰할 수 있고 재현 가능한 신경 세포 기록을 달성하기 위해서는 일관된 전극 배치가 필요했습니다. 전극은 신경 조직에서 몇 밀리미터 거리에 경막외로 배치되었기 때문에 전극의 움직임은 1mm를 초과해서는 안 됩니다. 두개골 창은 전극 배치 사이의 과도한 움직임을 방지하기 위한 치수로 설계되었습니다. 두개골 창 기술의 개발로 장기적인 신호 신뢰성과 품질을 개선하고 전극 고장의 위험을 제거하는 것을 목표로 합니다.
프로토콜
이 프로토콜은 덴마크 식품농수산부 산하 덴마크 수의학 및 식품청(프로토콜 번호 2020-15-0201-00514)의 승인을 받았습니다. 총 16마리의 암컷 재래종 돼지가 이 수술을 받았습니다. 시설에 도착했을 때 동물의 체중은 약 20kg으로 약 2개월 된 상태였습니다. 이식 시 체중은 약 30kg이었고 연구가 끝날 때 40-60kg이었습니다. 절차는 이식 수술, 접근 수술 및 말기 수술로 구성됩니다(그림 1).
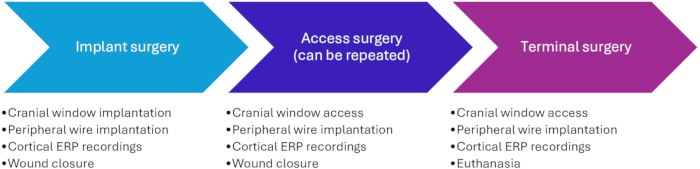
그림 1: 실험 절차의 타임라인. 접근 수술(2상)은 여러 번 반복될 수 있습니다. 회복과 수술 사이의 상처 치유를 위해 수술 사이에 최소 2주의 간격을 두는 것이 좋습니다. 약어: ERP = event-related potential. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. 이식 수술 (I상)
참고: 3D 프린팅 폴리락트산(PLA) 두개골 창(그림 2)을 이식하여 돼지의 1차 체감각 피질에서 반복적인 기록을 용이하게 합니다. 척골 신경의 전기 자극으로 인한 ERP가 기록됩니다. 수술과 상처 봉합은 두개골 창에 접근하고 이후에 닫을 수 있도록 수행됩니다.

그림 2: 두개골 창 디자인. (A) 두개골 창의 측면도는 벽의 높이와 두개골에 고정된 바닥을 나타냅니다. (B) 두개골 과부의 직경, 나사 구멍, 캡 공간 및 창을 나타내는 평면도. 두개골 창 캡은 캡 공간에 정확히 맞는 1mm 높이의 22mm 직경 실린더입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 두개골 창 이식
- 수술 준비
참고: 데이터 프로세서(RZ2), 워크스테이션(WS8) 및 PC는 수술이 시작되기 전에 켜져 있습니다. 비멸균 연구원은 최소 15분마다 스프레드시트에 수술 메모를 작성하여 활력 징후(심박수, spO2, 호기말 CO2, 심부 온도), 마취 수준(프로포폴 주입률, 펜타닐 주입률, 세보플루란 비율), 수술 단계 및 모든 불규칙성을 문서화합니다.- Zoletil 혼합물 5-7mL(1mL에는 8.3mg의 틸레타민, 8.3mg의 졸라제팜, 8.3mg의 자일라신 및 1.7mg의 부토판올이 포함됨)의 근육 주사를 사용하여 동물을 진정시킵니다.
참고: 이 특정 연구에서는 NMDA 수용체를 차단하지 않기 위해 Zoletil 혼합물에서 케타민을 생략했습니다. - 동물을 수술실로 이송합니다. 동물을 삽관하고 기계식 인공호흡기에 연결합니다.
- 귓정맥 카테터를 삽입하여 프로포폴, 펜타닐 및 식염수를 투여합니다.
- 외과적 마취 투여: 세보플루란 1-2%, 프로포폴(8mg∙kg-1∙h-1에서 10mg/mL 주입), 펜타닐(20μg∙kg-1∙h-1에서 50μg/mL 주입).
- 멸균 드레이핑을 하기 전에 멸균 마커를 사용하여 절개 부위를 표시합니다. 각 귀와 반대쪽 눈 사이에 직선을 그려 브레그마 점을 식별합니다. 브레그마 점은 이러한 선의 교차점에 있습니다(그림 3A). 절개 부위가 자극된 앞다리와 반대쪽 측면의 정중선에서 약간 측면에 있는지 확인하십시오.
- 커튼 아래에 금속판을 놓고 수술을 시작하기 전에 적절한 배치와 안정성을 확인하십시오.
- Zoletil 혼합물 5-7mL(1mL에는 8.3mg의 틸레타민, 8.3mg의 졸라제팜, 8.3mg의 자일라신 및 1.7mg의 부토판올이 포함됨)의 근육 주사를 사용하여 동물을 진정시킵니다.
- 두개골에 접근하기
참고: 프로토콜의 이 부분과 다음 부분에서 모든 절차는 달리 명시되지 않는 한 멸균 외과의에 의해 수행됩니다.- 1.1.1.5단계에서 표시한 대로 정중선에서 약간 옆쪽에 메스로 진피를 처음 절개합니다. 소작기로 피부를 절개하십시오.
참고: 돼지의 큰 전두동을 피하기 위해 절개 부위를 너무 앞쪽으로 확장하지 마십시오. 더 많은 공간이 필요한 경우 뒤쪽의 절개 부위를 확장하십시오. - 견인기를 놓고 겸자를 사용하여 피부를 잡고 골막과 피하 사이의 무혈관 결합 조직을 절단하여(그림 3B) 피부에 더 많은 유연성을 제공하고 1.4단계에서 봉합을 용이하게 합니다. 얻은 유연성에 맞게 견인기를 조정하십시오.
- 골막을 절개하고 골막용 엘리베이터를 사용하여 두개골에서 풀어줍니다. 견인기를 사용하여 골막을 옆으로 잡습니다.
- 1.1.1.5단계에서 표시한 대로 정중선에서 약간 옆쪽에 메스로 진피를 처음 절개합니다. 소작기로 피부를 절개하십시오.
- dura 접근하기
- 직경 10mm의 구멍을 시상 봉합선 정면과 정중선 봉합선 측면으로 뚫습니다(그림 3C). 둥근 드릴 비트로 인해 약간 가늘어지는 구멍이 생기므로 듀라 레벨에서 직경 10mm의 구멍을 만들려면 직경 15mm에서 시작합니다.
- 잘 맞도록 두개골 창을 초기에 구멍에 끼웁니다.
- 듀라가 보이면 더 작은 드릴 비트로 전환하여 듀라 수준에서 구멍의 최대 너비를 달성하십시오. Rongeurs를 사용하여 가장자리를 자릅니다.
- 두개골 창 이식
- 두개골 창이 구멍 안팎까지 맞는지 확인하고 깊이를 결정하십시오. 이것은 동물에 따라 다르지만 두개골 창의 벽이 경막에 닿도록 하여 잘 맞도록 하되 어떤 위치에서도 뇌에 압력을 가하지 마십시오.
- 두개골 창을 제자리에 고정한 상태에서 핸드 드릴을 사용하여 나사 구멍을 표시합니다.
- 두개골 창을 제거하고 최소 4mm 깊이의 구멍을 뚫습니다. 나사 중 하나의 두개골을 관통하여 피질 기록의 접지/참조로 사용합니다.
- 두개골 창을 배치하고(그림 3) 나비 주입 세트에서 바늘을 제거합니다. 뭉툭한 나비를 사용하여 두개골 창을 통해 나사 구멍의 깊이를 측정합니다. 구멍에 일치하는 길이의 나사를 삽입하고 조입니다.
알림: 나사가 너무 길면 두개골 창 캡을 효과적으로 고정할 수 없습니다. - 두개골을 뚫고 경막에 닿는 하나의 나사 아래에 U-커넥터를 놓습니다.
참고: 이 나사의 길이가 두개골의 두께보다 커서 다시 자라는 뼈가 경막과의 접촉을 막지 않도록 하는 것이 중요합니다.
- 수술 준비
- 주변 와이어 주입
참고: 이 절차는 두개골 창 이식과 동시에 수행할 수 있습니다. 이것은 멸균 절차입니다. 수술 부위 또는 두개골 부위의 오염을 방지하기 위해 멸균 복장을 착용해야 합니다.- 척골 신경 근처에 와이어 이식
- 앞다리의 뒤쪽 원위부 피부에 두 개의 바늘(관통하지 않음) 또는 2cm 떨어진 다른 멸균 금속 조각으로 피부를 만져 5mA에서 전기 자극을 피부에 가합니다. 신경이 이 두 지점 사이를 달리고 있음을 나타내는 명확한 발굽 굴곡을 찾으십시오.
알림: 뒤쪽 부분에 더 쉽게 접근할 수 있도록 팔다리를 뒤로 회전해야 할 수도 있습니다. - 신경 과정에 수직으로 두 개의 바늘을 약 2cm 간격으로 삽입합니다. 삽입 지점에서 약 3cm 떨어진 곳에서 피부를 다시 뚫습니다(그림 4A).
- 2mA에서 바늘에 적용된 테스트 자극을 사용하여 위치를 확인합니다. 발굽의 명확한 움직임이 보이는지 확인하십시오.
- Cooner 와이어를 바늘에 통과시키고 바늘을 제거하여 Cooner 와이어를 부분적으로 피부 아래에 남겨둡니다. 전선 중간에 있는 절연되지 않은 부분이 두 전선의 스킨 아래에 있는지 확인합니다(그림 4B).
알림: 팔다리를 뒤로 회전한 경우 조심스럽게 앞으로 돌립니다. - 각 악어 커넥터를 두 Cooner 와이어의 절연되지 않은 끝에 연결합니다.
- 앞다리의 뒤쪽 원위부 피부에 두 개의 바늘(관통하지 않음) 또는 2cm 떨어진 다른 멸균 금속 조각으로 피부를 만져 5mA에서 전기 자극을 피부에 가합니다. 신경이 이 두 지점 사이를 달리고 있음을 나타내는 명확한 발굽 굴곡을 찾으십시오.
- 모터 임계값 설정
- 업다운 방법16,17을 사용하여 모터 임계값을 찾습니다. 100μA에서 시작하여 50μA씩 증가하면서 발굽 영역에서 운동 반응을 관찰하고 느낍니다. 일반적으로 1mA 미만의 임계값이 가능합니다.
- 모터 임계값의 2배에서 200μs 펄스 폭을 가진 100개의 직사각형 양상 대칭 자극을 제공하고 모터 임계값의 10배에서 100개의 자극을 제공하도록 STG를 프로그래밍합니다.
- 척골 신경 근처에 와이어 이식
- 대뇌피질 신호 기록
- 비멸균 연구원에게 프리앰프를 제 위치에 놓고 광섬유 케이블을 사용하여 데이터 프로세서(RZ2)에 연결하도록 합니다.
- 세보플루란을 0.5-1%(수술 수준의 절반)로 낮추고 심박수, 만료된 CO2 및 혈압(사용 가능한 경우)을 모니터링하여 적절하고 안정적인 마취 깊이를 보장합니다. 필요에 따라 프로포폴과 펜타닐을 모두 늘리십시오.
- 비멸균 연구원이 헤드스테이지를 프리에 부착하도록 합니다.ampliifier(SI8) 및 (ZIF-clip) 헤드스테이지를 헤드에tage 마그네틱 스탠드 마이크로매니퓰레이터에 장착된 홀더.
- 마이크로매니퓰레이터 주위에 멸균 드레이핑을 놓고 접착 부분을 헤드스테이지 및 헤드스테이지 홀더에 부착합니다(그림 5A).
- 무균 연구원에게 마그네틱 스탠드를 사용하여 미세 조작기를 고정하고 μECoG 전극을 알코올에 담근 다음 (ZIF-clip) 헤드 스테이지에 놓습니다.
알림: 전극을 경막에 놓기 전에 전극을 건조시키십시오. μECoG 전극은 멸균되지 않았으므로 헤드스테이지를 덮고 있는 멸균 드레이핑만 만지십시오. - 마이크로 매니퓰레이터를 사용하여 μECoG를 제자리에 가져오고 면봉으로 안내합니다. 악어 커넥터를 사용하여 μECoG의 접지선을 접지 나사에 연결합니다.
- 세보플루란을 0으로 낮추고, 심박수, 만료된 CO2 및 혈압(사용 가능한 경우)을 모니터링하여 적절하고 안정적인 마취 깊이를 보장하고, 필요에 따라 프로포폴과 펜타닐을 모두 증가시킵니다.
- synapse에서 신호를 미리 봅니다. 일반적인 신호 범위는 최대 ±100μV입니다.
- 신호가 굵은 선 (라인 노이즈를 나타냄)처럼 나타나면 멸균 작업자가 다음 작업을 수행하도록 합니다.접지 회로를 조사하고 접지 나사와 연결부를 건조한 상태로 유지하고 주변 조직과 격리합니다. 돼지 사체 및 수술 기구에서 다른 케이블링이 분리되어 있는지 조사합니다. 그렇지 않은 경우 멸균 거즈를 사용하여 신체나 수술 기구에서 케이블을 분리하십시오.
- 신호의 진폭 이 ±100μV (움직임 아티팩트를 나타냄)보다 큰 경우 전극이 매달려 있고 뇌에 놓여 있는지, 돼지가 척골 신경의 환기 또는 전기 자극으로 인해 움직일 때 케이블이 움직이지 않는지 확인하십시오.
- 신호 진폭 이 ± 20mV보다 작 으면(접촉 불량 또는 깊은 마취를 나타냄) μECoG가 뇌에 닿고 경막과 전극에 수화가 되어 있는지 확인합니다. 필요한 경우 전극에 식염수를 약간 떨어뜨립니다. 세보플루란이 꺼져 있는지 확인하고 프로포폴(및 펜타닐)의 주입 속도를 줄입니다. 테스트 자극을 수행하고 유발된 반응이 보이는지 확인합니다. 주변 와이어의 절연되지 않은 부분이 완전히 피부 아래에 있는지 확인하십시오.
참고: 유발된 반응은 일반적으로 온라인에서 한 번의 스윕으로 구별할 수 있지만, 평균 5-10개의 자극을 취하여 오프라인에서 이를 평가하는 것도 가능합니다. 트리거 시점에 피크가 보이면 이는 자극 아티팩트입니다. 자극 아티팩트는 데이터 분석을 방해합니다.
- 양호한 조직 접촉을 유지하기 위해 전극에 멸균 거즈를 놓습니다. 조직의 건조를 방지하기 위해 거즈에 체온 식염수를 떨어뜨립니다.
참고: 이러한 기록은 경막외 마취이므로 정확한 온도는 필수가 아닙니다. 경막하 녹음의 경우 이것이 더 중요합니다. - 전극이 안정될 때까지(30분) 전극 배치 및 접지 커넥터 설정을 문서화하여 유사한 후속 녹음을 보장합니다(그림 5B-D). 녹음을 시작하고 30분마다 자극 프로그램을 시작하기 전에 10초 동안 기다립니다.
알림: 전극의 거즈가 수분이 유지되고 필요한 경우 체온 식염수를 떨어뜨리는지 기록 사이에 정기적으로 확인하십시오. - 3회의 자극 후 개입을 수행합니다(개입 전 기준선으로 사용). 다시 9라운드 동안 자극을 반복합니다.
알림: 전극의 거즈가 수분이 유지되고 필요한 경우 식염수가 떨어지는지 기록 사이에 정기적으로 계속 확인하십시오.
- 임플란트 부위 폐쇄
- 전극에서 거즈를 제거하고 면봉으로 부드럽게 안내하면서 마이크로 매니퓰레이터를 사용하여 전극을 제거합니다.
- 비멸균 연구원이 미세 조작기, 전극, 헤드스테이지 및 프리앰프를 제거하고 제거하도록 하고 탈이온수로 빠르게 헹궈 조직 잔여물을 제거하여 제조업체의 지시에 따라 전극을 청소합니다. 렌즈 클리너에 전극을 최대 4시간 동안 담궈 전극 표면에서 조직과 단백질을 제거한 다음 탈이온수로 두 번째 헹궈 전극 표면에서 렌즈 클리너를 제거합니다. 보관하기 전에 전극을 이소프로필 알코올에 담그십시오.
- 두개골 창 캡을 놓아 두개골 창을 닫고 두개골 창에 정확히 맞는지 확인합니다. 추가 고정이 필요하지 않습니다. 피부가 보형물에 가하는 압력이 보형물을 제자리에 유지합니다.
- 항생제 파우치를 두개골 창 캡 위에 놓고 매립형 수직 매트리스 봉합사 기법을 사용하여 단일 흡수성 봉합사로 피부를 피하로 봉합합니다(그림 6A). 피부 봉합사를 배치할 수 있는 공간을 확보하는 5-10mm 거리에 봉합사를 배치합니다. 마지막 세 개의 봉합사를 놓은 후 묶지 마십시오. 대신, 모든 봉합사가 배치될 때 이 세 개의 봉합사를 묶으십시오.
참고: 세 개를 모두 배치한 후 마지막 세 개의 봉합사를 묶으면 마지막 봉합사를 배치할 수 있는 충분한 공간이 확보됩니다. - 피부에 연속적인 방식으로 연속 피내 봉합사를 배치합니다. 절개 부위 측면에서 1-2cm 측면에서 피내 봉합사를 시작하고 봉합사의 과도한 긁힘과 풀림을 방지하기 위해 피부 아래에서 피부의 진피층까지 터널을 뚫습니다(그림 6B). 봉합사의 측면 끝에 매듭을 묶습니다.
참고: 프로포폴과 펜타닐은 깨어 있는 시간이 몇 분 동안 있으므로 이 절차 중에 끌 수 있습니다. - 절개 부위의 다른 쪽에 도달할 때까지 피하 봉합사 사이에 연속 봉합사를 놓습니다.
참고: 봉합사가 진피에서 나오지만 피부를 뚫지 않도록 하여 동물이 봉합사를 긁을 수 없도록 하는 것이 중요합니다. - 절개 부위 옆으로 1-2cm 떨어진 봉합사를 측면 출구 부위로 터널을 뚫고 매듭을 묶습니다(그림 6B). 절개 부위에 조직 접착제를 바릅니다.
- 동물 귀가 펜
- 동물의 멸균 커튼을 제거하고 움직임이 관찰되는 즉시 동물을 인공호흡기에서 떼십시오.
- 동물을 가정용 펜으로 옮기고 하룻밤 동안 펜 메이트와 분리하여 보관하십시오.
참고: 돼지는 수술 후 분리되는데, 이는 돼지가 우리 짝을 격렬하게 깨우려고 하여 물린 상처를 일으키는 것이 정상이기 때문입니다. 돼지는 주둥이를 접촉할 수 있어야 합니다.
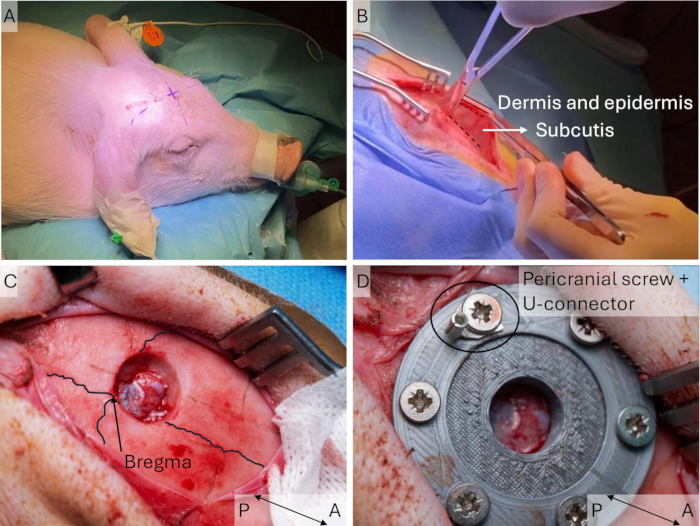
그림 3: 두개골 창의 이식. (A) 브레그마 포인트의 예상 위치는 멸균 드레이핑 전에 식별되어 돼지에 표시되는데, 이는 나중에 구별하기 어려울 수 있기 때문입니다. (B) 피부 절개 후 가위를 사용하여 무혈관 피하를 풀어줍니다. (C) 두개골에 직경 15mm의 구멍을 뚫고 룽거를 사용하여 가장자리를 제거합니다. 관상동상동맥(coronal and sagittal sisture lines)이 강조되어 있습니다. (D) 두개골 창은 나사로 이식하고 고정합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
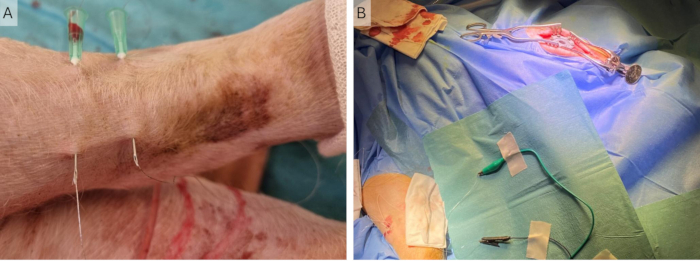
그림 4: 주변 와이어의 이식. (A) 두 개의 23G 바늘을 피부에 삽입하고 이를 통해 Cooner 와이어를 삽입합니다. (B) 바늘을 제거하고 악어 클립을 사용하여 자극기에 연결된 피부에 와이어를 남깁니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
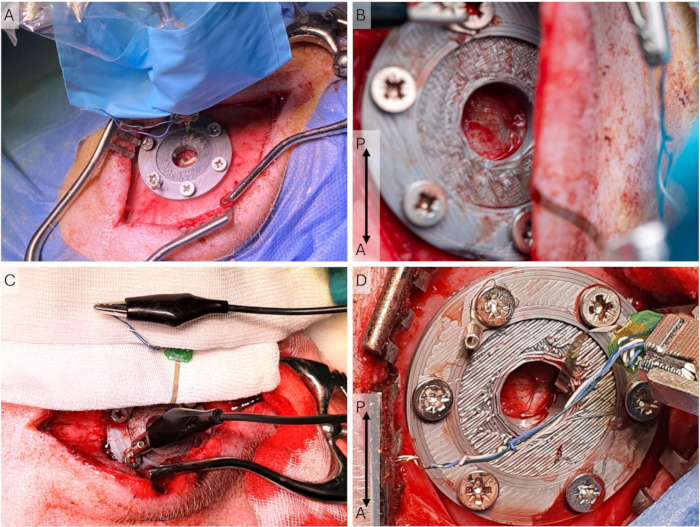
그림 5: 피질 기록 설정. (A) 전극 어레이는 경막에 배치되고, 헤드스테이지 홀더와 미세 조작기는 이식 수술 중 절개 부위가 더 길고 측면으로 향하는 멸균 슬리브에 있습니다. (B) 절개 부위가 더 내측에 있는 접근 수술 중 기록 설정에서 μECoG의 클로즈업. (C) ECoG의 모든 접지 및 기준선이 단락되고 U-커넥터를 통해 두개주 나사에 연결되는 접지 설정. (D) 접근 수술 중 헤드스테이지 및 헤드스테이지 홀더의 클로즈업. μECoG는 경막에 배치됩니다. 약어: ECoG = 피질 조영술; μECoG = 마이크로ECoG. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
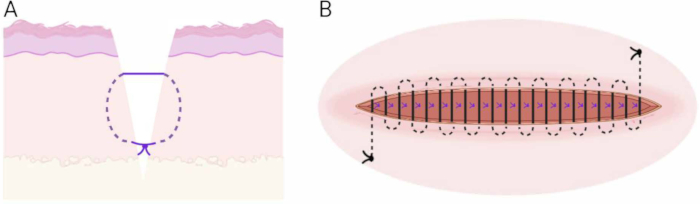
그림 6: 봉합 기술. (A) 피하 매몰 수직 매트리스 기술의 개략도. (B) 연속 피내 봉합사 기술의 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 접근 수술(2상)
참고: 2-4주 후, 두개골 창을 열어 S1의 피질 신호에 대한 후속 기록을 수행합니다. 수술과 상처 봉합은 다시 두개골 창에 접근하여 다시 닫을 수 있는 방식으로 수행됩니다.
- 수술 준비
참고: 2.1.1-2.1.6단계는 1.1.1.1-1.1.1.6단계와 유사합니다.- 졸레틸 혼합물(졸레틸 5mL[틸레타민 25mg/mL 및 졸라제팜 25mg/mL], 자일라진 6.25mL(20mg/mL) 및 부토르판올 2.5mL(10mg/mL))를 사용하여 동물을 진정시킵니다.
참고: 이 특정 연구에서는 NMDA 수용체의 차단을 피하기 위해 졸레틸 혼합물에서 케타민을 생략했습니다. - 동물을 수술실로 이송하여 삽관과 인공호흡을 합니다.
- 귀 정맥 카테터를 삽입하십시오. 카테터를 통해 프로포폴, 펜타닐 및 식염수를 투여합니다.
- 외과적 마취 투여: 세보플루란 1-2%, 프로포폴(8mg∙kg-1∙h-1에서 10mg/mL 주입), 펜타닐(20μg∙kg-1∙h-1에서 50μg/mL 주입).
- 필요한 경우 멸균 드레이핑을 하기 전에 멸균 마커를 사용하여 절개 부위를 표시합니다. 각 귀와 반대쪽 눈 사이에 직선을 그려 브레그마 점을 식별합니다. 브레그마는 이러한 선의 교차점에 있습니다(그림 3A).
참고: 초기 절개 부위는 일반적으로 여전히 볼 수 있습니다. 새로운 절개 부위는 대부분의 흉터 조직을 피하고 상처를 쉽게 봉합할 수 있도록 초기 절개 부위에서 최소 30mm 떨어진 곳에 위치해야 합니다. - 커튼 아래에 금속판을 놓고 수술을 시작하기 전에 적절한 배치와 안정성을 확인하십시오.
- 졸레틸 혼합물(졸레틸 5mL[틸레타민 25mg/mL 및 졸라제팜 25mg/mL], 자일라진 6.25mL(20mg/mL) 및 부토르판올 2.5mL(10mg/mL))를 사용하여 동물을 진정시킵니다.
- 두개골 창에 접근하기
참고: 2.2.1-2.2.3단계는 1.1.2.1-1.1.2.3단계와 유사합니다.- 2.1.5단계에서 표시한 대로 정중선에서 약간 옆쪽에 메스로 진피를 처음 절개합니다. 소작기로 피부를 절개하십시오.
참고: 말기 실험의 경우 원래 절개 부위와 동일한 위치에서 절개를 할 수 있습니다. - 견인기를 놓고 겸자를 사용하여 피부를 잡고 골막과 피하 사이의 무혈관 결합 조직을 절단하여(그림 3B) 피부에 더 많은 유연성을 제공하고 1.4단계에서 봉합을 용이하게 합니다. 얻은 유연성에 맞게 견인기를 조정하십시오.
참고: 터미널 실험인 경우 이 단계를 생략할 수 있습니다. - 골막을 절개하고 골막용 엘리베이터를 사용하여 두개골에서 풀어줍니다. 견인기를 사용하여 골막을 옆으로 잡습니다.
- 두개골 창 캡을 제거하고 경막에 도달할 때까지 면봉으로 부드러운 원을 그리며 움직여 개구부에서 연결 장치를 제거합니다.
- 2.1.5단계에서 표시한 대로 정중선에서 약간 옆쪽에 메스로 진피를 처음 절개합니다. 소작기로 피부를 절개하십시오.
- 주변 와이어 주입
- 1.2단계를 반복합니다.
- 대뇌피질 신호 기록
- 1.3단계를 반복합니다.
- 임플란트 부위 폐쇄
- 1.4단계를 반복합니다.
참고: 터미널 실험인 경우 이 단계를 생략할 수 있습니다.
- 1.4단계를 반복합니다.
3. 말기 수술 (3상)
참고: 2-4주 후, 두개골 창을 열어 S1의 피질 신호에 대한 후속 기록을 수행합니다. 위에서 설명한 대로 2.2-2.5단계를 반복한 다음 3.1단계를 반복합니다.
- 안락사
참고: 귀 정맥 카테터의 튜브는 바르비투르산염의 산화를 방지하기 위해 식염수로 세척해야 합니다.- 귓잎 카테터를 식염수로 세척합니다.
- 펜토바르비탈(10mL, 400mg/mL)을 과다 투여한 주사기를 부착하고 귓정맥 카테터를 통해 펜토바르비탈을 주입합니다.
결과
두개골 창 기술을 사용하여 16 마리의 동물에서 43 개의 세션에서 피질 신호를 기록했습니다. 동물은 수술 후 적절하게 치유되었으며 연구 전반에 걸쳐 쌍을 이루고 보충 표 S1의 복지 계획을 사용하여 매일 모니터링되었습니다. 모든 동물은 항상 0점을 받았으며 이는 우수한 복지를 나타냅니다. 그림 7 은 창문이 실제로 돼지 피질의 S1 영역 위에 배치되었음을 보여줍니다. 일반적으로 생체 내 및 사후 경막에서 약간의 흉터가 관찰되었지만(그림 7A), 사후 검사에서는 모든 동물에서 건강하고 반대쪽 S1 영역과 유사한 것으로 보이는 기저 피질 조직(그림 7B)에는 영향을 미치지 않는 것으로 밝혀졌습니다.
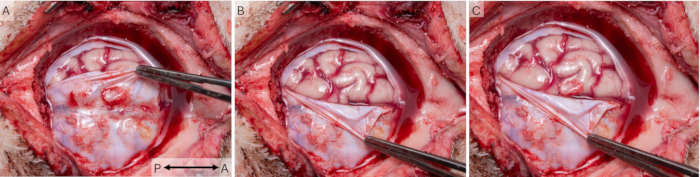
그림 7: 뇌 해부학과 관련된 피질 창의 배치. (A) S1과 관련하여 피질 조직의 건강 상태와 피질 창의 위치를 조사하기 위해 연구가 끝날 때 두개골 창을 제거했습니다. 이 경우 2주의 수술 간격이 사용되었으며 경막에서 일부 흉터 조직이 관찰될 수 있습니다. (B) 기저에 있는 뇌 조직이 건강하고 임플란트의 영향을 받지 않는 것처럼 보입니다. (C) 두 사진의 오버레이는 임플란트가 실제로 돼지 피질의 S1 영역을 덮고 있음을 보여줍니다. 화살표는 전후 축을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
간단히 말해서, 피질 신호를 분석하려면 라인 노이즈 및 기타 아티팩트를 제거하기 위해 필터링해야 합니다( 그림 8 및 표 1 참조). 노치 필터는 유럽에서 50Hz인 라인 노이즈 주파수와 그 고조파 주위에 사용됩니다. 그런 다음 신호는 고역 통과 필터링되어 오프셋 및 저주파 모션 아티팩트를 제거합니다. 최대 차단 주파수는 녹음 목적에 따라 다르지만 5Hz보다 높으면 ERP와 자발적인 EEG 기능이 모두 약화되므로 권장하지 않습니다. 또한 저역 통과 필터를 사용하여 고주파 노이즈를 제거합니다. 전극이 경막의 상부에 배치되기 때문에, 고주파는 뇌와 전극 사이의 조직에 의해 약간 감쇠된다18. 따라서 차단 주파수는 전극이 뇌 조직에 직접 위치할 때보다 낮을 수 있습니다.
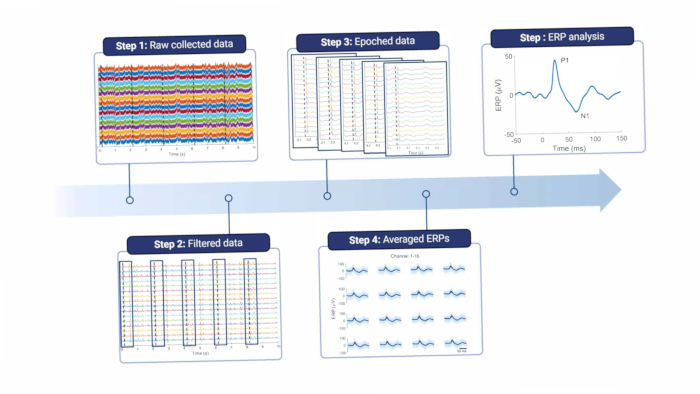
그림 8: 데이터 처리 파이프라인. 수집된 원시 데이터(1단계)는 필터링(2단계)을 통해 처리됩니다. 그런 다음 자극 트리거(3단계)를 기반으로 에포크로 나뉘며, 이는 평균화됩니다(4단계). 평균 ERP는 데이터 분석에 사용됩니다(5단계). 약어: ERPs = event-related potentials. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 필터 유형 | 일반적인 컷오프 | 일반적인 주문 | 중고 컷오프 | 중고 주문 |
| 노치 | 50±3 Hz 또는 60±3 Hz | 높은 순서 | 50±3 Hz 및 | 10번째 주문 |
| 및 고조파 | 고조파 ±1 Hz | |||
| 하이패스 | 0.1-5 Hz에서 | 낮은 순서 | 1-5 Hz에서 | 2차 주문 |
| 저역 통과 | 100-1000 Hz에서 | 낮은 순서 | 300 Hz에서 | 2차 주문 |
표 1: 피질파질검사 또는 뇌파검사 전극으로 기록된 표면 뇌 신호 분석을 위한 일반적인 필터 속성.
필터링된 데이터는 자극 전 50-100ms와 입력 후 500-1,000ms의 에포크로 나뉩니다. 노이즈가 있는 채널은 데이터에서 제거되고(그림 9A), 아티팩트로 오염된 epoch는 제거됩니다(그림 9B). 아티팩트가 없는 나머지 epoch는 각 채널에 대해 평균을 구합니다. 유발된 반응은 종종 단일 스윕으로 구별될 수 있습니다. 이는 10개 이상의 응답이 평균화될 때 더 명확하고 일관성이 있으며 25개 이상의 응답이 평균화될 때 변경되지 않습니다. 신뢰할 수 있는 평균을 얻으려면 아티팩트가 없는 Epoch가 20개 이상 있어야 합니다. 이는 일반적으로 해당되며 데이터 세트의 절반 이상에서는 Epoch를 제거할 필요가 없었습니다. 여러 단계(이식, 접근, 안락사 수술) 동안 기록된 ERP 간의 비교를 용이하게 하기 위해 데이터는 일반적으로 마취 깊이와 배경 활동의 차이를 설명하기 위해 z-점수로 정규화됩니다.
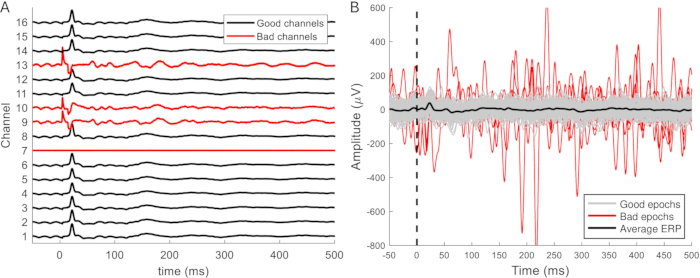
그림 9: 불량 채널 및 에포크의 예. (A) 뇌의 비교적 작은 영역에 걸친 경막외 기록의 신호는 특성은 비슷하지만 진폭이 다르다. 오작동하는 채널은 ERP 파형이 없다는 점에서 쉽게 구별할 수 있습니다. 또한 채널은 아티팩트, 더 잡음이 있는 모양 및 더 큰 신호 진폭(채널 9, 10 및 13)을 나타낼 수 있습니다. 채널 7은 오작동하는 채널의 또 다른 예이며 신호나 노이즈를 포착하지 않습니다. (B) 예상되는 ERP 진폭은 최대 약 100μV입니다. 잡음이 있는 에포크는 일반적으로 진폭이 더 크므로 평균 ERP 파형에 영향을 미칠 수 있으므로 제거해야 합니다. 일반적인 ERP 파형은 이와 다르지만 이 파형이 단일 Epoch에서 항상 구별할 수 있는 것은 아닙니다. 약어: ERP = event-related potential. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
두개골 창 기법을 사용하여 기록된 ERP의 신뢰성은 피크 진폭과 대기 시간 측면에서 높았다19. 반복 측정 분산 분석(RM-ANOVA)에서 피크 진폭(기록 1: 17.9 ± 7.26 μV, 기록 2: 17.6 ± 10.1 μV, 기록 3: 14.0 ± 6.95 μV) 및 채널 간 분산(기록 1: 6.47 ± 8.36 μV, 기록 2: 3.93 ± 6.13 μV, 기록 3: 3.84 ± 3.71 μV)에 대해서는 유의미한 차이가 발견되지 않았습니다. 첫 번째 녹음과 후속 녹음 사이의 최대 대기 시간에서 상당한 차이가 발견되었습니다. 피크는 후속 기록(기록 1: 25.2 ± 2.0ms; 기록 2: 24.0 ± 2.4ms, 기록 3: 24.1 ± 2.0 ms)에 비해 첫 번째 기록에서 1ms 늦었는데, 이는 신경계20,21의 발달과 관련이 있을 수 있으며, 이는 본 연구에서 청소년 재래종 돼지를 사용했기 때문이다.
ERP에 대한 고주파 자극(HFS)의 효과를 조사하기 위해 두개골 창 기술이 추가로 사용되었습니다. HFS는 설치류에서 표재성 등쪽 뿔 뉴런의 장기 강화를 유발합니다22,23, 통증 민감도 증가, 인간의 유발 뇌 반응 증가24,25. 이벤트 관련 전위의 N1 피크의 진폭이 크게 증가했으며(개입 전 기준선에 비해 259 ± 107% 증가), HFS와 동일한 동물에 HFS를 적용하지 않은 실험 간에 명확한 차이를 구별할 수 있었습니다(그림 10)17.
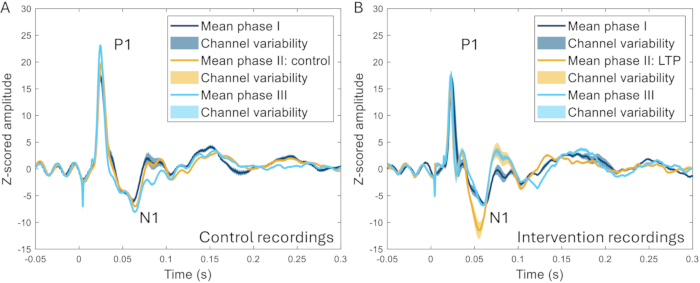
그림 10: 통증 모델 도입 2-3주 전, 도중, 2-3주 후에 기록된 모든 채널에서 평균화된 ERP의 예. (A) 2주 간격으로 3개의 서로 다른 기록을 통해 동일한 동물에서 수집된 ERP는 매우 유사한 특성을 보여줍니다. (B) ERP는 기록 간에 유사한 특성을 갖지만 N1은 2상 전후 3-4주 전후의 다른 단계에 비해 2단계에서 장기 강화를 유도한 후 더 큰 진폭을 갖습니다. 음영 처리된 영역은 채널 전체의 표준 편차를 나타냅니다. 약어: ERP = 이벤트 관련 전위; LTP = 장기 강화. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 표 S1: 돼지의 고독하고 사회적인 행동에 점수를 매기기 위한 복지 계획. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 기술 개발의 중요성은 전극 고장 모드를 제거하고 조직 반응을 줄이며 이에 따라 침습적 피질 기록 기술의 신뢰성을 향상시키는 데 있습니다. 연구 중에는 전극 파괴 모드가 발생하지 않았으며, 16마리의 동물과 43개의 기록 세션을 포함하여 연구 전반에 걸쳐 총 2개의 ECoG 어레이가 사용되었습니다. 이는 연구 경제에 추가적인 긍정적인 영향을 미칩니다. 기존의 완전 주입 방법(12,26,27)을 사용하여, 장치 고장이 발생하지 않는다는 가정 하에 최소 16개의 ECoG 어레이가 필요할 것입니다. 그러나 고장 모드와 조직 반응은 두개내 뇌 기록 11,12,13,28,29의 광범위한 구현에 계속해서 상당한 도전을 제기하고 있습니다. 이 연구는 전극의 수를 크게 줄여 만성 신경 과학 연구의 비용과 위험을 동시에 줄였습니다.
두개골 창 임플란트에서 발생한 유일한 부작용은 초기 수술에서 가끔 발생하는 감염입니다. 이러한 감염은 항상 피상적이었으며(경막 수준에 도달하지 못함) Genta-coll 재흡수성 항생제 스펀지를 이식하여 해결되었습니다. 이 치료법의 효과로 인해, 항생제 스펀지의 이식은 예방 조치로 두개골 창 이식의 일부로 채택되었습니다. 돼지는 발근 행동을 하는 강한 동물임에도 불구하고 표준 PLA로 만든 임플란트는 하나도 부러지지 않았습니다.
이식된 모든 전극은 이물질 반응 및 신경교세포 또는 섬유질 캡슐화 14,15,28,29,30의 영향을 받습니다. 이는 전극-조직 계면과 전극의 기록 능력이 이식 후 시간이 지남에 따라 변한다는 것을 의미합니다 13,18,28. 현재 방법을 사용하면 조직 반응이 임시 전극 배치 전략으로 인해 전극의 무결성 및 기록 충실도에 영향을 미치지 않았습니다. 전극은 각 세션 동안 경막에 배치되었으며, 따라서 전극-조직 인터페이스는 각 세션 동안 비슷했습니다. 세션마다 약간 다를 수 있는 유일한 요인은 전극 위치입니다. 따라서 창 크기를 전극 크기와 일치시키고 각 녹음 세션 중에 전극 배치 사진을 찍는 것이 중요합니다. 이러한 노력으로 신뢰성과 재현성이 높은 ERP가 기록되었습니다19.
두개골 창 임플란트에 대한 조직 반응이 발생했으며, 두개골의 외부 표면에서 경막까지 확장되는 벽이 없는 경두개 창을 사용하는 초기 파일럿에서 뼈 재생이 관찰되었습니다. 첫 번째 세션 후 2주 후에 연속적인 연골 조직층이 발견되었는데, 이는 뼈의 재성장을 나타냅니다. 이 조직을 제거하고 경막에 접근하는 것은 불가능했습니다. 그러므로, 두개골 표면에서 dura31 까지 뻗어 있는 수직 벽이 두개골 창에 추가되었다. 피질에 가해지는 압력을 피하기 위해 임플란트와 두개골 두께가 일치하도록 벽 길이가 다른 창문을 인쇄했습니다. 안락사 후 동물을 조사한 결과, 모든 동물에서 건강해 보이는 뇌 조직이 발견되었습니다. 연조직은 여전히 창 영역 내에 형성됩니다. 그러나 벽에 부착되지 않고 두개골과 연속적이지 않기 때문에 면봉을 사용하여 쉽게 제거 할 수 있습니다. 기록의 신뢰성을 위해 이 연조직을 창에서 제거하여 전극이 매번 경막에 배치되도록 하는 것이 중요합니다.
수술 최소 3주 간격으로 최적의 결과를 얻을 수 있습니다. 2주가 되면 두개골 창은 접근할 수 있지만 창 영역의 연조직은 경막에 부착됩니다. 또한 상처의 개폐는 출혈과 조직의 유연성 부족으로 인해 복잡합니다. 3주와 4주가 되면 절개 상처가 충분히 치유되어 정상 조직 경계(예: 골막, 피부, 경막)가 뚜렷하게 구분되어 창에서 연조직을 쉽게 제거하고 임플란트 위의 피부를 다시 닫을 수 있습니다. 4주 간격으로 뼈와 같은 조직이 관찰되지 않았기 때문에 수술과 다중 접근 수술 사이에 4주 이상이 가능할 수 있습니다. 수술 간격을 수개월까지 연장할 수 있는지에 대해서는 조사하지 않았다.
임플란트 및 접근 수술의 성공을 위해서는 초기 절개 및 상처 봉합이 중요합니다. 돼지 이마 피부의 유연성은 매우 제한적이기 때문에 피부의 무혈관 피하층을 느슨하게 하는 것이 필수적입니다. 이렇게 하면 보형물 위의 피부를 닫을 수 있는 추가적인 유연성을 제공하고 봉합사에 가해지는 스트레스를 줄일 수 있습니다. 이 스트레스는 두 겹의 봉합사와 추가 피부 접착제를 사용하여 더욱 줄일 수 있습니다. 동물이 상처를 긁고 봉합사를 조기에 제거하는 것을 방지하기 위해 지속적인 피내 봉합 기술을 사용하여 피부를 봉합합니다. 상처 개방 및 폐쇄 전략은 임플란트 또는 접근 수술 등 두 가지 유형의 생존 수술 모두에서 매우 중요합니다.
현재 접근 방식의 한계는 창에 접근하려면 가벼운 수술이 필요하기 때문에 깨어 있는 동물의 녹음을 할 수 없다는 것입니다. 즉, 연구 질문에 따라 모든 연구에 적합한 접근 방식이 아닐 수 있습니다. 완전히 이식된 장치가 깨어 있는 기록에 사용되기 위해서는, 계면(32)에서 생물학적 변화를 극복하기 위한 다른 방법들이 존재한다. 두개골 창에 접근하는 것은 작은 절차이기 때문에 전신 마취보다는 국소 마취제와 진정제를 사용하는 것이 가능할 수 있습니다. 두개골 창이 완전히 피부 아래에 있다는 장점은 동물이 쌍 또는 그룹 수용 될 수 있기 때문에 감염 가능성이 줄어들고 동물 복지가 향상된다는 것입니다. 또한, 우리는 유발된 반응19의 신뢰성만을 조사했다. 그러나 자발적인 뇌 활동이 기록되어 있으며 일반적으로 ERP8보다 신뢰성과 재현성이 높으며, 이는 이 방법이 ERP의 기록에 국한되지 않음을 나타냅니다.
우리의 방법은 만성 피질 기록을 위한 새롭고 확장 가능하며 신뢰할 수 있고 재현 가능한 방법을 제시합니다. 이 방법은 신뢰성과 재현성이 연구 결과에 필수적인 신경 과학 연구 연구에 매우 유용합니다33,34. 우리는 이 방법을 사용하여 다양한 통증 모델 및 대조군의 유도 전후에 S1의 피질 유발 반응을 조사한 결과 강력한 결과를 보여주었다17. 일반적으로 이 방법은 예를 들어 움직임, 청력 또는 시력을 조사하기 위해 다른 피질 영역에 접근하도록 쉽게 조정할 수 있습니다. 또한 간질의 진단을 위해 이 방법을 사용할 수도 있고4,35 뇌 손상 후 치료와 재활을 모니터링하는 것도 가능할 수 있다36,37.
이 방법은 또한 인간이 아닌 영장류나 다른 포유류, 고양이, 개 또는 양과 같은 다른 종으로 확장할 수 있습니다 35,38,39. 이러한 각 적응에는 수술 기법을 조정하고, 두개골 창 배치를 위한 신뢰할 수 있는 랜드마크를 식별하고, 디자인을 조정해야 합니다. 저자는 파일럿 테스트를 진행하기 전에 두개골 창 기술을 최적화하기 위해 시체를 사용할 것을 권장합니다. 특정 뇌 영역의 경우 수술이 더 침습적일 수 있으며, 이로 인해 권장 사항과 다른 최적의 회복 시간이 발생할 수 있습니다. 또한, 이 기술은 경막하 ECoG 기록 및 피질내 기록을 가능하게 하도록 조정될 수 있으며, 이에 따라 응용 프로그램을 확대하고 다양한 뇌 영역에 대한 접근성을 높일 수 있습니다. 돼지 두개골의 두께로 인해, 경막하 기록을 위한 공막절개술을 수행하기 위해 피질창의 크기를 증가시킬 필요가 있을 수 있다26,27.
피질내 기록의 경우, 캐뉼라 또는 셔틀(40)을 통해 전극을 배치하는 것이 가능하며, 이는 피질창의 크기를 더 감소시킬 수 있다. 경막하 및 두개내 기술 모두 출혈의 위험을 증가시키므로 수술 중에는 혈관을 피하기 위해 주의를 기울여야 합니다. 두개골 창 기술은 뇌의 전기 신호를 기록하는 것 이외의 목적, 예를 들어 편두통의 돼지 모델과 매우 관련이 있는 혈관 구조의 이미징과 같은 목적으로 사용될 수도 있습니다41. 더욱이, 두개골 창 방법은 2-광자 이미징과 같은 새로운 이미징 기술(31)과 조합하여 사용하도록 조정될 수 있으며, 향상된 광학 해상도(42)를 위해 Costine-Bartell 등이 개발한 경막 대체물과 결합될 수 있습니다.
결론적으로, 제시된 방법론적 접근법은 장치 고장의 위험을 제거하고, 전극 부위에서의 생물학적 반응을 최소화하며, 이에 따라 기록 충실도를 높이고 매우 신뢰할 수 있는 피질 기록을 생성함으로써 영구 임플란트12,13과 관련된 위험을 감소시킵니다. 이 방법론은 또한 다른 종 및 기록 유형으로 확장 가능하기 때문에 다른 응용 프로그램에도 큰 가능성을 가지고 있습니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
저자는 올보르 대학 병원의 실험실 동물 시설의 동물 관리인과 기술자에게 감사를 표하고 싶습니다. 신경가소성 및 통증 센터(CNAP)는 덴마크 국립연구재단(DNRF121)의 지원을 받고 있습니다. 그림 6 과 그림 8 은 BioRender에서 제작되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Cranial window implantation | |||
| Scalpel | disposable, blade 10 | ||
| Tweezers | |||
| Gauze | |||
| Cauterizer | |||
| Periosteum elevator | flat, 10 mm width | ||
| Weitlaner retractor | 3 x 4 prong, blunt, 16.5 cm | ||
| Midas Rex Legend EHS stylus surgical drill system | Medtronic Powered Surgical Solutions, Fort Worth, USA | ||
| Legend Ball Fine drill bits | Medtronic Powered Surgical Solutions, Fort Worth, USA | 7BA40F-MN and 7BA60F-MN | MedNext type 4 and 6 mm head diameter |
| Sterile cover for the drill | |||
| Syringe | 5 mL | ||
| Saline | |||
| Suction | |||
| Ruler | |||
| Cotton buds | |||
| Rongeur | straight jaw, 15 cm, 3 x 20 mm bit size | ||
| 2.5 mm hand drill and handle | |||
| Butterfly infusion set | |||
| Six M3 screws in 6-14 mm length | |||
| Screwdriver | |||
| Three sizes of 3D-printed cranial window (4-, 5- and 6-mm depth) and cap | |||
| Deisolated U-shaped connector | |||
| Crocodile connector | |||
| Genta-coll resorbable antibiotic sponge | |||
| VYCRIL resorbable suture | Ethicon | 2-0 26 mm round bodied | |
| Monocryl non-resorbable suture | Ethicon | 3-0 24 mm reverse cutting | |
| Needle holder | |||
| Scissors | |||
| Topical adhesive tissue glue | Leukosan | ||
| Peripheral wire implantation | |||
| Two partially uninsulated Cooner wires | |||
| NOTE: 1-2 cm of the wires is uninsulated in the middle and at one of the ends | |||
| Two 23 G needles | |||
| Gauze | |||
| Programmable stimulator controlled by a PC running MC_stimulus | Multichannel Systems, Reutlingen, Germany | STG4008 | |
| Two crocodile connectors | |||
| Cortical recordings | |||
| Metal plate for the magnetic micromanipulator | |||
| Magnetic micromanipulator stand | |||
| Micromanipulator | |||
| Headstage holder | |||
| 32-channel ZIF-clip headstage | TDT, Alachua, FL, USA | ||
| 32-channel micro-electrocorticography (µECoG) array | Neuronexus, Ann Arbor, USA | E32-1000-30-200 | |
| TDT recording equipment including pre-amplifier SI8, data processor RZ2 and workstation WS8 | TDT, Alachua, FL, USA |
참고문헌
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유