Method Article
Chronische Schädelfenstertechnik für wiederholte kortikale Aufzeichnungen während der Anästhesie bei Schweinen
In diesem Artikel
Zusammenfassung
Diese Studie stellt eine skalierbare, zuverlässige und reproduzierbare Methode für wiederholte chronische kortikale Aufzeichnungen in einem Schweinemodell vor. Die Methode findet Anwendung in verschiedenen Bereichen der Neurowissenschaften, unter anderem in der Schmerzforschung und in der neurologischen Diagnostik.
Zusammenfassung
Kortikale Aufzeichnungen sind für die Extraktion neuronaler Signale für verschiedene Anwendungen, einschließlich Gehirn-Computer-Schnittstellen und Krankheitsdiagnose, unerlässlich. Jede Anwendung stellt spezifische Anforderungen an die Aufnahmetechnik, und für Langzeitaufnahmen werden oft invasive Lösungen gewählt. Invasive Aufzeichnungsmethoden werden jedoch durch Geräteversagen und unerwünschte Gewebereaktionen herausgefordert, die die langfristige Signalqualität beeinträchtigen.
Um die Zuverlässigkeit und Qualität chronischer kortikaler Aufzeichnungen zu verbessern und gleichzeitig die Risiken im Zusammenhang mit Geräteversagen und Gewebereaktionen zu minimieren, haben wir eine kraniale Fenstertechnik entwickelt. In diesem Protokoll berichten wir über Methoden zur Implantation und zum Zugang zu einem Schädelfenster bei juvenilen Landrasseschweinen, das die temporäre Elektrokortikographie (ECoG)-Array-Platzierung an der Dura mater erleichtert. Wir beschreiben weiterhin, wie kortikale Signale mit der Cranial-Window-Technik aufgezeichnet werden können. Der Zugang zum Schädelfenster kann mehrmals wiederholt werden, aber es wird empfohlen, mindestens 2 Wochen zwischen Implantat- und Zugangsoperationen zu liegen, um die Genesung und Gewebeheilung zu erleichtern.
Der kraniale Fensteransatz minimierte erfolgreich die üblichen Elektrodenversagensmodi und Gewebereaktionen, was zu stabilen und zuverlässigen kortikalen Aufzeichnungen über die Zeit führte. Als Beispiel haben wir ereigniskorrelierte Potentiale (ERPs) aus dem primären somatosensorischen Kortex erfasst. Die Methode lieferte sehr zuverlässige Aufzeichnungen, die es auch erlaubten, die Wirkung einer Intervention (hochfrequente Stimulation) auf die ERPs zu beurteilen. Das Fehlen signifikanter Geräteausfälle und die reduzierte Anzahl der verwendeten Elektroden (zwei Elektroden, 43 Aufnahmesitzungen, 16 Tiere) deuten auf eine verbesserte Forschungsökonomie hin. Während für die Elektrodenplatzierung ein kleinerer chirurgischer Zugang erforderlich ist, bietet die Methode Vorteile wie ein geringeres Infektionsrisiko und ein verbessertes Tierwohl.
Diese Studie stellt eine skalierbare, zuverlässige und reproduzierbare Methode für chronische kortikale Aufzeichnungen vor, mit potenziellen Anwendungen in verschiedenen Bereichen der Neurowissenschaften, einschließlich der Schmerzforschung und der neurologischen Krankheitsdiagnose. Zukünftige Anpassungen könnten seine Verwendung auf andere Spezies und Aufzeichnungsmodalitäten ausweiten, wie z. B. intrakortikale Aufzeichnungen und bildgebende Verfahren.
Einleitung
Im Allgemeinen besteht der Zweck kortikaler Aufzeichnungen darin, Informationen aus neuronalen Signalen im Gehirn zu extrahieren. Diese Informationen können auf verschiedene Weise verwendet werden: Steuerung eines externen Geräts, Kommunikation, Krankheitsdiagnose oder Rehabilitation 1,2,3,4. Jede Anwendung stellt einzigartige Anforderungen an den erforderlichen Informationsgehalt und die räumliche Auflösung sowie an den Grad der Invasivität, der als akzeptabel angesehen wird. Daher wurden seit der Entdeckung des Elektroenzephalogramms im Jahr 1929 Aufzeichnungslösungen mit einer Reihe von Invasivitäten und räumlicher Auflösung entwickelt5.
Im Allgemeinen lassen sich diese in Elektroenzephalographie (EEG), Elektrokortikographie (ECoG) und intrakortikale Aufzeichnungen unterteilen. Das EEG ist eine nicht-invasive Aufzeichnungsmethode, die neuronale Schwingungen und ereigniskorrelierte Potentiale (ERPs) aus dem gesamten Gehirn erfasst. Seine Fähigkeit, die Quellen dieser Aktivität zu definieren, ist jedoch aufgrund seiner geringen räumlichen Auflösung begrenzt. ECoG ist eine invasivere Methode, bei der Elektroden epi- oder subdural platziert werden und typischerweise einen kleineren Teil des Kortex abdecken. Es hat eine höhere räumliche Auflösung und kann ERP und lokale Feldpotentiale (LFP) aufzeichnen. Daher kann es die Quelle der Gehirnaktivität genauer lokalisieren, was es zum Beispiel hilfreich macht, um den Ursprung der fokalen Epilepsie zu identifizieren. Die intrakortikale Aufzeichnung ist die invasivste Aufzeichnungsmethode und kann die Spike-Aktivität einzelner Neuronen aufzeichnen, die sich oberflächlich oder tief im Gehirn befinden, und LFP aus dem Volumen der Neuronen um die Elektroden herum. Diese Signale haben eine sehr hohe räumliche Auflösung und einen sehr hohen Informationsgehalt, werden aber von einer begrenzten Untergruppe von Neuronen (1-10 Neuronen pro Kanal) produziert6.
Um Informationen aus dem Gehirn über längere Zeiträume (Monate-Jahre) zu extrahieren, muss die Schnittstelle stabil und zuverlässig sein, damit die erfassten Signale während des gesamten Zeitraums weiterhin die gleichen Informationen repräsentieren. EEG-Aufzeichnungen erfordern häufige Elektrodenwechsel, wodurch ihre Zuverlässigkeit von sehr niedrig bis sehr hoch variiert 7,8,9,10. ECoG und intrakortikale Methoden werden daher oft für längere Aufzeichnungen gewählt. Beide Methoden setzen jedoch voraus, dass sowohl der Zustand der Aufzeichnungselektrode als auch des Gewebes über die Zeit stabil bleibt. Während die Elektrode in der Regel an der gleichen Stelle verbleibt, kann sich die Elektroden-Gewebe-Grenzfläche aufgrund von Gewebereaktionen oder Elektrodenausfallmodiändern 11,12,13,14. Zu den Gewebereaktionen gehören neuronaler Tod, Blutungen, Biofouling, Fremdkörperreaktionen, Gliose, Verkapselung, Infektionen, Meningitis und meningeale Extrusion15. Diese Reaktionen beeinträchtigen die Aufzeichnungsfähigkeit der Elektroden12, 13. Häufige Elektrodenausfallarten sind Delamination oder Leckage an den isolierten Teilen, Delamination oder Rissbildung der Elektrodenoberflächenbeschichtung, Drahtbeschädigung und Elektrodenversetzung11,12.
Um Elektrodenausfallmodi zu überwinden, haben wir die Machbarkeit einer temporären Elektrodenplatzierungslösung in Betracht gezogen, die auch viele der Herausforderungen im Zusammenhang mit Gewebereaktionen adressiert, nämlich neuronaler Tod, Fremdkörperreaktion, Gliose, Verkapselung und meningeale Extrusion. Darüber hinaus war eine konsistente Elektrodenplatzierung eine Voraussetzung, um zuverlässige und reproduzierbare neuronale Aufzeichnungen zu erzielen. Da die Elektrode epidural in einem Abstand von wenigen Millimetern zum Nervengewebe platziert wurde, sollte die Bewegung der Elektrode 1 mm nicht überschreiten. Das Schädelfenster wurde so dimensioniert, dass eine übermäßige Bewegung zwischen den Elektrodenplatzierungen verhindert wird. Mit der Entwicklung der Cranial-Window-Technik wollen wir die langfristige Zuverlässigkeit und Qualität des Signals verbessern und das Risiko eines Elektrodenversagens beseitigen.
Protokoll
Dieses Protokoll wurde von der dänischen Veterinär- und Lebensmittelverwaltung unter dem dänischen Ministerium für Ernährung, Landwirtschaft und Fischerei genehmigt (Protokollnummer 2020-15-0201-00514). Insgesamt wurden 16 weibliche Landrassenschweine den Eingriffen unterzogen. Die Tiere wogen bei ihrer Ankunft in der Einrichtung etwa 20 kg, was bedeutet, dass sie etwa 2 Monate alt waren. Sie wogen bei der Implantation etwa 30 kg und am Ende der Studie 40-60 kg. Die Eingriffe bestehen aus der Implantationschirurgie, der Zugangschirurgie und der terminalen Chirurgie (Abbildung 1).
Abbildung 1: Zeitleiste der experimentellen Verfahren. Die Zugangsoperation (Phase II) kann mehrmals wiederholt werden. Ein Abstand von mindestens 2 Wochen zwischen den Operationen wird empfohlen, um sich zu erholen und die Wundheilung zwischen den Operationen zu gewährleisten. Abkürzung: ERP = ereignisbezogenes Potenzial. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
1. Implantation (Phase I)
HINWEIS: Ein 3D-gedrucktes Schädelfenster aus Polymilchsäure (PLA) (Abbildung 2) wird implantiert, um wiederholte Aufzeichnungen aus dem primären somatosensorischen Kortex des Schweins zu ermöglichen. Es werden ERPs durch elektrische Stimulation des Nervus ulnaris aufgezeichnet. Die Operation und der Wundverschluss werden so durchgeführt, dass das Schädelfenster zugänglich ist und anschließend geschlossen werden kann.

Abbildung 2: Gestaltung des Schädelfensters. (A) Seitenansicht des Schädelfensters mit der Höhe der Wände und der Basis, die am Schädel befestigt ist. (B) Draufsicht mit Angabe des Durchmessers der Schädelwitwe, der Schraubenlöcher, des Verschlussraums und des Fensters. Die Schädelfensterkappe ist ein Zylinder mit einem Durchmesser von 22 mm und einer Höhe von 1 mm, der genau in den Verschlussraum passt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Implantation eines Schädelfensters
- Vorbereitung auf die Operation
HINWEIS: Der Datenprozessor (RZ2), die Workstation (WS8) und der PC werden eingeschaltet, bevor die Operation gestartet wird. Chirurgische Notizen werden mindestens alle 15 Minuten von einem unsterilen Forscher in einer Tabelle erstellt, um die Vitalparameter (Herzfrequenz, spO2, endtidales CO2, Kerntemperatur), die Anästhesiewerte (Propofol-Infusionsrate, Fentanyl-Infusionsrate, Sevofluran-Prozentsatz), das Stadium der Operation und etwaige Unregelmäßigkeiten zu dokumentieren.- Betäuben Sie das Tier mit einer intramuskulären Injektion von 5-7 ml Zoletil-Mischung (1 ml enthielt 8,3 mg Tiletamin, 8,3 mg Zolazepam, 8,3 mg Xylacin und 1,7 mg Butophanol).
HINWEIS: Für diese spezielle Studie wurde Ketamin in der Zoletil-Mischung weggelassen, um eine Blockierung der NMDA-Rezeptoren zu vermeiden. - Transportieren Sie das Tier in den Operationssaal. Intubieren Sie das Tier und schließen Sie es an ein mechanisches Beatmungsgerät an.
- Legen Sie einen Ohrvenenkatheter an, um Propofol, Fentanyl und Kochsalzlösung zu verabreichen.
- Chirurgische Anästhesie verabreichen: Sevofluran 1-2%, Propofol (10 mg/ml, infundiert mit 8 mg∙kg-1∙h-1), Fentanyl (50 μg/ml, infundiert mit 20 μg∙kg-1∙h-1).
- Markieren Sie die Inzisionsstelle mit einem sterilen Marker, bevor Sie sie steril drapieren. Identifizieren Sie den Bregmapunkt, indem Sie gerade Linien zwischen jedem Ohr und dem kontralateralen Auge zeichnen; Der Bregma-Punkt befindet sich am Schnittpunkt dieser Linien (Abbildung 3A). Achten Sie darauf, dass der Schnitt leicht lateral zur Mittellinie auf der Seite kontralateral zur stimulierten Vordergliedmaße erfolgt.
- Legen Sie die Metallplatte unter die Vorhänge und stellen Sie sicher, dass sie richtig platziert und stabil ist, bevor Sie mit der Operation beginnen.
- Betäuben Sie das Tier mit einer intramuskulären Injektion von 5-7 ml Zoletil-Mischung (1 ml enthielt 8,3 mg Tiletamin, 8,3 mg Zolazepam, 8,3 mg Xylacin und 1,7 mg Butophanol).
- Zugang zum Schädel
HINWEIS: In diesem und den folgenden Teilen des Protokolls werden alle Eingriffe von einem sterilen Chirurgen durchgeführt, sofern nicht anders angegeben.- Den ersten Schnitt in der Dermis mit einem Skalpell leicht seitlich der Mittellinie vornehmen, wie in Schritt 1.1.1.5 markiert. Setzen Sie den Schnitt durch die Haut mit einem Kauterisator fort.
HINWEIS: Verlängern Sie den Schnitt nicht zu weit nach vorne, um die großen Stirnhöhlen des Schweins zu vermeiden. Wenn mehr Platz benötigt wird, verlängern Sie den Schnitt auf der hinteren Seite. - Platzieren Sie den Retraktor und halten Sie die Haut mit einer Pinzette hoch und schneiden Sie das avaskuläre Bindegewebe zwischen dem Periost und der Unterhaut (Abbildung 3B), um der Haut mehr Flexibilität zu verleihen und das Nähen in Schritt 1.4 zu erleichtern. Stellen Sie den Retraktor auf die gewonnene Flexibilität ein.
- Schnitte das Periost und löse es mit einem Periostheber vom Schädel. Halten Sie das Periost mit dem Retraktor zur Seite.
- Den ersten Schnitt in der Dermis mit einem Skalpell leicht seitlich der Mittellinie vornehmen, wie in Schritt 1.1.1.5 markiert. Setzen Sie den Schnitt durch die Haut mit einem Kauterisator fort.
- Zugang zur Dura
- Bohren Sie ein Loch mit einem Durchmesser von 10 mm frontal zur sagittalen Nahtlinie und lateral zur Mittelliniennaht (Abbildung 3C). Beginnen Sie mit einem Durchmesser von 15 mm, um ein Loch mit einem Durchmesser von 10 mm auf Dura-Ebene zu erhalten, da der abgerundete Bohrer ein leicht konisches Loch ergibt.
- Passen Sie das Schädelfenster frühzeitig an das Loch an, um einen guten Sitz zu gewährleisten.
- Wechseln Sie zu einem kleineren Bohrer, wenn die Dura sichtbar wird, um die maximale Breite des Lochs auf Dura-Ebene zu erreichen. Schneiden Sie die Kanten mit Rongeuren ab.
- Implantation eines Schädelfensters
- Vergewissern Sie sich, dass das Schädelfenster in und bis zum Boden des Lochs passt, und bestimmen Sie seine Tiefe. Obwohl dies tierabhängig ist, stellen Sie sicher, dass die Wände des Schädelfensters für einen guten Sitz bis zur Dura reichen, aber an keiner Stelle Druck auf das Gehirn ausüben.
- Markieren Sie die Schraubenlöcher mit der Handbohrmaschine, während Sie das Schädelfenster festhalten.
- Entfernen Sie das Schädelfenster und bohren Sie die Löcher mindestens 4 mm tief. Dringen Sie in den Schädel ein, um eine der Schrauben zu finden, um sie als Masse/Referenz für die kortikalen Aufnahmen zu verwenden.
- Platzieren Sie das Schädelfenster (Abbildung 3) und entfernen Sie die Nadel aus dem Schmetterlingsinfusionsset. Messen Sie die Tiefe der Schraubenlöcher durch das Schädelfenster mit dem stumpfen Schmetterling. Setzen Sie eine Schraube mit passender Länge in das Loch ein und befestigen Sie sie.
HINWEIS: Eine zu lange Schraube kann die Schädelfensterkappe nicht effektiv befestigen. - Platzieren Sie einen U-Verbinder unter einer Schraube, die den Schädel perforiert und die Dura berührt.
HINWEIS: Es ist wichtig, dass die Länge dieser Schraube größer ist als die Dicke des Schädels, damit nachwachsender Knochen den Kontakt mit der Dura nicht verhindert.
- Vorbereitung auf die Operation
- Periphere Drahtimplantation
HINWEIS: Dieses Verfahren kann gleichzeitig mit der Implantation von Schädelfenstern durchgeführt werden. Hierbei handelt es sich um ein steriles Verfahren. Um eine Kontamination der Operationsstelle oder der Schädelstelle zu vermeiden, sollte sterile Kleidung getragen werden.- Implantation von Drähten in der Nähe des Nervus ulnaris
- Wenden Sie eine elektrische Stimulation bei 5 mA auf die Haut an, indem Sie die Haut am hinteren distalen Teil der Vordergliedmaße mit zwei Nadeln (nicht durchdringend) oder einem anderen sterilen Metallstück im Abstand von 2 cm berühren. Achten Sie auf eine deutliche Hufbeugung, die darauf hinweist, dass der Nerv zwischen diesen beiden Punkten verläuft.
HINWEIS: Es kann sein, dass der Wurfarm nach hinten gedreht werden muss, damit der hintere Teil leichter zugänglich ist. - Führen Sie die beiden Nadeln senkrecht zum Verlauf des Nervs in einem Abstand von ca. 2 cm ein. Stechen Sie die Haut etwa 3 cm vom Einstichpunkt entfernt erneut ein (Abbildung 4A).
- Überprüfen Sie die Position mit einem Teststimulus, der bei 2 mA auf die Nadeln angewendet wird. Achten Sie darauf, dass eine deutliche Bewegung des Hufes sichtbar ist.
- Führen Sie die Cooner-Drähte durch die Nadeln und entfernen Sie die Nadeln, wobei die Cooner-Drähte teilweise unter der Haut verbleiben. Stellen Sie sicher, dass sich der nicht isolierte Teil in der Mitte des Drahtes bei beiden Drähten unter der Haut befindet (Abbildung 4B).
HINWEIS: Wenn der Wurfarm nach hinten gedreht wurde, drehen Sie ihn vorsichtig nach vorne. - Befestigen Sie jeden Krokodilstecker an einem nicht isolierten Ende der beiden Cooner-Drähte.
- Wenden Sie eine elektrische Stimulation bei 5 mA auf die Haut an, indem Sie die Haut am hinteren distalen Teil der Vordergliedmaße mit zwei Nadeln (nicht durchdringend) oder einem anderen sterilen Metallstück im Abstand von 2 cm berühren. Achten Sie auf eine deutliche Hufbeugung, die darauf hinweist, dass der Nerv zwischen diesen beiden Punkten verläuft.
- Festlegen der motorischen Schwelle
- Ermitteln Sie die motorische Schwelle mit der Auf-Ab-Methode16,17; Beginnen Sie bei 100 μA, steigern Sie sich in Schritten von 50 μA, während Sie auf ein motorisches Ansprechverhalten im Hufbereich achten und fühlen. Ein Schwellenwert unter 1 mA ist in der Regel machbar.
- Programmieren Sie das STG so, dass es 100 rechteckige biphasische symmetrische Stimuli mit einer Pulsbreite von 200 μs bei der 2-fachen der motorischen Schwelle liefert, gefolgt von 100 Stimuli bei der 10-fachen der motorischen Schwelle.
- Implantation von Drähten in der Nähe des Nervus ulnaris
- Aufzeichnung kortikaler Signale
- Lassen Sie den Vorverstärker von einem unsterilen Forscher in Position bringen und verbinden Sie ihn über Glasfaserkabel mit dem Datenprozessor (RZ2).
- Verringern Sie Sevofluran auf 0,5-1 % (die Hälfte des chirurgischen Niveaus) und überwachen Sie die Herzfrequenz, das ausgeatmeteCO 2 und den Blutdruck (falls verfügbar), um eine angemessene und stabile Anästhesietiefe zu gewährleisten. Erhöhen Sie sowohl Propofol als auch Fentanyl nach Bedarf.
- Lassen Sie den Kopftisch von einem unsterilen Forscher an den Vorverstärker (SI8) anschließen und setzen Sie den Kopftisch (ZIF-Clip) in die Kopftischhalterung ein, die auf dem Mikromanipulator des Magnetstativs montiert ist.
- Legen Sie das sterile Abdecktuch um den Mikromanipulator und befestigen Sie das Klebeteil am Kopftisch und an der Kopftischhalterung (Abbildung 5A).
- Lassen Sie den Mikromanipulator von einem unsterilen Forscher mit dem Magnetstativ fixieren, tauchen Sie die μECoG-Elektrode in Alkohol und platzieren Sie sie in den Kopftisch (ZIF-Clip).
HINWEIS: Lassen Sie die Elektrode trocknen, bevor Sie sie auf die Dura legen. Achten Sie darauf, nur die sterilen Abdecktücher zu berühren, die den Kopftisch bedecken, da die μECoG-Elektrode nicht steril ist. - Bringen Sie das μECoG mit dem Mikromanipulator und der Führung mit einem Wattestäbchen an Ort und Stelle. Verbinden Sie die Erdungskabel des μECoG mit einem Krokodilstecker mit der Erdungsschraube.
- Verringern Sie Sevofluran auf 0 %, überwachen Sie die Herzfrequenz, das abgelaufeneCO 2 und den Blutdruck (falls verfügbar), um eine angemessene und stabile Anästhesietiefe zu gewährleisten, und erhöhen Sie sowohl Propofol als auch Fentanyl nach Bedarf.
- Vorschau der Signale in Synapse; Der typische Signalbereich liegt bei bis zu ±100 μV.
- Wenn das Signal wie eine fette Linie erscheint (was auf Leitungsrauschen hinweist), lassen Sie eine sterile Person die folgenden Maßnahmen ausführen: Untersuchen Sie die Erdungsschaltung und halten Sie die Erdungsschraube und die Anschlüsse trocken und von nahegelegenem Gewebe isoliert. Untersuchen Sie, ob andere Kabel vom Schweinekörper und den chirurgischen Instrumenten isoliert sind. Wenn nicht, verwenden Sie sterile Gaze, um die Verkabelung vom Körper oder von chirurgischen Instrumenten zu isolieren.
- Wenn die Amplitude des Signals größer als ±100 μV ist (was auf Bewegungsartefakte hinweist), stellen Sie sicher, dass die Elektrode aufgehängt ist und auf dem Gehirn aufliegt und dass sich die Verkabelung nicht bewegt, wenn sich das Schwein aufgrund von Beatmung oder elektrischer Stimulation des Nervus ulnaris bewegt.
- Wenn die Signalamplitude kleiner als ± 20 mV ist (was auf einen schlechten Kontakt oder eine tiefe Anästhesie hinweist), stellen Sie sicher, dass das μECoG auf dem Gehirn aufliegt und die Dura und die Elektrode hydratisiert sind. Bei Bedarf etwas Kochsalzlösung auf die Elektrode tropfen. Stellen Sie sicher, dass Sevofluran ausgeschaltet ist, und verringern Sie die Infusionsrate von Propofol (und möglicherweise Fentanyl). Führen Sie eine Teststimulation durch und prüfen Sie, ob evozierte Reaktionen sichtbar sind. Stellen Sie sicher, dass sich der nicht isolierte Teil des Peripheriekabels vollständig unter der Haut befindet.
HINWEIS: Evozierte Reaktionen können in der Regel in einzelnen Sweeps online unterschieden werden, aber es ist auch möglich, dies offline mit durchschnittlich 5-10 Stimuli auszuwerten. Wenn zum Zeitpunkt des Triggers ein Peak sichtbar ist, handelt es sich um ein Stimulationsartefakt. Das Stimulationsartefakt stört die Datenanalyse.
- Legen Sie sterile Gaze auf die Elektrode, um einen guten Gewebekontakt zu gewährleisten. Träufeln Sie Kochsalzlösung bei Körpertemperatur auf die Gaze, um ein Austrocknen des Gewebes zu verhindern.
HINWEIS: Da es sich bei diesen Aufzeichnungen um Epiduralaufnahmen handelt, ist die genaue Temperatur nicht entscheidend. Bei subduralen Aufnahmen ist dies kritischer. - Lassen Sie die Elektrode einrasten (30 Minuten) und dokumentieren Sie die Platzierung der Elektrode und die Einrichtung des Erdungsanschlusses, um ähnliche nachfolgende Aufnahmen zu gewährleisten (Abbildung 5B-D). Starten Sie die Aufnahme und warten Sie alle 10 Minuten 30 Sekunden, bevor Sie das Stimulationsprogramm starten.
HINWEIS: Überprüfen Sie regelmäßig zwischen den Aufnahmen, ob die Gaze auf der Elektrode hydratisiert bleibt, und tropfen Sie bei Bedarf Kochsalzlösung mit Körpertemperatur ab. - Führen Sie nach drei Stimulationsrunden eine Intervention durch (als Ausgangsbasis vor der Intervention). Wiederholen Sie die Stimulation für weitere neun Runden.
HINWEIS: Überprüfen Sie zwischen den Aufnahmen regelmäßig, ob die Gaze auf der Elektrode hydratisiert bleibt, und tropfen Sie bei Bedarf Kochsalzlösung ab.
- Verschluss der Implantatstelle
- Entfernen Sie die Gaze von der Elektrode und entfernen Sie die Elektrode mit dem Mikromanipulator, während Sie sie vorsichtig mit einem Wattestäbchen führen.
- Lassen Sie den Mikromanipulator, die Elektrode, den Kopftisch und den Vorverstärker von einem unsterilen Forscher entfernen und aufbewahren und reinigen Sie die Elektrode gemäß den Anweisungen des Herstellers mit einem Schnellspülen mit deionisiertem Wasser, um Gewebereste zu entfernen. Weichen Sie die Elektrode bis zu 4 Stunden lang in Linsenreiniger ein, um Gewebe und Proteine von der Elektrodenoberfläche zu entfernen, gefolgt von einem zweiten Spülen mit entionisiertem Wasser, um den Linsenreiniger von der Elektrodenoberfläche zu entfernen. Tauchen Sie die Elektrode vor der Lagerung in Isopropylalkohol.
- Platzieren Sie die Schädelfensterkappe, um das Schädelfenster zu schließen, und stellen Sie sicher, dass sie genau in das Schädelfenster passt. Es erfordert keine zusätzliche Befestigung; Der Druck der Haut auf das Implantat hält es an Ort und Stelle.
- Legen Sie den Antibiotikabeutel auf die Schädelfensterkappe und verschließen Sie die Haut subkutan mit einzelnen resorbierbaren Nähten unter Verwendung der Technik der vergrabenen vertikalen Matratzennaht (Abbildung 6A). Platzieren Sie die Nähte in einem Abstand von 5-10 mm, so dass Platz für die Platzierung der Hautnähte vorhanden ist. Binden Sie die letzten drei Nähte nicht nach dem Platzieren ab. Binden Sie stattdessen diese drei Nähte, wenn alle Nähte gelegt sind.
HINWEIS: Das Binden der letzten drei Nähte nach dem Platzieren aller drei stellt sicher, dass genügend Platz für das Platzieren der letzten Nähte vorhanden ist. - Platzieren Sie kontinuierliche intradermale Nähte kontinuierlich in der Haut. Beginnen Sie die intradermale Naht 1-2 cm lateral der Inzisionsstelle und tunneln Sie unter der Haut zur Hautschicht, aber unter deren Oberfläche (Abbildung 6B), um übermäßiges Kratzen und Lockern der Nähte zu vermeiden. Binde einen Knoten am seitlichen Ende der Naht.
HINWEIS: Propofol und Fentanyl können während dieses Vorgangs ausgeschaltet werden, da diese eine Aufwachzeit von mehreren Minuten haben. - Legen Sie die durchgehende Naht zwischen die subkutanen Nähte, bis die andere Seite des Schnitts erreicht ist.
HINWEIS: Es ist wichtig, dass die Naht in der Dermis austritt, aber nicht in die Haut sticht, damit das Tier weniger in der Lage ist, sich an den Nähten zu kratzen. - Tunneln Sie die Naht 1-2 cm lateral zum Schnitt zu einer lateralen Austrittsstelle und binden Sie einen Knoten (Abbildung 6B). Tragen Sie Gewebekleber auf die Inzisionsstelle auf.
- Rückkehr des Tieres in den Heimatstall
- Entfernen Sie die sterilen Abdeckungen vom Tier und entwöhnen Sie das Tier vom Beatmungsgerät, sobald eine Bewegung beobachtet wird.
- Bringen Sie das Tier in den Gehege und halten Sie es eine Nacht lang vom Gehege getrennt.
HINWEIS: Schweine werden nach der Operation getrennt, da es normal ist, dass sie gewaltsam versuchen, den Stallkameraden aufzuwecken, was zu Bisswunden führt. Schweine sollten in der Lage sein, Kontakt mit der Schnauze zu haben.
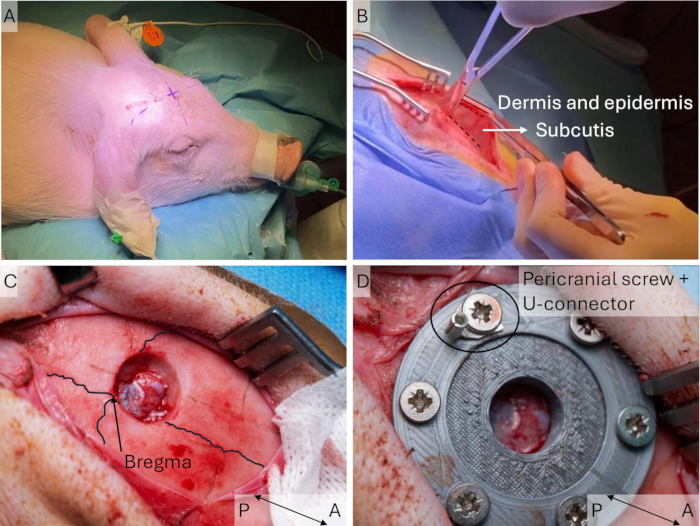
Abbildung 3: Implantation des Schädelfensters. (A) Die erwartete Position des Bregma-Punktes wird vor dem sterilen Abdecken des Schweins identifiziert und markiert, da dies im Nachhinein schwer zu unterscheiden sein kann. (B) Nach dem Hautschnitt wird die avaskuläre Unterhaut mit einer Schere gelockert. (C) Ein Loch mit einem Durchmesser von 15 mm wird in den Schädel gebohrt und die Kanten werden mit Rongeuren entfernt. Die koronalen und sagittalen Nahtlinien sind hervorgehoben. (D) Das Schädelfenster wird implantiert und mit Schrauben befestigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
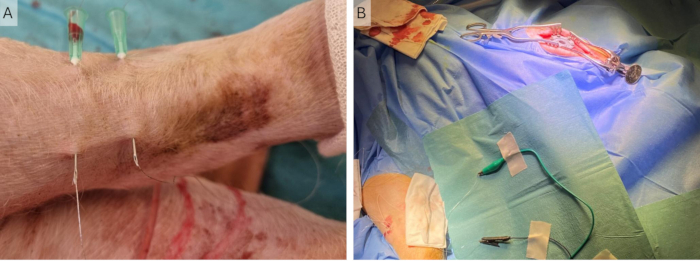
Abbildung 4: Implantation von peripheren Drähten. (A) Zwei 23-G-Nadeln werden in die Haut eingeführt und die Cooner-Drähte werden durch diese eingeführt. (B) Die Nadeln werden entfernt und die Drähte verbleiben in der Haut, die mit Krokodilklammern mit dem Stimulator verbunden sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
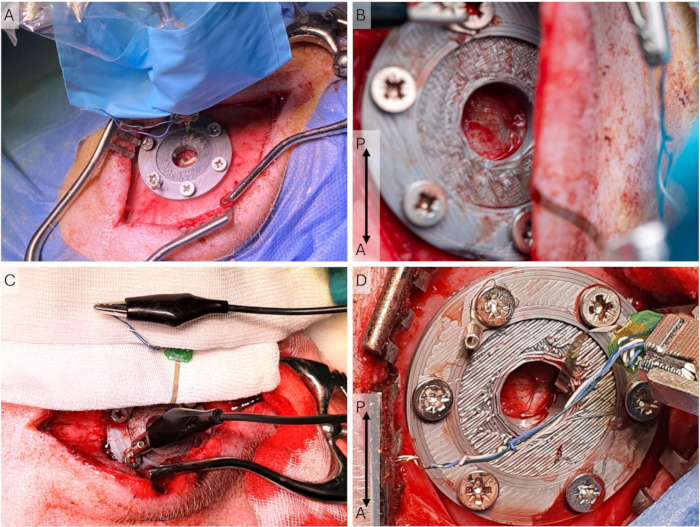
Abbildung 5: Aufbau der kortikalen Aufzeichnung. (A) Das Elektrodenarray wird auf die Dura gelegt, und der Kopftischhalter und der Mikromanipulator befinden sich während einer Implantationsoperation, bei der der Schnitt länger und lateraler ist, in einer sterilen Hülle. (B) Nahaufnahme des μECoG im Aufnahmeaufbau während einer Zugangsoperation, bei der der Schnitt eher medial ist. (C) Der Erdungsaufbau, bei dem alle Erdungs- und Referenzdrähte am ECoG kurzgeschlossen und über den U-Stecker mit der perikraniellen Schraube verbunden werden. (D) Nahaufnahme des Kopftisches und des Kopftischhalters während einer Zugangsoperation. Das μECoG wird auf die Dura aufgesetzt. Abkürzungen: ECoG = Elektrokortikographie; μECoG = microECoG. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
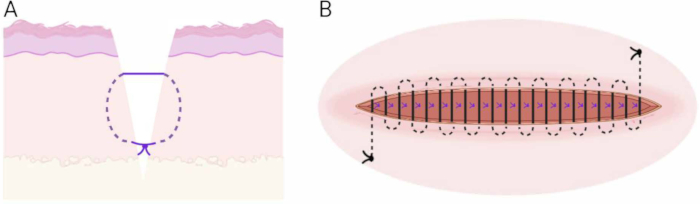
Abbildung 6: Nahttechnik. (A) Schematische Darstellung der Technik der subkutanen vergrabenen vertikalen Matratze. (B) Schematische Darstellung der Technik der kontinuierlichen intradermalen Naht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Zugangschirurgie (Phase II)
HINWEIS: Nach 2-4 Wochen wird das kraniale Fenster geöffnet, um Nachaufnahmen der kortikalen Signale des S1 durchzuführen. Die Operation und der Verschluss der Wunde werden wieder so durchgeführt, dass das Schädelfenster zugänglich und wieder verschlossen werden kann.
- Vorbereitung auf die Operation
HINWEIS: Die Schritte 2.1.1 bis 2.1.6 ähneln den Schritten 1.1.1.1 bis 1.1.1.6.- Betäuben Sie das Tier mit einer Zoletil-Mischung (5 ml Zoletil [Tiletamin 25 mg/ml und Zolazepam 25 mg/ml], 6,25 ml Xylazin (20 mg/ml) und 2,5 ml Butorphanol (10 mg/ml)).
HINWEIS: Für diese spezielle Studie wurde Ketamin in der Zoletil-Mischung weggelassen, um eine Blockierung der NMDA-Rezeptoren zu vermeiden. - Transportieren Sie das Tier in den Operationssaal, intubieren und beatmen Sie es.
- Legen Sie einen Ohrvenenkatheter an. Verabreichen Sie Propofol, Fentanyl und Kochsalzlösung über den Katheter.
- Chirurgische Anästhesie verabreichen: Sevofluran 1-2%, Propofol (10 mg/ml, infundiert mit 8 mg∙kg-1∙h-1), Fentanyl (50 μg/ml, infundiert mit 20 μg∙kg-1∙h-1).
- Markieren Sie bei Bedarf die Inzisionsstelle mit einem sterilen Marker, bevor Sie sie steril drapieren. Identifizieren Sie den Bregmapunkt, indem Sie gerade Linien zwischen jedem Ohr und dem kontralateralen Auge zeichnen; Bregma befindet sich am Schnittpunkt dieser Linien (Abbildung 3A).
HINWEIS: Der erste Schnitt ist in der Regel noch sichtbar. Der neue Schnitt sollte mindestens 30 mm vom ersten Schnitt entfernt platziert werden, um den größten Teil des Narbengewebes zu vermeiden und den Verschluss der Wunde zu erleichtern. - Legen Sie die Metallplatte unter die Vorhänge und stellen Sie sicher, dass sie richtig platziert und stabil ist, bevor Sie mit der Operation beginnen.
- Betäuben Sie das Tier mit einer Zoletil-Mischung (5 ml Zoletil [Tiletamin 25 mg/ml und Zolazepam 25 mg/ml], 6,25 ml Xylazin (20 mg/ml) und 2,5 ml Butorphanol (10 mg/ml)).
- Zugriff auf das Schädelfenster
HINWEIS: Die Schritte 2.2.1 bis 2.2.3 ähneln den Schritten 1.1.2.1 bis 1.1.2.3.- Den ersten Schnitt in der Dermis mit einem Skalpell leicht seitlich zur Mittellinie vornehmen, wie in Schritt 2.1.5 markiert. Setzen Sie den Schnitt durch die Haut mit einem Kauterisator fort.
HINWEIS: Im Falle eines terminalen Experiments kann der Schnitt an der gleichen Stelle wie der ursprüngliche Schnitt gemacht werden. - Platzieren Sie den Retraktor und halten Sie die Haut mit einer Pinzette hoch und schneiden Sie das avaskuläre Bindegewebe zwischen dem Periost und der Unterhaut (Abbildung 3B), um der Haut mehr Flexibilität zu verleihen und das Nähen in Schritt 1.4 zu erleichtern. Stellen Sie den Retraktor auf die gewonnene Flexibilität ein.
HINWEIS: Wenn es sich um ein Terminalexperiment handelt, kann dieser Schritt weggelassen werden. - Schneiden Sie das Periost ein und lösen Sie es mit dem Periostheber vom Schädel. Halten Sie das Periost mit dem Retraktor zur Seite.
- Entfernen Sie die Schädelfensterkappe und entfernen Sie mit sanft kreisenden Bewegungen mit einem Wattestäbchen das Bindegewebe aus der Öffnung, bis die Dura erreicht ist.
- Den ersten Schnitt in der Dermis mit einem Skalpell leicht seitlich zur Mittellinie vornehmen, wie in Schritt 2.1.5 markiert. Setzen Sie den Schnitt durch die Haut mit einem Kauterisator fort.
- Periphere Drahtimplantation
- Wiederholen Sie Schritt 1.2.
- Aufzeichnung kortikaler Signale
- Wiederholen Sie Schritt 1.3.
- Verschluss der Implantatstelle
- Wiederholen Sie Schritt 1.4.
HINWEIS: Wenn es sich um ein Terminalexperiment handelt, kann dieser Schritt weggelassen werden.
- Wiederholen Sie Schritt 1.4.
3. Endheilbare Chirurgie (Phase III)
HINWEIS: Nach 2-4 Wochen wird das kraniale Fenster geöffnet, um Nachaufnahmen der kortikalen Signale des S1 durchzuführen. Die Schritte 2.2-2.5 werden wie oben beschrieben wiederholt, gefolgt von Schritt 3.1.
- Euthanasie
HINWEIS: Der Schlauch des Ohrvenenkatheters muss mit Kochsalzlösung gespült werden, um eine Oxidation des Barbiturats zu verhindern.- Spülen Sie den Ohrvenenkatheter mit Kochsalzlösung.
- Setzen Sie eine Spritze mit der Überdosis Pentobarbital (10 ml, 400 mg/ml) auf und injizieren Sie das Pentobarbital über den Ohrvenenkatheter.
Ergebnisse
Mit der Cranial-Window-Technik wurden kortikale Signale in 43 Sitzungen bei 16 Tieren aufgezeichnet. Die Tiere heilten nach der Operation angemessen und wurden während der gesamten Studie in Paarhaltung untergebracht und täglich nach dem Tierschutzprogramm in der ergänzenden Tabelle S1 überwacht. Alle Tiere erhielten zu jeder Zeit die Note 0, was auf ein ausgezeichnetes Wohlergehen hinweist. Abbildung 7 zeigt, dass die Fenster tatsächlich über dem S1-Bereich der Schweinerinde platziert wurden. In vivo und post mortem wurden in der Regel einige Narben an der Dura beobachtet (Abbildung 7A), aber die postmortale Untersuchung ergab, dass sie nie das darunter liegende kortikale Gewebe betrafen (Abbildung 7B), das bei allen Tieren gesund und vergleichbar mit dem kontralateralen S1-Bereich zu sein schien.
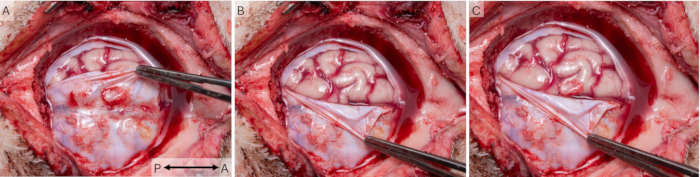
Abbildung 7: Platzierung des kortikalen Fensters in Bezug auf die Anatomie des Gehirns. (A) Um den Gesundheitszustand des kortikalen Gewebes und die Platzierung des kortikalen Fensters in Bezug auf S1 zu untersuchen, wurde das kraniale Fenster am Ende der Studie entfernt. In diesem Fall wurden Operationsintervalle von 2 Wochen verwendet, wobei an der Dura etwas Narbengewebe zu erkennen ist. (B) Das darunterliegende Hirngewebe scheint gesund und unempfindlich durch das Implantat zu sein. (C) Eine Überlagerung der beiden Fotos zeigt, dass das Implantat tatsächlich den S1-Bereich der Schweinerinde bedeckte. Der Pfeil zeigt die anterior-posteriore Achse. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Kurz gesagt, um die kortikalen Signale zu analysieren, müssen sie gefiltert werden, um Zeilenrauschen und andere Artefakte zu entfernen (siehe Abbildung 8 und Tabelle 1). Um die Netzrauschfrequenz, die in Europa 50 Hz beträgt, und ihre Oberschwingungen wird ein Kerbfilter verwendet. Die Signale werden dann hochpassgefiltert, um Offset- und niederfrequente Bewegungsartefakte zu entfernen. Die maximale Grenzfrequenz hängt vom Zweck der Aufzeichnungen ab, wird jedoch nicht höher als 5 Hz empfohlen, da dies sowohl die ERP- als auch die spontanen EEG-Funktionen abschwächt. Darüber hinaus wird ein Tiefpassfilter verwendet, um hochfrequentes Rauschen zu entfernen. Da die Elektrode auf der Dura platziert ist, werden hohe Frequenzen durch das Gewebe zwischen dem Gehirn und der Elektrode18 leicht gedämpft. Daher kann die Grenzfrequenz niedriger sein, als wenn sich die Elektrode direkt auf dem Hirngewebe befindet.
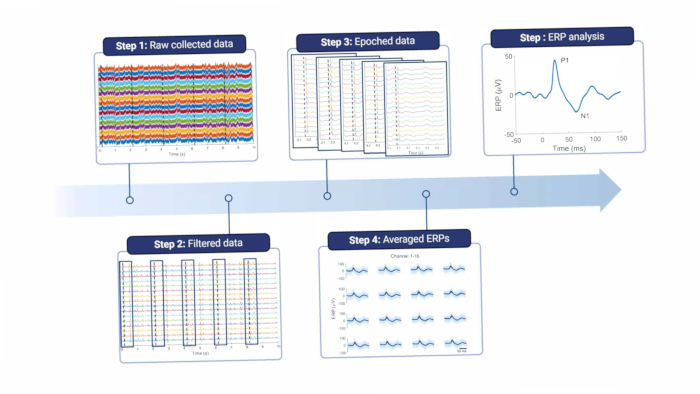
Abbildung 8: Datenverarbeitungspipeline. Die gesammelten Rohdaten (Schritt 1) werden durch Filtern (Schritt 2) verarbeitet. Sie werden dann anhand von Reizauslösern in Epochen eingeteilt (Schritt 3), die gemittelt werden (Schritt 4). Für die Datenanalyse werden die durchschnittlichen ERPs verwendet (Schritt 5). Abkürzung: ERPs = ereignisbezogene Potenziale. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Typ des Filters | Typischer Grenzwert | Typische Reihenfolge | Verwendeter Cutoff | Verwendete Bestellung |
| Kerbe | 50±3 Hz oder 60±3 Hz | Hoher Auftrag | 50±3 Hz und | 10. Ordnung |
| und Oberschwingungen | Oberschwingungen ±1 Hz | |||
| Hochpass | 0,1-5 Hz | Niedrige Bestellung | 1-5 Hz | 2. Ordnung |
| Tiefpass | 100-1000 Hz | Niedrige Bestellung | 300 Hz | 2. Ordnung |
Tabelle 1: Typische Filtereigenschaften für die Analyse von Oberflächensignalen des Gehirns, die mit Elektrokortikographie- oder Elektroenzephalographie-Elektroden aufgezeichnet wurden.
Die gefilterten Daten werden in Epochen von 50-100 ms vor und 500-1.000 ms nach dem Stimulus unterteilt. Rauschende Kanäle werden aus den Daten entfernt (Abbildung 9A), und die Epochen, die mit Artefakten kontaminiert sind, werden entfernt (Abbildung 9B). Die verbleibenden artefaktfreien Epochen werden für jeden Kanal gemittelt. Evozierte Reaktionen können oft in einzelnen Sweeps unterschieden werden. Diese werden klarer und konsistenter, wenn mindestens 10 Antworten gemittelt werden, und ändern sich nicht, wenn mehr als 25 gemittelt werden. Es sollte mindestens 20 artefaktfreie Epochen geben, um einen verlässlichen Durchschnitt zu erhalten. Dies ist in der Regel der Fall, und in mehr als der Hälfte der Datensätze war es nicht notwendig, Epochen zu entfernen. Um den Vergleich zwischen den ERPs, die während der verschiedenen Phasen (Implantation, Zugang, Euthanasie, Operationen) aufgezeichnet wurden, zu erleichtern, werden die Daten in der Regel mit einem Z-Score normalisiert, um Unterschiede in der Anästhesietiefe und der Hintergrundaktivität zu berücksichtigen.
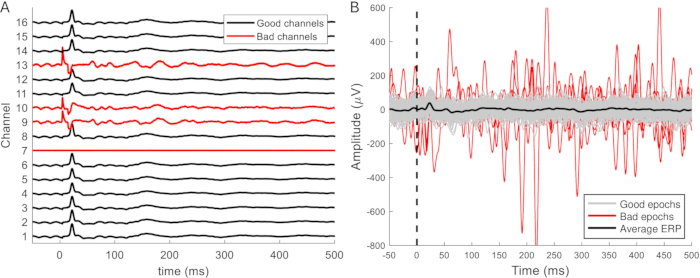
Abbildung 9: Beispiele für fehlerhafte Kanäle und Epochen. (A) Signale von epiduralen Aufzeichnungen über einen relativ kleinen Bereich des Gehirns haben ähnliche Eigenschaften, aber unterschiedliche Amplituden. Fehlerhafte Kanäle sind leicht daran zu erkennen, dass sie keine ERP-Wellenform haben. Darüber hinaus können Kanäle Artefakte, ein verrauschteres Erscheinungsbild und eine größere Signalamplitude aufweisen (Kanäle 9, 10 und 13). Kanal 7 ist ein weiteres Beispiel für einen fehlerhaften Kanal und nimmt kein Signal oder Rauschen auf. (B) Die erwartete ERP-Amplitude beträgt bis zu ca. 100 μV. Verrauschte Epochen haben typischerweise eine größere Amplitude, die sich auf die durchschnittliche ERP-Wellenform auswirken kann und daher entfernt werden sollte. Bei diesen fehlt die typische ERP-Wellenform, aber diese Wellenform ist nicht immer in einzelnen Epochen unterscheidbar. Abkürzung: ERP = ereignisbezogenes Potenzial. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Reliabilität der ERPs, die mit der Cranial-Window-Technik aufgezeichnet wurden, war in Bezug auf Spitzenamplituden und Latenz hoch19. Es wurden keine signifikanten Unterschiede hinsichtlich der Spitzenamplitude (Aufnahme 1: 17,9 ± 7,26 μV; Aufnahme 2: 17,6 ± 10,1 μV; Aufnahme 3: 14,0 ± 6,95 μV) und der Varianz zwischen den Kanälen (Aufnahme 1: 6,47 ± 8,36 μV; Aufzeichnung 2: 3,93 ± 6,13 μV; Aufzeichnung 3: 3,84 ± 3,71 μV) in einer wiederholt gemessenen Varianzanalyse (RM-ANOVA) gefunden. Es wurde ein signifikanter Unterschied in der Spitzenlatenz zwischen der ersten und den nachfolgenden Aufnahmen festgestellt. Der Peak war in der ersten Aufzeichnung 1 ms später als in den Folgeaufnahmen (Aufnahme 1: 25,2 ± 2,0 ms; Aufzeichnung 2: 24,0 ± 2,4 ms; Aufzeichnung 3: 24,1 ± 2,0 ms), was mit der Entwicklung des Nervensystems zusammenhängenkönnte 20,21, da in dieser Studie jugendliche Landrasseschweine verwendet wurden.
Die Cranial-Window-Technik wurde weiterhin verwendet, um die Wirkung der Hochfrequenzstimulation (HFS) auf ERPs zu untersuchen. HFS führt bei Nagetieren zu einer langfristigen Potenzierung von oberflächlichen Neuronen des Hinterhorns22,23, zu einer erhöhten Schmerzempfindlichkeit und zu erhöhten evozierten Gehirnreaktionen beim Menschen24,25. Es wurde ein signifikanter Anstieg der Amplitude des N1-Peaks der ereigniskorrelierten Potentiale beobachtet (259 ± 107% Anstieg im Vergleich zum Ausgangswert vor der Intervention), und es konnte ein deutlicher Unterschied zwischen HFS und Experimenten unterschieden werden, in denen kein HFS am selben Tier angewendet wurde (Abbildung 10)17.
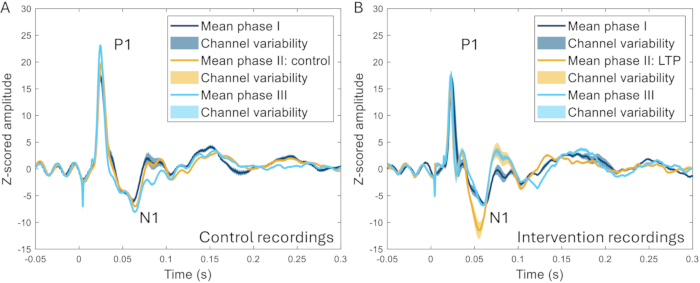
Abbildung 10: Beispiele für ERPs, die über alle Kanäle gemittelt wurden, die 2-3 Wochen vor, während und 2-3 Wochen nach der Induktion eines Schmerzmodells aufgezeichnet wurden. (A) Die ERPs, die vom selben Tier während drei verschiedener Aufzeichnungen im Abstand von 2 Wochen gesammelt wurden, zeigen sehr ähnliche Merkmale. (B) ERPs haben ähnliche Eigenschaften zwischen den Aufnahmen, aber der N1 hat eine größere Amplitude nach der Induktion der Langzeitpotenzierung in Phase II im Vergleich zu den anderen Phasen, die 3-4 Wochen vor und nach Phase II liegen. Schattierte Bereiche zeigen die Standardabweichung zwischen den Kanälen an. Abkürzungen: ERPs = ereignisbezogene Potenziale; LTP = Langzeitpotenzierung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Tabelle S1: Tierschutzprogramm zur Bewertung des Einzelgänger- und Sozialverhaltens der Schweine. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die Bedeutung der Entwicklung dieser Technik liegt in der Beseitigung von Elektrodenversagensmodi, der Reduzierung von Gewebereaktionen und damit in der Verbesserung der Zuverlässigkeit invasiver kortikaler Aufzeichnungstechniken. Während der Studie traten keine Elektrodenausfallmodi auf, und während der gesamten Studie wurden insgesamt zwei ECoG-Arrays verwendet, darunter 16 Tiere und 43 Aufnahmesitzungen. Dies wirkt sich zusätzlich positiv auf die Forschungswirtschaft aus. Unter Verwendung herkömmlicher vollständig implantierter Methoden 12,26,27 wären mindestens 16 ECoG-Arrays erforderlich, unter der Annahme, dass keine Geräteausfälle auftreten. Die Fehlermodi und Gewebereaktionen stellen jedoch weiterhin erhebliche Herausforderungen für die weit verbreitete Implementierung der intrakraniellen Hirnaufzeichnung dar 11,12,13,28,29. Diese Studie reduzierte die Anzahl der Elektroden erheblich, wodurch sowohl die Kosten als auch das Risiko chronischer neurowissenschaftlicher Studien gleichzeitig reduziert wurden.
Das einzige unerwünschte Ereignis, das bei den Schädelfensterimplantaten aufgetreten ist, sind gelegentliche Infektionen in den frühen Operationen. Diese Infektionen waren immer oberflächlich (erreichten nicht das Niveau der Dura) und wurden durch die Implantation eines resorbierbaren Antibiotikumschwamms von Genta-coll behoben. Aufgrund der Wirksamkeit dieser Behandlung wurde die Implantation eines antibiotischen Schwamms als Teil der Schädelfensterimplantation als vorbeugende Maßnahme gewählt. Obwohl Schweine starke Tiere sind, die ein Wurzelverhalten zeigen, war keines der Implantate aus Standard-PLA kaputt.
Alle implantierten Elektroden unterliegen einer Fremdkörperreaktion und einer glialen oder fibrösen Verkapselung 14,15,28,29,30. Dies bedeutet, dass sich die Elektroden-Gewebe-Grenzfläche sowie die Aufzeichnungsfähigkeit der Elektrode mit der Zeit nach der Implantation ändern 13,18,28. Mit der aktuellen Methode haben die Gewebereaktionen die Integrität und Aufzeichnungstreue der Elektroden aufgrund der Strategie der temporären Elektrodenplatzierung nicht beeinträchtigt. Die Elektrode wurde bei jeder Sitzung auf die Dura gelegt, so dass die Elektroden-Gewebe-Grenzfläche bei jeder Sitzung vergleichbar war. Der einzige Faktor, der sich von Sitzung zu Sitzung leicht unterschieden haben könnte, ist die Elektrodenposition. Es ist daher wichtig, die Fenstergröße an die Elektrodengröße anzupassen und während jeder Aufnahmesitzung Fotos von der Elektrodenplatzierung zu machen. Mit diesen Bemühungen wurden äußerst zuverlässige und reproduzierbare ERPs erfasst19.
Es kam zu einer Gewebereaktion auf das Implantat des Schädelfensters, und bei den frühesten Piloten, die ein transkranielles Fenster ohne Wände verwendeten, das sich von der Außenfläche des Schädels bis zur Dura erstreckte, wurde ein Knochenwachstum beobachtet. 2 Wochen nach der ersten Sitzung wurde eine durchgehende Schicht aus weichem Knochengewebe gefunden, die auf ein Knochenwachstum hinweist. Es war unmöglich, dieses Gewebe zu entfernen und Zugang zur Dura zu erhalten; Daher wurden vertikale Wände, die sich von der Oberfläche des Schädels bis zur Dura31 erstrecken, an das Schädelfenster angebaut. Es wurden Fenster mit unterschiedlichen Wandlängen gedruckt, um das Implantat an die Schädeldicke anzupassen und Druck auf die Hirnrinde zu vermeiden. Die Tiere wurden nach der Euthanasie untersucht, wobei sich bei allen Tieren ein gesund aussehendes Hirngewebe zeigte. Im Fensterbereich bildet sich noch Weichgewebe; Es haftet jedoch nicht an der Wand und ist nicht durchgehend mit dem Schädel, so dass es leicht mit einem Wattestäbchen entfernt werden kann. Entscheidend für die Zuverlässigkeit der Aufnahmen ist, dass dieses Weichgewebe aus dem Fenster entfernt wird, so dass die Elektrode jedes Mal aufs Neue auf die Dura aufgesetzt wird.
Optimale Ergebnisse werden mit einem Abstand von mindestens 3 Wochen zwischen den Operationen erzielt. Mit 2 Wochen ist das Schädelfenster zugänglich, aber das Weichgewebe im Fensterbereich ist an der Dura befestigt. Darüber hinaus wird das Öffnen und Schließen der Wunde durch Blutungen und mangelnde Flexibilität des Gewebes erschwert. Nach 3 und 4 Wochen ist die Schnittwunde so weit verheilt, dass die normalen Gewebegrenzen (z. B. Periost, Haut, Dura) deutlich sind, was es einfach macht, das Weichgewebe aus dem Fenster zu entfernen und die Haut über dem Implantat wieder zu schließen. Da in Abständen von 4 Wochen kein knochenähnliches Gewebe beobachtet wurde, können mehr als 4 Wochen zwischen Operationen und Operationen mit mehrfachem Zugang möglich sein. Wir haben nicht untersucht, ob der Zeitraum zwischen den Operationen auf mehrere Monate verlängert werden kann.
Für den Erfolg der Implantat- und Zugangsoperationen sind der Erstschnitt und der Wundverschluss entscheidend. Die Flexibilität der Stirnhaut des Schweins ist sehr eingeschränkt, weshalb die Lockerung der avaskulären Unterhautschicht der Haut unerlässlich ist. Dies bietet zusätzliche Flexibilität, um die Haut über dem Implantat zu schließen, und reduziert die Belastung der Nähte. Diese Belastung wird durch die Verwendung von zwei Schichten Nähten und zusätzlichem Hautkleber weiter reduziert. Die Haut wird mit einer kontinuierlichen intradermalen Nahttechnik vernäht, um zu vermeiden, dass die Tiere die Wunden zerkratzen und die Nähte vorzeitig entfernen. Die Strategien zur Wundöffnung und -verschließung sind bei beiden Arten von Überlebensoperationen von entscheidender Bedeutung, unabhängig davon, ob es sich um ein Implantat oder eine Zugangsoperation handelt.
Eine Einschränkung des derzeitigen Ansatzes besteht darin, dass der Zugang zum Fenster eine geringfügige Operation erfordert, was Aufzeichnungen bei wachen Tieren ausschließt. Das bedeutet, dass es je nach Fragestellung nicht für jede Studie ein geeigneter Ansatz sein wird. Für vollständig implantierte Geräte, die bei Wachaufzeichnungen verwendet werden sollen, existieren andere Verfahren zur Überwindung biologischer Veränderungen an der Grenzfläche32. Da der Zugang zum Schädelfenster ein kleiner Eingriff ist, kann es möglich sein, anstelle einer Vollnarkose ein Lokalanästhetikum und ein Beruhigungsmittel zu verwenden. Die Vorteile der vollständigen Unterbringung des Schädelfensters unter der Haut sind ein geringeres Infektionsrisiko und ein verbessertes Tierwohl, da die Tiere in Paar- oder Gruppenhaltung gehalten werden können. Darüber hinaus haben wir nur die Zuverlässigkeit der evozierten Reaktionen untersucht19. Die spontane Hirnaktivität wurde jedoch aufgezeichnet und ist im Allgemeinen zuverlässiger und reproduzierbarer als ERP8, was darauf hindeutet, dass die Methode nicht auf die Aufzeichnung von ERP beschränkt ist.
Unsere Methode stellt eine neuartige, skalierbare, zuverlässige und reproduzierbare Methode für chronische kortikale Aufzeichnungen dar. Diese Methode ist sehr wertvoll für neurowissenschaftliche Forschungsstudien, bei denen Zuverlässigkeit und Reproduzierbarkeit für das Ergebnis der Studien von entscheidender Bedeutung sind33,34. Wir haben die Methode verwendet, um kortikal evozierte Reaktionen von S1 vor und nach der Induktion verschiedener Schmerzmodelle und -kontrollen zu untersuchen, und haben robuste Ergebnisse gezeigt17. Im Allgemeinen kann die Methode leicht angepasst werden, um auf andere kortikale Bereiche zuzugreifen, z. B. um Bewegung, Hören oder Sehen zu untersuchen. Es kann auch möglich sein, das Verfahren zur Diagnose von Epilepsie 4,35 oder zur Überwachung der Behandlung und Rehabilitation nach Hirnverletzungenanzuwenden 36,37.
Die Methode ist auch auf andere Spezies skalierbar, wie z. B. nicht-menschliche Primaten oder andere Säugetiere, Katzen, Hunde oder Schafe 35,38,39. Jede dieser Anpassungen erfordert eine Anpassung der Operationstechnik, die Identifizierung zuverlässiger Orientierungspunkte für die Platzierung von Schädelfenstern und eine Anpassung des Designs. Die Autoren empfehlen die Verwendung von Leichen, um die Schädelfenstertechnik zu optimieren, bevor mit dem Pilotversuch begonnen wird. Für bestimmte Hirnareale kann die Operation invasiver sein, was zu einer anderen optimalen Erholungszeit führen kann, als wir empfehlen. Darüber hinaus kann die Technik so angepasst werden, dass subdurale ECoG-Aufzeichnungen und intrakortikale Aufzeichnungen möglich sind, wodurch ihre Anwendungsmöglichkeiten erweitert und der Zugang zu verschiedenen Gehirnregionen verbessert wird. Aufgrund der Dicke des Schweineschädels kann es notwendig sein, das kortikale Fenster zu vergrößern, um die Durotomie für subdurale Aufzeichnungen durchzuführen26,27.
Bei intrakortikalen Aufzeichnungen ist es möglich, die Elektrode über eine Kanüle oder ein Shuttle40 zu platzieren, was eine weitere Verkleinerung des kortikalen Fensters ermöglicht. Sowohl subdurale als auch intrakranielle Techniken erhöhen das Blutungsrisiko, daher muss während der Operation darauf geachtet werden, Blutgefäße zu vermeiden. Die Cranial-Window-Technik kann auch für andere Zwecke als die Aufzeichnung elektrischer Signale aus dem Gehirn verwendet werden, z. B. für die Bildgebung des Gefäßsystems, die in Schweinemodellen der Migräne von großer Bedeutung ist41. Darüber hinaus kann das Cranial-Window-Verfahren für die Verwendung in Kombination mit neuartigen bildgebenden Verfahren31, wie z. B. der 2-Photonen-Bildgebung, angepasst werden und kann mit dem von Costine-Bartell et al. entwickelten Duralersatz kombiniert werden, um die optische Auflösung42 zu verbessern.
Zusammenfassend lässt sich sagen, dass der vorgestellte methodische Ansatz die mit einem dauerhaften Implantatverbundenen Risiken 12,13 reduziert, indem er das Risiko eines Geräteversagens eliminiert, biologische Reaktionen an der Elektrodenstelle minimiert und dadurch die Aufzeichnungstreue erhöht und zu äußerst zuverlässigen kortikalen Aufzeichnungen führt. Die Methodik ist auch für andere Anwendungen vielversprechend, da sie auf andere Arten und Aufzeichnungstypen skalierbar ist.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Die Autoren danken den Tierpflegern und Technikern der Versuchstiereinrichtung am Universitätskrankenhaus Aalborg. Das Zentrum für Neuroplastizität und Schmerz (CNAP) wird von der dänischen Nationalen Forschungsstiftung (DNRF121) unterstützt. Abbildung 6 und Abbildung 8 wurden in BioRender erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| Cranial window implantation | |||
| Scalpel | disposable, blade 10 | ||
| Tweezers | |||
| Gauze | |||
| Cauterizer | |||
| Periosteum elevator | flat, 10 mm width | ||
| Weitlaner retractor | 3 x 4 prong, blunt, 16.5 cm | ||
| Midas Rex Legend EHS stylus surgical drill system | Medtronic Powered Surgical Solutions, Fort Worth, USA | ||
| Legend Ball Fine drill bits | Medtronic Powered Surgical Solutions, Fort Worth, USA | 7BA40F-MN and 7BA60F-MN | MedNext type 4 and 6 mm head diameter |
| Sterile cover for the drill | |||
| Syringe | 5 mL | ||
| Saline | |||
| Suction | |||
| Ruler | |||
| Cotton buds | |||
| Rongeur | straight jaw, 15 cm, 3 x 20 mm bit size | ||
| 2.5 mm hand drill and handle | |||
| Butterfly infusion set | |||
| Six M3 screws in 6-14 mm length | |||
| Screwdriver | |||
| Three sizes of 3D-printed cranial window (4-, 5- and 6-mm depth) and cap | |||
| Deisolated U-shaped connector | |||
| Crocodile connector | |||
| Genta-coll resorbable antibiotic sponge | |||
| VYCRIL resorbable suture | Ethicon | 2-0 26 mm round bodied | |
| Monocryl non-resorbable suture | Ethicon | 3-0 24 mm reverse cutting | |
| Needle holder | |||
| Scissors | |||
| Topical adhesive tissue glue | Leukosan | ||
| Peripheral wire implantation | |||
| Two partially uninsulated Cooner wires | |||
| NOTE: 1-2 cm of the wires is uninsulated in the middle and at one of the ends | |||
| Two 23 G needles | |||
| Gauze | |||
| Programmable stimulator controlled by a PC running MC_stimulus | Multichannel Systems, Reutlingen, Germany | STG4008 | |
| Two crocodile connectors | |||
| Cortical recordings | |||
| Metal plate for the magnetic micromanipulator | |||
| Magnetic micromanipulator stand | |||
| Micromanipulator | |||
| Headstage holder | |||
| 32-channel ZIF-clip headstage | TDT, Alachua, FL, USA | ||
| 32-channel micro-electrocorticography (µECoG) array | Neuronexus, Ann Arbor, USA | E32-1000-30-200 | |
| TDT recording equipment including pre-amplifier SI8, data processor RZ2 and workstation WS8 | TDT, Alachua, FL, USA |
Referenzen
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten