Method Article
ブタの麻酔中に皮質記録を繰り返すための慢性頭蓋窓法
要約
この研究は、ブタモデルで慢性皮質記録を繰り返すためのスケーラブルで信頼性が高く、再現性のある方法を示しています。この方法は、疼痛研究や神経疾患診断など、神経科学のさまざまな分野で応用されています。
要約
皮質記録は、ブレイン・コンピュータ・インターフェースや疾患診断など、さまざまなアプリケーションに情報を提供するためのニューロン信号の抽出に不可欠です。各アプリケーションは、録音技術に特定の要件を課し、長期録音には侵襲的なソリューションが選択されることがよくあります。しかし、侵襲的な記録法は、デバイスの故障や組織への悪影響により、長期的なシグナル品質が損なわれるという課題があります。
慢性皮質記録の信頼性と品質を向上させながら、デバイスの故障や組織反応に関連するリスクを最小限に抑えるために、頭蓋窓技術を開発しました。このプロトコルでは、幼若の在来種豚に頭蓋窓を埋め込んでアクセスする方法を報告します。これにより、硬膜への一時的な皮質電気検査 (ECoG) アレイの配置が容易になります。さらに、頭蓋窓法を使用して皮質信号を記録する方法について説明します。頭蓋窓へのアクセスは数回繰り返すことができますが、回復と組織の治癒を促進するために、インプラント手術とアクセス手術の間に最低2週間の間隔を空けることをお勧めします。
頭蓋窓アプローチにより、一般的な電極の故障モードと組織応答を最小限に抑えることに成功し、長期にわたって安定した信頼性の高い皮質記録が得られました。例として、一次体性感覚皮質からのイベント関連電位(ERP)を記録しました。この方法により、信頼性の高い録音が得られ、ERPに対する介入(高周波刺激)の効果を評価することもできました。重大なデバイス障害がなく、使用する電極の数が減少していること(電極2つ、記録セッション43回、動物16匹)は、研究経済性の向上を示唆しています。電極の留置にはわずかな外科的アクセスが必要ですが、この方法には感染リスクの低減や動物福祉の向上などの利点があります。
この研究は、慢性皮質記録のためのスケーラブルで信頼性が高く、再現性のある方法を示しており、疼痛研究や神経疾患診断など、神経科学のさまざまな分野での応用が期待されています。将来の適応は、皮質内記録やイメージング技術など、他の種や記録モダリティにその使用を拡大する可能性があります。
概要
一般に、皮質記録の目的は、脳内のニューロンシグナル伝達から情報を抽出することです。この情報は、外部デバイスの制御、通信、疾患診断、またはリハビリテーション1,2,3,4など、さまざまな方法で使用できます。各アプリケーションには、必要な情報コンテンツと空間解像度、および許容できると考えられる侵襲性の量に独自の要件が課せられます。したがって、1929年に脳波が発見されて以来、さまざまな侵襲性と空間分解能を備えた記録ソリューションが開発されてきました5。
一般に、これらは脳波記録法(EEG)、皮質電気検査(ECoG)、および皮質内記録に分けることができます。脳波は、脳全体の神経振動と事象関連電位(ERP)を捕捉する非侵襲的な記録方法です。ただし、このアクティビティのソースを定義する機能は、空間分解能が低いため制限されています。ECoGは、電極を硬膜外または硬膜下に配置し、通常は皮質のより小さな部分を覆う、より侵襲的な方法です。空間分解能が高く、ERPと表面局所電位(LFP)を記録できます。したがって、脳活動の原因をより正確に特定することができるため、例えば、焦点性てんかんの原因を特定するのに役立ちます。皮質内記録は最も侵襲的な記録方法であり、脳の表面または深部に位置する個々のニューロンからのスパイク活動と、電極周囲のニューロンの体積からのLFPを記録できます。これらの信号は、非常に高い空間分解能と情報量を持っていますが、ニューロンの限られたサブセット(チャネルあたり1〜10個のニューロン)によって生成されます6。
長期間(数か月から数年)にわたって脳から情報を抽出するには、取得した信号が全期間にわたって同じ情報を表し続けるためには、インターフェースが安定していて信頼性が高い必要があります。脳波記録は頻繁な電極交換を必要とするため、その信頼性は非常に低いものから非常に高いものまで変動します 7,8,9,10。したがって、ECoGおよび皮質内法は、長時間の録音のためにしばしば選択されます。しかしながら、これらの方法の両方において、記録電極および組織の状態が長期にわたって安定していなければならない。電極は通常同じ位置に留まるが、電極-組織界面は、組織反応または電極故障モード11,12,13,14により変化し得る。組織反応には、ニューロン死、出血、生物付着、異物反応、神経膠症、カプセル化、感染、髄膜炎、および髄膜の押し出しが含まれます15。これらの反応は、電極12,13の記録能力を損なう。一般的な電極故障モードは、絶縁部品の層間剥離または漏れ、電極表面コーティングの層間剥離または亀裂、ワイヤの損傷、および電極の脱臼11,12です。
電極の故障モードを克服するために、組織応答に関連する多くの課題、すなわちニューロン死、異物反応、神経膠症、カプセル化、髄膜の押し出しにも対処する一時的な電極配置ソリューションの実行可能性を検討しました。さらに、信頼性と再現性のあるニューロン記録を達成するためには、一貫した電極配置が必要でした。電極は神経組織から数ミリメートルの距離で硬膜外に配置されているため、電極の動きは1mmを超えてはなりません。頭蓋窓は、電極配置間の過度の移動を防ぐための寸法で設計されました。頭蓋窓技術の開発により、長期的な信号の信頼性と品質を向上させ、電極の故障リスクを排除することを目指しています。
プロトコル
このプロトコルは、デンマークの食糧農業水産省傘下のデンマーク獣医食品局によって承認されています(プロトコル番号2020-15-0201-00514)。合計16頭の雌の在来種豚が手術を受けました。施設に到着した時の動物の体重は約20kg、つまり生後約2か月でした。彼らの体重は、移植時に約30kg、研究終了時に40〜60kgでした。手術は、移植手術、アクセス手術、および終末手術で構成されています(図1)。
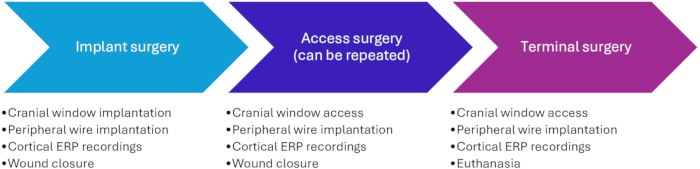
図1:実験手順のタイムライン。 アクセス手術(フェーズII)は数回繰り返される場合があります。手術間の回復と創傷治癒のために、手術の間に少なくとも2週間の間隔を空けることをお勧めします。略語:ERP =イベント関連の可能性。 この図の拡大版を表示するには、ここをクリックしてください。
1. インプラント手術(フェーズI.)
注:3Dプリントされたポリ乳酸(PLA)頭蓋窓(図2)は、ブタの主要な体性感覚皮質からの繰り返し記録を容易にするために埋め込まれています。尺骨神経の電気刺激によるERPが記録されます。手術と創傷閉鎖は、その後頭蓋窓にアクセスして閉じることができるように行われます。

図2:頭蓋窓のデザイン(A)壁の高さと頭蓋骨に固定されている基部を示す頭蓋窓の側面図。(B)頭蓋未亡人の直径、ネジ穴、キャップスペース、窓を示す上面図。頭蓋窓キャップは、キャップスペースに正確に収まる高さ1mmの直径22mmのシリンダーです。この図の拡大版を表示するには、ここをクリックしてください。
- 頭蓋窓移植
- 手術の準備
注:手術を開始する前に、データプロセッサ(RZ2)、ワークステーション(WS8)、およびPCの電源を入れます。手術ノートは、バイタルサイン(心拍数、spO2、呼気終末CO2、深部体温)、麻酔レベル(プロポフォール注入率、フェンタニル注入率、セボフルランパーセンテージ)、手術のステージ、および不規則性を記録するために、非滅菌研究者によって少なくとも15分ごとにスプレッドシートで取得されます。- 5〜7 mLのゾレチル混合物(1 mLには8.3 mgのチレタミン、8.3 mgのゾラゼパム、8.3 mgのキシラシン、および1.7 mgのブトファノールが含まれていました)の筋肉内注射を使用して動物を鎮静させます。.
注:この特定の研究では、NMDA受容体のブロックを避けるために、ゾレチル混合物からケタミンが省略されました。. - 動物を手術室に運びます。動物を挿管し、人工呼吸器に接続します。
- 耳の静脈カテーテルを留置して、プロポフォール、フェンタニル、生理食塩水を投与します。
- 外科的麻酔を投与する:セボフルラン1-2%、プロポフォール(10 mg / mLを8 mg・kg-1・h-1で注入)、フェンタニル(50 μg / mLを20 μg・kg-1・h-1で注入)。.
- 滅菌ドレープの前に、滅菌マーカーを使用して切開部位に印を付けます。各耳と反対側の目の間に直線を引いて、ブレグマポイントを特定します。ブレグマ ポイントは、これらの線の交点にあります (図 3A)。切開部が刺激を受けた前肢の反対側の正中線に対してわずかに横方向にあることを確認してください。
- 手術を開始する前に、金属プレートをドレープの下に置き、適切な配置と安定性を確認してください。
- 5〜7 mLのゾレチル混合物(1 mLには8.3 mgのチレタミン、8.3 mgのゾラゼパム、8.3 mgのキシラシン、および1.7 mgのブトファノールが含まれていました)の筋肉内注射を使用して動物を鎮静させます。.
- 頭蓋骨へのアクセス
注:プロトコルのこの部分および次の部分では、特に指示がない限り、すべての手順は滅菌外科医によって行われます。- ステップ1.1.1.5でマークしたように、メスで真皮の最初の切開を正中線のわずかに外側に行います。焼灼器で皮膚を通して切開を続けます。
注:豚の大きな前頭洞を避けるために、切開部を前方に伸ばしすぎないでください。さらにスペースが必要な場合は、後側の切開部を伸ばします。 - リトラクターを配置し、鉗子を使用して皮膚を支え、骨膜と皮下組織の間の無血管結合組織を切断します(図3B)これにより、皮膚の柔軟性が向上し、ステップ1.4の縫合が容易になります。リトラクターを得られた柔軟性に調整します。
- 骨膜を切開し、骨膜エレベーターを使用して頭蓋骨から緩めます。リトラクターを使用して骨膜を脇に置きます。
- ステップ1.1.1.5でマークしたように、メスで真皮の最初の切開を正中線のわずかに外側に行います。焼灼器で皮膚を通して切開を続けます。
- 硬膜へのアクセス
- 矢状縫合線の正面と正中線縫合糸の側面に直径10mmの穴を開けます(図3C)。丸みを帯びたドリルビットはわずかに先細りの穴になるため、硬膜レベルで直径10mmの穴を達成するためには、直径15mmから開始します。
- 頭蓋窓を早い段階で穴に取り付けて、しっかりとフィットするようにします。
- 硬膜が見えたら、硬膜レベルで穴の最大幅を達成するために、より小さなドリルビットに切り替えます。Rongeursを使用してエッジをクリップします。
- 頭蓋窓移植
- 頭蓋窓が穴の中と底まで収まることを確認し、その深さを決定します。これは動物によって異なりますが、頭蓋窓の壁が硬膜に到達して適切にフィットするようにしますが、どの場所でも脳に圧力をかけないようにしてください。
- 頭蓋窓を所定の位置に保持しながら、ハンドドリルを使用してネジ穴に印を付けます。
- 頭蓋窓を取り外し、少なくとも4mmの深さの穴を開けます。頭蓋骨を貫通して、いずれかのネジを皮質記録の接地/基準として使用します。
- 頭蓋窓を配置し(図3)、バタフライ注入セットから針を取り外します。.鈍い蝶を使用して、頭蓋窓を通るネジ穴の深さを測定します。穴に長さが一致するネジを挿入して固定します。
注意: ネジが長すぎると、頭蓋窓のキャップを効果的に固定できません。 - 頭蓋骨に穴を開けて硬膜に触れる1本のネジの下にUコネクタを配置します。
注意: このネジの長さは頭蓋骨の厚さよりも長く、再成長する骨が硬膜との接触を妨げないようにすることが重要です。
- 手術の準備
- ペリフェラルワイヤーの埋め込み
注:この手順は、頭蓋窓の移植と同時に行うことができます。これは無菌の手順です。手術部位または頭蓋部位の汚染を防ぐために、滅菌服を着用する必要があります。- 尺骨神経の近くにワイヤーを埋め込む
- 前肢の後部遠位部分の皮膚に2本の針(貫通しない)または2cm離れた別の滅菌金属片で皮膚に触れることにより、5mAの電気刺激を皮膚に加えます。.神経がこれら2つのポイントの間を走っていることを示す明確な蹄の屈曲を探します。
注意: 後部にアクセスしやすくするために、手足を後方に回転させる必要がある場合があります。 - 神経の経路に対して垂直に2本の針を約2cm離して挿入します。挿入点から約3cmのところに再度皮膚を突き刺します(図4A)。
- 2mAで針に加えられたテスト刺激を使用して位置を確認します。蹄の明確な動きが見えていることを確認してください。
- クーナーワイヤーを針に通し、針を取り外して、クーナーワイヤーを部分的に皮膚の下に残します。ワイヤの中央にある絶縁されていない部分が、両方のワイヤのスキンの下にあることを確認します(図4B)。
注意: 手足が後方に回転した場合は、慎重に前方に回転させます。 - 各クロコダイルコネクタを、2本のクーナーワイヤの非絶縁端に取り付けます。
- 前肢の後部遠位部分の皮膚に2本の針(貫通しない)または2cm離れた別の滅菌金属片で皮膚に触れることにより、5mAの電気刺激を皮膚に加えます。.神経がこれら2つのポイントの間を走っていることを示す明確な蹄の屈曲を探します。
- モーターしきい値の設定
- アップダウン法を使用してモーターのしきい値を見つけます16,17;100μAから始まり、50μAのステップで増加し、蹄の領域の運動反応を見て感じます。通常、1mA未満のスレッショルドが実現可能です。
- STGをプログラムして、モーターしきい値の2倍で200μsのパルス幅で100個の長方形の二相対称刺激を提供し、続いてモーターしきい値の10倍で100個の刺激を提供します。
- 尺骨神経の近くにワイヤーを埋め込む
- 皮質信号の記録
- 非滅菌の研究者にプリアンプを所定の位置に持ってきてもらい、光ファイバーケーブルを使用してデータプロセッサ(RZ2)に接続します。
- セボフルランを0.5〜1%(手術レベルの半分)に減らし、心拍数、期限切れのCO2、および血圧(利用可能な場合)を監視して、適切で安定した麻酔深度を確保します。.必要に応じて、プロポフォールとフェンタニルの両方を増やします。.
- 非滅菌の研究者にヘッドステージをプリアンプ(SI8)に取り付けてもらい、(ZIF-clip)ヘッドステージを磁気スタンドマイクロマニピュレーターに取り付けられたヘッドステージホルダーに置きます。
- 滅菌ドレープをマイクロマニピュレーターの周りに置き、接着部品をヘッドステージとヘッドステージホルダーに取り付けます(図5A)。
- 非滅菌の研究者に、マグネティックスタンドでマイクロマニピュレーターを固定してもらい、μECoG電極をアルコールに浸して(ZIF-clip)ヘッドステージに設置してもらう。
注意: 電極を硬膜に置く前に、電極を乾かしてください。μECoG電極は滅菌されていないため、ヘッドステージを覆う滅菌ドレープにのみ触れてください。 - マイクロマニピュレーターを使用してμECoGを所定の位置に持ってきて、綿棒でガイドします。μECoGのアース線をワニ口コネクタでアースネジに接続します。
- セボフルランを0%に減らし、心拍数、期限切れのCO2、 および血圧(利用可能な場合)を監視して、適切で安定した麻酔深度を確保し、必要に応じてプロポフォールとフェンタニルの両方を増やします。.
- シナプスで信号をプレビューします。標準的な信号範囲は最大±100μVです。
- 信号が 太字の線 (ラインノイズの兆候)のように見える場合は、滅菌した人に次のアクションを実行してもらいます:接地回路を調査し、接地ネジと接続を乾いた状態に保ち、近くの組織から隔離します。他のケーブルが豚の体や手術器具から分離されているかどうかを調査します。そうでない場合は、滅菌ガーゼを使用して、ケーブルを体または手術器具から分離します。
- 信号の 振幅 が ±100μVより大きい 場合(運動アーチファクトの兆候)、電極が吊り下げられて脳に載っていること、および尺骨神経の換気または電気刺激によりブタが動くときにケーブルが動かないことを確認してください。
- 信号 振幅 が ± 20 mV未満 の場合(接触不良または深部麻酔の兆候)、μECoGが脳に留まり、硬膜と電極が水和していることを確認してください。必要に応じて、電極に生理食塩水を滴下します。セボフルランがオフになっていることを確認し、プロポフォール(および場合によってはフェンタニル)の注入速度を減らします。.テスト刺激を行い、誘発された反応が見えるかどうかを確認します。周辺ワイヤの絶縁されていない部分が完全に皮膚の下にあることを確認します。
注:誘発された応答は、通常、オンラインでの1回のスイープで区別できますが、これをオフラインで評価することも可能で、平均5〜10回の刺激を取ります。トリガー時にピークが見える場合、それは刺激アーティファクトです。刺激アーチファクトはデータ分析に干渉します。
- 電極に滅菌ガーゼを敷き、組織の良好な接触を維持します。ガーゼに体温生理食塩水を滴下して、組織の乾燥を防ぎます。
注:これらの録音は硬膜外であるため、正確な温度は必須ではありません。硬膜下録音では、これはより重要です。 - 電極が落ち着くまで待ち(30分)、電極の配置とアースコネクタの設定を文書化して、その後の録音が同様のものになるようにします(図5B-D)。録音を開始し、30秒待ってから、10分ごとに刺激プログラムを開始します。
注意: 録音の合間に電極のガーゼが水和したままであることを定期的に確認し、必要に応じて体温生理食塩水を滴下します。 - 3 ラウンドの刺激後に介入を実行します (介入前のベースラインとして機能するため)。さらに9ラウンド、刺激を繰り返します。
注意: 電極のガーゼが水和したままであることを録音の合間に定期的に確認し続け、必要に応じて生理食塩水を滴下します。
- インプラント部位の閉鎖
- 電極からガーゼをはがし、マイクロマニピュレーターで綿棒で優しく導きながら電極を取り外します。
- 非滅菌の研究者にマイクロマニピュレーター、電極、ヘッドステージ、プリアンプを取り外して保管してもらい、脱イオン水ですばやくすすいで組織の残留物を除去し、製造元の指示に従って電極を洗浄します。電極をレンズクリーナーに最大4時間浸して電極表面から組織とタンパク質を取り除き、続いて脱イオン水で2回目ですすいでレンズクリーナーを電極表面から除去します。保管する前に、電極をイソプロピルアルコールに浸してください。
- 頭蓋窓キャップを取り付けて頭蓋窓を閉じ、頭蓋窓に正確に収まるようにします。追加の固定は必要ありません。皮膚からインプラントへの圧力により、インプラントは所定の位置に保たれます。
- 抗生物質のポーチを頭蓋窓キャップの上に置き、埋設垂直マットレス縫合技術を使用して単一の吸収性縫合糸で皮膚を皮下閉じます(図6A)。縫合糸を5〜10mmの距離で配置し、皮膚縫合糸を配置するスペースを確保します。最後の3つの縫合糸を配置した後、結ばないでください。代わりに、すべての縫合糸が配置されたときに、これら3つの縫合糸を結びます。
注:3つすべてを配置した後、最後の3つの縫合糸を結ぶと、最後の縫合糸を配置するのに十分なスペースが確保されます。 - 連続的な皮内縫合糸を皮膚に連続的に配置します。皮内縫合糸を切開部位の1〜2 cm外側から開始し、縫合糸の過度の引っかき傷や緩みを避けるために、皮膚の下から皮膚の真皮層までトンネルを掘ります(図6B)。縫合糸の外側の端に結び目を作ります。
注:プロポフォールとフェンタニルは、覚醒時間が数分あるため、この手順中にオフにすることができます。 - 切開部の反対側に達するまで、連続縫合糸を皮下縫合糸の間に配置します。
注:縫合糸が真皮から出るが、皮膚を突き刺さらないことが重要であり、これにより動物が縫合糸を引っ掻くことが少なくなります。 - 縫合糸を切開部の横方向に1〜2cmトンネルで塞ぎ、横方向の出口部位に結び目を作ります(図6B)。切開部位にティッシュ接着剤を塗布します。
- 家に帰る動物ペン
- 動物から滅菌ドレープを取り外し、動きが観察されたらすぐに動物を人工呼吸器から離乳させます。
- 動物を家の囲いに移し、一晩ペンメイトから離しておきます。
注:豚は、ペンメイトを激しく起こそうとすると、噛み傷が生じるのが普通であるため、手術後に分離されます。豚は鼻を接触させることができるべきです。
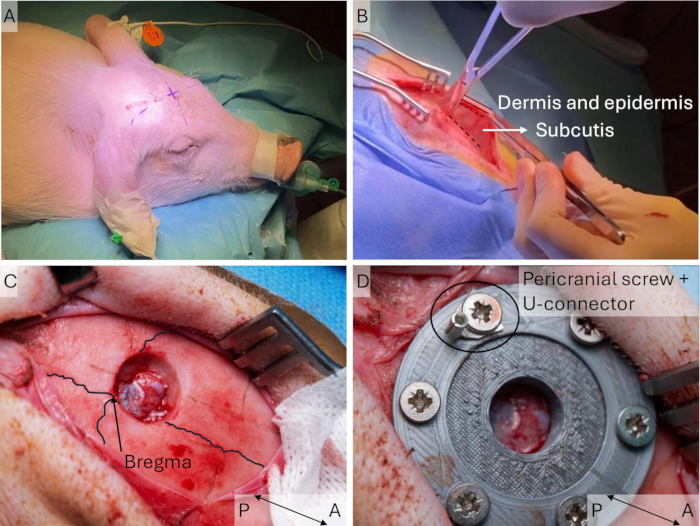
図3:頭蓋窓の移植。 (A)ブレグマポイントの予想される位置は、滅菌ドレープの前に豚に識別され、マークされています。これは後で区別するのが難しい場合があるためです。(B)皮膚切開後、ハサミで無血管下組織をほぐします。(C)頭蓋骨に直径15mmの穴を開け、ロンジャーを使用してエッジを取り除きます。冠状縫合線と矢状縫合線が強調表示されています。(D)頭蓋窓を埋め込み、ネジを使用して固定します。 この図の拡大版を表示するには、ここをクリックしてください。
図4:周辺ワイヤーの埋め込み (A) 2本の23G針を皮膚に挿入し、これらを通してクーナーワイヤーを挿入する。(B)針を取り外し、ワニ口クリップを使用して刺激装置に接続された皮膚にワイヤーを残します。 この図の拡大版を表示するには、ここをクリックしてください。
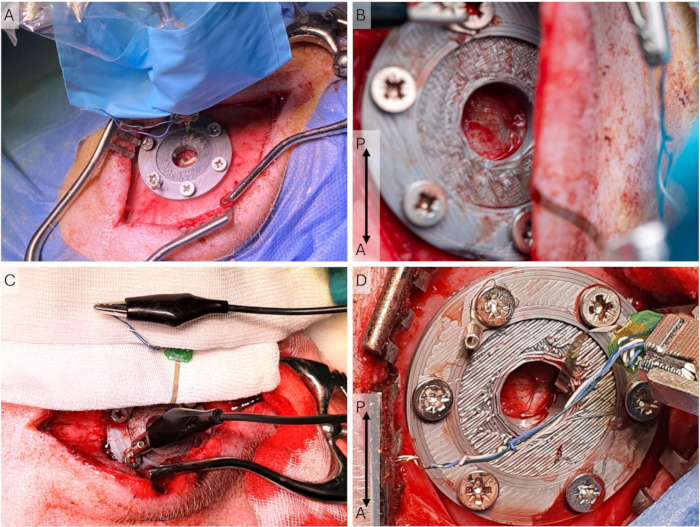
図5:皮質記録のセットアップ。 (A) 電極アレイは硬膜上に配置され、ヘッドステージホルダーとマイクロマニピュレーターは、切開部が長く横方向になる移植手術中に滅菌スリーブに入れられます。(B)アクセス手術中の記録セットアップでのμECoGのクローズアップ、切開がより内側にある場所。(C)ECoGのすべての接地線と参照線が短絡され、Uコネクタを介して頭蓋周囲ネジに接続されている接地セットアップ。(D)アクセス手術中のヘッドステージとヘッドステージホルダーのクローズアップ。μECoGは硬膜上に置かれます。略語:ECoG =皮質電位検査;μECoG = microECoGです。 この図の拡大版を表示するには、ここをクリックしてください。
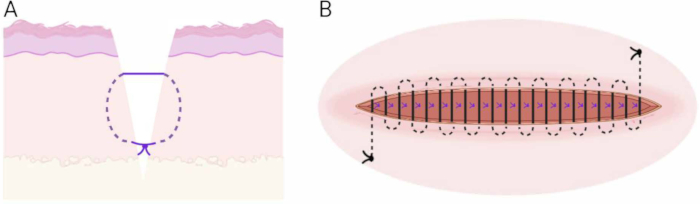
図6:縫合技術。 (A)皮下埋設垂直マットレス技術の概略図。(B)連続皮内縫合術の概略図。 この図の拡大版を表示するには、ここをクリックしてください。
2. アクセス手術(フェーズII)
注:2〜4週間後、頭蓋窓が開き、S1からの皮質信号のフォローアップ記録が行われます。手術と創傷の閉鎖は、頭蓋窓にアクセスして再び閉じることができるように、再び行われます。
- 手術の準備
注: 手順 2.1.1 から 2.1.6 は、手順 1.1.1.1 から 1.1.1.6 と似ています。- ゾレチル混合物(5 mLのゾレチル[タイルタミン25 mg / mLおよびゾラゼパム25 mg / mL]、6.25 mLのキシラジン(20 mg / mL)、および2.5 mLのブトルファノール(10 mg / mL))を使用して動物を鎮静させます。.
注:この特定の研究では、NMDA受容体の遮断を避けるために、ケタミンはゾレチル混合物から省略されました。. - 動物を手術室に運び、挿管して換気します。
- 耳の静脈カテーテルを留置します。プロポフォール、フェンタニル、生理食塩水をカテーテルから投与します。
- 外科的麻酔を投与する:セボフルラン1-2%、プロポフォール(10 mg / mLを8 mg・kg-1・h-1で注入)、フェンタニル(50 μg / mLを20 μg・kg-1・h-1で注入)。.
- 必要に応じて、滅菌ドレープの前に滅菌マーカーを使用して切開部位に印を付けます。各耳と反対側の目の間に直線を引いて、ブレグマポイントを特定します。bregma はこれらの線の交点にあります (図 3A)。
注:通常、最初の切開部はまだ見えます。新しい切開部は、ほとんどの瘢痕組織を避け、創傷の閉鎖を容易にするために、最初の切開部から少なくとも30 mm離して配置する必要があります。 - 手術を開始する前に、金属プレートをドレープの下に置き、適切な配置と安定性を確認してください。
- ゾレチル混合物(5 mLのゾレチル[タイルタミン25 mg / mLおよびゾラゼパム25 mg / mL]、6.25 mLのキシラジン(20 mg / mL)、および2.5 mLのブトルファノール(10 mg / mL))を使用して動物を鎮静させます。.
- 頭蓋窓へのアクセス
注: 手順 2.2.1 から 2.2.3 は、手順 1.1.2.1 から 1.1.2.3 と似ています。- ステップ2.1.5でマークしたように、メスで真皮の最初の切開を正中線のわずかに外側に行います。焼灼器で皮膚を通して切開を続けます。
注:最終実験の場合、切開は元の切開と同じ位置に行うことができます。 - リトラクターを配置し、鉗子を使用して皮膚を支え、骨膜と皮下組織の間の無血管結合組織を切断します(図3B)これにより、皮膚の柔軟性が向上し、ステップ1.4の縫合が容易になります。リトラクターを得られた柔軟性に調整します。
注: これが最終実験である場合、この手順は省略できます。 - 骨膜を切開し、骨膜エレベーターを使用して頭蓋骨から緩めます。リトラクターを使用して骨膜を脇に置きます。
- 頭蓋窓のキャップを取り外し、硬膜に達するまで綿棒で穏やかな円を描く動きを使用して開口部から結合物を取り外します。.
- ステップ2.1.5でマークしたように、メスで真皮の最初の切開を正中線のわずかに外側に行います。焼灼器で皮膚を通して切開を続けます。
- ペリフェラルワイヤーの埋め込み
- 手順1.2を繰り返します。
- 皮質信号の記録
- 手順1.3を繰り返します。
- インプラント部位の閉鎖
- 手順1.4を繰り返します。
注: これが最終実験である場合、この手順は省略できます。
- 手順1.4を繰り返します。
3. 終末期手術(第III相)
注:2〜4週間後、頭蓋窓が開き、S1からの皮質信号のフォローアップ記録が行われます。上記のように、ステップ 2.2 から 2.5 を繰り返し、ステップ 3.1 を繰り返します。
- 安楽死
注:耳静脈カテーテルのチューブは、バルビツール酸の酸化を防ぐために生理食塩水で洗い流す必要があります。- 耳の静脈カテーテルを生理食塩水で洗い流します。
- ペントバルビタール(10 mL、400 mg / mL)の過剰投与でシリンジを取り付け、耳静脈カテーテルを介してペントバルビタールを注入します。.
結果
頭蓋窓法を用いて、皮質信号は16匹の動物で43回のセッションで記録された。動物は手術後に適切に治癒し、研究全体を通してペアで飼育され、 補足表S1の福祉スキームを使用して毎日監視されました。すべての動物は常に0点を獲得し、優れた福祉を示しています。 図7 は、窓が実際にブタ皮質のS1領域上に配置されたことを示しています。通常、 in vivo および死後に硬膜に何らかの瘢痕が観察されましたが(図7A)、死後検査では、すべての動物で健康に見え、対側のS1領域に匹敵すると思われる下層皮質組織(図7B)に影響を与えないことが明らかになりました。
図7:脳の解剖学的構造に対する皮質窓の配置。 (A)皮質組織の健康状態とS1に関連する皮質窓の配置を調査するために、研究の最後に頭蓋窓を取り外しました。この場合、2週間の手術間隔が使用され、硬膜にいくつかの瘢痕組織が観察されます。(B)下にある脳組織は健康で、インプラントの影響を受けていないように見えます。(C)2枚の写真を重ね合わせると、インプラントは確かにブタ皮質のS1領域を覆っていたことがわかる。矢印は前後軸を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
簡単に言うと、皮質信号を解析するには、ラインノイズやその他のアーチファクトを除去するために皮質信号をフィルタリングする必要があります( 図8 および 表1を参照)。ラインノイズ周波数(ヨーロッパでは50Hzとその高調波)の周囲にはノッチフィルタが使用されます。次に、信号はハイパスフィルタリングされ、オフセットと低周波のモーションアーチファクトが除去されます。最大カットオフ周波数は録音の目的によって異なりますが、5 Hzを超えるとERPと自発的なEEG機能の両方が減衰するため、お勧めしません。さらに、ローパスフィルターを使用して高周波ノイズを除去します。電極が硬膜の上に配置されるため、高周波は脳と電極との間の組織によってわずかに減衰される18。したがって、カットオフ周波数は、電極が脳組織に直接配置されている場合よりも低くなる可能性があります。
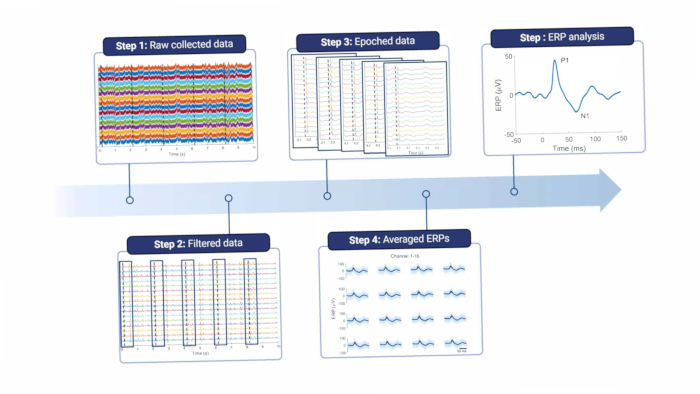
図 8: データ処理パイプライン。 収集された生のデータ (ステップ 1) は、フィルタリング (ステップ 2) によって処理されます。次に、刺激トリガーに基づいてエポックに分割され(ステップ3)、エポックが平均化されます(ステップ4)。平均ERPはデータ分析に使用されます(ステップ5)。略語:ERPs = イベント関連の可能性。 この図の拡大版を表示するには、ここをクリックしてください。
| フィルターの種類 | 一般的なカットオフ | 一般的な注文 | 使用済みカットオフ | 使用順序 |
| ノッチ | 50±3 Hz または 60±3 Hz | 高次 | 50±3 Hz と | 10次 数 |
| と高調波 | 高調波 ±1 Hz | |||
| ハイパス | 0.1-5ヘルツ | 低次数 | 1-5ヘルツ | 2次 数 |
| ローパス | 100-1000ヘルツ | 低次数 | 300ヘルツ | 2次 数 |
表1:皮質電位計または脳波計電極で記録された脳表面信号の分析のための典型的なフィルター特性。
フィルタリングされたデータは、刺激の50〜100ミリ秒前と500〜1,000ミリ秒後のエポックに分割されます。ノイズの多いチャネルはデータから削除され(図9A)、アーティファクトで汚染されたエポックは削除されます(図9B)。残りのアーティファクトのないエポックは、各チャネルで平均化されます。誘発された応答は、多くの場合、1回のスイープで区別できます。これらは、少なくとも 10 個の回答が平均化されると、より明確で一貫性が増し、25 個を超える回答が平均化されても変化しません。信頼できる平均を得るには、アーティファクトのないエポックが少なくとも 20 個ある必要があります。これは通常、ケースであり、データセットの半分以上で、エポックを削除する必要はありませんでした。さまざまなフェーズ (移植、アクセス、安楽死手術) で記録された ERP 間の比較を容易にするために、データは通常、麻酔薬の深さとバックグラウンド活動の違いを考慮して Z スコアで正規化されます。
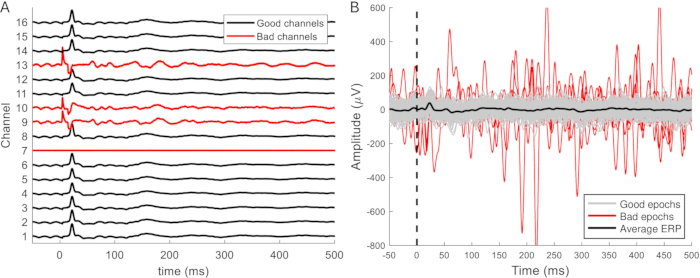
図9:不良チャネルとエポックの例 (A)脳の比較的小さな領域にわたる硬膜外記録からの信号は、同様の特性を持っていますが、振幅は異なります。誤動作しているチャンネルは、ERP波形がないことで簡単に区別できます。さらに、チャンネルではアーチファクトが発生し、ノイズが多くなり、信号振幅が大きくなることがあります(チャンネル9、10、13)。チャンネル7は、故障したチャンネルの別の例であり、信号やノイズを拾いません。(B)予想されるERP振幅は約100μVです。ノイズの多いエポックは通常、振幅が大きく、平均ERP波形に影響を与える可能性があるため、除去する必要があります。典型的なERP波形はこれらに欠けていますが、この波形は必ずしも単一のエポックで区別できるわけではありません。略語:ERP =イベント関連の可能性。 この図の拡大版を表示するには、ここをクリックしてください。
頭蓋窓技術を使用して記録されたERPの信頼性は、ピーク振幅と遅延19の点で高かった。反復測定分散分析(RM-ANOVA)において、ピーク振幅(記録1:17.9 ± 7.26 μV、記録2:17.6 ± 10.1 μV、記録3:14.0 ± 6.95 μV)およびチャネル間分散(記録1:6.47 ± 8.36 μV、記録2:3.93 ± 6.13 μV、記録3:3.84 ± 3.71 μV)に有意差は認められませんでした。最初の録音とフォローアップの録音の間のピークレイテンシーには大きな違いが見られました。ピークは、フォローアップ記録(記録1:25.2 ± 2.0 ms;記録2:24.0 ± 2.4 ms;記録3:24.1 ± 2.0 ms)と比較して、最初の記録の1ミリ秒後であり、これは、この研究では思春期の在来種豚が使用されたため、神経系の発達に関連している可能性があります20,21。
さらに、頭蓋窓法を用いて、高周波刺激(HFS)がERPに及ぼす影響を調査した。HFSは、げっ歯類22,23の表在性後角ニューロンの長期増強、ヒトの痛みの感受性の増加、および誘発される脳反応の増加を引き起こします24,25。事象関連電位のN1ピークの振幅の有意な増加が観察され(介入前のベースラインと比較して259±107%の増加)、HFSとHFSを同じ動物に適用しなかった実験との間には明確な違いを区別することができた(図10)17。
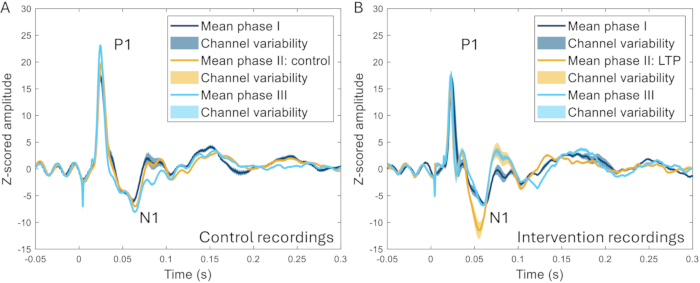
図10:疼痛モデルの誘発の2〜3週間前、導入中、および2〜3週間後に記録されたすべてのチャネルで平均化されたERPの例(A)2週間間隔で3つの異なる記録中に同じ動物から収集されたERPは、非常に類似した特性を示しています。(B)ERPは記録間で同様の特性を持っていますが、フェーズIIの長期増強の誘導後のN1は、フェーズIIの前後3〜4週間の他のフェーズと比較して振幅が大きくなります。網掛けされた領域は、チャネル間の標準偏差を示します。略語:ERPs =イベント関連の可能性;LTP = 長期増強。この図の拡大版を表示するには、ここをクリックしてください。
補足表S1:豚の孤独で社会的行動を採点するための福祉スキーム。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
この技術の開発の重要性は、電極の故障モードを取り除き、組織応答を減らし、それによって侵襲的な皮質記録技術の信頼性を向上させることにあります。試験中に電極の故障モードは発生せず、16匹の動物と43回の録音セッションを含む合計2つのECoGアレイが研究全体で使用されました。これは、研究経済にさらなるプラスの影響を与えます。従来の完全埋め込み方法12、26、27を使用すると、デバイスの故障が発生しないという仮定の下で、少なくとも16のECoGアレイが必要になる。しかし、失敗モードと組織応答は、頭蓋内脳記録11,12,13,28,29の広範な実施に引き続き大きな課題を提起しています。この研究により、電極の数が大幅に減少し、慢性神経科学研究のコストとリスクの両方を同時に削減しました。
頭蓋窓インプラントで発生した唯一の有害事象は、初期の手術で時折発生する感染症です。これらの感染症は常に表面的なものであり(硬膜のレベルに達していない)、Genta-coll再吸収性抗生物質スポンジを埋め込むことで解決しました。この治療の有効性により、予防策として頭蓋窓移植の一部として抗生物質スポンジの埋め込みが採用されました。ブタは発根行動をとる強い動物であるにもかかわらず、標準的なPLAで作られたインプラントはどれも壊れていませんでした。
埋め込まれたすべての電極は、異物応答、およびグリアまたは繊維状のカプセル化14,15,28,29,30の影響を受けます。これは、電極-組織界面、および電極の記録能力が、移植13,18,28後の時間とともに変化することを意味する。現在の方法を使用すると、一時的な電極配置戦略により、組織応答は電極の完全性と記録忠実度に影響を与えませんでした。電極は各セッション中に硬膜に配置されていたため、電極と組織の界面は各セッションで同等でした。セッションごとにわずかに異なる可能性のある唯一の要因は、電極の位置です。したがって、ウィンドウサイズを電極サイズに一致させ、各記録セッション中に電極の配置の写真を撮ることが重要です。これらの努力により、信頼性と再現性の高いERPが記録されています19。
頭蓋窓インプラントに対する組織応答が起こり、頭蓋骨の外面から硬膜まで伸びる壁のない経頭蓋窓を使用した初期のパイロットでは骨の再成長が観察されています。最初のセッションの2週間後に軟骨組織の連続層が見つかり、骨の再成長を示しました。この組織を切除して硬膜にアクセスすることは不可能でした。そのため、頭蓋骨の表面から硬膜31 まで伸びる垂直壁が頭蓋窓に追加されました。皮質への圧力を避けるために、インプラントと頭蓋骨の厚さを一致させるために、壁の長さが異なる窓が印刷されました。動物は安楽死後に調査され、すべての動物で健康に見える脳組織を明らかにしました。軟部組織はまだ窓の領域内に形成されます。ただし、壁に付着せず、頭蓋骨と連続していないため、綿棒を使用して簡単に取り外すことができます。記録の信頼性を確保するためには、この軟部組織を窓から取り除き、毎回電極を硬膜に配置することが重要です。
手術の間隔を空けると、最適な結果が得られます。2週間で、頭蓋窓にアクセスできるようになりますが、窓領域の軟部組織は硬膜に付着しています。さらに、創傷の開閉は、出血や組織の柔軟性の欠如によって複雑になります。3週目と4週目で、切開創は十分に治癒し、正常な組織の境界(骨膜、皮膚、硬膜など)が明確になり、窓から軟部組織を取り外してインプラントの上の皮膚を再度閉じることが容易になります。4週間間隔で骨様組織は観察されていないため、手術と複数回のアクセス手術の間に4週間以上が可能かもしれません。手術の間隔を数ヶ月に延長できるかどうかについては、調査を行っていません。
インプラント手術とアクセス手術を成功させるためには、最初の切開と創傷の閉鎖が重要です。ブタの額の皮膚の柔軟性は非常に限られているため、皮膚の無血管皮下層を緩めることが不可欠です。これにより、インプラント上の皮膚を閉じるための柔軟性が高まり、縫合糸へのストレスが軽減されます。このストレスは、2層の縫合糸と追加の皮膚接着剤を使用することでさらに軽減されます。皮膚は、動物が傷口を引っ掻いたり、縫合糸を早期に抜いたりしないように、連続的な皮内縫合技術を使用して縫合されます。創傷の開閉戦略は、インプラント手術であろうとアクセス手術であろうと、どちらのタイプのサバイバル手術でも重要です。
現在のアプローチの限界は、ウィンドウへのアクセスには軽度の手術が必要であり、覚醒している動物での録音が不可能であることです。これは、研究課題によっては、すべての研究に適したアプローチではないことを意味します。覚醒記録で使用される完全埋め込みデバイスのためには、界面32における生物学的変化を克服するための他の方法が存在する。頭蓋窓へのアクセスは簡単な手順であるため、全身麻酔ではなく、局所麻酔薬と鎮静剤を使用できる場合があります。頭蓋窓が完全に皮膚の下にあることの利点は、動物をペアまたはグループハウスにすることができるため、感染の可能性を減らし、動物福祉を向上させることです。さらに、誘発応答の信頼性についてのみ調査した19。しかし、自発的な脳活動が記録されており、一般にERP8よりも信頼性と再現性が高く、この方法がERPの記録に限定されないことを示しています。
私たちの方法は、慢性皮質記録のための新しく、スケーラブルで、信頼性が高く、再現性のある方法を提供します。この方法は、信頼性と再現性が研究の結果に不可欠である神経科学研究にとって非常に価値があります33,34。この方法を使用して、さまざまな疼痛モデルとコントロールの誘導前後のS1からの皮質誘発応答を調査し、堅牢な結果を示しています17。一般に、この方法は、例えば、運動、聴覚、または視覚を調査するために、他の皮質領域にアクセスするために容易に適合させることができる。また、てんかん4,35の診断にこの方法を使用することも、脳損傷36,37後の治療およびリハビリテーションを監視することも可能であるかもしれない。
この方法は、人間以外の霊長類や他の哺乳動物、猫、犬、または羊などの他の種にも拡張可能である35,38,39。これらの適応のそれぞれは、外科的技術を調整し、頭蓋窓の配置のための信頼できるランドマークを特定し、そのデザインを調整する必要があります。著者たちは、パイロット試験に進む前に、頭蓋窓技術を最適化するために死体を使用することを推奨している。脳の特定の領域では、手術がより侵襲的になる場合があり、その結果、推奨されるものとは異なる最適な回復時間が生じる可能性があります。さらに、この技術は、硬膜下ECoG記録および皮質内記録を可能にするように適応させることができ、それによってその適用が広がり、さまざまな脳領域へのアクセスが増加します。ブタの頭蓋骨の厚さのために、硬膜下記録26,27の硬膜切開術を行うためには、皮質窓のサイズを大きくする必要があるかもしれない。
皮質内記録の場合、カニューレまたはシャトル40を介して電極を配置することが可能であり、これにより皮質窓のサイズをさらに縮小することができる。硬膜下手術と頭蓋内術はどちらも出血のリスクを高めるため、手術中は血管を避けるように注意する必要があります。頭蓋窓技術は、脳からの電気信号を記録する以外の目的、例えば、片頭痛のブタモデルに非常に関連性のある血管系のイメージングにも使用され得る41。さらに、頭蓋窓法は、2光子イメージングのような新規なイメージング技術31と組み合わせて使用するために適合させることができ、また、改善された光学分解能42のためにCostine−Bartellらによって開発された硬膜代替物と組み合わせることができる。
結論として、提示された方法論的アプローチは、デバイスの故障のリスクを排除し、電極部位での生物学的応答を最小限に抑え、それによって記録の忠実度を高め、信頼性の高い皮質記録をもたらすことにより、永久インプラント12,13に関連するリスクを低減する。この方法論は、他の種や記録タイプにスケーラブルであるため、他のアプリケーションにも大きな期待が寄せられています。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
著者は、オールボー大学病院の実験動物施設の動物飼育者と技術者に感謝します。Center for Neuroplasticity and Pain (CNAP) は、デンマーク国立研究財団 (DNRF121) の支援を受けています。 図 6 と 図 8 は BioRender で作成しました。
資料
| Name | Company | Catalog Number | Comments |
| Cranial window implantation | |||
| Scalpel | disposable, blade 10 | ||
| Tweezers | |||
| Gauze | |||
| Cauterizer | |||
| Periosteum elevator | flat, 10 mm width | ||
| Weitlaner retractor | 3 x 4 prong, blunt, 16.5 cm | ||
| Midas Rex Legend EHS stylus surgical drill system | Medtronic Powered Surgical Solutions, Fort Worth, USA | ||
| Legend Ball Fine drill bits | Medtronic Powered Surgical Solutions, Fort Worth, USA | 7BA40F-MN and 7BA60F-MN | MedNext type 4 and 6 mm head diameter |
| Sterile cover for the drill | |||
| Syringe | 5 mL | ||
| Saline | |||
| Suction | |||
| Ruler | |||
| Cotton buds | |||
| Rongeur | straight jaw, 15 cm, 3 x 20 mm bit size | ||
| 2.5 mm hand drill and handle | |||
| Butterfly infusion set | |||
| Six M3 screws in 6-14 mm length | |||
| Screwdriver | |||
| Three sizes of 3D-printed cranial window (4-, 5- and 6-mm depth) and cap | |||
| Deisolated U-shaped connector | |||
| Crocodile connector | |||
| Genta-coll resorbable antibiotic sponge | |||
| VYCRIL resorbable suture | Ethicon | 2-0 26 mm round bodied | |
| Monocryl non-resorbable suture | Ethicon | 3-0 24 mm reverse cutting | |
| Needle holder | |||
| Scissors | |||
| Topical adhesive tissue glue | Leukosan | ||
| Peripheral wire implantation | |||
| Two partially uninsulated Cooner wires | |||
| NOTE: 1-2 cm of the wires is uninsulated in the middle and at one of the ends | |||
| Two 23 G needles | |||
| Gauze | |||
| Programmable stimulator controlled by a PC running MC_stimulus | Multichannel Systems, Reutlingen, Germany | STG4008 | |
| Two crocodile connectors | |||
| Cortical recordings | |||
| Metal plate for the magnetic micromanipulator | |||
| Magnetic micromanipulator stand | |||
| Micromanipulator | |||
| Headstage holder | |||
| 32-channel ZIF-clip headstage | TDT, Alachua, FL, USA | ||
| 32-channel micro-electrocorticography (µECoG) array | Neuronexus, Ann Arbor, USA | E32-1000-30-200 | |
| TDT recording equipment including pre-amplifier SI8, data processor RZ2 and workstation WS8 | TDT, Alachua, FL, USA |
参考文献
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved