Method Article
Technique de la fenêtre crânienne chronique pour les enregistrements corticaux répétés pendant l’anesthésie chez le porc
Dans cet article
Résumé
Cette étude présente une méthode évolutive, fiable et reproductible pour les enregistrements corticaux chroniques répétés dans un modèle porcin. La méthode a des applications dans divers domaines des neurosciences, notamment la recherche sur la douleur et le diagnostic des maladies neurologiques.
Résumé
Les enregistrements corticaux sont essentiels pour extraire des signaux neuronaux afin d’informer diverses applications, notamment les interfaces cerveau-ordinateur et le diagnostic des maladies. Chaque application impose des exigences spécifiques à la technique d’enregistrement, et des solutions invasives sont souvent sélectionnées pour les enregistrements à long terme. Cependant, les méthodes d’enregistrement invasives sont mises à l’épreuve par la défaillance des dispositifs et les réponses tissulaires défavorables, qui compromettent la qualité du signal à long terme.
Pour améliorer la fiabilité et la qualité des enregistrements corticaux chroniques tout en minimisant les risques liés aux défaillances du dispositif et aux réactions tissulaires, nous avons développé une technique de fenêtre crânienne. Dans ce protocole, nous rapportons des méthodes pour implanter et accéder à une fenêtre crânienne chez des porcs landrace juvéniles, ce qui facilite le placement d’un réseau d’électrocorticographie temporaire (ECoG) sur la dure-mère. Nous décrivons plus en détail comment les signaux corticaux peuvent être enregistrés à l’aide de la technique de la fenêtre crânienne. L’accès à la fenêtre crânienne peut être répété plusieurs fois, mais un minimum de 2 semaines entre les chirurgies d’implant et d’accès est conseillé pour faciliter la récupération et la cicatrisation des tissus.
L’approche de la fenêtre crânienne a réussi à minimiser les modes de défaillance des électrodes courants et les réponses tissulaires, ce qui a permis d’obtenir des enregistrements corticaux stables et fiables au fil du temps. Nous avons enregistré les potentiels liés aux événements (ERP) du cortex somatosensoriel primaire à titre d’exemple. La méthode a fourni des enregistrements très fiables, qui ont également permis d’évaluer l’effet d’une intervention (stimulation à haute fréquence) sur les ERP. L’absence de défaillances significatives des dispositifs et le nombre réduit d’électrodes utilisées (deux électrodes, 43 sessions d’enregistrement, 16 animaux) suggèrent une amélioration de l’économie de la recherche. Bien qu’un accès chirurgical mineur soit nécessaire pour la mise en place des électrodes, la méthode offre des avantages tels que la réduction du risque d’infection et l’amélioration du bien-être des animaux.
Cette étude présente une méthode évolutive, fiable et reproductible pour les enregistrements corticaux chroniques, avec des applications potentielles dans divers domaines des neurosciences, y compris la recherche sur la douleur et le diagnostic des maladies neurologiques. Des adaptations futures pourraient étendre son utilisation à d’autres espèces et modalités d’enregistrement, telles que les enregistrements intracorticaux et les techniques d’imagerie.
Introduction
En général, le but des enregistrements corticaux est d’extraire des informations de la signalisation neuronale dans le cerveau. Ces informations peuvent être utilisées de différentes manières : contrôle d’un appareil externe, communication, diagnostic de maladieou réadaptation1,2,3,4. Chaque application impose des exigences uniques en matière de contenu d’information et de résolution spatiale requise, ainsi que de degré d’invasivité considéré comme acceptable. Par conséquent, des solutions d’enregistrement avec une gamme d’invasivité et de résolution spatiale ont été développées depuis la découverte de l’électroencéphalogramme en 19295.
Généralement, ceux-ci peuvent être divisés en électroencéphalographie (EEG), électrocorticographie (ECoG) et enregistrements intracorticaux. L’EEG est une méthode d’enregistrement non invasive qui capture les oscillations neuronales et les potentiels liés aux événements (ERP) de l’ensemble du cerveau. Cependant, sa capacité à définir les sources de cette activité est limitée en raison de sa faible résolution spatiale. L’ECoG est une méthode plus invasive où les électrodes sont placées épi- ou sous-durale, couvrant généralement une plus petite partie du cortex. Il a une résolution spatiale plus élevée et peut enregistrer les potentiels de champ local (LFP) de l’ERP et de surface. Par conséquent, il peut localiser plus précisément la source de l’activité cérébrale, ce qui le rend utile, par exemple, pour identifier l’origine de l’épilepsie focale. L’enregistrement intracortical est la méthode d’enregistrement la plus invasive et peut enregistrer l’activité de pointe des neurones individuels situés superficiellement ou profondément à l’intérieur du cerveau et la LFP du volume des neurones autour des électrodes. Ces signaux ont une résolution spatiale et un contenu informatif très élevés, mais sont produits par un sous-ensemble restreint de neurones (1 à 10 neurones par canal)6.
Pour extraire des informations du cerveau pendant des périodes prolongées (mois-années), l’interface doit être stable et fiable pour que les signaux acquis continuent à représenter les mêmes informations pendant toute la période. Les enregistrements EEG nécessitent des changements d’électrodes fréquents, ce qui rend leur fiabilité variable de très faible à très élevée 7,8,9,10. Les méthodes ECoG et intracorticales sont donc souvent choisies pour les enregistrements prolongés. Cependant, ces deux méthodes exigent que l’état de l’électrode d’enregistrement, ainsi que du tissu, reste stable dans le temps. Alors que l’électrode reste généralement au même endroit, l’interface électrode-tissu peut changer en raison de réactions tissulaires ou des modes de défaillance de l’électrode 11,12,13,14. Les réactions tissulaires comprennent la mort neuronale, l’hémorragie, l’encrassement biologique, la réaction à un corps étranger, la gliose, l’encapsulation, l’infection, la méningite et l’extrusion de méningées15. Ces réactions compromettent les capacités d’enregistrement des électrodes12,13. Les modes de défaillance courants des électrodes sont le délaminage ou la fuite au niveau des pièces isolées, le délaminage ou la fissuration du revêtement de surface de l’électrode, l’endommagement du fil et la dislocation de l’électrode11,12.
Pour surmonter les modes de défaillance des électrodes, nous avons examiné la viabilité d’une solution de placement temporaire d’électrodes qui répond également à de nombreux défis liés aux réponses tissulaires, à savoir la mort neuronale, la réaction à un corps étranger, la gliose, l’encapsulation et l’extrusion de méninges. De plus, un placement cohérent des électrodes était nécessaire pour obtenir des enregistrements neuronaux fiables et reproductibles. Étant donné que l’électrode a été placée par voie épidurale à quelques millimètres du tissu nerveux, le mouvement de l’électrode ne doit pas dépasser 1 mm. La fenêtre crânienne a été conçue avec des dimensions pour empêcher un mouvement excessif entre les positions d’électrodes. Avec le développement de la technique de la fenêtre crânienne, nous visons à améliorer la fiabilité et la qualité du signal à long terme et à éliminer le risque de défaillance des électrodes.
Protocole
Ce protocole a été approuvé par l’Administration vétérinaire et alimentaire danoise sous l’égide du ministère de l’Alimentation, de l’Agriculture et de la Pêche du Danemark (numéro de protocole 2020-15-0201-00514). Au total, 16 porcs femelles landrace ont subi les procédures. Les animaux pesaient environ 20 kg à leur arrivée dans l’établissement, c’est-à-dire qu’ils étaient âgés d’environ 2 mois. Ils pesaient environ 30 kg lors de l’implantation et 40-60 kg à la fin de l’étude. Les procédures comprennent la chirurgie d’implantation, la chirurgie d’accès et la chirurgie terminale (Figure 1).
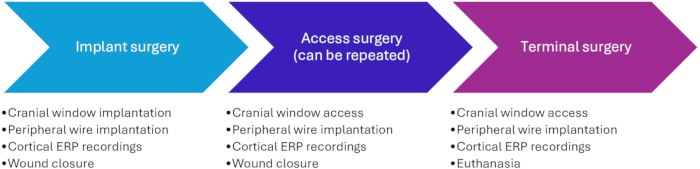
Figure 1 : Chronologie des procédures expérimentales. La chirurgie d’accès (phase II) peut être répétée plusieurs fois. Une séparation d’au moins 2 semaines est conseillée entre les chirurgies pour la récupération et la cicatrisation des plaies entre les chirurgies. Abréviation : ERP = event-related potential. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Chirurgie d’implantation (phase I)
REMARQUE : Une fenêtre crânienne d’acide polylactique (PLA) imprimée en 3D (Figure 2) est implantée pour faciliter les enregistrements répétés du cortex somatosensoriel primaire du porc. Les ERP dus à la stimulation électrique du nerf cubital sont enregistrés. L’intervention chirurgicale et la fermeture de la plaie sont effectuées de manière à ce que la fenêtre crânienne puisse être accessible et fermée par la suite.

Figure 2 : Conception de la fenêtre crânienne. (A) Vue latérale de la fenêtre crânienne indiquant la hauteur des parois et la base qui est fixée au crâne. (B) Vue de dessus indiquant le diamètre de la veuve crânienne, les trous de vis, l’espace du capuchon et la fenêtre. Le capuchon de la fenêtre crânienne est un cylindre de 22 mm de diamètre avec une hauteur de 1 mm qui s’adapte précisément à l’espace du bouchon. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Implantation de fenêtres crâniennes
- Préparation à l’intervention chirurgicale
REMARQUE : Le processeur de données (RZ2), le poste de travail (WS8) et le PC sont allumés avant le début de l’opération. Des notes chirurgicales sont prises sur une feuille de calcul au moins toutes les 15 minutes par un chercheur non stérile pour documenter les signes vitaux (fréquence cardiaque, spO2, CO2 en fin d’expiration, température centrale), les niveaux d’anesthésie (débit de perfusion de propofol, taux de perfusion de fentanyl, pourcentage de sévoflurane), le stade de la chirurgie et toute irrégularité.- Tranquilliser l’animal à l’aide d’une injection intramusculaire de 5 à 7 mL de mélange de Zoletil (1 mL contenait 8,3 mg de Tiletamine, 8,3 mg de Zolazépam, 8,3 mg de Xylacine et 1,7 mg de Butophanol).
REMARQUE : Pour cette étude particulière, la kétamine a été omise du mélange Zoletil afin d’éviter de bloquer les récepteurs NMDA. - Transportez l’animal jusqu’à la salle d’opération. Intubez l’animal et connectez-le à un ventilateur mécanique.
- Placez un cathéter veineux auriculaire pour administrer du propofol, du fentanyl et du sérum physiologique.
- Administrer une anesthésie chirurgicale : Sévoflurane 1-2 %, propofol (10 mg/mL perfusé à 8 mg∙kg-1∙h-1), fentanyl (50 μg/mL perfusé à 20 μg∙kg-1∙h-1).
- Marquez le site d’incision à l’aide d’un marqueur stérile avant le drapage stérile. Identifiez le point de bregma en traçant des lignes droites entre chaque oreille et l’œil controlatéral ; le point de bregma se trouve à l’intersection de ces lignes (figure 3A). Assurez-vous que l’incision est légèrement latérale à la ligne médiane du côté controlatéral au membre antérieur stimulé.
- Placez la plaque métallique sous les champs et assurez-vous d’un bon placement et d’une bonne stabilité avant de commencer la chirurgie.
- Tranquilliser l’animal à l’aide d’une injection intramusculaire de 5 à 7 mL de mélange de Zoletil (1 mL contenait 8,3 mg de Tiletamine, 8,3 mg de Zolazépam, 8,3 mg de Xylacine et 1,7 mg de Butophanol).
- Accès au crâne
REMARQUE : Dans cette partie et les suivantes du protocole, toutes les procédures sont effectuées par un chirurgien stérile, sauf indication contraire.- Faites l’incision initiale dans le derme à l’aide d’un scalpel légèrement latéral à la ligne médiane, comme indiqué à l’étape 1.1.1.5. Poursuivez l’incision à travers la peau avec un cautérisant.
REMARQUE : N’étendez pas l’incision trop loin vers l’avant pour éviter les gros sinus frontaux du porc. Si vous avez besoin de plus d’espace, étendez l’incision sur le côté postérieur. - Placez l’écarteur et maintenez la peau à l’aide d’une pince et coupez le tissu conjonctif avasculaire entre le périoste et l’sous-cutané (Figure 3B) pour donner plus de souplesse à la peau et faciliter la suture à l’étape 1.4. Ajustez l’écarteur à la flexibilité obtenue.
- Incisez le périoste et détachez-le du crâne à l’aide d’un élévateur de périoste. Tenez le périoste de côté à l’aide de l’écarteur.
- Faites l’incision initiale dans le derme à l’aide d’un scalpel légèrement latéral à la ligne médiane, comme indiqué à l’étape 1.1.1.5. Poursuivez l’incision à travers la peau avec un cautérisant.
- Accès à la dure-mère
- Percez un trou de 10 mm de diamètre frontal à la ligne de suture sagittale et latéral à la suture médiane (Figure 3C). Commencez à un diamètre de 15 mm pour obtenir un trou de 10 mm de diamètre au niveau de la dure, car le foret arrondi donnera un trou légèrement effilé.
- Installez la fenêtre crânienne sur le trou dès le début pour assurer un bon ajustement.
- Passez à un foret plus petit lorsque la dure-mère devient visible pour obtenir la largeur maximale du trou au niveau de la dura. Coupez les bords à l’aide de rongeurs.
- Implantation de fenêtres crâniennes
- Confirmez que la fenêtre crânienne s’insère à l’intérieur et jusqu’au fond du trou et décidez de sa profondeur. Bien que cela dépende de l’animal, assurez-vous que les parois de la fenêtre crânienne atteignent la dure-mère pour un bon ajustement, mais n’exercez aucune pression sur le cerveau à aucun endroit.
- Marquez les trous de vis à l’aide de la perceuse à main tout en maintenant la fenêtre crânienne en place.
- Retirez la fenêtre crânienne et percez les trous d’au moins 4 mm de profondeur. Pénétrer dans le crâne pour que l’une des vis l’utilise comme masse/référence pour les enregistrements corticaux.
- Placez la fenêtre crânienne (Figure 3) et retirez l’aiguille du dispositif de perfusion papillon. Mesurez la profondeur des trous de vis à travers la fenêtre crânienne à l’aide du papillon émoussé. Insérez et fixez une vis de la même longueur dans le trou.
REMARQUE : Une vis trop longue ne parviendra pas à fixer efficacement le capuchon de la fenêtre crânienne. - Placez un connecteur en U sous une vis qui perfore le crâne et touche la dure-mère.
REMARQUE : Il est important que la longueur de cette vis soit supérieure à l’épaisseur du crâne afin que la repousse de l’os n’empêche pas le contact avec la dure-mère.
- Préparation à l’intervention chirurgicale
- Implantation de fil périphérique
REMARQUE : Cette procédure peut être effectuée en même temps que l’implantation de la fenêtre crânienne. Il s’agit d’une procédure stérile. Pour éviter la contamination du site chirurgical ou du site crânien, des vêtements stériles doivent être portés.- Implanter des fils près du nerf cubital
- Appliquer une stimulation électrique à 5 mA sur la peau en touchant la peau au niveau de la partie distale postérieure du membre antérieur avec deux aiguilles (non pénétrantes) ou un autre morceau de métal stérile séparé de 2 cm. Recherchez une flexion nette du sabot, qui indique que le nerf passe entre ces deux points.
REMARQUE : Le membre peut avoir besoin d’être tourné vers l’arrière afin que la partie postérieure soit plus facile d’accès. - Insérez les deux aiguilles perpendiculairement au trajet du nerf à environ 2 cm l’une de l’autre. Percez à nouveau la peau à environ 3 cm du point d’insertion (Figure 4A).
- Vérifier l’emplacement à l’aide d’un stimulus d’essai appliqué sur les aiguilles à 2 mA ; Assurez-vous qu’un mouvement clair du sabot est visible.
- Passez les fils Cooner dans les aiguilles et retirez les aiguilles, en laissant les fils Cooner partiellement sous la peau. Assurez-vous que la partie non isolée au milieu du fil se trouve sous la peau des deux fils (Figure 4B).
REMARQUE : Si le membre a été tourné vers l’arrière, tournez-le soigneusement vers l’avant. - Fixez chaque connecteur crocodile à une extrémité désisolée des deux fils Cooner.
- Appliquer une stimulation électrique à 5 mA sur la peau en touchant la peau au niveau de la partie distale postérieure du membre antérieur avec deux aiguilles (non pénétrantes) ou un autre morceau de métal stérile séparé de 2 cm. Recherchez une flexion nette du sabot, qui indique que le nerf passe entre ces deux points.
- Établissement du seuil moteur
- Déterminez le seuil du moteur à l’aide de la méthode haut-bas16,17 ; commencer à 100 μA, en augmentant par pas de 50 μA, tout en observant et en ressentant une réponse motrice dans la zone du sabot. Un seuil inférieur à 1 mA est généralement réalisable.
- Programmez le STG pour fournir 100 stimuli symétriques biphasiques rectangulaires avec une largeur d’impulsion de 200 μs à 2x le seuil du moteur, suivie de 100 stimuli à 10x le seuil du moteur.
- Implanter des fils près du nerf cubital
- Enregistrement des signaux corticaux
- Demandez à un chercheur non stérile de mettre le préamplificateur en position et de le connecter au processeur de données (RZ2) à l’aide de câbles à fibres optiques.
- Réduire le sévoflurane à 0,5-1 % (la moitié de son niveau chirurgical) et surveiller la fréquence cardiaque, le CO2 expiré et la pression artérielle (si disponible) pour assurer une profondeur d’anesthésie adéquate et stable. Augmentez à la fois le propofol et le fentanyl au besoin.
- Demandez à un chercheur non stérile de fixer le foulard au préamplificateur (SI8) et de placer le pavillon (ZIF-clip) dans le support de pavillon, qui est monté sur le micromanipulateur à pied magnétique.
- Placez le drapé stérile autour du micromanipulateur et fixez la partie adhésive à la scène de tête et au support de scène de tête (Figure 5A).
- Demandez à un chercheur non stérile de fixer le micromanipulateur à l’aide du support magnétique, de tremper l’électrode μECoG dans de l’alcool et de la placer dans la scène de tête (clip ZIF).
REMARQUE : Laissez l’électrode sécher avant de la placer sur la dure-mère. Assurez-vous de ne toucher que le drapé stérile recouvrant la tête, car l’électrode μECoG n’est pas stérile. - Mettez le μECoG en place à l’aide du micromanipulateur et guidez-le avec un coton-tige. Connectez les fils de terre de l’ECoG à la vis de terre à l’aide d’un connecteur crocodile.
- Diminuez le sévoflurane à 0 %, surveillez la fréquence cardiaque, le CO2 expiré et la pression artérielle (si disponible) pour assurer une profondeur d’anesthésie adéquate et stable, augmentez à la fois le propofol et le fentanyl au besoin.
- Prévisualiser les signaux dans synapse ; la plage de signal typique est jusqu’à ±100 μV.
- Si le signal apparaît comme une ligne en gras (indiquant un bruit de ligne), demandez à une personne stérile d’effectuer les actions suivantes : examinez le circuit de mise à la terre et gardez la vis de mise à la terre et les connexions sèches et isolées des tissus voisins. Vérifiez si d’autres câbles sont isolés du corps du porc et des instruments chirurgicaux. Si ce n’est pas le cas, utilisez de la gaze stérile pour isoler le câblage du corps ou des instruments chirurgicaux.
- Si l’amplitude du signal est supérieure à ±100 μV (indication d’artefacts de mouvement), assurez-vous que l’électrode est suspendue et repose sur le cerveau et que le câblage ne bouge pas lorsque le porc se déplace en raison de la ventilation ou de la stimulation électrique du nerf cubital.
- Si l’amplitude du signal est inférieure à ± 20 mV (indiquant un mauvais contact ou une anesthésie profonde), assurez-vous que le μECoG repose sur le cerveau et que la dure-mère et l’électrode sont hydratées ; Si nécessaire, versez un peu de solution saline sur l’électrode. Assurez-vous que le sévoflurane a été désactivé et diminuez le taux de perfusion de propofol (et peut-être de fentanyl). Effectuez un test de stimulation et vérifiez si les réponses évoquées sont visibles. Assurez-vous que la partie non isolée du fil périphérique se trouve entièrement sous la peau.
REMARQUE : Les réponses évoquées peuvent généralement être distinguées en un seul balayage en ligne, mais il est également possible d’évaluer cela hors ligne, en prenant en moyenne 5 à 10 stimuli. Si un pic est visible au moment du déclenchement, il s’agit d’un artefact de stimulation. L’artefact de stimulation interfère avec l’analyse des données.
- Placez de la gaze stérile sur l’électrode pour maintenir un bon contact avec les tissus. Versez une solution saline à température corporelle sur la gaze pour éviter le dessèchement des tissus.
REMARQUE : Étant donné que ces enregistrements sont périduraux, la température exacte n’est pas essentielle. Avec les enregistrements sous-duraux, c’est plus critique. - Laissez l’électrode se stabiliser (30 min) et documentez l’emplacement de l’électrode et la configuration du connecteur de terre pour assurer des enregistrements ultérieurs similaires (Figure 5B-D). Démarrez l’enregistrement et attendez 30 s avant de commencer le programme de stimulation toutes les 10 min.
REMARQUE : Vérifiez régulièrement entre les enregistrements que la gaze sur l’électrode reste hydratée et versez une solution saline à température corporelle si nécessaire. - Effectuez une intervention après trois cycles de stimulation (pour servir de référence avant l’intervention). Répétez la stimulation pendant neuf autres tours.
REMARQUE : Continuez à vérifier régulièrement entre les enregistrements que la gaze sur l’électrode reste hydratée et versez une solution saline si nécessaire.
- Fermeture du site implantaire
- Retirez la gaze de l’électrode et retirez l’électrode à l’aide du micromanipulateur tout en la guidant doucement avec un coton-tige.
- Demandez à un chercheur non stérile de retirer et de ranger le micromanipulateur, l’électrode, la tête et le préamplificateur et de nettoyer l’électrode selon les instructions du fabricant à l’aide d’un rinçage rapide à l’eau désionisée pour éliminer les résidus de tissus. Faites tremper l’électrode jusqu’à 4 h dans un nettoyant pour lentille pour éliminer les tissus et les protéines de la surface de l’électrode, suivi d’un deuxième rinçage à l’eau désionisée pour retirer le nettoyant pour lentille de la surface de l’électrode. Avant de la ranger, trempez l’électrode dans de l’alcool isopropylique.
- Placez le capuchon de la fenêtre crânienne pour fermer la fenêtre crânienne, en vous assurant qu’il s’adapte précisément à la fenêtre crânienne. Il ne nécessite aucune fixation supplémentaire ; La pression de la peau sur l’implant le maintiendra en place.
- Placez le sac antibiotique sur le capuchon de la fenêtre crânienne et fermez la peau par voie sous-cutanée avec des sutures simples résorbables à l’aide de la technique de suture verticale enterrée du matelas (Figure 6A). Placez les sutures à une distance de 5 à 10 mm, ce qui laisse de l’espace pour placer les sutures cutanées. Ne faites pas les trois dernières sutures après les avoir placées. Au lieu de cela, attachez ces trois sutures lorsque toutes les sutures sont placées.
REMARQUE : Attacher les trois dernières sutures après les avoir placées garantit qu’il y a suffisamment d’espace pour placer les dernières sutures. - Placez des sutures intradermiques continues de manière continue dans la peau. Commencez la suture intradermique à 1 à 2 cm latéralement au site d’incision et creusez un tunnel sous la peau jusqu’à la couche dermique de la peau, mais sous sa surface (Figure 6B) pour éviter de gratter et de desserrer excessivement les sutures. Faites un nœud à l’extrémité latérale de la suture.
REMARQUE : Le propofol et le fentanyl peuvent être désactivés pendant cette procédure, car ils ont plusieurs minutes de temps de réveil. - Placez la suture continue entre les sutures sous-cutanées jusqu’à ce que l’autre côté de l’incision soit atteint.
REMARQUE : Il est important que la suture sorte dans le derme mais ne perce pas la peau afin que l’animal soit moins capable de gratter sur les sutures. - Creusez un tunnel de 1 à 2 cm sur le côté de l’incision jusqu’à un site de sortie latérale et faites un nœud (Figure 6B). Appliquez de la colle tissulaire sur le site de l’incision.
- Retour de l’animal à l’enclos
- Retirez les champs stériles de l’animal et sevrez-le du ventilateur dès qu’un mouvement est observé.
- Transférez l’animal dans l’enclos domestique et gardez-le séparé de l’enclos pendant une nuit.
REMARQUE : Les porcs sont séparés après l’opération, car il est normal qu’ils essaient violemment de réveiller le compagnon de l’enclos, ce qui entraîne des morsures. Les porcs doivent pouvoir être en contact avec le museau.
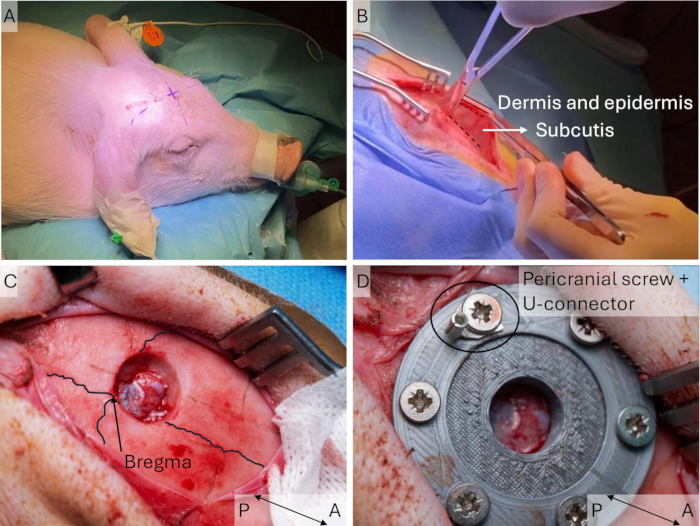
Figure 3 : Implantation de la fenêtre crânienne. (A) L’emplacement prévu du point de bregma est identifié et marqué sur le porc avant le drapage stérile, car il peut être difficile de le distinguer par la suite. (B) Après l’incision cutanée, le sous-cutané avasculaire est desserré à l’aide de ciseaux. (C) Un trou de 15 mm de diamètre est percé dans le crâne, et les bords sont enlevés à l’aide de rongeurs. Les lignes de suture coronaire et sagittale sont mises en évidence. (D) La fenêtre crânienne est implantée et fixée à l’aide de vis. Veuillez cliquer ici pour voir une version agrandie de cette figure.
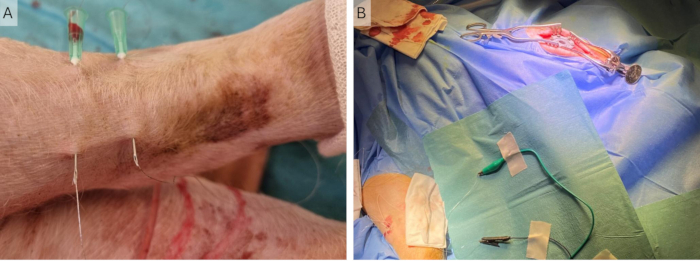
Figure 4 : Implantation de fils périphériques. (A) Deux aiguilles 23 G sont placées dans la peau et les fils Cooner sont insérés à travers celles-ci. (B) Les aiguilles sont retirées et les fils sont laissés dans la peau reliée au stimulateur à l’aide de pinces crocodiles. Veuillez cliquer ici pour voir une version agrandie de cette figure.
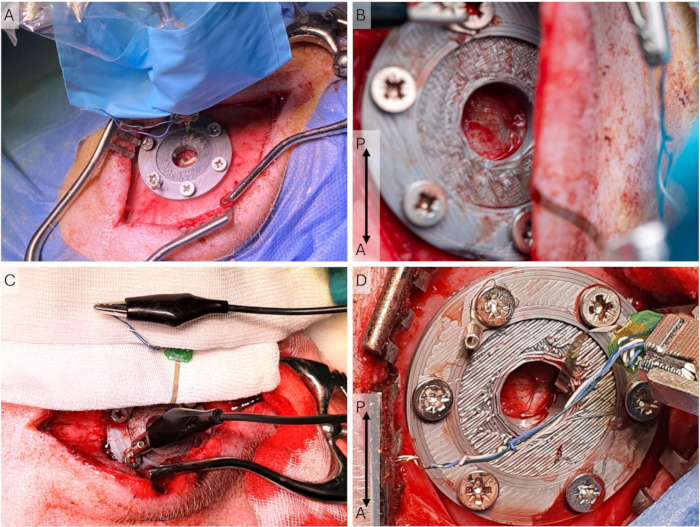
Figure 5 : Configuration de l’enregistrement cortical. (A) Le réseau d’électrodes est placé sur la dure-mère, et le support de tête et le micromanipulateur sont dans un manchon stérile lors d’une chirurgie d’implantation, où l’incision est plus longue et plus latérale. (B) Gros plan de l’ECoG dans la configuration d’enregistrement lors d’une chirurgie d’accès, où l’incision est plus médiale. (C) La configuration de mise à la terre, où tous les fils de mise à la terre et de référence de l’ECoG sont court-circuités et connectés via le connecteur en U à la vis péricrânienne. (D) Gros plan de l’étage de tête et du support de l’étage pendant une chirurgie d’accès. Le μECoG est placé sur la dure-mère. Abréviations : ECoG = électrocorticographie ; μECoG = microECoG. Veuillez cliquer ici pour voir une version agrandie de cette figure.
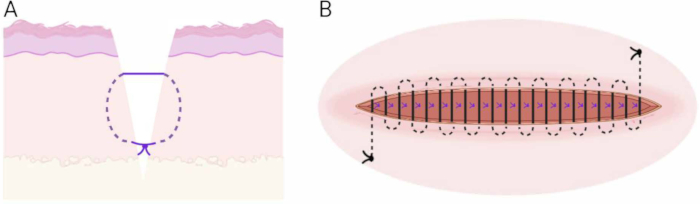
Figure 6 : Technique de suture. (A) Schéma de la technique du matelas vertical enterré sous-cutané. (B) Schéma de la technique de suture intradermique continue. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Chirurgie d’accès (phase II)
REMARQUE : Après 2 à 4 semaines, la fenêtre crânienne est ouverte pour effectuer des enregistrements de suivi des signaux corticaux du S1. L’opération et la fermeture de la plaie sont à nouveau effectuées de manière à ce que la fenêtre crânienne puisse être accessible et fermée à nouveau.
- Préparation à l’intervention chirurgicale
REMARQUE : Les étapes 2.1.1 à 2.1.6 sont similaires aux étapes 1.1.1.1 à 1.1.1.6.- tranquilliser l’animal à l’aide d’un mélange de zolétil (5 mL de zoletil [tilétamine 25 mg/mL et zolazépam 25 mg/mL], 6,25 mL de xylazine (20 mg/mL) et 2,5 mL de butorphanol (10 mg/mL)).
REMARQUE : Pour cette étude particulière, la kétamine a été omise du mélange de zoletil afin d’éviter le blocage des récepteurs NMDA. - Transportez l’animal jusqu’à la salle d’opération, intubez-le et aérez-le.
- Placez un cathéter veineux auriculaire. Administrez du propofol, du fentanyl et de la solution saline via le cathéter.
- Administrer une anesthésie chirurgicale : Sévoflurane 1-2 %, propofol (10 mg/mL perfusé à 8 mg∙kg-1∙h-1), fentanyl (50 μg/mL perfusé à 20 μg∙kg-1∙h-1).
- Si nécessaire, marquez le site d’incision à l’aide d’un marqueur stérile avant le drapage stérile. Identifiez le point de bregma en traçant des lignes droites entre chaque oreille et l’œil controlatéral ; bregma se trouve à l’intersection de ces lignes (figure 3A).
REMARQUE : L’incision initiale est généralement encore visible. La nouvelle incision doit être placée à au moins 30 mm de l’incision initiale pour éviter la majeure partie du tissu cicatriciel et faciliter la fermeture de la plaie. - Placez la plaque métallique sous les champs et assurez-vous d’un bon placement et d’une bonne stabilité avant de commencer la chirurgie.
- tranquilliser l’animal à l’aide d’un mélange de zolétil (5 mL de zoletil [tilétamine 25 mg/mL et zolazépam 25 mg/mL], 6,25 mL de xylazine (20 mg/mL) et 2,5 mL de butorphanol (10 mg/mL)).
- Accès à la fenêtre crânienne
REMARQUE : Les étapes 2.2.1 à 2.2.3 sont similaires aux étapes 1.1.2.1 à 1.1.2.3.- Faites l’incision initiale dans le derme à l’aide d’un scalpel légèrement latéral à la ligne médiane, comme indiqué à l’étape 2.1.5. Poursuivez l’incision à travers la peau avec un cautérisant.
REMARQUE : Dans le cas d’une expérience terminale, l’incision peut être faite au même endroit que l’incision d’origine. - Placez l’écarteur et maintenez la peau à l’aide d’une pince et coupez le tissu conjonctif avasculaire entre le périoste et l’sous-cutané (Figure 3B) pour donner plus de souplesse à la peau et faciliter la suture à l’étape 1.4. Ajustez l’écarteur à la flexibilité obtenue.
REMARQUE : S’il s’agit d’une expérience terminale, cette étape peut être omise. - Incisez le périoste et détarez-le du crâne à l’aide de l’élévateur de périoste. Tenez le périoste de côté à l’aide de l’écarteur.
- Retirez le capuchon de la fenêtre crânienne et retirez tout conjonctif de l’ouverture en effectuant de légers mouvements circulaires avec un coton-tige jusqu’à ce que la dure-mère soit atteinte.
- Faites l’incision initiale dans le derme à l’aide d’un scalpel légèrement latéral à la ligne médiane, comme indiqué à l’étape 2.1.5. Poursuivez l’incision à travers la peau avec un cautérisant.
- Implantation de fil périphérique
- Répétez l’étape 1.2.
- Enregistrement des signaux corticaux
- Répétez l’étape 1.3.
- Fermeture du site implantaire
- Répétez l’étape 1.4.
REMARQUE : S’il s’agit d’une expérience terminale, cette étape peut être omise.
- Répétez l’étape 1.4.
3. Chirurgie terminale (phase III)
REMARQUE : Après 2 à 4 semaines, la fenêtre crânienne est ouverte pour effectuer des enregistrements de suivi des signaux corticaux du S1. Les étapes 2.2 à 2.5 sont répétées, comme décrit ci-dessus, suivies de l’étape 3.1.
- Euthanasie
REMARQUE : Le tube du cathéter veineux de l’oreille doit être rincé avec une solution saline pour éviter l’oxydation du barbiturique.- Rincer le cathéter veineux de l’oreille avec une solution saline.
- Fixez une seringue avec la surdose de pentobarbital (10 mL, 400 mg/mL) et injectez le pentobarbital par le cathéter veineux de l’oreille.
Résultats
En utilisant la technique de la fenêtre crânienne, les signaux corticaux ont été enregistrés en 43 séances chez 16 animaux. Les animaux ont guéri de manière appropriée après l’opération et ont été logés par paires tout au long de l’étude et surveillés quotidiennement à l’aide du programme de bien-être du tableau supplémentaire S1. Tous les animaux ont reçu un score de 0 en tout temps, ce qui indique un excellent bien-être. La figure 7 montre que les fenêtres ont effectivement été placées sur la zone S1 du cortex porcin. Des cicatrices ont généralement été observées sur la dure-mère in vivo et post-mortem (Figure 7A), mais l’examen post-mortem a révélé qu’elle n’a jamais affecté le tissu cortical sous-jacent (Figure 7B), qui semblait sain chez tous les animaux et comparable à la zone S1 controlatérale.
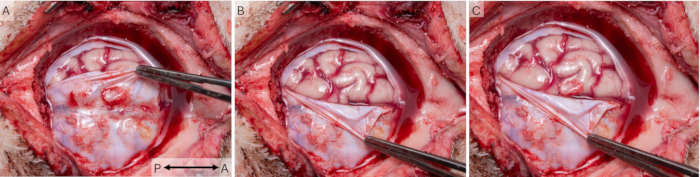
Figure 7 : Placement de la fenêtre corticale par rapport à l’anatomie du cerveau. (A) Pour étudier la santé du tissu cortical et le placement de la fenêtre corticale par rapport à S1, la fenêtre crânienne a été retirée à la fin de l’étude. Des intervalles chirurgicaux de 2 semaines ont été utilisés dans ce cas, et un peu de tissu cicatriciel peut être observé sur la dure-mère. (B) Le tissu cérébral sous-jacent semble sain et non affecté par l’implant. (C) Une superposition des deux photos montre que l’implant couvrait effectivement la zone S1 du cortex porcin. La flèche indique l’axe antéro-postérieur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
En bref, pour analyser les signaux corticaux, ils doivent être filtrés pour éliminer le bruit de ligne et d’autres artefacts (voir la figure 8 et le tableau 1). Un filtre coupe-bande est utilisé autour de la fréquence de bruit de ligne, qui est de 50 Hz en Europe et de ses harmoniques. Les signaux sont ensuite filtrés passe-haut pour éliminer les artefacts de mouvement décalés et à basse fréquence ; la fréquence de coupure maximale dépend de l’objectif des enregistrements, mais une fréquence supérieure à 5 Hz n’est pas conseillée, car cela atténuera à la fois les fonctions ERP et EEG spontanées. De plus, un filtre passe-bas est utilisé pour éliminer tout bruit à haute fréquence. Comme l’électrode est placée au-dessus de la dure-mère, les hautes fréquences sont légèrement atténuées par le tissu entre le cerveau et l’électrode18. Par conséquent, la fréquence de coupure peut être plus basse que lorsque l’électrode est située directement sur le tissu cérébral.
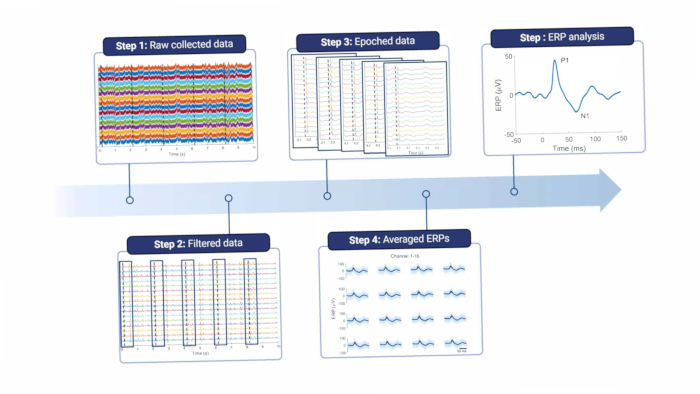
Figure 8 : Pipeline de traitement des données. Les données brutes collectées (étape 1) sont traitées par filtrage (étape 2). Ils sont ensuite divisés en époques en fonction des déclencheurs de stimulus (étape 3), dont la moyenne est calculée (étape 4). Les ERP moyens sont utilisés pour l’analyse des données (étape 5). Abréviation : ERP = event-related potentials. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Type de filtre | Seuil typique | Commande typique | Coupure d’occasion | Commande d’occasion |
| Entaille | 50±3 Hz ou 60±3 Hz | Ordre élevé | 50±3 Hz et | 10ème ordre |
| et harmoniques | harmoniques ±1 Hz | |||
| Passe-haut | 0,1 à 5 Hz | Ordre bas | 1 à 5 Hz | 2èmeordre |
| Passe-bas | 100 à 1000 Hz | Ordre bas | 300 Hz | 2èmeordre |
Tableau 1 : Propriétés typiques des filtres pour l’analyse des signaux cérébraux de surface enregistrés avec des électrodes d’électrocorticographie ou d’électroencéphalographie.
Les données filtrées sont divisées en époques de 50 à 100 ms avant et de 500 à 1 000 ms après le stimulus. Les canaux bruyants sont supprimés des données (Figure 9A) et les époques contaminées par des artefacts sont supprimées (Figure 9B). La moyenne des époques sans artefacts restantes est calculée pour chaque canal. Les réponses évoquées peuvent souvent être distinguées en un seul balayage. Celles-ci deviennent plus claires et plus cohérentes lorsqu’au moins 10 réponses sont moyennées et ne changent pas lorsque plus de 25 réponses sont moyennées. Il doit y avoir au moins 20 époques sans artefact pour obtenir une moyenne fiable. C’est généralement le cas, et dans plus de la moitié des ensembles de données, il n’était pas nécessaire de supprimer des époques. Pour faciliter la comparaison entre les ERP enregistrés au cours des différentes phases (implantation, accès, euthanasies), les données sont généralement normalisées par le z-score pour tenir compte des différences de profondeur de l’anesthésie et d’activité de fond.
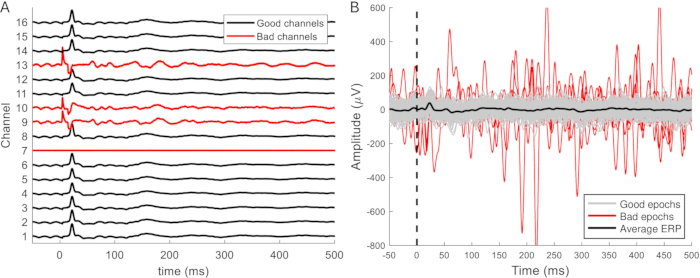
Figure 9 : Exemples de canaux et d’époques défectueux. (A) Les signaux provenant d’enregistrements épiduraux sur une zone relativement petite du cerveau ont des caractéristiques similaires mais des amplitudes différentes. Les canaux défectueux se distinguent facilement par leur absence de forme d’onde ERP. De plus, les canaux peuvent présenter des artefacts, une apparence plus bruyante et une amplitude de signal plus grande (canaux 9, 10 et 13). Le canal 7 est un autre exemple de canal défectueux et ne capte aucun signal ou bruit. (B) L’amplitude de l’PAR attendue est d’environ 100 μV. Les époques bruyantes ont généralement une amplitude plus grande, ce qui peut affecter la forme d’onde moyenne de l’PAR et doit donc être supprimée. La forme d’onde typique de l’ERP fait défaut parmi celles-ci, mais cette forme d’onde n’est pas toujours distinguable à une seule époque. Abréviation : ERP = event-related potential. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La fiabilité des ERP enregistrés à l’aide de la technique de la fenêtre crânienne était élevée en termes d’amplitudes de crête et de latence19. Aucune différence significative n’a été observée pour l’amplitude de crête (enregistrement 1 : 17,9 ± 7,26 μV ; enregistrement 2 : 17,6 ± 10,1 μV ; enregistrement 3 : 14,0 ± 6,95 μV) et la variance entre les canaux (enregistrement 1 : 6,47 ± 8,36 μV ; enregistrement 2 : 3,93 ± 6,13 μV ; enregistrement 3 : 3,84 ± 3,71 μV) dans une analyse de variance mesurée répétée (RM-ANOVA). Une différence significative a été constatée dans la latence maximale entre le premier enregistrement et les enregistrements suivants. Le pic était 1 ms plus tard dans le premier enregistrement par rapport aux enregistrements suivants (enregistrement 1 : 25,2 ± 2,0 ms ; enregistrement 2 : 24,0 ± 2,4 ms ; enregistrement 3 : 24,1 ± 2,0 ms), ce qui peut être lié au développement du système nerveux20,21, car des porcs landrace adolescents ont été utilisés dans cette étude.
La technique de la fenêtre crânienne a ensuite été utilisée pour étudier l’effet de la stimulation à haute fréquence (HFS) sur les ERP. HFS provoque une potentialisation à long terme des neurones superficiels de la corne dorsale chez les rongeurs22,23, une sensibilité accrue à la douleur et une augmentation des réponses cérébrales évoquées chez l’homme24,25. Une augmentation significative de l’amplitude du pic N1 des potentiels liés à l’événement a été observée (259 ± augmentation de 107 % par rapport à la référence avant l’intervention), et une nette différence a pu être distinguée entre les HFS et les expériences dans lesquelles aucun HFS n’a été appliqué sur le même animal (Figure 10)17.
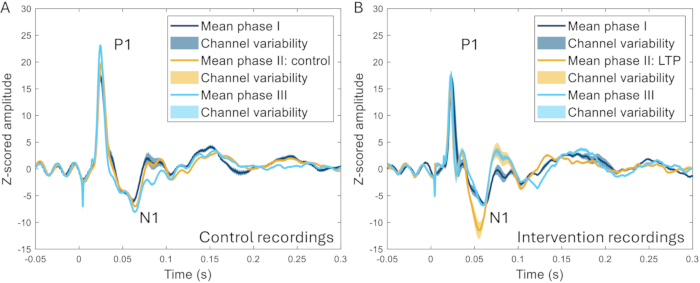
Figure 10 : Exemples de PRE moyennés sur tous les canaux enregistrés 2 à 3 semaines avant, pendant et 2 à 3 semaines après l’induction d’un modèle de douleur. (A) Les PRE prélevés sur le même animal lors de trois enregistrements différents à 2 semaines d’intervalle présentent des caractéristiques très similaires. (B) Les ERP ont des caractéristiques similaires entre les enregistrements, mais le N1 a une plus grande amplitude après l’induction de la potentialisation à long terme dans la phase II par rapport aux autres phases qui se situent 3-4 semaines avant et après la phase II. Les zones ombrées indiquent l’écart type entre les canaux. Abréviations : ERP = potentiels liés aux événements ; LTP = potentialisation à long terme. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau supplémentaire S1 : Programme de bien-être pour évaluer le comportement solitaire et social des porcs. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
L’importance du développement de cette technique réside dans l’élimination des modes de défaillance des électrodes, la réduction des réponses tissulaires et l’amélioration ainsi de la fiabilité des techniques d’enregistrement corticale invasives. Aucun mode de défaillance des électrodes ne s’est produit au cours de l’étude, et un total de deux réseaux ECoG ont été utilisés tout au long de l’étude, y compris 16 animaux et 43 sessions d’enregistrement. Cela a un impact positif supplémentaire sur l’économie de la recherche. En utilisant des méthodes traditionnelles entièrement implantées 12,26,27, au moins 16 réseaux ECoG seraient nécessaires en supposant qu’aucune défaillance du dispositif ne se produise. Cependant, les modes d’échec et les réponses tissulaires continuent de poser des défis importants à la mise en œuvre généralisée de l’enregistrement cérébral intracrânien 11,12,13,28,29. Cette étude a considérablement réduit le nombre d’électrodes, réduisant ainsi à la fois le coût et le risque des études en neurosciences chroniques.
Le seul événement indésirable qui s’est produit avec les implants de fenêtre crânienne sont des infections occasionnelles dans les premières chirurgies. Ces infections étaient toujours superficielles (n’atteignant pas le niveau de la dure-mère) et étaient résolues par l’implantation d’une éponge antibiotique résorbable Genta-coll. En raison de l’efficacité de ce traitement, l’implantation de l’éponge antibiotique a été adoptée dans le cadre de l’implantation de la fenêtre crânienne à titre préventif. Bien que les porcs soient des animaux forts qui ont un comportement d’enracinement, aucun des implants en PLA standard n’a été cassé.
Toutes les électrodes implantées sont soumises à une réponse de corps étranger et à une encapsulation gliale ou fibreuse 14,15,28,29,30. Cela signifie que l’interface électrode-tissu, ainsi que la capacité d’enregistrement de l’électrode, changent avec le temps après l’implantation 13,18,28. En utilisant la méthode actuelle, les réponses tissulaires n’ont pas affecté l’intégrité et la fidélité d’enregistrement des électrodes en raison de la stratégie de placement temporaire des électrodes. L’électrode a été placée sur la dure-mère lors de chaque séance, et l’interface électrode-tissu était donc comparable lors de chaque séance. Le seul facteur qui aurait pu légèrement différer d’une séance à l’autre est la position de l’électrode. Il est donc crucial d’adapter la taille de la fenêtre à la taille de l’électrode et de prendre des photos de l’emplacement de l’électrode lors de chaque session d’enregistrement. Grâce à ces efforts, des ERP hautement fiables et reproductibles ont étéenregistrés19.
Une réponse tissulaire à l’implant de la fenêtre crânienne s’est produite, et une repousse osseuse a été observée chez les premiers pilotes utilisant une fenêtre transcrânienne sans parois s’étendant de la surface externe du crâne à la dure-mère. Une couche continue de tissu osseux mou a été trouvée 2 semaines après la première séance, indiquant une repousse osseuse. Il était impossible d’enlever ce tissu et d’accéder à la dure-mère ; Par conséquent, des parois verticales s’étendant de la surface du crâne à la dure-mère31 ont été ajoutées à la fenêtre crânienne. Des fenêtres avec différentes longueurs de paroi ont été imprimées pour correspondre l’implant à l’épaisseur du crâne afin d’éviter la pression sur le cortex. Les animaux ont été étudiés après l’euthanasie, ce qui a révélé des tissus cérébraux d’apparence saine chez tous les animaux. Des tissus mous se forment encore dans la zone de la fenêtre ; Cependant, il ne se fixe pas au mur et n’est pas continu avec le crâne, ce qui le rend facile à retirer à l’aide d’un coton-tige. Il est essentiel pour la fiabilité des enregistrements que ce tissu mou soit retiré de la fenêtre afin que l’électrode soit placée sur la dure-mère à chaque fois.
Des résultats optimaux sont obtenus avec au moins 3 semaines entre les chirurgies. À 2 semaines, la fenêtre crânienne est accessible, mais les tissus mous de la zone de la fenêtre sont attachés à la dure-mère. De plus, l’ouverture et la fermeture de la plaie sont compliquées par des saignements et un manque de flexibilité des tissus. À 3 et 4 semaines, la plaie d’incision a suffisamment cicatrisé pour que les limites tissulaires normales (par exemple, le périoste, la peau, la dure-mère) soient distinctes, ce qui facilite le retrait des tissus mous de la fenêtre et la refermeture de la peau sur l’implant. Étant donné qu’aucun tissu osseux n’a été observé à 4 semaines d’intervalle, il peut être possible d’espacer plus de 4 semaines entre les chirurgies et les chirurgies à accès multiple. Nous n’avons pas cherché à savoir si la période entre les interventions chirurgicales pouvait être prolongée à plusieurs mois.
Pour le succès des chirurgies d’implant et d’accès, l’incision initiale et la fermeture de la plaie sont essentielles. La flexibilité de la peau du front du porc est très limitée, c’est pourquoi il est essentiel de desserrer la couche sous-cutanée avasculaire de la peau. Cela offre une flexibilité supplémentaire pour fermer la peau sur l’implant et réduit le stress sur les sutures. Ce stress est encore réduit par l’utilisation de deux couches de sutures et de colle cutanée supplémentaire. La peau est suturée à l’aide d’une technique de suture intradermique continue pour éviter que les animaux ne grattent les plaies et ne retirent prématurément les sutures. Les stratégies d’ouverture et de fermeture de la plaie sont essentielles dans les deux types de chirurgie de survie, qu’il s’agisse d’un implant ou d’une chirurgie d’accès.
Une limite de l’approche actuelle est que l’accès à la fenêtre nécessite une intervention chirurgicale mineure, ce qui empêche les enregistrements chez les animaux éveillés. Cela signifie que, selon la question de recherche, il ne s’agira pas d’une approche adaptée à toutes les études. Pour les dispositifs entièrement implantés à utiliser dans les enregistrements éveillés, d’autres méthodes existent pour surmonter les changements biologiques à l’interface32. Étant donné que l’accès à la fenêtre crânienne est une petite procédure, il peut être possible d’utiliser un anesthésique local et un sédatif plutôt qu’une anesthésie générale. Les avantages de la fenêtre crânienne entièrement sous la peau sont la réduction des risques d’infection et l’amélioration du bien-être des animaux, car les animaux peuvent être logés en couple ou en groupe. De plus, nous n’avons étudié que la fiabilité des réponses évoquées19. Cependant, l’activité cérébrale spontanée a été enregistrée et est généralement plus fiable et reproductible que l’ERP8, ce qui indique que la méthode ne se limite pas à l’enregistrement de l’ERP.
Notre méthode présente une méthode nouvelle, évolutive, fiable et reproductible pour les enregistrements corticaux chroniques. Cette méthode est très précieuse pour les études de recherche en neurosciences, où la fiabilité et la reproductibilité sont essentielles au résultat des études33,34. Nous avons utilisé la méthode pour étudier les réponses évoquées corticales de S1 avant et après l’induction de différents modèles de douleur et de contrôles, montrant des résultats robustes17. En général, la méthode peut facilement être adaptée pour accéder à d’autres zones corticales, par exemple pour étudier le mouvement, l’audition ou la vision. Il peut également être possible d’utiliser la méthode pour le diagnostic de l’épilepsie 4,35 ou de surveiller le traitement et la réadaptation après une lésion cérébrale36,37.
La méthode est également adaptable à d’autres espèces, comme les primates non humains ou d’autres mammifères, les chats, les chiens ou les moutons 35,38,39. Chacune de ces adaptations nécessitera d’ajuster la technique chirurgicale, d’identifier des points de repère fiables pour le placement des fenêtres crâniennes et d’ajuster sa conception. Les auteurs recommandent l’utilisation de cadavres pour optimiser la technique de la fenêtre crânienne avant de procéder à des essais pilotes. Pour certaines zones du cerveau, la chirurgie peut être plus invasive, ce qui peut entraîner un temps de récupération optimal différent de celui que nous recommandons. En outre, la technique peut être adaptée pour permettre des enregistrements ECoG sous-duraux et des enregistrements intracorticaux, élargissant ainsi ses applications et augmentant l’accès à diverses régions du cerveau. En raison de l’épaisseur du crâne porcin, il peut être nécessaire d’augmenter la taille de la fenêtre corticale pour effectuer la durotomie pour les enregistrements sous-duraux26,27.
Pour les enregistrements intracorticaux, il est possible de placer l’électrode à l’aide d’une canule ou d’une navette40, ce qui permet de réduire encore la taille de la fenêtre corticale. Les techniques sous-durales et intracrâniennes augmenteront le risque de saignement, il faut donc veiller à éviter les vaisseaux sanguins pendant la chirurgie. La technique de la fenêtre crânienne peut également être utilisée à des fins autres que l’enregistrement de signaux électriques du cerveau, par exemple, l’imagerie du système vasculaire, qui est très pertinente dans les modèles porcins de migraine41. De plus, la méthode de la fenêtre crânienne peut être adaptée pour être utilisée en combinaison avec de nouvelles techniques d’imagerie31, comme l’imagerie à 2 photons, et peut être combinée avec le substitut dural développé par Costine-Bartell et al. pour une meilleure résolution optique42.
En conclusion, l’approche méthodologique présentée réduit les risques liés à un implant permanent 12,13 en éliminant le risque de défaillance du dispositif, en minimisant les réponses biologiques au site de l’électrode et, par conséquent, en augmentant la fidélité de l’enregistrement et en obtenant des enregistrements corticaux hautement fiables. La méthodologie est également très prometteuse pour d’autres applications, car elle est adaptable à d’autres espèces et types d’enregistrement.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Les auteurs tiennent à remercier les soigneurs et les techniciens de l’animalerie de laboratoire de l’hôpital universitaire d’Aalborg. Le Centre pour la neuroplasticité et la douleur (CNAP) est soutenu par la Fondation nationale danoise pour la recherche (DNRF121). Les figures 6 et 8 ont été créées dans BioRender.
matériels
| Name | Company | Catalog Number | Comments |
| Cranial window implantation | |||
| Scalpel | disposable, blade 10 | ||
| Tweezers | |||
| Gauze | |||
| Cauterizer | |||
| Periosteum elevator | flat, 10 mm width | ||
| Weitlaner retractor | 3 x 4 prong, blunt, 16.5 cm | ||
| Midas Rex Legend EHS stylus surgical drill system | Medtronic Powered Surgical Solutions, Fort Worth, USA | ||
| Legend Ball Fine drill bits | Medtronic Powered Surgical Solutions, Fort Worth, USA | 7BA40F-MN and 7BA60F-MN | MedNext type 4 and 6 mm head diameter |
| Sterile cover for the drill | |||
| Syringe | 5 mL | ||
| Saline | |||
| Suction | |||
| Ruler | |||
| Cotton buds | |||
| Rongeur | straight jaw, 15 cm, 3 x 20 mm bit size | ||
| 2.5 mm hand drill and handle | |||
| Butterfly infusion set | |||
| Six M3 screws in 6-14 mm length | |||
| Screwdriver | |||
| Three sizes of 3D-printed cranial window (4-, 5- and 6-mm depth) and cap | |||
| Deisolated U-shaped connector | |||
| Crocodile connector | |||
| Genta-coll resorbable antibiotic sponge | |||
| VYCRIL resorbable suture | Ethicon | 2-0 26 mm round bodied | |
| Monocryl non-resorbable suture | Ethicon | 3-0 24 mm reverse cutting | |
| Needle holder | |||
| Scissors | |||
| Topical adhesive tissue glue | Leukosan | ||
| Peripheral wire implantation | |||
| Two partially uninsulated Cooner wires | |||
| NOTE: 1-2 cm of the wires is uninsulated in the middle and at one of the ends | |||
| Two 23 G needles | |||
| Gauze | |||
| Programmable stimulator controlled by a PC running MC_stimulus | Multichannel Systems, Reutlingen, Germany | STG4008 | |
| Two crocodile connectors | |||
| Cortical recordings | |||
| Metal plate for the magnetic micromanipulator | |||
| Magnetic micromanipulator stand | |||
| Micromanipulator | |||
| Headstage holder | |||
| 32-channel ZIF-clip headstage | TDT, Alachua, FL, USA | ||
| 32-channel micro-electrocorticography (µECoG) array | Neuronexus, Ann Arbor, USA | E32-1000-30-200 | |
| TDT recording equipment including pre-amplifier SI8, data processor RZ2 and workstation WS8 | TDT, Alachua, FL, USA |
Références
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon