Method Article
Técnica de ventana craneal crónica para registros corticales repetidos durante la anestesia en cerdos
En este artículo
Resumen
Este estudio presenta un método escalable, confiable y reproducible para registros corticales crónicos repetidos en un modelo porcino. El método tiene aplicaciones en varios campos de la neurociencia, incluida la investigación del dolor y el diagnóstico de enfermedades neurológicas.
Resumen
Las grabaciones corticales son esenciales para extraer señales neuronales para informar diversas aplicaciones, incluidas las interfaces cerebro-computadora y el diagnóstico de enfermedades. Cada aplicación impone requisitos específicos a la técnica de grabación, y a menudo se seleccionan soluciones invasivas para grabaciones a largo plazo. Sin embargo, los métodos de registro invasivos se ven desafiados por el fallo del dispositivo y las respuestas adversas de los tejidos, que comprometen la calidad de la señal a largo plazo.
Para mejorar la fiabilidad y la calidad de los registros corticales crónicos y, al mismo tiempo, minimizar los riesgos relacionados con el fallo del dispositivo y las reacciones tisulares, desarrollamos una técnica de ventana craneal. En este protocolo, reportamos métodos para implantar y acceder a una ventana craneal en cerdos juveniles de raza autóctona, lo que facilita la colocación de matrices de electrocorticografía temporal (ECoG) en la duramadre. Describimos con más detalle cómo se pueden registrar las señales corticales utilizando la técnica de la ventana craneal. El acceso a la ventana craneal se puede repetir varias veces, pero se recomienda un mínimo de 2 semanas entre las cirugías de implante y de acceso para facilitar la recuperación y la cicatrización de los tejidos.
El enfoque de la ventana craneal minimizó con éxito los modos comunes de falla de los electrodos y las respuestas de los tejidos, lo que resultó en registros corticales estables y confiables a lo largo del tiempo. Registramos potenciales relacionados con eventos (ERP) de la corteza somatosensorial primaria como ejemplo. El método proporcionó registros altamente confiables, que también permitieron evaluar el efecto de una intervención (estimulación de alta frecuencia) en los ERPs. La ausencia de fallos significativos en los dispositivos y la reducción del número de electrodos utilizados (dos electrodos, 43 sesiones de registro, 16 animales) sugieren una mejor economía de la investigación. Si bien se requiere un acceso quirúrgico menor para la colocación de electrodos, el método ofrece ventajas como la reducción del riesgo de infección y la mejora del bienestar animal.
Este estudio presenta un método escalable, fiable y reproducible para los registros corticales crónicos, con aplicaciones potenciales en diversos campos de la neurociencia, incluida la investigación del dolor y el diagnóstico de enfermedades neurológicas. Las adaptaciones futuras pueden extender su uso a otras especies y modalidades de registro, como los registros intracorticales y las técnicas de imagen.
Introducción
En general, el propósito de las grabaciones corticales es extraer información de la señalización neuronal en el cerebro. Esta información se puede utilizar de varias maneras: control de un dispositivo externo, comunicación, diagnóstico de enfermedades o rehabilitación 1,2,3,4. Cada aplicación establece requisitos únicos sobre el contenido de la información y la resolución espacial requerida y la cantidad de invasividad que se considera aceptable. Por lo tanto, desde el descubrimiento del electroencefalograma en 1929 se han desarrollado soluciones de registro con un rango de invasividad y resolución espacial5.
Por lo general, se pueden dividir en electroencefalografía (EEG), electrocorticografía (ECoG) y registros intracorticales. El EEG es un método de registro no invasivo que captura las oscilaciones neuronales y los potenciales relacionados con eventos (ERP) de todo el cerebro. Sin embargo, su capacidad para definir las fuentes de esta actividad es limitada debido a su baja resolución espacial. La ECoG es un método más invasivo en el que los electrodos se colocan por vía epil o subdural, normalmente cubriendo una porción más pequeña de la corteza. Tiene una resolución espacial más alta y puede registrar ERP y potenciales de campo local de superficie (LFP). Por lo tanto, puede localizar la fuente de actividad cerebral con mayor precisión, lo que lo hace útil, por ejemplo, para identificar el origen de la epilepsia focal. El registro intracortical es el método de registro más invasivo y puede registrar la actividad de picos de las neuronas individuales ubicadas superficial o profundamente dentro del cerebro y el LFP del volumen de las neuronas alrededor de los electrodos. Estas señales tienen una resolución espacial y un contenido de información muy altos, pero son producidas por un subconjunto restringido de neuronas (1-10 neuronas por canal)6.
Para extraer información del cerebro durante períodos prolongados (meses-años), la interfaz debe ser estable y confiable para que las señales adquiridas continúen representando la misma información durante todo el período. Los registros de EEG requieren cambios frecuentes de electrodos, lo que hace que su fiabilidad sea variable de muy baja a muy alta 7,8,9,10. Por lo tanto, a menudo se seleccionan los métodos ECoG e intracorticales para registros prolongados. Sin embargo, estos métodos requieren que la condición del electrodo de registro, así como el tejido, permanezcan estables a lo largo del tiempo. Si bien el electrodo generalmente permanece en el mismo lugar, la interfaz electrodo-tejido puede cambiar debido a reacciones tisulares o modos de falla del electrodo 11,12,13,14. Las reacciones tisulares incluyen muerte neuronal, hemorragia, bioincrustación, reacción a cuerpo extraño, gliosis, encapsulación, infección, meningitis y extrusión meníngea15. Estas reacciones comprometen la capacidad de registro de los electrodos 12,13. Los modos comunes de falla de los electrodos son la delaminación o fuga en las partes aisladas, la delaminación o el agrietamiento del recubrimiento de la superficie del electrodo, el daño del cable y la dislocación del electrodo11,12.
Para superar los modos de falla de los electrodos, consideramos la viabilidad de una solución de colocación temporal de electrodos que también aborda muchos de los desafíos relacionados con las respuestas de los tejidos, a saber, la muerte neuronal, la reacción a cuerpos extraños, la gliosis, la encapsulación y la extrusión meníngea. Además, la colocación constante de los electrodos era un requisito para lograr registros neuronales fiables y reproducibles. Dado que el electrodo se colocó por vía epidural a una distancia de unos pocos milímetros del tejido nervioso, el movimiento del electrodo no debe exceder 1 mm. La ventana craneal se diseñó con dimensiones para evitar un movimiento excesivo entre las colocaciones de los electrodos. Con el desarrollo de la técnica de ventana craneal, nuestro objetivo es mejorar la fiabilidad y la calidad de la señal a largo plazo y eliminar el riesgo de fallo del electrodo.
Protocolo
Este protocolo ha sido aprobado por la Administración Veterinaria y Alimentaria de Dinamarca dependiente del Ministerio de Alimentación, Agricultura y Pesca de Dinamarca (número de protocolo 2020-15-0201-00514). Un total de 16 cerdos hembras de raza autóctona se han sometido a los procedimientos. Los animales pesaban aproximadamente 20 kg a su llegada a las instalaciones, lo que significa que tenían aproximadamente 2 meses de edad. Pesaban alrededor de 30 kg al momento de la implantación y de 40 a 60 kg al final del estudio. Los procedimientos consisten en cirugía de implantación, cirugía de acceso y cirugía terminal (Figura 1).
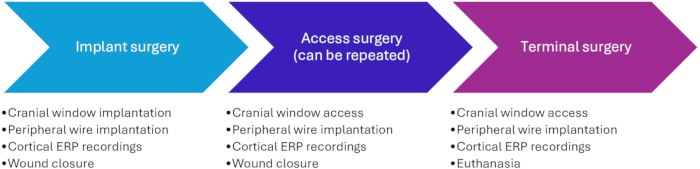
Figura 1: Cronología de los procedimientos experimentales. La cirugía de acceso (Fase II) puede repetirse varias veces. Se aconseja una separación de al menos 2 semanas entre cirugías para la recuperación y la cicatrización de heridas entre cirugías. Abreviatura: ERP = potencial relacionado con eventos. Haga clic aquí para ver una versión más grande de esta figura.
1. Cirugía de implantación (Fase I)
NOTA: Se implanta una ventana craneal de ácido poliláctico (PLA) impresa en 3D (Figura 2) para facilitar las grabaciones repetidas de la corteza somatosensorial primaria del cerdo. Se registran las ERPs debidas a la estimulación eléctrica del nervio cubital. La cirugía y el cierre de la herida se realizan para poder acceder a la ventana craneal y cerrarla posteriormente.

Figura 2: Diseño de la ventana craneal. (A) Vista lateral de la ventana craneal que indica la altura de las paredes y la base que se sujeta al cráneo. (B) Vista superior que indica el diámetro de la viuda craneal, los orificios de los tornillos, el espacio de la tapa y la ventana. La tapa de la ventana craneal es un cilindro de 22 mm de diámetro con una altura de 1 mm que encaja con precisión en el espacio de la tapa. Haga clic aquí para ver una versión más grande de esta figura.
- Implante de ventana craneal
- Preparación para la cirugía
NOTA: El procesador de datos (RZ2), la estación de trabajo (WS8) y el PC se encienden antes de comenzar la cirugía. Las notas de la cirugía se toman en una hoja de cálculo al menos cada 15 minutos por un investigador no estéril para documentar los signos vitales (frecuencia cardíaca,spO2, CO2 al final de la espiración, temperatura central), los niveles de anestesia (tasa de infusión de propofol, tasa de infusión de fentanilo, porcentaje de sevoflurano), la etapa de la cirugía y cualquier irregularidad.- Tranquilizar al animal con una inyección intramuscular de 5-7 mL de mezcla de Zoletil (1 mL contenía 8,3 mg de tiletamina, 8,3 mg de Zolazepam, 8,3 mg de Xilacina y 1,7 mg de Butophanol).
NOTA: Para este estudio en particular, se omitió la ketamina de la mezcla de Zoletil para evitar el bloqueo de los receptores NMDA. - Transporta al animal a la sala de cirugía. Intubar al animal y conectarlo a un ventilador mecánico.
- Colocar un catéter en las venas del oído para administrar propofol, fentanilo y solución salina.
- Administrar anestesia quirúrgica: Sevoflurano 1-2%, propofol (10 mg/mL infundido a 8 mg∙kg-1∙h-1), fentanilo (50 μg/mL infundido a 20 μg∙kg-1∙h-1).
- Marque el sitio de la incisión con un marcador estéril antes de colocar el paño estéril. Identifique el punto bregma dibujando líneas rectas entre cada oreja y el ojo contralateral; el punto bregma está en la intersección de esas líneas (Figura 3A). Asegúrese de que la incisión sea ligeramente lateral a la línea media en el lado contralateral a la extremidad anterior estimulada.
- Coloque la placa de metal debajo de las cortinas y asegure la colocación y estabilidad adecuadas antes de comenzar la cirugía.
- Tranquilizar al animal con una inyección intramuscular de 5-7 mL de mezcla de Zoletil (1 mL contenía 8,3 mg de tiletamina, 8,3 mg de Zolazepam, 8,3 mg de Xilacina y 1,7 mg de Butophanol).
- Acceso al cráneo
NOTA: En esta y en las siguientes partes del protocolo, todos los procedimientos son realizados por un cirujano estéril a menos que se indique lo contrario.- Realice la incisión inicial en la dermis con un bisturí ligeramente lateral a la línea media, como se indica en el paso 1.1.1.5. Continúe la incisión a través de la piel con un cauterizador.
NOTA: No extienda la incisión demasiado hacia delante para evitar los grandes senos frontales del cerdo. Si se necesita más espacio, extienda la incisión en el lado posterior. - Coloque el retractor y sostenga la piel con pinzas y corte el tejido conectivo avascular entre el periostio y el subcutis (Figura 3B) para proporcionar más flexibilidad a la piel y facilitar la sutura en el paso 1.4. Ajuste el retractor a la flexibilidad que se obtuvo.
- Incide el periostio y afloja del cráneo con un elevador de periostio. Sostenga el periostio a un lado con el retractor.
- Realice la incisión inicial en la dermis con un bisturí ligeramente lateral a la línea media, como se indica en el paso 1.1.1.5. Continúe la incisión a través de la piel con un cauterizador.
- Acceso a la duramadre
- Taladre un orificio de 10 mm de diámetro frontal a la línea de sutura sagital y lateral a la sutura de la línea media (Figura 3C). Comience con un diámetro de 15 mm para lograr un orificio de 10 mm de diámetro a nivel de duramadre, ya que la broca redondeada dará como resultado un orificio ligeramente cónico.
- Coloque la ventana craneal en el orificio desde el principio para garantizar un buen ajuste.
- Cambie a una broca más pequeña cuando la duramadre se haga visible para lograr el ancho máximo del orificio al nivel de la duramadre. Recorta los bordes con Rongeurs.
- Implante de ventana craneal
- Confirme que la ventana craneal encaja dentro y hasta el fondo del agujero y decida su profundidad. Aunque esto depende del animal, asegúrese de que las paredes de la ventana craneal lleguen a la duramadre para un buen ajuste, pero no ejerza presión sobre el cerebro en ningún lugar.
- Marque los orificios de los tornillos con el taladro manual mientras sostiene la ventana craneal en su lugar.
- Retire la ventana craneal y perfore los agujeros al menos 4 mm de profundidad. Penetra en el cráneo para que uno de los tornillos lo use como tierra/referencia para las grabaciones corticales.
- Coloque la ventana craneal (Figura 3) y retire la aguja del equipo de infusión de mariposa. Mida la profundidad de los orificios de los tornillos a través de la ventana craneal con la mariposa roma. Inserte y apriete un tornillo con una longitud correspondiente en el orificio.
NOTA: Un tornillo demasiado largo no podrá sujetar la tapa de la ventana craneal de manera efectiva. - Coloque un conector en U debajo de un tornillo que perfora el cráneo y toca la duramadre.
NOTA: Es importante que la longitud de este tornillo sea mayor que el grosor del cráneo para que el hueso que vuelve a crecer no impida el contacto con la duramadre.
- Preparación para la cirugía
- Implantación de alambre periférico
NOTA: Este procedimiento se puede realizar simultáneamente con la implantación de la ventana craneal. Este es un procedimiento estéril. Para evitar la contaminación del sitio quirúrgico o del sitio craneal, se debe usar ropa estéril.- Implantar cables cerca del nervio cubital
- Aplicar estimulación eléctrica a 5 mA sobre la piel tocando la piel en la parte distal posterior de la extremidad anterior con dos agujas (no penetrantes) u otra pieza metálica estéril separada por 2 cm. Busca una flexión clara de la pezuña, lo que indica que el nervio corre entre estos dos puntos.
NOTA: Es posible que sea necesario rotar la extremidad hacia atrás para que sea más fácil acceder a la parte posterior. - Inserte las dos agujas perpendiculares al curso del nervio a una distancia aproximada de 2 cm. Vuelva a perforar la piel aproximadamente a 3 cm del punto de inserción (Figura 4A).
- Verificar la ubicación utilizando un estímulo de prueba aplicado a las agujas a 2 mA; Asegúrese de que se vea un movimiento claro de la pezuña.
- Pase los alambres de Cooner a través de las agujas y retire las agujas, dejando los alambres de Cooner parcialmente debajo de la piel. Asegúrese de que la parte no aislada en el medio del cable esté debajo de la piel de ambos cables (Figura 4B).
NOTA: Si la extremidad se giró hacia atrás, gírela con cuidado hacia adelante. - Conecte cada conector de cocodrilo a un extremo desaislado de los dos cables Cooner.
- Aplicar estimulación eléctrica a 5 mA sobre la piel tocando la piel en la parte distal posterior de la extremidad anterior con dos agujas (no penetrantes) u otra pieza metálica estéril separada por 2 cm. Busca una flexión clara de la pezuña, lo que indica que el nervio corre entre estos dos puntos.
- Establecimiento del umbral motor
- Encuentre el umbral del motor usando el método arriba-abajo 16,17; comience a 100 μA, aumentando con pasos de 50 μA, mientras observa y siente una respuesta motora en el área del casco. Por lo general, es factible un umbral por debajo de 1 mA.
- Programe el STG para proporcionar 100 estímulos simétricos bifásicos rectangulares con un ancho de pulso de 200 μs a 2 veces el umbral motor seguido de 100 estímulos a 10 veces el umbral motor.
- Implantar cables cerca del nervio cubital
- Registro de señales corticales
- Pida a un investigador no estéril que coloque el preamplificador en su posición y lo conecte al procesador de datos (RZ2) mediante cables de fibra óptica.
- Disminuya el sevoflurano a 0.5-1% (la mitad de su nivel quirúrgico) y controle la frecuencia cardíaca, el CO2 espirado y la presión arterial (si está disponible) para garantizar una profundidad de anestesia adecuada y estable. Aumente tanto el propofol como el fentanilo según sea necesario.
- Pida a un investigador no estéril que conecte la platina al preamplificador (SI8) y coloque la platina (ZIF-clip) en el soporte de la cabecera, que está montado en el micromanipulador de soporte magnético.
- Coloque el paño estéril alrededor del micromanipulador y fije la pieza adhesiva a la cabecera y al soporte de la cabecera (Figura 5A).
- Pida a un investigador no estéril que asegure el micromanipulador con el soporte magnético, sumerja el electrodo μECoG en alcohol y colóquelo en la cabecera (ZIF-clip).
NOTA: Deje que el electrodo se seque antes de colocarlo en la duramadre. Asegúrese de tocar solo el paño estéril que cubre la cabecera, ya que el electrodo μECoG no es estéril. - Coloque el μECoG en su lugar con el micromanipulador y guíe con un bastoncillo de algodón. Conecte los cables de tierra del μECoG al tornillo de tierra con un conector de cocodrilo.
- Disminuya el sevoflurano al 0%, controle la frecuencia cardíaca, el CO 2 espirado y la presión arterial (si está disponible) para garantizar una profundidad de anestesia adecuada y estable, aumente tanto el propofol como el fentanilo según sea necesario.
- Vista previa de las señales en la sinapsis; el rango de señal típico es de hasta ±100 μV.
- Si la señal aparece como una línea en negrita (indicativo de ruido de línea), pídale a una persona estéril que realice las siguientes acciones: investigue los circuitos de conexión a tierra y mantenga el tornillo de conexión a tierra y las conexiones secos y aislados de los tejidos cercanos. Investigue si hay otro cableado aislado del cuerpo del cerdo y de los instrumentos quirúrgicos. De lo contrario, use gasa estéril para aislar el cableado del cuerpo o de los instrumentos quirúrgicos.
- Si la amplitud de la señal es superior a ±100 μV (indicativo de artefactos de movimiento), asegúrese de que el electrodo esté suspendido y descanse en el cerebro y que el cableado no se mueva cuando el cerdo se mueva debido a la ventilación o la estimulación eléctrica del nervio cubital.
- Si la amplitud de la señal es inferior a ± 20 mV (indicativo de un mal contacto o de una anestesia profunda), asegúrese de que la μECoG descanse en el cerebro y que la duramadre y el electrodo estén hidratados; Si es necesario, gotee un poco de solución salina en el electrodo. Asegúrese de que el sevoflurano se haya desactivado y disminuya la velocidad de infusión de propofol (y posiblemente fentanilo). Realice una prueba de estimulación y compruebe si las respuestas evocadas son visibles. Asegúrese de que la parte no aislada del cable periférico esté completamente debajo de la piel.
NOTA: Las respuestas evocadas generalmente se pueden distinguir en barridos individuales en línea, pero también es posible evaluar esto fuera de línea, tomando un promedio de 5 a 10 estímulos. Si un pico es visible en el momento del desencadenante, es un artefacto de estimulación. El artefacto de estimulación interferirá con el análisis de datos.
- Coloque una gasa estéril en el electrodo para mantener un buen contacto con el tejido. Gotee solución salina a temperatura corporal sobre la gasa para evitar que el tejido se seque.
NOTA: Dado que estos registros son epidurales, la temperatura exacta no es esencial. En el caso de las grabaciones subdurales, esto es más crítico. - Permita que el electrodo se asiente (30 min) y documente la ubicación del electrodo y la configuración del conector de tierra para garantizar registros posteriores similares (Figura 5B-D). Comience a grabar y espere 30 s antes de comenzar el programa de estimulación cada 10 min.
NOTA: Verifique regularmente entre registros que la gasa del electrodo permanezca hidratada y gotee solución salina a temperatura corporal si es necesario. - Realizar una intervención después de tres rondas de estimulación (para que sirva como referencia previa a la intervención). Repita la estimulación durante otras nueve rondas.
NOTA: Continúe verificando regularmente entre grabaciones que la gasa del electrodo permanezca hidratada y gotee solución salina si es necesario.
- Cierre del sitio del implante
- Retire la gasa del electrodo y retire el electrodo con el micromanipulador mientras lo guía suavemente con un bastoncillo de algodón.
- Pida a un investigador no estéril que retire y almacene el micromanipulador, el electrodo, la cabecera y el preamplificador, y que limpie el electrodo de acuerdo con las instrucciones del fabricante utilizando un enjuague rápido con agua desionizada para eliminar los residuos de tejido. Remoje el electrodo durante un máximo de 4 horas en un limpiador de lentes para eliminar el tejido y las proteínas de la superficie del electrodo, seguido de un segundo enjuague con agua desionizada para eliminar el limpiador de lentes de la superficie del electrodo. Antes de guardarlo, sumerja el electrodo en alcohol isopropílico.
- Coloque la tapa de la ventana craneal para cerrar la ventana craneal, asegurándose de que encaje con precisión en la ventana craneal. No requiere fijación adicional; La presión de la piel sobre el implante lo mantendrá en su lugar.
- Coloque la bolsa de antibiótico encima de la tapa de la ventana craneal y cierre la piel por vía subcutánea con suturas reabsorbibles individuales mediante la técnica de sutura vertical enterrada en colchón (Figura 6A). Colocar las suturas a una distancia de 5-10 mm, lo que deja espacio para colocar las suturas cutáneas. No ate las tres últimas suturas después de colocarlas. En su lugar, ate estas tres suturas cuando se coloquen todas las suturas.
NOTA: Atar las últimas tres suturas después de colocar las tres asegura que haya suficiente espacio para colocar las últimas suturas. - Colocar suturas intradérmicas continuas de forma continua en la piel. Comience la sutura intradérmica 1-2 cm lateral al sitio de la incisión y haga un túnel debajo de la piel hasta la capa dérmica de la piel, pero debajo de su superficie (Figura 6B) para evitar el rascado excesivo y el aflojamiento de las suturas. Haz un nudo en el extremo lateral de la sutura.
NOTA: El propofol y el fentanilo se pueden desactivar durante este procedimiento, ya que tienen varios minutos de tiempo de despertar. - Coloque la sutura continua entre las suturas subcutáneas hasta llegar al otro lado de la incisión.
NOTA: Es importante que la sutura salga por la dermis pero no perfore la piel para que el animal sea menos capaz de rascarse las suturas. - Tunelice la sutura 1-2 cm lateral a la incisión hasta un sitio de salida lateral y haga un nudo (Figura 6B). Aplique pegamento tisular en el sitio de la incisión.
- Corral de regreso de animales a casa
- Retire las cortinas estériles del animal y desconecte al animal del ventilador tan pronto como se observe movimiento.
- Transfiera al animal al corral de la casa y manténgalo separado del compañero del corral durante una noche.
NOTA: Los cerdos se separan después de la cirugía, ya que es normal que intenten despertar violentamente al compañero de corral, lo que resulta en heridas por mordeduras. Los cerdos deben poder tener contacto con el hocico.
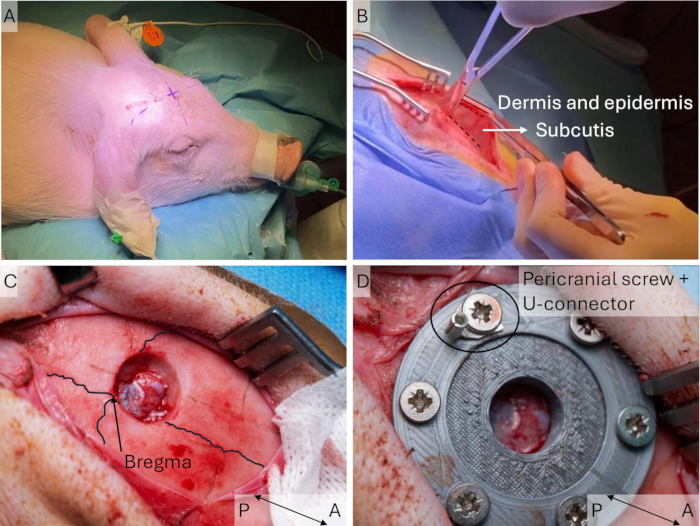
Figura 3: Implantación de la ventana craneal. (A) La ubicación esperada del punto bregma se identifica y marca en el cerdo antes de cubrirlo estérilmente, ya que puede ser difícil distinguirlo después. (B) Después de la incisión en la piel, el subcutis avascular se afloja con unas tijeras. (C) Se perfora un orificio de 15 mm de diámetro en el cráneo y se eliminan los bordes con rongeurs. Se resaltan las líneas de sutura coronal y sagital. (D) La ventana craneal se implanta y se fija mediante tornillos. Haga clic aquí para ver una versión más grande de esta figura.
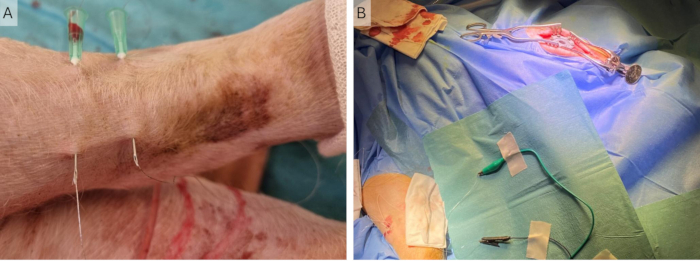
Figura 4: Implantación de los hilos periféricos. (A) Se colocan dos agujas de 23 G en la piel y se introducen los hilos Cooner a través de ellas. (B) Se retiran las agujas y se dejan los cables en la piel conectados al estimulador mediante pinzas de cocodrilo. Haga clic aquí para ver una versión más grande de esta figura.
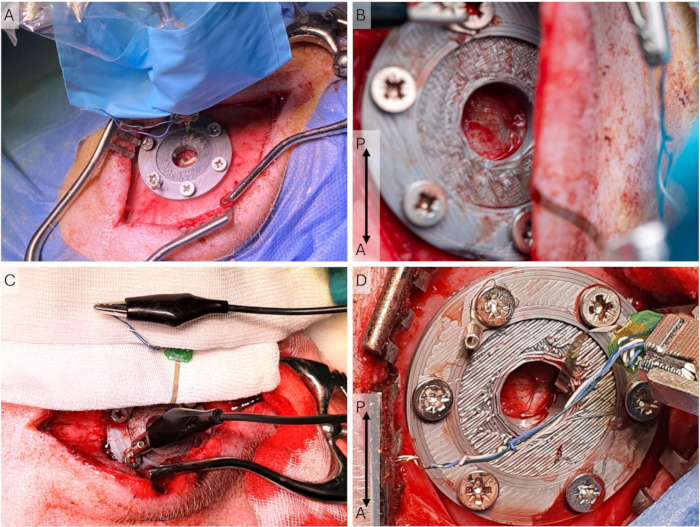
Figura 5: Configuración de grabación cortical. (A) La guía de electrodos se coloca en la duramadre, y el soporte de la cabecera y el micromanipulador están en una funda estéril durante una cirugía de implantación, donde la incisión es más larga y más lateral. (B) Primer plano de la μECoG en la configuración de grabación durante una cirugía de acceso, donde la incisión es más medial. (C) La configuración de puesta a tierra, donde todos los cables de conexión a tierra y de referencia en el ECoG están cortocircuitados y conectados a través del conector en U al tornillo pericraneal. (D) Primer plano del escenario de la cabeza y del soporte del escenario durante una cirugía de acceso. El μECoG se coloca en la duramadre. Abreviaturas: ECoG = electrocorticografía; μECoG = microECoG. Haga clic aquí para ver una versión más grande de esta figura.
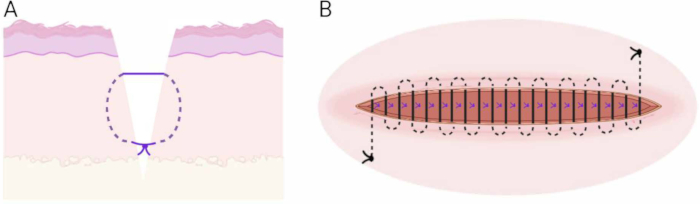
Figura 6: Técnica de sutura. (A) Esquema de la técnica de colchón vertical enterrado subcutáneo. (B) Esquema de la técnica de sutura intradérmica continua. Haga clic aquí para ver una versión más grande de esta figura.
2. Cirugía de acceso (Fase II)
NOTA: Después de 2-4 semanas, se abre la ventana craneal para realizar registros de seguimiento de las señales corticales del S1. La cirugía y el cierre de la herida se realizan de nuevo de tal manera que se puede acceder a la ventana craneal y cerrarla de nuevo.
- Preparación para la cirugía
NOTA: Los pasos 2.1.1-2.1.6 son similares a los pasos 1.1.1.1-1.1.1.6.- Tranquilizar al animal con una mezcla de zoletil (5 mL de zoletil [tiletamina 25 mg/mL y zolazepam 25 mg/mL], 6,25 mL de xilacina (20 mg/mL) y 2,5 mL de butorfanol (10 mg/mL)).
NOTA: Para este estudio en particular, se omitió la ketamina de la mezcla de zoletil para evitar el bloqueo de los receptores NMDA. - Transportar al animal a la sala de cirugía e intubarlo y ventilarlo.
- Coloque un catéter para las venas del oído. Administre propofol, fentanilo y solución salina a través del catéter.
- Administrar anestesia quirúrgica: Sevoflurano 1-2%, propofol (10 mg/mL infundido a 8 mg∙kg-1∙h-1), fentanilo (50 μg/mL infundido a 20 μg∙kg-1∙h-1).
- Si es necesario, marque el sitio de la incisión con un marcador estéril antes de cubrirlo estérilmente. Identifique el punto bregma dibujando líneas rectas entre cada oreja y el ojo contralateral; bregma está en la intersección de esas líneas (Figura 3A).
NOTA: Por lo general, la incisión inicial aún es visible. La nueva incisión debe colocarse al menos a 30 mm de la incisión inicial para evitar la mayor parte del tejido cicatricial y facilitar el cierre de la herida. - Coloque la placa de metal debajo de las cortinas y asegure la colocación y estabilidad adecuadas antes de comenzar la cirugía.
- Tranquilizar al animal con una mezcla de zoletil (5 mL de zoletil [tiletamina 25 mg/mL y zolazepam 25 mg/mL], 6,25 mL de xilacina (20 mg/mL) y 2,5 mL de butorfanol (10 mg/mL)).
- Acceso a la ventana craneal
NOTA: Los pasos 2.2.1-2.2.3 son similares a los pasos 1.1.2.1-1.1.2.3.- Realice la incisión inicial en la dermis con un bisturí ligeramente lateral a la línea media como se indica en el paso 2.1.5. Continúe la incisión a través de la piel con un cauterizador.
NOTA: En el caso de un experimento terminal, la incisión se puede hacer en el mismo lugar que la incisión original. - Coloque el retractor y sostenga la piel con pinzas y corte el tejido conectivo avascular entre el periostio y el subcutis (Figura 3B) para proporcionar más flexibilidad a la piel y facilitar la sutura en el paso 1.4. Ajuste el retractor a la flexibilidad que se obtuvo.
NOTA: Si se trata de un experimento terminal, se puede omitir este paso. - Incidir el periostio y aflojarlo del cráneo utilizando el elevador de periostio. Sostenga el periostio a un lado con el retractor.
- Retire la tapa de la ventana craneal y retire cualquier conectivo de la abertura con suaves movimientos circulares con un bastoncillo de algodón hasta llegar a la duramadre.
- Realice la incisión inicial en la dermis con un bisturí ligeramente lateral a la línea media como se indica en el paso 2.1.5. Continúe la incisión a través de la piel con un cauterizador.
- Implantación de alambre periférico
- Repita el paso 1.2.
- Registro de señales corticales
- Repita el paso 1.3.
- Cierre del sitio del implante
- Repita el paso 1.4.
NOTA: Si se trata de un experimento terminal, se puede omitir este paso.
- Repita el paso 1.4.
3. Cirugía terminal (Fase III)
NOTA: Después de 2-4 semanas, se abre la ventana craneal para realizar registros de seguimiento de las señales corticales del S1. Los pasos 2.2-2.5 se repiten, como se ha descrito anteriormente, seguidos del paso 3.1.
- Eutanasia
NOTA: El tubo del catéter de la vena del oído debe lavarse con solución salina para evitar la oxidación del barbitúrico.- Enjuague el catéter de la vena del oído con solución salina.
- Coloque una jeringa con la sobredosis de pentobarbital (10 mL, 400 mg/mL) e inyecte el pentobarbital a través del catéter de la vena del oído.
Resultados
Utilizando la técnica de ventana craneal, se registraron las señales corticales en 43 sesiones en 16 animales. Los animales se curaron adecuadamente después de la cirugía y se les alojó en parejas durante todo el estudio y se les realizó un seguimiento diario utilizando el esquema de bienestar de la Tabla Suplementaria S1. Todos los animales recibieron una puntuación de 0 en todo momento, lo que indica un excelente bienestar. La Figura 7 muestra que las ventanas se colocaron sobre el área S1 de la corteza del cerdo. Por lo general, se observaron algunas cicatrices en la duramadre in vivo y post-mortem (Figura 7A), pero el examen postmortem reveló que nunca afectó al tejido cortical subyacente (Figura 7B), que parecía sano en todos los animales y comparable al área S1 contralateral.
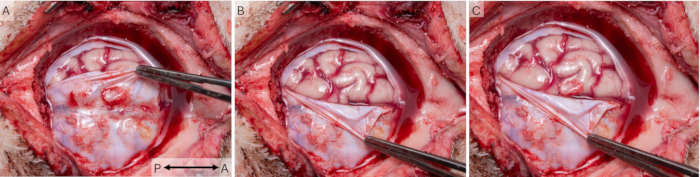
Figura 7: Ubicación de la ventana cortical en relación con la anatomía cerebral. (A) Para investigar la salud del tejido cortical y la ubicación de la ventana cortical en relación con S1, se extirpó la ventana craneal al final del estudio. En este caso se utilizaron intervalos quirúrgicos de 2 semanas, y se puede observar algo de tejido cicatricial en la duramadre. (B) El tejido cerebral subyacente parece sano y no se ve afectado por el implante. (C) Una superposición de las dos fotos muestra que el implante efectivamente cubrió el área S1 de la corteza del cerdo. La flecha indica el eje antero-posterior. Haga clic aquí para ver una versión más grande de esta figura.
Brevemente, para analizar las señales corticales, deben filtrarse para eliminar el ruido de línea y otros artefactos (ver Figura 8 y Tabla 1). Se utiliza un filtro de muesca alrededor de la frecuencia de ruido de línea, que es de 50 Hz en Europa y sus armónicos. A continuación, las señales se filtran de paso alto para eliminar los artefactos de desplazamiento y movimiento de baja frecuencia; la frecuencia de corte máxima depende del propósito de las grabaciones, pero no se recomienda una frecuencia superior a 5 Hz, ya que esto atenuará tanto las características de ERP como las de EEG espontáneo. Además, se utiliza un filtro de paso bajo para eliminar cualquier ruido de alta frecuencia. Dado que el electrodo se coloca en la parte superior de la duramadre, las frecuencias altas son ligeramente atenuadas por el tejido entre el cerebro y el electrodo18. Por lo tanto, la frecuencia de corte puede ser menor que cuando el electrodo está situado directamente en el tejido cerebral.
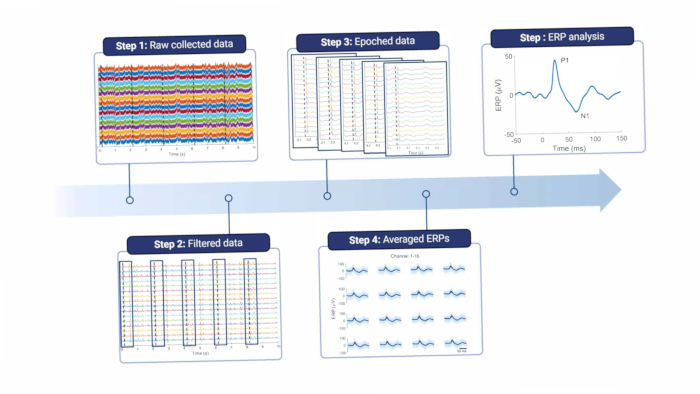
Figura 8: Canalización de procesamiento de datos. Los datos brutos recopilados (paso 1) se procesan mediante filtrado (paso 2). A continuación, se dividen en épocas basadas en los desencadenantes de los estímulos (paso 3), que se promedian (paso 4). Para el análisis de datos se utilizan los ERP medios (paso 5). Abreviatura: ERP = potenciales relacionados con eventos. Haga clic aquí para ver una versión más grande de esta figura.
| Tipo de filtro | Corte típico | Orden típico | Corte usado | Pedido de segunda mano |
| Muesca | 50±3 Hz o 60±3 Hz | Orden superior | 50±3 Hz y | 10º orden |
| y armónicos | armónicos ±1 Hz | |||
| Paso alto | 0,1-5 Hz | Orden bajo | 1-5 Hz | 2º orden |
| Paso bajo | 100-1000 Hz | Orden bajo | 300 Hz | 2º orden |
Tabla 1: Propiedades típicas del filtro para el análisis de señales cerebrales de superficie registradas con electrodos de electrocorticografía o electroencefalografía.
Los datos filtrados se dividen en épocas de 50-100 ms antes y 500-1.000 ms después del estímulo. Los canales ruidosos se eliminan de los datos (Figura 9A) y se eliminan las épocas que están contaminadas con artefactos (Figura 9B). El resto de las épocas sin artefactos se promedian para cada canal. Las respuestas evocadas a menudo se pueden distinguir en barridos individuales. Estos se vuelven más claros y consistentes cuando se promedian al menos 10 respuestas y no cambian cuando se promedian más de 25. Debe haber al menos 20 épocas libres de artefactos para obtener un promedio confiable. Este suele ser el caso, y en más de la mitad de los conjuntos de datos, no fue necesario eliminar ninguna época. Para facilitar la comparación entre las PRE registradas durante las diferentes fases (implantación, acceso, cirugías de eutanasia), los datos suelen normalizarse con una puntuación z para tener en cuenta las diferencias en la profundidad anestésica y la actividad de fondo.
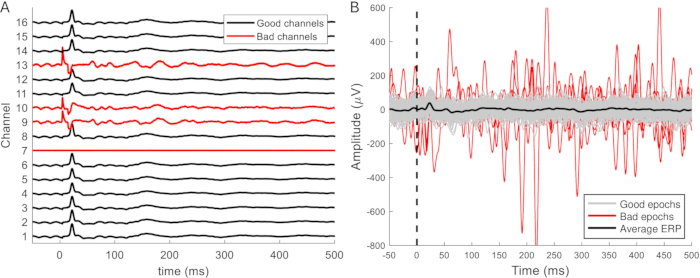
Figura 9: Ejemplos de canales y épocas defectuosos. (A) Las señales de los registros epidurales en un área relativamente pequeña del cerebro tienen características similares pero diferentes amplitudes. Los canales que funcionan mal se distinguen fácilmente por su falta de la forma de onda ERP. Además, los canales pueden exhibir artefactos, una apariencia más ruidosa y una mayor amplitud de señal (canales 9, 10 y 13). El canal 7 es otro ejemplo de un canal que funciona mal y no capta ninguna señal ni ruido. (B) La amplitud esperada del ERP es de hasta aproximadamente 100 μV. Las épocas ruidosas suelen tener una amplitud mayor, lo que puede afectar a la forma de onda media del ERP y, por lo tanto, debe eliminarse. Falta la forma de onda típica de ERP, pero esta forma de onda no siempre se distingue en épocas individuales. Abreviatura: ERP = potencial relacionado con eventos. Haga clic aquí para ver una versión más grande de esta figura.
La fiabilidad de las ERPs registradas mediante la técnica de ventana craneal fue alta en cuanto a amplitudes de pico y latencia19. No se encontraron diferencias significativas para la amplitud de pico (registro 1: 17,9 ± 7,26 μV; registro 2: 17,6 ± 10,1 μV; registro 3: 14,0 ± 6,95 μV) y la varianza entre canales (registro 1: 6,47 ± 8,36 μV; registro 2: 3,93 ± 6,13 μV; registro 3: 3,84 ± 3,71 μV) en un análisis de varianza medido repetidamente (RM-ANOVA). Se encontró una diferencia significativa en la latencia máxima entre la primera grabación y la siguiente. El pico fue 1 ms más tarde en el primer registro en comparación con los registros de seguimiento (registro 1: 25,2 ± 2,0 ms; registro 2: 24,0 ± 2,4 ms; registro 3: 24,1 ± 2,0 ms), lo que puede estar relacionado con el desarrollo del sistema nervioso20,21, ya que en este estudio se utilizaron cerdos criollos adolescentes.
La técnica de la ventana craneal se utilizó además para investigar el efecto de la estimulación de alta frecuencia (HFS) en los ERP. El HFS causa una potenciación a largo plazo de las neuronas superficiales del asta dorsal en roedores22,23, un aumento de la sensibilidad al dolor y un aumento de las respuestas cerebrales evocadas en humanos24,25. Se observó un aumento significativo en la amplitud del pico N1 de los potenciales relacionados con el evento (259 ± un aumento del 107% en comparación con la línea de base previa a la intervención), y se pudo distinguir una clara diferencia entre el HFS y los experimentos en los que no se aplicó HFS en el mismo animal (Figura 10)17.
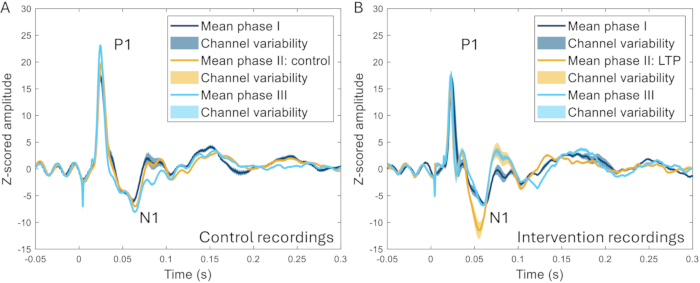
Figura 10: Ejemplos de ERPs promediados en todos los canales registrados 2-3 semanas antes, durante y 2-3 semanas después de la inducción de un modelo de dolor. (A) Los ERP recolectados del mismo animal durante tres registros diferentes con 2 semanas de diferencia muestran características muy similares. (B) Los ERP tienen características similares entre registros, pero el N1 tiene una mayor amplitud después de la inducción de la potenciación a largo plazo en la fase II en comparación con las otras fases que son 3-4 semanas antes y después de la fase II. Las áreas sombreadas indican la desviación estándar entre canales. Abreviaturas: ERP = potenciales relacionados con eventos; LTP = potenciación a largo plazo. Haga clic aquí para ver una versión más grande de esta figura.
Tabla complementaria S1: Plan de bienestar para puntuar el comportamiento solitario y social de los cerdos. Haga clic aquí para descargar este archivo.
Discusión
La importancia del desarrollo de esta técnica radica en la eliminación de los modos de fallo de los electrodos, la reducción de las respuestas tisulares y, por lo tanto, la mejora de la fiabilidad de las técnicas invasivas de registro cortical. No se produjeron modos de fallo de electrodos durante el estudio, y se utilizaron un total de dos matrices de ECoG durante todo el estudio, incluidos 16 animales y 43 sesiones de grabación. Esto tiene un impacto positivo adicional en la economía de la investigación. Utilizando métodos tradicionales completamente implantados 12,26,27, se necesitarían al menos 16 matrices ECoG bajo el supuesto de que no se produzcan fallos en el dispositivo. Sin embargo, los modos de falla y las respuestas tisulares continúan planteando desafíos significativos para la implementación generalizada del registro intracraneal del cerebro 11,12,13,28,29. Este estudio redujo sustancialmente el número de electrodos, reduciendo así tanto el costo como el riesgo de los estudios de neurociencia crónica al mismo tiempo.
El único evento adverso que ha ocurrido con los implantes de ventana craneal son infecciones ocasionales en las cirugías tempranas. Estas infecciones eran siempre superficiales (no llegaban al nivel de la duramadre) y se resolvían mediante la implantación de una esponja antibiótica reabsorbible Genta-coll. Debido a la efectividad de este tratamiento, se adoptó la implantación de la esponja antibiótica como parte de la implantación de la ventana craneal como medida preventiva. A pesar de que los cerdos son animales fuertes que realizan un comportamiento de enraizamiento, ninguno de los implantes hechos de PLA estándar se rompió.
Todos los electrodos implantados están sujetos a una respuesta de cuerpo extraño y a encapsulación glial o fibrosa 14,15,28,29,30. Esto significa que la interfaz electrodo-tejido, así como la capacidad de registro del electrodo, cambia con el tiempo después de la implantación 13,18,28. Con el método actual, las respuestas de los tejidos no han afectado a la integridad y fidelidad de registro de los electrodos debido a la estrategia de colocación temporal de los electrodos. El electrodo se colocó en la duramadre durante cada sesión, por lo que la interfase electrodo-tejido fue comparable durante cada sesión. El único factor que podría haber diferido ligeramente por sesión es la posición del electrodo. Por lo tanto, es crucial hacer coincidir el tamaño de la ventana con el tamaño del electrodo y tomar fotos de la colocación del electrodo durante cada sesión de grabación. Con estos esfuerzos, se han registrado ERP altamente confiables y reproducibles19.
Se produjo una respuesta del tejido al implante de ventana craneal, y se ha observado un recrecimiento óseo en los primeros pilotos que utilizaron una ventana transcraneal sin paredes que se extendieran desde la superficie externa del cráneo hasta la duramadre. Se encontró una capa continua de tejido óseo blando 2 semanas después de la primera sesión, lo que indica un recrecimiento óseo. Era imposible extirpar este tejido y acceder a la duramadre; Por lo tanto, se agregaron paredes verticales que se extienden desde la superficie del cráneo hasta la duramadre31 a la ventana craneal. Se imprimieron ventanas con diferentes longitudes de pared para que coincidieran con el implante con el grosor del cráneo para evitar la presión sobre la corteza. Los animales fueron investigados después de la eutanasia, lo que reveló tejido cerebral de apariencia saludable en todos los animales. Todavía se forman tejidos blandos dentro del área de la ventana; Sin embargo, no se adhiere a la pared y no es continuo con el cráneo, por lo que es fácil de quitar con un bastoncillo de algodón. Es fundamental para la fiabilidad de los registros que este tejido blando se retire de la ventana para que el electrodo se coloque en la duramadre cada vez.
Los resultados óptimos se obtienen con al menos 3 semanas entre cirugías. A las 2 semanas, la ventana craneal es accesible, pero el tejido blando en el área de la ventana se une a la duramadre. Además, la apertura y el cierre de la herida se complican por el sangrado y la falta de flexibilidad en el tejido. A las 3 y 4 semanas, la herida de la incisión se ha curado lo suficiente como para que los límites normales del tejido (por ejemplo, periostio, piel, duramadre) sean distintos, lo que facilita la extracción del tejido blando de la ventana y el volver a cerrar la piel sobre el implante. Dado que no se ha observado tejido similar al hueso a intervalos de 4 semanas, puede ser factible que pasen más de 4 semanas entre cirugías y cirugías de acceso múltiple. No hemos investigado si el período entre cirugías puede extenderse a varios meses.
Para el éxito de las cirugías de implante y acceso, la incisión inicial y el cierre de la herida son críticos. La flexibilidad de la piel de la frente del cerdo es muy limitada, por lo que es esencial aflojar la capa subcutánea avascular de la piel. Esto proporciona flexibilidad adicional para cerrar la piel sobre el implante y reduce la tensión en las suturas. Este estrés se reduce aún más mediante el uso de dos capas de suturas y pegamento adicional para la piel. La piel se sutura mediante una técnica de sutura intradérmica continua para evitar que los animales se rasquen las heridas y retiren las suturas prematuramente. Las estrategias de apertura y cierre de heridas son críticas en ambos tipos de cirugía de supervivencia, ya sea un implante o una cirugía de acceso.
Una limitación del enfoque actual es que el acceso a la ventana requiere una cirugía menor, lo que impide las grabaciones en animales despiertos. Esto significa que, dependiendo de la pregunta de investigación, no será un enfoque adecuado para todos los estudios. Para que los dispositivos completamente implantados se utilicen en grabaciones con vigilia, existen otros métodos para superar los cambios biológicos en la interfaz32. Dado que el acceso a la ventana craneal es un procedimiento pequeño, puede ser posible utilizar un anestésico local y un sedante en lugar de anestesia general. Las ventajas de que la ventana craneal esté completamente debajo de la piel son la reducción de las posibilidades de infección y la mejora del bienestar animal, ya que los animales pueden alojarse en parejas o en grupos. Además, solo hemos investigado la fiabilidad de las respuestas evocadas19. Sin embargo, la actividad cerebral espontánea ha sido registrada y es generalmente más confiable y reproducible que el ERP8, lo que indica que el método no se limita al registro del ERP.
Nuestro método presenta un método novedoso, escalable, fiable y reproducible para el registro cortical crónico. Este método es muy valioso para los estudios de investigación en neurociencias, donde la fiabilidad y la reproducibilidad son esenciales para el resultado de los estudios33,34. Hemos utilizado el método para investigar las respuestas corticales evocadas de S1 antes y después de la inducción de diferentes modelos de dolor y controles, mostrando resultados robustos17. En general, el método se puede adaptar fácilmente para acceder a otras áreas corticales, por ejemplo, para investigar el movimiento, la audición o la visión. También puede ser posible utilizar el método para el diagnóstico de la epilepsia 4,35 o monitorizar el tratamiento y la rehabilitación después de una lesión cerebral36,37.
El método también es escalable a otras especies, como primates no humanos u otros mamíferos, gatos, perros u ovejas 35,38,39. Cada una de estas adaptaciones requerirá ajustar la técnica quirúrgica, identificar puntos de referencia confiables para la colocación de la ventana craneal y ajustar su diseño. Los autores recomiendan el uso de cadáveres para optimizar la técnica de la ventana craneal antes de proceder a la prueba piloto. Para ciertas áreas del cerebro, la cirugía puede ser más invasiva, lo que puede resultar en un tiempo de recuperación óptimo diferente al recomendado. Además, la técnica puede adaptarse para permitir el registro de ECoG subdural y el registro intracortical, ampliando así sus aplicaciones y aumentando el acceso a varias regiones cerebrales. Debido al grosor del cráneo porcino, puede ser necesario aumentar el tamaño de la ventana cortical para realizar la durotomía para los registros subdurales26,27.
Para los registros intracorticales, es posible colocar el electrodo a través de una cánula o una lanzadera40, lo que permite reducir aún más el tamaño de la ventana cortical. Tanto las técnicas subdurales como las intracraneales aumentarán el riesgo de sangrado, por lo que se debe tener cuidado durante la cirugía para evitar los vasos sanguíneos. La técnica de la ventana craneal también se puede utilizar para fines distintos al registro de señales eléctricas del cerebro, por ejemplo, la obtención de imágenes de la vasculatura, que es muy relevante en los modelos porcinos de migraña41. Además, el método de la ventana craneal puede adaptarse para su uso en combinación con técnicas de imagen novedosas31, como la imagen de 2 fotones, y puede combinarse con el sustituto dural desarrollado por Costine-Bartell et al. para mejorar la resolución óptica42.
En conclusión, el abordaje metodológico presentado reduce los riesgos relacionados con un implante permanente12,13 al eliminar el riesgo de falla del dispositivo, minimizar las respuestas biológicas en el sitio del electrodo y, por lo tanto, aumentar la fidelidad del registro y resultar en registros corticales altamente confiables. La metodología también es muy prometedora para otras aplicaciones, ya que es escalable a otras especies y tipos de registro.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Los autores desean agradecer a los cuidadores de animales y a los técnicos del centro de animales de laboratorio del Hospital Universitario de Aalborg. El Centro de Neuroplasticidad y Dolor (CNAP) cuenta con el apoyo de la Fundación Nacional de Investigación de Dinamarca (DNRF121). La Figura 6 y la Figura 8 se crearon en BioRender.
Materiales
| Name | Company | Catalog Number | Comments |
| Cranial window implantation | |||
| Scalpel | disposable, blade 10 | ||
| Tweezers | |||
| Gauze | |||
| Cauterizer | |||
| Periosteum elevator | flat, 10 mm width | ||
| Weitlaner retractor | 3 x 4 prong, blunt, 16.5 cm | ||
| Midas Rex Legend EHS stylus surgical drill system | Medtronic Powered Surgical Solutions, Fort Worth, USA | ||
| Legend Ball Fine drill bits | Medtronic Powered Surgical Solutions, Fort Worth, USA | 7BA40F-MN and 7BA60F-MN | MedNext type 4 and 6 mm head diameter |
| Sterile cover for the drill | |||
| Syringe | 5 mL | ||
| Saline | |||
| Suction | |||
| Ruler | |||
| Cotton buds | |||
| Rongeur | straight jaw, 15 cm, 3 x 20 mm bit size | ||
| 2.5 mm hand drill and handle | |||
| Butterfly infusion set | |||
| Six M3 screws in 6-14 mm length | |||
| Screwdriver | |||
| Three sizes of 3D-printed cranial window (4-, 5- and 6-mm depth) and cap | |||
| Deisolated U-shaped connector | |||
| Crocodile connector | |||
| Genta-coll resorbable antibiotic sponge | |||
| VYCRIL resorbable suture | Ethicon | 2-0 26 mm round bodied | |
| Monocryl non-resorbable suture | Ethicon | 3-0 24 mm reverse cutting | |
| Needle holder | |||
| Scissors | |||
| Topical adhesive tissue glue | Leukosan | ||
| Peripheral wire implantation | |||
| Two partially uninsulated Cooner wires | |||
| NOTE: 1-2 cm of the wires is uninsulated in the middle and at one of the ends | |||
| Two 23 G needles | |||
| Gauze | |||
| Programmable stimulator controlled by a PC running MC_stimulus | Multichannel Systems, Reutlingen, Germany | STG4008 | |
| Two crocodile connectors | |||
| Cortical recordings | |||
| Metal plate for the magnetic micromanipulator | |||
| Magnetic micromanipulator stand | |||
| Micromanipulator | |||
| Headstage holder | |||
| 32-channel ZIF-clip headstage | TDT, Alachua, FL, USA | ||
| 32-channel micro-electrocorticography (µECoG) array | Neuronexus, Ann Arbor, USA | E32-1000-30-200 | |
| TDT recording equipment including pre-amplifier SI8, data processor RZ2 and workstation WS8 | TDT, Alachua, FL, USA |
Referencias
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados