Method Article
Tecnica della finestra cranica cronica per registrazioni corticali ripetute durante l'anestesia nei suini
In questo articolo
Riepilogo
Questo studio presenta un metodo scalabile, affidabile e riproducibile per registrazioni corticali croniche ripetute in un modello suino. Il metodo ha applicazioni in vari campi delle neuroscienze, tra cui la ricerca sul dolore e la diagnostica delle malattie neurologiche.
Abstract
Le registrazioni corticali sono essenziali per estrarre i segnali neuronali per informare varie applicazioni, tra cui le interfacce cervello-computer e la diagnostica delle malattie. Ogni applicazione pone requisiti specifici sulla tecnica di registrazione e spesso vengono selezionate soluzioni invasive per registrazioni a lungo termine. Tuttavia, i metodi di registrazione invasivi sono messi alla prova dal guasto del dispositivo e dalle risposte avverse dei tessuti, che compromettono la qualità del segnale a lungo termine.
Per migliorare l'affidabilità e la qualità delle registrazioni corticali croniche, riducendo al minimo i rischi legati al guasto del dispositivo e alle reazioni tissutali, abbiamo sviluppato una tecnica della finestra cranica. In questo protocollo, riportiamo i metodi per impiantare e accedere a una finestra cranica in suini autoctoni giovani, che facilita il posizionamento di array di elettrocorticografia temporanea (ECoG) sulla dura madre. Descriviamo ulteriormente come i segnali corticali possono essere registrati utilizzando la tecnica della finestra cranica. L'accesso alla finestra cranica può essere ripetuto più volte, ma si consiglia un minimo di 2 settimane tra l'impianto e gli interventi chirurgici di accesso per facilitare il recupero e la guarigione dei tessuti.
L'approccio della finestra cranica è riuscito a ridurre al minimo le modalità comuni di guasto degli elettrodi e le risposte tissutali, ottenendo registrazioni corticali stabili e affidabili nel tempo. Ad esempio, abbiamo registrato i potenziali evento-correlati (ERP) dalla corteccia somatosensoriale primaria. Il metodo ha fornito registrazioni altamente affidabili, che hanno anche permesso di valutare l'effetto di un intervento (stimolazione ad alta frequenza) sugli ERP. L'assenza di guasti significativi dei dispositivi e il numero ridotto di elettrodi utilizzati (due elettrodi, 43 sessioni di registrazione, 16 animali) suggeriscono un miglioramento dell'economia della ricerca. Sebbene sia necessario un piccolo accesso chirurgico per il posizionamento degli elettrodi, il metodo offre vantaggi come la riduzione del rischio di infezione e il miglioramento del benessere degli animali.
Questo studio presenta un metodo scalabile, affidabile e riproducibile per le registrazioni corticali croniche, con potenziali applicazioni in vari campi delle neuroscienze, tra cui la ricerca sul dolore e la diagnosi delle malattie neurologiche. Futuri adattamenti potrebbero estenderne l'uso ad altre specie e modalità di registrazione, come le registrazioni intracorticali e le tecniche di imaging.
Introduzione
In generale, lo scopo delle registrazioni corticali è quello di estrarre informazioni dalla segnalazione neuronale nel cervello. Queste informazioni possono essere utilizzate in vari modi: controllo di un dispositivo esterno, comunicazione, diagnosi di malattia o riabilitazione 1,2,3,4. Ogni applicazione pone requisiti univoci sul contenuto informativo e sulla risoluzione spaziale richiesta e sulla quantità di invasività considerata accettabile. Pertanto, dalla scoperta dell'elettroencefalogramma nel 1929, sono state sviluppate soluzioni di registrazione con una gamma di invasività e risoluzione spaziale.
Generalmente, questi possono essere suddivisi in elettroencefalografia (EEG), elettrocorticografia (ECoG) e registrazioni intracorticali. L'EEG è un metodo di registrazione non invasivo che cattura le oscillazioni neurali e i potenziali correlati agli eventi (ERP) dall'intero cervello. Tuttavia, la sua capacità di definire le fonti di questa attività è limitata a causa della sua bassa risoluzione spaziale. L'ECoG è un metodo più invasivo in cui gli elettrodi vengono posizionati epi- o subduralmente, in genere coprendo una porzione più piccola della corteccia. Ha una risoluzione spaziale più elevata ed è in grado di registrare ERP e potenziali di campo locale di superficie (LFP). Pertanto, può localizzare la fonte dell'attività cerebrale in modo più preciso, il che lo rende utile, ad esempio, per identificare l'origine dell'epilessia focale. La registrazione intracorticale è il metodo di registrazione più invasivo e può registrare l'attività di picco da singoli neuroni situati superficialmente o in profondità all'interno del cervello e LFP dal volume di neuroni attorno agli elettrodi. Questi segnali hanno una risoluzione spaziale e un contenuto informativo molto elevati, ma sono prodotti da un sottoinsieme ristretto di neuroni (1-10 neuroni per canale)6.
Per estrarre informazioni dal cervello per periodi prolungati (mesi-anni), l'interfaccia deve essere stabile e affidabile affinché i segnali acquisiti continuino a rappresentare le stesse informazioni durante l'intero periodo. Le registrazioni EEG richiedono frequenti cambi di elettrodo, rendendo la loro affidabilità variabile da molto bassa a molto alta 7,8,9,10. Pertanto, i metodi ECoG e intracorticali sono spesso selezionati per registrazioni prolungate. Tuttavia, entrambi questi metodi richiedono che le condizioni dell'elettrodo di registrazione, così come del tessuto, rimangano stabili nel tempo. Mentre l'elettrodo di solito rimane nella stessa posizione, l'interfaccia elettrodo-tessuto può cambiare a causa di reazioni tissutali o modalità di guasto dell'elettrodo 11,12,13,14. Le reazioni tissutali comprendono la morte neuronale, l'emorragia, la bioincrostazione, la reazione da corpo estraneo, la gliosi, l'incapsulamento, l'infezione, la meningite e l'estrusione meningea15. Queste reazioni compromettono le capacità di registrazione degli elettrodi12,13. Le modalità comuni di guasto dell'elettrodo sono la delaminazione o la perdita nelle parti isolate, la delaminazione o la fessurazione del rivestimento superficiale dell'elettrodo, il danneggiamento del filo e la dislocazione dell'elettrodo11,12.
Per superare le modalità di guasto degli elettrodi, abbiamo considerato la fattibilità di una soluzione di posizionamento temporaneo degli elettrodi che affronta anche molte delle sfide relative alle risposte tissutali, vale a dire la morte neuronale, la reazione da corpo estraneo, la gliosi, l'incapsulamento e l'estrusione meningea. Inoltre, il posizionamento coerente degli elettrodi era un requisito per ottenere registrazioni neuronali affidabili e riproducibili. Poiché l'elettrodo è stato posizionato per via epidurale a pochi millimetri di distanza dal tessuto nervoso, il movimento dell'elettrodo non deve superare 1 mm. La finestra cranica è stata progettata con dimensioni tali da evitare movimenti eccessivi tra i posizionamenti degli elettrodi. Con lo sviluppo della tecnica della finestra cranica, miriamo a migliorare l'affidabilità e la qualità del segnale a lungo termine e a eliminare il rischio di guasto dell'elettrodo.
Protocollo
Questo protocollo è stato approvato dall'Amministrazione veterinaria e alimentare danese sotto il Ministero dell'alimentazione, dell'agricoltura e della pesca della Danimarca (protocollo numero 2020-15-0201-00514). Un totale di 16 femmine di suini autoctoni sono stati sottoposti alle procedure. Gli animali pesavano circa 20 kg all'arrivo in struttura, il che significa che avevano circa 2 mesi. Pesavano circa 30 kg al momento dell'impianto e 40-60 kg alla fine dello studio. Le procedure consistono in chirurgia implantare, chirurgia di accesso e chirurgia terminale (Figura 1).
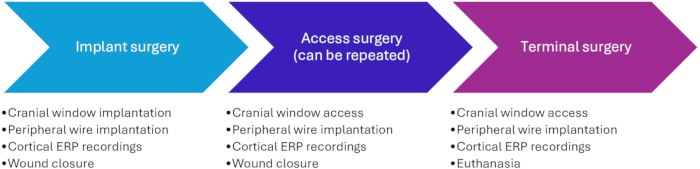
Figura 1: Cronologia delle procedure sperimentali. L'intervento chirurgico di accesso (Fase II) può essere ripetuto più volte. Si consiglia una separazione di almeno 2 settimane tra gli interventi chirurgici per il recupero e la guarigione delle ferite tra gli interventi chirurgici. Abbreviazione: ERP = potenziale evento-correlato. Clicca qui per visualizzare una versione più grande di questa figura.
1. Chirurgia implantare (Fase I)
NOTA: Una finestra cranica in acido polilattico (PLA) stampata in 3D (Figura 2) viene impiantata per facilitare le registrazioni ripetute dalla corteccia somatosensoriale primaria del maiale. Vengono registrati gli ERP dovuti alla stimolazione elettrica del nervo ulnare. L'intervento chirurgico e la chiusura della ferita vengono eseguiti in modo che la finestra cranica possa essere accessibile e chiusa successivamente.

Figura 2: Progettazione della finestra cranica. (A) Vista laterale della finestra cranica che indica l'altezza delle pareti e la base che è fissata al cranio. (B) Vista dall'alto che indica il diametro della vedova cranica, i fori per le viti, lo spazio del tappo e la finestra. Il tappo della finestra cranica è un cilindro di 22 mm di diametro con un'altezza di 1 mm che si inserisce perfettamente nello spazio del tappo. Clicca qui per visualizzare una versione più grande di questa figura.
- Impianto di finestra cranica
- Preparazione per l'intervento chirurgico
NOTA: Il processore dati (RZ2), la workstation (WS8) e il PC vengono accesi prima dell'inizio dell'intervento. Le note chirurgiche vengono prese su un foglio di calcolo almeno ogni 15 minuti da un ricercatore non sterile per documentare i segni vitali (frequenza cardiaca, spO2, CO2 di fine espirazione, temperatura interna), i livelli di anestesia (velocità di infusione di propofol, velocità di infusione di fentanil, percentuale di sevoflurano), lo stadio dell'intervento chirurgico ed eventuali irregolarità.- Tranquillizzare l'animale utilizzando un'iniezione intramuscolare di 5-7 ml di miscela di Zoletil (1 ml conteneva 8,3 mg di tiletamina, 8,3 mg di zolazepam, 8,3 mg di xilacino e 1,7 mg di butofanolo).
NOTA: Per questo particolare studio, la ketamina è stata omessa dalla miscela Zoletil per evitare di bloccare i recettori NMDA. - Trasportare l'animale in sala operatoria. Intubare l'animale e collegarlo a un ventilatore meccanico.
- Posizionare un catetere venoso auricolare per somministrare propofol, fentanil e soluzione fisiologica.
- Somministrare l'anestesia chirurgica: Sevoflurano 1-2%, propofol (10 mg/mL infuso a 8 mg∙kg-1∙h-1), fentanil (50 μg/mL infuso a 20 μg∙kg-1∙h-1).
- Contrassegnare il sito di incisione utilizzando un pennarello sterile prima del drappeggio sterile. Identificare il punto bregma tracciando linee rette tra ciascun orecchio e l'occhio controlaterale; il punto di bregma si trova all'intersezione di queste linee (Figura 3A). Assicurarsi che l'incisione sia leggermente laterale alla linea mediana sul lato controlaterale all'arto anteriore stimolato.
- Posizionare la piastra metallica sotto i teli e garantire il corretto posizionamento e stabilità prima di iniziare l'intervento chirurgico.
- Tranquillizzare l'animale utilizzando un'iniezione intramuscolare di 5-7 ml di miscela di Zoletil (1 ml conteneva 8,3 mg di tiletamina, 8,3 mg di zolazepam, 8,3 mg di xilacino e 1,7 mg di butofanolo).
- Accesso al teschio
NOTA: In questa e nelle seguenti parti del protocollo, tutte le procedure vengono eseguite da un chirurgo sterile, se non diversamente indicato.- Praticare l'incisione iniziale nel derma con un bisturi leggermente laterale alla linea mediana, come indicato al punto 1.1.1.5. Continuare l'incisione attraverso la pelle con un cauterizzatore.
NOTA: Non estendere l'incisione troppo anteriormente per evitare i grandi seni frontali del maiale. Se è necessario più spazio, estendere l'incisione sul lato posteriore. - Posizionare il divaricatore e sostenere la pelle con una pinza e tagliare il tessuto connettivo avascolare tra il periostio e il sottocute (Figura 3B) per fornire maggiore flessibilità alla pelle e facilitare la sutura nel passaggio 1.4. Regolare il divaricatore in base alla flessibilità ottenuta.
- Incidere il periostio e allentarlo dal cranio utilizzando un elevatore del periostio. Tenere da parte il periostio utilizzando il divaricatore.
- Praticare l'incisione iniziale nel derma con un bisturi leggermente laterale alla linea mediana, come indicato al punto 1.1.1.5. Continuare l'incisione attraverso la pelle con un cauterizzatore.
- Accesso alla dura madre
- Praticare un foro di 10 mm di diametro frontalmente alla linea di sutura sagittale e lateralmente alla sutura della linea mediana (Figura 3C). Iniziare con un diametro di 15 mm per ottenere un foro di 10 mm di diametro a livello della dura dura, poiché la punta arrotondata risulterà in un foro leggermente affusolato.
- Montare la finestra cranica sul foro all'inizio per garantire una buona vestibilità.
- Passare a una punta da trapano più piccola quando la dura madre diventa visibile per ottenere la massima larghezza del foro a livello della dura dura. Ritaglia i bordi usando Rongeurs.
- Impianto di finestra cranica
- Verifica che la finestra cranica si adatti all'interno e fino al fondo del foro e decidi la sua profondità. Sebbene ciò dipenda dall'animale, assicurati che le pareti della finestra cranica raggiungano la dura madre per una buona vestibilità, ma non esercitare pressione sul cervello in nessun punto.
- Segnare i fori delle viti utilizzando il trapano a mano tenendo in posizione la finestra cranica.
- Rimuovere la finestra cranica e praticare i fori profondi almeno 4 mm. Penetrare nel cranio per una delle viti per usarlo come terreno/riferimento per le registrazioni corticali.
- Posizionare la finestra cranica (Figura 3) e rimuovere l'ago dal set per infusione a farfalla. Misurare la profondità dei fori delle viti attraverso la finestra cranica usando la farfalla smussata. Inserire e serrare una vite di lunghezza corrispondente nel foro.
NOTA: Una vite troppo lunga non riuscirà a fissare efficacemente il tappo della finestra cranica. - Posizionare un connettore a U sotto una vite che perfora il cranio e tocca la dura.
NOTA: È importante che la lunghezza di questa vite sia maggiore dello spessore del cranio in modo che la ricrescita dell'osso non impedisca il contatto con la dura.
- Preparazione per l'intervento chirurgico
- Impianto di filo periferico
NOTA: Questa procedura può essere eseguita in concomitanza con l'impianto della finestra cranica. Questa è una procedura sterile. Per prevenire la contaminazione del sito chirurgico o del sito cranico, è necessario indossare un abbigliamento sterile.- Impianto di fili vicino al nervo ulnare
- Applicare la stimolazione elettrica a 5 mA sulla pelle toccando la pelle nella parte distale posteriore dell'arto anteriore con due aghi (non penetranti) o un altro pezzo di metallo sterile separato da 2 cm. Cerca una chiara flessione dello zoccolo, che indica che il nervo corre tra questi due punti.
NOTA: Potrebbe essere necessario ruotare l'arto all'indietro in modo che la parte posteriore sia più facile da raggiungere. - Inserire i due aghi perpendicolarmente al decorso del nervo a circa 2 cm di distanza. Forare nuovamente la pelle a circa 3 cm dal punto di inserimento (Figura 4A).
- Verificare la posizione utilizzando uno stimolo di prova applicato agli aghi a 2 mA; Assicurarsi che sia visibile un movimento chiaro dello zoccolo.
- Passare i fili di Cooner attraverso gli aghi e rimuovere gli aghi, lasciando i fili di Cooner parzialmente sotto la pelle. Assicurarsi che la parte non isolata al centro del filo sia sotto la pelle per entrambi i fili (Figura 4B).
NOTA: Se l'arto è stato ruotato all'indietro, ruotarlo con cautela in avanti. - Collegare ciascun connettore a coccodrillo a un'estremità deisolata dei due fili Cooner.
- Applicare la stimolazione elettrica a 5 mA sulla pelle toccando la pelle nella parte distale posteriore dell'arto anteriore con due aghi (non penetranti) o un altro pezzo di metallo sterile separato da 2 cm. Cerca una chiara flessione dello zoccolo, che indica che il nervo corre tra questi due punti.
- Stabilire la soglia del motore
- Trovare la soglia del motore utilizzando il metodo su-giù16,17; iniziare a 100 μA, aumentando con incrementi di 50 μA, osservando e sentendo una risposta del motore nell'area dello zoccolo. Una soglia inferiore a 1 mA è in genere fattibile.
- Programmare l'STG per fornire 100 stimoli simmetrici bifasici rettangolari con un'ampiezza dell'impulso di 200 μs a 2 volte la soglia motoria, seguiti da 100 stimoli a 10 volte la soglia motoria.
- Impianto di fili vicino al nervo ulnare
- Registrazione dei segnali corticali
- Chiedere a un ricercatore non sterile di portare il preamplificatore in posizione e di collegarlo al processore dati (RZ2) utilizzando cavi in fibra ottica.
- Ridurre il sevoflurano allo 0,5-1% (metà del suo livello chirurgico) e monitorare la frequenza cardiaca, la CO2 espirata e la pressione sanguigna (se disponibile) per garantire una profondità di anestesia adeguata e stabile. Aumentare sia il propofol che il fentanil secondo necessità.
- Chiedere a un ricercatore non sterile di collegare l'headstage al preamplificatore (SI8) e di posizionare l'headstage (ZIF-clip) nel supporto dell'headstage, che è montato sul micromanipolatore magnetico del supporto.
- Posizionare il telo sterile attorno al micromanipolatore e fissare la parte adesiva al tavolino e al supporto del tavolino (Figura 5A).
- Chiedi a un ricercatore non sterile di fissare il micromanipolatore utilizzando il supporto magnetico, immergere l'elettrodo μECoG nell'alcol e posizionarlo nell'headstage (ZIF-clip).
NOTA: Lasciare asciugare l'elettrodo prima di posizionarlo sulla dura. Assicurarsi di toccare solo il drappeggio sterile che copre l'headstage, poiché l'elettrodo μECoG non è sterile. - Portare il μECoG in posizione utilizzando il micromanipolatore e guidando con un batuffolo di cotone. Collegare i fili di terra del μECoG alla vite di messa a terra con un connettore a coccodrillo.
- Ridurre il sevoflurano allo 0%, monitorare la frequenza cardiaca, la CO2 espirata e la pressione sanguigna (se disponibile) per garantire una profondità adeguata e stabile dell'anestesia, aumentare sia il propofol che il fentanil secondo necessità.
- Visualizza in anteprima i segnali in sinapsi; l'intervallo di segnale tipico è fino a ±100 μV.
- Se il segnale appare come una linea in grassetto (indicativa di rumore di linea), chiedere a una persona sterile di eseguire le seguenti azioni: esaminare i circuiti di messa a terra e mantenere la vite di messa a terra e i collegamenti asciutti e isolati dai tessuti vicini. Indagare se altri cavi sono isolati dal corpo del maiale e dagli strumenti chirurgici. In caso contrario, utilizzare una garza sterile per isolare i cavi dal corpo o dagli strumenti chirurgici.
- Se l'ampiezza del segnale è maggiore di ±100 μV (indicativa di artefatti da movimento), assicurarsi che l'elettrodo sia sospeso e poggi sul cervello e che il cablaggio non si muova quando il maiale si muove a causa della ventilazione o della stimolazione elettrica del nervo ulnare.
- Se l'ampiezza del segnale è inferiore a ± 20 mV (indicativo di scarso contatto o anestesia profonda), assicurarsi che il μECoG poggi sul cervello e che la dura madre e l'elettrodo siano idratati; Se necessario, gocciolare un po' di soluzione fisiologica sull'elettrodo. Assicurarsi che il sevoflurano sia stato disattivato e ridurre la velocità di infusione del propofol (e possibilmente del fentanil). Eseguire un test di stimolazione e verificare se le risposte evocate sono visibili. Assicurarsi che la parte non isolata del filo periferico sia interamente sotto la pelle.
NOTA: Le risposte evocate possono essere tipicamente distinte in singoli sweep online, ma è anche possibile valutarle offline, prendendo una media di 5-10 stimoli. Se un picco è visibile al momento dell'innesco, si tratta di un artefatto di stimolazione. L'artefatto di stimolazione interferirà con l'analisi dei dati.
- Posizionare una garza sterile sull'elettrodo per mantenere un buon contatto con i tessuti. Versare soluzione fisiologica a temperatura corporea sulla garza per evitare l'essiccazione del tessuto.
NOTA: Poiché queste registrazioni sono epidurali, la temperatura esatta non è essenziale. Con le registrazioni subdurali, questo è più critico. - Lasciare che l'elettrodo si stabilizzi (30 minuti) e documentare il posizionamento dell'elettrodo e la configurazione del connettore di terra per garantire registrazioni successive simili (Figura 5B-D). Avviare la registrazione e attendere 30 s prima di iniziare il programma di stimolazione ogni 10 minuti.
NOTA: Controllare regolarmente tra una registrazione e l'altra che la garza sull'elettrodo rimanga idratata e, se necessario, gocciolare soluzione fisiologica a temperatura corporea. - Eseguire un intervento dopo tre cicli di stimolazione (per fungere da base pre-intervento). Ripetere la stimolazione per altri nove cicli.
NOTA: Continuare a controllare regolarmente tra una registrazione e l'altra che la garza sull'elettrodo rimanga idratata e, se necessario, gocciolare soluzione fisiologica.
- Chiusura del sito implantare
- Rimuovere la garza dall'elettrodo e rimuovere l'elettrodo utilizzando il micromanipolatore guidandolo delicatamente con un batuffolo di cotone.
- Chiedere a un ricercatore non sterile di rimuovere e conservare il micromanipolatore, l'elettrodo, l'headstage e il preamplificatore e pulire l'elettrodo secondo le indicazioni del produttore utilizzando un rapido risciacquo con acqua deionizzata per rimuovere i residui di tessuto. Immergere l'elettrodo per un massimo di 4 ore nel detergente per lenti per rimuovere tessuti e proteine dalla superficie dell'elettrodo, seguito da un secondo risciacquo con acqua deionizzata per rimuovere il detergente per lenti dalla superficie dell'elettrodo. Prima di riporlo, immergere l'elettrodo in alcol isopropilico.
- Posizionare il tappo della finestra cranica per chiudere la finestra cranica, assicurandosi che si adatti perfettamente alla finestra cranica. Non richiede alcun fissaggio aggiuntivo; La pressione della pelle sull'impianto lo manterrà in posizione.
- Posizionare la sacca antibiotica sopra il tappo della finestra cranica e chiudere la pelle per via sottocutanea con singole suture riassorbibili utilizzando la tecnica della sutura a materasso verticale sepolta (Figura 6A). Posizionare le suture a una distanza di 5-10 mm, che lascia spazio per posizionare le suture cutanee. Non legare le ultime tre suture dopo averle posizionate. Invece, lega queste tre suture quando tutte le suture sono posizionate.
NOTA: Legare le ultime tre suture dopo averle posizionate tutte e tre assicura che ci sia spazio sufficiente per posizionare le ultime suture. - Posizionare suture intradermiche continue in modo continuo nella pelle. Iniziare la sutura intradermica 1-2 cm lateralmente al sito di incisione e scavare un tunnel sotto la pelle fino allo strato dermico della pelle ma sotto la sua superficie (Figura 6B) per evitare graffi eccessivi e allentamento delle suture. Fare un nodo all'estremità laterale della sutura.
NOTA: Il propofol e il fentanil possono essere disattivati durante questa procedura, poiché hanno diversi minuti di tempo di risveglio. - Posizionare la sutura continua tra le suture sottocutanee fino a raggiungere l'altro lato dell'incisione.
NOTA: È importante che la sutura esca dal derma ma non fori la pelle in modo che l'animale sia meno in grado di graffiare le suture. - Scavare la sutura a 1-2 cm lateralmente all'incisione fino a un sito di uscita laterale e fare un nodo (Figura 6B). Applicare la colla per tessuti sul sito dell'incisione.
- Recinto per il ritorno degli animali a casa
- Rimuovere i teli sterili dall'animale e svezzare l'animale dal ventilatore non appena si osserva un movimento.
- Trasferisci l'animale nel recinto di casa e tienilo separato dal compagno di recinto per una notte.
NOTA: I suini vengono separati dopo l'intervento chirurgico, poiché è normale che cerchino violentemente di svegliare il compagno di penna, provocando ferite da morso. I suini dovrebbero essere in grado di avere un contatto con il muso.
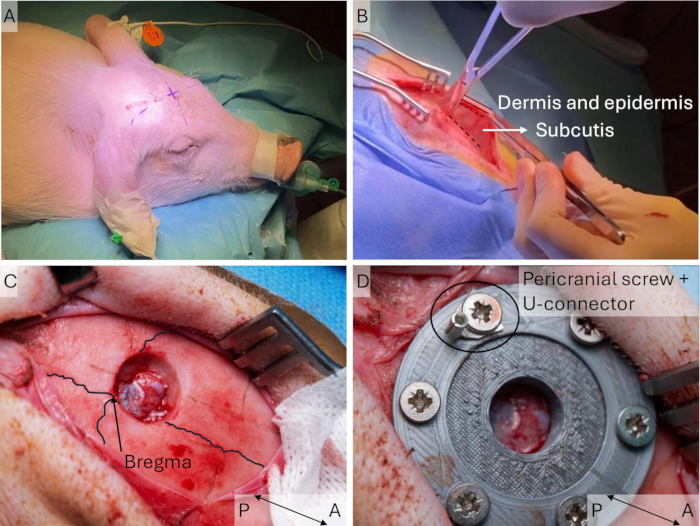
Figura 3: Impianto della finestra cranica. (A) La posizione prevista del punto di bregma è identificata e contrassegnata sul suino prima del drappeggio sterile, poiché può essere difficile distinguerla in seguito. (B) Dopo l'incisione cutanea, il sottocute avascolare viene allentato con le forbici. (C) Viene praticato un foro di 15 mm di diametro nel cranio e i bordi vengono rimossi utilizzando rongeurs. Le linee di sutura coronale e sagittale sono evidenziate. (D) La finestra cranica viene impiantata e fissata mediante viti. Clicca qui per visualizzare una versione più grande di questa figura.
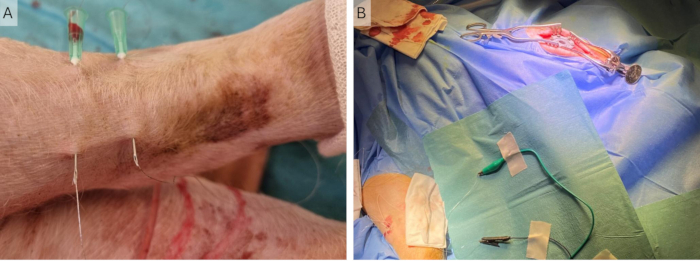
Figura 4: Impianto di fili periferici. (A) Due aghi da 23 G vengono inseriti nella pelle e i fili di Cooner vengono inseriti attraverso di essi. (B) Gli aghi vengono rimossi e i fili vengono lasciati nella pelle collegata allo stimolatore tramite clip a coccodrillo. Clicca qui per visualizzare una versione più grande di questa figura.
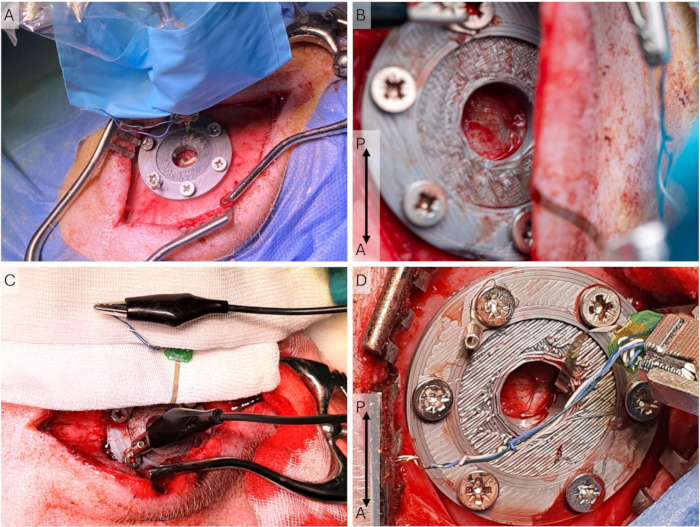
Figura 5: Configurazione della registrazione corticale. (A) L'array di elettrodi è posizionato sulla dura madre e il supporto dell'headstage e il micromanipolatore si trovano in un manicotto sterile durante un intervento chirurgico di impianto, dove l'incisione è più lunga e più laterale. (B) Primo piano del μECoG nella configurazione di registrazione durante un intervento chirurgico di accesso, dove l'incisione è più mediale. (C) La configurazione di messa a terra, in cui tutti i fili di messa a terra e di riferimento sull'ECoG sono cortocircuitati e collegati tramite il connettore a U alla vite pericranica. (D) Primo piano dell'headstage e del supporto dell'headstage durante un intervento chirurgico di accesso. Il μECoG è posizionato sulla dura. Abbreviazioni: ECoG = elettrocorticografia; μECoG = microECoG. Clicca qui per visualizzare una versione più grande di questa figura.
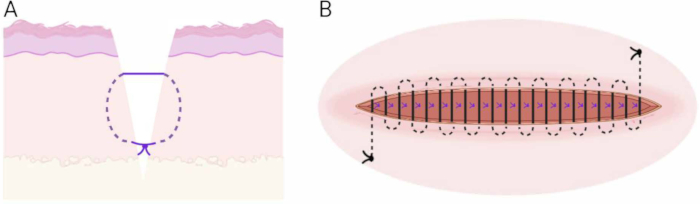
Figura 6: Tecnica di sutura. (A) Schema della tecnica del materasso verticale interrato sottocutaneo. (B) Schema della tecnica di sutura intradermica continua. Clicca qui per visualizzare una versione più grande di questa figura.
2. Chirurgia dell'accesso (Fase II)
NOTA: Dopo 2-4 settimane, la finestra cranica viene aperta per eseguire registrazioni di follow-up dei segnali corticali provenienti da S1. L'intervento chirurgico e la chiusura della ferita vengono nuovamente eseguiti in modo tale da consentire l'accesso e la richiusura della finestra cranica.
- Preparazione per l'intervento chirurgico
NOTA: I passaggi 2.1.1-2.1.6 sono simili ai passaggi 1.1.1.1-1.1.1.6.- Tranquillizzare l'animale utilizzando una miscela di zoletil (5 ml di zoletil [tiletamina 25 mg/mL e zolazepam 25 mg/mL], 6,25 ml di xilazina (20 mg/mL) e 2,5 ml di butorfanolo (10 mg/mL)).
NOTA: Per questo particolare studio, la ketamina è stata omessa dalla miscela di zoletil per evitare il blocco dei recettori NMDA. - Trasporta l'animale in sala operatoria e intubalo e ventilarlo.
- Posizionare un catetere venoso auricolare. Somministrare propofol, fentanil e soluzione salina tramite il catetere.
- Somministrare l'anestesia chirurgica: Sevoflurano 1-2%, propofol (10 mg/mL infuso a 8 mg∙kg-1∙h-1), fentanil (50 μg/mL infuso a 20 μg∙kg-1∙h-1).
- Se necessario, contrassegnare il sito di incisione utilizzando un pennarello sterile prima del drappeggio sterile. Identificare il punto bregma tracciando linee rette tra ciascun orecchio e l'occhio controlaterale; bregma si trova all'intersezione di queste linee (Figura 3A).
NOTA: L'incisione iniziale è in genere ancora visibile. La nuova incisione deve essere posizionata ad almeno 30 mm dall'incisione iniziale per evitare la maggior parte del tessuto cicatriziale e facilitare la chiusura della ferita. - Posizionare la piastra metallica sotto i teli e garantire il corretto posizionamento e stabilità prima di iniziare l'intervento chirurgico.
- Tranquillizzare l'animale utilizzando una miscela di zoletil (5 ml di zoletil [tiletamina 25 mg/mL e zolazepam 25 mg/mL], 6,25 ml di xilazina (20 mg/mL) e 2,5 ml di butorfanolo (10 mg/mL)).
- Accesso alla finestra cranica
NOTA: I passaggi 2.2.1-2.2.3 sono simili ai passaggi 1.1.2.1-1.1.2.3.- Praticare l'incisione iniziale nel derma con un bisturi leggermente laterale alla linea mediana come indicato al punto 2.1.5. Continuare l'incisione attraverso la pelle con un cauterizzatore.
NOTA: Nel caso di un esperimento terminale, l'incisione può essere praticata nella stessa posizione dell'incisione originale. - Posizionare il divaricatore e sostenere la pelle con una pinza e tagliare il tessuto connettivo avascolare tra il periostio e il sottocute (Figura 3B) per fornire maggiore flessibilità alla pelle e facilitare la sutura nel passaggio 1.4. Regolare il divaricatore in base alla flessibilità ottenuta.
NOTA: se si tratta di un esperimento terminale, questo passaggio può essere omesso. - Incidere il periostio e allentarlo dal cranio utilizzando l'elevatore del periostio. Tenere da parte il periostio utilizzando il divaricatore.
- Rimuovere il tappo della finestra cranica e rimuovere l'eventuale connettivo dall'apertura con delicati movimenti circolari con un batuffolo di cotone fino a raggiungere la dura madre.
- Praticare l'incisione iniziale nel derma con un bisturi leggermente laterale alla linea mediana come indicato al punto 2.1.5. Continuare l'incisione attraverso la pelle con un cauterizzatore.
- Impianto di filo periferico
- Ripetere il passaggio 1.2.
- Registrazione dei segnali corticali
- Ripetere il passaggio 1.3.
- Chiusura del sito implantare
- Ripetere il passaggio 1.4.
NOTA: se si tratta di un esperimento terminale, questo passaggio può essere omesso.
- Ripetere il passaggio 1.4.
3. Chirurgia terminale (Fase III)
NOTA: Dopo 2-4 settimane, la finestra cranica viene aperta per eseguire registrazioni di follow-up dei segnali corticali provenienti da S1. I passaggi 2.2-2.5 vengono ripetuti, come descritto sopra, seguiti dal passaggio 3.1.
- Eutanasia
NOTA: Il tubo del catetere venoso auricolare deve essere lavato con soluzione fisiologica per prevenire l'ossidazione del barbiturico.- Sciacquare il catetere venoso auricolare con soluzione fisiologica.
- Inserire una siringa con il sovradosaggio di pentobarbital (10 mL, 400 mg/mL) e iniettare il pentobarbital attraverso il catetere venoso auricolare.
Risultati
Utilizzando la tecnica della finestra cranica, i segnali corticali sono stati registrati in 43 sessioni in 16 animali. Gli animali sono guariti in modo appropriato dopo l'intervento chirurgico e sono stati alloggiati in coppia durante lo studio e monitorati quotidianamente utilizzando lo schema di benessere nella Tabella S1 supplementare. Tutti gli animali hanno ricevuto un punteggio 0 in ogni momento, indicando un eccellente benessere. La Figura 7 mostra che le finestre sono state effettivamente posizionate sopra l'area S1 della corteccia del maiale. Di solito si osservavano alcune cicatrici sulla dura madre in vivo e post-mortem (Figura 7A), ma l'esame post mortem ha rivelato che non ha mai colpito il tessuto corticale sottostante (Figura 7B), che appariva sano in tutti gli animali e paragonabile all'area S1 controlaterale.
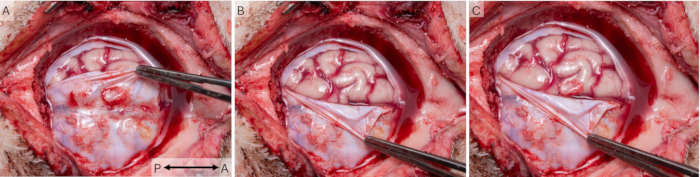
Figura 7: Posizionamento della finestra corticale in relazione all'anatomia cerebrale. (A) Per studiare la salute del tessuto corticale e il posizionamento della finestra corticale in relazione a S1, la finestra cranica è stata rimossa alla fine dello studio. In questo caso sono stati utilizzati intervalli chirurgici di 2 settimane e si può osservare del tessuto cicatriziale sulla dura. (B) Il tessuto cerebrale sottostante appare sano e non influenzato dall'impianto. (C) Una sovrapposizione delle due foto mostra che l'impianto copriva effettivamente l'area S1 della corteccia di maiale. La freccia indica l'asse antero-posteriore. Clicca qui per visualizzare una versione più grande di questa figura.
In breve, per analizzare i segnali corticali, devono essere filtrati per rimuovere il rumore di linea e altri artefatti (vedi Figura 8 e Tabella 1). Un filtro notch viene utilizzato intorno alla frequenza del rumore di linea, che in Europa è di 50 Hz e alle sue armoniche. I segnali vengono quindi filtrati passa-alto per rimuovere gli artefatti di movimento offset e a bassa frequenza; la frequenza di taglio massima dipende dallo scopo delle registrazioni, ma si sconsiglia di superare i 5 Hz, in quanto ciò attenuerà sia le caratteristiche ERP che l'EEG spontaneo. Inoltre, un filtro passa-basso viene utilizzato per rimuovere qualsiasi rumore ad alta frequenza. Poiché l'elettrodo è posizionato sopra la dura, le alte frequenze sono leggermente attenuate dal tessuto tra il cervello e l'elettrodo18. Pertanto, la frequenza di taglio può essere inferiore rispetto a quando l'elettrodo è situato direttamente sul tessuto cerebrale.
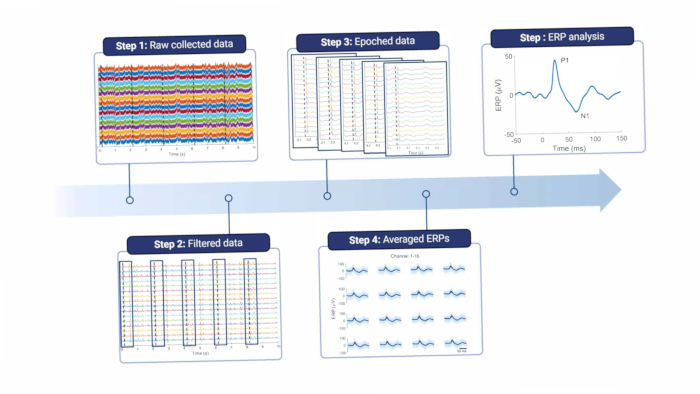
Figura 8: pipeline di elaborazione dati. I dati grezzi raccolti (passaggio 1) vengono elaborati mediante filtro (passaggio 2). Vengono poi suddivise in epoche in base ai trigger di stimolo (fase 3), che vengono mediati (fase 4). Per l'analisi dei dati vengono utilizzati gli ERP medi (fase 5). Abbreviazione: ERP = potenziali evento-correlati. Clicca qui per visualizzare una versione più grande di questa figura.
| Tipo di filtro | Taglio tipico | Ordine tipico | Cutoff utilizzato | Ordine usato |
| Tacca | 50±3 Hz o 60±3 Hz | Ordine elevato | 50±3 Hz e | 10° ordine |
| e armoniche | armoniche ±1 Hz | |||
| Passaggio alto | 0,1-5 Hz | Ordine basso | 1-5 Hz | 2° ordine |
| Passa basso | 100-1000 Hz | Ordine basso | 300 Hz | 2° ordine |
Tabella 1: Proprietà tipiche del filtro per l'analisi dei segnali cerebrali superficiali registrati con elettrodi per elettrocorticografia o elettroencefalografia.
I dati filtrati sono suddivisi in epoche di 50-100 ms prima e 500-1.000 ms dopo lo stimolo. I canali rumorosi vengono rimossi dai dati (Figura 9A) e le epoche contaminate da artefatti vengono rimosse (Figura 9B). Per ogni canale viene calcolata la media delle epoche rimanenti prive di artefatti. Le risposte evocate possono spesso essere distinte in singole sweep. Questi diventano più chiari e coerenti quando si calcola la media di almeno 10 risposte e non cambiano quando si fa la media di più di 25. Dovrebbero esserci almeno 20 epoche prive di artefatti per ottenere una media affidabile. Questo è tipicamente il caso, e in più della metà dei set di dati non è stato necessario rimuovere alcuna epoca. Per facilitare il confronto tra gli ERP registrati durante le diverse fasi (impianto, accesso, interventi chirurgici di eutanasia), i dati sono tipicamente normalizzati con z-score per tenere conto delle differenze nella profondità dell'anestesia e nell'attività di fondo.
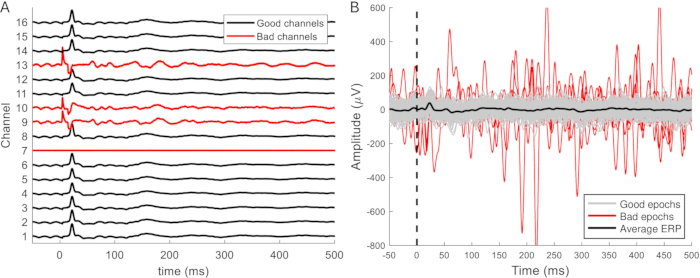
Figura 9: Esempi di canali ed epoche errati. (A) I segnali provenienti dalle registrazioni epidurali su un'area relativamente piccola del cervello hanno caratteristiche simili ma ampiezze diverse. I canali malfunzionanti sono facilmente distinguibili per la loro mancanza della forma d'onda ERP. Inoltre, i canali possono presentare artefatti, un aspetto più rumoroso e un'ampiezza del segnale maggiore (canali 9, 10 e 13). Il canale 7 è un altro esempio di canale malfunzionante e non rileva alcun segnale o rumore. (B) L'ampiezza ERP prevista è fino a circa 100 μV. Le epoche rumorose hanno tipicamente un'ampiezza maggiore, che può influenzare la forma d'onda media dell'ERP e dovrebbe quindi essere rimossa. La tipica forma d'onda ERP è carente tra queste, ma questa forma d'onda non è sempre distinguibile nelle singole epoche. Abbreviazione: ERP = potenziale evento-correlato. Clicca qui per visualizzare una versione più grande di questa figura.
L'affidabilità degli ERP registrati utilizzando la tecnica della finestra cranica era elevata in termini di ampiezze di picco e latenza19. Non sono state riscontrate differenze significative per l'ampiezza del picco (registrazione 1: 17,9 ± 7,26 μV; registrazione 2: 17,6 ± 10,1 μV; registrazione 3: 14,0 ± 6,95 μV) e la varianza tra i canali (registrazione 1: 6,47 ± 8,36 μV; registrazione 2: 3,93 ± 6,13 μV; registrazione 3: 3,84 ± 3,71 μV) in un'analisi misurata ripetuta della varianza (RM-ANOVA). È stata riscontrata una differenza significativa nella latenza di picco tra la prima e le successive registrazioni. Il picco è stato di 1 ms più tardi nella prima registrazione rispetto alle registrazioni di follow-up (registrazione 1: 25,2 ± 2,0 ms; registrazione 2: 24,0 ± 2,4 ms; registrazione 3: 24,1 ± 2,0 ms), che può essere correlato allo sviluppo del sistema nervoso20,21, poiché in questo studio sono stati utilizzati suini autoctoni adolescenti.
La tecnica della finestra cranica è stata ulteriormente utilizzata per studiare l'effetto della stimolazione ad alta frequenza (HFS) sugli ERP. L'HFS provoca un potenziamento a lungo termine dei neuroni superficiali delle corna dorsali nei roditori22,23, un aumento della sensibilità al dolore e un aumento delle risposte cerebrali evocate negli esseri umani24,25. È stato osservato un aumento significativo dell'ampiezza del picco N1 dei potenziali evento-correlati (259 ± aumento del 107% rispetto al basale pre-intervento) e si è potuta distinguere una chiara differenza tra HFS ed esperimenti in cui non è stato applicato HFS nello stesso animale (Figura 10)17.
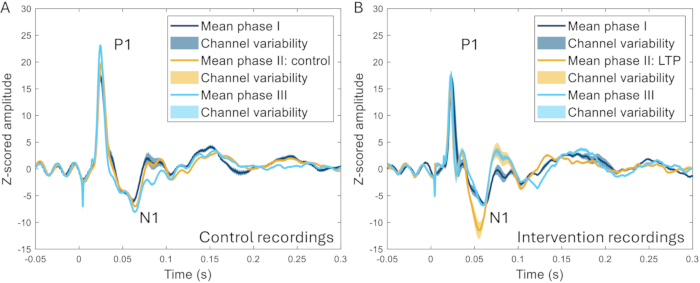
Figura 10: Esempi di ERP mediati su tutti i canali registrati 2-3 settimane prima, durante e 2-3 settimane dopo l'induzione di un modello di dolore. (A) L'ERP raccolto dallo stesso animale durante tre diverse registrazioni a distanza di 2 settimane l'una dall'altra mostra caratteristiche molto simili. (B) GLI ERP hanno caratteristiche simili tra le registrazioni, ma l'N1 ha un'ampiezza maggiore dopo l'induzione del potenziamento a lungo termine nella fase II rispetto alle altre fasi che sono 3-4 settimane prima e dopo la fase II. Le aree ombreggiate indicano la deviazione standard tra i canali. Abbreviazioni: ERP = potenziali evento-correlati; LTP = potenziamento a lungo termine. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella supplementare S1: Schema di benessere per valutare il comportamento solitario e sociale dei suini. Clicca qui per scaricare questo file.
Discussione
L'importanza dello sviluppo di questa tecnica risiede nella rimozione delle modalità di guasto degli elettrodi, nella riduzione delle risposte tissutali e quindi nel miglioramento dell'affidabilità delle tecniche di registrazione corticale invasive. Durante lo studio non si sono verificate modalità di guasto degli elettrodi e durante lo studio sono stati utilizzati un totale di due array ECoG, tra cui 16 animali e 43 sessioni di registrazione. Ciò ha un ulteriore impatto positivo sull'economia della ricerca. Utilizzando i metodi tradizionali completamente impiantati 12,26,27, sarebbero necessari almeno 16 array ECoG nell'ipotesi che non si verifichino guasti al dispositivo. Tuttavia, le modalità di fallimento e le risposte tissutali continuano a porre sfide significative all'implementazione diffusa della registrazione cerebrale intracranica 11,12,13,28,29. Questo studio ha ridotto sostanzialmente il numero di elettrodi, riducendo così sia il costo che il rischio degli studi cronici di neuroscienze.
L'unico evento avverso che si è verificato con le protesi della finestra cranica sono infezioni occasionali nei primi interventi chirurgici. Queste infezioni erano sempre superficiali (non raggiungevano il livello della dura) e si risolvevano con l'impianto di una spugna antibiotica riassorbibile Genta-coll. A causa dell'efficacia di questo trattamento, l'impianto della spugna antibiotica è stato adottato come parte dell'impianto della finestra cranica come misura preventiva. Nonostante i maiali siano animali forti che eseguono comportamenti di radicamento, nessuno degli impianti realizzati in PLA standard si è rotto.
Tutti gli elettrodi impiantati sono soggetti a una risposta da corpo estraneo e all'incapsulamento gliale o fibroso 14,15,28,29,30. Ciò significa che l'interfaccia elettrodo-tessuto, così come la capacità di registrazione dell'elettrodo, cambia nel tempo dopo l'impianto 13,18,28. Utilizzando il metodo attuale, le risposte tissutali non hanno influenzato l'integrità e la fedeltà di registrazione degli elettrodi grazie alla strategia di posizionamento temporaneo degli elettrodi. L'elettrodo è stato posizionato sulla dura madre durante ogni sessione e l'interfaccia elettrodo-tessuto è stata quindi paragonabile durante ogni sessione. L'unico fattore che potrebbe essere leggermente diverso per sessione è la posizione dell'elettrodo. È quindi fondamentale abbinare le dimensioni della finestra alle dimensioni dell'elettrodo e scattare foto del posizionamento dell'elettrodo durante ogni sessione di registrazione. Grazie a questi sforzi, sono stati registrati ERP altamente affidabili e riproducibili19.
Si è verificata una risposta tissutale all'impianto della finestra cranica e la ricrescita ossea è stata osservata nei primi piloti che utilizzavano una finestra transcranica senza pareti che si estendevano dalla superficie esterna del cranio alla dura. Uno strato continuo di tessuto osseo molle è stato trovato 2 settimane dopo la prima sessione, indicando la ricrescita ossea. Era impossibile rimuovere questo tessuto e accedere alla dura; pertanto, alla finestra cranica sono state aggiunte pareti verticali che si estendono dalla superficie del cranio alla duramadre 31 . Sono state stampate finestre con pareti di diverse lunghezze per abbinare l'impianto allo spessore del cranio per evitare pressioni sulla corteccia. Gli animali sono stati studiati dopo l'eutanasia, che ha rivelato un tessuto cerebrale dall'aspetto sano in tutti gli animali. I tessuti molli si formano ancora all'interno dell'area della finestra; Tuttavia, non si attacca al muro e non è in continuità con il cranio, il che lo rende facile da rimuovere con un batuffolo di cotone. È fondamentale per l'affidabilità delle registrazioni che questo tessuto molle venga rimosso dalla finestra in modo che l'elettrodo venga posizionato ogni volta sulla dura madre.
I risultati ottimali si ottengono con almeno 3 settimane tra gli interventi chirurgici. A 2 settimane, la finestra cranica è accessibile, ma i tessuti molli nell'area della finestra sono attaccati alla dura. Inoltre, l'apertura e la chiusura della ferita sono complicate da sanguinamento e mancanza di flessibilità nel tessuto. A 3 e 4 settimane, la ferita da incisione è sufficientemente guarita da rendere distinti i normali confini dei tessuti (ad esempio, periostio, pelle, dura), facilitando la rimozione del tessuto molle dalla finestra e la richiusura della pelle sopra l'impianto. Poiché non è stato osservato alcun tessuto simile all'osso a intervalli di 4 settimane, possono essere possibili più di 4 settimane tra gli interventi chirurgici e gli interventi chirurgici ad accesso multiplo. Non abbiamo indagato se il periodo tra gli interventi chirurgici possa essere esteso a diversi mesi.
Per il successo degli interventi chirurgici di impianto e accesso, l'incisione iniziale e la chiusura della ferita sono fondamentali. La flessibilità della pelle della fronte del maiale è molto limitata, motivo per cui è essenziale allentare lo strato sottocutaneo avascolare della pelle. Ciò fornisce una maggiore flessibilità per chiudere la pelle sopra l'impianto e riduce lo stress sulle suture. Questo stress viene ulteriormente ridotto utilizzando due strati di suture e colla per la pelle aggiuntiva. La pelle viene suturata utilizzando una tecnica di sutura intradermica continua per evitare che gli animali graffino le ferite e rimuovano prematuramente i punti di sutura. Le strategie di apertura e chiusura della ferita sono fondamentali in entrambi i tipi di chirurgia di sopravvivenza, sia che si tratti di un impianto o di un intervento chirurgico di accesso.
Un limite dell'approccio attuale è che l'accesso alla finestra richiede un piccolo intervento chirurgico, il che preclude le registrazioni negli animali svegli. Ciò significa che, a seconda della domanda di ricerca, non sarà un approccio adatto per ogni studio. Per i dispositivi completamente impiantati da utilizzare nelle registrazioni da sveglio, esistono altri metodi per superare i cambiamenti biologici all'interfaccia32. Poiché l'accesso alla finestra cranica è una procedura di piccole dimensioni, potrebbe essere possibile utilizzare un anestetico locale e un sedativo piuttosto che l'anestesia generale. I vantaggi della finestra cranica interamente sotto la pelle sono la riduzione delle possibilità di infezione e il miglioramento del benessere degli animali, poiché gli animali possono essere alloggiati in coppia o in gruppo. Inoltre, abbiamo solo studiato l'affidabilità delle risposte evocate19. Tuttavia, l'attività cerebrale spontanea è stata registrata ed è generalmente più affidabile e riproducibile dell'ERP8, indicando che il metodo non si limita alla registrazione dell'ERP.
Il nostro metodo presenta un metodo nuovo, scalabile, affidabile e riproducibile per le registrazioni corticali croniche. Questo metodo è molto prezioso per gli studi di ricerca sulle neuroscienze, dove l'affidabilità e la riproducibilità sono essenziali per l'esito degli studi33,34. Abbiamo utilizzato il metodo per studiare le risposte evocate corticali da S1 prima e dopo l'induzione di diversi modelli di dolore e controlli, mostrando risultati robusti17. In generale, il metodo può essere facilmente adattato per accedere ad altre aree corticali, ad esempio per indagare il movimento, l'udito o la vista. Potrebbe anche essere possibile utilizzare il metodo per la diagnosi di epilessia 4,35 o monitorare il trattamento e la riabilitazione dopo una lesione cerebrale36,37.
Il metodo è anche scalabile ad altre specie, come primati non umani o altri mammiferi, gatti, cani o pecore 35,38,39. Ciascuno di questi adattamenti richiederà la regolazione della tecnica chirurgica, l'identificazione di punti di riferimento affidabili per il posizionamento della finestra cranica e la regolazione del suo design. Gli autori raccomandano l'uso di cadaveri per ottimizzare la tecnica della finestra cranica prima di procedere ai test pilota. Per alcune aree cerebrali, l'intervento chirurgico può essere più invasivo, il che può comportare un tempo di recupero ottimale diverso da quello raccomandato. La tecnica può, inoltre, essere adattata per consentire registrazioni ECoG subdurali e registrazioni intracorticali, ampliando così le sue applicazioni e aumentando l'accesso a varie regioni del cervello. A causa dello spessore del cranio suino, potrebbe essere necessario aumentare le dimensioni della finestra corticale per eseguire la durotomia per le registrazioni subdurali26,27.
Per le registrazioni intracorticali, è possibile posizionare l'elettrodo tramite una cannula o una navetta40, che consente un'ulteriore riduzione delle dimensioni della finestra corticale. Sia le tecniche subdurali che quelle intracraniche aumenteranno il rischio di sanguinamento, quindi è necessario prestare attenzione durante l'intervento chirurgico per evitare i vasi sanguigni. La tecnica della finestra cranica può essere utilizzata anche per scopi diversi dalla registrazione di segnali elettrici dal cervello, ad esempio l'imaging del sistema vascolare, che è molto rilevante nei modelli suini di emicrania41. Inoltre, il metodo della finestra cranica può essere adattato per l'uso in combinazione con nuove tecniche di imaging31, come l'imaging a 2 fotoni, e può essere combinato con il sostituto durale sviluppato da Costine-Bartell et al. per una migliore risoluzione ottica42.
In conclusione, l'approccio metodologico presentato riduce i rischi legati a un impianto permanente12,13 eliminando il rischio di fallimento del dispositivo, riducendo al minimo le risposte biologiche nel sito dell'elettrodo e, quindi, aumentando la fedeltà della registrazione e ottenendo registrazioni corticali altamente affidabili. La metodologia è molto promettente anche per altre applicazioni, in quanto è scalabile per altre specie e tipi di registrazione.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Gli autori desiderano ringraziare i custodi degli animali e i tecnici della struttura per animali da laboratorio presso l'ospedale universitario di Aalborg. Il Centro per la Neuroplasticità e il Dolore (CNAP) è supportato dalla Fondazione Nazionale Danese per la Ricerca (DNRF121). La Figura 6 e la Figura 8 sono state create in BioRender.
Materiali
| Name | Company | Catalog Number | Comments |
| Cranial window implantation | |||
| Scalpel | disposable, blade 10 | ||
| Tweezers | |||
| Gauze | |||
| Cauterizer | |||
| Periosteum elevator | flat, 10 mm width | ||
| Weitlaner retractor | 3 x 4 prong, blunt, 16.5 cm | ||
| Midas Rex Legend EHS stylus surgical drill system | Medtronic Powered Surgical Solutions, Fort Worth, USA | ||
| Legend Ball Fine drill bits | Medtronic Powered Surgical Solutions, Fort Worth, USA | 7BA40F-MN and 7BA60F-MN | MedNext type 4 and 6 mm head diameter |
| Sterile cover for the drill | |||
| Syringe | 5 mL | ||
| Saline | |||
| Suction | |||
| Ruler | |||
| Cotton buds | |||
| Rongeur | straight jaw, 15 cm, 3 x 20 mm bit size | ||
| 2.5 mm hand drill and handle | |||
| Butterfly infusion set | |||
| Six M3 screws in 6-14 mm length | |||
| Screwdriver | |||
| Three sizes of 3D-printed cranial window (4-, 5- and 6-mm depth) and cap | |||
| Deisolated U-shaped connector | |||
| Crocodile connector | |||
| Genta-coll resorbable antibiotic sponge | |||
| VYCRIL resorbable suture | Ethicon | 2-0 26 mm round bodied | |
| Monocryl non-resorbable suture | Ethicon | 3-0 24 mm reverse cutting | |
| Needle holder | |||
| Scissors | |||
| Topical adhesive tissue glue | Leukosan | ||
| Peripheral wire implantation | |||
| Two partially uninsulated Cooner wires | |||
| NOTE: 1-2 cm of the wires is uninsulated in the middle and at one of the ends | |||
| Two 23 G needles | |||
| Gauze | |||
| Programmable stimulator controlled by a PC running MC_stimulus | Multichannel Systems, Reutlingen, Germany | STG4008 | |
| Two crocodile connectors | |||
| Cortical recordings | |||
| Metal plate for the magnetic micromanipulator | |||
| Magnetic micromanipulator stand | |||
| Micromanipulator | |||
| Headstage holder | |||
| 32-channel ZIF-clip headstage | TDT, Alachua, FL, USA | ||
| 32-channel micro-electrocorticography (µECoG) array | Neuronexus, Ann Arbor, USA | E32-1000-30-200 | |
| TDT recording equipment including pre-amplifier SI8, data processor RZ2 and workstation WS8 | TDT, Alachua, FL, USA |
Riferimenti
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon