Method Article
Intravital Longitudinal Imaging of Vascular Dynamics in the Calvarial Bone Marrow(갈바리골수에서 혈관 역학의 생체 내 종단 영상)
요약
생체 내 현미경 검사를 통해 조직 재생 및 종양 발달과 같은 동적 생물학적 과정을 연구할 수 있습니다. 매우 역동적인 조직인 calvarial bone marrow는 조혈과 혈관 기능에 대한 통찰력을 제공합니다. 생체 적합성 3D 프린팅 머리 고정 임플란트를 사용하면 반복적인 종방향 이미징이 가능하여 조직 역학 및 종양 미세환경에 대한 이해가 향상됩니다.
초록
생체 내 종방향 형광 현미경 이미징은 특히 조직 재생, 종양 발달 및 치료 반응의 맥락에서 동적 생물학적 과정을 연구하기 위한 중요한 기술로 부상했습니다. 특히, calvarial 골수는 매우 역동적인 조직으로, 조혈의 운명이 주변 미세환경과 상호 연결되어 있으며, 특수 혈관이 정상 및 병리학적 조혈에 반응합니다. 고정된 조직에 대한 기존의 이미징은 정적 정보를 제공하여 이러한 프로세스에 대한 포괄적인 이해를 제한하는 경우가 많습니다.
세포 특이적 마커를 발현하는 형질전환 동물, 살아있는 세포 추적자, 이미징 장비의 발전 및 특수 챔버의 사용으로 인해 생체 내 현미경 검사는 역동적인 생물학적 현상에 대한 통찰력을 얻기 위한 중추적인 도구로 부상했습니다. 생체 내 영상의 한 가지 응용 분야는 종양 혈관 거동 및 치료 효과에 대한 조사입니다. 새롭게 설계된 3D 프린팅 티타늄 머리 고정 임플란트는 마우스의 두개골에 안정적으로 연결할 수 있으며 여러 세션 중 종방향 이미징에 적합합니다.
제안된 프로토콜은 혈관 이질성의 시각화 및 정량화, 기질 및 조혈 세포와의 상호 작용, 혈관 기능 매개변수의 측정을 포함하여 골수 골수의 혈관 역학에 대한 공간적 및 시간적 검사를 허용합니다. 또한 이 기술을 사용하면 이광자 현미경을 사용하여 확립된 혈관층을 시각화하고 치료 효과, 줄기세포 동원 및 시간 경과에 따른 화학요법 화합물의 국소화를 모니터링할 수 있습니다. 전반적으로 이 생체 내 종방향 이미징 프로토콜은 종양 혈관 거동과 조혈 세포 역학을 모두 조사하기 위한 포괄적인 플랫폼을 제공하여 이러한 생물학적 현상을 제어하는 복잡한 과정에 대한 귀중한 통찰력을 제공합니다.
서문
갈바리 골수(BM)의 생체 내 현미경 이미징은 BM 틈새 시장 내에서 조혈, 조직 미세환경 조절 및 혈관 역학의 동적 과정을 조사하기 위한 강력하고 필수적인 기술 역할을 합니다. 이 방법론적 접근 방식의 주요 목적은 생체 내 BM 미세환경 내에서 세포 행동, 상호 작용 및 공간 조직에 대한 실시간 시각화 및 분석을 가능하게 하는 것입니다. 연구자들은 형광 표지와 결합된 고급 이미징 기술을 사용하여 BM 칼바리아를 직접 관찰함으로써 조혈 줄기세포(HSC), 기질 세포 및 주변 혈관 구조 간의 복잡한 상호 작용을 규명할 수 있으며, 이를 통해 조혈 및 면역 반응 조절에 대한 중요한 통찰력을 제공할 수 있습니다.
생체 내 현미경 검사 이미징 줄기 세포의 개발 및 활용은 종종 세포 거동 및 조직 상호 작용의 동적 특성을 포착하지 못하는 전통적인 조직학적 및 생체 외 이미징 방법의 한계에서 비롯됩니다. 정적 이미징 기술과 달리 생체 내 현미경을 사용하면 연구원이 실시간으로 세포 역학을 관찰할 수 있으므로 실험 동물을 희생하지 않고도 본래의 틈새 시장 내에서 세포 이동, 증식 및 분화와 같은 종적 과정을 연구할 수 있습니다. 또한, 생체 내 현미경 검사는 혈관 기능(예: 관류, 투과성, 저산소증)과 같은 생체 내 기능적 행동을 연구할 수 있는 고유한 이점을 제공하여 생리학적 관련성을 보존하고 조직 고정 및 처리와 관련된 인공물을 피할 수 있습니다. 이 분야의 선구적인 연구는 이 접근법 1,2의 엄청난 이점을 입증했으며, 그들의 발견은 BM 틈새 시장 내에서 내인성 HSC 국소화, 이동 및 혈관 조직과의 상호 작용을 추적하기 위해 생체 내 현미경을 활용한 보다 최근에 개선된 접근법 3,4,5에 의해 확증되고 확장되었습니다. 또한, 생체 내 현미경 검사는 백혈병 및 BM 부전 증후군과 같은 조혈 질환의 기전을 밝히는 데 중요한 역할을 했으며, 백혈병 세포 운동성 6,7, 질병 관련 혈관 영향8 및 약물 반응9에 대한 새로운 통찰력을 제공합니다.
골수 BM의 생체 내 현미경 이미징은 대체 뼈 부위를 덮는 몇 가지 장점이 있습니다. 첫째, 두개골 내에 포함된 BM은 대퇴골 또는 경골과 같은 더 깊은 뼈에 비해 생체 내 이미징에 쉽게 접근할 수 있습니다. 이러한 접근성은 침습적 수술 절차의 필요 없이 2차 조화 생성(SHG) 시각화10을 통해 뼈 자체를 포함한 조직 미세환경을 직접 관찰할 수 있도록 합니다. 둘째, 두개골은 상대적으로 얇고 반투명하여 BM 틈새 내에서 세포 역학을 더 잘 시각화할 수 있습니다. 이러한 투명성은 뼈를 얇게 하거나 투명하게 하는 기술 없이도 이광자 현미경, 컨포칼 현미경 및 광시트 현미경을 통해 고해상도 이미징을 용이하게 합니다. 종골골은 생체 내 이미징 실험을 위한 안정적이고 평평하며 견고한 플랫폼을 제공하여 조직 움직임 아티팩트를 최소화하고 장기간의 관찰 기간 동안 일관된 이미징 조건을 보장합니다. 이러한 안정성은 시간 경과에 따른 세포 거동 및 반응을 추적하는 종단 연구에 특히 유리합니다. 재현성은 실험 동물 전반에 걸쳐 상대적으로 작고 공간적으로 정의된 종골 구조를 감안할 때 또 다른 큰 이점입니다. 이러한 균일성은 서로 다른 실험 그룹 간의 비교를 용이하게 하고 이미징 데이터의 강력한 통계 분석을 가능하게 합니다.
여기에서는 생체 적합성 23등급 티타늄 합금(Ti6Al4V)을 사용하여 3D 프린팅된 새로 개발된 머리 고정 임플란트11을 도입하여 생체 내 이광자 현미경을 통해 마우스 칼바리 BM을 이미지화하는 방법을 설명합니다. 임플란트는 임플란트 홀더를 통해 마우스 헤드를 현미경 스테이지에 견고하고 안정적으로 고정하여 호흡 아티팩트를 최소화하고 시간이 지남에 따라 동일한 영역을 종방향 이미징할 수 있습니다. BM 미세환경(SHG+ 뼈 표면; nestin-GFP+ 중간엽 세포; cdh5-DSRED+, cdh5-GFP+ 또는 pdgfb-GFP+ 내피 세포) 및 악성 조혈 구획(tdTOMATO+ AML 세포) 및 혈관의 내강을 묘사하는 형광 조영제(dextran-TRITC). 혈관 길이, 직진도, 직경, 다양한 혈관 영역에서의 투과성을 포함하여 몇 시간 또는 며칠에 걸쳐 측정된 혈관 매개변수는 조직 거동 및 건강에 대한 중요한 정보를 제공할 수 있습니다.
프로토콜
모든 동물 실험은 프랑스 "Ministère de l'enseignement supérieur, de la recherche et de l'innovation"의 승인을 받은 윤리 협약 APAFIS#27215-2020041513522374 v6에 따라 수행되었습니다.
1. 3D 프린팅을 위한 생체적합성 티타늄 헤드 고정 임플란트 설계
참고: 당사는 유한 요소 해석(FEA) 기능이 내장된 파라메트릭 모델링 CAD(Computer-Aided Design) 소프트웨어를 사용하여 생체 적합성 머리 고정 임플란트를 설계했습니다( 재료 표 참조). 설계 프로세스의 주요 입력물에는 마우스 두개골의 고해상도 해부학적 모델, 현미경 대물렌즈 모델 및 고정 시스템 모델이 포함되며, 이 모든 것들은 임플란트의 치수와 구성을 알려줍니다. 최종 출력은 일반적으로 STL 또는 STEP 형식의 플랫폼 독립적 메시 파일이며 대부분의 3D 프린팅 소프트웨어와 호환됩니다. 이 파일 형식은 정확한 임플란트 제작을 위해 3D 프린터로 원활하게 전송할 수 있도록 합니다.
- 마우스의 3D 모델 준비
- 준비된 마우스 두개골 또는 생체 내 마우스 두개골을 마이크로 CT 스캐너에 배치합니다.
- 미세한 해부학적 세부 사항의 최적 해상도를 위한 스캔 매개변수 설정: Control Panel(제어판 )을 열고 Scan Conditions(스캔 조건 ) 섹션에서 Field of View(FOV)를 선택합니다. LiveView 를 사용하여 스캔 볼륨을 정의합니다.
알림: 검출기 해상도를 통해 FOV는 검출기 해상도에 따라 복셀 크기를 결정합니다. 최신 마이크로 CT 기계에서 5mm FOV는 일반적으로 5μm 복셀 크기, 10mm FOV 에서 10μm 복셀 크기, 25mm FOV 에서 21μm 복셀 크기에 해당합니다. 이 해상도에서 제한된 FOV는 전체 두개골을 덮기 위해 여러 번의 스캔이 필요할 수 있습니다. 여러 스캔을 수행하려면 스캔 간에 겹쳐야 합니다. - 이미징 소프트웨어에서 여러 고해상도 스캔을 함께 연결하여 하나의 포괄적인 두개골 모델을 만들 수 있습니다.
- 마이크로 CT DICOM 파일을 세분화 소프트웨어(예: 3D Slicer, Amira, Avizo 또는 Mimics)로 가져와 두개골을 분리합니다.
- 임계값 기반 분할을 수행하여 주변 구조에서 뼈 조직을 분리하고 복잡하거나 노이즈가 있는 영역을 미세 조정하기 위해 수동으로 조정합니다.
- 3D 슬라이서에서 먼저 DICOM 파일을 가져와서 데이터 세트를 로드하고 축, 시상 및 관상 슬라이스 보기에서 CT 슬라이스를 관찰합니다.
- Segment Editor을 열고 Add를 클릭하여 새 세분화를 만듭니다. 추가를 클릭하여 임계값을 설정할 새 세그먼트를 만듭니다.
- Segment Editor 패널에서 Threshold 효과를 클릭합니다. Lower (하한) 및 Upper threshold(상한 임계값) 슬라이더를 조정(또는 숫자 값 입력)하여 세그먼트화할 영역이 슬라이스 보기에서 빨간색으로 강조 표시되도록 합니다. 임계값이 지정된 3D 세그먼트가 준비되었습니다.
- 분할된 두개골을 STL 파일로 내보내려면 세분화 모듈로 변경합니다. 임계값이 지정된 세그먼트가 선택되어 있는지 확인합니다. Export/Import Models and Labelmaps 섹션에서 Export type 을 Models로 설정합니다. 및 파일 형식: STL. 내보내기 버튼을 클릭합니다.
참고: STL 파일은 삼각형 메쉬 형식을 사용하여 두개골 표면을 수천 개의 삼각형으로 표현하여 해부학적 모양을 세밀하게 캡처합니다.- 필요한 경우 다음과 같이 MeshLab에서 스티칭을 수행합니다.
- Import meshes by click( 파일) | Import Mesh(메시 를 불러오고 참조 스캔으로 하나를 선택합니다).
- Align 도구를 사용하여 다른 스캔을 정렬합니다(Filters | 참가신청 | 정렬)을 사용하여 해당 점을 표시하고 프로세스를 사용합니다.
- 정렬된 스캔을 병합하려면 Filters( 필터) | 메쉬 레이어 | Merge Only Visible Layers 옵션을 사용하여 Visible Layers를 병합합니다.
- 필요한 경우 다음과 같이 MeshLab에서 스티칭을 수행합니다.
- 메쉬를 청소하고 복구하여 다음과 같이 중복된 정점과 삼각형을 제거하여 노이즈로 인한 삼각형을 제거하고 의도하지 않은 구멍을 채워 매끄럽고 연속적인 표면을 얻습니다.
- Filters( 필터)를 클릭합니다. 청소 및 수리 | 중복된 정점을 제거합니다.
- Filters( 필터)를 클릭합니다. 청소 및 수리 | 중복된 면을 제거합니다.
- Filters( 필터)를 클릭합니다. 청소 및 수리 | 분리된 조각을 제거합니다(면 번호에 의해). 유지할 최소 면 수에 대한 임계값을 지정합니다(예: 작은 클러스터 또는 노이즈를 제거하려면 이 임계값을 낮게 설정).
- Filters( 필터)를 클릭합니다. Remeshing, Simplification, and Reconstruction [리메싱, 단순화 및 재구성] | 구멍을 닫습니다.
- 마이크로 CT의 초기 STL 파일에는 CAD 소프트웨어와 호환되지 않는 매우 높은 삼각형 수가 포함되어 있으므로 ~10,000-30,000개의 삼각형으로 메쉬 단순화를 수행합니다. 매우 세밀한 영역에서는 정확한 임플란트 착용을 보장하기 위해 두개골 상단에 더 작은 삼각형을 유지하십시오. 거친 영역에서는 더 큰 삼각형으로 덜 중요한 영역을 단순화하여 파일 크기를 줄이고 처리 효율성을 최적화합니다.
참고: 메쉬 단순화는 영역별로 이루어지며 1.1.8.1-1.1.8.3에 자세히 설명되어 있습니다.- 영역 선택 도구에서 Select Connected Components를 사용하여 단순화할 영역을 선택할 수 있습니다.
- 매개변수가 있는 선택한 영역에서 Quadratic Edge Collapse Decimation 을 사용합니다. Filters( 필터)를 클릭합니다. Remeshing, Simplification and Reconstruction [리메싱, 단순화 및 재구성] | 단순화: Quadric Edge Collapse Decimation. 품질 임계값 을 0.8로 설정하고, 메시의 경계를 YES 로 유지 하고, 토폴로지 를 YES로 유지하고, 대상 면 수: 필요한 해상도 에 해당하는 대상 번호를 설정합니다.
- 총 삼각형 수가 원하는 수준으로 줄어들 때까지 필요에 따라 반복합니다. 그런 다음 단순화된 모델을 STL 파일에 저장합니다.
- CAD 모델에서 두개골 모델 준비
- STL 형식의 단순화된 두개골 모델을 CAD 소프트웨어에 새 부품 또는 모델로 가져올 수 있습니다. 필요한 경우 가져온 파일이 소프트웨어의 기능에 따라 솔리드 또는 곡면 본체로 제대로 변환되었는지 확인합니다. 모델을 기본 CAD 파일 형식으로 저장하여 추가 수정을 가능하게 하고 후속 설계 단계와의 호환성을 보장합니다.
- Bregma 및 Lambda에 참조점을 배치하고 이 모델에서 Bregma-Lambda 축을 만듭니다.
- Bregma-Lambda 축을 포함하는 중앙분리대 평면을 만듭니다.
- 중앙분리대 평면에서 calvaria에 접하는 축을 만든 다음 준비된 두개골을 저장합니다(보충 그림 S1).
- 새 어셈블리를 만들고 준비된 두개골을 Bregma가 원점과 일치하고, 중앙면 평면이 오른쪽 평면과 일치하고, calvarial 축이 수평이 되는 방식으로 삽입합니다.
- 머리 고정 임플란트는 준비된 두개골 모델과 완벽하게 맞도록 어셈블리 내에서 직접 설계됩니다. 이를 위해 임플란트를 어셈블리 내에서 새 파트로 만듭니다. 먼저 Insert (삽입) | 구성 요소 | CAD 소프트웨어의 새 부품 . 프롬프트가 표시되면 calvaria 곡면 또는 어셈블리의 맨 위 평면을 참조로 선택하여 새 파트를 배치하고 앵커링합니다.
- 두개골을 가로질러 동일한 간격(2mm 간격)의 평면 세트를 만듭니다. 각 평면에서 스케치를 작성하고 각 스케치에서 두개골 위 0.2mm 높이의 두개골 상단 표면 단면을 따라 9개의 점이 있는 대칭 스플라인 형태로 0.2mm 오프셋 투영 곡선을 그립니다(보충 그림 S2).
- 이 스플라인( Skull Limit Surface)을 사용하여 스윕 표면을 만들어 이 표면이 결함 없이 매끄럽도록 하여 임플란트 피처를 구성하는 데 사용합니다.
- 두개골에서 관찰 가능한 표면의 정의
참고: 3D 모델을 기반으로 3D 관찰에 이상적인 칼바리아 뼈의 가장 평평한 영역이 식별됩니다. 이 영역은 두개골의 생물학적, 구조적 무결성을 고려하면서 이광자 현미경의 대물렌즈에 대한 최적의 접근을 보장하기 위해 신중하게 선택됩니다. 정의는 Bregma 점이 좌표계의 원점 역할을하는 입체 좌표를 사용할 수 있습니다.- calvarial plane에 스케치를 작성하고 AP +6.5에서 -2, AP 0.0에서 6mm 폭의 배 모양 스플라인을 작성합니다. 이것은 Observable Surface Contour (보충 그림 S3)가 될 것입니다.
참고: microscope objective는 이전에 정의된 두개골의 관찰 가능한 표면에 상대적으로 가상으로 배치됩니다. 이 단계에는 대물렌즈의 크기와 모양에 의해 부과되는 공간적 제약을 결정하여 임플란트 디자인이 현미경의 요구 사항을 수용하는지 확인하는 작업이 포함됩니다. - 현미경 대물렌즈 모델을 어셈블리에 수직으로 삽입합니다. calvarial bone 이온의 calvarial plane에 평행한 평면에 초점을 제한하고 Microscope Objective의 Bounding Volume을 정의합니다.
- Observable Surface Contour를 따라 목표를 스윕하여 볼륨을 생성합니다.
- 정의된 관찰 가능한 표면 주위에 관찰 창을 만들어 현미경 대물렌즈가 방해받지 않고 접근할 수 있도록 합니다.
참고: 관찰 창은 침수 액체 보유 및 보호 덮개의 올바른 닫힘을 위한 고체 구조와 같은 보조 기능을 가진 고리 모양의 구조입니다. - calvarial plane에 스케치를 작성하고 관찰 가능한 곡면 윤곽선을 복사합니다.
- 0.5mm 두께의 평행 윤곽선을 만듭니다. 이 이중 윤곽을 위쪽으로 0.9mm 돌출시키고 4° 드래프트 각도로 두개골 한계 표면 표면으로 아래쪽으로 돌출시킵니다.
- calvarial plane에 스케치를 작성하고 AP +6.5에서 -2, AP 0.0에서 6mm 폭의 배 모양 스플라인을 작성합니다. 이것은 Observable Surface Contour (보충 그림 S3)가 될 것입니다.
- 시멘트, 꼬리 및 더브테일 구조를 정의합니다.
- calvarial plane에 스케치를 만들고 관찰 창에 연결하는 0.5mm 두께의 C 모양을 그리고 4° 구배 각도로 표면 Skull Limit Surface까지 2mm 높이와 아래쪽으로 돌출합니다(보충 그림 S4).
- calvarial plane에 스케치를 작성하고 이 공간을 방사형으로 배치된 0.4mm 두께의 직사각형으로 채우고 그 사이에 1mm의 공간을 둡니다.
- 관찰 창(Observation Window)과 비슷하게 돌출시킵니다.
- 사용 가능한 부피를 고려하여 두개골에 고정하는 임플란트의 꼬리를 만듭니다.
- 접합 구조물에 접선으로 횡단 평면을 만들고 뒤로 12.5mm 더 만듭니다.
- 이 평면에 직사각형을 스케치합니다. 그 사이에 피라미드 모양의 몸체를 스윕하고 각도를 수평에서 약 20°와 37°로 설정합니다.
- 시멘트 구조 근처의 꼬리에 나사산 M1.6 구멍을 추가합니다.
- 꼬리 끝에 스케치를 작성하고 더브테일 프로파일을 그립니다.
- 이 프로파일을 8mm 돌출시킵니다.
- 대물렌즈에 대한 비간섭 확인.
- 관찰 창과 더브테일을 포함한 전체 임플란트 디자인을 검사하여 현미경 대물렌즈에 기계적 간섭이 없는지 확인합니다. 1.3.3단계에서 생성된 볼륨에 간섭이 있는지 확인합니다.
참고: 이 검증 단계는 장애물 없이 필요에 따라 목표를 배치하고 이동할 수 있는지 확인하는 데 중요합니다.
- 관찰 창과 더브테일을 포함한 전체 임플란트 디자인을 검사하여 현미경 대물렌즈에 기계적 간섭이 없는지 확인합니다. 1.3.3단계에서 생성된 볼륨에 간섭이 있는지 확인합니다.
- 보형물의 꼬리에서 불필요한 물질을 제거하여 무게를 최소화하고 동물의 잠재적인 불편함을 줄입니다.
- 중앙분리대 평면에 스케치를 작성하고 그 위에 삼각형 컷아웃을 그려 꼬리 본체에서 돌출로 추출할 때 트러스 구조를 형성합니다.
- 수직 평면에서 반복합니다.
- FEM(Finite Element Method) 시뮬레이션을 통해 최대 변위를 검증하여 다양한 조건에서 임플란트의 기계적 특성을 해석합니다.
참고: 이 시뮬레이션은 사용 중 임플란트 내의 최대 변위와 응력을 예측하는 데 도움이 되어 신뢰성을 보장합니다.- CAD 소프트웨어 시뮬레이션 애드인을 활성화합니다.
- Simulation 도구 모음에서 새 정적 스터디를 작성합니다. Simulation 탭(보이는 경우)으로 이동하거나 Simulation(시뮬레이션) | 공부하다. 스터디(Study) 대화 상자에서 스터디 유형으로 정적(Static)을 선택합니다. 확인을 클릭하여 새 스터디를 만듭니다(보충 그림 S5).
참고: 이 스터디 유형은 임플란트 사용에서 예상되는 대로 정적 하중 하에서 변형 및 응력을 분석하는 데 적합합니다. - 실제 임플란트 조성(Ti6Al4V)과 일치하는 임플란트 소재를 선택합니다.
- 고정 구속조건을 정의하여 더브테일 고정과 접촉하는 임플란트의 부착점을 시뮬레이션합니다. 더브테일의 상단 표면을 고정으로 정의합니다.
- 임플란트의 바닥 표면에 가해지는 수직 하중 을 정의합니다. 1N의 수직 힘을 설정합니다.
- 메쉬를 생성합니다. 높은 응력 또는 변형이 예상되는 영역에서 메쉬를 미세 조정합니다(보충 그림 S6). 이렇게 하려면 스터디 트리의 메쉬 요소를 마우스 오른쪽 버튼으로 클릭하고 Create Mesh... 메쉬 대화상자에서 슬라이더를 사용하거나 메쉬 컨트롤 상자를 활성화하여 메쉬 밀도를 조정하여 최대 및 최소 요소 크기를 독립적으로 설정합니다. OK(확인)를 클릭하여 메시를 생성합니다.
참고: 소프트웨어는 스터디에 대한 초기 메시를 자동으로 생성하지만, 보다 정확한 결과를 위해 특히 임플란트 안정성에 중요한 영역(예: 관찰 창)에서 더 미세한 메시를 선택하기 위해 메시를 미세 조정할 수 있습니다. 이러한 영역에서 더 미세한 메시를 사용하면 국소 응력 집중을 캡처하여 시뮬레이션의 정확도가 향상됩니다. - 정적 해석을 시작하여 임플란트 전체의 변위, 응력 및 변형률 분포를 계산합니다.
- 결과를 분석합니다. 변위 플롯을 검사하여 최대 변형 영역을 식별합니다. 이 플롯은 적용된 하중 하에서 임플란트가 얼마나 변형되는지를 보여주며, 과도한 움직임의 위험이 있는 영역을 강조 표시합니다. Observation Window 내부의 변형이 3미크론을 초과하지 않는지 확인합니다.
- 마지막으로, 사용하지 않을 때 관찰 창을 보호할 수 있는 보호 덮개를 설계하십시오. 이 뚜껑은 노출된 뼈를 환경 오염 물질 및 물리적 손상으로부터 보호합니다.
2. 마우스 치료, 마취 및 머리 임플란트의 외과적 임플란트
참고: 여기에서는 그림과 같이 수컷 또는 암컷, 7주에서 12주 된 C57BL/6 또는 형질전환 마우스를 사용할 수 있습니다. BM의 백혈병 집락화를 유도하기 위해, Horton 등12에 기술된 바와 같이 생성된 백혈병 세포를 이미징 2-3주 전에 정맥 주사합니다. 상처의 건강을 보장하려면 멸균 기술을 사용해야 합니다.
- 후드 아래에서 멸균 수술 도구(무딘 가위 및 핀셋), 트리머 및 안구 젤, 식염수, 소독제, 치과 시멘트, 흡수성 면봉 및 세척 티슈를 포함한 소모품을 조립합니다. 비드 살균기를 켭니다.
- 마취 유도 챔버에 4% 이소플루란과 대기 산소를 채우고 마우스를 챔버에 넣습니다. 동물이 완전히 마취되면(오른쪽 반사 상실 및 더 깊고 느린 호흡 패턴 확인) 마취 마스크의 콧방울로 이소플루란 흐름을 전환하고 이소플루란 농도를 2%로 낮춥니다.
- 마우스를 37°C 가열 패드에 놓고 호흡수를 육안으로 모니터링합니다. 선택 사항: 병리학적 표현형이 있는 마우스의 경우 마취 내내 올바른 온도를 유지하기 위해 생존 담요를 추가합니다.
- 수술 30분 전에 진통제를 피하하(Buprecare, 0.01mg/kg)로 투여합니다.
- 전기 면도기로 마우스 머리를 면도하십시오.
- 마취제 상태에서 건조함을 방지하기 위해 마우스의 눈에 안과 젤 한 방울을 떨어뜨리고 젤이 두피에 떨어지지 않도록 합니다.
- 마우스를 청소하여 수술 부위에 남아 있는 털을 제거합니다. 면 티슈에 소독제로 두피 상단을 닦습니다. 상처 감염의 위험뿐만 아니라 이미징 아티팩트를 피하기 위해 모든 머리카락을 제거해야 합니다.
- 멸균 집게와 가위를 사용하여(멸균기에서 30초 후) 두피 중앙 부분을 작게 절개하여 중앙의 뼈 흉터를 드러냅니다. 이를 따라 올바른 길이 및 너비 이미징 영역을 정의하십시오. 두피 부분을 조심스럽게 제거하고 집게를 사용하여 귀 사이의 피부를 들어 올린 다음 머리 뒤쪽을 작게 절개합니다. 피부를 위로 잡고 가위를 피부 아래로 통과시키고 이미징 영역 바깥쪽을 조심스럽게 자릅니다.
- 두개골과 두피 사이의 결합 조직을 제거합니다. 면봉에 멸균 PBS로 노출된 뼈를 닦습니다. 두개골 뼈가 장기간 노출되는 것을 방지하기 위해 머리 임플란트를 마우스의 두개골에 빠르게 부착합니다(<10분).
- 제조업체의 지침에 따라 페트리 접시에 충분한 치과 시멘트를 넣은 페이스트를 만들고 머리 고정 임플란트의 바닥에 빠르게 바릅니다.
- 이미징 영역 내부에 치과 시멘트가 묻지 않도록 헤드 홀더를 노출된 마우스의 두개골에 놓고 굳을 때까지 기다립니다.
- 설정이 완료되면(보통 3-5분 이내) 이미징 챔버에 37°C PBS를 몇 방울 떨어뜨려 두개골의 수분을 유지합니다.
3. 이광자 현미경을 사용한 이미징
- 수술을 시작하기 전에 레이저를 켜고 안정화를 위해 예열하십시오. 현미경을 켜고 수집 소프트웨어를 시작합니다. 적절한 대물렌즈를 선택합니다(이 실험의 경우 25x/0.95 WATER IMMERSION).
- xy 스테이지와 일체로 이동할 수 있도록 히트패드가 있는 수의학 브레드보드를 배치할 수 있는 충분한 공간이 있는 fix-stage 직립 현미경 스탠드를 사용합니다. 견고한 알루미늄 광학 브레드보드를 플랫폼으로 사용하여 헤드 임플란트와 입위 마스크를 고정합니다. 이소플루란 주입 및 추출과 관련된 플렉시블 호스와 커넥터를 현미경 케이지의 마스크에 연결합니다.
- 빠른 스캔을 위한 획득 설정 구성: 512 x 512 픽셀 포맷, 600Hz 속도; 및 확대/축소 계수 1.
- 880nm에서 레이저 라인을 조정하여 동일한 여기 파장을 가진 SHG, GFP 및 tdTOMATO를 검출할 수 있습니다.
- NDD 검출기를 활성화하고 스펙트럼 검출 게이트를 정의하기 전에 실내의 조명을 끄고 현미경 스탠드 주변의 상자를 올바르게 닫습니다: PMT1, SHG [388 - 431 nm] 검출; GFP[485 - 548 nm]의 경우 HyD2, tdTOMATO[551 - 645 nm]의 경우 HyD3. 오프셋을 0으로 둡니다.
- 새 프로젝트 데이터 세트를 만들고 특정 실험에 따라 이름을 바꿉니다.
- 머리 고정 임플란트가 마우스의 두개골에 부착되면(시멘트 경화를 통해 확인됨) 현미경의 입체 마스크 쪽으로 이소플루란을 켭니다.
- 마우스를 빠르게 현미경으로 가져옵니다. 마우스 이빨을 마스크에 조심스럽게 삽입하여 한 손으로 코를 들어 올려 이소플루란이 마우스 코를 통해 침투할 수 있도록 합니다.
- 한 손으로 마우스를 잡고 다른 손으로 머리 고정 임플란트의 더브테일을 고정 홀더에 부드럽게 밀어 넣고 나사 손잡이를 반바퀴 돌려 고정합니다.
- 온도 모니터링을 위해 수성 젤이 미리 내장된 직장 프로브를 삽입하고 마우스의 눈에 점안액을 추가합니다.
- 헤드 이미징 챔버를 다량의 수성 젤 또는 PBS로 채우고 Water Im멀젼 대물렌즈를 낮추어 완전히 담그면 이광자 여기에 의해 생성된 신호의 최적 여기 및 검출을 얻을 수 있습니다.
- x-y 스테이지와 z 드라이브를 이동하여 골격 흉터의 중앙 뼈에 초점을 맞춥니다.
참고: 현미경의 접안렌즈와 메탈 할라이드 타입을 사용하는 것이 편리합니다.amp 트라이 밴드 여기 방출 필터로 필터링된 광원으로 사용합니다. 광학 절단이 부족하면 선명한 이미지를 얻을 수 없습니다. 그러나 연습을 하면 두개골의 중앙 영역을 쉽게 알아볼 수 있습니다. - 뼈 표면과 중심 정맥으로 표시된 조직을 식별한 후 메탈 할라이드 램프를 끄고 현미경 케이지 창을 닫아 HyD 검출기를 보호하고 적외선(IR) 레이저가 통과할 수 있도록 합니다.
- PMT/SHG 게인을 850V(선형 작동 범위)로 설정하고 HyD 게인을 100%로 설정합니다. 3개 채널 중 가장 낮은 채널에서 200 그레이 레벨(8비트 검출기 동적 사용)의 동적 범위를 가진 이미지를 얻을 때까지 IR 레이저 출력을 높입니다. 방출 차이가 너무 중요하거나 "언더 로우" 룩업 테이블(LUT) 모드를 사용하여 포화가 있는 경우 다른 검출기의 이득을 줄입니다.
참고: 우리의 경우 30%의 레이저 출력으로 모든 채널에서 대비를 얻을 수 있었습니다. - 수집 소프트웨어에서 뼈 표면(SHG) 내에 둘러싸인 BM 포켓(GFP+, tdTOMATO+)으로 만들어진 영역을 검색합니다.
- 다양한 ROI를 찾으려면 LAS NAVIGATOR 를 활성화하고 나선형 모드를 사용하여 전체 영역에 대한 개요를 생성합니다. 획득된 표면이 충분히 크면 획득을 중지합니다. 개요를 저장하고, 병합하고, 이름을 바꿉니다: 이것은 종방향 이미징의 경우 참조 이미지가 됩니다.
알림: 너무 큰 나선형을 생성하면 장치 홀더가 대물렌즈와 접촉할 수 있으므로 주의하십시오. - 단일 이미지 아이콘을 클릭하여 일부 ROI 위치를 기록하고 작업 목록에서 각 위치의 이름을 바꿉니다. 화면 캡처를 수행하여 이전에 저장된 개요에 다양한 ROI의 상대적 위치를 겹쳐 놓습니다.
참고: 이 화면 캡처는 수집 소프트웨어가 이 실험에 사용된 버전에서 이 위치 그룹을 불러오는 것을 허용하지 않기 때문에 종적 이미징에서 ROI를 대체하는 데 필수적입니다. - z-stack 볼륨을 획득하려면 z-stack 모드를 선택하고, 3μm에서 스텝 크기를 정의하고, 모든 영역에 대해 동일한 스택 크기 옵션을 선택 취소합니다. 첫 번째 위치를 선택하고, 위쪽 및 아래쪽 위치를 정의하고, z-스텝 크기를 확인하고, 스택 재정의를 클릭합니다. 큐브 아이콘은 위치 목록의 위치 이름 옆에 나타납니다. 서로 다른 ROI의 모든 위치에 대해 이 단계를 반복합니다.
- acquire를 누르고 이미지(~50개의 계획이 있는 3개 채널 z-스택)를 적절한 폴더에 저장합니다. 이 단계는 실험의 Tctrl을 표시합니다. 획득 매개변수가 올바른지 확인합니다(3개 채널에서 올바른 동적 범위를 얻고, 가능한 한 신호 포화를 피하고, 전체 주기에 대한 수집 시간을 확인합니다).
- 동적 특징(이 경우 혈관 투과성)을 측정하려면 타임랩스를 획득하십시오.
- 이 설정에서 3개의 검출기를 통해 3개의 채널을 동시에 이미징할 수 있습니다. 실험에 네 번째 채널이 필요한 경우(이 경우 덱스트란 모니터링) 순차 모드를 활성화하고 두 번째 수집 시퀀스를 추가합니다. Dextran Cy5 형광단을 여기시킬 수 있도록 820nm 에서 IR 레이저 라인을 조정합니다. Hyd2 감지 범위를 [650 - 744 nm]로 변경하고 다른 검출기를 비활성화합니다. 스택 획득 모드 중에서 선택합니다.
참고: 기본적으로 두 번째 획득 시퀀스는 시퀀스 1과 동일한 매개변수를 갖습니다. - 타임랩스를 시작하기 전에 모든 포지션 획득을 시작하여 녹음 시간이 덱스트란 누출을 감지하는 데 필요한 최소 시간인 3분(순차 모드 추가를 고려)을 초과하지 않도록 합니다.
- 덱스트런 주입 전에 획득 모드를 xyzt로 변경합니다. t 모듈에서 시간 간격을 3분으로, 기간을 1시간으로 조정합니다.
- 이 설정에서 3개의 검출기를 통해 3개의 채널을 동시에 이미징할 수 있습니다. 실험에 네 번째 채널이 필요한 경우(이 경우 덱스트란 모니터링) 순차 모드를 활성화하고 두 번째 수집 시퀀스를 추가합니다. Dextran Cy5 형광단을 여기시킬 수 있도록 820nm 에서 IR 레이저 라인을 조정합니다. Hyd2 감지 범위를 [650 - 744 nm]로 변경하고 다른 검출기를 비활성화합니다. 스택 획득 모드 중에서 선택합니다.
- 100μL의 덱스트란 70 KDa-TRITC(또는 500 KDa-Cy5)를 마우스 당 3mg으로 정맥 주사하고 획득을 시작합니다.
- 획득 후 데이터 세트를 적절한 폴더에 저장합니다.
알림: 이 여러 단계에서 마우스의 호흡 빈도와 온도를 자주 모니터링하고 필요한 경우 이소플루란 흐름을 조정하십시오. 이상적으로는 온도, ECG 및 호흡 속도를 기록하고 실험의 메타데이터로 포함할 수 있습니다.
4. 마우스 복구
- 이미징 세션이 완료되면 획득 소프트웨어 내에서 HyDs 검출기를 비활성화하고 마우스 가열 상자(37°C)를 켭니다. 현미경 케이지를 열고 대물렌즈를 들어 올린 다음 마우스에서 직장 프로브를 제거합니다. 다음으로, 머리 고정 임플란트의 더브테일을 고정 홀더에서 부드럽게 밀어내고 마우스를 현미경의 정위 마스크에서 열 패드의 수술 마스크로 이동합니다.
- 현미경으로 이소플루란 주입을 끄고 열 패드를 끕니다.
- 멸균 면봉으로 마우스의 두개골에서 수성 젤 또는 PBS를 부드럽게 제거합니다.
- 앞서 설명한 바와 같이 이미징 세션 사이에 두개골 수분을 유지하기 위해 intrasite gel을 추가합니다13.
- 특정 커버로 머리 임플란트의 이미징 영역을 닫고 나사로 조심스럽게 고정합니다.
- 마우스를 37°C의 가열 상자에 넣고 깨어날 때까지 기다립니다. 쥐를 동물 시설로 데려와 하이드로겔과 농축제가 함유된 깨끗한 우리에 수용합니다. 매일 동물을 모니터링하여 통증이나 감염의 징후를 발견하고, 이 경우 매일 부프레케어를 투여합니다. 종골 습도를 유지하려면 인트라사이트 젤을 일주일에 2회 교체하십시오.
참고: 판지 대피소와 둥지 재료가 있는 높은 케이지를 선택하고 마우스를 개별 케이지에 넣어야 합니다.
5. 종단적 인수
참고: 다음 날 동안 마우스를 다시 이미지화할 수 있습니다. 그러나 반복적인 마취로 인한 안구 건조증이나 과도한 피로, 호흡 곤란 및 저체온증과 같은 원치 않는 영향을 피하기 위해 일주일에 3회 이상 영상 촬영 세션을 반복하지 마십시오.
- 헤드 홀더가 이미 설치된 마우스를 다시 이미징하려면 2.2단계를 수행하고 시술 중 건조를 방지하기 위해 마우스의 눈에 안과 젤 한 방울을 떨어뜨립니다.
- 섹션 3에서 3.16단계까지 따라 개요 이미지를 얻습니다.
참고: 홀더 위치의 높이나 각도를 변경할 필요 없이 헤드 티타늄 임플란트를 사용하면 전체 관심 영역을 매우 쉽게 찾을 수 있습니다. - 필요한 경우 열린 이미지 및 정렬 모듈을 사용하여 이전 이미지와 새 이미지를 다시 정렬합니다.
- 3.17단계의 화면 캡처 이미지를 열어 원래 위치에 위치를 표시합니다.
참고: SHG 대비를 사용하는 것은 GFP를 발현하는 혈관 및 관련 세포의 리모델링을 예상할 때 특히 유용합니다. - 3.18-3.22단계에서 설명한 것과 동일한 방식으로 z-스택과 타임랩스를 획득합니다.
6. 혈관 매개변수 정량화
- 혈관 매개변수
- 소프트웨어로 생성된 이미지(.lif 파일)를 IMARIS에서 열려면 먼저 파일 변환기를 사용하여 ".ims" 형식으로 변환하십시오. IMARIS로 ".ims" 파일을 열고 메타데이터(X, Y, Z 스케일)를 확인한 다음 필라멘트 모듈을 선택합니다. 자동 생성 건너뛰기, 수동 편집을 선택합니다.
- 필라멘트 생성 중에 더 나은 시각화를 위해 Settings(리프 기호)로 이동하여 Line in Style을 선택하고 픽셀 수를 기본값(1)으로 둡니다. Show dendrites(시작점, 분기점, Terminal 점)를 포함한 상자를 선택합니다. 척추 표시를 선택 해제합니다.
- draw(브러시 기호)에서 Method AutoPath(지름은 5μm)를 선택하고 용기와 연결된 채널 소스(이 경우 TRITC-Dextran)를 선택합니다. 마지막으로 자동 중앙 및 자동 직경r을 선택합니다.
- Shift + 마우스 오른쪽 버튼을 클릭하여 분기의 시작점을 선택하고 Shift + 마우스 왼쪽 버튼을 클릭하여 분기의 끝점을 선택하여 필라멘트 그리기를 시작합니다.
참고: 시작점은 연한 파란색, 분기점은 빨간색 또는 진한 파란색, 끝점은 녹색입니다. - 그리는 동안 필라멘트의 올바른 지름을 설정하려면 마우스 스크롤 버튼을 사용합니다.
- 서로 다른 단자점이 있는 두 필라멘트를 결합하려면 두 필라멘트 사이에 새 시작점을 만들고 각 끝점에 연결합니다.
참고: 따라서 녹색 단자점이 분기점에 나타납니다. - 혈관 트리가 생성되면 설정으로 돌아가서 시작점, 분기점 및 단자점의 수가 올바른지 확인합니다. 원뿔 을 선택하여 지름을 시각화하고 모양을 확인합니다.
- 필라멘트 지름(또는 연결)이 잘못된 것 같으면 편집 (연필 기호)으로 이동하여 마우스 오른쪽 버튼을 클릭하여 제거할 필라멘트를 선택하고 삭제를 클릭합니다. 마우스 스크롤 버튼으로 필라멘트의 지름을 조정하여 필라멘트를 다시 그립니다.
- 생성된 모든 통계 데이터를 추출하고 저장하려면 Statistic(통계) 아이콘 | export all statistics to file-(화면 하단의 Multiple floppy Disks(여러 플로피 디스크) 아이콘)을 클릭합니다.
참고: 혈관에 해당하지 않는 잠재적으로 비정상적인 필라멘트를 방지하기 위해 20μm보다 긴 필라멘트만 통계 분석에 포함되었습니다.
- 누출 정량화
참고: IMARIS에서 소프트웨어(.lif 파일)로 생성된 이미지를 열려면 먼저 파일 변환기를 사용하여 ".ims" 형식으로 변환하십시오.- 동일한 시계열에서 덱스트란 주입 전후에 촬영한 이미지를 병합하려면 Surpass 모드로 이동하여 첫 번째 이미지(Tctrl , 덱스트란 주입 전)와 타임랩스 이미지(시간 1, 60분)를 모두 클릭하여 연 다음 편집을 클릭하고 시간 지점을 추가하여 결합합니다.
참고: 최종 3D 드리프트를 수정하려면 피지와 IMARIS 간의 브리지 기능을 사용하여 6.2.2-6.2.7 단계를 수행합니다. 피지에 "IMARIS_Bridge96.jar" 및 "IMARISBridgeUtils.jar" 플러그인을 설치하십시오. 3D 드리프트 등록은 "StackReg Pluging"(이미 피지에서 사용 가능)을 사용하여 수행됩니다. 필요하지 않은 경우 6.2.8단계로 이동합니다 - 3D 드리프트 보정을 수행하려면 Plugins(플러그인) | 이마리스 | 이미지 출처: IMARIS.
- 피지에서는 Plugins(플러그인) | 참가신청 | 올바른 3D 드리프트.
- 표시되는 새 창에서 등록에 적합한 채널을 선택합니다.
참고: 이 경우 Nestin-GFP였지만 움직이지 않는 물체와 높은 신호 대 배경 비율을 강조하는 모든 채널일 수 있습니다. - 작은 드리프트 감지를 향상시키려면 다중 시간 척도 계산, 하위 픽셀 드리프트 보정 및 에지 향상 이미지를 선택하고 다른 설정은 기본값으로 둡니다.
- 수정된 이미지를 IMARIS에 브리지하려면 해당 이미지를 선택하고 Plugins(플러그인) | 이마리스 | 이미지 제공: IMARIS.
- File(파일) | 다른 이름으로 저장.
- 수집된 모든 채널을 시각화하려면 Edit(편집) | 디스플레이 조정을 표시합니다. dextran 채널 과 시간 1 (화면 하단의 프레임 2 )을 선택합니다.
- Add new surface(새 표면 추가) 확인란을 선택하여 시점 1에서 혈관 내강을 정의하는 새 표면(파란색 개체)을 생성합니다.
- Surface 1에서 Properties(속성)로 이동하여 Algorithm Settings(알고리즘 설정)의 모든 매개변수를 선택 취소합니다. 다음 단계를 클릭합니다(파란색 화살표).
- Source channel(소스 채널)에서 vascular channel(이 경우 dextran)을 선택하고 Smooth and background subtraction(매끄럽게 배경 빼기)을 선택합니다. 다른 모든 매개변수는 기본값으로 둡니다. 다음 단계(파란색 화살표)를 클릭합니다.
- Threshold 값은 모든 포지티브 영역의 두께와 적용 범위 측면에서 표면 모양에 따라 조정합니다. 다음 단계(파란색 화살표)를 클릭합니다.
- 불특정 표면(대부분 작은 점)을 기본적으로 복셀 수(Number of Voxels) 필터를 사용하여 제외합니다. 마지막 단계 (녹색 화살표)를 클릭합니다.
- 필요한 경우 Setting parameters(매개변수 설정)에서 편집(연필 아이콘)을 클릭하여 표면을 수동으로 계속 조정합니다. 제거할 개체를 선택하려면 해당 개체를 마우스 왼쪽 버튼으로 클릭하고 삭제를 선택하여 삭제합니다. 삭제할 객체가 다른 객체에 정렬된 경우 Shift + 두 부분 사이를 클릭하고 단면 절단을 선택하여 표면의 분리된 두 부분을 분리합니다. 필요한 만큼 이 단계를 반복합니다.
- 마지막으로 선택 모드 (오른쪽의 대상 아이콘)를 사용하여 모든 세그먼트를 결합하고 Control + Scroll 을 눌러 모든 개체를 복구합니다. 모두 선택되었으면 마우스 왼쪽 버튼을 클릭하고 통합을 클릭합니다.
- 참조 지표면을 생성하려면 이 지표면을 다른 시점에 복사합니다. 전체 표면을 선택하고 복제를 클릭하여 복제한 다음 이름을 Intravascular로 바꿉니다.
- Intravascular(혈관 내) 표면을 선택하고 Duplicate to all Timepoints(모든 시점에 복제)를 클릭합니다.
- dextran 신호를 분할하여 혈관 내(IN) 영역과 혈관 외(OUT) 영역을 구분합니다. 모든 시점에 대한 IN channeI를 만들려면 Intravascular(혈관 내) | 편집 (연필 단추) | 모두 마스크.
- 채널 선택에서 적절한 채널을 선택하고 마스크를 적용하기 전에 중복 채널을 선택합니다. Mask Settings(마스크 설정)에서 Constant inside/outside(내부/외부 상수)만 선택하고 voxels outside surface(외부 표면)를 0으로 설정합니다. 마지막으로 모든 시점에 적용도 체크합니다.
- Display Adjustment에서는 기본적으로 masked라는 이름의 새 채널이 생성됩니다. 이름을 IN으로 바꿉니다.
- 모든 시점에 대해 채널 OUT 을 만들려면 6.2.18-6.2.20단계를 반복하되 표면 내부의 복셀을 0으로 설정을 선택합니다. 이 새 채널 OUT의 이름을 바꿉니다.
- 통계 데이터를 추출하려면 Statistic(통계) 아이콘 | Export All Statistics to File(모든 통계를 파일로 내보내기 )(화면 하단의 여러 플로피 디스크 아이콘)
- 누수를 분석하려면 각 시점에 대해 외부의 강도 합계 채널을 내부의 강도 합계 채널로 나눕니다.
- 동일한 시계열에서 덱스트란 주입 전후에 촬영한 이미지를 병합하려면 Surpass 모드로 이동하여 첫 번째 이미지(Tctrl , 덱스트란 주입 전)와 타임랩스 이미지(시간 1, 60분)를 모두 클릭하여 연 다음 편집을 클릭하고 시간 지점을 추가하여 결합합니다.
결과
그림 1과 그림 2에서 CAD 모델은 스캔한 쥐 두개골에 배치된 티타늄 머리 고정 임플란트의 모습을 보여주며, 이 임플란트는 두개골의 해부학적 구조를 따르도록 설계되었으며 현미경 스테이지에 단단히 고정할 수 있는 가볍고 생체 적합성 장치를 제공하여 세포 수준의 안정성을 보장합니다. 이 단계별 프로토콜을 따르면 임플란트가 마우스의 두개골에 안정적으로 부착되고 더브테일로 현미경 홀더에 단단히 고정될 수 있으므로 시간이 지남에 따라 액체 체류 및 생체 내 관찰을 위한 평평한 이미징 영역이 가능합니다. 상처의 손상이나 감염을 최소화하기 위해 덮개로 닫을 수 있어 몇 주에 걸쳐 동일한 조직 영역을 반복적으로 이미징할 수 있습니다. 머리 임플란트를 착용한 쥐는 깨어나면 자유롭게 돌아다니고, 먹이를 먹고, 규칙적인 일상을 보낼 수 있습니다.
그림 3은 세동맥, 전이 모세혈관 및 정현파를 포함한 이질적인 모세혈관으로 만들어진 갈바리 BM 혈관구조의 타일 스캔 보기를 보여줍니다. 혈관은 뼈 표면 및 혈관 주위 중간엽 세포와 밀접하게 접촉하는 복잡한 조직 미세환경에 내장되어 있습니다. 백혈병이 발병하는 동안, 혈관과 가까운 BM 미세환경 내에서 단일의 고립된 백혈병 세포를 검출할 수 있으며, 시간이 지남에 따라 생착이 증가하여 질병의 말기에 칼바리아를 채웁니다.
그림 4는 이 프로토콜로 얻은 이미지가 통계적 방법으로 분석할 수 있는 정량적 데이터를 제공하는 방법을 보여줍니다. IMARIS 필라멘트 도구로 혈관을 분할하고 혈관 조각의 길이와 직경, 직진도를 측정하는 방법을 보여줍니다. 이러한 매개변수의 상관 관계도 평가할 수 있습니다.
그림 5는 4일, 7일, 10일째에 AML 진행 중 골관절 BM의 두 가지 다른 위치에 대한 종단 이미징 획득을 보여주며, 10일째는 유세포 분석법을 통해 측정된 바와 같이 백혈병 세포와 BM의 ~50% 생착과 관련이 있습니다(표시되지 않음). 우리는 기존 혈관의 크기에 대한 중요한 리모델링뿐만 아니라 국소 뼈 손실과 관련된 특정 영역에서 새로운 혈관의 형성을 관찰할 수 있습니다.
마지막으로, 그림 6에서는 시간이 지남에 따라 다양한 혈관 장벽이 형광 염료를 유지하는 능력을 보여주는 타임 랩스 이미징을 통해 혈관 투과성을 동적 매개변수로 측정하는 방법을 보여줍니다.

그림 1: 티타늄 기반 생체 적합성 헤드 홀더의 설계 및 생산. (A) 임플란트 현장 부품: 관찰 링 1개, 접합 기능 2개, 안정화 앵커 3개, 꼬리 4개, 더브테일 5개, 나사 구멍 6개, 브레그마 7개. (B) 헤드 임플란트와 홀더의 연결: 8 고정 본체, 9 클램프, 10 편심 레버, 11 구조, 12 현미경 대물렌즈. (C) 최대 변위가 0.04N 힘에 대해 0.23μm인 FEM 시뮬레이션에 의한 하중에 대한 임플란트의 변형. (D) 덮개와 그 나사를 보호합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 생체 내 이미징을 위한 마우스 준비. (A) 이미징 전에 수술로 노출된 머리 임플란트와 이미징 영역의 모습. (B) 마우스의 두개골에 단단히 부착된 머리 임플란트. (C) 머리 임플란트의 덮개가 닫힌 회복 케이지에서 깨어 있는 쥐. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
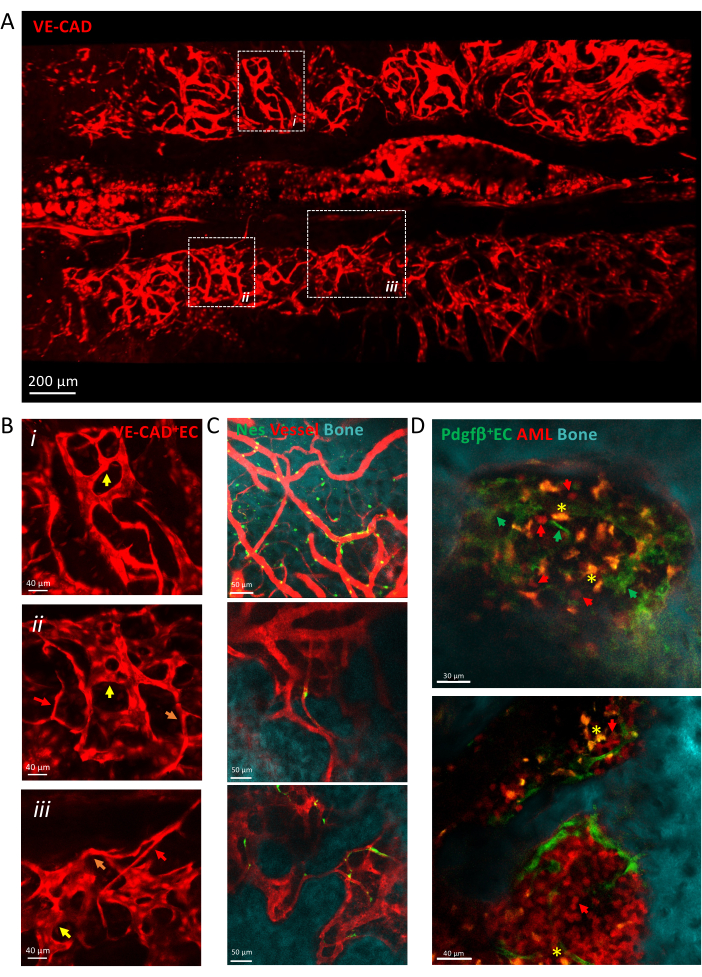
그림 3: 칼바리아 혈관 구조의 생체 내 이미징.(A) cdh5-DSRED로 표지된 칼바리아 혈관 구조의 타일 스캔 보기의 z-투영. (B) 그림으로 표시된 영역을 확대하여 화살표로, 세동맥은 빨간색 화살표로, 전이 모세혈관은 주황색 화살표로, 정현파는 노란색 화살표로 표시된 다양한 유형의 혈관을 설명합니다. (i) 및 (ii) X μm 조직의 z-돌기; (iii) 단일 조각. (C) 뼈 표면(SHG), 혈관 주위 세포(nes-GFP+) 및 혈관 내강(dextran-TRITC)을 보여주는 BM 혈관의 여러 시야의 단일 슬라이스. (D) AML 진행과 관련된 혈관 틈새. AML 개발의 초기(위) 및 후기(아래) 시점의 대표적인 조각입니다. MLL-AF9 백혈병은 tdTOMATO(빨간색 화살표)로 표시되며, 혈관은 pdgfb-GFP(녹색 화살표), 뼈 표면은 SHG, 대식세포는 노란색(자가형광, 노란색 별표)으로 표시됩니다. 스케일 바 = 200μm(A), 40μm(B, D-하단 패널), 50μm(C). 약어: BM = 골수; GFP = 녹색 형광 단백질; AML = 급성 골수성 백혈병; EC= 내피 세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 혈관 매개변수 정량화. (A) TRITC-dextran으로 표지된 골수 혈관의 대표적인 z-투영에서 IMARIS 필라멘트 도구를 통한 혈관 매개변수 측정. 선과 원뿔 표현이 표시됩니다. (B) A에 표시된 이미지에서 용기 매개변수의 정량화. (C) 혈관 직진도와 길이 사이에 반대 상관관계를 보이는 혈관 매개변수 간의 상관관계(음수, Spearman r = -3523; p < 0.0001; R2 = 0.2102) 대 직경(양수; 창병 r = 0.4110; 피 < 0.0001; R2 = 0.1299)입니다. 스케일 바 = 100μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
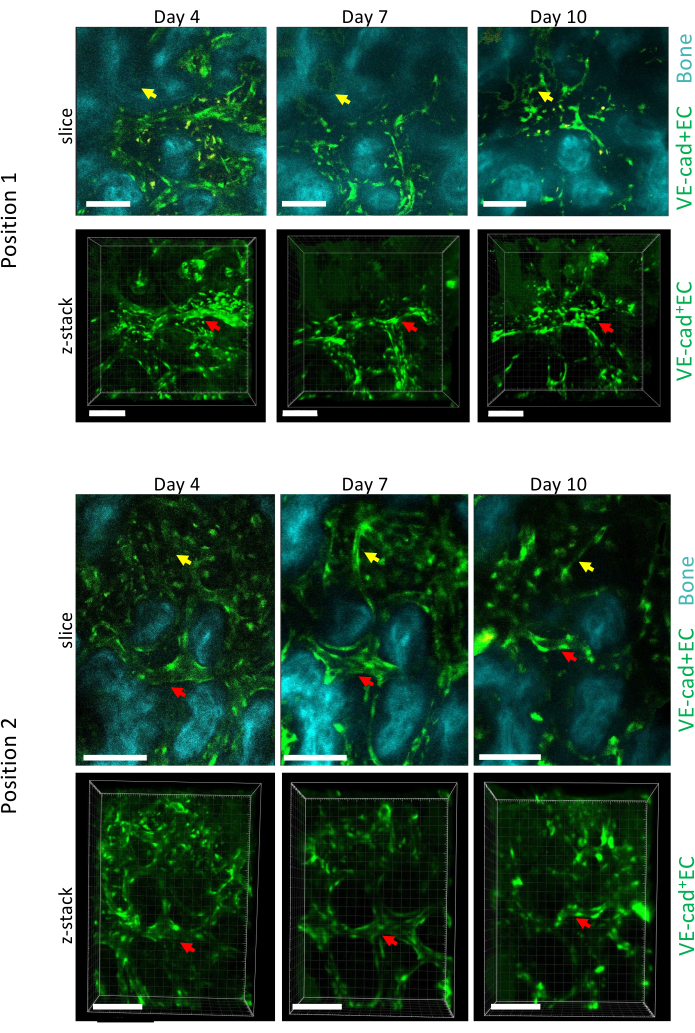
그림 5: AML 발달에 대한 칼바리아 BM의 두 가지 다른 위치에 대한 종단 영상. 혈관 내벽의 내피 세포는 cdh5-GFP, 뼈 표면은 SHG, 대식세포는 노란색(자가형광)으로 표지됩니다. 기존 선박의 개조 (빨간색 화살표) 및 새로운 선박의 형성 (노란색 화살표)이 표시됩니다. 스케일 바 = 100μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
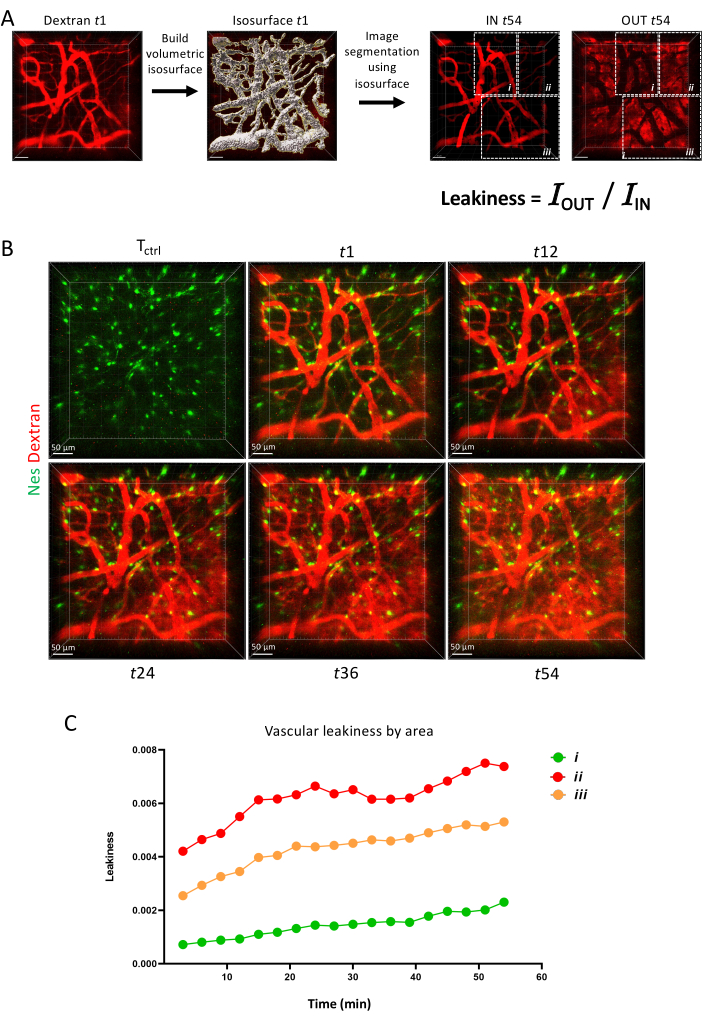
그림 6: 혈관 투과성. (A) IMARIS 표면 도구를 통한 혈관 투과성 측정 개략도. (B) 1시간 동안 세로로 이미지화된 동일한 영역의 Z-투영. (C) A에 표시된 면적 내 혈관 투과성의 정량화. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 S1: 준비된 두개골. 중앙분리대에서 calvaria에 접하는 축을 만든 다음 준비된 두개골을 저장합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 S2: 2mm 간격을 계획합니다. 두개골을 가로질러 균일한 간격(2mm 간격)의 평면 세트를 만드는 방법. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 S3: 관찰 가능한 표면 윤곽. calvarial plane에 스케치를 작성하고 AP +6.5에서 -2, AP 0.0에서 6mm 폭의 배 모양 스플라인을 작성합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 S4: 관찰 빈도우. calvarial plane에 스케치를 작성하고 관찰 창에 연결되는 0.5mm 두께의 C 쉐이프를 그립니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 S5: 새 연구를 클릭합니다. Simulation 탭(보이는 경우)으로 이동하거나 Simulation(시뮬레이션) | 공부하다. 스터디(Study) 대화 상자에서 스터디 유형으로 정적(Static)을 선택합니다. 확인을 클릭하여 새 검토를 작성합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 S6: 마우스 오른쪽 버튼을 클릭하여 메시를 생성합니다. 높은 응력 또는 변형이 예상되는 영역에서 메쉬를 미세 조정합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
생체 내 현미경 검사의 주요 강점은 기본 환경 내에서 실시간으로 동적 세포 과정을 캡처하여 기존 조직학적 및 생체 외 이미징 방법의 한계를 극복할 수 있다는 것입니다. 이 프로토콜에 설명된 형광 표지와 결합된 고급 이미징 기술을 사용하여 calvarial BM을 직접 관찰함으로써 연구자들은 혈관 기능 매개변수8,14뿐만 아니라 백혈병 세포 생착 및 이동 6,15, 증식 및 대사 활성16,17과 같은 종적 과정도 연구할 수 있습니다 생리학적 관련성을 보존하고 조직 고정 및 처리와 관련된 인공물을 방지합니다.
다른 뼈 부위에 비해 BM calvaria intravital imaging의 장점으로는 쉬운 접근성, 뼈 손상 없이 더 나은 시각화를 가능하게 하는 두개골 뼈의 투명성, 조직 운동 아티팩트를 최소화하는 calvarium 뼈의 안정성, 다른 실험 그룹 간의 비교를 용이하게 하는 실험 동물 간의 재현성 등이 있습니다. 동물을 회수하고 종단 이미징을 수행할 수 있는 가능성은 연구에 사용되는 동물의 수를 줄일 수도 있습니다. 두개골 혈관 성장 패턴의 균주 특이적 차이와 그에 따른 골형성이 관찰되었기 때문에18, 완벽한 해부학적 호환성과 원하는 이미징 부위에 접근할 수 있도록 원하는 마우스 균주에 대한 특정 이미징 임플란트를 설계할 때 이를 고려하는 것이 중요하다는 점을 언급할 가치가 있습니다.
언급해야 할 또 다른 중요한 점은 다른 뼈와 비교하여 골수 BM 내의 혈관 및 조혈 특성의 잠재적 차이인데, 이는 최근 몇 년 동안 잘 연구되지 않은 질문입니다. 새로운 연구에 따르면 골수 BM은 조혈, 뼈 및 혈관 구조 및 기능 측면에서 다른 뼈와 다르며, 19,20,21,22,23, 신경 병리학에 대한 반응24. 이러한 차이는 특정 칼바리아 소견을 일반화하기 전에 더 자세히 조사하고 고려해야 합니다.
이미징 임플란트의 설계 및 제작은 재료 선택부터 시작하여 이 실험 설정의 핵심 단계입니다. 생체 적합성 임플란트는 생체 의학 연구에서 중추적인 역할을 하며, 조직 공학 및 재생 의학에서 약물 전달 시스템 및 생체 내 모니터링 장치에 이르기까지 다양한 응용 분야를 촉진합니다. 생체 내 영상에 적합한 머리 임플란트의 재료 선택은 매우 중요합니다. 이상적으로, 재료는 우수한 생체 적합성, 최소한의 유연성과 전반적인 안정성을 보장하는 데 적합한 기계적 특성, 그리고 마지막으로 염증을 유발하지 않고 두개골 내에 통합될 수 있는 능력을 나타내야 합니다. 티타늄은 생물학적 조직과 접촉하여 부작용을 유발하지 않고 동물의 신체 내에서 우수한 내약성을 가지며 부식에 대한 내성이 있어 체액이나 실험 용액에 노출되더라도 장기적인 안정성을 보장합니다. 또한 기계적 강도로 인해 변형 및 파괴에 강합니다. 티타늄은 강도에도 불구하고 밀도가 상대적으로 낮기 때문에 실험 동물과 연구자의 부담을 최소화하는 경량 생체 내 이미징 장치가 됩니다. 마지막으로, 제조의 다양성으로 인해 크기, 모양 및 기능과 같은 특정 실험 요구 사항에 맞게 생체 내 이미징 장치를 맞춤화할 수 있습니다.
여기에서 우리는 유한 요소 해석(FEA) 기능이 내장된 파라메트릭 모델링 CAD 소프트웨어, 특히 SolidWorks를 사용하여 생체 적합성 머리 고정 임플란트를 설계했습니다. 이 접근 방식을 사용하면 임플란트의 구조적 및 공간적 요구 사항을 정확하고 반복적으로 조정할 수 있어 해부학적 호환성과 기계적 복원력을 모두 보장할 수 있습니다. FreeCAD와 같은 무료 대안은 유사한 모델링 및 시뮬레이션 기능을 제공합니다. 설계 프로세스의 주요 입력물에는 마우스 두개골의 고해상도 해부학적 모델, 현미경 대물렌즈 모델 및 고정 시스템 모델이 포함되며, 이 모든 것들은 임플란트의 치수와 구성을 알려줍니다. 최종 출력은 일반적으로 STL 또는 STEP 형식의 플랫폼 독립적 메시 파일이며 대부분의 3D 프린팅 소프트웨어와 호환됩니다.
초기 단계는 생체 내 마이크로 CT 스캐닝과 같은 고해상도 이미징 기술을 사용하여 마우스 머리의 상세한 해부학적 특징을 캡처하는 것입니다. 이 접근 방식은 최고의 해부학적 세부 사항과 정확성을 제공하여 두개골의 미세 구조를 캡처합니다. 준비된 벌거벗은 두개골의 3D 스캐닝도 옵션이 될 수 있습니다. 레이저 또는 구조광 스캐너를 사용하는 이 방법은 일반적으로 준비된 두개골에 사용되며 마이크로 CT에 비해 내부 세부 사항은 적지만 정확한 표면 윤곽을 제공합니다. 그렇지 않으면, 해부학 모델은 오픈 소스 출판물 및 데이터베이스(25 또는 DigiMorph {https://www.digimorph.org/specimens/Mus_musculus/})로부터 다운로드될 수 있다. 이러한 모델은 편리하기는 하지만 표본별 세부 정보가 부족할 수 있으므로 실제 브레그마-람다 거리로 확장하는 것과 같이 연구의 특정 동물에 대한 조정이 필요한 경우가 많습니다. 그런 다음 획득한 데이터는 마우스 두개골의 정밀한 3D 모델을 만드는 데 사용되며, 이는 임플란트 설계의 기본 템플릿으로 사용됩니다.
임플란트를 두개골에 고정하기 위해, 관찰 창이 차지하지 않는 나머지 두개골 표면을 덮을 수 있도록 시멘트 구조가 설계되었습니다. 이 구조는 중요한 해부학적 특징을 피하면서 강력한 부착 지점을 제공해야 합니다. 시멘트 구조에는 확산을 통해 임플란트 아래 시멘트의 최적 중합을 보장하기 위해 여러 개의 구멍이 있습니다. 또한 시멘트 구조의 벽은 드래프트 각도가 작아 시멘트가 이러한 각진 벽에 단단히 고정될 수 있습니다. 본체에서 고정 시스템까지 확장되는 임플란트의 꼬리가 설계되었습니다. 이 구성 요소는 관찰 중에 임플란트를 정렬하고 안정화하는 데 중요하며, 설계는 사용 가능한 공간과 마우스 머리의 해부학적 제약을 고려해야 합니다. 마지막으로, 더브테일 메커니즘이 임플란트 설계에 통합되어 고정 시스템에서 임플란트를 쉽게 부착하고 분리할 수 있습니다. 이 기능은 반복적인 관찰 중에 임플란트의 실용성과 유용성을 향상시킵니다. 더브테일 메커니즘은 반복적인 이미징 세션을 위해 관찰된 조직을 쉽게 검색할 수 있도록 반복 가능한 고정을 제공합니다.
calvarial BM의 생체 내 현미경 이미징 채택을 고려하는 독자는 이 방법이 연구에 적합한지 여부를 결정하기 위해 연구 목표와 실험 요구 사항을 신중하게 평가해야 합니다. 생체 내 현미경 검사는 조혈, 조직 미세환경 조절 및 생체 내 혈관 역학에 대한 탁월한 통찰력을 제공하지만 특정 기술적 과제와 한계도 제시합니다. 연구자는 신중한 실험 설계, 이미징 매개변수의 최적화 및 적절한 대조군의 활용을 통해 이러한 문제를 해결할 준비가 되어 있어야 합니다. 또한 연구원들은 특수 이미징 장비의 가용성, 형광 라벨링 기술에 대한 전문 지식 및 이미지 분석을 위한 컴퓨팅 리소스를 고려해야 합니다. 전반적으로, calvarial BM의 생체 내 현미경 이미징은 조혈 및 혈관 생물학에 대한 우리의 이해를 발전시킬 수 있는 엄청난 잠재력을 가지고 있으며, BM 미세환경 내에서 발생하는 동적 과정에 대한 독특한 창을 제공합니다.
공개
Jozsua Fodor는 YMETRY 회사(등록 번호 888312352)의 설립자입니다. 다른 저자는 이해 상충이 없습니다.
감사의 말
저자는 현미경 실험 및 마우스 하우징에 대한 지원에 대해 Institut Cochin의 IMAG'IC 및 동물 시설의 모든 직원에게 감사를 표합니다. Tg(Nes-EGFP)33Enik 및 Tg(Pdgfb-icre/ERT2)1Frut 마우스는 Bonnet 박사(런던의 Francis Crick Institute)의 친절한 선물이었습니다. Tg(Cdh5-cre/ERT2)1Rha 및 B6. Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze/J 마우스는 Rafii 박사(Weill Cornell Medicine, New York)의 친절한 선물이었습니다. 이 연구는 CNRS, INSERM 및 Université de Paris Cite의 지원을 받았으며, ATIP-AVENIR, Fondation ARC pour la recherche sur le cancer (R19084KS-RSE20008KSA), Ville de Paris "Emergence" (R20192KK-RPH20192KKA), Laurette Fugain (R23197KK), Cancéropôle IDF (RPH23177KKA), INCA PLBIO (RPH21162KKA), Fondation de France (RAF23152KKA), Ligue contre le cancer (282273/807251), Institut du cancer Paris Carpem, 유럽 혈액학 협회(RAK23130KKA) 및 유럽 연구 위원회 ERC-STG(EEA24092KKA). IMAG'IC 핵심 시설은 National Infrastructure France BioImaging(ANR-10-INBS-04 보조금)의 지원을 받습니다. Passaro 실험실은 "Institut Hors Murs des Sciences Cardiovasculaires"및 "Leukemia Institute Paris Saint-Louis"에 소속되어 있습니다.
자료
| Name | Company | Catalog Number | Comments |
| Amira | Thermo ScientificTM | ||
| Anesthesia | Isoflurane 2% to 3% | ||
| Anesthesic mask (animal detection) | Minerve | ||
| Anesthesic unit | Minerve | ||
| B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze | Jackson laboratories | MGI:3809523 | |
| CalvariaVue | Ymetry | https://ymetry.com/site/head-fixation-implants/44-mouse-head-fixation-implant-for-calvaria.html | |
| Dental cement | Kemdent | SUN527 | |
| Dextran 500 kDa-Cy5 | Tebu-bio | DX500-S5-1 | 3 mg/mouse |
| Dextran 70 kDa-TRITC | Sigma | T1162 | 3 mg/mouse |
| Disinfectant | MP-Labo | Dermidine-60ml | |
| Electric razor | Aescular | Isis | |
| Eye gel | Ocry-gel | 10g | |
| Fiji | https://imagej.net/software/fiji/downloads | v 17 May 30 | |
| Fiji plugings to bridge with Imaris | https://imagej.net/software/fiji/downloads | Imaris_Bridge96.jar ; ImarisBridgeUtils.jar | |
| Heating box | Datesand | Thermacage | |
| Heating pad for surgery | Minerve | ||
| Imaging heating pad & rectal probe | F. Haer | ||
| Imaris v9.6.0 | Oxford instruments | ||
| Intrasite gel | Chinoxia | 2390766 | |
| LAS AF Software | Leica | LAS X 3.5.7.23225 | |
| Medication | Buprecare, 0.01 mg/kg | ||
| Objective HCX IRAPO L 25x/0.95 WATER | Leica | 506374 | |
| Saline buffer (PBS 1x) | Sigma | P4417 | Sterilize by autoclave |
| SP8 DIVE FALCON Multiphoton Microscope | Leica | ||
| Stereotoxic mask | Minerve | 1201261 | |
| Sterilizator beads | Sigma | Z742555 | |
| Surgery tools | Moria | 4877A; 2183 | |
| Survival blanket | SECURIMED | 11006 | |
| Swabs / Tissues | Sterilize by autoclave | ||
| Syringe 1 mL 26 G | BD Plastipak | 305501 | |
| Temperature controller | F. Haer | 40-90-5D-02 | |
| Tg(Nes-EGFP)33Enik mice | Jackson laboratories | MGI:5523870 | |
| Tg(Pdgfb-icre/ERT2)1Frut mice | Jackson laboratories | MGI:3793852 | |
| Tg(Cdh5-cre/ERT2)1Rha mice | Jackson laboratories | MGI:3848982 | |
| Ultrasound gel | Parker laboratories | Aquasonic 100 |
참고문헌
- Lo Celso, C., et al. Live-animal tracking of individual haematopoietic stem/progenitor cells in their niche. Nature. 457 (7225), 92-96 (2009).
- Pittet, M. J., Weissleder, R. Intravital imaging. Cell. 147 (5), 983-991 (2011).
- Itkin, T., et al. Distinct bone marrow blood vessels differentially regulate haematopoiesis. Nature. 532 (7599), 323-328 (2016).
- Christodoulou, C., et al. Live-animal imaging of native haematopoietic stem and progenitor cells. Nature. 578 (7794), 278-283 (2020).
- Upadhaya, S., et al. Intravital imaging reveals motility of adult hematopoietic stem cells in the bone marrow niche. Cell Stem Cell. 27 (2), 336-345.e4 (2020).
- Hawkins, E. D., et al. T-cell acute leukaemia exhibits dynamic interactions with bone marrow microenvironments. Nature. 538 (7626), 518-522 (2016).
- Duarte, D., et al. Defining the in vivo characteristics of acute myeloid leukemia cells behavior by intravital imaging. Immunol Cell Biol. 97 (2), 229-235 (2019).
- Passaro, D., et al. Increased vascular permeability in the bone marrow microenvironment contributes to disease progression and drug response in acute myeloid leukemia. Cancer Cell. 32 (3), 324-341.e6 (2017).
- Jia, Y., et al. FLT3 inhibitors upregulate CXCR4 and E-selectin ligands via ERK suppression in AML cells and CXCR4/E-selectin inhibition enhances anti-leukemia efficacy of FLT3-targeted therapy in AML. Leukemia. 37 (6), 1379-1383 (2023).
- Pendleton, E. G., Tehrani, K. F., Barrow, R. P., Mortensen, L. J. Second harmonic generation characterization of collagen in whole bone. Biomed Opt Express. 11 (8), 4379-4396 (2020).
- Ventalon, C., Bourdieu, L., Leger, J. F., Fodor, J. Dispositif de liaison d'un animal de laboratoire à au moins un système d'expérimentation, et procédé de fixation d'un tel dispositif. France patent. , (2021).
- Horton, S. J., et al. Acute myeloid leukemia induced by MLL-ENL is cured by oncogene ablation despite acquisition of complex genetic abnormalities. Blood. 113 (20), 4922-4929 (2009).
- Scott, M. K., Akinduro, O., Lo Celso, C. In vivo 4-dimensional tracking of hematopoietic stem and progenitor cells in adult mouse calvarial bone marrow. J Vis Exp. (91), e51683 (2014).
- Jung, Y., et al. Intravital imaging of mouse bone marrow: Hemodynamics and vascular permeability. Methods Mol Biol. 1763, 11-22 (2018).
- Le, V. H., et al. In vivo longitudinal visualization of bone marrow engraftment process in mouse calvaria using two-photon microscopy. Sci Rep. 7, 44097 (2017).
- Spencer, J. A., et al. Direct measurement of local oxygen concentration in the bone marrow of live animals. Nature. 508 (7495), 269-273 (2014).
- Yang, M., Mahanty, A., Jin, C., Wong, A. N. N., Yoo, J. S. Label-free metabolic imaging for sensitive and robust monitoring of anti-CD47 immunotherapy response in triple-negative breast cancer. J Immunother Cancer. 10 (9), e005199 (2022).
- Li, W., et al. Tracking strain-specific morphogenesis and angiogenesis of murine calvaria with large-scale optoacoustic and Ultrasound Microscopy. J Bone Miner Res. 37 (5), 1032-1043 (2022).
- Lassailly, F., Foster, K., Lopez-Onieva, L., Currie, E., Bonnet, D. Multimodal imaging reveals structural and functional heterogeneity in different bone marrow compartments: functional implications on hematopoietic stem cells. Blood. 122 (10), 1730-1740 (2013).
- Rindone, A. N., et al. Quantitative 3D imaging of the cranial microvascular environment at single-cell resolution. Nat Commun. 12 (1), 6219 (2021).
- Mills, W. A., Coburn, M. A., Eyo, U. B. The emergence of the calvarial hematopoietic niche in health and disease. Immunol Rev. 311 (1), 26-38 (2022).
- Bixel, M. G., et al. Angiogenesis is uncoupled from osteogenesis during calvarial bone regeneration. Nat Commun. 15 (1), 4575 (2024).
- Koh, B. I., et al. Adult skull bone marrow is an expanding and resilient haematopoietic reservoir. Nature. 636 (8041), 172-181 (2024).
- Kolabas, Z. I., et al. Distinct molecular profiles of skull bone marrow in health and neurological disorders. Cell. 186 (17), 3706-3725.e9 (2023).
- Rosenhain, S., et al. A preclinical micro-computed tomography database including 3D whole body organ segmentations. Sci Data. 5, 180294 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유