Method Article
التصوير الطولي داخل الحيوية لديناميكيات الأوعية الدموية في نخاع عظم الجلسنة
In This Article
Summary
يسمح الفحص المجهري داخل الحيوية بدراسة العمليات البيولوجية الديناميكية مثل تجديد الأنسجة وتطور الورم. يقدم نخاع العظم الجلفي ، وهو نسيج ديناميكي للغاية ، نظرة ثاقبة حول تكون الدم ووظيفة الأوعية الدموية. يسمح استخدام غرسة تثبيت الرأس المطبوعة ثلاثية الأبعاد المتوافقة حيويا بالتصوير الطولي المتكرر ، مما يعزز فهمنا لديناميكيات الأنسجة والبيئة الدقيقة للورم.
Abstract
ظهر التصوير المجهري الطولي الفلوري داخل الحيوية كتقنية حاسمة لدراسة العمليات البيولوجية الديناميكية ، لا سيما في سياق تجديد الأنسجة وتطور الورم والاستجابات العلاجية. على وجه الخصوص ، نخاع العظم الجليزي هو نسيج ديناميكي للغاية ، حيث يرتبط مصير المكونة للدم بالبيئة المكروية المحيطة ، مع أوعية متخصصة تستجيب لتكون الدم الطبيعي والمرضي. يوفر التصوير التقليدي للأنسجة الثابتة معلومات ثابتة ، وغالبا ما يحد من الفهم الشامل لهذه العمليات.
أدى دمج المعدلة وراثيا التي تعبر عن علامات خاصة بالخلايا ، وتتبع الخلايا الحية ، والتقدم في معدات التصوير ، واستخدام الغرف المتخصصة إلى رفع الفحص المجهري داخل الحيوية إلى أداة محورية لاكتساب رؤى حول الظواهر البيولوجية الديناميكية. أحد تطبيقات التصوير داخل الحيوية هو التحقيق في سلوك الأوعية الدموية السرطانية وآثارها العلاجية. يمكن توصيل غرسة تثبيت رأس التيتانيوم المصممة حديثا بطباعة ثلاثية الأبعاد بجمجمة الفأر وهي مناسبة للتصوير الطولي أثناء جلسات متعددة.
يسمح البروتوكول المقترح بالفحص المكاني والزماني لديناميكيات الأوعية الدموية في نخاع العظام الجلسية ، بما في ذلك تصور وقياس عدم تجانس الأوعية الدموية ، والتفاعل مع الخلايا اللحمية والمكونة للدم ، وقياس المعلمات الوظيفية للأوعية الدموية. بالإضافة إلى ذلك ، تتيح هذه التقنية تصور أسرة الأوعية الدموية الراسخة ومراقبة التأثيرات العلاجية ، وتعبئة الخلايا الجذعية ، وتوطين مركبات العلاج الكيميائي بمرور الوقت باستخدام الفحص المجهري ثنائي الفوتون. بشكل عام ، يوفر بروتوكول التصوير الطولي داخل الحيوية منصة شاملة للتحقيق في كل من سلوك الأوعية الدموية وديناميكيات الخلايا المكونة للدم ، مما يوفر رؤى قيمة حول العمليات المعقدة التي تحكم هذه الظواهر البيولوجية.
Introduction
يعمل التصوير المجهري داخل الحيوية لنخاع العظم الجلسي (BM) كتقنية قوية لا غنى عنها للتحقيق في العمليات الديناميكية لتكون الدم ، وتنظيم البيئة الدقيقة للأنسجة ، وديناميكيات الأوعية الدموية داخل مكانة BM. الغرض الأساسي من هذا النهج المنهجي هو تمكين التصور والتحليل في الوقت الفعلي للسلوكيات الخلوية والتفاعلات والتنظيم المكاني داخل البيئة المكروية BM في الجسم الحي. من خلال المراقبة المباشرة ل BM calvaria باستخدام تقنيات التصوير المتقدمة إلى جانب وضع العلامات الفلورية ، يمكن للباحثين توضيح التفاعل المعقد بين الخلايا الجذعية المكونة للدم (HSCs) والخلايا اللحمية والأوعية الدموية المحيطة ، وبالتالي توفير رؤى مهمة حول تنظيم تكون الدم والاستجابات المناعية.
تطوير واستخدام الخلايا الجذعية للتصوير المجهري داخل الحيوية من قيود طرق التصوير النسيجي التقليدية والتصوير خارج الجسم الحي ، والتي غالبا ما تفشل في التقاط الطبيعة الديناميكية للسلوكيات الخلوية والتفاعلات في الأنسجة. على عكس تقنيات التصوير الثابت ، يمكن الفحص المجهري داخل الحيوية الباحثين من مراقبة الديناميكيات الخلوية في الوقت الفعلي ، مما يسمح بدراسة العمليات الطولية مثل هجرة الخلايا والتكاثر والتمايز داخل مكانتها الأصلية ، دون التضحية بحيوانات التجارب. علاوة على ذلك ، يوفر الفحص المجهري داخل الحيوية ميزة فريدة لدراسة السلوكيات الوظيفية في الجسم الحي ، مثل وظائف الأوعية الدموية (على سبيل المثال ، التروية ، والنفاذية ، ونقص الأكسجة) ، وبالتالي الحفاظ على الأهمية الفسيولوجية وتجنب القطع الأثرية المرتبطة بتثبيت الأنسجة ومعالجتها. أظهرت الدراسات الرائدة في هذا المجال المزايا الهائلة لهذا النهج1،2 ، وقد تم تأكيد النتائج التي توصلوا إليها وتوسيعها من خلال الأساليب المكررةمؤخرا 3،4،5 التي استخدمت الفحص المجهري داخل الحيوية لتتبع توطين HSC الداخلي والهجرة والتفاعلات مع الأوعية الدموية داخل مكانة BM. علاوة على ذلك ، كان للفحص المجهري داخل الحيوية دور فعال في توضيح الآليات الكامنة وراء اضطرابات المكونة للدم ، مثل سرطان الدم ومتلازمات فشل BM ، وتقديم رؤى جديدة حول حركة خلايا سرطان الدم6،7 ، والآثار الوعائية المرتبطة بالمرض8 ، والاستجابة للأدوية9.
هناك العديد من مزايا التصوير المجهري داخل الحيوية لمواقع العظام البديلة التي تغطي BM الجلدي. أولا ، يوفر BM الموجود داخل عظم الجمجمة سهولة الوصول إلى التصوير داخل الحياة مقارنة بالعظام العميقة مثل عظم الفخذ أو الساق. تسهل إمكانية الوصول هذه المراقبة المباشرة للبيئة الدقيقة للأنسجة ، بما في ذلك العظم نفسه ، من خلال تصور الجيل التوافقي الثاني (SHG)10 ، دون الحاجة إلى إجراءات جراحية جراحية. ثانيا ، الجمجمة رقيقة وشفافة نسبيا ، مما يسمح بتصور أفضل للديناميكيات الخلوية داخل مكانة BM. تسهل هذه الشفافية التصوير عالي الدقة باستخدام الفحص المجهري ثنائي الفوتون ، والفحص المجهري متحد البؤر ، والفحص المجهري للصفائح الضوئية ، دون الحاجة إلى تقنيات ترقق العظام أو تطهيرها. يوفر العظم الجليزي منصة مستقرة ومسطحة وصلبة لتجارب التصوير داخل الحيوية ، مما يقلل من القطع الأثرية لحركة الأنسجة ويضمن ظروف تصوير متسقة على مدى فترات المراقبة الطويلة. هذا الاستقرار مفيد بشكل خاص للدراسات الطولية التي تتبع السلوكيات والاستجابات الخلوية بمرور الوقت. تعد قابلية التكاثر ميزة كبيرة أخرى ، نظرا للبنية الصغيرة نسبيا والمحددة مكانيا للعظم الجليزي عبر التجارب. يسهل هذا التوحيد المقارنة بين المجموعات التجريبية المختلفة ويتيح تحليلا إحصائيا قويا لبيانات التصوير.
نصف هنا طريقة لتصوير BM الجلالي للفأر عبر الفحص المجهري ثنائي الفوتون داخل الحيوية من خلال إدخال غرسة تثبيت الرأسالمطورة حديثا 11 ، مطبوعة ثلاثية الأبعاد باستخدام سبيكة التيتانيوم المتوافقة حيويا من الدرجة 23 (Ti6Al4V) ، والتي تتميز بغطاء صلب مخصص وسهل الوضع مصنوع من نفس سبائك التيتانيوم ، مما يسمح بإغلاق الجرح بشكل آمن لتجنب الالتهابات أو تلف موقع الجراحة. تقوم الغرسة بتثبيت رأس الفأر بثبات وثبات على مرحلة المجهر عبر حامل الغرسة ، مما يقلل من قطع الصنع التنفسية ويسمح بالتصوير الطولي لنفس المناطق بمرور الوقت. يتم توفير بعض الأمثلة على الصور متعددة الألوان التي تصور الخلايا والهياكل من البيئة المكروية BM (SHG + سطح العظام. خلايا اللحمة المتوسطة nestin-GFP + ؛ cdh5-DSRED + أو cdh5-GFP + أو pdgfb-GFP + الخلايا البطانية) والحيز الخبيث المكونة للدم (tdTOMATO + خلايا AML) ، بالإضافة إلى عوامل التباين الفلورية التي تصور تجويف الأوعية الدموية (dextran-TRITC). يمكن أن توفر معلمات الأوعية الدموية التي يتم قياسها على مدار ساعات أو أيام ، بما في ذلك طول الوعاء والاستقامة والقطر ، بالإضافة إلى النفاذية في مناطق الأوعية الدموية المختلفة ، معلومات مهمة عن سلوك الأنسجة وصحتها.
Protocol
تم إجراء جميع التجارب على بموجب الاتفاقية الأخلاقية APAFIS # 27215-2020041513522374 v6 ، المعتمدة من قبل "Ministère de l'enseignement supérieur، de la recherche et de l'innovation" الفرنسية.
1. تصميم غرسة تثبيت رأس التيتانيوم المتوافقة حيويا للطباعة ثلاثية الأبعاد
ملاحظة: لقد صممنا غرسة تثبيت رأس متوافقة حيويا باستخدام برنامج تصميم بمساعدة الكمبيوتر (CAD) للنمذجة البارامترية مع إمكانات تحليل العناصر المحدودة (FEA) المضمنة (انظر جدول المواد). تشمل المدخلات الأساسية لعملية التصميم نموذجا تشريحيا عالي الدقة لجمجمة الفأر ، ونموذجا لهدف المجهر ، ونموذجا لنظام التثبيت ، والتي تعلم معا أبعاد الغرسة وتكوينها. الإخراج النهائي هو ملف شبكي مستقل عن النظام الأساسي ، عادة بتنسيق STL أو STEP ، متوافق مع معظم برامج الطباعة ثلاثية الأبعاد. يضمن تنسيق الملف هذا النقل السلس إلى الطابعة ثلاثية الأبعاد لتصنيع الزرع بدقة.
- إعداد نموذج 3D من الماوس
- ضع جمجمة الفأر ، المعدة أو في الجسم الحي ، في الماسح الضوئي المقطعي المحوسب الدقيق.
- قم بتعيين معلمات المسح الضوئي للحصول على الدقة المثلى للتفاصيل التشريحية الدقيقة: افتح لوحة التحكم وفي قسم Scan Conditions (شروط الفحص ) ، اختر مجال رؤية (FOV). استخدم LiveView لتحديد وحدة تخزين المسح الضوئي.
ملاحظة: من خلال دقة الكاشف ، سيحدد مجال الرؤية حجم فوكسل بناء على دقة الكاشف. في أجهزة التصوير المقطعي المحوسب الأحدث ، يتوافق مجال الرؤية 5 مم عادة مع حجم فوكسيل 5 ميكرومتر ، ومجال الرؤية 10 مم إلى حجم فوكسيل 10 ميكرومتر ، ومجال الرؤية 25 مم إلى حجم فوكسل 21 ميكرومتر. قد يتطلب مجال الرؤية المحدود في هذا الدقة عمليات مسح متعددة لتغطية الجمجمة بأكملها. تتطلب عمليات الفحص المتعددة تداخلا بين عمليات الفحص. - قم بتجميع العديد من عمليات المسح الضوئي عالية الدقة معا في برنامج التصوير لإنشاء نموذج واحد شامل للجمجمة.
- قم باستيراد ملفات micro-CT DICOM إلى برنامج تجزئة (على سبيل المثال ، 3D Slicer أو Amira أو Avizo أو Mimics) لعزل الجمجمة.
- قم بإجراء تجزئة قائمة على العتبة لفصل أنسجة العظام عن الهياكل المحيطة وإجراء تعديلات يدوية لتحسين المناطق المعقدة أو الصاخبة.
- في 3D Slicer ، قم أولا باستيراد ملفات DICOM وتحميل مجموعة البيانات ومراقبة شرائح التصوير المقطعي المحوسب في طرق عرض الشريحة المحورية والسكيتية والإكليلية .
- افتح شريحة Editor، وانقر على إضافة لإنشاء تقسيم جديد | إضافة لإنشاء شريحة جديدة، والتي سيتم تحديد الحد منها.
- في لوحة محرر الشرائح، انقر فوق تأثير العتبة. اضبط منزلقي الحد الأدنى والعلوي (أو اكتب قيما رقمية) بحيث يتم تمييز المنطقة المراد تقسيمها باللون الأحمر في طرق عرض الشرائح. مقطع ثلاثي الأبعاد ذو عتبة جاهز.
- لتصدير الجمجمة المجزأة كملف STL، قم بالتغيير إلى وحدة التجزئة. تأكد من تحديد الشريحة ذات العتبة. في قسم تصدير/استيراد النماذج وخرائط التسميات، قم بتعيين نوع التصدير إلى النماذج. وتنسيق الملف: STL. انقر فوق الزر "تصدير".
ملاحظة: تستخدم ملفات STL تنسيقا شبكيا مثلثا يمثل سطح الجمجمة بآلاف المثلثات ، ويلتقط الشكل التشريحي بتفاصيل دقيقة.- إذا لزم الأمر ، قم بالخياطة في MeshLab على النحو التالي:
- استيراد الشبكات بالنقر فوق ملف | قم باستيراد الشبكة وحدد واحدة كمسح مرجعي.
- محاذاة عمليات المسح الضوئي الأخرى باستخدام أداة Align (عوامل التصفية | التسجيل | محاذاة) عن طريق وضع علامة على النقاط المقابلة واستخدام العملية.
- دمج عمليات المسح المحاذاة بالنقر فوق عوامل التصفية | طبقة شبكية | قم بتسطيح الطبقات المرئية باستخدام خيار دمج الطبقات المرئية فقط .
- إذا لزم الأمر ، قم بالخياطة في MeshLab على النحو التالي:
- قم بتنظيف وإصلاح الشبكة ، وإزالة الرؤوس والمثلثات المكررة على النحو التالي ، لضمان إزالة المثلثات الناجمة عن الضوضاء وملء أي ثقوب غير مقصودة ، للحصول على سطح أملس ومستمر:
- انقر فوق الفلاتر | التنظيف والإصلاح | إزالة الرؤوس المكررة.
- انقر فوق الفلاتر | التنظيف والإصلاح | إزالة الوجوه المكررة.
- انقر فوق الفلاتر | التنظيف والإصلاح | قم بإزالة القطع المعزولة (حسب رقم الوجه). حدد حدا للحد الأدنى لعدد الوجوه المراد الاحتفاظ به (على سبيل المثال، قم بتعيين هذا الحد منخفضا لإزالة المجموعات الصغيرة أو الضوضاء).
- انقر فوق الفلاتر | إعادة الربط والتبسيط وإعادة الإعمار | أغلق الثقوب.
- قم بتبسيط الشبكة إلى ~ 10,000-30,000 مثلثات حيث تحتوي ملفات STL الأولية من micro-CT على عدد كبير جدا من المثلثات غير المتوافقة مع برنامج CAD. في المناطق عالية التفاصيل، احتفظ بمثلثات أصغر في الجزء العلوي من الجمجمة لضمان ملاءمة الزرع بدقة. في المناطق الأكثر خشونة ، قم بتبسيط المناطق الأقل أهمية باستخدام مثلثات أكبر لتقليل حجم الملف وتحسين كفاءة المعالجة.
ملاحظة: يتم تبسيط الشبكة حسب المناطق ومفصل في 1.1.8.1-1.8.3.- استخدم تحديد المكونات المتصلة في أداة تحديد المنطقة لتحديد مناطق للتبسيط.
- استخدم Quadratic Edge Decimation في المناطق المحددة مع المعلمات. انقر فوق الفلاتر | إعادة الربط والتبسيط وإعادة الإعمار | التبسيط: تدمير انهيار الحافة الرباعية. قم بتعيين عتبة الجودة إلى 0.8، والحفاظ على حدود الشبكة إلى نعم، والحفاظ على المخطط إلى نعم، وعدد الوجوه المستهدفة: قم بتعيين رقم مستهدف يتوافق مع الدقة المطلوبة.
- كرر حسب الضرورة حتى يتم تقليل العدد الإجمالي للمثلثات إلى المستوى المطلوب. بعد ذلك، احفظ النموذج المبسط في ملف STL.
- تحضير نموذج الجمجمة في نموذج CAD
- قم باستيراد نموذج الجمجمة المبسط بتنسيق STL إلى برنامج CAD كجزء أو نموذج جديد. تأكد من تحويل الملف المستورد بشكل صحيح إلى جسم صلب أو سطحي إذا لزم الأمر، اعتمادا على قدرات البرنامج. احفظ النموذج بتنسيق ملف CAD الأصلي لتمكين المزيد من التعديلات وضمان التوافق مع خطوات التصميم اللاحقة.
- ضع النقاط المرجعية على Bregma و Lambda وقم بإنشاء محور Bregma-Lambda في هذا النموذج.
- قم بإنشاء المستوى الوسيط بما في ذلك محور Bregma-Lambda.
- في المستوى المتوسط ، قم بإنشاء محور عرضي للكفاريا ، ثم احفظ الجمجمة المحضرة (الشكل التكميلي S1).
- قم بإنشاء مجموعة جديدة وأدخل الجمجمة المحضرة بطريقة تتزامن فيها بريجما مع الأصل ، والمستوى المتوسط مع المستوى الصحيح ، والمحور الجلجي أفقيا.
- سيتم تصميم غرسة تثبيت الرأس مباشرة داخل المجموعة لضمان التوافق المثالي مع نموذج الجمجمة المعد. لتحقيق ذلك ، قم بإنشاء الغرسة كجزء جديد داخل التجميع. ابدأ بالانتقال إلى إدراج | مكون | جزء جديد في برنامج CAD. عند المطالبة ، حدد سطح الكالفاريا أو المستوى العلوي للتجميع كمرجع لوضع الجزء الجديد وتثبيته.
- قم بإنشاء مجموعة من المستويات المتباعدة بشكل متساو (تباعد 2 مم) عبر الجمجمة. في كل مستوى ، قم بإنشاء رسم تخطيطي ، وفي كل رسم تخطيطي ، ارسم منحنى إسقاط إزاحة 0.2 مم على شكل شريحة متماثلة بتسع نقاط ، بعد قسم السطح العلوي للجمجمة 0.2 مم فوق الجمجمة (الشكل التكميلي S2).
- قم بإنشاء سطح منزوع باستخدام هذه الشرائح - سطح حد الجمجمة - لضمان أن يكون هذا السطح أملسا دون أي عيب ، لاستخدامه في بناء ميزات الزرع.
- تعريف السطح المرئي على الجمجمة
ملاحظة: استنادا إلى النموذج ثلاثي الأبعاد ، يتم تحديد المنطقة الأكثر تسطحا من عظم الجلسنة المثالية للمراقبة ثلاثية الأبعاد. تم اختيار هذه المنطقة بعناية لضمان الوصول الأمثل لهدف المجهر ثنائي الفوتون مع مراعاة السلامة البيولوجية والهيكلية للجمجمة. قد يستخدم التعريف إحداثيات تجسيمية حيث تعمل نقطة بريغما كأصل لنظام الإحداثيات.- قم بإنشاء رسم تخطيطي في المستوى الجليزي وقم بإنشاء شريحة على شكل كمثرى من AP +6.5 إلى -2 ، عرض 6 مم عند نقطة الوصول 0.0. سيكون هذا هو محيط السطح المرئي (الشكل التكميلي S3).
ملاحظة: يتم وضع هدف المجهر فعليا بالنسبة للسطح المحدد مسبقا الذي يمكن ملاحظته على الجمجمة. تتضمن هذه الخطوة تحديد القيود المكانية التي يفرضها حجم الهدف وشكله ، مما يضمن أن تصميم الغرسة يستوعب متطلبات المجهر. - أدخل نموذج هدف المجهر في التجميع عموديا. تقييد نقطة التركيز الخاصة به على مستوى مواز لمستوى الجلسنة أيون العظم الجلجي وتحديد الحجم المحيط لهدف المجهر.
- قم بإنشاء وحدة تخزين عن طريق مسح الهدف باتباع محيط السطح الملحوظ.
- قم بإنشاء نافذة مراقبة حول السطح المحدد الذي يمكن ملاحظته ، مما يضمن الوصول دون عوائق لهدف المجهر.
ملاحظة: نافذة المراقبة عبارة عن هيكل يشبه الحلقة له وظائف ثانوية مثل احتباس السوائل الغاطسة والهيكل الصلب للإغلاق الصحيح للغطاء الواقي. - قم بإنشاء رسم تخطيطي في المستوى الجلجي وانسخ محيط السطح الذي يمكن ملاحظته.
- قم بإنشاء محيط متوازي بسمك 0.5 مم. قم ببثق هذا الكفاف المزدوج لأعلى 0.9 مم وإلى أسفل إلى سطح حد الجمجمة بزاوية سحب 4 درجات.
- قم بإنشاء رسم تخطيطي في المستوى الجليزي وقم بإنشاء شريحة على شكل كمثرى من AP +6.5 إلى -2 ، عرض 6 مم عند نقطة الوصول 0.0. سيكون هذا هو محيط السطح المرئي (الشكل التكميلي S3).
- تحديد الهياكل الأسمنتية والذيل والمتوافقة.
- قم بإنشاء رسم تخطيطي في المستوى الجليزي وارسم شكل C بسمك 0.5 مم متصل بنافذة المراقبة وبثق ارتفاع 2 مم وهبوطا إلى سطح حد الجمجمة بزاوية سحب 4 درجات (الشكل التكميلي S4).
- قم بإنشاء رسم تخطيطي في المستوى الجليزي واملأ هذه المساحة بمستطيلات بسمك 0.4 مم موضوعة شعاعيا بمسافة 1 مم بينهما.
- البثق بشكل مشابه لنافذة المراقبة.
- قم بإنشاء ذيل الغرسة بالاعتماد على الجمجمة للتثبيت من خلال احترام الحجم المتاح.
- قم بإنشاء مستوى عرضي بشكل عرضي لهيكل الأسمنت وآخر 12.5 مم للخلف.
- ارسم المستطيلات على هذه الطائرات. امسح جسما هرميا بينهما ، واضبط الزوايا حوالي 20 درجة و 37 درجة من الأفقي.
- أضف ثقبا ملولبا M1.6 في الذيل بالقرب من هيكل الأسمنت.
- قم بإنشاء رسم تخطيطي في نهاية الذيل وارسم ملف تعريف التشابك.
- بثق هذا الملف الشخصي بمقدار 8 مم.
- التحقق من عدم التدخل في الهدف.
- افحص تصميم الغرسة بالكامل ، بما في ذلك نافذة المراقبة والتشافق ، للتأكد من عدم وجود تداخل ميكانيكي مع هدف المجهر. تحقق من وجود تداخلات مع وحدة التخزين التي تم إنشاؤها في الخطوة 1.3.3.
ملاحظة: تعد خطوة التحقق هذه حاسمة لضمان إمكانية وضع الهدف ونقله على النحو المطلوب دون إعاقة.
- افحص تصميم الغرسة بالكامل ، بما في ذلك نافذة المراقبة والتشافق ، للتأكد من عدم وجود تداخل ميكانيكي مع هدف المجهر. تحقق من وجود تداخلات مع وحدة التخزين التي تم إنشاؤها في الخطوة 1.3.3.
- قم بإزالة المواد غير الضرورية من ذيل الغرسة لتقليل الوزن وتقليل الانزعاج المحتمل للحيوان.
- قم بإنشاء رسم تخطيطي في المستوى المتوسط وارسم قواطع مثلثة عليه لتشكيل هيكل الجمالون عند استخراجه عن طريق البثق من جسم الذيل.
- كرر في المستوى العمودي.
- التحقق من الإزاحة القصوى عن طريق محاكاة طريقة العناصر المحدودة (FEM) لتحليل الخواص الميكانيكية للغرسة في ظل ظروف مختلفة.
ملاحظة: تساعد هذه المحاكاة في التنبؤ بأقصى إزاحة وضغوط داخل الغرسة أثناء الاستخدام ، مما يضمن موثوقيتها.- قم بتمكين الوظيفة الإضافية لمحاكاة برنامج CAD.
- في شريط أدوات المحاكاة، قم بإنشاء دراسة ثابتة جديدة. انتقل إلى علامة التبويب "المحاكاة" (إذا كانت مرئية) أو انتقل إلى "المحاكاة" | دراسة. في مربع الحوار دراسة، اختر ثابت كنوع الدراسة. انقر فوق موافق لإنشاء الدراسة الجديدة (الشكل التكميلي S5).
ملاحظة: هذا النوع من الدراسة مناسب لتحليل التشوه والإجهاد تحت الأحمال الساكنة ، كما هو متوقع في استخدام الغرسة. - اختر مادة للغرسة تتناسب مع تركيبة الزرع الفعلية (Ti6Al4V).
- حدد قيودا ثابتة لمحاكاة نقاط التعلق بالغرسة حيث ستتصل بتثبيت الذيل المتوافق. حدد السطح العلوي للعلامة المتوافقة على أنه ثابت.
- حدد الحمل الرأسي على السطح السفلي للزرع. اضبط 1 نيوتن القوة الرأسية.
- إنشاء شبكة. صقل الشبكة في المناطق التي يتوقع فيها إجهاد أو تشوه عالي (الشكل التكميلي S6). للقيام بذلك ، انقر بزر الماوس الأيمن فوق عنصر الشبكة في شجرة الدراسة وحدد إنشاء شبكة ... في مربع الحوار Mesh ، اضبط Mesh Density إما باستخدام شريط التمرير أو عن طريق تنشيط المربع Mesh Control لتعيين الحد الأقصى والحد الأدنى لأحجام العناصر بشكل مستقل. انقر فوق موافق لإنشاء الشبكة.
ملاحظة: يقوم البرنامج تلقائيا بإنشاء شبكة أولية للدراسة ولكن للحصول على نتائج أكثر دقة ، يمكن تحسين الشبكة لتحديد شبكة أدق ، خاصة في المناطق التي تعتبر ضرورية لاستقرار الزرع (مثل نافذة المراقبة). تعمل التشابك الدقيق في هذه المناطق على تحسين دقة المحاكاة من خلال التقاط تركيزات الإجهاد المحلية. - ابدأ التحليل الثابت لحساب توزيعات الإزاحة والإجهاد والإجهاد عبر الغرسة.
- تحليل النتائج. افحص مخطط الإزاحة لتحديد مناطق التشوه الأقصى. توضح هذه المؤامرة مدى تشوه الغرسة تحت الأحمال المطبقة ، مما يسلط الضوء على أي مناطق معرضة لخطر الحركة المفرطة. تأكد من أن التشوه داخل نافذة المراقبة لا يتجاوز 3 ميكرون.
- أخيرا ، صمم غطاء واقيا لحماية نافذة المراقبة ، عندما لا تكون قيد الاستخدام. يحمي هذا الغطاء العظام المكشوفة من الملوثات البيئية والأضرار الجسدية.
2. علاجات الفئران والتخدير والزرع الجراحي لغرسة الرأس
ملاحظة: هنا ، سواء ذكرا أو أنثى ، يمكن استخدام C57BL / 6 أو الفئران المعدلة وراثيا التي تتراوح أعمارها بين 7 و 12 أسبوعا ، كما هو موضح. للحث على استعمار سرطان الدم في BM ، يتم إعطاء خلايا سرطان الدم المتولدة ، كما هو موضح من قبل Horton et al.12 ، عن طريق الوريد قبل 2-3 أسابيع من التصوير. لضمان صحة الجرح ، يجب استخدام تقنيات معقمة.
- تحت الغطاء ، قم بتجميع أدوات الجراحة المعقمة (المقص والملاقط الحادة) ، وأداة التشذيب ، والمواد الاستهلاكية ، بما في ذلك جل العين ، والمحلول الملحي ، والمطهر ، وأسمنت الأسنان ، والمسحات الماصة ، وأنسجة التنظيف. قم بتشغيل معقم الخرز.
- املأ غرفة تحريض التخدير بنسبة 4٪ من الأيزوفلوران والأكسجين الجوي وضع الفأر في الغرفة. عندما يتم تخدير تماما (تحقق من فقدان منعكس التصحيح ونمط التنفس الأعمق والأبطأ) ، قم بتبديل تدفق الأيزوفلوران إلى مخروط الأنف لقناع التخدير وخفض تركيز الأيزوفلوران إلى 2٪.
- ضع الماوس على وسادة تسخين 37 درجة مئوية وراقب معدل التنفس بصريا. اختياري: بالنسبة للفئران ذات النمط الظاهري المرضي ، أضف بطانية البقاء على قيد الحياة للحفاظ على درجة الحرارة الصحيحة طوال فترة التخدير.
- قم بتطبيق مسكنات الألم تحت الجلد (بوبريكير ، 0.01 مجم / كغ) قبل 30 دقيقة من الجراحة.
- احلق رأس الماوس بشفرة حلاقة كهربائية.
- أضف قطرة من جل العيون على عيون الفأر لمنع الجفاف أثناء التخدير ، مع التأكد من عدم تساقط الجل على فروة الرأس.
- نظف الماوس لإزالة أي شعر متبقي من منطقة الجراحة. امسح الجزء العلوي من فروة الرأس بمطهر على منديل قطني. تأكد من إزالة كل الشعر لتجنب تصوير القطع الأثرية وكذلك خطر الإصابة بعدوى الجرح.
- باستخدام ملقط ومقص معقم (بعد 30 ثانية في المعقم) ، قم بعمل شق صغير في الجزء المركزي من فروة الرأس لكشف ندبة العظام المركزية. اتبعها لتحديد منطقة التصوير الصحيحة للطول والعرض. قم بإزالة قطعة فروة الرأس بعناية ، وارفع الجلد بين الأذنين باستخدام ملقط ، وقم بعمل شق صغير في مؤخرة الرأس. أمسك الجلد لأعلى ، مرر المقص تحت الجلد واقطعه بعناية خارج منطقة التصوير.
- قم بإزالة النسيج الضام بين الجمجمة وفروة الرأس. امسح العظم المكشوف باستخدام PBS معقم على قطعة قطن. انتقل بسرعة إلى ربط غرسة الرأس بجمجمة الفأر لتجنب التعرض لفترات طويلة لعظم الجمجمة (<10 دقائق).
- اصنع عجينة تحتوي على ما يكفي من الأسمنت للأسنان في طبق بتري باتباع تعليمات الشركة المصنعة وقم بتطبيقه بسرعة على الجزء السفلي من غرسة تثبيت الرأس.
- دون وضع أي أسمنت أسنان داخل منطقة التصوير ، ضع حامل الرأس على جمجمة الماوس المكشوفة ، ثم انتظر حتى يتماسك.
- بمجرد ضبطه (عادة في غضون 3-5 دقائق) ، أضف بضع قطرات من 37 درجة مئوية PBS في غرفة التصوير للحفاظ على ترطيب الجمجمة.
3. التصوير باستخدام مجهر ثنائي الفوتون
- قبل بدء الجراحة ، قم بتشغيل الليزر واتركه يسخن حتى يستقر. قم بتشغيل المجهر وابدأ برنامج الاستحواذ. حدد الهدف المناسب (غمر في الماء 25x/0.95 لهذه التجربة).
- استخدم حامل مجهر عمودي ذو مرحلة ثابتة يحتوي على مساحة كافية لوضع لوح تجارب بيطري مع وسادة حرارية ، كل ذلك ليتم تحريكه بشكل متكامل مع مرحلة xy. استخدم لوح تجارب بصري صلب من الألومنيوم كمنصة لربط غرسة الرأس والقناع التجسيمي. اربط الخراطيم المرنة وموصلاتها المرتبطة بحقن الأيزوفلوران واستخراجه بالقناع الموجود في قفص المجهر.
- تكوين إعدادات الاستحواذ للمسح الضوئي بسرعة: تنسيق 512 × 512 بكسل ؛ السرعة 600 هرتز ؛ وعامل التكبير 1.
- قم بضبط خط الليزر عند 880 نانومتر لتتمكن من اكتشاف SHG و GFP و tdTOMATO بنفس الطول الموجي للإثارة.
- أطفئ الضوء في الغرفة وأغلق الصندوق حول حامل المجهر بشكل صحيح قبل تنشيط كاشفات NDD وتحديد بوابات الكشف الطيفية: PMT1 ، للكشف عن SHG [388 - 431 نانومتر] ؛ HyD2 ، ل GFP [485 - 548 نانومتر] و HyD3 ل tdTOMATO [551 - 645 نانومتر]. اترك الإزاحة عند 0.
- قم بإنشاء مجموعة بيانات مشروع جديدة وأعد تسميتها وفقا للتجربة المحددة.
- بمجرد توصيل غرسة تثبيت الرأس بجمجمة الفأر (يتم تأكيدها من خلال تصلب الأسمنت) ، قم بتشغيل الأيزوفلوران باتجاه القناع التجسيمي للمجهر.
- أحضر الماوس بسرعة إلى المجهر. أدخل أسنان الفأر بعناية في القناع للسماح باختراق الأيزوفلوران عبر أنف الفأر عن طريق رفع أنفه بيد واحدة.
- أثناء إمساك الماوس بيد واحدة ، قم بتمرير تشابك غرسة تثبيت الرأس برفق في حامل التثبيت باليد الأخرى وقم بتثبيته بنصف دورة من مقبض المسمار.
- أدخل مسبارا مستقيميا مدمجا مسبقا مع جل مائي لمراقبة درجة الحرارة وأضف قطرات العين إلى عيون الفأر.
- املأ غرفة تصوير الرأس بكمية كبيرة من الجل المائي أو PBS وقم بخفض هدف الغمر في الماء لغمره تماما للحصول على الإثارة المثلى والكشف عن الإشارات الناتجة عن الإثارة ثنائية الفوتون.
- حرك مرحلة xy ومحرك الأقراص z للتركيز على العظم المركزي في ندبة السقالة.
ملاحظة: من الملائم استخدام عدسات المجهر والمصباح من نوع الهاليد المعدني كمصدر للضوء ، يتم ترشيحه بواسطة مرشح انبعاث الإثارة ثلاثي النطاقات. الافتقار إلى التقسيم البصري يجعل من المستحيل الحصول على صورة واضحة. ولكن مع الممارسة ، يمكن التعرف بسهولة على المنطقة المركزية للجمجمة. - بعد تحديد الأنسجة ، التي تتميز بسطح عظمي ووريد مركزي ، قم بإيقاف تشغيل مصباح الهاليد المعدني وأغلق نوافذ قفص المجهر لحماية كاشفات HyD والسماح لليزر بالأشعة تحت الحمراء (IR) بالمرور.
- اضبط كسب PMT / SHG على 850 فولت (نطاق التشغيل الخطي) واضبط مكاسب HyD على 100٪. قم بزيادة طاقة ليزر الأشعة تحت الحمراء حتى يتم الحصول على صورة ذات نطاق ديناميكي يبلغ 200 مستوى رمادي (مع كاشفات 8 بت ديناميكية) على أدنى القنوات الثلاث. قلل من مكاسب أجهزة الكشف الأخرى إذا كانت اختلافات الانبعاثات مهمة جدا أو إذا كان هناك تشبع باستخدام وضع جدول البحث "السفلي" (LUT).
ملاحظة: في حالتنا ، كانت قوة الليزر بنسبة 30٪ كافية للحصول على التباين في جميع القنوات. - في برنامج الاستحواذ ، ابحث عن منطقة مصنوعة من جيوب BM (GFP + ، tdTOMATO +) مغلفة بأسطح العظام (SHG).
- للعثور على عائد استثمار مختلف، قم بتنشيط LAS NAVIGATOR وإنشاء نظرة عامة على المنطقة بأكملها باستخدام الوضع الحلزوني. أوقف الاستحواذ عندما يكون السطح المكتسب كبيرا بما يكفي. احفظ النظرة العامة ودمجها وأعد تسميتها: ستكون هذه هي الصورة المرجعية في حالة التصوير الطولي.
ملاحظة: احرص على عدم إنشاء دوامة كبيرة جدا لأن ذلك قد يتسبب في ملامسة حامل الجهاز للهدف. - سجل بعض مواضع عائد الاستثمار بالنقر فوق رمز الصورة الفردية وأعد تسمية كل موضع في قائمة المهام. التقط لقطة شاشة للحصول على الموضع النسبي لعائد الاستثمار المختلف متراكبا على النظرة العامة المحفوظة مسبقا.
ملاحظة: سيكون التقاط الشاشة هذا ضروريا لاستبدال عائد الاستثمار في التصوير الطولي ، حيث لا يسمح برنامج الاستحواذ باستدعاء هذه المجموعة من المواقف في الإصدار المستخدم لهذه التجربة. - للحصول على وحدة تخزين z-stack، حدد وضع z-stack، وحدد حجم الخطوة عند 3 ميكرومتر، وقم بإلغاء تحديد نفس حجم المكدس لخيار جميع المناطق. حدد الموضع الأول ، وحدد المواضع العلوية والسفلية ، وتحقق من حجم الخطوة z ، وانقر فوق إعادة تعريف المكدس. تظهر أيقونة مكعب بجوار اسم الموضع في قائمة المواضع. كرر هذه الخطوة لجميع مواضع عائد الاستثمار المختلفة.
- اضغط على اكتساب وحفظ الصور (ثلاث قنوات z-stacks مع ~ 50 خطط) في المجلد المناسب. هذه الخطوة تمثل Tctrl للتجربة. تحقق من صحة معلمات الاستحواذ (احصل على النطاق الديناميكي الصحيح في القنوات الثلاث ، وتجنب تشبع الإشارة قدر الإمكان ، وتحقق من وقت الاستحواذ لدورة كاملة).
- لقياس ميزة ديناميكية (نفاذية الأوعية الدموية في هذه الحالة) ، احصل على فاصل زمني.
- في هذا الإعداد ، تسمح أجهزة الكشف الثلاثة بالتصوير المتزامن لثلاث قنوات. إذا كانت هناك حاجة إلى قناة رابعة للتجربة (مراقبة ديكستران في هذه الحالة) ، فقم بتنشيط الوضع المتسلسل وأضف تسلسل اكتساب ثان. قم بضبط خط ليزر الأشعة تحت الحمراء عند 820 نانومتر لتتمكن من إثارة فلوروفور Dextran Cy5. قم بتغيير نطاق الكشف عن Hyd2 إلى [650 - 744 نانومتر] وقم بإلغاء تنشيط أجهزة الكشف الأخرى. اختر بين وضع اكتساب المكدسات .
ملاحظة: بشكل افتراضي، يحتوي تسلسل الاكتساب الثاني على نفس معلمات التسلسل 1. - قبل البدء في الفاصل الزمني ، ابدأ اكتساب جميع المراكز لضمان ألا يتجاوز وقت التسجيل 3 دقائق (مع مراعاة إضافة الوضع التسلسلي) ، وهو الحد الأدنى للوقت المطلوب للكشف عن تسرب ديكستران.
- قبل حقن ديكستران ، قم بتغيير وضع الاستحواذ إلى xyzt. في الوحدة النمطية t ، اضبط الفاصل الزمني على 3 دقائق والمدة إلى 1 ساعة.
- في هذا الإعداد ، تسمح أجهزة الكشف الثلاثة بالتصوير المتزامن لثلاث قنوات. إذا كانت هناك حاجة إلى قناة رابعة للتجربة (مراقبة ديكستران في هذه الحالة) ، فقم بتنشيط الوضع المتسلسل وأضف تسلسل اكتساب ثان. قم بضبط خط ليزر الأشعة تحت الحمراء عند 820 نانومتر لتتمكن من إثارة فلوروفور Dextran Cy5. قم بتغيير نطاق الكشف عن Hyd2 إلى [650 - 744 نانومتر] وقم بإلغاء تنشيط أجهزة الكشف الأخرى. اختر بين وضع اكتساب المكدسات .
- حقن 100 ميكرولتر من Dextran, 70 KDa-TRITC (أو 500 KDa-Cy5) بمعدل 3 ملغ/فأر عن طريق الوريد وابدأ في الاستحواذ.
- بعد الاستحواذ ، احفظ مجموعة البيانات في المجلد المناسب.
ملاحظة: خلال هذه الخطوات العديدة ، راقب تردد تنفس الماوس ودرجة حرارته بشكل متكرر واضبط تدفق الأيزوفلوران إذا لزم الأمر. من الناحية المثالية ، يمكن تسجيل درجة الحرارة وتخطيط القلب ومعدل التنفس وإدراجها كبيانات وصفية للتجربة.
4. استعادة الماوس
- بمجرد اكتمال جلسة التصوير ، قم بإلغاء تنشيط كاشف HyDs داخل برنامج الاستحواذ وقم بتشغيل صندوق تسخين الماوس (37 درجة مئوية). افتح قفص المجهر ، وارفع الهدف ، وقم بإزالة مسبار المستقيم من الماوس. بعد ذلك ، قم بإخراج تشابك غرسة تثبيت الرأس برفق من حامل التثبيت وحرك الماوس من القناع التجسيمي للمجهر إلى قناع الجراحة على الوسادة الحرارية.
- قم بإيقاف تشغيل حقن الأيزوفلوران تحت المجهر وإيقاف تشغيل وسادة الحرارة.
- قم بإزالة الجل المائي أو PBS برفق من جمجمة الفأر باستخدام مسحة معقمة.
- أضف جل داخل الموقع للحفاظ على رطوبة الجمجمة بين جلسات التصوير ، كما هو موضح سابقا13.
- أغلق منطقة التصوير لغرسة الرأس بالغطاء المحدد وثبتها بعناية بالمسمار.
- ضع الماوس في صندوق التسخين على حرارة 37 درجة مئوية وانتظر حتى يستيقظ. أحضر الفأر إلى منشأة ووضعه في قفص نظيف مع الهيدروجيل والتخصيب. راقب كل يوم لاكتشاف أي علامات للألم أو العدوى ، وفي هذه الحالة قم بإدارة Buprecare يوميا. للحفاظ على رطوبة الجلسنة ، قم بتغيير الجل داخل الموقع مرتين في الأسبوع.
ملاحظة: اختر قفصا مرتفعا به ملاجئ من الورق المقوى ومواد التعشيش وتأكد من وضع الفئران في أقفاص فردية.
5. عمليات الاستحواذ الطولية
ملاحظة: يمكن تصوير الماوس مرة أخرى خلال الأيام التالية. ومع ذلك ، تأكد من عدم تكرار أكثر من ثلاث جلسات تصوير في الأسبوع لتجنب الآثار غير المرغوب فيها للتخدير المتكرر ، مثل جفاف العين أو التعب المفرط ، وكذلك ضيق التنفس وانخفاض حرارة الجسم.
- لإعادة تصوير الماوس مع حامل رأس مثبت بالفعل ، اتبع الخطوة 2.2 وضع قطرة صغيرة من جل العين على عيون الفأر لمنع الجفاف أثناء العملية.
- اتبع القسم 3 حتى الخطوة 3.16 للحصول على صورة النظرة العامة.
ملاحظة: استخدام غرسة التيتانيوم في الرأس دون الحاجة إلى تغيير ارتفاع أو زاوية موضع الحامل يجعل من السهل جدا العثور على منطقة الاهتمام العامة. - إذا لزم الأمر، أعد محاذاة الصور السابقة والجديدة باستخدام وحدة الصورة المفتوحة والمحاذاة.
- افتح صورة التقاط الشاشة من الخطوة 3.17 لتحديد المواضع في مكانها الأصلي.
ملاحظة: يعد استخدام تباين SHG مفيدا جدا خاصة عند توقع إعادة تشكيل الأوعية الدموية والخلايا المرتبطة بها التي تعبر عن GFP. - احصل على مكدسات z والفواصل المتتابعة بنفس الطريقة الموضحة في الخطوات 3.18-3.22.
6. القياس الكمي لمعلمة الأوعية الدموية
- معلمات الأوعية الدموية
- لفتح الصور التي تم إنشاؤها باستخدام البرنامج (ملفات .lif) في IMARIS ، قم أولا بتحويلها إلى تنسيق ".ims" باستخدام ملف محول الملفات. افتح ملف ".ims" باستخدام IMARIS ، وتحقق من البيانات الوصفية (مقاييس X ، Y ، Z) ، وحدد وحدة Filament . حدد تخطي الإنشاء التلقائي ، وتحرير يدويا.
- للحصول على تصور أفضل أثناء إنشاء الفتيل، انتقل إلى الإعدادات (رمز الورقة)، وحدد الخط في النمط، واترك عدد وحدات البكسل عند القيمة الافتراضية (1). ضع علامة في المربعات إظهار التشعبات، بما في ذلك نقطة البداية ونقاط الفرع والنقاط الطرفية. قم بإلغاء تحديد إظهار العمود الفقري.
- ضمن الرسم (رمز الفرشاة) ، حدد Method AutoPath ؛ 5 ميكرومتر كقطر ، ومصدر القناة المرتبط بالوعاء (TRITC-Dextran في هذه الحالة). أخيرا ، ضع علامة على المركز التلقائي والقطر التلقائي.
- ابدأ في رسم الخيوط باستخدام shift + النقر بزر الماوس الأيمن لاختيار نقطة بداية للفرع و shift + النقر الأيسر لاختيار نقطة نهاية الفرع.
ملاحظة: نقطة البداية باللون الأزرق الفاتح ، والنقاط المتفرعة باللون الأحمر أو الأزرق الداكن ، والنقاط النهائية باللون الأخضر. - لضبط القطر الصحيح للفتيل أثناء الرسم ، استخدم زر تمرير الماوس.
- للانضمام إلى خيطين بنقاط طرفية مميزة ، قم بإنشاء نقطة انطلاق جديدة بينهما وقم بتوصيلها في كل نقطة نهاية.
ملاحظة: وبالتالي ، تظهر النقاط الطرفية الخضراء في نقاط متفرعة. - بمجرد إنشاء شجرة الأوعية الدموية ، ارجع إلى الإعدادات وتأكد من صحة أعداد نقاط البداية والمتفرعة والطرفية. حدد المخروط لتصور الأقطار والتحقق من مظهرها.
- إذا كان قطر الفتيل (أو الاتصال) يبدو غير صحيح، فانتقل إلى Edit (رمز القلم الرصاص)، وحدد الفتيل المراد إزالته بنقرة بزر الماوس الأيمن، ثم انقر فوق Delete. أعد رسم الفتيل عن طريق ضبط القطر على الفتيل باستخدام زر تمرير الماوس.
- لاستخراج جميع بيانات الإحصائيات التي تم إنشاؤها وحفظها ، انقر فوق أيقونة الإحصائيات | تصدير جميع الإحصائيات إلى ملف - (أيقونة الأقراص المرنة المتعددة في أسفل الشاشة).
ملاحظة: لتجنب أي خيوط شاذة محتملة لا تتوافق مع الأوعية ، تم تضمين الخيوط التي يزيد طولها عن 20 ميكرومتر فقط في التحليل الإحصائي.
- القياس الكمي للمرونة
ملاحظة: لفتح الصور التي تم إنشاؤها باستخدام البرنامج (ملف .lif) في IMARIS، قم أولا بتحويلها إلى تنسيق ".ims" باستخدام ملف محول الملفات.- لدمج الصور الملتقطة قبل وبعد حقن ديكستران في نفس السلسلة الزمنية ، انتقل إلى وضع التجاوز ، وانقر فوق كل من الصورة الأولى (Tctrl ، قبل حقن ديكستران) وصورة الفاصل الزمني (الوقت 1 ، 60 دقيقة) لفتحها ، ودمجها بالنقر فوق تحرير وإضافة نقاط زمنية.
ملاحظة: لتصحيح الانحراف ثلاثي الأبعاد النهائي ، انتقل إلى الخطوات 6.2.2-6.2.7 باستخدام وظيفة الجسر بين فيجي و IMARIS. قم بتثبيت المكونات الإضافية التالية في فيجي: "IMARIS_Bridge96.jar" و "IMARISBridgeUtils.jar". يتم تنفيذ تسجيل الانجراف ثلاثي الأبعاد باستخدام "StackReg Pluging" (متوفر بالفعل في فيجي). إذا لم يكن ذلك ضروريا، فانتقل إلى الخطوة 6.2.8 - للقيام بتصحيح الانجراف ثلاثي الأبعاد ، افتح فيجي لجسر الصور من IMARIS بالنقر فوق الإضافات | ايماريس | صورة من IMARIS.
- في فيجي، حدد الإضافات | التسجيل | تصحيح الانجراف 3D.
- في النوافذ الجديدة التي تظهر، اختر القناة المناسبة للتسجيل.
ملاحظة: كان Nestin-GFP في هذه الحالة ، ولكن يمكن أن يكون أي قناة تسلط الضوء على الكائنات غير المتحركة ونسبة إشارة إلى خلفية عالية. - لتحسين اكتشاف الانجرافات الصغيرة، حدد حساب مقياس الوقت المتعدد وتصحيح انحراف البكسل الفرعي وتحسين الصور من Edge، واترك الإعدادات الأخرى كإعدادات افتراضية.
- لربط الصورة المصححة ب IMARI ، حددها وانقر فوق الإضافات | ايماريس | صورة إلى IMARIS.
- احفظه في المجلد المناسب بالنقر فوق ملف | حفظ باسم.
- لتصور جميع القنوات المكتسبة ، انقر فوق تحرير | إظهار ضبط العرض. حدد قناة dextran والوقت 1 (الإطار 2 في أسفل الشاشة).
- قم بإنشاء سطح جديد يحدد تجويف الأوعية الدموية في النقطة الزمنية 1 عن طريق تحديد خانة الاختيار إضافة سطح جديد (كائن أزرق)
- في Surface 1، انتقل إلى الخصائص وقم بإلغاء تحديد جميع المعلمات في إعدادات الخوارزمية. انقر فوق الخطوة التالية (السهم الأزرق)
- حدد قناة الأوعية الدموية (ديكستران في هذه الحالة) ضمن القناة المصدر وحدد الطرح السلس والخلفية. اترك جميع المعلمات الأخرى عند القيم الافتراضية. انقر فوق الخطوة التالية (السهم الأزرق).
- اضبط قيمة العتبة وفقا لمظهر السطح من حيث سمك وتغطية جميع المناطق الموجبة. انقر فوق الخطوة التالية (السهم الأزرق).
- استبعاد الأسطح غير المحددة (معظمها من النقاط الصغيرة) باستخدام المرشح افتراضيا عدد Voxels. انقر فوق الخطوة الأخيرة (السهم الأخضر).
- إذا لزم الأمر ، استمر في ضبط السطح يدويا بالنقر فوق تحرير (رمز القلم الرصاص) في إعداد المعلمات. لتحديد كائن لإزالته ، انقر بزر الماوس الأيسر فوقه واحذفه عن طريق تحديد حذف. إذا تم تجميع الكائن المراد حذفه إلى كائن آخر، فافصل الجزأين المنفصلين من السطح بالنقر فوق shift + انقر فوق اليسار بين الاثنين وتحديد Cut Surface. كرر هذه الخطوة عدة مرات حسب الضرورة.
- أخيرا ، اجمع بين جميع المقاطع باستخدام وضع التحديد (رمز الهدف على اليمين) واضغط على Control + Scroll لاستعادة جميع الكائنات. عند تحديد الكل، انقر بزر الماوس الأيسر وانقر فوق توحيد.
- لإنشاء السطح المرجعي، انسخ هذا السطح إلى النقاط الزمنية الأخرى. حدد السطح العام وقم بتكراره بالنقر فوق تكرار وإعادة تسميته باسم داخل الأوعية الدموية.
- حدد السطح داخل الأوعية الدموية وانقر فوق تكرار إلى جميع النقاط الزمنية.
- قم بتقسيم إشارة ديكستران للتمييز بين المناطق داخل الأوعية الدموية (IN) وخارجها (OUT). لإنشاء IN channeI لجميع النقاط الزمنية ، انقر فوق السطح داخل الأوعية الدموية | تحرير (زر قلم رصاص) | قناع الكل.
- في تحديد القناة، حدد القناة المناسبة وحدد القناة المكررة قبل تطبيق القناع. في إعدادات القناع ، ضع علامة فقط ثابت في الداخل / الخارج مع تعيين فوكسل خارج السطح على 0. أخيرا ، ضع علامة أيضا تنطبق على جميع النقاط الزمنية.
- في ضبط الشبكة الإعلانية، يتم إنشاء قناة جديدة افتراضيا مع إخفاء الاسم. أعد تسميته في.
- لإنشاء قناة OUT لجميع النقاط الزمنية، كرر الخطوات 6.2.18-6.2.20، ولكن حدد تعيين voxels داخل السطح إلى 0. أعد تسمية هذه القناة الجديدة OUT.
- لاستخراج البيانات الإحصائية ، انقر فوق أيقونة الإحصاء | تصدير جميع الإحصائيات إلى ملف (أيقونة أقراص مرنة متعددة في أسفل الشاشة)
- لتحليل التسرب، اقسم قناة مجموع الشدة بالخارج على قناة مجموع الشدة بالداخل لكل نقطة زمنية.
- لدمج الصور الملتقطة قبل وبعد حقن ديكستران في نفس السلسلة الزمنية ، انتقل إلى وضع التجاوز ، وانقر فوق كل من الصورة الأولى (Tctrl ، قبل حقن ديكستران) وصورة الفاصل الزمني (الوقت 1 ، 60 دقيقة) لفتحها ، ودمجها بالنقر فوق تحرير وإضافة نقاط زمنية.
النتائج
في الشكل 1 والشكل 2 ، يظهر نموذج CAD لغرسة تثبيت رأس التيتانيوم موضوعة على جمجمة فأر ممسوحة ضوئيا ، وهي مصممة لمتابعة التركيب التشريحي للجمجمة وتوفير جهاز خفيف الوزن ومتوافق حيويا قادر على التمسك بقوة بمرحلة المجهر لضمان استقرار المستوى الخلوي. باتباع هذا البروتوكول خطوة بخطوة ، يتم ربط الغرسة بثبات بجمجمة الفأر ويمكن تثبيتها بإحكام بحامل المجهر من خلال تشابكها ، مما يسمح بمنطقة تصوير مسطحة للاحتباس بالسوائل والمراقبة داخل الحيوية بمرور الوقت. يمكن إغلاقه بغطاء لتقليل أي ضرر أو عدوى في الجرح ، مما يسمح بالتصوير المتكرر لنفس منطقة الأنسجة على مدار أسابيع. بمجرد الاستيقاظ ، يمكن للفأر الذي يرتدي غرسة رأس أن يتجول بحرية ويتغذى ويمارس روتينا منتظما.
يوضح الشكل 3 عرضا لمسح البلاط لالأوعية الدموية الجلجلية BM المصنوعة من الشعيرات الدموية غير المتجانسة ، بما في ذلك الشرايين والشعيرات الدموية الانتقالية والجيوب الأنفية. يتم تضمين الأوعية الدموية في بيئة مكروية معقدة للأنسجة على اتصال وثيق بسطح العظام والخلايا الوسيطة حول الأوعية الدموية. أثناء تطور سرطان الدم ، يمكن اكتشاف خلايا ابيضاض الدم المعزولة داخل البيئة المكروية BM على مقربة من الأوعية ، ويزداد نقشها بمرور الوقت ، مما يملأ الكالفاريا في المراحل المتأخرة من المرض.
يوضح الشكل 4 كيف يمكن للصور التي تم الحصول عليها باستخدام هذا البروتوكول أن توفر بيانات كمية يمكن تحليلها بالطرق الإحصائية. نوضح كيفية تقسيم الأوعية باستخدام أداة خيوط IMARIS وقياس طول وقطر شظايا الأوعية الدموية ، بالإضافة إلى استقامتها. يمكن أيضا تقييم ارتباط هذه المعلمات.
يوضح الشكل 5 اكتساب التصوير الطولي لموضعين مختلفين من BM الجلالي أثناء تطور ابيضاض الدم النقوي الحاد في الأيام 4 و 7 و 10 ، مع ارتباط اليوم 10 بنقش ~ 50٪ من BM بخلايا سرطان الدم ، كما تم قياسه عن طريق قياس التدفق الخلوي (غير موضح). يمكننا ملاحظة إعادة تشكيل مهمة لحجم الأوعية الموجودة مسبقا ، بالإضافة إلى تكوين أوعية جديدة في مناطق محددة مرتبطة بفقدان العظام الموضعي.
أخيرا ، في الشكل 6 ، نوضح كيف يمكن قياس نفاذية الأوعية الدموية كمعامل ديناميكي مع تصوير الفاصل الزمني الذي يظهر قدرة حواجز الأوعية الدموية المختلفة على الاحتفاظ بصبغة الفلورسنت بمرور الوقت.

الشكل 1: تصميم وإنتاج حامل رأس متوافق حيويا قائم على التيتانيوم. (أ) أجزاء من الغرسة في الموقع: 1 حلقة مراقبة ، 2 ميزة تدعيم ، 3 مرساة تثبيت ، 4 ذيل ، 5 تتوافق ، 6 ثقب ملولب ، 7 بريجما. (ب) توصيل غرسة الرأس بالحامل: 8 جسم تثبيت ، 9 مشبك ، 10 رافعة غريب الأطوار ، 11 هيكل ، 12 هدف مجهر. (ج) تشوه الغرسة ضد الحمل بواسطة محاكاة FEM حيث يكون الحد الأقصى للإزاحة 0.23 ميكرومتر مقابل قوة 0.04 نيوتن. (د) غطاء الحماية والمسمار الخاص به. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تحضير الفأر للتصوير داخل الحيوية. (أ) منظر لغرسة الرأس ومنطقة التصوير المكشوفة جراحيا قبل التصوير. (ب) غرسة رأس متصلة بإحكام بجمجمة الفأر. (ج) استيقاظ الفأر في قفص التعافي مع الغطاء المغلق على غرسة الرأس. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
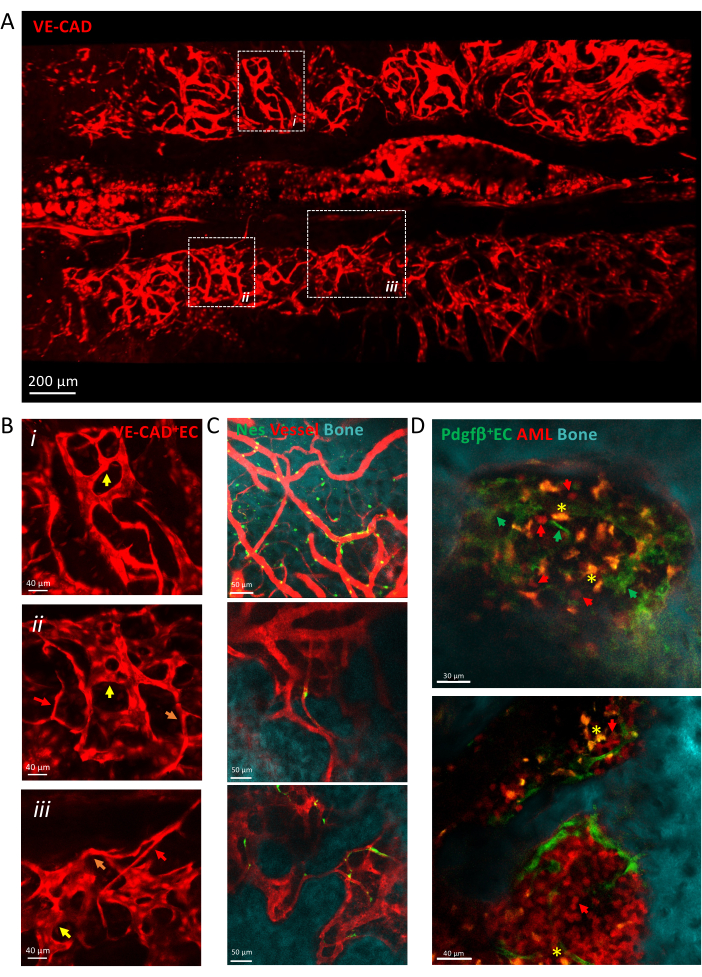
الشكل 3: التصوير داخل الحياة لالأوعية الدموية كالفاريا. (أ) إسقاط z لعرض مسح البلاط لالأوعية الدموية الكالفارية المسمى بواسطة cdh5-DSRED. (ب) تكبير المناطق المصورة لوصف أنواع مختلفة من الأوعية التي تصورها الأسهم ، والشرايين بالسهام الحمراء ، والشعيرات الدموية الانتقالية بالسهام البرتقالية ، والجيوب الأنفية بالسهام الصفراء. (i) و (ii) الإسقاطات z للأنسجة X ميكرومتر ؛ (ثالثا) شريحة واحدة. (ج) شرائح مفردة من عدة مجالات رؤية لأوعية BM ، تظهر سطح العظام (SHG) والخلايا المحيطة بالأوعية الدموية (nes-GFP +) والتجويف الوعائي (dextran-TRITC). (د) مكانة الأوعية الدموية المرتبطة بتطور ابيضاض الدم النقوي الحاد. شرائح تمثيلية للنقاط الزمنية المبكرة (العليا) والمتأخرة (السفلية) لتطور مكافحة غسل الدار. تم تصنيف سرطان الدم MLL-AF9 ب tdTOMATO (الأسهم الحمراء) ، بينما يتم تصنيف الأوعية ب pdgfb-GFP (الأسهم الخضراء) ، وسطح العظام مع SHG ، والبلاعم باللون الأصفر (التألق الذاتي ، النجمة الصفراء). أشرطة المقياس = 200 ميكرومتر (A) ، 40 ميكرومتر (B ، D- اللوحة السفلية) ، 50 ميكرومتر (C). الاختصارات: BM = نخاع العظام. GFP = بروتين الفلورسنت الأخضر. ابيضاض الدم النخاعي الحاد = ابيضاض الدم النخاعي الحاد. EC = الخلايا البطانية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: القياس الكمي لمعلمة الأوعية الدموية. (أ) قياس معلمات الأوعية الدموية عبر أداة خيوط IMARIS في إسقاط z تمثيلي لأوعية نخاع العظام المسمى ب TRITC-dextran. يتم عرض تمثيلات الخط والمخروط. (ب) التقدير الكمي لمعلمات السفينة في الصورة المبينة في ألف. (ج) الارتباط بين معلمات الأوعية الدموية الذي يظهر ارتباطا معاكسا بين استقامة الوعاء وطوله (سلبي ، سبيرمان ص = -3523 ؛ ص < 0.0001 ؛ R2 = 0.2102) مقابل القطر (إيجابي ؛ سبيرمان ص = 0.4110 ؛ ص < 0.0001 ؛ R2 = 0.1299). أشرطة المقياس = 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
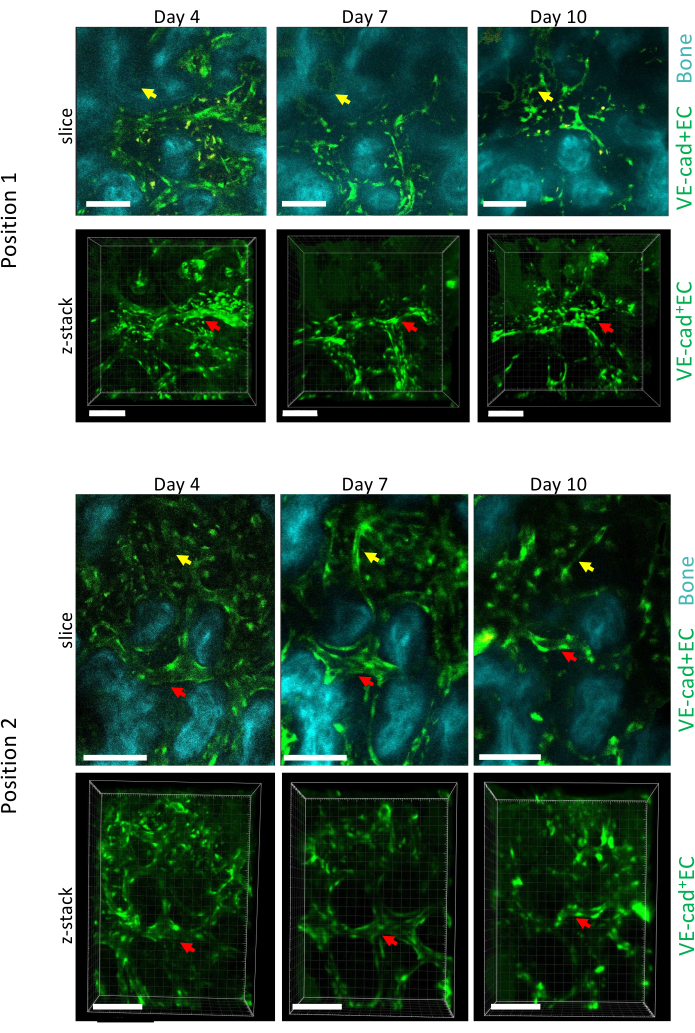
الشكل 5: التصوير الطولي لموضعين مختلفين من كالفاريا BM خلال تطور ابيضاض الدم النقوي الحاد. يتم تصنيف أوعية بطانة الخلايا البطانية ب cdh5-GFP ، وسطح العظام مع SHG ، والبلاعم باللون الأصفر (التألق الذاتي). يتم عرض إعادة تشكيل الأوعية الموجودة مسبقا (الأسهم الحمراء) وتشكيل أوعية جديدة (الأسهم الصفراء). أشرطة المقياس = 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
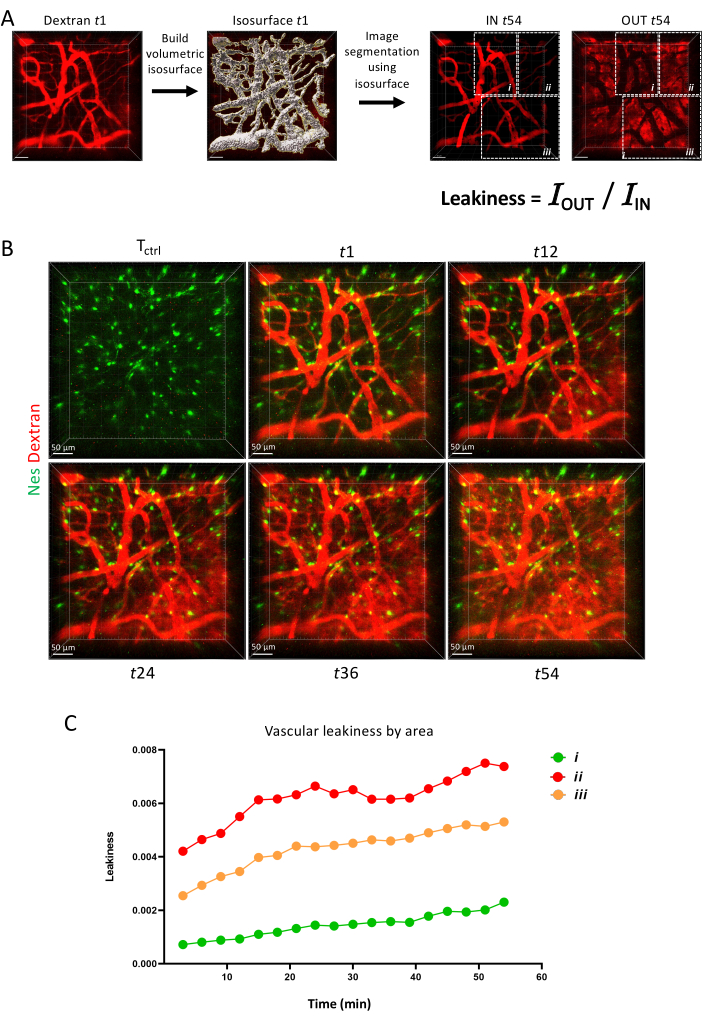
الشكل 6: نفاذية الأوعية الدموية. (أ) مخططات قياس نفاذية الأوعية الدموية عبر أداة سطح IMARIS. (ب) الإسقاط Z لنفس المنطقة المصورة طوليا على مدار 1 ساعة. (ج) التقدير الكمي لنفاذية الأوعية الدموية داخل المناطق كما هو موضح في أ. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي S1: جمجمة جاهزة. في المستوى المتوسط ، قم بإنشاء محور عرضي للكفاريا ، ثم احفظ الجمجمة المعدة. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي S2: الخطط متباعدة 2 مم. كيفية إنشاء مجموعة من الطائرات المتباعدة بشكل متساو (تباعد 2 مم) عبر الجمجمة. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي S3: محيط السطح الذي يمكن ملاحظته. قم بإنشاء رسم تخطيطي في المستوى الجليزي وقم بإنشاء شريحة على شكل كمثرى من AP +6.5 إلى -2 ، عرض 6 مم عند نقطة الوصول 0.0. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي S4: ملاحظة vindow. قم بإنشاء رسم تخطيطي في المستوى الجليزي وارسم شكل C بسمك 0.5 مم متصل بنافذة المراقبة . الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي S5: انقر فوق دراسة جديدة. انتقل إلى علامة التبويب "المحاكاة " (إذا كانت مرئية) أو انتقل إلى "المحاكاة" | دراسة. في مربع الحوار دراسة ، اختر ثابت كنوع الدراسة. انقر فوق موافق لإنشاء الدراسة الجديدة. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي S6: انقر بزر الماوس الأيمن لإنشاء شبكة. صقل الشبكة في المناطق التي يتوقع فيها الضغط العالي أو التشوه. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
تتمثل القوة الأساسية للفحص المجهري داخل الحيوية في قدرته على التقاط العمليات الخلوية الديناميكية في الوقت الفعلي داخل بيئتها الأصلية ، والتغلب على قيود طرق التصوير النسيجي التقليدية والتصوير خارج الجسم الحي . من خلال المراقبة المباشرة لمؤشر كتلة الدم الجلالي باستخدام تقنيات التصوير المتقدمة إلى جانب وضع العلامات الفلورية كما هو موضح في هذا البروتوكول ، يمكن للباحثين دراسة ليس فقط المعلمات الوظيفية للأوعيةالدموية 8،14 ، ولكن أيضا العمليات الطولية مثل نقش خلايا اللوكيميا وهجرتها6،15 ، والانتشار ، والنشاط الأيضي16،17 الحفاظ على الأهمية الفسيولوجية وتجنب القطع الأثرية المرتبطة بتثبيت الأنسجة ومعالجتها.
تشمل مزايا التصوير داخل الحيوية BM calvaria على مواقع العظام البديلة سهولة الوصول ، وشفافية عظم الجمجمة مما يسمح بتصور أفضل دون تلف العظام ، واستقرار عظم الكالفاريوم مما يقلل من القطع الأثرية لحركة الأنسجة ، وقابلية التكاثر عبر التجارب مما يسهل المقارنة بين المجموعات التجريبية المختلفة. تسمح إمكانية استعادة وإجراء التصوير الطولي أيضا بتقليل عدد المستخدمة في الدراسة. من الجدير بالذكر أنه نظرا لوحظ الاختلافات الخاصة بالسلالة في أنماط نمو أوعية الجمجمة وما يترتب على ذلك من تكوينالعظم 18 ، فمن المهم أن تأخذ ذلك في الاعتبار عند تصميم غرسة التصوير المحددة لسلالة الفأر المطلوبة للسماح بالتوافق التشريحي المثالي والوصول إلى موقع التصوير المطلوب.
نقطة أخرى مهمة يجب ذكرها هي الاختلافات المحتملة في خصائص الأوعية الدموية والمكونة للدم داخل BM الجلجلي مقارنة بالعظام الأخرى ، وهو سؤال لم يتم استكشافه بشكل جيد حتى السنوات الأخيرة. تشير الدراسات الجديدة إلى وظائف موضعية لعظام مختلفة ، حيث يختلف BM الجلالي عن العظام الأخرى من حيث تكون الدم وبنية العظام والأوعية الدموية ووظيفتها19،20،21،22،23 ، بالإضافة إلى الاستجابة للأمراض العصبية24. يجب استكشاف هذه الاختلافات بشكل أكبر وأخذها في الاعتبار قبل تعميم نتائج محددة لكلفاريا.
يعد تصميم وبناء غرسة التصوير خطوة أساسية لهذا الإعداد التجريبي ، بدءا من اختيار المادة. تلعب الغرسات المتوافقة حيويا دورا محوريا في البحوث الطبية الحيوية ، حيث تسهل مجموعة واسعة من التطبيقات التي تتراوح من هندسة الأنسجة والطب التجديدي إلى أنظمة توصيل الأدوية وأجهزة المراقبة في الجسم الحي . يعد اختيار مادة غرسة الرأس المكيفة للتصوير داخل الحياة أمرا بالغ الأهمية. من الناحية المثالية ، يجب أن تظهر المادة توافقا حيويا ممتازا ، وخصائص ميكانيكية مناسبة لضمان الحد الأدنى من المرونة والاستقرار العام ، وأخيرا ، القدرة على الاندماج داخل الجمجمة دون التسبب في التهاب. يعتبر التيتانيوم مثاليا لتحمله الجيد داخل جسم ، دون تحريض ردود فعل سلبية عند ملامسته للأنسجة البيولوجية ، وكذلك لمقاومته للتآكل ، مما يضمن الاستقرار على المدى الطويل حتى لو تعرض لسوائل الجسم أو المحاليل التجريبية. علاوة على ذلك ، فإن قوتها الميكانيكية تجعلها مقاومة للتشوه والكسر. على الرغم من قوته ، إلا أن التيتانيوم له كثافة منخفضة نسبيا ، مما ينتج عنه أجهزة تصوير خفيفة الوزن داخل الحيوية تقلل من العبء على التجارب والباحثين. أخيرا ، يسمح تعدد استخداماته في التصنيع بتخصيص أجهزة التصوير داخل الحيوية لتناسب المتطلبات التجريبية المحددة ، مثل الحجم والشكل والوظيفة.
هنا ، قمنا بتصميم غرسة تثبيت رأس متوافقة حيويا باستخدام برنامج CAD للنمذجة البارامترية مع إمكانات تحليل العناصر المحدودة (FEA) المدمجة ، وتحديدا SolidWorks. يتيح هذا النهج إجراء تعديلات دقيقة ومتكررة على المتطلبات الهيكلية والمكانية للغرسة ، مما يضمن التوافق التشريحي والمرونة الميكانيكية. تقدم البدائل المجانية ، مثل FreeCAD ، وظائف نمذجة ومحاكاة مماثلة. تشمل المدخلات الأساسية لعملية التصميم نموذجا تشريحيا عالي الدقة لجمجمة الفأر ، ونموذجا لهدف المجهر ، ونموذجا لنظام التثبيت ، والتي تعلم معا أبعاد الغرسة وتكوينها. الإخراج النهائي هو ملف شبكي مستقل عن النظام الأساسي ، عادة بتنسيق STL أو STEP ، متوافق مع معظم برامج الطباعة ثلاثية الأبعاد.
تتضمن الخطوة الأولى التقاط السمات التشريحية التفصيلية لرأس الفأر باستخدام تقنيات التصوير عالية الدقة ، مثل المسح المضغوط المصغر في الجسم الحي . يوفر هذا النهج أعلى التفاصيل التشريحية والدقة ، ويلتقط الهياكل المجهرية للجمجمة. يمكن أن يكون المسح ثلاثي الأبعاد للجمجمة العارية المعدة خيارا أيضا. تستخدم هذه الطريقة ، باستخدام الماسحات الضوئية بالليزر أو الضوء الهيكلي ، بشكل شائع على الجمجمة المعدة وتوفر ملامح سطحية دقيقة ، على الرغم من أنها أقل تفاصيل داخلية مقارنة بالتصوير المقطعي المحوسب الدقيق. بخلاف ذلك ، يمكن تنزيل نماذج التشريح من المنشورات وقواعد البيانات مفتوحةالمصدر 25 أو DigiMorph {https://www.digimorph.org/specimens/Mus_musculus/}. على الرغم من أنها مريحة ، إلا أن هذه النماذج قد تفتقر إلى التفاصيل الخاصة بالعينة ، لذلك غالبا ما تكون هناك حاجة إلى تعديلات للحيوان المحدد في الدراسة مثل التحجيم إلى مسافة Bregma-Lambda الفعلية. ثم يتم استخدام البيانات المكتسبة لإنشاء نموذج ثلاثي الأبعاد دقيق لجمجمة الفأر ، لتكون بمثابة النموذج التأسيسي لتصميم الزرع.
لتثبيت الغرسة على الجمجمة ، تم تصميم هيكل أسمنتي لتغطية سطح الجمجمة المتبقي الذي لا تشغله نافذة المراقبة. يجب أن يوفر هذا الهيكل نقاط ربط قوية مع تجنب السمات التشريحية الحرجة. يحتوي هيكل الأسمنت على فتحات متعددة لضمان البلمرة المثلى للأسمنت تحت الغرسة من خلال الانتشار. بالإضافة إلى ذلك ، تتميز جدران هيكل الأسمنت بزاوية سحب صغيرة ، مما يسمح للأسمنت بالتثبيت بإحكام على هذه الجدران الزاوية. تم تصميم ذيل الغرسة ، الذي يمتد من الجسم الرئيسي إلى نظام التثبيت. هذا المكون ضروري لمحاذاة الغرسة وتثبيتها أثناء المراقبة ، ويجب أن يأخذ تصميمه في الاعتبار المساحة المتاحة والقيود التشريحية لرأس الماوس. أخيرا ، تم دمج آلية تتوافق في تصميم الغرسة لسهولة ربط الغرسة وفصلها عن نظام التثبيت. تعزز هذه الميزة التطبيق العملي وسهولة استخدام الغرسة أثناء الملاحظات المتكررة. توفر آلية التشابك تثبيتا قابلا للتكرار لسهولة استرجاع الأنسجة المرصودة لجلسات التصوير المتكررة.
يجب على القراء الذين يفكرون في اعتماد التصوير المجهري داخل الحيوية لكتلة الجسم الجليزية تقييم أهدافهم البحثية ومتطلباتهم التجريبية بعناية لتحديد ما إذا كانت هذه الطريقة مناسبة لدراساتهم. بينما يقدم الفحص المجهري داخل الحيوية رؤى لا مثيل لها حول تكون الدم ، وتنظيم البيئة الدقيقة للأنسجة ، وديناميكيات الأوعية الدموية في الجسم الحي ، فإنه يمثل أيضا بعض التحديات والقيود التقنية. يجب أن يكون الباحثون مستعدين لمواجهة هذه التحديات من خلال التصميم التجريبي الدقيق ، وتحسين معلمات التصوير ، واستخدام الضوابط المناسبة. بالإضافة إلى ذلك ، يجب على الباحثين مراعاة توافر معدات التصوير المتخصصة ، والخبرة في تقنيات وضع العلامات الفلورية ، والموارد الحسابية لتحليل الصور. بشكل عام ، ينطوي التصوير المجهري داخل الحيوية ل BM الجلالي على إمكانات هائلة لتعزيز فهمنا لتكون الدم وبيولوجيا الأوعية الدموية ، مما يوفر نافذة فريدة على العمليات الديناميكية التي تحدث داخل البيئة الدقيقة BM.
Disclosures
جوزوا فودور هو مؤسس شركة YMETRY (سجل رقم 888312352). المؤلفون الآخرون ليس لديهم تضارب في المصالح.
Acknowledgements
يود المؤلفون أن يشكروا جميع موظفي IMAG'IC ومرافق في معهد كوشين على دعمهم لتجارب الفحص المجهري وإسكان الفئران. Tg (Nes-EGFP) 33Enik و Tg (Pdgfb-icre / ERT2) 1كانت الفئران Frut هدية لطيفة من الدكتور بونيه (معهد فرانسيس كريك ، لندن). Tg (Cdh5-cre / ERT2) 1Rha و B6. كانت الفئران Cg-GT (ROSA) 26Sortm9 (CAG-tdTomato) Hze / J هدية لطيفة من الدكتور رفيعي (طب وايل كورنيل ، نيويورك). وقد حظي العمل الموصوف بدعم من المركز الوطني للبحوث الاجتماعية، ومعهد البحوث الاستراتيجية للأبحاث وجامعة باريس سيتي، ومنح من ATIP-AVENIR، ومؤسسة ARC للبحوث في مجال السرطان (R19084KS - RSE20008KSA)، دي باريس "الظهور" (R20192KK - RPH20192KKA)، ولوريت فوجين (R23197KK)، وكانسيروبول جيش الدفاع الإسرائيلي (RPH23177KKA)، ومنظمة الاستخبارات الدولية (RPH21162KKA)، ومؤسسة فرنسا (RAF23152KKA)، ورابطة مناهضة السرطان (282273/807251)، ومعهد السرطان في باريس كاربيم، الجمعية الأوروبية لأمراض الدم (RAK23130KKA) ومجلس البحوث الأوروبي ERC-STG (EEA24092KKA). يتم دعم مرفق IMAG'IC الأساسي من قبل البنية التحتية الوطنية في فرنسا للتصوير الحيوي (منحة ANR-10-INBS-04). ينتمي مختبر باسارو إلى "معهد مورس لعلوم القلب والأوعية الدموية" وإلى "معهد اللوكيميا في باريس سانت لويس.
Materials
| Name | Company | Catalog Number | Comments |
| Amira | Thermo ScientificTM | ||
| Anesthesia | Isoflurane 2% to 3% | ||
| Anesthesic mask (animal detection) | Minerve | ||
| Anesthesic unit | Minerve | ||
| B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze | Jackson laboratories | MGI:3809523 | |
| CalvariaVue | Ymetry | https://ymetry.com/site/head-fixation-implants/44-mouse-head-fixation-implant-for-calvaria.html | |
| Dental cement | Kemdent | SUN527 | |
| Dextran 500 kDa-Cy5 | Tebu-bio | DX500-S5-1 | 3 mg/mouse |
| Dextran 70 kDa-TRITC | Sigma | T1162 | 3 mg/mouse |
| Disinfectant | MP-Labo | Dermidine-60ml | |
| Electric razor | Aescular | Isis | |
| Eye gel | Ocry-gel | 10g | |
| Fiji | https://imagej.net/software/fiji/downloads | v 17 May 30 | |
| Fiji plugings to bridge with Imaris | https://imagej.net/software/fiji/downloads | Imaris_Bridge96.jar ; ImarisBridgeUtils.jar | |
| Heating box | Datesand | Thermacage | |
| Heating pad for surgery | Minerve | ||
| Imaging heating pad & rectal probe | F. Haer | ||
| Imaris v9.6.0 | Oxford instruments | ||
| Intrasite gel | Chinoxia | 2390766 | |
| LAS AF Software | Leica | LAS X 3.5.7.23225 | |
| Medication | Buprecare, 0.01 mg/kg | ||
| Objective HCX IRAPO L 25x/0.95 WATER | Leica | 506374 | |
| Saline buffer (PBS 1x) | Sigma | P4417 | Sterilize by autoclave |
| SP8 DIVE FALCON Multiphoton Microscope | Leica | ||
| Stereotoxic mask | Minerve | 1201261 | |
| Sterilizator beads | Sigma | Z742555 | |
| Surgery tools | Moria | 4877A; 2183 | |
| Survival blanket | SECURIMED | 11006 | |
| Swabs / Tissues | Sterilize by autoclave | ||
| Syringe 1 mL 26 G | BD Plastipak | 305501 | |
| Temperature controller | F. Haer | 40-90-5D-02 | |
| Tg(Nes-EGFP)33Enik mice | Jackson laboratories | MGI:5523870 | |
| Tg(Pdgfb-icre/ERT2)1Frut mice | Jackson laboratories | MGI:3793852 | |
| Tg(Cdh5-cre/ERT2)1Rha mice | Jackson laboratories | MGI:3848982 | |
| Ultrasound gel | Parker laboratories | Aquasonic 100 |
References
- Lo Celso, C., et al. Live-animal tracking of individual haematopoietic stem/progenitor cells in their niche. Nature. 457 (7225), 92-96 (2009).
- Pittet, M. J., Weissleder, R. Intravital imaging. Cell. 147 (5), 983-991 (2011).
- Itkin, T., et al. Distinct bone marrow blood vessels differentially regulate haematopoiesis. Nature. 532 (7599), 323-328 (2016).
- Christodoulou, C., et al. Live-animal imaging of native haematopoietic stem and progenitor cells. Nature. 578 (7794), 278-283 (2020).
- Upadhaya, S., et al. Intravital imaging reveals motility of adult hematopoietic stem cells in the bone marrow niche. Cell Stem Cell. 27 (2), 336-345.e4 (2020).
- Hawkins, E. D., et al. T-cell acute leukaemia exhibits dynamic interactions with bone marrow microenvironments. Nature. 538 (7626), 518-522 (2016).
- Duarte, D., et al. Defining the in vivo characteristics of acute myeloid leukemia cells behavior by intravital imaging. Immunol Cell Biol. 97 (2), 229-235 (2019).
- Passaro, D., et al. Increased vascular permeability in the bone marrow microenvironment contributes to disease progression and drug response in acute myeloid leukemia. Cancer Cell. 32 (3), 324-341.e6 (2017).
- Jia, Y., et al. FLT3 inhibitors upregulate CXCR4 and E-selectin ligands via ERK suppression in AML cells and CXCR4/E-selectin inhibition enhances anti-leukemia efficacy of FLT3-targeted therapy in AML. Leukemia. 37 (6), 1379-1383 (2023).
- Pendleton, E. G., Tehrani, K. F., Barrow, R. P., Mortensen, L. J. Second harmonic generation characterization of collagen in whole bone. Biomed Opt Express. 11 (8), 4379-4396 (2020).
- Ventalon, C., Bourdieu, L., Leger, J. F., Fodor, J. Dispositif de liaison d'un animal de laboratoire à au moins un système d'expérimentation, et procédé de fixation d'un tel dispositif. France patent. , (2021).
- Horton, S. J., et al. Acute myeloid leukemia induced by MLL-ENL is cured by oncogene ablation despite acquisition of complex genetic abnormalities. Blood. 113 (20), 4922-4929 (2009).
- Scott, M. K., Akinduro, O., Lo Celso, C. In vivo 4-dimensional tracking of hematopoietic stem and progenitor cells in adult mouse calvarial bone marrow. J Vis Exp. (91), e51683 (2014).
- Jung, Y., et al. Intravital imaging of mouse bone marrow: Hemodynamics and vascular permeability. Methods Mol Biol. 1763, 11-22 (2018).
- Le, V. H., et al. In vivo longitudinal visualization of bone marrow engraftment process in mouse calvaria using two-photon microscopy. Sci Rep. 7, 44097 (2017).
- Spencer, J. A., et al. Direct measurement of local oxygen concentration in the bone marrow of live animals. Nature. 508 (7495), 269-273 (2014).
- Yang, M., Mahanty, A., Jin, C., Wong, A. N. N., Yoo, J. S. Label-free metabolic imaging for sensitive and robust monitoring of anti-CD47 immunotherapy response in triple-negative breast cancer. J Immunother Cancer. 10 (9), e005199 (2022).
- Li, W., et al. Tracking strain-specific morphogenesis and angiogenesis of murine calvaria with large-scale optoacoustic and Ultrasound Microscopy. J Bone Miner Res. 37 (5), 1032-1043 (2022).
- Lassailly, F., Foster, K., Lopez-Onieva, L., Currie, E., Bonnet, D. Multimodal imaging reveals structural and functional heterogeneity in different bone marrow compartments: functional implications on hematopoietic stem cells. Blood. 122 (10), 1730-1740 (2013).
- Rindone, A. N., et al. Quantitative 3D imaging of the cranial microvascular environment at single-cell resolution. Nat Commun. 12 (1), 6219 (2021).
- Mills, W. A., Coburn, M. A., Eyo, U. B. The emergence of the calvarial hematopoietic niche in health and disease. Immunol Rev. 311 (1), 26-38 (2022).
- Bixel, M. G., et al. Angiogenesis is uncoupled from osteogenesis during calvarial bone regeneration. Nat Commun. 15 (1), 4575 (2024).
- Koh, B. I., et al. Adult skull bone marrow is an expanding and resilient haematopoietic reservoir. Nature. 636 (8041), 172-181 (2024).
- Kolabas, Z. I., et al. Distinct molecular profiles of skull bone marrow in health and neurological disorders. Cell. 186 (17), 3706-3725.e9 (2023).
- Rosenhain, S., et al. A preclinical micro-computed tomography database including 3D whole body organ segmentations. Sci Data. 5, 180294 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved