Method Article
Calvarial Bone Marrowにおける血管動態の生体内縦断的イメージング
要約
生体内顕微鏡検査は、組織再生や腫瘍発生などのダイナミックな生物学的プロセスの研究を可能にします。非常に動的な組織である頭蓋骨髄は、造血と血管機能に関する洞察を提供します。生体適合性のある3Dプリントされた頭部固定インプラントを使用すると、反復的な縦方向のイメージングが可能になり、組織ダイナミクスと腫瘍微小環境の理解が深まります。
要約
生体内縦断的蛍光顕微鏡イメージングは、特に組織再生、腫瘍発生、および治療反応の文脈で、動的な生物学的プロセスを研究するための重要な技術として浮上しています。特に、頭蓋骨髄は非常に動的な組織であり、造血運命は周囲の微小環境と相互に関連しており、正常な造血と病的な造血に反応する特殊な血管があります。従来の固定組織のイメージングでは、静的な情報が得られ、多くの場合、これらのプロセスの包括的な理解が制限されていました。
細胞特異的マーカーを発現するトランスジェニック動物、生細胞トレーサー、イメージング機器の進歩、および特殊なチャンバーの使用の統合により、生体内顕微鏡検査は、動的な生物学的現象への洞察を得るための極めて重要なツールに昇格しました。生体内イメージングの応用の1つは、腫瘍血管の挙動と治療効果の調査です。新設計の3Dプリントされたチタン製頭部固定インプラントは、マウスの頭蓋骨に安定して接続でき、複数回のセッションでの縦方向のイメージングに適しています。
提案されたプロトコルは、血管の不均一性の視覚化と定量化、間質細胞と造血細胞との相互作用、血管機能パラメータの測定など、頭蓋骨髄の血管動態の空間的および時間的調査を可能にします。さらに、この技術により、確立された血管床の可視化や、治療効果、幹細胞の動員、および2光子顕微鏡を用いた化学療法化合物の経時的な局在のモニタリングが可能になります。全体として、この生体内縦断的イメージングプロトコルは、腫瘍血管の挙動と造血細胞動態の両方を調査するための包括的なプラットフォームを提供し、これらの生物学的現象を支配する複雑なプロセスに関する貴重な洞察を提供します。
概要
頭蓋骨髄(BM)の生体内顕微鏡イメージングは、造血、組織微小環境調節、およびBMニッチ内の血管動態の動的プロセスを調査するための強力で不可欠な技術として機能します。この方法論的アプローチの主な目的は、 in vivo の BM 微小環境内の細胞の挙動、相互作用、および空間構成のリアルタイムの視覚化と分析を可能にすることです。研究者は、蛍光標識と組み合わせた高度なイメージング技術を使用してBMカルバリアを直接観察することにより、造血幹細胞(HSC)、間質細胞、および周囲の血管系との間の複雑な相互作用を解明することができ、それによって造血と免疫応答の調節に関する重要な洞察を得ることができます。
生体内顕微鏡イメージングの開発と利用は、従来の組織学的およびex vivoイメージング法の限界から幹細胞を採取するものであり、細胞の挙動や組織の相互作用の動的な性質を捉えることができないことがよくあります。静的イメージング技術とは異なり、生体内顕微鏡法では、研究者は細胞のダイナミクスをリアルタイムで観察できるため、実験動物を犠牲にすることなく、細胞の移動、増殖、天然のニッチ内での分化などの縦断的プロセスを研究することができます。さらに、生体内顕微鏡法は、血管機能(灌流、透過性、低酸素症など)などのin vivoでの機能的挙動を研究するという独自の利点を提供し、それによって生理学的関連性を維持し、組織の固定と処理に関連するアーティファクトを回避します。この分野の先駆的な研究は、このアプローチの多大な利点を実証しており1,2、その発見は、生体内顕微鏡法を利用して内因性HSCの局在、移動、およびBMニッチ内の血管系との相互作用を追跡する、より最近洗練されたアプローチ3,4,5によって裏付けられ、拡大されています。さらに、生体内顕微鏡検査は、白血病やBM不全症候群などの造血障害の根底にあるメカニズムの解明に役立ち、白血病細胞の運動性6,7、疾患関連血管への影響8、および薬物反応9に関する新たな洞察を提供しています。
頭蓋骨のBMカバー代替骨部位の生体内顕微鏡イメージングにはいくつかの利点があります。まず、頭蓋骨に含まれるBMは、大腿骨や脛骨などのより深い骨と比較して、生体内イメージングに容易にアクセスできます。このアクセス可能性は、侵襲的な外科的処置を必要とせずに、第2高調波発生(SHG)可視化10を介して、骨自体を含む組織微小環境の直接観察を容易にする。第二に、頭蓋骨は比較的薄く半透明であるため、BMニッチ内の細胞ダイナミクスをよりよく視覚化できます。この透明性により、2光子顕微鏡、共焦点顕微鏡、ライトシート顕微鏡による高解像度イメージングが容易になり、骨の薄化やクリアリング技術は必要ありません。頭蓋骨は、生体内イメージング実験のための安定した平坦で剛性の高いプラットフォームを提供し、組織の動きのアーチファクトを最小限に抑え、長時間の観察期間にわたって一貫したイメージング条件を確保します。この安定性は、細胞の挙動と応答を経時的に追跡する縦断的研究に特に有利です。再現性は、実験動物全体での頭蓋骨の構造が比較的小さく、空間的に定義されたことを考えると、もう一つの大きな利点です。この均一性により、異なる実験グループ間の比較が容易になり、イメージングデータの堅牢な統計解析が可能になります。
ここでは、生体適合性グレード23チタン合金(Ti6Al4V)を使用して3Dプリントされた新開発の頭部固定インプラント11を導入し、生体適合性グレード23チタン合金(Ti6Al4V)を使用してマウスの頭蓋骨BMを画像化する方法を説明します。インプラントは、インプラントホルダーを介してマウスヘッドを顕微鏡ステージにしっかりと安定して固定し、呼吸アーチファクトを最小限に抑え、時間の経過とともに同じ領域を縦方向にイメージングすることができます。いくつかの例は、BM微小環境(SHG+骨表面;nestin-GFP+間葉系細胞;cdh5-DSRED+、cdh5-GFP+、またはpdgfb-GFP+内皮細胞)、悪性造血コンパートメント(tdTOMATO+ AML細胞)、および血管の内腔を描写する蛍光造影剤(デキストラン-TRITC)。血管の長さ、真直度、直径、さまざまな血管領域の透過性など、数時間または数日にわたって測定された血管パラメータは、組織の挙動と健康に関する重要な情報を提供します。
プロトコル
すべての動物実験は、フランスの「Ministère de l'enseignement supérieur, de la recherche et de l'innovation」によって承認された倫理協定APAFIS#27215-2020041513522374 v6に基づいて実施されました。
1. 3Dプリンティング用の生体適合性チタン頭部固定インプラントの設計
注:パラメトリックモデリングコンピュータ支援設計(CAD)ソフトウェアと有限要素解析(FEA)機能( 材料の表を参照)を使用して、生体適合性頭部固定インプラントを設計しました。設計プロセスの主な入力には、マウスの頭蓋骨の高解像度解剖学的モデル、顕微鏡対物レンズのモデル、固定システムのモデルが含まれ、これらが一緒になってインプラントの寸法と構成を通知します。最終的な出力は、プラットフォームに依存しないメッシュファイルで、通常はSTLまたはSTEP形式で、ほとんどの3Dプリントソフトウェアと互換性があります。このファイル形式により、3Dプリンターへのシームレスな転送が可能になり、正確なインプラント製造が可能になります。
- マウスの3Dモデルの準備
- マウスの頭蓋骨を、調製済みまたは in vivoでマイクロCTスキャナーに配置します。
- 解剖学的詳細を最適に解決するためのスキャンパラメータを設定します: コントロールパネル を開き、 スキャン条件 セクションで視野(FOV)を選択します。 LiveView を使用してスキャンボリュームを定義します。
注意: 検出器の解像度を通じて、FOVは検出器の解像度に基づいてボクセルサイズを決定します。新しいマイクロCTマシンでは、 5 mm FOV は通常 、5 μmボクセルサイズ、10 mm FOV から 10 μmボクセルサイズ、25 mm FOV から 21 μmボクセルサイズに対応します。この解像度ではFOVが限られているため、頭蓋骨全体をカバーするために複数回のスキャンが必要になる場合があります。複数のスキャンでは、スキャン間でオーバーラップする必要があります。 - イメージングソフトウェアで複数の高解像度スキャンをつなぎ合わせて、頭蓋骨の単一の包括的なモデルを作成します。
- マイクロCT DICOMファイルをセグメンテーションソフトウェア(3D Slicer、Amira、Avizo、Mimicsなど)にインポートして、頭蓋骨を分離します。
- 閾値ベースのセグメンテーションを実行して骨組織を周囲の構造から分離し、複雑な領域やノイズの多い領域を微調整するために手動調整を行います。
- 3D Slicerでは、まずDICOMファイルをインポートしてデータセットを読み込み、軸、矢状、冠状スライスのビューでCTスライスを観察します。
- セグメント編集を開き、[追加]をクリックして新しいセグメンテーションを作成します |[追加] は、しきい値を設定する新しいセグメントを作成します。
- セグメントエディターパネルで、しきい値エフェクトをクリックします。[下限しきい値] スライダーと [上限しきい値] スライダーを調整 (または数値を入力) して、セグメント化する領域がスライス ビューで赤で強調表示されるようにします。しきい値が設定された 3D セグメントの準備が整いました。
- セグメント化された頭蓋骨をSTLファイルとしてエクスポートするには、セグメンテーションモジュールに変更します。しきい値が適用されたセグメントが選択されていることを確認します。「モデルとラベルマップのエクスポート/インポート」セクションで、「エクスポートタイプ」を「モデル」に設定します。ファイル形式:STL。「エクスポート」ボタンをクリックします。
注:STLファイルは三角形のメッシュ形式を使用し、頭蓋骨の表面を数千の三角形で表し、解剖学的形状を詳細にキャプチャします。- 必要に応じて、以下のようにMeshLabでスティッチングを行います。
- メッシュをインポートするには、[ ファイル] |メッシュをインポートし 、リファレンススキャンとして1つを選択します。
- 整列ツールを使用して他のスキャンを整列します(フィルター|参加登録 |整列)に対応するポイントをマークし、プロセスを使用します。
- 位置合わせされたスキャンをマージするには、[フィルター] |メッシュレイヤー |「可視レイヤーのみを統合」オプションを使用して、可視レイヤーをフラット化します。
- 必要に応じて、以下のようにMeshLabでスティッチングを行います。
- メッシュをクリーニングして修復し、次のように重複する頂点と三角形を削除して、ノイズによる三角形の除去と意図しない穴の埋めを確実にし、滑らかで連続した表面を取得します。
- 「フィルター」をクリックします。クリーニングと修理 |重複した頂点を削除します。
- 「フィルター」をクリックします。クリーニングと修理 |重複した面を削除します。
- 「フィルター」をクリックします。クリーニングと修理 |孤立したピースを(面番号で)削除します。保持する面の最小数のしきい値を指定します(たとえば、このしきい値を低く設定すると、小さなクラスターやノイズが除去されます)。
- 「フィルター」をクリックします。リメッシュ、簡略化、再構築 |穴を閉じます。
- マイクロCTからの初期STLファイルには、CADソフトウェアと互換性のない非常に高い三角形数が含まれているため、メッシュを~10,000〜30,000個の三角形に簡略化します。細部の領域では、頭蓋骨の上部に小さな三角形を保持して、インプラントが正確にフィットするようにします。粗い領域では、重要度の低い領域を大きな三角形で簡略化して、ファイルサイズを小さくし、処理効率を最適化します。
注: メッシュの簡略化は領域ごとに行われ、1.1.8.1-1.1.8.3 で詳しく説明されています。- 領域選択ツールで接続コンポーネントを選択(Select Connected Components)を使用して、簡略化する領域を選択します。
- パラメータを使用して選択した領域に Quadratic Edge Collapse Decimation を使用します。「フィルター」をクリックします。リメッシュ、簡素化、再構築 |簡略化: Quadric Edge Collapse Decimation。Quality Thresholdを0.8に、Preserve Boundary of the meshをYESに、Preserve topologyをYESに、Target Number of faces:必要な解像度に対応するターゲット番号を設定します。
- 三角形の総数が目的のレベルに減少するまで、必要に応じて反復します。次に、簡略化されたモデルをSTLファイルに保存します。
- CADモデルでの頭蓋骨モデルの準備
- 簡略化された頭蓋骨モデルをSTL形式でCADソフトウェアに新しいパーツまたはモデルとしてインポートします。ソフトウェアの機能に応じて、インポートしたファイルが必要に応じてソリッドボディまたはサーフェスボディに適切に変換されていることを確認してください。モデルをネイティブCADファイル形式で保存して、さらに変更を加え、後続の設計ステップとの互換性を確保します。
- このモデルでBregmaとLambdaに参照点を配置し、Bregma-Lambda軸を作成します。
- Bregma-Lambda軸を含む中央値平面を作成します。
- 中央値平面で、頭蓋骨に接する軸を作成し、準備した頭蓋骨を保存します(補足図S1)。
- 新しいアセンブリを作成し、準備した頭蓋骨を、Bregmaが原点と一致し、中央平面が右平面と一致し、頭蓋骨軸が水平になるように挿入します。
- 頭部固定インプラントは、準備された頭蓋骨モデルに完全にフィットするように、アセンブリ内で直接設計されます。これを実現するには、インプラントをアセンブリ内の新しいパーツとして作成します。まず、[ 挿入] |コンポーネント |CADソフトウェアの新しい部品 。プロンプトが表示されたら、新しいパーツを配置して固定するための参照として、カルバリア サーフェスまたはアセンブリの上面を選択します。
- 頭蓋骨を横切る等間隔の平面(2 mm間隔)のセットを作成します。各平面上にスケッチを作成し、各スケッチ上に、頭蓋骨の上面の 0.2 mm 上のセクションに沿って、9 つの点を持つ対称スプラインの形で 0.2 mm オフセットの投影曲線を描きます (補足図 S2)。
- これらのスプライン( スカルリミットサーフェス)を使用してスイープサーフェスを作成し、このサーフェスが欠陥なく滑らかであることを確認して、インプラントフィーチャーの構築に使用します。
- 頭蓋骨の観測可能な表面の定義
注:3Dモデルに基づいて、3D観察に最適な頭蓋骨の最も平らな領域が特定されます。この領域は、頭蓋骨の生物学的および構造的完全性を考慮しながら、2光子顕微鏡の対物レンズに最適なアクセスを確保するために慎重に選択されています。この定義では、Bregma 点が座標系の原点として機能する定位固定装置座標を使用できます。- カルバリア平面にスケッチを作成し、AP 0.0 で AP +6.5 から -2、幅 6 mm の洋ナシ形のスプラインを作成します。これが 観測可能な表面輪郭 になります (補足図 S3)。
注:顕微鏡対物レンズは、頭蓋骨の以前に定義された観察可能な表面に対して仮想的に配置されます。このステップでは、対物レンズのサイズと形状によって課せられる空間的制約を決定し、インプラントの設計が顕微鏡の要件に対応していることを確認します。 - 顕微鏡の対物レンズモデルをアセンブリに垂直に挿入します。その焦点を頭蓋骨の頭蓋面に平行な平面上に拘束し、 顕微鏡対物レンズのバウンディングボリュームを定義します。
- Observable Surface Contour に従って対物レンズをスイープしてボリュームを作成します。
- 定義された観察可能な表面の周囲に観察窓を作成し、顕微鏡の対物レンズへのアクセスを妨げないようにします。
注:観察窓は、浸漬液の保持や保護カバーを正しく閉じるための固体構造などの二次機能を持つリング状の構造です。 - カルバリアル平面にスケッチを作成し、観測可能なサーフェスの輪郭をコピーします。
- 厚さ 0.5 mm の平行な輪郭を作成します。この二重輪郭を上向きに0.9 mm押し出し、ドラフト角度4°で表面のスカルリミットサーフェスまで下向きに押し出します。
- カルバリア平面にスケッチを作成し、AP 0.0 で AP +6.5 から -2、幅 6 mm の洋ナシ形のスプラインを作成します。これが 観測可能な表面輪郭 になります (補足図 S3)。
- セメンチング構造、テール構造、およびダブテール構造の定義。
- calvarial平面にスケッチを作成し、観察窓に接続する厚さ0.5 mmのC字型を描き、勾配4°の角度で表面の頭蓋骨限界面まで高さ2 mm下向きに押し出します(補足図S4)。
- カルバリアル平面にスケッチを作成し、このスペースを厚さ 0.4 mm の長方形で埋め、その間に 1 mm のスペースを空けて放射状に配置します。
- 観察ウィンドウと同様に押し出します。
- インプラントの尾部は、利用可能なボリュームを尊重して、頭蓋骨を固定に頼って作成します。
- セメンチング構造に接する方向に横方向の平面を作成し、さらに後方に12.5 mmの平面を作成します。
- これらの平面上に長方形をスケッチします。ピラミッド型のボディをその間にスイープし、水平から約20°と37°の角度を設定します。
- セメンチング構造の近くのテールにネジ付きのM1.6穴を追加します。
- テールの端にスケッチを作成し、ダブテールプロファイルを描画します。
- このプロファイルを8 mm押し出します。
- 対物レンズとの非干渉の検証。
- 観察窓やダブテールを含むインプラント全体の設計を調べて、顕微鏡の対物レンズに機械的な干渉がないことを確認します。手順1.3.3で作成したボリュームとの干渉がないか確認してください。
注意: この検証手順は、障害物なく必要に応じて対物レンズを配置および移動できるようにするために重要です。
- 観察窓やダブテールを含むインプラント全体の設計を調べて、顕微鏡の対物レンズに機械的な干渉がないことを確認します。手順1.3.3で作成したボリュームとの干渉がないか確認してください。
- インプラントの尻尾から不要な材料を取り除き、重量を最小限に抑え、動物の潜在的な不快感を軽減します。
- 中央分離平面にスケッチを作成し、その上に三角形の切り欠きを描画して、テール ボディからの押し出しによって抽出されたときにトラス構造を形成します。
- 垂直面で繰り返します。
- 有限要素法(FEM)シミュレーションにより最大変位を検証し、さまざまな条件下でのインプラントの機械的特性を解析します。
注:このシミュレーションは、使用中のインプラント内の最大変位と応力を予測するのに役立ち、信頼性を確保します。- CAD ソフトウェア シミュレーション アドインを有効にします。
- シミュレーション(Simulation)ツールバーで、新しい静解析スタディを作成します。[シミュレーション]タブに移動するか(表示されている場合)、または[シミュレーション]|勉強。[スタディ]ダイアログ ボックスで、スタディ タイプとして[静解析]を選択します。[OK]をクリックして、新しいスタディを作成します(補足図S5)。
注:このスタディタイプは、インプラントの使用で予想されるように、静的荷重下での変形と応力の解析に適しています。 - 実際のインプラント組成(Ti6Al4V)に一致するインプラントの材料を選択してください。
- 固定拘束を定義して、インプラントがアリ溝固定に接触するインプラントの取り付け点をシミュレートします。 アリ溝の上面サーフェス を 固定として定義します。
- インプラントの 底面の垂直荷重 を定義します。 1Nの垂直方向の力を設定します。
- メッシュを生成します。高い応力または変形が予想される領域でメッシュを細分化します(補足図S6)。これを行うには、スタディツリーのメッシュ要素を右クリックし、[メッシュを作成]を選択します。[メッシュ]ダイアログ ボックスで、スライダを使用するか、[メッシュ コントロール]ボックスをアクティブにして、最大要素サイズと最小要素サイズを個別に設定して、[メッシュ密度]を調整します。[OK]をクリックしてメッシュを生成します。
注:ソフトウェアはスタディの初期メッシュを自動的に生成しますが、より正確な結果を得るために、特にインプラントの安定性にとって重要な領域(観察ウィンドウなど)では、メッシュを細分化してより細かいメッシュを選択することができます。これらの領域でのメッシュ作成が細かくなると、局所的な応力集中が捕捉されるため、シミュレーションの精度が向上します。 - 静解析を開始して、インプラント全体の変位、応力、およびひずみ分布を計算します。
- 結果を分析します。変位プロットを調べて、最大変形の領域を特定します。このプロットは、荷重が加えられた状態でインプラントがどれだけ変形するかを示し、過度の動きのリスクがある領域を強調しています。観察窓内の変形が3ミクロンを超えないようにしてください。
- 最後に、使用しないときは観察窓を保護するための保護カバーを設計します。この蓋は、露出した骨を環境汚染物質や物理的損傷から保護します。
2. マウス治療、麻酔、頭部インプラントの外科的移植
注:ここでは、図のように、オスまたはメス、7〜12週齢のC57BL/6またはトランスジェニックマウスを使用できます。BMの白血病コロニー形成を誘導するために、Hortonら12によって記載されているように、生成された白血病細胞を、イメージングの2〜3週間前に静脈内投与する。創傷の健康を保証するために、滅菌技術を使用する必要があります。
- ボンネットの下には、滅菌手術ツール(鈍いハサミとピンセット)、トリマー、およびアイジェル、生理食塩水、消毒剤、歯科用セメント、吸収性綿棒、洗浄組織などの消耗品を組み立てます。ビーズ滅菌器の電源を入れます。
- 麻酔導入チャンバーに4%イソフルランと大気酸素を入れ、マウスをチャンバーに入れます。動物が完全に麻酔をかけられたら(直立反射の喪失とより深くゆっくりとした呼吸パターンを確認してください)、イソフルランの流れを麻酔マスクの鼻円錐に切り替え、イソフルラン濃度を2%に下げます。
- マウスを37°Cの加熱パッドに置き、呼吸数を視覚的に監視します。オプション:病理学的表現型のマウスの場合は、麻酔中を通して正しい温度を維持するためにサバイバルブランケットを追加します。
- 手術の30分前に鎮痛剤を皮下投与します(Buprecare、0.01 mg / kg)。
- 電気カミソリでネズミの頭を剃ります。
- 麻酔下での乾燥を防ぐために、マウスの目に眼科用ジェルを一滴加え、ジェルが頭皮に滴り落ちないようにします。
- マウスを清掃して、手術部位に残っている毛を取り除きます。頭皮の上部を綿ティッシュに消毒剤で拭きます。画像のアーチファクトや創傷感染のリスクを避けるために、必ずすべての髪の毛を取り除いてください。
- 滅菌鉗子とハサミ(滅菌器で30秒後)を使用して、頭皮の中央部分に小さな切開を行い、中央の骨の傷跡を露出させます。それに従って、正しい長さと幅のイメージング領域を定義します。頭皮の一部を慎重に取り除き、鉗子を使用して耳の間の皮膚を持ち上げ、後頭部に小さな切開を行います。皮膚を持ち上げ、はさみを皮膚の下に通し、イメージング領域の外側を慎重に切り取ります。
- 頭蓋骨と頭皮の間の結合組織を取り除きます。露出した骨を綿棒で滅菌PBSで拭きます。頭蓋骨の長時間の曝露を避けるために、マウスの頭蓋骨への頭部インプラントの取り付けに迅速に進みます(<10分)。
- メーカーの指示に従って、ペトリ皿に十分な歯科用セメントを含むペーストを作成し、頭固定インプラントの底にすばやく塗布します。
- イメージング領域内に歯科用セメントを入れずに、ヘッドホルダーをマウスの露出した頭蓋骨に置き、固まるのを待ちます。
- 固めたら(通常は3〜5分以内)、イメージングチャンバーに37°CのPBSを数滴加えて、頭蓋骨の水分を保ちます。
3. 2光子顕微鏡によるイメージング
- 手術を開始する前に、レーザーのスイッチを入れ、安定するまでウォームアップします。顕微鏡のスイッチを入れ、取得ソフトウェアを起動します。適切な対物レンズ(この実験では25x/0.95 WATER浸漬)を選択します。
- ヒートパッド付きの獣医用ブレッドボードを置くのに十分なスペースがある固定ステージ直立顕微鏡スタンドを使用し、すべてxyステージと一体的に移動させます。頑丈なアルミニウム製の光学ブレッドボードをプラットフォームとして使用して、頭部インプラントと脳定位固定マスクを固定します。イソフルランの注入と抽出に関連するフレキシブルホースとそのコネクターを顕微鏡ケージ内のマスクにリンクします。
- 高速スキャンのための画像取り込み設定の構成: フォーマット512 x 512ピクセル、速度600 Hz; ズーム 係数 1。
- レーザーラインを880nmに調整して、同じ励起波長でSHG、GFP、およびtdTOMATOを検出できるようにします。
- NDD検出器を作動させ、スペクトル検出ゲートを定義する前に、部屋の照明を消し、顕微鏡スタンドの周りのボックスを適切に閉じてください:PMT1、SHG [388 - 431 nm]を検出します。GFP [485 - 548 nm] 用の HyD2 と tdTOMTO 用の HyD3 [551 - 645 nm]。オフセットは 0 のままにします。
- 新しいプロジェクト データセットを作成し、特定の実験に従って名前を変更します。
- 頭部固定インプラントがマウスの頭蓋骨に取り付けられたら(セメント硬化によって確認)、イソフルランを顕微鏡の定位固定マスクに向けてスイッチを入れます。
- マウスを顕微鏡にすばやく持って行きます。マウスの歯をマスクに慎重に挿入し、片手で鼻を持ち上げてマウスの鼻にイソフルランが浸透できるようにします。
- 片手でマウスを持ちながら、もう一方の手で頭部固定インプラントのダブテールを固定ホルダーにそっと滑り込ませ、ネジノブを半回転させて固定します。
- 温度モニタリング用の水性ゲルがあらかじめ埋め込まれた直腸プローブを導入し、マウスの眼に点眼薬を追加します。
- ヘッドイメージングチャンバーに大量の水性ゲルまたはPBSを充填し、水浸対物レンズを下げて完全に浸漬すると、最適な励起が得られ、2光子励起によって生成される信号が検出されます。
- x-yステージとzドライブを動かして、中心の骨を足場の傷跡に焦点を合わせます。
注:顕微鏡の接眼レンズとメタルハライドタイプのランプを光源として使用し、トライバンド励起発光フィルターでフィルタリングすると便利です。光学セクショニングがないため、鮮明な画像を取得することが不可能になります。しかし、練習を重ねれば、頭蓋骨の中央部は簡単に認識できるようになります。 - 骨表面と中心静脈でマークされた組織を特定したら、メタルハライドランプをオフにし、顕微鏡ケージの窓を閉じてHyD検出器を保護し、赤外線(IR)レーザーを通過させます。
- PMT/SHGゲインを850V(線形動作範囲)に設定し、HyDゲインを100%に設定します。3 つのチャネルのうち最も低いチャネルで 200 グレー レベルのダイナミック レンジ (8 ビット検出器は動的) の画像が得られるまで、IR レーザー出力を上げます。放射差が重要すぎる場合、または飽和がある場合は、「アンダーローワー」ルックアップテーブル(LUT)モードを使用して、他の検出器のゲインを下げます。
注:私たちの場合、30%のレーザー出力ですべてのチャネルでコントラストを得るのに十分でした。 - 取得ソフトウェアで、骨表面(SHG)にBMポケット(GFP+、tdTOMATO+)を包み込んだ領域を検索します。
- さまざまな ROI を見つけるには、 LAS NAVIGATOR をアクティブにし、 スパイラル モードを使用して領域全体の概要を作成します。取得したサーフェスが十分に大きい場合は、取得を停止します。概要を保存し、マージして名前を変更します:これは縦方向のイメージングの場合の参照画像になります。
注意: スパイラルが大きすぎると、デバイスホルダーが対物レンズに接触する可能性があるため、注意してください。 - 1つの画像アイコンをクリックして一部のROIポジションを記録し、タスクリストの各ポジションの名前を変更します。画面キャプチャを取得して、以前に保存した概要にさまざまなROIの相対位置を重ね合わせます。
注:このスクリーンキャプチャは、この実験に使用したバージョンでは、取得ソフトウェアがこの位置のグループを呼び出すことを許可していないため、縦方向イメージングのROIを置き換えるために不可欠です。 - zスタックボリュームを取得するには、 zスタックモードを選択し、 ステップサイズ を 3μmで定義し、 すべての領域に同じスタックサイズ オプションの選択を解除します。 最初の位置を選択し、 上部 と 下部 の位置を定義し、zステップサイズを確認して、 スタックの再定義をクリックします。立方体アイコンは、ポジション リストのポジション名の横に表示されます。この手順を、異なる ROI のすべての位置に対して繰り返します。
- [取得] を押して、画像 (~50 プランの 3 チャネル z スタック) を適切なフォルダーに保存します。このステップは、実験の Tctrl をマークします。集録パラメータが正しいことを確認します(3つのチャンネルで正しいダイナミックレンジを取得し、信号の飽和を可能な限り回避し、完全なサイクルの集録時間を確認します)。
- 動的特徴(この場合は血管透過性)を測定するには、タイムラプスを取得します。
- このセットアップでは、3つの検出器により、3つのチャンネルを同時にイメージングできます。実験に4番目のチャンネル(この場合はデキストランモニタリング)が必要な場合は、 シーケンシャルモード をアクティブにして、2番目の取得シーケンスを追加します。IRレーザーラインを 820 nm に調整して、DextranCy5蛍光色素を励起できるようにします。 Hyd2 の検出範囲を[650 - 744 nm]に変更し、他の検出器を非アクティブにします。スタック取得モード から 選択します。
注:デフォルトでは、2番目の取得シーケンスのパラメータはシーケンス1と同じです。 - タイムラプスを開始する前に、すべての位置の取得を開始して、記録時間がデキストラン漏れを検出するために必要な最小時間である3分を超えないようにします(シーケンシャルモードの追加を考慮に入れて)。
- デキストラン注入の前に、 アクイジションモード を xyztに変更します。 t モジュールで、 時間間隔 を 3 分 に、 期間 を 1 時間に調整します。
- このセットアップでは、3つの検出器により、3つのチャンネルを同時にイメージングできます。実験に4番目のチャンネル(この場合はデキストランモニタリング)が必要な場合は、 シーケンシャルモード をアクティブにして、2番目の取得シーケンスを追加します。IRレーザーラインを 820 nm に調整して、DextranCy5蛍光色素を励起できるようにします。 Hyd2 の検出範囲を[650 - 744 nm]に変更し、他の検出器を非アクティブにします。スタック取得モード から 選択します。
- 100 μL の Dextran 70 KDa-TRITC (または 500 KDa-Cy5) を 3 mg/マウスに静脈内注入し、取得を開始します。
- 取得後、データセットを適切なフォルダに保存します。
注意: これらの多数のステップでは、マウスの呼吸周波数と温度を頻繁に監視し、必要に応じてイソフルランの流れを調整します。理想的には、体温、ECG、呼吸数を記録し、実験のメタデータとして含めることができます。
4.マウスの回復
- イメージングセッションが完了したら、取得ソフトウェア内でHyDs検出器を非アクティブにし、マウス加熱ボックス(37°C)をオンにします。顕微鏡ケージを開き、対物レンズを持ち上げ、直腸プローブをマウスから取り外します。次に、頭部固定インプラントのアリ溝を固定ホルダーからそっと滑り込ませ、マウスを顕微鏡の定位固定マスクからヒートパッド上の手術用マスクに移動します。
- 顕微鏡下でイソフルラン注射のスイッチを切り、ヒートパッドのスイッチを切ります。.
- 滅菌綿棒でマウスの頭蓋骨から水性ゲルまたはPBSを静かに取り除きます。
- 前に説明したように、イメージングセッション間で頭蓋骨の水分を維持するために、サイト内ゲルを添加する13。
- 頭部インプラントのイメージング領域を特定のカバーで閉じ、ネジで慎重に固定します。
- マウスを37°Cの加熱ボックスに入れ、目が覚めるまで待ちます。マウスを動物施設に連れて行き、ヒドロゲルと濃縮物が入った清潔なケージに収容します。痛みや感染の兆候を見つけるために毎日動物を監視し、その場合は毎日Buprecareを投与してください。カルバリアル湿度を保つために、サイト内ゲルを週に2回交換します。
注:段ボール製のシェルターとネスティングマテリアルを備えた高いケージを選択し、マウスを個々のケージに入れるようにしてください。
5. 縦断的買収
注:マウスは、次の日に再度画像化できます。ただし、目の乾燥や過度の疲労、呼吸困難や低体温症など、麻酔を繰り返すことによる望ましくない影響を避けるために、週に3回以上のイメージングセッションを繰り返さないように注意してください。
- ヘッドホルダーがすでに取り付けられているマウスを再イメージ化するには、手順2.2に従い、マウスの目に眼科用ゲルを少量垂らして、処置中の乾燥を防ぎます。
- セクション 3 からステップ 3.16 までを進み、オーバーview イメージを取得します。
注:ホルダーの位置の高さや角度を変更せずにヘッドチタンインプラントを使用すると、関心のある全体的な領域を非常に簡単に見つけることができます。 - 必要に応じて、 開いている画像 と 位置合わせモジュールを使用して、以前の画像と新しい画像を再位置合わせします。
- 手順3.17の画面キャプチャ画像を開いて、元の場所に位置をマークします。
注:SHG造影剤の使用は、特にGFPを発現する血管および関連細胞のリモデリングを期待する場合に非常に有用です。 - zスタックとタイムラプスは、手順3.18-3.22で説明したのと同じ方法で取得します。
6. 血管パラメータの定量化
- 血管パラメータ
- ソフトウェアで生成した画像(.lifファイル)をIMARISで開くには、まずファイルコンバーターで「.ims」形式に変換します。IMARISで「.ims」ファイルを開き、メタデータ(X、Y、Zスケール)を確認して、 Filament モジュールを選択します。 [自動作成をスキップし、手動で編集する]を選択します。
- フィラメント生成中の視覚化を向上させるには、[設定](リーフシンボル)に移動し、[スタイル]で[ライン]を選択し、ピクセル数はデフォルト値(1)のままにします。[始点]、[分岐点]、[終点]を含む[樹状突起を表示]チェックボックスをオンにします。[背表紙を表示]のチェックを外します。
- [draw (brush symbol)]で、[Method AutoPath]を選択し、直径として5 μm、および血管に関連付けられたチャネルソース(この場合はTRITC-Dextran)を選択します。最後に、自動中心と自動直径rにチェックマークを付けます。
- フィラメントの描画を開始するには 、Shift + マウスの右クリック を使用して分岐の 始点 を選択し、 Shift + 左クリック で分岐 の終点 を選択します。
注: 始点は水色、分岐点は赤または紺色、終点は緑です。 - 描画中にフィラメントの適切な直径を設定するには、マウスのスクロールボタンを使用します。
- 2 つのフィラメントを異なる終端点で結合するには、それらの間に新しい開始点を作成し、各終了点で接続します。
注:したがって、緑色の終端ポイントは分岐ポイントに表示されます。 - 血管ツリーが作成されたら、 設定 に戻り、開始点、分岐点、および終了点の数が正しいことを確認します。 円錐 を選択して直径を視覚化し、その外観を確認します。
- フィラメントの直径(または接続)が正しくないと思われる場合は、[ 編集 ](鉛筆記号)に移動し、削除するフィラメントを右クリックして、[ 削除]をクリックします。マウスのスクロールボタンでフィラメントの直径を調整して、フィラメントを再描画します。
- 生成されたすべての統計データを抽出して保存するには、[ 統計 ] アイコン | [すべての統計をファイルにエクスポート] をクリックします (画面下部の複数のフロッピー ディスク アイコン)。
注:血管に対応していない可能性のある異常フィラメントを避けるために、20μmを超えるフィラメントのみを統計分析に含めました。
- リーキーネスの定量化
注:ソフトウェアで生成した画像(.lifファイル)をIMARISで開くには、まずファイルコンバーターで「.ims」形式に変換してください。- デキストラン注入前とデキストラン注入後に撮影した画像を同じ時系列で結合するには、 Surpassモードに移動し、最初の画像(Tctrl 、デキストラン注入前)とタイムラプス画像(時間1、60分)の両方をクリックして開き、 編集 をクリックして タイムポイントを追加して結合します。
注:最終的な3Dドリフトを修正するには、フィジーとIMARIS間のブリッジ機能を使用して手順6.2.2〜6.2.7を実行します。フィジーに次のプラグインをインストールします:「IMARIS_Bridge96.jar」と「IMARISBridgeUtils.jar」。3Dドリフトの登録は、「StackReg Pluging」(フィジーですでに利用可能)を使用して実行されます。不要な場合は、手順 6.2.8 に進みます - 3Dドリフト補正を行うには、フィジーを開き、IMARISからの画像をブリッジするために、 Plugins |イマリス |画像:IMARISより。
- フィジーでは、 プラグイン |参加登録 |3Dドリフトを修正します。
- 表示される新しいウィンドウで、 登録に適したチャネルを選択します。
注:この場合はNestin-GFPでしたが、動かないオブジェクトや高い信号対背景比を強調する任意のチャネルである可能性があります。 - 小さなドリフトの検出を強化するには、[ マルチタイム スケール計算]、[サブ ピクセル ドリフト補正]、 および [エッジ イメージの強調] を選択し、他の設定はデフォルトのままにします。
- 修正した画像をIMARISにブリッジするには、画像を選択して[プラグイン]をクリックします|イマリス |画像はIMARISに。
- 適切なフォルダに保存するには、[ ファイル] |名前を付けて保存。
- 取得したすべてのチャネルを視覚化するには、[ 編集] |表示調整を表示します。 dextran チャネル と 時間 1 (画面下部のフレーム 2 ) を選択します。
- 新しいサーフェスを追加チェックボックス(青色のオブジェクト)をオンにして、時間点 1 の血管内腔を定義する新しいサーフェスを作成します
- Surface 1 で [プロパティ] に移動し、[アルゴリズム設定] のすべてのパラメーターのチェックを外します。次のステップ(青い矢印)をクリックします
- ソースチャネルの下の血管チャネル(この場合はデキストラン)を選択し、[スムーズとバックグラウンドの減算]にチェックマークを付けます。他のすべてのパラメータはデフォルト値のままにします。次のステップ(青い矢印)をクリックします。
- [しきい値]の値を、すべての正の領域の厚さとカバレッジの観点から、表面の外観に応じて調整します。次のステップ(青い矢印)をクリックします。
- 非特定のサーフェス(主に小さなドット)を除外するには、デフォルトで ボクセルの数(Number of Voxels)というフィルタを使用します。 最後のステップ (緑の矢印)をクリックします。
- 必要に応じて、パラメータの設定の編集(鉛筆アイコン)をクリックして、手動でサーフェスの調整を続けます。削除するオブジェクトを選択するには、オブジェクトを左クリックし、[削除]を選択して削除します。削除するオブジェクトが別のオブジェクトに照合されている場合は、サーフェスの 2 つの分離された部分の間を Shift + 左にクリックし、[サーフェスをカット](Cut Surface)を選択して、サーフェスの 2 つの分離された部分を切断します。この手順を必要な回数だけ繰り返します。
- 最後に、 選択モード (右側のターゲットアイコン)を使用してすべてのセグメントを結合し、 Control +スクロール を押してすべてのオブジェクトを回復します。すべてを選択したら、左クリックして [統合] をクリックします。
- 参照サーフェスを生成するには、このサーフェスを他のタイムポイントにコピーします。グローバルサーフェスを選択し、[ Duplicate ]をクリックして複製し、名前を 「Intravascular」に変更します。
- 表面の 血管内 を選択し、[ すべてのタイムポイントに複製]をクリックします。
- デキストラン信号を分割して、血管内(IN)領域と血管外(OUT)領域を区別します。.すべての時点の IN チャンネルを作成するには、表面の 血管内|編集 (鉛筆ボタン) |すべてをマスクします。
- [チャンネル選択]で、適切なチャンネルを選択し、マスクを適用する前に重複するチャンネルにチェックマークを付けます。[Mask Settings] で、[Constant inside/outside] のみにチェックを入れ、ボクセルの外側サーフェスを 0 に設定します。最後に、チェックマークも すべての時点に適用します。
- Display Adjustment(ディスプレイ調整)では、デフォルトで新しいチャンネルが作成され、名前がマスクされます。名前を IN に変更します。
- すべてのタイム ポイントのチャネル OUT を作成するには、手順 6.2.18 から 6.2.20 を繰り返しますが、[ サーフェス内のボクセルを 0 に設定] を選択します。この新しいチャンネルの名前を OUTに変更します。
- 統計データを抽出するには、 統計アイコン |すべての統計をファイルにエクスポート (画面下部の複数のフロッピー ディスク アイコン)
- 漏れを解析するには、各時点の 強度合計チャネルの外側 を内部の 強度合計チャネル で除算します。
- デキストラン注入前とデキストラン注入後に撮影した画像を同じ時系列で結合するには、 Surpassモードに移動し、最初の画像(Tctrl 、デキストラン注入前)とタイムラプス画像(時間1、60分)の両方をクリックして開き、 編集 をクリックして タイムポイントを追加して結合します。
結果
図1と図2では、スキャンしたマウスの頭蓋骨にチタン製の頭部固定インプラントを配置したCADモデルが示されており、これは頭蓋骨の解剖学的構造に追従し、顕微鏡ステージにしっかりと保持できる軽量で生体適合性のあるデバイスを提供し、細胞レベルの安定性を確保しています。この段階的なプロトコルに従うことにより、インプラントはマウスの頭蓋骨に安定して取り付けられ、そのダブテールによって顕微鏡ホルダーにしっかりと固定できるため、液体の保持と経時的な生体内観察のためのフラットなイメージング領域が可能になります。カバーで閉じることで、傷口の損傷や感染を最小限に抑えることができ、同じ組織領域を数週間にわたって繰り返しイメージングすることができます。一度目を覚ますと、頭部インプラントを装着したマウスは自由に歩き回り、餌をやったり、定期的なルーチンを持つことができます。
図3は、細動脈、遷移毛細血管、正弦波などの不均一な毛細血管で作られた頭蓋骨BM血管系のタイルスキャンビューを示しています。血管は、骨表面および血管周囲間葉系細胞と密接に接触した複雑な組織微小環境に埋め込まれます。白血病の発症時には、BM微小環境内で血管に近接した単一の単離白血病細胞が検出され、その生着が時間とともに増加し、疾患の後期に頭蓋骨が満たされます。
図4は、このプロトコルで取得した画像が定量的データを提供し、統計的手法で分析できる方法を示しています。IMARISフィラメントツールを使用して血管をセグメント化し、血管断片の長さと直径、およびそれらの真直度を測定する方法を示します。これらのパラメータの相関も評価できます。
図5は、4日目、7日目、10日目のAML進行中の頭蓋骨BMの2つの異なる位置の縦断的イメージング取得を示しており、10日目は、フローサイトメトリー(図示せず)を介して測定されたBMの白血病細胞への~50%の生着と関連しています。既存の血管のサイズの重要なリモデリングと、局所的な骨量減少に関連する特定の領域での新しい血管の形成を観察できます。
最後に、 図6では、さまざまな血管バリアが蛍光色素を長期にわたって保持する能力を示すタイムラプスイメージングを使用して、血管透過性を動的パラメータとして測定する方法を示します。

図1:チタンベースの生体適合性ヘッドホルダーの設計と製造。 (A)インプラントのその 場の部品:観察リング1個、セメンチング機能2個、安定化アンカー3個、テール4個、ダブテール5個、ネジ穴6個、ブレグマ7個。(B)ヘッドインプラントのホルダーへの接続:8固定本体、9クランプ、10偏心レバー、11構造、12顕微鏡対物レンズ。(C)最大変位が0.04Nの力に対して0.23μmのFEMシミュレーションによる荷重に対するインプラントの変形。(D)保護カバーとそのネジ。 この図の拡大版を表示するには、ここをクリックしてください。

図2:生体内イメージングのためのマウスの準備(A)頭部インプラントとイメージング前に外科的に露出したイメージング領域の図。(B)マウスの頭蓋骨にしっかりと取り付けられた頭部インプラント。(C)ヘッドインプラントの閉じたカバーで回復ケージ内でマウスを目覚めさせています。この図の拡大版を表示するには、ここをクリックしてください。
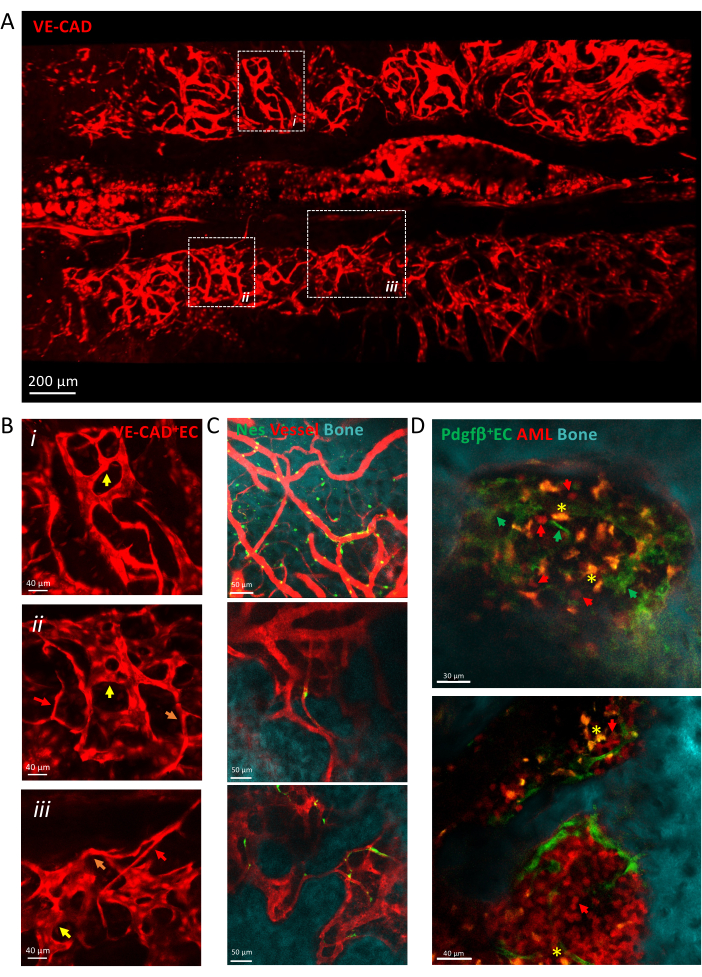
図3:心房細血管系の生体内イメージング (A)cdh5-DSREDで標識された心房細血管のタイルスキャンビューのz投影。(B)描かれた領域を拡大して、矢印で描かれたさまざまな種類の血管、赤い矢印で細動脈、オレンジ色の矢印で移行毛細血管、黄色の矢印で正弦波を説明します。(i)および(ii)Xμm組織のz投影。(iii)シングルスライス。(C)骨表面(SHG)、血管周囲細胞(nes-GFP+)、血管内腔(デキストラン-TRITC)を示す、BM血管のいくつかの視野の単一のスライス。(D)AMLの進行に関連する血管ニッチ。AML開発の初期(上)と後期(下)の時点の代表的なスライス。MLL-AF9白血病はtdTOMATOで標識(赤矢印)、血管はpdgfb-GFP(緑の矢印)、骨表面はSHG、マクロファージは黄色(自家蛍光、黄色のアスタリスク)で標識されています。スケールバー = 200 μm (A)、40 μm (B、D-下部パネル)、50 μm (C)。略語:BM =骨髄;GFP = 緑色蛍光タンパク質;AML = 急性骨髄性白血病;EC=内皮細胞。この図の拡大版を表示するには、ここをクリックしてください。

図4:血管パラメータの定量化 (A)TRITC-デキストランで標識された骨髄血管の代表的なz投影におけるIMARIS フィラメントツール による血管パラメータの測定。線と円錐の表現が表示されます。(B) Aに示す画像内の血管パラメータの定量化。(C)血管の真直度と長さとの間に反対の相関を示す血管パラメータ間の相関(負、Spearman r = -3523; p < 0.0001;R2 = 0.2102) 対 直径 (正;スピアマンr = 0.4110;p < 0.0001;R2 = 0.1299)。スケールバー = 100 μm。 この図の拡大版を表示するには、ここをクリックしてください。
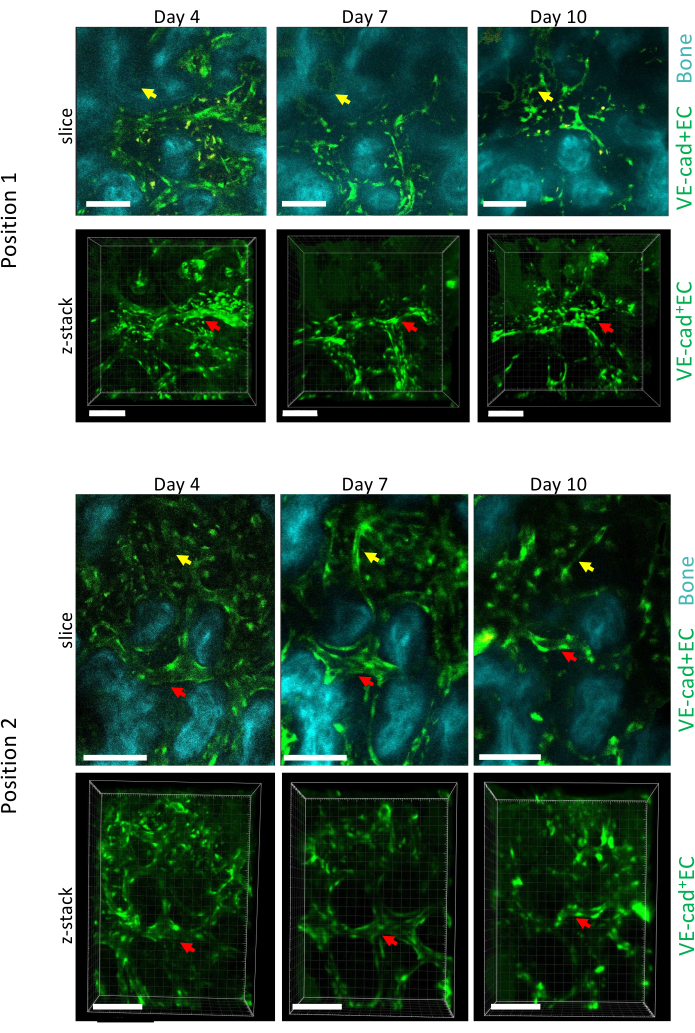
図5:AML発生上のcalvaria BMの2つの異なる位置の縦断的イメージング。 血管の内側を覆う内皮細胞は cdh5-GFP、骨表面はSHG、マクロファージは黄色(自家蛍光)で標識されています。既存の船の改造(赤い矢印)と新しい船の編成(黄色の矢印)を示しています。スケールバー = 100 μm。 この図の拡大版を表示するには、ここをクリックしてください。
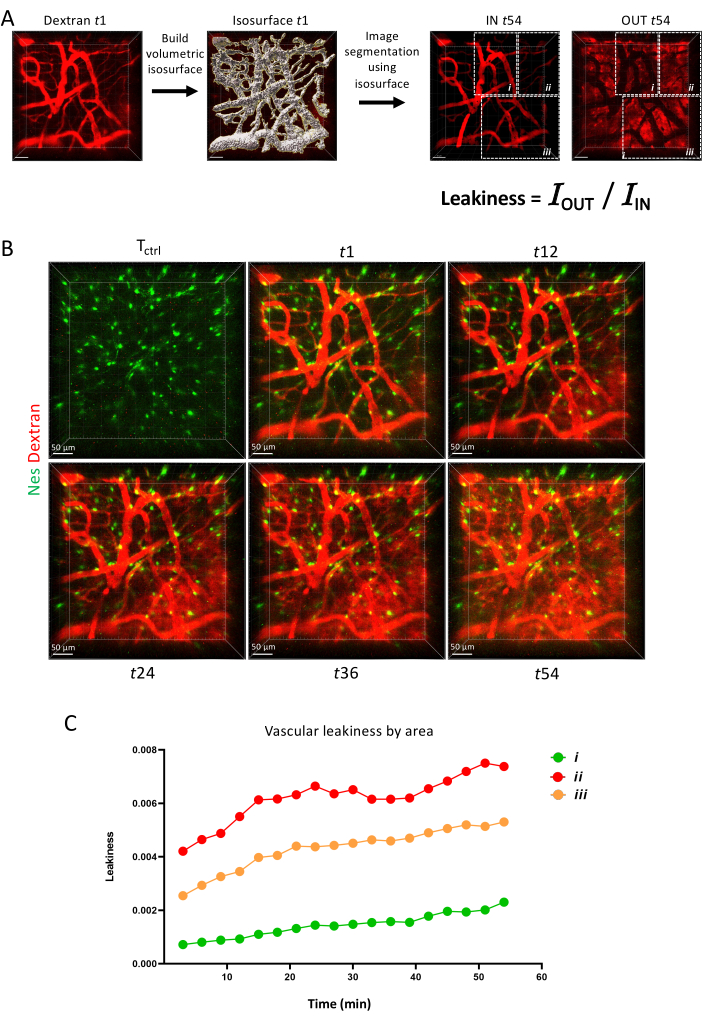
図6:血管透過性 (A) IMARIS 表面ツール による血管透過性測定の概略図 (B) 1時間にわたって縦方向に画像化された同じ領域のZ投影 (C) Aに示されている領域内の血管透過性の定量化。 この図の拡大版を表示するには、ここをクリックしてください。
補足図S1:準備された頭蓋骨。 中央平面で、頭蓋骨に接する軸を作成し、準備した頭蓋骨を保存します。 このファイルをダウンロードするには、ここをクリックしてください。
補足図S2:平面図2mm間隔。 頭蓋骨を横切る等間隔の平面(2 mm間隔)のセットを作成する方法。 このファイルをダウンロードするには、ここをクリックしてください。
補足図S3:観測可能な表面の輪郭。 カルバリア平面にスケッチを作成し、AP 0.0 で AP +6.5 から -2、幅 6 mm の洋ナシ形のスプラインを作成します。 このファイルをダウンロードするには、ここをクリックしてください。
補足図S4:観察ヴィンドウ。 カルバリア平面にスケッチを作成し、 観測 ウィンドウに接続する厚さ0.5mmのC字型を描きます。 このファイルをダウンロードするには、ここをクリックしてください。
補足図S5:[新しいスタディ]をクリックします。 [シミュレーション]タブに移動するか(表示されている場合)、または[シミュレーション]|勉強。[スタディ]ダイアログ ボックスで、スタディ タイプとして[静解析]を選択します。[OK]をクリックして、新しいスタディを作成します。このファイルをダウンロードするには、ここをクリックしてください。
補足図S6:右クリックしてメッシュを作成します。 高い応力や変形が予想される領域でメッシュを細分化します。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
生体内顕微鏡法の主な強みは、従来の組織学的およびex vivoイメージング法の限界を克服し、本来の環境内で動的な細胞プロセスをリアルタイムに捉える能力です。このプロトコルに記載されているように、蛍光標識と組み合わせた高度なイメージング技術を使用して頭蓋骨BMを直接観察することにより、研究者は血管機能パラメータ8,14だけでなく、白血病細胞の生着と移動6,15、増殖、および代謝活性16,17などの縦断的プロセスも研究できる生理学的な関連性を維持し、組織の固定と処理に関連するアーティファクトを回避します。
BM calvaria生体内イメージングは、他の骨部位に比べて、アクセスのしやすさ、骨の損傷なしに頭蓋骨の透明性により可視化が容易であること、カルバリウム骨の安定性、組織運動アーチファクトの最小化、実験動物間での再現性などが挙げられます。動物を回収し、縦方向のイメージングを行うことができるため、研究に使用する動物の数を減らすこともできます。頭蓋骨血管の成長パターンとその結果としての骨形成における株特異的な違いが観察されているため18、完全な解剖学的適合性と所望のイメージング部位へのアクセスを可能にするために、所望のマウス系統の特異的イメージングインプラントを設計する際には、このことを考慮に入れることが重要であることに言及する価値がある。
言及すべきもう一つの重要な点は、他の骨と比較して、頭蓋骨内の血管および造血特性の潜在的な違いであり、近年までほとんど探求されていなかった問題です。新しい研究は、異なる骨の局所的な機能を示唆しており、頭蓋骨BMは、造血、骨および血管の構造と機能19、20、21、22、23、および神経学的病理学への応答24の点で他の骨とは異なります。これらの違いは、特定のカルバリア所見を一般化する前に、さらに調査し、考慮に入れる必要があります。
イメージングインプラントの設計と構築は、材料の選択から始まるこの実験セットアップの重要なステップです。生体適合性インプラントは、生物医学研究において極めて重要な役割を果たしており、組織工学や再生医療から薬物送達システムや in vivo モニタリングデバイスに至るまで、幅広いアプリケーションを促進します。生体内イメージングに適した頭部インプラントの材料の選択は非常に重要です。理想的には、材料は優れた生体適合性、最小限の柔軟性と全体的な安定性を確保するのに適した機械的特性、そして最後に、炎症を誘発することなく頭蓋骨内に統合する能力を示す必要があります。チタンは、生体組織と接触して副作用を誘発することなく、動物の体内での良好な忍容性、および耐腐食性にとって理想的であり、体液や実験溶液にさらされても長期的な安定性を確保します。さらに、その機械的強度により、変形や破壊に強いです。チタンは強度が高いにもかかわらず、密度が比較的低いため、実験動物や研究者の負担を最小限に抑える軽量な生体内イメージングデバイスとなっています。最後に、その製造における汎用性により、サイズ、形状、機能などの特定の実験要件に合わせて生体内イメージングデバイスをカスタマイズできます。
ここでは、有限要素解析(FEA)機能が組み込まれたパラメトリックモデリングCADソフトウェア、特にSolidWorksを使用して、生体適合性のある頭部固定インプラントを設計しました。このアプローチにより、インプラントの構造的および空間的要件に対して正確かつ反復的な調整が可能になり、解剖学的適合性と機械的弾力性の両方が確保されます。FreeCADなどの無料の代替手段は、同様のモデリングおよびシミュレーション機能を提供します。設計プロセスの主な入力には、マウスの頭蓋骨の高解像度解剖学的モデル、顕微鏡対物レンズのモデル、固定システムのモデルが含まれ、これらが一緒になってインプラントの寸法と構成を通知します。最終的な出力は、プラットフォームに依存しないメッシュファイルで、通常はSTLまたはSTEP形式で、ほとんどの3Dプリントソフトウェアと互換性があります。
最初のステップでは、 in vivo マイクロCTスキャンなどの高解像度イメージング技術を使用して、マウスの頭部の詳細な解剖学的特徴をキャプチャします。このアプローチは、最高の解剖学的詳細と精度を提供し、頭蓋骨の微細構造を捉えます。準備された裸の頭蓋骨の3Dスキャンもオプションになる可能性があります。レーザースキャナーまたはストラクチャードライトスキャナーを使用するこの方法は、準備された頭蓋骨に一般的に採用され、マイクロCTと比較して内部の詳細が少なく、正確な表面輪郭を提供します。それ以外の場合、解剖学モデルは、オープンソースの出版物およびデータベース25 またはDigiMorph{https://www.digimorph.org/specimens/Mus_musculus/}からダウンロードすることができる。これらのモデルは便利ですが、標本固有の詳細が欠けている可能性があるため、実際のBregma-Lambda距離へのスケーリングなど、研究対象の特定の動物に対して調整が必要になることがよくあります。取得したデータは、マウスの頭蓋骨の正確な3Dモデルを作成するために使用され、インプラント設計の基本的なテンプレートとして機能します。
インプラントを頭蓋骨に固定するために、観察窓が占めていない残りの頭蓋骨表面を覆うようにセメンチング構造が設計されています。この構造は、重要な解剖学的特徴を回避しながら、堅牢な取り付けポイントを提供する必要があります。セメンチング構造には、拡散によるインプラント下のセメントの最適な重合を確保するために、複数の開口部があります。さらに、セメンチング構造の壁には小さなドラフト角度があり、これによりセメントはこれらの角度のある壁に対してしっかりと固定されます。インプラントの尾部は、本体から固定システムまで伸びるように設計されています。このコンポーネントは、観察中にインプラントを位置合わせして安定させるために重要であり、その設計では、マウスの頭の利用可能なスペースと解剖学的制約を考慮する必要があります。最後に、アリ溝機構がインプラント設計に統合されており、固定システムからインプラントを簡単に取り付けたり取り外したりできます。この機能により、繰り返し観察する際のインプラントの実用性と使いやすさが向上します。アリ溝機構により、再現性のある固定が可能で、観察された組織を簡単に取り出して、繰り返しのイメージングセッションを行うことができます。
calvarial BMの生体内顕微鏡イメージングの採用を検討している読者は、この方法が彼らの研究に適しているかどうかを判断するために、研究目標と実験要件を慎重に評価する必要があります。生体内顕微鏡は、造血、組織微小環境調節、 in vivoでの血管動態に関する比類のない洞察を提供しますが、特定の技術的課題と制限も提示します。研究者は、慎重な実験デザイン、イメージングパラメータの最適化、および適切な制御の利用を通じて、これらの課題に対処する準備をする必要があります。さらに、研究者は、特殊なイメージング機器の利用可能性、蛍光標識技術の専門知識、および画像分析のための計算リソースを検討する必要があります。全体として、頭蓋骨BMの生体内顕微鏡イメージングは、造血と血管生物学の理解を深める大きな可能性を秘めており、BM微小環境内で発生するダイナミックなプロセスへのユニークな窓を提供します。
開示事項
Jozsua Fodorは、YMETRY社の創設者です(登録番号888312352)。他の著者には利益相反はありません。
謝辞
筆者らは、Institut CochinのIMAG'ICおよび動物施設のスタッフ全員に対し、顕微鏡実験とマウス飼育のサポートに感謝します。Tg(Nes-EGFP)33EnikとTg(Pdgfb-icre/ERT2)1Frutマウスは、Dr. Bonnet(The Francis Crick Institute, London)からのご厚意により製作されました。Tg(Cdh5-cre/ERT2)1RhaおよびB6。Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze/Jマウスは、Rafii博士(Weill Cornell Medicine, New York)からのご厚意により製作されました。本研究は、CNRS、INSERM、パリ大学、ATIP-AVENIR、Fondation ARC pour la recherche sur le cancer(R19084KS - RSE20008KSA)、パリ市立大学「Emergence」(R20192KK - RPH20192KKA)、Laurette Fugain(R23197KK)、Cancéropôle IDF(RPH23177KKA)、INCA PLBIO(RPH21162KKA)、Fondation de France(RAF23152KKA)、Ligue contre le cancer(282273/807251)、Institut du cancer Paris Carpem、 欧州血液学会(RAK23130KKA)および欧州研究評議会ERC-STG(EEA24092KKA)。IMAG'ICの中核施設は、National Infrastructure France BioImaging(助成金ANR-10-INBS-04)の支援を受けています。Passaro研究室は、「Institut Hors Murs des Sciences Cardiovasculaires」および「Leukemia Institute Paris Saint-Louis」に所属しています。
資料
| Name | Company | Catalog Number | Comments |
| Amira | Thermo ScientificTM | ||
| Anesthesia | Isoflurane 2% to 3% | ||
| Anesthesic mask (animal detection) | Minerve | ||
| Anesthesic unit | Minerve | ||
| B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze | Jackson laboratories | MGI:3809523 | |
| CalvariaVue | Ymetry | https://ymetry.com/site/head-fixation-implants/44-mouse-head-fixation-implant-for-calvaria.html | |
| Dental cement | Kemdent | SUN527 | |
| Dextran 500 kDa-Cy5 | Tebu-bio | DX500-S5-1 | 3 mg/mouse |
| Dextran 70 kDa-TRITC | Sigma | T1162 | 3 mg/mouse |
| Disinfectant | MP-Labo | Dermidine-60ml | |
| Electric razor | Aescular | Isis | |
| Eye gel | Ocry-gel | 10g | |
| Fiji | https://imagej.net/software/fiji/downloads | v 17 May 30 | |
| Fiji plugings to bridge with Imaris | https://imagej.net/software/fiji/downloads | Imaris_Bridge96.jar ; ImarisBridgeUtils.jar | |
| Heating box | Datesand | Thermacage | |
| Heating pad for surgery | Minerve | ||
| Imaging heating pad & rectal probe | F. Haer | ||
| Imaris v9.6.0 | Oxford instruments | ||
| Intrasite gel | Chinoxia | 2390766 | |
| LAS AF Software | Leica | LAS X 3.5.7.23225 | |
| Medication | Buprecare, 0.01 mg/kg | ||
| Objective HCX IRAPO L 25x/0.95 WATER | Leica | 506374 | |
| Saline buffer (PBS 1x) | Sigma | P4417 | Sterilize by autoclave |
| SP8 DIVE FALCON Multiphoton Microscope | Leica | ||
| Stereotoxic mask | Minerve | 1201261 | |
| Sterilizator beads | Sigma | Z742555 | |
| Surgery tools | Moria | 4877A; 2183 | |
| Survival blanket | SECURIMED | 11006 | |
| Swabs / Tissues | Sterilize by autoclave | ||
| Syringe 1 mL 26 G | BD Plastipak | 305501 | |
| Temperature controller | F. Haer | 40-90-5D-02 | |
| Tg(Nes-EGFP)33Enik mice | Jackson laboratories | MGI:5523870 | |
| Tg(Pdgfb-icre/ERT2)1Frut mice | Jackson laboratories | MGI:3793852 | |
| Tg(Cdh5-cre/ERT2)1Rha mice | Jackson laboratories | MGI:3848982 | |
| Ultrasound gel | Parker laboratories | Aquasonic 100 |
参考文献
- Lo Celso, C., et al. Live-animal tracking of individual haematopoietic stem/progenitor cells in their niche. Nature. 457 (7225), 92-96 (2009).
- Pittet, M. J., Weissleder, R. Intravital imaging. Cell. 147 (5), 983-991 (2011).
- Itkin, T., et al. Distinct bone marrow blood vessels differentially regulate haematopoiesis. Nature. 532 (7599), 323-328 (2016).
- Christodoulou, C., et al. Live-animal imaging of native haematopoietic stem and progenitor cells. Nature. 578 (7794), 278-283 (2020).
- Upadhaya, S., et al. Intravital imaging reveals motility of adult hematopoietic stem cells in the bone marrow niche. Cell Stem Cell. 27 (2), 336-345.e4 (2020).
- Hawkins, E. D., et al. T-cell acute leukaemia exhibits dynamic interactions with bone marrow microenvironments. Nature. 538 (7626), 518-522 (2016).
- Duarte, D., et al. Defining the in vivo characteristics of acute myeloid leukemia cells behavior by intravital imaging. Immunol Cell Biol. 97 (2), 229-235 (2019).
- Passaro, D., et al. Increased vascular permeability in the bone marrow microenvironment contributes to disease progression and drug response in acute myeloid leukemia. Cancer Cell. 32 (3), 324-341.e6 (2017).
- Jia, Y., et al. FLT3 inhibitors upregulate CXCR4 and E-selectin ligands via ERK suppression in AML cells and CXCR4/E-selectin inhibition enhances anti-leukemia efficacy of FLT3-targeted therapy in AML. Leukemia. 37 (6), 1379-1383 (2023).
- Pendleton, E. G., Tehrani, K. F., Barrow, R. P., Mortensen, L. J. Second harmonic generation characterization of collagen in whole bone. Biomed Opt Express. 11 (8), 4379-4396 (2020).
- Ventalon, C., Bourdieu, L., Leger, J. F., Fodor, J. Dispositif de liaison d'un animal de laboratoire à au moins un système d'expérimentation, et procédé de fixation d'un tel dispositif. France patent. , (2021).
- Horton, S. J., et al. Acute myeloid leukemia induced by MLL-ENL is cured by oncogene ablation despite acquisition of complex genetic abnormalities. Blood. 113 (20), 4922-4929 (2009).
- Scott, M. K., Akinduro, O., Lo Celso, C. In vivo 4-dimensional tracking of hematopoietic stem and progenitor cells in adult mouse calvarial bone marrow. J Vis Exp. (91), e51683 (2014).
- Jung, Y., et al. Intravital imaging of mouse bone marrow: Hemodynamics and vascular permeability. Methods Mol Biol. 1763, 11-22 (2018).
- Le, V. H., et al. In vivo longitudinal visualization of bone marrow engraftment process in mouse calvaria using two-photon microscopy. Sci Rep. 7, 44097 (2017).
- Spencer, J. A., et al. Direct measurement of local oxygen concentration in the bone marrow of live animals. Nature. 508 (7495), 269-273 (2014).
- Yang, M., Mahanty, A., Jin, C., Wong, A. N. N., Yoo, J. S. Label-free metabolic imaging for sensitive and robust monitoring of anti-CD47 immunotherapy response in triple-negative breast cancer. J Immunother Cancer. 10 (9), e005199 (2022).
- Li, W., et al. Tracking strain-specific morphogenesis and angiogenesis of murine calvaria with large-scale optoacoustic and Ultrasound Microscopy. J Bone Miner Res. 37 (5), 1032-1043 (2022).
- Lassailly, F., Foster, K., Lopez-Onieva, L., Currie, E., Bonnet, D. Multimodal imaging reveals structural and functional heterogeneity in different bone marrow compartments: functional implications on hematopoietic stem cells. Blood. 122 (10), 1730-1740 (2013).
- Rindone, A. N., et al. Quantitative 3D imaging of the cranial microvascular environment at single-cell resolution. Nat Commun. 12 (1), 6219 (2021).
- Mills, W. A., Coburn, M. A., Eyo, U. B. The emergence of the calvarial hematopoietic niche in health and disease. Immunol Rev. 311 (1), 26-38 (2022).
- Bixel, M. G., et al. Angiogenesis is uncoupled from osteogenesis during calvarial bone regeneration. Nat Commun. 15 (1), 4575 (2024).
- Koh, B. I., et al. Adult skull bone marrow is an expanding and resilient haematopoietic reservoir. Nature. 636 (8041), 172-181 (2024).
- Kolabas, Z. I., et al. Distinct molecular profiles of skull bone marrow in health and neurological disorders. Cell. 186 (17), 3706-3725.e9 (2023).
- Rosenhain, S., et al. A preclinical micro-computed tomography database including 3D whole body organ segmentations. Sci Data. 5, 180294 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved