È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Eterogiunzione di ossidi metallici per attività fotocatalitiche
In questo articolo
Riepilogo
Lo sviluppo di un'eterogiunzione potenzia le attività fotocatalitiche della sintesi della combustione in soluzione, che è un processo efficiente in termini di tempo/energia. In questo protocollo sono state utilizzate tecniche avanzate di caratterizzazione analitica per valutare le caratteristiche dei materiali e i nanocompositi hanno dimostrato una migliore degradazione del colorante acido-arancio-8.
Abstract
C'è una significativa domanda globale di miglioramenti nelle tecniche di sintesi e nelle loro caratteristiche ottimali, soprattutto per applicazioni su scala industriale. La sintesi della combustione in soluzione basata su sol-gel (SG-SCS) è un metodo semplice per produrre materiali porosi ordinati. A questo proposito, la teoria degli acidi e delle basi duri e molli di Pearson aiuta a selezionare la reattività ospite-drogante per formare una corretta eterogiunzione.
La formazione di un'eterogiunzione modifica anche le proprietà essenziali dei materiali, migliorando la fotocatalisi attraverso il trasferimento di carica o attività sinergiche. Una temperatura di calcinazione di 500 °C è ideale per questo processo sulla base dei risultati della valutazione della stabilità tramite un'analisi del rapporto di termogravimetria differenziale (DTG).
Le dimensioni su scala nanometrica delle nanoparticelle (NP) e dei nanocompositi (NC) generati sono state convalidate utilizzando la diffrazione dei raggi X e la microscopia elettronica a trasmissione ad alta risoluzione (HRTEM). Inoltre, le micrografie al microscopio elettronico a scansione e le analisi BET hanno confermato la natura della porosità dei materiali. HRTEM, spettroscopia fotoelettronica a raggi X e indagini a raggi X a dispersione di energia hanno stabilito la composizione dei materiali. Lo studio ha rilevato che le NC degradano il colore arancione acido 8 (AO8) in modo più efficiente rispetto allo ZnO nudo.
Introduzione
La protezione dell'ambiente è diventata una delle principali preoccupazioni con la rapida ascesa delle aziende in tutto il mondo. Di conseguenza, i nanomateriali (NM) basati sulla nanotecnologia e la loro sintesi hanno attirato l'attenzione dei ricercatori sui materiali sfusi nel mondo scientifico moderno1. Diversi approcci fisico-chimici sono stati adattati per trattare i contaminanti organici e inorganici 2,3. A questo proposito, grazie alla sua semplicità e capacità di sciogliere le tossine senza creare contaminazione secondaria, la fotocatalisi eterogenea è considerata una tecnica di bonifica adattativa4. Gli studi hanno progettato un'eterogiunzione o drogaggio tra semiconduttori a banda proibita adatti, che aiuta a ridurre la ricombinazione elettrone-lacuna, l'area superficiale e il volume del costituente. Questa condizione ha successivamente aumentato la degradazione fotocatalitica dei coloranti 5,6,7. Lavori recenti hanno anche riportato un ruolo sinergico e di miglioramento del trasferimento di caricabatterie attraverso eterogiunzioni/ibridi 8,9, e gli ossidi metallici semiconduttori dimostrano proprietà fisiche e chimiche uniche per applicazioni multifunzionali10. Di conseguenza, il TiO2 e le NP di ossido di zinco (NP di ZnO) hanno ricevuto un'attenzione significativa11,12 tra i ricercatori.
Rispetto ai singoli materiali, la formazione di un'eterogiunzione è diventata una delle preferenze uniche per aumentare il rapporto tra superficie e volume dei materiali e migliorare le prestazioni fotocatalitiche e antibatteriche di un materiale. Inoltre, l'impatto sinergico delle eterogiunzioni binarie migliora la separazione delle coppie elettrone/lacuna fotogenerate rispetto alle eterogiunzioni binarie13,14. Gli studi hanno dimostrato che un'eterogiunzione tra Mn2O3 e ZnONPs 15 migliora la stabilità e la capacità di adsorbimento del substrato e riduce la resistenza al trasferimento di carica nelle NP sintetizzate. Inoltre, diversi studi hanno utilizzato la reattività ospite-drogante basata sulla teoria degli acidi e delle basi duri e morbidi di Pearson (HSAB) per testare l'eterogiunzione o la formazione di droganti. Si è scoperto che gli acidi duri di Lewis (come il Mn(III)) non possono diffondersi nella linea di confine del reticolo ospite di Zn (II) in presenza di un solvente a base dura come l'acqua16,17. Vengono adsorbiti sulla superficie dell'ospite e ossidati per formare un ibrido dopo calcinazione.
Grazie al suo potenziale, l'attuale attenzione globale per le applicazioni scalabili a livello industriale della sintesi dei materiali è rivolta al miglioramento dell'approccio e delle sue prospettive critiche13. La sintesi della combustione in soluzione (SCS) è un metodo semplice ed efficiente in termini di tempo/energia per creare materiali porosi ordinati regolarmente18, che svolgono un ruolo significativo nel fenomeno del trasporto di ioni/massa19. La SCS comprende una distribuzione dopante-ospite decente o eterogiunzione basata sulla teoria degli acidi e delle basi duri e morbidi di Pearson (HSAB). Il drogaggio/eterogiunzione può regolare le proprietà ottiche, magnetiche ed elettriche dei materiali, aumentando successivamente l'applicazione dei materiali attraverso un efficace trasferimento di carica e/o ruoli sinergici20. L'SCS assistito da ADA (architecture-directing agent) può anche produrre strutture di nanocristalli colloidali ordinati (CNF) utilizzate per il trasporto di massa/ioni nei dispositivi di conversione dell'energia21,22.
Questo studio ha prodotto un tensioattivo e un agente complessante di alcol polivinilico (PVA) per sintetizzare NP di ZnO e l'eterogiunzione di nanocompositi binari (NC) a base di ZnO attraverso un approccio SG-SCS rispettoso dell'ambiente. L'eterogiunzione tra gli ossidi, che svolge un ruolo vitale nel trasferimento di carica, è stata stimata sulla base della teoria HSAB. Sono state utilizzate tecniche di caratterizzazione per comprendere le proprietà strutturali, ottiche e morfologiche dei materiali. L'efficienza di degradazione del materiale è stata testata sia su coloranti AO8 stabili che tossici.
Protocollo
1. Sintesi di nanomateriali
- Sintesi di nanocompositi ZnO-Mn2O3
- Sintetizzare nanocompositi utilizzando alcol polivinilico come tensioattivo e un approccio SG-SCS assistito da agente complessante. Per un'illustrazione grafica dell'approccio SG-SCS, vedere la Figura S1 supplementare.
- Sciogliere 1,5 g di polimero PVA in 100 mL di acqua distillata agitando continuamente su un agitatore magnetico per circa 15 minuti a 115 °C23.
- Versare le soluzioni precursori saline, il nitrato di zinco esaidrato a una concentrazione del 90% v/v e il solfato di manganese a una concentrazione del 10% v/v nella soluzione PVA sopra disciolta mescolando continuamente per circa 10 minuti e abbassare la temperatura a 70 °C.
NOTA: I precursori del sale sono stati mescolati simultaneamente per bilanciare la reattività del precursore nanocomposito per seguire l'approccio di drogaggio nucleologico16,24. La temperatura è stata ridotta a 70 °C per controllare la crescita e l'aggregazione accelerata delle nanoparticelle, seguendo il modello La Mar25,26. - Invecchiare il sol sviluppato dell'idrossido metallico (particelle colloidali) tenendolo in un'area chiusa e buia per 2 giorni. Quindi, disidratare la soluzione riscaldandola a 110 °C (nell'aria) per formare un gel.
NOTA: Il polimero PVA funge da architettura, dirigendo i modelli e gli agenti complessanti, che aiutano nella dispersione omogenea dei cationi metallici, avviando il processo di combustione e prevenendo le proprietà di aggregazione/agglomerazione. - Sottoporre il gel alla combustione in aria riscaldando il forno ad una temperatura di accensione di ~150-250 °C (temperatura approssimativa controllata con un semplice termometro). La temperatura di accensione è la temperatura minima richiesta per avviare la combustione. Durante la combustione, utilizzare cappe per raccogliere tutti i sottoprodotti dei gas tossici che influiscono sulla salute umana.
NOTA: Il processo di combustione è stato attivato formando complessi tra il polimero PVA e i precursori dei nitrati, che fungono da combustibile per facilitare il processo di combustione. - Calcinare i materiali combusti per 3 ore a 500 °C in un forno a muffola, ottimizzato utilizzando la tecnica analitica della termogravimetria differenziale (DTG). DTG decompone le impurità incombuste e migliora la cristallinità dei materiali27.
- Sintesi nuda di ZnO e Mn2O3 NP
- Sintetizzare ossidi metallici nudi utilizzando l'approccio sol-gel. Sintetizzare ZnO e Mn2O3 nudi senza PVA utilizzando tutti i passaggi menzionati in precedenza, passaggi 1.1.1.-1.1.6., ad eccezione del passaggio 1.1.2. A causa dell'assenza dei complessi di nitrato metallico e polimero PVA, non si verifica alcun processo di autopropagazione durante la fase finale di essiccazione.
2. Caratterizzazione NP
- Determinare il rapporto termogravimetrico, in particolare il termico termogravimetrico/differenziale (analisi DT/DTA), in un'atmosfera di azoto a una portata di 20,0 mL/min e un tempo di rampa di 50 °C/min per studiare la stabilità termica e il comportamento di degradazione delle NP e delle NC.
- Eseguire la spettroscopia infrarossa a trasformata di Fourier (FTIR) utilizzando pellet KBr nell'intervallo 400-4000 cm−1 per studiare il comportamento del gruppo funzionale di superficie di NP e NC.
- Eseguire la diffrazione dei raggi X (XRD) per studiare la struttura cristallografica di PVA, NP e NC.
- Utilizzare il metodo Brunauer-Emmett-Teller (BET; N2 isoterme di adsorbimento-desorbimento) per calcolare l'area superficiale specifica dei campioni nell'intervallo di pressione relativa (P/Po) di 0,05-0,35. Determinare le distribuzioni delle dimensioni dei pori dei campioni utilizzando il metodo Barrett-Joyner-Halenda (BJH). Infine, misurare l'assorbimento di N2 di tutte le NP e NC a -196,15 °C.
- Utilizzare la microscopia elettronica a scansione con spettroscopia a raggi X a dispersione di energia (SEM-EDX) e la microscopia elettronica a trasmissione ad alta risoluzione (HRTEM) per studiare le morfologie ed eseguire studi composizionali delle NP e delle NC.
- Esegui un'analisi di spettroscopia fotoelettronica a raggi X (XPS) su un sistema integrato con una lente a immersione magnetica brevettata da Kratos, un sistema di neutralizzazione della carica e un analizzatore a specchio sferico. Calibra le energie di picco in base all'energia del carbonio esterno.
NOTA: Il ricercatore ha adottato tutte le procedure e i protocolli standard durante il processo di caratterizzazione.
3. Studi di degradazione in batch
- Eseguire l'esperimento fotocatalitico sciogliendo 20 ppm di colorante AO8 in 250 mL di soluzione acquosa (solvente acquoso) con 0,06 g di fotocatalizzatori N&N e NC di ZnO.
- Utilizzare l'esperimento di degradazione come conduttore in un reattore circolare in vetroda 176,6 cm 2. Per questo esperimento, utilizzare una lampada a vapori di mercurio a media pressione (lampada Hg) come sorgente luminosa (λmax = 365 nm, 125 W)28. Prima dell'accensione, agitare continuamente la sospensione di reazione al buio per 30 minuti per creare l'equilibrio di adsorbimento/desorbimento di AO8/CR sulle NP/NC.
- Irradiare direttamente i campioni concentrando la luce sulla miscela di reazione da una distanza di 20 cm. Utilizzare un agitatore magnetico a 110 giri/min per mescolare continuamente la soluzione. Controllare la temperatura dell'intero reattore durante l'esperimento utilizzando la circolazione dell'acqua.
- Prelevare 5 mL della soluzione colorante ogni 15 minuti per misurare le loro concentrazioni al tempo t mediante spettrofotometro UV-vis. Calcola la percentuale di efficienza di degradazione fotocatalitica utilizzando l'equazione:
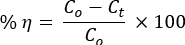
dove Co e Ct sono le concentrazioni di irradiazione iniziale e successiva all'irradiazione temporale , rispettivamente, della soluzione di coloranti AO8 e CR; e η è l'efficienza di decolorazione delle foto, - Usa l'equazione cinetica pseudo-del primo ordine per studiare la dinamica delle reazioni:
Cinetica pseudo del primo ordine: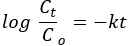
dove Co e Ct sono rispettivamente le concentrazioni iniziali e di equilibrio del colorante AO8 (mg/L), k è la costante di velocità e t è il tempo in minuti.
Risultati
La Figura 1A illustra le stabilità termiche delle NC binarie prima che uno strumento DTG analizzi la calcinazione nell'atmosfera di N2. Una sequenza di vaporizzazione di molecole di H2O adsorbite, decadimento intramolecolare, idrossidi metallici e/o decomposizione della catena laterale PVA, decomposizione della catena principale intermolecolare/PVA e, infine, la parte cristallina ha avuto luogo per dare carbonio, idrocarburi e cenere
Discussione
Il presente protocollo descrive la sintesi di nanocristalli utilizzando una strategia bottom-up con forma, dimensione e struttura precise. Lo studio ha osservato che la nucleazione e la crescita dei nanocristalli erano significative prima della formazione dei nanocristalli. Qui, gli ossidi di ZnO e manganese sono stati sintetizzati sulla base della teoria dei gruppi25 di LaMer, che postula il processo di formazione dei nanocristalli dopo aver ridotto i precursori ...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo l'Università di Scienza e Tecnologia Adama per il suo sostegno in questo lavoro. Il finanziamento è stato fornito dai ricercatori dell'Università di Taif che sostengono il progetto numero (TURSP-2020/44), Università di Taif, Arabia Saudita.
Materiali
| Name | Company | Catalog Number | Comments |
| Acid orange 8 | Sigma-Aldrich | 65%, | |
| Chlorine | Sigma-Aldrich | 7782-50-5 | |
| Dithienogermole | Sigma-Aldrich | 773881-43-9 | |
| HCl | Sigma-Aldrich | 7647-01-0 | |
| Manganese nitrate (10%) salt | Sigma-Aldrich | 15710-66-4 | 10% |
| Manganese sulfate monohydrate | Sigma-Aldrich | Density: 2.95 g/cm³; solubility in water: 70 g/100 mL (70 °C); 99.95%, MnSO4.H2O | |
| Poly (vinyl alcohol) | Sigma-Aldrich | 9002-89-5 | Density: 1.19–1.31 g/cm³ @20 °C, soluble in water only @ > 80 °C |
| Zinc nitrate hexahydrate (90%) | Sigma-Aldrich | 10196-18-6 | 98%; Density: 2.065 g/cm³ @20 °C; solubility in water: 184.3 g/100 mL @20 °C |
| Instruments used | |||
| Materials name | Model | Analysis | |
| BET (N2 adsorption-desorption isotherms) | Quanta chrome instrument. | Textural properties | |
| DT/DTA | Shimadzu DTG-60H | Measure thermal stability | |
| FTIR | Perkin Elmer FT-IR, Spectrum 65 | Chemical bonding information | |
| HRTEM | JEOL TEM 2100 HRTEM | Morphological, size, and composition analysis | |
| SEM-EDX | SEM-EDX-EVO 18 with low vacuum facility and ALTO 1000 cryo attachment | Morphological analysis | |
| XPS | AXIS ULTRA from AXIS 165 | ||
| XRD | Shimadzu, XRD-7000 | Crystallinity, structure, and approximate average crystallite size | |
| Common software used | |||
| Name | Company | Use | |
| Mendeley | Mendeley-Desktop-1.19.8-win32 | For citing references | |
| Origin | OriginPro 8 | XRD, BET, UV-vis-DRS data analysis |
Riferimenti
- Khort, A., et al. Corrosion and transformation of solution combustion synthesized Co, Ni and CoNi nanoparticles in synthetic freshwater with and without natural organic matter. Scientific Reports. 11 (1), 7860 (2021).
- Pype, M., Lawrence, M. G., Keller, J., Gernjak, W. Reverse osmosis integrity monitoring in water reuse: The challenge to verify virus removal - A review. Water Research. 98, 384-395 (2016).
- Adeleye, A. S., et al. Engineered nanomaterials for water treatment and remediation: Costs, benefits, and applicability. Chemical Engineering Journal. 286, 640-662 (2016).
- Gómez-Pastora, J., et al. Review and perspectives on the use of magnetic nanophotocatalysts (MNPCs) in water treatment. Chemical Engineering Journal. 310 (2), 407-427 (2017).
- Nadeem, M. S., et al. Enhancement in the photocatalytic and antimicrobial properties of ZnO nanoparticles by structural variations and energy bandgap tuning through Fe and Co co-doping. Ceramics International. 47 (8), 11109-11121 (2021).
- Nadeem, M. S., et al. Energy-levels well-matched direct Z-scheme ZnNiNdO/CdS heterojunction for elimination of diverse pollutants from wastewater and microbial disinfection. Environmental Science and Pollution Research International. , (2022).
- Munawar, T., Iqbal, F., Yasmeen, S., Mahmood, K., Hussain, A. Multi metal oxide NiO-CdO-ZnO nanocomposite-Synthesis, structural, optical, electrical properties and enhanced sunlight driven photocatalytic activity. Ceramics International. 46 (2), 2421-2437 (2020).
- Srinivasa, N., et al. Facile synthesis of Ni/NiO nanocomposites: The effect of Ni content in NiO upon the oxygen evolution reaction within alkaline media. RSC Advances. 11 (24), 14654-14664 (2021).
- Chen, P., et al. Solution combustion synthesis of ternary Ni/WC/C composites with efficient electrocatalytic oxygen reduction performance. RSC Advances. 11 (61), 38718-38726 (2021).
- Nagvenkar, A. P., Perelshtein, I., Piunno, Y., Mantecca, P., Gedanken, A. Sonochemical one-step synthesis of polymer-capped metal oxide nanocolloids: Antibacterial activity and cytotoxicity. ACS Omega. 4 (9), 13631-13639 (2019).
- Janotti, A., Van de Walle, C. G. Fundamentals of zinc oxide as a semiconductor. Reports on Progress in Physics. 72 (12), 126501 (2009).
- Abebe, B., Murthy, H. C. A., Amare, E. Enhancing the photocatalytic efficiency of ZnO: Defects, heterojunction, and optimization. Environmental Nanotechnology, Monitoring. & Management. 14, 100336 (2020).
- Abebe, B., Murthy, H. C. A., Zereffa, E. A. Multifunctional application of PVA-aided Zn-Fe-Mn coupled oxide nanocomposite. Nanoscale Research Letters. 16, 1 (2021).
- Shekofteh-Gohari, M., Habibi-Yangjeh, A. Fe3O4/ZnO/CoWO4 nanocomposites: Novel magnetically separable visible-light-driven photocatalysts with enhanced activity in degradation of different dye pollutants. Ceramics International. 43 (3), 3063-3071 (2017).
- Saravanan, R., Gupta, V. K. K., Narayanan, V., Stephen, A. Visible light degradation of textile effluent using novel catalyst ZnO/γ-Mn2O3. Journal of the Taiwan Institute of Chemical Engineers. 45 (4), 1910-1917 (2014).
- Buonsanti, R., Milliron, D. J. Chemistry of doped colloidal nanocrystals. Chemistry of Materials. 25 (8), 1305-1317 (2013).
- Hu, H., He, H., Zhang, J., Hou, X., Wu, P. Optical sensing at the nanobiointerface of metal ion-optically-active nanocrystals. Nanoscale. 10 (11), 5035-5046 (2018).
- Deganello, F., Tyagi, A. K. Solution combustion synthesis, energy and environment: Best parameters for better materials. Progress in Crystal Growth and Characterization of Materials. 64 (2), 23-61 (2018).
- Buonsanti, R., et al. Assembly of ligand-stripped nanocrystals into precisely controlled mesoporous architectures. Nano Letters. 12 (7), 3872-3877 (2012).
- Li, F., Ran, J., Jaroniec, M., Qiao, S. Z. Solution combustion synthesis of metal oxide nanomaterials for energy storage and conversion. Nanoscale. 7 (42), 17590-17610 (2015).
- Williams, T. E., et al. Nearest-neighbour nanocrystal bonding dictates framework stability or collapse in colloidal nanocrystal frameworks. Chemical Communications. 53 (35), 4853-4856 (2017).
- Helms, B. A., Williams, T. E., Buonsanti, R., Milliron, D. J. Colloidal nanocrystal frameworks. Advanced Materials. 27 (38), 5820-5829 (2015).
- Liu, B., et al. Synthesis of ZnO nano-powders via a novel PVA-assisted freeze-drying process. RSC Advances. 6 (111), 110349-110355 (2016).
- Abebe, B., Murthy, H. C. A. Insights into ZnO-based doped porous nanocrystal frameworks. RSC Advances. 12 (10), 5816-5833 (2022).
- LaMer, V. K., Dinegar, R. H. Theory, production and mechanism of formation of monodispersed hydrosols. Journal of the American Chemical Society. 72 (11), 4847-4854 (1950).
- Jun, Y. -. S., et al. Classical and nonclassical nucleation and growth mechanisms for nanoparticle formation. Annual Review of Physical Chemistry. 73, 453-477 (2022).
- Gao, Y., Meng, F., Li, X., Wen, J. Z., Li, Z. Factors controlling nanosized Ni-Al 2 O 3 catalysts synthesized by solution combustion for slurry-phase CO methanation: the ratio of reducing valences to oxidizing valences in redox systems. Catalysis Science & Technology. 6 (21), 7800-7811 (2016).
- Abebe, B., Zereffa, E. A., Murthy, H. C. A. Synthesis of poly(vinyl alcohol)-aided ZnO/Mn 2 O 3 nanocomposites for acid orange-8 dye degradation: Mechanism and antibacterial activity. ACS Omega. 6 (1), 954-964 (2021).
- Kumar, S., Krishnakumar, B., Sobral, A. J. F. N., Koh, J. Bio-based ( chitosan / PVA / ZnO ) nanocomposites fi lm Thermally stable and photoluminescence material for removal of organic dye. Carbohydrate Polymers. 205, 559-564 (2019).
- Dai, Y., et al. Enhanced mechanical, thermal, and UV-shielding properties of poly(vinyl alcohol)/metal-organic framework nanocomposites. RSC Advances. 8 (67), 38681-38688 (2018).
- Munawar, T., et al. Novel tri-phase heterostructured ZnO-Yb2O3-Pr2O3 nanocomposite; structural, optical, photocatalytic and antibacterial studies. Ceramics International. 46 (8), 11101-11114 (2020).
- Mukhtar, F., et al. Enhancement in carrier separation of ZnO-Ho2O3-Sm2O3 hetrostuctured nanocomposite with rGO and PANI supported direct dual Z-scheme for antimicrobial inactivation and sunlight driven photocatalysis. Advanced Powder Technology. 32 (10), 3770-3787 (2021).
- Lachheb, H., et al. Electron transfer in ZnO-Fe 2 O 3 aqueous slurry systems and its effects on visible light photocatalytic activity. Catalysis Science & Technology. 7 (18), 4041-4047 (2017).
- Thommes, M., et al. Physisorption of gases, with special reference to the evaluation of surface area and pore size distribution (IUPAC Technical Report). Pure and Applied Chemistry. 87 (9-10), 1051-1069 (2015).
- Kumar, P., Kim, K. -. H., Kwon, E. E., Szulejko, J. E. Metal-organic frameworks for the control and management of air quality: advances and future direction. Journal of Materials Chemistry A. 4 (2), 345-361 (2016).
- Liu, J., et al. NiO-PTA supported on ZIF-8 as a highly effective catalyst for hydrocracking of Jatropha oil. Scientific Reports. 6, 23667 (2016).
- Fatehah, M. O., Aziz, H. A., Stoll, S. Stability of ZnO nanoparticles in solution. Influence of pH, dissolution, aggregation and disaggregation effects. Journal of Colloid Science and Biotechnology. 3 (1), 75-84 (2014).
- Sigoli, F. A., Davolos, M. R., Jafelicci, M. Morphological evolution of zinc oxide originating from zinc hydroxide carbonate. Journal of Alloys and Compounds. 262-263, 292-295 (1997).
- Wachs, I. E. Raman and IR studies of surface metal oxide species on oxide supports: Supported metal oxide catalysts. Catalysis Today. 27 (3-4), 437-455 (1996).
- Parler, C. M., Ritter, J. A., Amiridis, M. D. Infrared spectroscopic study of sol-gel derived mixed-metal oxides. Journal of Non-Crystalline Solids. 279 (2-3), 119-125 (2001).
- Anžlovar, A., Kogej, K., Crnjak Orel, Z., Žigon, M. Polyol mediated nano size zinc oxide and nanocomposites with poly(methyl methacrylate). Express Polymer Letters. 5 (7), 604-619 (2011).
- Saravanan, R., et al. ZnO/Ag/Mn 2 O 3 nanocomposite for visible light-induced industrial textile effluent degradation, uric acid and ascorbic acid sensing and antimicrobial activity. RSC Advances. 5 (44), 34645-34651 (2015).
- Yang, G., Yan, W., Wang, J., Yang, H. Fabrication and formation mechanism of Mn 2 O 3 hollow nanofibers by single-spinneret electrospinning. CrystEngComm. 16 (30), 6907-6913 (2014).
- Liu, Y., et al. A magnetically separable photocatalyst based on nest-like γ-Fe 2 O 3 /ZnO double-shelled hollow structures with enhanced photocatalytic activity. Nanoscale. 4 (1), 183-187 (2012).
- Hu, Y., et al. A microwave-assisted rapid route to synthesize ZnO/ZnS core-shell nanostructures via controllable surface sulfidation of ZnO nanorods. CrystEngComm. 13 (10), 3438-3443 (2011).
- Zhang, J., et al. Synthesis and gas sensing properties of α-Fe 2 O 3 @ ZnO core-shell nanospindles. Nanotechnology. 22 (18), 185501 (2011).
- Penn, R. L. Imperfect oriented attachment: Dislocation generation in defect-free nanocrystals. Science. 281 (5379), 969-971 (1998).
- Zhang, J., Huang, F., Lin, Z. Progress of nanocrystalline growth kinetics based on oriented attachment. Nanoscale. 2 (1), 18-34 (2009).
- Zeng, Z., et al. A fluorescence-electrochemical study of carbon nanodots (CNDs) in bio- and photoelectronic applications and energy gap investigation. Physical Chemistry Chemical Physics. 19 (30), 20101-20109 (2017).
- Zhai, T., et al. Controllable synthesis of hierarchical ZnO nanodisks for highly photocatalytic activity. CrystEngComm. 14 (5), 1850-1855 (2012).
- Li, N., et al. Efficient removal of chromium from water by Mn3O4 @ZnO/Mn3O4 composite under simulated sunlight irradiation: Synergy of photocatalytic reduction and adsorption. Applied Catalysis B: Environmental. 214, 126-136 (2017).
- Abebe, B. Polymer assisted colloidal nanocrystal framework synthesis: Sol-gel approach. Materials Research Express. 8 (12), 125005 (2021).
- Jiamprasertboon, A., et al. Heterojunction α-Fe2O3/ZnO films with enhanced photocatalytic properties grown by aerosol-assisted chemical vapour deposition. Chemistry - A European Journal. 25 (48), 11337-11345 (2019).
- Mukhtar, F., et al. Dual S-scheme heterojunction ZnO-V2O5-WO3 nanocomposite with enhanced photocatalytic and antimicrobial activity. Materials Chemistry and Physics. 263, 124372 (2021).
- Marschall, R. Semiconductor composites: Strategies for enhancing charge carrier separation to improve photocatalytic activity. Advanced Functional Materials. 24 (17), 2421-2440 (2013).
- Beranek, R. (Photo)electrochemical methods for the determination of the band edge positions of TiO 2-based nanomaterials. Advances in Physical Chemistry. 2011, 786759 (2011).
- Hoffmann, M. R., Martin, S. T., Choi, W., Bahnemann, D. W. Environmental applications of semiconductor photocatalysis. Chemical Reviews. 95 (1), 69-96 (1995).
- Wu, Y., Wang, D., Li, Y. Understanding of the major reactions in solution synthesis of functional nanomaterials. Science China Materials. 59, 938-996 (2016).
- Xia, Y., Xiong, Y., Lim, B., Skrabalak, S. E. Shape-controlled synthesis of metal nanocrystals: Simple chemistry meets complex physics. Angewandte Chemie. 48 (1), 60-103 (2008).
- Kim, S. J., Yoon, S., Kim, H. J. Review of solution-processed oxide thin-film transistors. Japanese Journal of Applied Physics. 53, (2014).
- Zhang, J., Guo, Q., Liu, Y., Cheng, Y. Preparation and characterization of Fe2O3/Al2O3 using the solution combustion approach for chemical looping combustion. Industrial & Engineering Chemistry Research. 51 (39), 12773-12781 (2012).
- Novitskaya, E., Kelly, J. P., Bhaduri, S., Graeve, O. A. A review of solution combustion synthesis: an analysis of parameters controlling powder characteristics. International Materials Reviews. 66 (3), 188-214 (2021).
- González-Cortés, S. L., Imbert, F. E. Fundamentals, properties and applications of solid catalysts prepared by solution combustion synthesis (SCS). Applied Catalysis A: General. 452, 117-131 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon