Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Metalloxid-Heteroübergang für photokatalytische Aktivitäten
In diesem Artikel
Zusammenfassung
Die Entwicklung eines Heteroübergangs steigert die photokatalytischen Aktivitäten der Lösungsverbrennungssynthese, die ein zeit- und energieeffizienter Prozess ist. In diesem Protokoll wurden fortschrittliche analytische Charakterisierungstechniken verwendet, um die Eigenschaften der Materialien zu bewerten, und Nanokomposite zeigten einen verbesserten Abbau des sauren Orange-8-Farbstoffs.
Zusammenfassung
Es besteht ein erheblicher weltweiter Bedarf an Verbesserungen der Synthesetechniken und ihrer optimalen Eigenschaften, insbesondere für Anwendungen im industriellen Maßstab. Die Sol-Gel-basierte Lösungsverbrennungssynthese (SG-SCS) ist eine einfache Methode zur Herstellung geordneter poröser Materialien. In dieser Hinsicht hilft Pearsons Theorie der harten und weichen Säuren und Basen bei der Auswahl der Wirts-Dotierstoff-Reaktivität, um einen geeigneten Heteroübergang zu bilden.
Die Bildung eines Heteroübergangs verändert auch die wesentlichen Eigenschaften der Materialien und verbessert die Photokatalyse durch Ladungstransfer oder synergistische Aktivitäten. Eine Kalzinierungstemperatur von 500 °C ist für diesen Prozess ideal, basierend auf den Ergebnissen der Stabilitätsbewertung mittels einer differentiellen Thermogravimetrie-Verhältnisanalyse (DTG).
Die nanoskaligen Dimensionen der erzeugten Nanopartikel (NPs) und Nanokomposite (NCs) wurden mittels Röntgenbeugung und hochauflösender Transmissionselektronenmikroskopie (HRTEM) validiert. Darüber hinaus bestätigten die rasterelektronenmikroskopischen Aufnahmen und BET-Analysen die Porosität der Materialien. HRTEM, Röntgenphotoelektronenspektroskopie und energiedispersive Röntgenuntersuchungen ermittelten die Materialzusammensetzung. Die Studie ergab, dass NCs die Farbe Säureorange 8 (AO8) effizienter abbauen als blankes ZnO.
Einleitung
Der Umweltschutz ist mit dem rasanten Aufstieg der Unternehmen weltweit zu einem wichtigen Anliegen geworden. Daher haben nanotechnologiebasierte Nanomaterialien (NMs) und ihre Synthese in der modernen wissenschaftlichen Welt die Aufmerksamkeit der Forscher auf sich gezogen, anstatt Massenmaterialienzu nennen 1. Mehrere physikalisch-chemische Ansätze wurden an die Behandlung organischer und anorganischer Kontaminanten angepasst 2,3. In diesem Zusammenhang wird die heterogene Photokatalyse aufgrund ihrer Einfachheit und Fähigkeit, Toxine aufzulösen, ohne eine Sekundärkontamination zu erzeugen, als adaptive Sanierungstechnik angesehen4. Studien haben einen Heteroübergang oder eine Dotierung zwischen geeigneten Bandlücken-Halbleitern entwickelt, die dazu beiträgt, die Elektron-Loch-Rekombination, die Oberfläche und das Volumen des Bestandteils zu reduzieren. Dieser Zustand erhöhte in der Folge den photokatalytischen Abbau von Farbstoffen 5,6,7. Jüngste Arbeiten haben auch über eine synergistische und Ladertransfer-Verbesserungsrolle durch Heteroübergänge/Hybride berichtet 8,9, und Halbleitermetalloxide zeigen einzigartige physikalische und chemische Eigenschaften für multifunktionale Anwendungen10. Infolgedessen haben TiO2 und Zinkoxid NP (ZnO NPs) unter Forschern große Aufmerksamkeit erhalten11,12.
Im Vergleich zu Einzelmaterialien ist die Bildung eines Heteroübergangs zu einer der einzigartigen Präferenzen geworden, um die Oberfläche und das Volumenverhältnis von Materialien zu vergrößern und die photokatalytische und antibakterielle Leistung eines Materials zu verbessern. Darüber hinaus verbessert der synergistische Einfluss binärer Heteroübergänge die Trennung von photogenerierten Elektron/Loch-Paaren im Vergleich zu binären Heteroübergängen13,14. Studien haben gezeigt, dass ein Heteroübergang zwischen Mn2O3 und ZnO NPs15 die Stabilität und Adsorptionskapazität des Substrats verbessert und den Ladungstransferwiderstand in synthetisierten NPs reduziert. Darüber hinaus haben mehrere Studien die Wirts-Dotierstoff-Reaktivität auf der Grundlage der Pearson-Theorie der harten und weichen Säuren und Basen (HSAB) verwendet, um die Bildung von Heteroübergängen oder Dotieren zu testen. Es wurde festgestellt, dass harte Lewis-Säuren (wie Mn(III)) in Gegenwart eines harten Lösungsmittels wie Wasser nicht in die Grenzlinie des Zn(II)-Wirtsgitters diffundieren können16,17. Sie werden an der Wirtsoberfläche adsorbiert und bei Kalzinierung oxidiert, um einen Hybrid zu bilden.
Aufgrund seines Potenzials liegt der derzeitige globale Fokus für industriell skalierbare Anwendungen der Materialsynthese auf der Verbesserung des Ansatzes und seiner kritischen Perspektiven13. Die Lösungsverbrennungssynthese (SCS) ist eine einfache, zeit- und energieeffiziente Methode zur Herstellung regelmäßig geordneter poröser Materialien18, die eine wichtige Rolle beim Ionen-/Stofftransport19 spielen. SCS besteht aus einer anständigen Dotier-Wirt-Verteilung oder Heterojunction, die auf Pearsons Theorie der harten und weichen Säuren und Basen (HSAB) basiert. Die Dotierung/der Heteroübergang kann die optischen, magnetischen und elektrischen Eigenschaften der Materialien abstimmen und anschließend die Anwendung von Materialien durch effektiven Ladungstransfer und/oder synergistische Rollenverstärken 20. Das ADA-unterstützte SCS (Architecture-Directing Agent) kann auch geordnete kolloidale Nanokristallgerüste (CNFs) herstellen, die für den Massen-/Ionentransport in energiekonvertierenden Bauelementen verwendet werden21,22.
In dieser Studie wurde ein Tensid und Komplexbildner aus Polyvinylalkohol (PVA) hergestellt, um ZnO-NPs und ZnO-basierte binäre Nanokomposit-Heteroübergänge (NCs) durch einen umweltfreundlichen SG-SCS-Ansatz zu synthetisieren. Der Heteroübergang zwischen den Oxiden, der eine wichtige Rolle beim Ladungstransfer spielt, wurde auf der Grundlage der HSAB-Theorie abgeschätzt. Charakterisierungstechniken wurden eingesetzt, um die strukturellen, optischen und morphologischen Eigenschaften der Materialien zu verstehen. Die Abbaueffizienz des Materials wurde sowohl an stabilen als auch an giftigen AO8-Farbstoffen getestet.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Synthese von Nanomaterialien
- ZnO-Mn2O3 Nanokomposit-Synthese
- Synthese von Nanokompositen unter Verwendung von Polyvinylalkohol als Tensid und einem Komplexbildner-gestützten SG-SCS-Ansatz. Eine grafische Darstellung des SG-SCS-Ansatzes finden Sie in der ergänzenden Abbildung S1.
- 1,5 g PVA-Polymer in 100 mL destilliertem Wasser unter ständigem Rühren auf einem Magnetrührer für ca. 15 min bei 115 °C23 auflösen.
- Die Salzvorläuferlösungen, Zinknitrathexahydrat in einer Konzentration von 90 % v/v und Mangansulfat in einer Konzentration von 10 % v/v in die oben gelöste PVA-Lösung unter ständigem Rühren für ca. 10 min gießen und die Temperatur auf 70 °C senken.
ANMERKUNG: Salzvorläufer wurden gleichzeitig gemischt, um die Reaktivität der Nanokomposit-Vorläufer auszugleichen und dem Nukleations-Dotierungsansatzzu folgen 16,24. Die Temperatur wurde auf 70 °C gesenkt, um das beschleunigte Wachstum und die Aggregation der Nanopartikel zu kontrollieren, nach dem La-Mar-Modell25,26. - Altern Sie das entwickelte Sol (kolloidale Partikel) des Metallhydroxids, indem Sie es 2 Tage lang an einem geschlossenen und dunklen Ort aufbewahren. Dann dehydrieren Sie die Lösung, indem Sie sie bei 110 °C (an der Luft) erhitzen, um ein Gel zu bilden.
HINWEIS: Das PVA-Polymer fungiert als Architektur, die Schablonen und Komplexbildner leitet, die die homogene Dispersion von Metallkationen unterstützen, den Verbrennungsprozess einleiten und Aggregations-/Agglomerationseigenschaften verhindern. - Setzen Sie das Gel einer Verbrennung an der Luft aus, indem Sie den Ofen auf eine Zündtemperatur von ~150-250 °C erhitzen (ungefähre Temperatur, die mit einem einfachen Thermometer überprüft wird). Die Zündtemperatur ist die Mindesttemperatur, die erforderlich ist, um die Verbrennung zu starten. Verwenden Sie während der Verbrennung Hauben, um alle giftigen Gase zu sammeln, die die menschliche Gesundheit beeinträchtigen.
HINWEIS: Der Verbrennungsprozess wurde durch die Bildung von Komplexen zwischen PVA-Polymer und Nitratvorläufern aktiviert, die als Brennstoff fungieren, um den Verbrennungsprozess zu erleichtern. - Die verbrannten Materialien werden 3 h lang bei 500 °C in einem Muffelofen kalziniert, optimiert mit der Analysetechnik der Differenzthermogravimetrie (DTG). DTG zersetzt die unverbrannten Verunreinigungen und verbessert die Kristallinität der Materialien27.
- Synthese von Bare ZnO undMn 2O3 NPs
- Synthetisieren Sie Bare-Metal-Oxide mit dem Sol-Gel-Ansatz. Synthetisieren Sie blankes ZnO und Mn2O3 ohne PVA mit allen zuvor genannten Schritten, Schritten 1.1.1.-1.1.6., mit Ausnahme von Schritt 1.1.2. Durch den Verzicht auf die Metallnitrat- und PVA-Polymerkomplexe findet im letzten Trocknungsschritt kein Selbstvermehrungsprozess statt.
2. NP-Charakterisierung
- Bestimmung des Thermogravimetrieverhältnisses, insbesondere des thermischen thermogravimetrischen/differentiellen thermischen Verhältnisses (DT/DTA-Analyse), in einer Stickstoffatmosphäre bei einer Durchflussrate von 20,0 mL/min und einer Rampenzeit von 50 °C/min, um die thermische Stabilität und das Degradationsverhalten der NPs und NCs zu untersuchen.
- Führen Sie die Fourier-Transformations-Infrarot-Spektroskopie (FTIR) mit KBr-Pellets im Bereich von 400-4000 cm−1 durch, um das Verhalten von Oberflächenfunktionsgruppen von NPs und NCs zu untersuchen.
- Führen Sie Röntgenbeugung (XRD) durch, um die kristallographische Struktur von PVA, NPs und NCs zu untersuchen.
- Verwenden Sie den Brunauer-Emmett-Teller (BET; N2 Adsorptions-Desorptionsisothermen) zur Berechnung der spezifischen Oberfläche der Proben im Relativdruckbereich (P/P o) von 0,05 bis 0,35. Bestimmen Sie die Porengrößenverteilungen der Proben mit der Barrett-Joyner-Halenda-Methode (BJH). Abschließend wird die N 2-Sorption aller NP und NC bei -196,15 °C gemessen.
- Verwenden Sie die Rasterelektronenmikroskopie mit energiedispersiver Röntgenspektroskopie (REM-EDX) und hochauflösender Transmissionselektronenmikroskopie (HRTEM), um die Morphologien zu untersuchen und Untersuchungen der Zusammensetzung der NPs und NCs durchzuführen.
- Führen Sie eine Röntgenphotoelektronenspektroskopie (XPS)-Analyse an einem System durch, das mit einer von Kratos patentierten magnetischen Tauchlinse, einem Ladungsneutralisationssystem und einem sphärischen Spiegelanalysator integriert ist. Kalibrieren Sie die Spitzenenergien auf der Grundlage der Energie von externem Kohlenstoff.
HINWEIS: Der Forscher hat während des Charakterisierungsprozesses alle Standardverfahren und -protokolle angewendet.
3. Studien zur Chargendegradation
- Das photokatalytische Experiment wird durchgeführt, indem 20 ppm AO8-Farbstoff in 250 mL wässriger Lösung (Wasserlösungsmittel) mit 0,06 g ZnO, NPs und NCs-Photokatalysatoren gelöst werden.
- Verwenden Sie das Degradationsexperiment als Leiter in einem 176,6 cm2 kreisförmigen Glasreaktor. Für dieses Experiment wird eine Mitteldruck-Quecksilberdampflampe (Hg-Lampe) als Lichtquelle verwendet (λmax = 365 nm, 125 W)28. Vor der Beleuchtung die Reaktionssuspension 30 min lang kontinuierlich im Dunkeln rühren, um das Adsorptions-/Desorptionsgleichgewicht des AO8/CR an den NPs/NCs herzustellen.
- Bestrahlen Sie die Proben direkt, indem Sie das Licht aus einer Entfernung von 20 cm auf das Reaktionsgemisch fokussieren. Verwenden Sie einen Magnetrührer bei 110 U/min, um die Lösung kontinuierlich zu mischen. Kontrollieren Sie die Temperatur des gesamten Reaktors während des Experiments mithilfe der Wasserzirkulation.
- Alle 15 Minuten werden 5 ml der Farbstofflösung entnommen, um ihre Konzentrationen zum Zeitpunkt t mit dem UV-Vis-Spektralphotometer zu messen. Berechnen Sie den prozentualen Anteil der photokatalytischen Degradationseffizienz anhand der Gleichung:
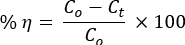
wobei Co und Ct die anfängliche bzw. nachfolgende Bestrahlungskonzentration t der AO8- und CR-Farbstofflösung sind; und η ist die Effizienz der Fotoentfärbung, - Verwenden Sie die kinetische Gleichung pseudoerster Ordnung, um die Reaktionsdynamik zu untersuchen:
Pseudo-Kinetik erster Ordnung: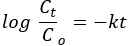
wobei Co und Ct die Anfangs- bzw. Gleichgewichtskonzentrationen des AO8-Farbstoffs (mg/L) sind, k die Geschwindigkeitskonstante und t die Zeit in Minuten ist.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Abbildung 1A zeigt die thermische Stabilität von binären NCs, bevor ein DTG-Instrument die Kalzinierung in der N2-Atmosphäre analysiert. Eine Sequenz der Verdampfung von adsorbierten H2O-Molekülen, des intramolekularen Zerfalls, der Zerlegung von Metallhydroxiden oder/und PVA-Seitenketten, der intermolekularen/PVA-Hauptkettenzerlegung und schließlich des kristallinen Teils fand statt, um Kohlenstoff, Kohlenwasserstoffe und Asche
Access restricted. Please log in or start a trial to view this content.
Diskussion
Das vorliegende Protokoll beschreibt die Synthese von Nanokristallen unter Verwendung einer Bottom-up-Strategie mit präziser Form, Größe und Struktur. Die Studie beobachtete, dass die Keimbildung und das Wachstum von Nanokristallen vor der Bildung der Nanokristalle signifikant waren. Hier wurden die ZnO- und Manganoxide auf der Grundlage der LaMer-Gruppentheorie25 synthetisiert, die den Prozess der Nanokristallbildung nach der Reduktion von Vorläufern in Atome...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Wir möchten der Adama Science and Technology University für ihre Unterstützung bei dieser Arbeit danken. Die Finanzierung erfolgte durch die Taif University Researchers Supporting Project Nummer (TURSP-2020/44), Taif University, Taif, Saudi-Arabien.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Acid orange 8 | Sigma-Aldrich | 65%, | |
| Chlorine | Sigma-Aldrich | 7782-50-5 | |
| Dithienogermole | Sigma-Aldrich | 773881-43-9 | |
| HCl | Sigma-Aldrich | 7647-01-0 | |
| Manganese nitrate (10%) salt | Sigma-Aldrich | 15710-66-4 | 10% |
| Manganese sulfate monohydrate | Sigma-Aldrich | Density: 2.95 g/cm³; solubility in water: 70 g/100 mL (70 °C); 99.95%, MnSO4.H2O | |
| Poly (vinyl alcohol) | Sigma-Aldrich | 9002-89-5 | Density: 1.19–1.31 g/cm³ @20 °C, soluble in water only @ > 80 °C |
| Zinc nitrate hexahydrate (90%) | Sigma-Aldrich | 10196-18-6 | 98%; Density: 2.065 g/cm³ @20 °C; solubility in water: 184.3 g/100 mL @20 °C |
| Instruments used | |||
| Materials name | Model | Analysis | |
| BET (N2 adsorption-desorption isotherms) | Quanta chrome instrument. | Textural properties | |
| DT/DTA | Shimadzu DTG-60H | Measure thermal stability | |
| FTIR | Perkin Elmer FT-IR, Spectrum 65 | Chemical bonding information | |
| HRTEM | JEOL TEM 2100 HRTEM | Morphological, size, and composition analysis | |
| SEM-EDX | SEM-EDX-EVO 18 with low vacuum facility and ALTO 1000 cryo attachment | Morphological analysis | |
| XPS | AXIS ULTRA from AXIS 165 | ||
| XRD | Shimadzu, XRD-7000 | Crystallinity, structure, and approximate average crystallite size | |
| Common software used | |||
| Name | Company | Use | |
| Mendeley | Mendeley-Desktop-1.19.8-win32 | For citing references | |
| Origin | OriginPro 8 | XRD, BET, UV-vis-DRS data analysis |
Referenzen
- Khort, A., et al. Corrosion and transformation of solution combustion synthesized Co, Ni and CoNi nanoparticles in synthetic freshwater with and without natural organic matter. Scientific Reports. 11 (1), 7860(2021).
- Pype, M., Lawrence, M. G., Keller, J., Gernjak, W. Reverse osmosis integrity monitoring in water reuse: The challenge to verify virus removal - A review. Water Research. 98, 384-395 (2016).
- Adeleye, A. S., et al. Engineered nanomaterials for water treatment and remediation: Costs, benefits, and applicability. Chemical Engineering Journal. 286, 640-662 (2016).
- Gómez-Pastora, J., et al. Review and perspectives on the use of magnetic nanophotocatalysts (MNPCs) in water treatment. Chemical Engineering Journal. 310 (2), 407-427 (2017).
- Nadeem, M. S., et al. Enhancement in the photocatalytic and antimicrobial properties of ZnO nanoparticles by structural variations and energy bandgap tuning through Fe and Co co-doping. Ceramics International. 47 (8), 11109-11121 (2021).
- Nadeem, M. S., et al. Energy-levels well-matched direct Z-scheme ZnNiNdO/CdS heterojunction for elimination of diverse pollutants from wastewater and microbial disinfection. Environmental Science and Pollution Research International. , (2022).
- Munawar, T., Iqbal, F., Yasmeen, S., Mahmood, K., Hussain, A. Multi metal oxide NiO-CdO-ZnO nanocomposite-Synthesis, structural, optical, electrical properties and enhanced sunlight driven photocatalytic activity. Ceramics International. 46 (2), 2421-2437 (2020).
- Srinivasa, N., et al. Facile synthesis of Ni/NiO nanocomposites: The effect of Ni content in NiO upon the oxygen evolution reaction within alkaline media. RSC Advances. 11 (24), 14654-14664 (2021).
- Chen, P., et al. Solution combustion synthesis of ternary Ni/WC/C composites with efficient electrocatalytic oxygen reduction performance. RSC Advances. 11 (61), 38718-38726 (2021).
- Nagvenkar, A. P., Perelshtein, I., Piunno, Y., Mantecca, P., Gedanken, A. Sonochemical one-step synthesis of polymer-capped metal oxide nanocolloids: Antibacterial activity and cytotoxicity. ACS Omega. 4 (9), 13631-13639 (2019).
- Janotti, A., Van de Walle, C. G. Fundamentals of zinc oxide as a semiconductor. Reports on Progress in Physics. 72 (12), 126501(2009).
- Abebe, B., Murthy, H. C. A., Amare, E. Enhancing the photocatalytic efficiency of ZnO: Defects, heterojunction, and optimization. Environmental Nanotechnology, Monitoring. & Management. 14, 100336(2020).
- Abebe, B., Murthy, H. C. A., Zereffa, E. A. Multifunctional application of PVA-aided Zn-Fe-Mn coupled oxide nanocomposite. Nanoscale Research Letters. 16, 1(2021).
- Shekofteh-Gohari, M., Habibi-Yangjeh, A. Fe3O4/ZnO/CoWO4 nanocomposites: Novel magnetically separable visible-light-driven photocatalysts with enhanced activity in degradation of different dye pollutants. Ceramics International. 43 (3), 3063-3071 (2017).
- Saravanan, R., Gupta, V. K. K., Narayanan, V., Stephen, A. Visible light degradation of textile effluent using novel catalyst ZnO/γ-Mn2O3. Journal of the Taiwan Institute of Chemical Engineers. 45 (4), 1910-1917 (2014).
- Buonsanti, R., Milliron, D. J. Chemistry of doped colloidal nanocrystals. Chemistry of Materials. 25 (8), 1305-1317 (2013).
- Hu, H., He, H., Zhang, J., Hou, X., Wu, P. Optical sensing at the nanobiointerface of metal ion-optically-active nanocrystals. Nanoscale. 10 (11), 5035-5046 (2018).
- Deganello, F., Tyagi, A. K. Solution combustion synthesis, energy and environment: Best parameters for better materials. Progress in Crystal Growth and Characterization of Materials. 64 (2), 23-61 (2018).
- Buonsanti, R., et al. Assembly of ligand-stripped nanocrystals into precisely controlled mesoporous architectures. Nano Letters. 12 (7), 3872-3877 (2012).
- Li, F., Ran, J., Jaroniec, M., Qiao, S. Z. Solution combustion synthesis of metal oxide nanomaterials for energy storage and conversion. Nanoscale. 7 (42), 17590-17610 (2015).
- Williams, T. E., et al. Nearest-neighbour nanocrystal bonding dictates framework stability or collapse in colloidal nanocrystal frameworks. Chemical Communications. 53 (35), 4853-4856 (2017).
- Helms, B. A., Williams, T. E., Buonsanti, R., Milliron, D. J. Colloidal nanocrystal frameworks. Advanced Materials. 27 (38), 5820-5829 (2015).
- Liu, B., et al. Synthesis of ZnO nano-powders via a novel PVA-assisted freeze-drying process. RSC Advances. 6 (111), 110349-110355 (2016).
- Abebe, B., Murthy, H. C. A. Insights into ZnO-based doped porous nanocrystal frameworks. RSC Advances. 12 (10), 5816-5833 (2022).
- LaMer, V. K., Dinegar, R. H. Theory, production and mechanism of formation of monodispersed hydrosols. Journal of the American Chemical Society. 72 (11), 4847-4854 (1950).
- Jun, Y. -S., et al. Classical and nonclassical nucleation and growth mechanisms for nanoparticle formation. Annual Review of Physical Chemistry. 73, 453-477 (2022).
- Gao, Y., Meng, F., Li, X., Wen, J. Z., Li, Z. Factors controlling nanosized Ni-Al 2 O 3 catalysts synthesized by solution combustion for slurry-phase CO methanation: the ratio of reducing valences to oxidizing valences in redox systems. Catalysis Science & Technology. 6 (21), 7800-7811 (2016).
- Abebe, B., Zereffa, E. A., Murthy, H. C. A. Synthesis of poly(vinyl alcohol)-aided ZnO/Mn 2 O 3 nanocomposites for acid orange-8 dye degradation: Mechanism and antibacterial activity. ACS Omega. 6 (1), 954-964 (2021).
- Kumar, S., Krishnakumar, B., Sobral, A. J. F. N., Koh, J. Bio-based ( chitosan / PVA / ZnO ) nanocomposites fi lm Thermally stable and photoluminescence material for removal of organic dye. Carbohydrate Polymers. 205, 559-564 (2019).
- Dai, Y., et al. Enhanced mechanical, thermal, and UV-shielding properties of poly(vinyl alcohol)/metal-organic framework nanocomposites. RSC Advances. 8 (67), 38681-38688 (2018).
- Munawar, T., et al. Novel tri-phase heterostructured ZnO-Yb2O3-Pr2O3 nanocomposite; structural, optical, photocatalytic and antibacterial studies. Ceramics International. 46 (8), 11101-11114 (2020).
- Mukhtar, F., et al. Enhancement in carrier separation of ZnO-Ho2O3-Sm2O3 hetrostuctured nanocomposite with rGO and PANI supported direct dual Z-scheme for antimicrobial inactivation and sunlight driven photocatalysis. Advanced Powder Technology. 32 (10), 3770-3787 (2021).
- Lachheb, H., et al. Electron transfer in ZnO-Fe 2 O 3 aqueous slurry systems and its effects on visible light photocatalytic activity. Catalysis Science & Technology. 7 (18), 4041-4047 (2017).
- Thommes, M., et al. Physisorption of gases, with special reference to the evaluation of surface area and pore size distribution (IUPAC Technical Report). Pure and Applied Chemistry. 87 (9-10), 1051-1069 (2015).
- Kumar, P., Kim, K. -H., Kwon, E. E., Szulejko, J. E. Metal-organic frameworks for the control and management of air quality: advances and future direction. Journal of Materials Chemistry A. 4 (2), 345-361 (2016).
- Liu, J., et al. NiO-PTA supported on ZIF-8 as a highly effective catalyst for hydrocracking of Jatropha oil. Scientific Reports. 6, 23667(2016).
- Fatehah, M. O., Aziz, H. A., Stoll, S. Stability of ZnO nanoparticles in solution. Influence of pH, dissolution, aggregation and disaggregation effects. Journal of Colloid Science and Biotechnology. 3 (1), 75-84 (2014).
- Sigoli, F. A., Davolos, M. R., Jafelicci, M. Morphological evolution of zinc oxide originating from zinc hydroxide carbonate. Journal of Alloys and Compounds. 262-263, 292-295 (1997).
- Wachs, I. E. Raman and IR studies of surface metal oxide species on oxide supports: Supported metal oxide catalysts. Catalysis Today. 27 (3-4), 437-455 (1996).
- Parler, C. M., Ritter, J. A., Amiridis, M. D. Infrared spectroscopic study of sol-gel derived mixed-metal oxides. Journal of Non-Crystalline Solids. 279 (2-3), 119-125 (2001).
- Anžlovar, A., Kogej, K., Crnjak Orel, Z., Žigon, M. Polyol mediated nano size zinc oxide and nanocomposites with poly(methyl methacrylate). Express Polymer Letters. 5 (7), 604-619 (2011).
- Saravanan, R., et al. ZnO/Ag/Mn 2 O 3 nanocomposite for visible light-induced industrial textile effluent degradation, uric acid and ascorbic acid sensing and antimicrobial activity. RSC Advances. 5 (44), 34645-34651 (2015).
- Yang, G., Yan, W., Wang, J., Yang, H. Fabrication and formation mechanism of Mn 2 O 3 hollow nanofibers by single-spinneret electrospinning. CrystEngComm. 16 (30), 6907-6913 (2014).
- Liu, Y., et al. A magnetically separable photocatalyst based on nest-like γ-Fe 2 O 3 /ZnO double-shelled hollow structures with enhanced photocatalytic activity. Nanoscale. 4 (1), 183-187 (2012).
- Hu, Y., et al. A microwave-assisted rapid route to synthesize ZnO/ZnS core-shell nanostructures via controllable surface sulfidation of ZnO nanorods. CrystEngComm. 13 (10), 3438-3443 (2011).
- Zhang, J., et al. Synthesis and gas sensing properties of α-Fe 2 O 3 @ ZnO core-shell nanospindles. Nanotechnology. 22 (18), 185501(2011).
- Penn, R. L. Imperfect oriented attachment: Dislocation generation in defect-free nanocrystals. Science. 281 (5379), 969-971 (1998).
- Zhang, J., Huang, F., Lin, Z. Progress of nanocrystalline growth kinetics based on oriented attachment. Nanoscale. 2 (1), 18-34 (2009).
- Zeng, Z., et al. A fluorescence-electrochemical study of carbon nanodots (CNDs) in bio- and photoelectronic applications and energy gap investigation. Physical Chemistry Chemical Physics. 19 (30), 20101-20109 (2017).
- Zhai, T., et al. Controllable synthesis of hierarchical ZnO nanodisks for highly photocatalytic activity. CrystEngComm. 14 (5), 1850-1855 (2012).
- Li, N., et al. Efficient removal of chromium from water by Mn3O4 @ZnO/Mn3O4 composite under simulated sunlight irradiation: Synergy of photocatalytic reduction and adsorption. Applied Catalysis B: Environmental. 214, 126-136 (2017).
- Abebe, B. Polymer assisted colloidal nanocrystal framework synthesis: Sol-gel approach. Materials Research Express. 8 (12), 125005(2021).
- Jiamprasertboon, A., et al. Heterojunction α-Fe2O3/ZnO films with enhanced photocatalytic properties grown by aerosol-assisted chemical vapour deposition. Chemistry - A European Journal. 25 (48), 11337-11345 (2019).
- Mukhtar, F., et al. Dual S-scheme heterojunction ZnO-V2O5-WO3 nanocomposite with enhanced photocatalytic and antimicrobial activity. Materials Chemistry and Physics. 263, 124372(2021).
- Marschall, R. Semiconductor composites: Strategies for enhancing charge carrier separation to improve photocatalytic activity. Advanced Functional Materials. 24 (17), 2421-2440 (2013).
- Beranek, R. (Photo)electrochemical methods for the determination of the band edge positions of TiO 2-based nanomaterials. Advances in Physical Chemistry. 2011, 786759(2011).
- Hoffmann, M. R., Martin, S. T., Choi, W., Bahnemann, D. W. Environmental applications of semiconductor photocatalysis. Chemical Reviews. 95 (1), 69-96 (1995).
- Wu, Y., Wang, D., Li, Y. Understanding of the major reactions in solution synthesis of functional nanomaterials. Science China Materials. 59, 938-996 (2016).
- Xia, Y., Xiong, Y., Lim, B., Skrabalak, S. E. Shape-controlled synthesis of metal nanocrystals: Simple chemistry meets complex physics. Angewandte Chemie. 48 (1), 60-103 (2008).
- Kim, S. J., Yoon, S., Kim, H. J. Review of solution-processed oxide thin-film transistors. Japanese Journal of Applied Physics. 53, (2014).
- Zhang, J., Guo, Q., Liu, Y., Cheng, Y. Preparation and characterization of Fe2O3/Al2O3 using the solution combustion approach for chemical looping combustion. Industrial & Engineering Chemistry Research. 51 (39), 12773-12781 (2012).
- Novitskaya, E., Kelly, J. P., Bhaduri, S., Graeve, O. A. A review of solution combustion synthesis: an analysis of parameters controlling powder characteristics. International Materials Reviews. 66 (3), 188-214 (2021).
- González-Cortés, S. L., Imbert, F. E. Fundamentals, properties and applications of solid catalysts prepared by solution combustion synthesis (SCS). Applied Catalysis A: General. 452, 117-131 (2013).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten