Method Article
Canlı Ancak Kültürlenemeyen Patojenleri Canlandırmak için İn Vivo Model Olarak Tavuk Embriyosu
Bu Makalede
Özet
Bu yöntem, tavuk embriyosunu, bakteriyel patojen L. monocytogenes'i yaşayabilir ancak kültürlenemeyen (VBNC) bir durumdan canlandırmak ve bakteri uyku hali mekanizmalarının anlaşılmasında potansiyel olarak daha fazla kullanım sağlamak için basit ve uygun maliyetli bir in vivo model olarak göstermektedir.
Özet
Tavuk embriyosu, çeşitli biyolojik olayların incelenmesinde basitliği, satın alınabilirliği ve uyarlanabilirliği nedeniyle biyomedikal araştırmalarda artan uygulama ile popüler bir in vivo model olarak ortaya çıkmıştır. Bu model, mikrobiyal patojeniteyi araştırmak için kullanılmıştır ve bakteri uyku halini incelemek için yararlı bir araç haline gelmektedir. Canlı ancak kültürlenemeyen (VBNC) durum, bakterilerin zorlu ortamlarda canlılıklarını korumak için metabolik olarak hareketsiz ve ekime dirençli hale geldiği hareketsiz bir durumdur. Uygun koşullar altında, VBNC bakterileri metabolik olarak aktif ve kültürlenebilir bir duruma geri dönebilir. Gıda kaynaklı listeriyoza neden olan Listeria monocytogenes gibi bir VBNC durumuna geçen bakteriyel patojenler, geleneksel büyümeye bağlı yöntemlerle tespit edilmekten kaçındıkları ve canlanma üzerine virülanslarını geri kazanabildikleri için bir halk sağlığı sorunudur. Bu, VBNC patojenlerinin yeniden canlanmasına neden olan koşulların ve mekanizmaların daha iyi anlaşılmasını gerektirir. Burada sunulan yöntem, tavuk embriyosunu, VBNC L. monocytogenes'i kültürlenebilir bir duruma geri döndürmek için etkili bir in vivo model olarak göstermektedir. Büyük ölçüde besinsel yenilemeye dayanan in vitro canlandırma girişimlerinin verimsiz olduğu durumlarda, bu protokol, maden suyunda açlık tarafından üretilen L. monocytogenes'in hücre duvarı eksikliği olan VBNC formlarının yeniden aktivasyonunu teşvik etmeyi başarır. Daha da önemlisi, elde edilen sonuçlar, VBNC L. monocytogenes'in canlanması için embriyonun gerekliliğinin altını çizmekte ve bu süreçte embriyo ile ilişkili faktörlerin önemli bir rol oynadığını göstermektedir. Bu yöntemin diğer potansiyel kullanımları, VBNC durum canlanma mekanizmalarında rol oynayan bakteriyel faktörlerin taranmasını ve tanımlanmasını içerir. Bu nedenle bu model, bilgisi tespit edilemeyen patojenlerin neden olduğu halk sağlığı risklerini azaltmak için kritik olan bakteri uyku halinin moleküler işleyişi hakkında fikir verebilir.
Giriş
Alternatif in vivo araştırma modelleri arayışında, düşük ilişkili maliyetler ve lojistik ve etik hususlarla, tavuk embriyosu ortaya çıktı ve hızla en uygulanabilir, yönetilebilir ve tekrarlanabilir in vivo omurgalı model sistemlerinden biri haline geldi 1,2. Kemirgenler ve tavşanlar gibi diğer hayvan modelleriyle karşılaştırıldığında, döllenmiş tavuk yumurtalarının elde edilmesi ucuzdur ve gelişimleri için karmaşık bir konut lojistiği gerektirmez. Ayrıca, tavuk yumurtası boyutu, çok sayıda embriyonun paralel olarak işlenmesini sağlayarak çok sayıda deneysel test koşulunu/grubunu ve replikasını destekler. Kısa embriyogenez süresi (21 gün) ve gelişim döneminin herhangi bir noktasında embriyoya ve ilişkili yapılara erişmenin ve gözlemlemenin basitliği, bunu gelişimsel biyoloji (örneğin, kalp ve beyin oluşumu)3,4 ve farmakoloji (ilaç aktivitesinin, dağıtımının ve toksisitesinin test edilmesi) gibi çeşitli alanlarda yararlı bir model haline getirir1,5, 6. Ek olarak, tavuk embriyosunun olgunlaşmamış bağışıklık sistemi, onu bağışıklık temelli çalışmalar ve kanser araştırmaları ile ilgili yaklaşımlar için uygun bir sistem haline getirir7. Daha da önemlisi, bu modelin embriyonik doğası nedeniyle, gelişimsel gün 13-148'de olgun bir nosiseptif sistem edinen bu zaman dilimi içinde yürütülen araştırma uygulamaları yasal ve etik kaygılarla kısıtlanmamaktadır7.
Tavuk embriyo modeli, insanlarda ve diğer memelilerde hastalığa neden olan mikropların patojenitesini incelemek için de yaygın olarak kullanılmaktadır. Gerçekten de, protozoanın virülansını araştırmak için çok sayıda çalışma bu modeli araştırmış ve doğrulamıştır (örneğin, Neospora caninum, Eimeria tenella, Cryptosporidium spp.)9,10,11, mantar (örneğin, Candida albicans, Aspergillus fumigatus)12,13 ve bakteri türleri (örneğin, Enterococcus spp., Salmonella enterica, Francisella spp., Campylobacter jejuni, Clostridium perfringens, Listeria monocytogenes, Neisseria gonorrhoeae, Staphylococcus aureus)10, 14,15,16,17,18,19,20,21,22 ve ayrıca antimikrobiyal bileşiklerin terapötik etkisini test etmek için 17,23.
Mikroorganizmalar, yukarıda bahsedilenler gibi, genellikle çevrelerinde/çevrelerinde stresli uyaranlara maruz kalırlar ve bu nedenle, potansiyel olarak zararlı/ölümcül durumlara dayanmak için stresle başa çıkma stratejileri geliştirmişlerdir. Bazı bakteri türleri, ciddi çevresel kısıtlamalar altında hücresel ve genetik bütünlüğü koruyan endospor adı verilen oldukça esnek ve metabolik olarak uykuda olan yapılar üretebilir. Uygun çevresel koşullar toplanırsa, endosporlar çimlenme ile canlı aktif hücrelere dönüşebilir24. Bununla birlikte, sporlanmayan bakteriler, ana fenotipik özelliği rutin büyüme ortamında kültürlenebilirlik kaybı olan, canlı ancak kültürlenemeyen (VBNC) olarak adlandırılan alternatif metabolik olarak hareketsiz bir duruma girebilir25. VBNC durumuna girdiği bildirilen > 100 bakteri türünün büyük bir kısmının insanlar ve diğer hayvanlar için patojenik olduğu26 ve VBNC patojenlerinin metabolik olarak aktif ve virülan bir duruma geri dönebileceği göz önüne alındığında25,26, VBNC patojenlerini tespit etmede geleneksel büyüme temelli yöntemlerin başarısızlığı ilgili bir halk sağlığı sorunudur. Bu canlanma sürecini yönlendiren çevresel ipuçları ve moleküler ve fizyolojik mekanizmalar henüz iyi anlaşılmamıştır ve mikrobiyal türlere ve VBNC durumunu indükleyen stres(ler)e göre değişebilir.
Araştırmacılar, bir VBNC durumunda bakteriyel patojenlerin in vivo canlanma kapasitesini araştırmak için tavuk embriyo modelinin özelliklerinden yararlandılar. Sudaki besin yoksunluğu nedeniyle VBNC durumuna sürülen insan kaynaklı C. jejuni izolatları, embriyonlu tavuk yumurtalarında geçişten sonra insan hücrelerinde kültürlenebilirliklerini ve virülanslarını geri kazandılar27. Benzer şekilde, Edwardsiella tarda28, Legionella pneumophila29 ve L. monocytogenes30 gibi diğer patojenler için de VBNC durumunu geri döndürmeye yönelik başarılı girişimler bildirilmiştir.
Yakın zamanda, L. monocytogenes'in maden suyunda açlıktan VBNC durumuna sürüldüğünde, çubuk şeklindeki bir hücreden bir kokoid hücresine geçtiğini bildirdik. Bu morfolojik dönüşümün, hücre duvarındaki kümülatif hasardan kaynaklandığını, bakteri tarafından tamamen dökülmesine yol açtığını ve daha sonra hücre duvarı eksikliği olan küresel hücre formu31 haline geldiğini ortaya çıkardık. Bu duvarsız VBNC L. monocytogenes formlarını in vitro olarak canlandırmaya yönelik başarısız girişimlerimiz, besin yenileme yaklaşımlarını kullanarak, potansiyel kurtarmalarını in vivo olarak araştırmamıza neden oldu. L. monocytogenes30 ile umut verici kullanımı göz önüne alındığında, bu görev için tavuk embriyo modelini seçtik. Sonuçlar, embriyonlu tavuk yumurtası sisteminin, hücre duvarı eksikliği olan VBNC L. monocytogenes'in aktif kültürlenebilir bir duruma geri dönmesini teşvik etme kapasitesini doğruladı31.
Burada, L. monocytogenes'in embriyonlu tavuk yumurtası ortamına maruz kalma yoluyla hareketsiz bir VBNC durumundan in vivo olarak yeniden canlandırılmasını sağlayan ayrıntılı bir protokol sunuyoruz. Tavuk yumurtalarının ve VBNC bakterilerinin hazırlanmasını ve izlenmesini, yumurtaların aşılanmasını, embriyonlu ve embriyonasyonsuz yumurtaların işlenmesini ve VBNC hücre canlanma verimliliğini değerlendirmek için kültürlenebilir bakteri yükünün puanlanmasını açıklıyoruz. Sonuçlar, tavuk embriyosunu, bakteri uyku hali gibi mikrobiyal yaşamın farklı yönlerini yöneten mekanizmaları anlamak için basit, uygun maliyetli ve uygun bir model olarak yeniden doğrulamaktadır. Bu in vivo sistem, bireysel bakteri genlerinin diriliş sürecine katkısını araştırmak için daha fazla araştırılabilir.
Protokol
Bu protokol, araştırmalarda hayvan kullanımı için geçerli kurumsal Fransız (Kararname no. 2013-118) ve Avrupa (Direktif 2010/63/EU) yönergelerini takip eder. Ayrıca, Fransız yasalarına göre (2020-274 sayılı Kararname), bu protokol etik kısıtlamalarla ilgili değildir, çünkü tavuk embriyoları ile yapılan tüm deneyler, embriyogenezin son üçüncü döneminden önce (yani 14. günden önce) gerçekleştirilir ve tamamlanır.
1. VBNC bakterilerinin hazırlanması
- Aşılama döngüleri kullanılarak gliserol stoklarından (-80 ° C'de saklanır) beyin kalp infüzyonu (BHI) agar ortamına çizgi bakteri suşları. İzole koloniler elde etmek için gece boyunca 37 °C'de inkübe edin.
NOT: Gerekirse, agar ortamını, suş(lar)ın direnç(ler)e sahip olduğu (doğal olarak veya genetik modifikasyon yoluyla) antibiyotik(ler) ile destekleyin. - Her suş için 5 mL BHI suyu ile 2-3 tüp hazırlayın ve 2-3 koloni ile aşılamak için bir aşılama döngüsü kullanın. Durağan faza kadar bakteri yetiştirmek için kültürleri gece boyunca 37 ° C'de çalkalama (200 rpm) ile inkübe edin. Bu kültürlerin her biri, VBNC bakteri süspansiyonlarının bağımsız biyolojik kopyalarını hazırlamak için kullanılacaktır.
- Her kültürü BHI suyunda 1:10 oranında seyreltin ve optik yoğunluğu 600 nm (OD600) dalga boyunda bir spektrofotometrede ölçün. Listeria monocytogenes'in optimal olarak büyütülmüş sabit faz kültürlerinin OD600 değeri 2 ile 4 arasında değişir. Bu, 2-4 x 109 koloni oluşturan birim (CFU)/mL'lik bir bakteri konsantrasyonuna eşittir.
- 1.5 mL'lik bir mikrotüpte 1.5 mL bakteri kültürünü 6.000 x g'da 2 dakika boyunca santrifüjleme ile peletleyin. Bir vakum pompası kullanarak süpernatanı aspire edin. Hücre peletini 1 mL otoklavlanmış ve filtrelenmiş maden suyunda yeniden süspanse edin.
- Adım 1.4'ü üç kez tekrarlayarak bakterileri iyice yıkayın. Bu, aksi takdirde VBNC bakterilerinin oluşumunu geciktirecek olan kültür ortamı besin maddelerinin tamamen uzaklaştırılmasını sağlar.
- 30 mL maden suyu içeren T25 hücre kültürü şişelerine 30 μL yıkanmış bakteri ekleyerek 106 CFU / mL'lik bir başlangıç konsantrasyonunda bakteri süspansiyonları hazırlayın.
- Süspansiyonları serolojik bir pipet kullanarak karıştırın. Bunları oda sıcaklığında, statik (şişe dik konumda) ve loş aydınlatma koşullarında saklayın.
2. VBNC bakterilerinin oluşumunun izlenmesi
- Bakteri süspansiyonlarındaki kültürlenebilir popülasyonu 1. günde ( hazırlandıktan hemen sonra) ve daha sonra aşağıda açıklandığı gibi haftalık olarak belirleyin.
- Maden suyunda VBNC bakteri süspansiyonunun 10 kat seri dilüsyonlarını hazırlayın (10-1 ila 10-3 dilüsyon). 100 μL seyreltilmemiş süspansiyonu ve her seyreltmeyi iki kez BHI agar üzerine yerleştirin ve gece boyunca 37 ° C'de inkübe edin.
NOT: Kültürlenebilirlik 1 CFU/mL'< yaklaştığında, kültürlenebilen bakterilerin varlığını/yokluğunu doğrulamak için seyreltilmemiş süspansiyonun daha büyük bir hacmi (0.5-2 mL) kaplanmalıdır. - Kültürlenebilir bakteri konsantrasyonunu aşağıdaki gibi hesaplayın:
kültürlenebilir bakteri konsantrasyonu (CFU/mL) = (ortalama koloni sayısı x numune seyreltme faktörü) / kaplanmış numune hacmi (mL cinsinden).
- Maden suyunda VBNC bakteri süspansiyonunun 10 kat seri dilüsyonlarını hazırlayın (10-1 ila 10-3 dilüsyon). 100 μL seyreltilmemiş süspansiyonu ve her seyreltmeyi iki kez BHI agar üzerine yerleştirin ve gece boyunca 37 ° C'de inkübe edin.
- Bakteriyel süspansiyonlardaki canlı popülasyonu 1. günde ( hazırlandıktan hemen sonra) ve daha sonra aşağıda açıklandığı gibi haftalık olarak belirleyin.
- Bakteriyel süspansiyonun bir örneğini (ör., yaklaşık 106 hücre / mL'lik bir konsantrasyonda) canlılık boyası 5 (6) -karboksifloresein diasetat (CFDA) ile karanlıkta 30 dakika boyunca 30 μM'lik bir nihai konsantrasyonda inkübe edin. Ayrıca CFDA (lekesiz kontrol) içermeyen bir numune ve CFDA (canlı olmayan/ölü hücre kontrolü) ile inkübasyondan önce 30 dakika boyunca 95 ° C'de muamele edilmiş bir numune hazırlayın.
- Numuneleri, CFDA floresan için 488 nm uyarma lazeri ve 520 nm emisyon dedektörü ile donatılmış bir akış sitometresinde analiz edin. İstatistiksel sağlamlık için, en az 30 μL/dk'lık bir akış hızında numune başına yaklaşık 1 x10 5 bakteri olayı elde edin (bu, elde edilen 10-100 μL'lik bir numune hacmine karşılık gelir).
- Logaritmik ölçekli bir ileri saçılma (FSC) ve yan saçılma (SSC) grafiğinde bakterilerle ilişkili olayları bulmak ve geçit vermek için boyanmamış örneği kullanın. Geçitli bakteri olaylarını logaritmik ölçekli bir CFDA floresan histogramında çizin ve canlı (CFDA pozitif) popülasyonları canlı olmayan (CFDA negatif) popülasyonlardan ayırt etmek için boyanmamış ve canlı olmayan/ölü hücre örneklerini kullanın.
- Canlı bakteri konsantrasyonunu aşağıdaki gibi hesaplayın:
canlı bakteri konsantrasyonu (hücreler/mL) = alınan numunedeki ortalama CFDA pozitif olay sayısı / edinilen numune hacmi (mL cinsinden)
NOT: Sitometre modeline bağlı olarak, hücre nicelemesi, akış sitometrisi sayma boncuklarının kullanılmasını gerektirebilir.
3. Yumurtaların kuluçkalanması
- Tedarikçiden teslim alındıktan sonra, döllenmiş yumurtaların ertesi güne kadar oda sıcaklığında bekletilmesine izin verin.
- Bu arada yumurta kuluçka makinesinin su haznesini deiyonize su ile doldurun ve gücü açın. Sıcaklığı 37,7 °C'ye ve maksimum bağıl nemi %47'ye ayarlayın.
NOT: Elimizde yumurtalar %38-%42 bağıl nem aralığında inkübe edilmekte olup, beklenen embriyogenez oranı ve başarısı üzerinde gözle görülür bir etkisi yoktur. - Embriyogenezi başlatmak için yumurtaları kuluçka makinesine aktarın. Bunları, hava cebi yukarı bakacak şekilde (yani sivri ucu aşağı bakacak şekilde) inkübatör tepsisine/tepsilerine yerleştirin.
- Yumurtaları 6 gün kuluçkaya yatırın. 4 gün sonra, canlı embriyonlu yumurtaları ölü veya embriyonasyonsuz yumurtalardan şekerleme yaparak ayırt edin.
- İç kısmı aydınlatmak ve içeriğini görsel olarak ayırt etmek için yumurtayı güçlü bir ışık kaynağının (mumcu) altına/üzerine yerleştirin. 3 veya 4 günlük kuluçka döneminden sonra, canlı embriyonlu yumurtalar, hava cebinden aşağıya doğru genişleyen bir kan damarı ağı gösterir. Bu ağ, ölü embriyonlu yumurtalarda çökmüş ve düzensiz görünür ve embriyogenezi başlatamayan yumurtalarda tamamen yoktur. Görünürse, canlı bir embriyo seğirme hareketi bile gösterebilir (Şekil 1).
4. Aşılama için yumurtaların hazırlanması
- Aşılama gününde, mevcut canlı embriyonlu ve embriyonasyonsuz yumurta sayısını belirlemek için yumurtaları mumlayın. Embriyonlaşmamış yumurtaları (toplam sayının yaklaşık% 10-20'si) ve ölü embriyolu yumurtaları adım 3.4'te açıklandığı gibi tanımlayın. İkincisini, biyolojik atık bertarafı için kurumsal yönergelere göre atın.
- Yumurta kabuğu üzerindeki enjeksiyon noktasını hava cebi kenarlığının 2-5 mm yukarısında işaretleyin (Şekil 2A). Bu alanı %70 (h/h) etanol ile ıslatılmış kağıt mendil ile ovalayarak dezenfekte edin.
- 18G'lik bir iğne kullanarak, kabuk zarını delmeden enjeksiyon noktasında kabuk üzerinde dikkatlice bir delme çukuru açın (Şekil 2B). Enjeksiyon noktasını %70 (h/h) etanol ile ıslatılmış bir kağıt mendil ile dezenfekte edin.
5. Yumurtaların aşılanması
- 25G (0,5 mm x 16 mm) bir iğneyi 1 mL'lik bir şırıngaya takın ve VBNC bakteri süspansiyonu ile doldurun. Gerekirse, şırınganın iç duvarına yapışmış hava kabarcıklarını parmağınızla hafifçe vurarak çıkarın.
- Kültürlenebilir bakterilerden türetilen sterilite ve büyüme için kontrol koşulları olarak sırasıyla BHI suyunda gece boyunca büyütülen L. monocytogenes (5 x 103 CFU / mL) süspansiyonu ile inokülasyon yapın.
- İğneyi, enjeksiyon noktasındaki delinmiş kabuktan geçirin ve iğnenin tabanı kabuk yüzeyine temas edene kadar dik bir açıyla sonuna kadar sokun. Bu, şırınga içeriğini allantoik boşluğa (embriyonlu yumurtalarda) veya albümine (embriyonlu olmayan yumurtalarda) iletmek için iğne ucunu konumlandırır.
- Dikkatlice ve yavaşça 100 μL aşı enjekte edin. Embriyoda ölümcül yaralanmalara neden olmamak için embriyonlu bir yumurtanın içindeyken iğnenin açısını mümkün olduğunca sabit tutun.
- İğneyi dikkatlice ve yavaşça çıkarın ve aşılama giriş bölgesini kapatmak için enjeksiyon noktasını yuvarlak bir çıkartma ile kapatın. Kolaylık ve netlik için, her koşul/yumurta grubu için farklı renkte etiketler kullanın.
- Aşılanmış yumurtaları 2 gün daha kuluçka makinesine geri koyun. Gelişmekte olan embriyolara sahip yumurtaların 30 dakikadan fazla kuluçka makinesinden (veya 37,7 ° C'nin altındaki bir sıcaklıkta) çıkmadığından emin olun. Gerekirse aşılamayı gruplar halinde gerçekleştirin.
6. Aşılama örneklerinde kültürlenebilir hücrelerin varlığının değerlendirilmesi
- 100 μL VBNC bakteri süspansiyonunu 96 oyuklu bir mikroplakanın birden fazla kuyusuna dağıtın. Kuyucuk sayısını ≥ 2 x aşılanmış (embriyonlu + embriyonasyonsuz) yumurta sayısını hesaplayın.
- Adım 5.2'de belirtilen kontrol koşullarını kullanıyorsanız, her bir aşılamanın 100 μL'sini (yani, maden suyu veya kültürlenebilir bakteriler) aynı 96 oyuklu mikroplakadaki en az üç oyuğa dağıtın.
- Çok kanallı bir pipet kullanarak, önceki iki adımda hazırlanan oyukların her birine 100 μL BHI ortamı ekleyin.
- Kültürlenebilir bakteri içeren kuyucuklarda bakteri üremesini teşvik etmek için plakayı statik koşullar altında 37 °C'de inkübe edin. Kültürlenebilir bakterilerin varlığına ve bu koşullarda yeniden büyüme hızlarına bağlı olarak, kültürlenebilir bakteri içeren kuyuları tam olarak ortaya çıkarmak için bir veya daha fazla kuluçka günü gerekebilir.
- Her aşı için, bakteri üremesi için pozitif ve negatif puan alan kuyucukların sayısını görsel olarak inceleyin ve sayın.
7. Embriyo canlılığının izlenmesi
- Aşılamadan sonraki gün, embriyo ölümcüllüğünü kontrol etmek için embriyonlu yumurtaları mumlayın.
- Ölü embriyo içeren yumurtaları bir kenara koyun ve enfekte biyolojik atık bertarafı için kurumsal yönergelere göre atın.
8. Embriyonlu yumurtaların işlenmesi
- Embriyo ölümcüllüğünü kontrol etmek için embriyonlu yumurtaları kuluçka makinesinden ve mumdan kurtarın. Ölü embriyoları atın ve nihai sonuçlarda bunları dikkate almayın.
- Etiketi yumurtadan çıkarın ve kabuğun üst ucunu (hava cebini kaplayan) %70 (h/h) etanol ile ıslatılmış kağıt mendil ile dezenfekte edin.
- Temiz bir çift diseksiyon makası kullanarak, hava cebini ortaya çıkarmak için kabuğu enjeksiyon noktasından kesin. Temiz bir diseksiyon cımbızı kullanarak, hava cebini yumurtanın geri kalanından ayıran iç kabuk zarını yırtın.
- Yumurta içeriğini dikkatlice steril bir Petri kabına boşaltın. Bir cımbız kullanarak, embriyoyu izole edin ve yeni bir Petri kabına aktarın. Gerekirse embriyoyu steril PBS ile yıkayın.
- Embriyoyu 4 mL steril PBS içeren 15 mL'lik bir santrifüj tüpüne aktarın. Bir homojenizatör kullanarak embriyoyu ayırın (hız: 10.000 rpm). Her homojenizasyon arasında dispersiyon aletinin ucunu steril PBS, %70 (h/h) etanol ve tekrar steril PBS içinde sırayla geçirerek temizleyin.
- Embriyonun 500 μL'lik plakası BHI agar üzerine homojenleştirilir. Plakaları gece boyunca 37 °C'de (veya gerekirse daha uzun) inkübe edin.
NOT: İsteğe bağlı olarak, seyreltilmemiş homojenatta yüksek CFU sayılarının (yani 300'>) beklenmesi durumunda homojenatın seri seyreltmeleri kaplanabilir. - Her aşılama grubu için, agar plakalarında L. monocytogenes büyümesi için pozitif ve negatif puan alan yumurta sayısını sayın.
NOT: Embriyo ekstraksiyonu ve homojenizasyonun gerçekleştirildiği aseptik koşullara rağmen, embriyo homojenatlarının kaplanması için seçici olmayan bir agar ortamının kullanılması, kontaminant büyümesi riskini beraberinde getirir. Cins/türe özgü bir büyüme ortamının kullanılması veya seçici bir antibiyotikle takviye edilmesi (bunun için yalnızca test edilen bakteri suşunun dirençli olduğu) bu tür kontaminasyonu azaltabilir veya önleyebilir.
9. Embriyonlaşmamış yumurtaların işlenmesi
- Embriyonlaşmamış yumurtaları inkübatörden kurtarın. Yumurta albüminine erişmek için 8.2 ve 8.3 adımlarını tekrarlayın.
- Bir mikropipet kullanarak 500 μL albümin toplayın ve doğrudan BHI agar üzerine yayın. Plakaları gece boyunca 37 °C'de veya gerekirse daha uzun süre inkübe edin.
- Her aşılama grubu için, agar plakalarında L. monocytogenes büyümesi için pozitif puan alan yumurta sayısını sayın.
Sonuçlar
Tavuk embriyo modelinin, maden suyunda açlık sonucu oluşan L. monocytogenes'in hücre duvarı eksikliği olan VBNC formlarını canlandırma potansiyelini test etmek için, VBNC bakteri aşısının hazırlanma zamanlamasını (≥ 28 gün) embriyonlu yumurtalarınkiyle (6 gün) ifade etmek önemliydi. L. monocytogenes'in replikasyon süspansiyonları, planlanan yumurta aşılama gününden 28 gün önce maden suyunda 1 x 106 CFU / mL'lik bir konsantrasyonda ayarlandı. Bu başlangıç bakteri konsantrasyonunun, 28 gün sonra <1 CFU / mL'lik istenen bir kalıntı kültürlenebilirlik ile sonuçlandığı gösterilmiştir31. Süspansiyonların bakteri hücre kültürlenebilirliği ve canlılık seviyelerinin son bir doğrulaması, mL başına 1 x 106 canlı hücre ve 0.5 kültürlenebilir hücre içeren bir VBNC L. monocytogenes inoculum'un seçilmesiyle sonuçlandı. Deney için, bu inokulumun 100 μL'si (yani, 1 x 105 canlı hücre ve < 0.1 CFU) embriyonlu ve embriyonasyonsuz yumurta gruplarına verildi. Kontrol grupları, embriyolu ve embriyonasyonsuz yumurtalara aynı dozda maden suyu veya 5 x 103 CFU/mL BHI suyunda gece boyunca büyütülen L. monocytogenes süspansiyonu enjekte edilerek paralel olarak hazırlandı.
Aşılamadan 2 gün sonra, kültürlenebilir L. monocytogenes'in varlığını değerlendirmek için yumurtalar işlendi. Beklendiği gibi, maden suyu enjekte edilen sterilite kontrol grubu yumurtalarından bakteri üremesi geri kazanılmazken, kültürlenebilir L. monocytogenes ile tedavi edilen kontrol grubundaki yumurtaların %100'ü agar ortamında büyüme için pozitif puan aldı (Tablo 1). Daha da önemlisi, VBNC bakterileri ile aşılanmış yumurtalardan elde edilen tüm embriyolar, aynı VBNC bakterisi ile enjekte edilen embriyonlaşmamış bir yumurtanın içeriği ile yayılan her plakada tamamen yokluğunun aksine, plaka üzerinde L. monocytogenes büyümesine yol açmıştır (Tablo 1). Bu sonuç, daha önce bildirildiği gibi, VBNC L. monocytogenes'in uyanış süreci için tavuk embriyosunun gereksiniminin altını çizmektedir30.
VBNC bakterileri enjekte edilen embriyonlu yumurtalardan elde edilen L. monocytogenes büyümesinin, kalan kültürlenebilir hücrelerin yeniden büyümesinden değil, gerçek bir VBNC hücre iyileşmesinden gelme olasılığını belirlemek için, yumurta geçişinden önce ve sonra bakteri üremesine neden olan aşılama dozlarının sıklığını karşılaştırmak gerekir. İlkini elde etmek için, VBNC bakteri aşısının çoklu 100 μL dozları, 96 oyuklu bir plakada VBNC L. monocytogenes revival32'yi desteklemeyen besin açısından zengin bir ortam olan BHI ile karıştırıldı ve 37 ° C'de inkübe edildi. Bakteri üremesi için pozitif olan aşılanmış BHI kuyularının% 9.5'inin sıklığı (84'te 8), geri kazanılmış kültürlenebilir bakterileri gösteren yumurtaların% 100 sıklığından önemli ölçüde farklıdır (Fisher'ın kesin testi, p = 1.6 × 10−17) (Tablo 1). Bu önemli ve istatistiksel olarak anlamlı fark, embriyonlu yumurtalardan geri kazanılan L. monocytogenes büyümesinin büyük ölçüde VBNC bakterilerinin yeniden aktivasyonuna bağlı olduğunu güçlü bir şekilde göstermektedir. Ek olarak, vejetatif formlarından farklı olarak, VBNC L. monocytogenes embriyonlu olmayan yumurtalarda canlanamadı, bu da embriyonlu yumurtalarda VBNC hücre canlanmasının aşılamadaki kalıntı kültürlenebilir bakterilere bağlı olmadığını destekledi.
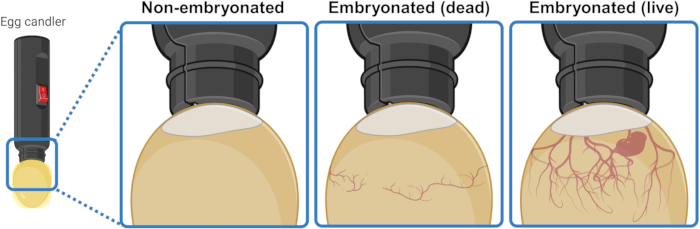
Şekil 1: Embriyonasyona uğramamış, ölü embriyona edilmiş ve canlı embriyonlu tavuk yumurtalarının şekerleme ile ayırt edilmesi. Embriyogenez durumu, yumurtanın yakın mesafeden bir ışık kaynağı (yumurta mumcusu) ile aydınlatılmasıyla belirlenir. Gelişmekte olan canlı bir embriyo içeren yumurtalar (görünür veya görünmez), hava cebinden aşağı doğru genişleyen güçlü bir kan damarı ağı gösterir. Bu ağ, ölü embriyolu yumurtalarda çökmüş ve düzensiz görünür ve embriyogenezi başlatamayan yumurtalarda tamamen yoktur. BioRender.com yılında oluşturuldu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
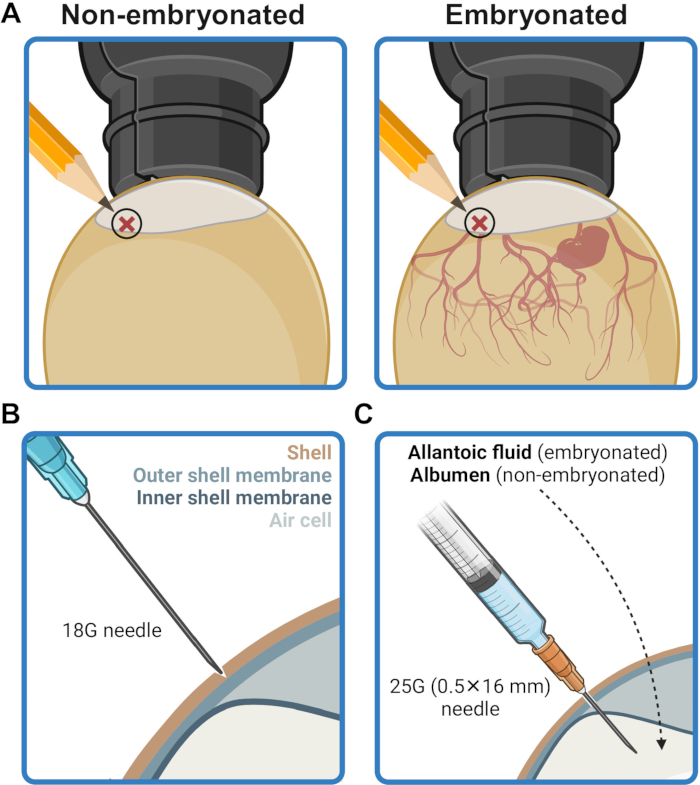
Şekil 2: Aşılama için yumurtanın hazırlanması. (A) Enjeksiyon bölgesi, şekerleme ile görüldüğü gibi, hava cebi sınırının 2-5 mm üzerinde bir konumda işaretlenmiştir. (B) Enjeksiyon bölgesindeki kabuk, dış kabuk zarını delmeden 18G'lik bir iğnenin ucu yardımıyla delinir. (C) Aşı, 25G (0.5 mm x 16 mm) bir iğne ile embriyonlu yumurtalardaki allantoik sıvıya veya embriyonlu olmayan yumurtalardaki albümine verilir. BioRender.com yılında oluşturuldu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Aşılama | Yumurta geçişinden önce kültürlenebilirlika | Yumurta geçişinden sonra kültürlenebilirlikb | |||
| Embriyonlu yumurtalar | p-değeric | Embriyonlaşmamış yumurtalar | p-değerid | ||
| Maden suyu | 0/3 (0%) | 0/10 (0%) | >0.999 | 0/10 (0%) | >0.999 |
| VBNC Lm | 8/84 (9.52%) | 24/24 (100%) | 1.63E-17 | 0/18 (0%) | 0.344 |
| Kültürlenebilir Lm | 3/3 (100%) | 8/8 (100%) | >0.999 | 2/2 (100%) | >0.999 |
| birBakteri üremesi olan BHI kuyularının sayısı/Aşılanan BHI kuyularının sayısı. | |||||
| bBakteri üremesi olan yumurta sayısı / Aşılanan yumurta sayısı. | |||||
| cEmbriyonlu yumurtalarda geçiş öncesi ve sonrası kültürlenebilirliğin karşılaştırılması (iki taraflı Fisher'ın kesin testi). | |||||
| dEmbriyonlu olmayan yumurtalarda geçişten önce ve sonra kültürlenebilirliğin karşılaştırılması (iki taraflı Fisher'ın kesin testi). | |||||
Tablo 1: VBNC L. monocytogenes , embriyonlu tavuk yumurtalarında geçişten sonra kültürlenebilir bir duruma geri döner. Embriyolu ve embriyonasyonsuz tavuk yumurtaları (6 gün) sadece 100 μL maden suyu ile veya VBNC (1 x 104 hücre, 28 gün) veya kültürlenebilir (500 hücreli) L. monocytogenes'in maden suyu süspansiyonları ile aşılanmıştır. 2 gün sonra, embriyolar (veya embriyonlaşmamış yumurtalardaki albümin) geri kazanıldı ve kültürlenebilir L. monocytogenes'in varlığını değerlendirmek için BHI agar üzerine kaplandı. Yumurta geçişinden önce bir aşılama dozunda bulunan kültürlenebilir hücrelerin sıklığı, her bir süspansiyonun 100 μL'sinin 96 oyuklu bir mikroplakanın birden fazla oyuğunda BHI suyu ile karıştırılması ve 37 ° C'de inkübasyondan sonra bakteri üremesi olan kuyucukların sayısının puanlanmasıyla belirlendi. İstatistiksel anlamlılık, iki kuyruklu bir Fisher'ın kesin testi kullanılarak hesaplandı ve p değerleri ≥ 0.05 anlamlı olarak kabul edilmedi. Bu tablo31'den yeniden üretildi.
Tartışmalar
Bakteriyel patojenlerin yaşayabilir ancak kültürlenemeyen (VBNC) formlarıyla ilişkili halk sağlığı ve ekonomik riskler, geleneksel mikrobiyal büyümeye dayalı yöntemlerle tespit edilmekten kaçınma kapasitelerinin yanı sıra klinik ve gıda endüstrisi ortamlarında kullanılan çoğu antimikrobiyale toleransları/duyarsızlıklarının bir sonucudur26,33. Bu nedenle, bir VBNC durumunda bakteri hücrelerinin geçişini, bakımını ve canlanmasını sağlayan mekanizmaları daha iyi anlamak için araştırma araçları ve modelleri bulmak acil hale gelmektedir.
Birçok açıdan, tavuk embriyosu, daha geleneksel memeli araştırma modellerine (örneğin, fare, sıçan, tavşan) avantajlı bir alternatiftir. Yumurtlayan bir organizma ile çalışmak teknik olarak daha pratiktir, çünkü embriyonik gelişimi hızlıdır ve dıştan ve atasından bağımsız olarak gerçekleşir. Daha da önemlisi, tavuk yumurtası ve embriyolarının üretimi, barındırılması ve bakımı ile ilgili mali ve lojistik yükler belirgin şekilde daha düşüktür. Ek olarak, büyük sayılar elde etme kolaylığı, birden fazla deneysel koşulun ve/veya tekrarların paralel olarak test edilmesini ve kapsamlı ve istatistiksel olarak sağlam verilerin oluşturulmasını sağlar. Balık veya nematod gibi memeli olmayan modeller benzer avantajlar sağlayabilse de, sıcakkanlı bir omurgalı olarak tavuk embriyosu evrimsel olarak insanlara daha yakındır ve bu nedenle immünoloji, hastalık modellemesi, geliştirme ve toksikoloji gibi alanlarda daha iyi bir araştırma modelidir. Embriyonik modellerle, özellikle olgun bir nosiseptif sistemin henüz kurulmadığı gelişimin ilk üçte ikilik diliminde, etik açıdan çalışmak daha kolaydır8. Bu kısa zaman penceresi, hızlı geri dönüş süreleri gerektiren uygulamalar için uygundur (örneğin, ilaç testi1), ancak daha sonraki embriyogenez aşamalarına ve hatta kuluçka sonrası yaşama (örneğin, gelişimsel ve davranışsal çalışmalar) kadar süren tahliller için kısıtlamalar getirebilir. Adaptif bir bağışıklık sisteminin olmaması, tavuk embriyosunu konak-patojen etkileşimleri ve kanser biyolojisi gibi alanlarda yararlı bir araştırma aracı haline getirir7.
Tavuk embriyosu, mikrobiyal virülans 9,10,11,12,13,14,15,16,17,18 çalışmasında yaygın olarak kullanılmıştır, ancak VBNC patojenlerini canlandırmak için bir model olarak idareli bir şekilde kullanılmıştır 27,28,29,30. Burada, bu in vivo sistemin VBNC L. monocytogenes'in kurtarılması için nasıl başarılı bir şekilde kullanılabileceğine dair ayrıntılı bir metodolojik açıklama sağladık.
Bu yöntemde dikkate alınması gereken kritik bir nokta, kültürlenebilir hücrelerin kalıntı varlığı ve bunların gerçek VBNC hücre canlanmasını alt etme potansiyelleri konusudur. Bu konuyu ele almak için VBNC hücre üretim yönteminin sınırlamaları (VBNC hücre saflık seviyeleri, başlangıç bakteri konsantrasyonu ile birleştirilir), kontamine kültürlenebilir hücreleri tamamen ortadan kaldırmak veya bunları ihmal edilebilir bir seviyeye indirmek için alternatif yaklaşımlar kullanma ihtiyacını artırmaktadır. Bu tür yaklaşımlar, örneğin, yalnızca kültürlenebilir hücreleri hedef alan antimikrobiyaller tarafından nötralizasyon/öldürmeyi içerebilir. Alternatif olarak, kültürlenebilir hücre popülasyonunun fiziksel olarak uzaklaştırılması, akış sitometrisi ile benzersiz morfofizyolojik özelliklere (örneğin, hücre şekli, yüzey veya sitoplazmik yapılar veya moleküller) dayalı olarak elde edilebilir. Bu yaklaşım, farklı yaşlara sahip (yani farklı zaman noktalarında oluşan) VBNC hücre alt popülasyonlarının izolasyonuna/saflaştırılmasına izin verme avantajına sahiptir ve bu, canlanma kapasiteleri için ovo içinde de test edilebilir.
Bu yöntemin dikkat gerektiren diğer noktaları arasında, özellikle enjeksiyon adımı sırasında ve hemen sonrasında (istenmeyen iğne ile ilişkili travma veya ölümcüllüğü önlemek için) embriyonlu yumurtaların dikkatli bir şekilde ele alınması ve manipülasyon süresinin optimal inkübasyon sıcaklığının dışında azaltılması için çaba gösterilmesi yer alır. Ek olarak, embriyoların alınması, işlenmesi ve kaplanmasının gerçekleştirilmesi gereken aseptik koşullara rağmen, agar plakalarında istenmeyen mikrobiyal büyüme hala meydana gelebilir. Bu, ilgilenilen bakteri türü için seçici bir formülasyona (bazal bileşim ve/veya takviyeler) sahip agar ortamının kullanılmasıyla veya belirli bir antibiyotiğe direnç gösteren bir suşun kullanılmasıyla çözülebilir.
Bu çalışma, bakteri uyku halinin mekanik yönlerini araştırmak için tavuk embriyosunu basit ama güçlü ve uygun maliyetli bir in vivo model olarak sergilemektedir. Bu bağlamda, bireysel bakteriyel mutantların taranması yoluyla veya karma bir kütüphane (örneğin, transpozon mutant kütüphanesi) kullanılarak genom çapında bir ölçekte VBNC durum uyanış sürecinde yer alan bakteriyel faktörleri tanımlamak için potansiyel olarak kullanılabilir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Bu çalışma, Micalis Enstitüsü'nden (AAP Micalis FAMe 2023) bir hibe ile desteklenmiştir. F.C., Agence Nationale de Recherche'den (THOR: ANR-20-CE15-0008; KALICI: ANR-20-CE35-0001).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 5(6)-carboxyfluorescein diacetate (CFDA) | Sigma-Aldrich | 21879 | Prepare stock solution at 30 mM in DMSO. Aliquot and store at −20 °C. |
| Benchtop centrifuge, 24 tubes 1.5–2 mL | Eppendorf | ||
| Biosafety cabinet, class II | |||
| Brain heart infusion (BHI) agar | BD | 248130 | |
| Brain heart infusion (BHI) broth | BD | 237500 | |
| Cell culture flasks, 25 cm2 (T25), vented cap | |||
| Centrifuge tubes, 15 mL | Sarstedt | ||
| Deionised water | To fill water reservoir of egg incubator | ||
| Dissection scissors, pointed ends | |||
| Dissection tweezers, curved + serrated ends | |||
| Egg candler | FIEM (Guanzate, IT) | IM35 | |
| Egg incubator (MG 244 Mercurius SH) | FIEM (Guanzate, IT) | SH244AD | Capacity for 144 chicken eggs (rocking trays) + 100 (hatching tray) |
| Eggs, fertilized | PFIE (INRAE Val-de-Loire, FR) | From white Leghorn chickens, raised in specific pathogen-free conditions | |
| Ethyl alcohol, 70% (v/v) | |||
| Flow cytometer (CytoFLEX S) | Beckman Coulter | V0-B2-Y4-R0 | |
| Heating block (95 °C) | |||
| Incubator (37 °C) | For growth of bacteria on agar plates | ||
| Incubator w/ shaking (37 °C, 200 rpm) | INFORS-HT | For growth of liquid bacterial cultures | |
| Inoculation loops | |||
| Microcentrifuge tubes, 1.5 mL | Eppendorf | ||
| Microtiter plates w/ lid, 96-well, transparent | Greiner | To prepare serial dilutions and analyze samples in flow cytometer | |
| Mineral water | Autoclaved (121 °C, 20 min) and sterile-filtered (0.2 µm) | ||
| Needle, hypodermic, 18G | Terumo | AN1838R1 | Dimensions: 1.2 × 38 mm |
| Needle, hypodermic, 25G | Terumo | AN2516R1 | Dimensions: 0.5 × 16 mm |
| Petri dishes, 10 cm ø | Greiner | For preparation of BHI agar plates and processing of chicken embryos | |
| Phosphate buffered saline (PBS), 1X | Gibco | 14190 | |
| Plate spreaders | |||
| Serological pipettes, disposable, 5 + 10 + 25 mL | |||
| Spectrophotometer (UV-Vis) + cuvettes 1 mL | |||
| Stickers, round, colored (Tough-Spots) | Dutscher | Dimensions: 9.5 mm ø | |
| Syringe, Luer slip, 1 mL | Terumo | ||
| Tissue homogenizer | IKA | ULTRA-TURRAX T25 disperser + S25N 8G dispersion tool | |
| Vacuum pump |
Referanslar
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır